高等热力学第1章基本概念
热力学第一章1 基本概念

当 p > pb
Ga表ge压p力respsue re
p pe pb
当 p < pb
真空度 pv
p pb pv
Vacuum pressure
pe
p
pv
pb
p
大气压力Atmospheric pressure
大气压随时间、地点变化
物理大气压 1atm = 760mmHg
当h变化不大,ρ常数
1mmHg = ρgh = 133.322Pa
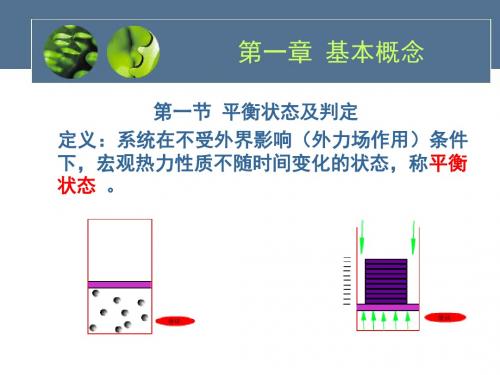
稳定不一定平衡,但平衡一定稳定
平衡Equilibrium与均匀Even
平衡:时间上 均匀:空间上
平衡不一定均匀,单相平衡态则一定是均匀的
为什么引入平衡概念?
如果系统平衡,可用一组确切 的参数(压力、温度)描述
但平衡状态是死态,没有能量交换
能量交换
状态变化
如何描述
破坏平衡
§1-4 状态方程、坐标图
最重要的系统
只交换热量和一种准静态的容积变化功
Moving Boundary Work 容积变化功 Compression Work
压缩功 膨胀功
Expansion Work
§1-3 状态和状态参数
State and state properties
状态:某一瞬间热力系所呈现的宏观状况
状态参数:描述热力系状态的物理量
当h变化大,ρ ρ(h)
p (h)gdh
Other Pressure Measurement Devices
工业或一般科研测量:压力传感器
Pressure transducers Piezoelectric effect
高精度测量:活塞压力计
piston manometer
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
《热力学1章》课件

热量指的是在热传递过程中传递 的能量,单位是焦耳。热量是能 量转移的过程,表示物体之间热 能传递的多少。
热能和其他形式能量的转换
热能与其他形式能量的转换
热能可以与其他形式的能量相互转换,如机械能、电能和化学能等。热力学第 一定律指出,能量不能凭空产生也不能凭空消失,只能从一种形式转化为另一 种形式。
研究环境中的热力学过程和能量 转换规律,为环境保护提供理论
支持。
THANKS
感谢您的观看
恒。
推导过程中涉及到的概念和原理 还包括:热量、温度、功等。
热力学第一定律的应用
01
02
03
应用领域
热力学第一定律在能源、 化工、环境、航空航天等 领域都有广泛的应用。
具体应用
如燃烧过程、蒸汽机工作 原理、制冷技术等都遵循 热力学第一定律,即能量 的转换与守恒。
注意事项
在实际应用中,需要考虑 到能量的损失和效率问题 ,以及如何提高能量的利 用率。
02
通过分析分子运动和热传导等现 象,我们可以推导出热力学第二 定律,它限制了热量自发地从低 温物体传到高温物体的可能性。
热力学第二定律的应用
热力学第二定律在能源利用、制 冷技术、空调等领域有广泛应用
。
它指导我们如何更有效地利用能 源,例如在发电站中,通过提高 蒸汽机的效率来减少热量损失,
从而提高发电效率。
制冷技术
制冷技术是热力学的另一个重要应用领域,如空调、冰箱和工业制冷等
。制冷技术利用物质的相变和热力学原理实现物体的冷却和温度控制。
03
化工生产
化工生产中许多工艺过程都涉及到热力学原理,如蒸馏、萃取、结晶和
化学反应等。了解和掌握热力学原理有助于优化化工生产过程,提高产
高等工热第一章概念总结

1.热力学第零定律:如果两个系统分别与第三个系统处于热平衡,则两个系统彼此必然处于热平衡。
2.热力学第一定律:在热力系统的两个给定稳定状态之间进行的一切绝热过程的功都是相同的。
它是能量守恒与转化定律在热现象上的应用;(不同表达方式)热力学:热能与其他形态对能量(机械能、化学能、电磁能……)之间相互转化和守恒。
工程热力学:热能与机械能之间相互转化和守恒。
3. 热力学第二定律:(克劳修斯说法)热不可能自发地、不付代价地、从低温物体传至高温物体。
(开尔文说法)不可能制造出从单一热源吸热,使之全部转化成为功而不留下其他任何变化的热力发动机。
4.热力学第二定律推论I:只和单一热源交换热量的热力系统,在其确定的初始与最终稳定状态之间进行的一切可逆过程的输出总功相同;如为不可逆过程,则输出的总功总是小于可逆过程所输出的总功。
5. 热力学第二定律推论II:只能与单一热源交换热量的热力系统,在完成了一个可逆循环后,所输出的总功以及和热源交换的热量均为零。
1.简单可压缩系统:只交换热量和一种准静态的容积变化功(压缩功、膨胀功)。
2. 平衡状态:在不受外界影响的条件下(重力场除外),如果系统的状态参数不随时间变化。
3.热力学平衡状态:力平衡、热平衡、化学平衡、相平衡。
4. 强度参数:与物质的量无关的参数,如压力p、温度T;广延参数:与物质的量有关的参数−可加性,如质量m、容积V、内能U、焓H、熵S。
5. 独立参数数目N=不平衡势差数=能量转换方式的数目=各种功的方式+热量= n+17. 准静态过程:如果在过程进行的每一瞬间,热力系统内部都无限地接近热力平衡状态,这种过程称为准净态过程。
其过程可用一系列平衡状态表示,形成一条连续地曲线。
8. 准静态过程的工程条件:破坏平衡所需时间(外部作用时间)>>恢复平衡所需时间(驰豫时间)。
有足够时间恢复新平衡⇒准静态过程9. 可逆过程与不可逆过程:可逆过程是指在过程完成以后,能够使热力系统及其外界都严格地回复到该过程前的起始状态,在任何环节都没有留下任何变化。
热力学第一章课件

热力学第一章
§1-1 热力系统
1 开口系
1
m
2
1+2 闭口系
WQ
1+2+3 绝热闭口系 1+2+3+4 孤立系
热力学第一章
状态参数的微分特征
设 z =z (x , y)
dz是全微分
Total
dzxzy
z dxyx
dy
differentials
充要条件:
2z 2z xy yx
可判断是否 是状态参数
热力学第一章
强度参数与广延参数
Intensive properties Extensive properties
4
3
非孤立系+相关外界
=孤立系
热力学第一章
热力系统其它分类方式
其它分类方式
均匀系 物理化学性质
非均匀系
工质种类
单元系 多元系
相态
单相 多相热力学第一章
简单可压缩系统
Simple compressible system
最重要的系统
只交换热量和一种准静态的容积变化功
Moving Boundary Work 容积变化功 Compression Work
氟化锂晶体的实验发现负的开尔文温度
3) T=0 0.5mw 2=0 分子一切运动停止,
零点能
热力学第一章
温度的热力学定义
热力学第零定律(R.W. Fowler in 1931) 如果两个系统分别与第三个系统处于
高等工程热力学第1章
一、准平衡(静态)过程
随时都不显著偏离平衡状态的过程。
条件:过程进行得相对缓慢; 促使变化的势差相对较小; 工质能恢复平衡。 准平衡过程中,物系随时处于完全平衡中,因而状 态变化的轨迹可用热力性质图上的过程曲线表示。
17
二 、可逆过程
当物系完成了某一过程之后能沿相同的路径逆行而回复 到原来状态,并使过程中所涉及到的外界亦回复到原来状 态,而不留下任何改变的过程。 可逆过程与准静态过程的关系
红线内 ——闭口绝热系
黄线内(不包含电热丝) ——闭口系
绿线内(包含电热丝) ——闭口绝热系 兰线内 ——孤立系
30
☻ 刚性绝热喷管
☻ A、B两部落“鸡、犬 之声相闻,民至老死不 相往来”
A
B
取红线为系统—
闭口系 取喷管为系统— 开口系绝热系? A部落为系统 —闭口系 A+B部落为系统
—孤立系
31
稳定平衡
不稳定平衡
随遇平衡
亚稳定平衡
如何判别系统是否处于稳定平衡状态? 已处于平衡态的物系的状态不会改变,熵达最大。
假想系统偏离原有状态发生“虚变化”,设S = f (x),
按泰勒级数展开
14
高价无穷小
dS 1 d 2S 2 + ΔS = δx + (δ x ) dx 2! dx2 1 ΔS - δS = δ2 S + 2
dS ≥
对于简单可压缩系
δQ
Tr
外界热源温度
dS ≥
d U + δW
Tr
T为常数,热平衡
dS ≥
dU + δW
T
T=Tr
移项整理
10
dU - d(TS ) = d(U - TS ) ≤ -δW
热力学基本原理(一)讲解

δ W pex dV;
① 向真空膨胀(自由膨胀)
p ex = 0, W=0 ② 等容过程 dV=0,W=0 ③ 恒外压膨胀 pex= 常量, W= – pex (V2 -V1)
④ 恒温可逆过程
W nRT ln V2 nRT ln p2
V1
p1
2019/6/10
1-3 体积功的计算、可逆过程
数值可连续变化,数学上有全微分
p f (T ,V )
dp p dT p dV T V V T
2019/6/10
1-1 热力学基本概念
三、过程和途径
过程:系统由一个始态到一个终态的状态变化。 途径:实现过程的具体步骤。
几种重要过程:
(1)等温过程:系统的始终态温度相等,且等于恒定的环境温度。 (2)等压过程:系统的始终态压力相等,且等于恒定的环境压力。 (3)等容过程:在整个过程中,系统的体积保持不变。 (4)绝热过程:在整个过程中,系统与环境之间无热量的交换。 (5)循环过程:系统经历一个过程后,又回到原来的状态。
ΔU = U2 - U1= Q + W
例1-1:某封闭系统中充有气体,吸收了45 kJ的热,又对环境做 了29 kJ的功,计算系统的热力学能的变化。
解:吸热 Q = 45kJ 失功 W= - 29kJ △U= Q + W = 45 + (-29) = 16 kJ 该系统的热力学能增加了16kJ。
2019/6/10
第 1 章 热力学基本原理(一)
1.1 热力学基本概念 1.2 热力学第一定律 1.3 体积功的计算、可逆过程 1.4 焓与热容 1.5 热力学第一定律在单纯物理变化过程中的应用 1.6 热力学第一定律对化学反应的应用——热化学
第一章 热力学基础

例: 一热力学系统在等温定容的条件下发生变 化时,放热15 kJ,同时做电功35 kJ,假 若系统在发生变化时,不做非体积功(其 它条件不变),计算系统能放出多少热。
例: 在101.3 kPa及298 K时,液态溴的气化热 为30.7 kJ/mol,计算该条件下1 mol溴完 全气化时系统热力学能的变化值。
p = ΣpB
如:组分气体B的物质的量为nB 混合气体的物质的量为n
混合气体的体积为V
则它们的压力: pB = nBRT/V p = nRT/V
将两式相除,得
pB nB p =n
nB nΒιβλιοθήκη 则pB =nB p n
为组分气体B的摩尔分数
同温同容,气态物质的分压与其物质的量成正比。
物质 氮气 氧气 氩气 二氧化碳 水
热(heat):系统和环境之间因温度不同而传递 或交换的能量的形式。 用符号Q 表示。单位:J、kJ。
功(work) :除了热之外其它传递或交换的能量 形式。 用符号W 表示。单位:J、kJ。
热的本质:系统与环境间因内部粒子无序运动 强度不同而造成的能量传递。
热的正负符号规定:以系统为中心,系统 吸热,Q 为正值,系统放热,Q 为负值。
热是途径函数,不是状态函数。 • 热不仅与始末态有关,还与过程经历的具
体途径有关。 • 微量热记作δQ,一定量的热记作Q,而不
是ΔQ。
功是系注统意与: 环功境和间热因都内不部是粒状子态有函序运数动。而交换 的其能数量值。与变化途径有关。都是过程的产物。
功的符号规定:以系统为中心,环境对系统做 功,W为正值;系统对环境做功,W为负值。
2019年热力学第一章23ppt课件.ppt

If two bodies are in thermal equilibrium with a third body, they are also in thermal equilibrium with each other.
相变 — 相不平衡势
化学反应 — 化学不平衡势
平衡的本质:不存在不平衡势 In an equilibrium state there are no unbalanced potentials
平衡Equilibrium与稳定Steady
稳定:参数不随时间变化
稳定但存在不平衡势差 去掉外界影响,
则状态变化 若以(热源+铜棒+冷源) 为系统,又如何?
§1-1 热力系统
1 开口系
1
m
2
1+2 闭口系
WQ
1+2+3 绝热闭口系 1+2+3+4 孤立系
4
3
非孤立系+相关外界
=孤立系
热力系统其它分类方式
其它分类方式
均匀系 物理化学性质
非均匀系
工质种类
单元系 多元系
单相 相态
多相
简单可压缩系统
Simple compressible system
最重要的系统 简单可压缩系统 只交换热量和一种准静态的容积变化功
容积变化功
压缩功 膨胀功
§1-2 状态和状态参数
State and state properties
状态:某一瞬间热力系所呈现的宏观状况
状态参数:描述热力系状态的物理量
状态参数的特征:
01基本概念及定义热力学2013-文档资料

第一章 基本概念及定义
12
2. 准静态过程 quasi-static state process
过程中系统经历的是一系列平衡状态,并在 每次状态变化时仅是无限小地偏离平衡状态。 实现准静态过程的条件: 系统和外界△→0 大部分实际过程可以近似地当作准静态过程。
在状态参数坐标图上,可用一条过 程曲线定性地表示该准静态过程。
第一章 基本概念及定义
6
3. 温度 Temperature , T ( t )
温度是标志系统冷、热程度的参数。 温度的建立以及测量是以热力学第零定律为基础的。
热力学第零定律(热平衡定律)The Zeroth Law of Thermodynamics : 两个系统分别与第三个系统处于热平衡,则这两个系统彼此也
是衡量可逆过程中工质与外 界是否发生热交换的标志。
在p-v图上: 一点:一个平衡状态 一实线:一个准静态过程
在T-s图上:一点:一个平衡状态 一实线:一个准静态过程
曲线下面积:
可逆过程中系统所 做的容积变化功。
功是过程量
第一章 基本概念及定义
曲线下面积:
可逆过程中系统与 外界所交换热量。
热量是过程量
状态参数坐标图:
应用两个独立状态参数,可组成状态参数坐标图。
ex: P-V, T-s, h-s, p-h
注意:①图上任意一点代表一个平衡状态;
②若系统处于不平衡状态, 则无法在状态参数坐标图上描述。
第一章 基本概念及定义
10
1-4 状态方程式
1. 状态方程式
三个基本状态参数(p、v、T)之间的函数关系。即:
• 功量是过程量,仅存在于过程中,过程 一旦结束,功量这种能量形式就不复存在。
热力学第一章基本概念

h
15
四、热力系示例
1.刚性绝热气缸-活塞系统,B侧设有电热丝 红线内 ——闭口绝热系
黄线内不包含电热丝 ——闭口系
黄线内包含电热丝 ——闭口绝热系
兰线内
——孤立系
h
16
2.刚性绝热喷管
取红线为系统— 闭口系
取喷管为Hale Waihona Puke 统—开口系绝热系?h
17
3.A、B两部落“鸡、犬之声相闻, 民至老死不相往来”
又:广延量的比性质具有强度量特性,如比体积
v
V
m
工程热力学约定用小写字母表示单位质量参数。
h
20
状态参数的微分特征
设 z =z (x , y)
dz是全微分
dzxzy dxyzxdy
充要条件:
2z 2z xy yx
h
可判断是否是状 态参数
22
强度参数与广延参数
强度参数:与物质的量无关的参数
如压力 p、温度T
h
6
1-2 热力系统(热力系、系统、体系) 外界和边界
一、定义
• 系统(thermodynamic system, system)
人为分割出来,作为热力学 研究对象的有限物质系统。 • 外界(surrounding ): 与体系发生质、能交换的物系。
• 边界(boundary):
系统与外界的分界面(线)。
A部落为系统
—闭口系 A
A+B部落为系统—孤立系
h
B
18
1-3 工质的热力学状态和基本状态参数
一、热力学状态和状态参数
热力学状态(state of thermodynamic system) —系统宏观物理状况的综合
高等工程热力学 童钧耕 第1章基本概念

b
a
.
.
wnet d
c
.
a
b qnet d
.
c
输出净功; 在p-v图及T-s图上顺时针进行; 膨胀线在压缩线上方;吸热线在放热线上方。
24
回顾
▲ 逆向循环 制冷循环 热泵循环
一般地讲:输入净功; 在状态参数图逆时针运行; 吸热小于放热。
25
回顾
▲ 循环经济性指标: 收益 代价 动力循环: 热效率 逆向循环: 制冷系数
热流体科学理论
— 高等工程热力学部分
主讲:屈健 副教授
Email: rjqu@
1
教材:童钧耕,吴孟余,王平阳著,高等工程热力学, 科学出版社,2006 参考书目:
陈则韶 著,
高等工程热力学,中国科学技术大学出版社,第2版,
2014
K. Annamalai, I. K. Puri 著, Advanced Thermodynamics Engineering,CPC Press, 2002
☻ 焓
☺的功量。
流动功:系统维持流动 所花费的代价。
pAH pv
☺焓
p2v2 p1v1 ( [ pv])
●定义:H=U+pV ●物理意义: 引进或排出工质而输入或排出系统的总能量。 14
☻ 熵
δQ dS T rev ☆ 熵是状态参数
► 热力学状态 —系统宏观物理状况的综合 ► 状态参数 —描述物系所处状态的宏观物 理量 a)状态参数是宏观量,是大量粒子的 平均效应,只有 平衡态才有状参,系统有多个状态参数,如
p,V , T ,U , H , S , F , G 等。
b)状态参数的特性—状态的单值函数 物理上—与过程无关 数学上—其微量是全微分, dx 0
工程热力学-1第一章 基本概念

例1-2 P23 可逆过程功的计算关键:找到p和v之间的关系
三、过程热量
系统与外界之间依靠温差传递的能量称为热量。 符号:Q ;单位:J 或kJ。
单位质量工质所传递的热量用q 表示,单位为 J/kg 或 kJ/kg。
热量正负的规定: 系统吸热:q > 0 系统放热:q < 0
热量和功量都是系统与外界在相互作用的过程 中所传递的能量,都是过程量而不是状态量
热量如何表达?
热量是否可以用类似于功的
? 式子表示?
Entropy
引入“熵”
清华大学刘仙洲教授 命名为“熵”
在可逆过程中,系统与外界交换的热量与功量
的计算公式具有相的形式。
功量:
热量:
w pdv
qqTTds?
2
w 1 pdv
2
q 1 Tds
条件 准静态或可逆
可逆
s 称为比熵。比熵同比体积 v 一样是工质的状态 参数。
比熵的定义式:ds q
T
(可逆过程)
比熵的单位为J/ (kg·K) 或 kJ/ (kg·K)
对于质量为m的工质,
Q TdS
2
Q 1 TdS
S为质量为 m 的工质的熵,单位是 J/K。
示热图
2
w 1 pdv
2
q 1 Tds
在可逆过程中单位 质量工质与外界交换 的 热 量 可 以 用 T-s 图 (温熵图)上过程曲 线下的面积来表示。
消除一种 不平衡势差
达到某一 方面平衡
消除一种能量 传递方式
状态公理 对于组成一定的物质系统,该系统平衡态的
独立状态参数有 n +1
n-表示系统与外界进行准静功交换的数目
高等工程热力学-第一章、热力学基本原理及定义

功量的 流:
系统所交换的功量,对系统自身 值变化的贡献。
例:两种可逆绝热膨胀过程,
判断功量 值的正负。
=面积(A+B)-面积B =面积A>0
=面积D-面积(C+D) =-面积C<0
功库:假想的、定质量定容积的绝热系统,内部可逆。
注意:无用能只是指能量的作功能力为零,并非绝对无用, 在非作功场合仍有使用价值。
4.有用功及无用功
系统1→2过程:
无用功: 有用功:
(可逆过程)
最大有用功:
问:下面哪些是过程量,哪些是状态量?
5. 与 Exergy and Anergy
在一定的环境条件下,一定形态的能量中可以转换成有 用功的最大理论限度,称为该种形态能量中的 , 而不 能转换成有用功的部分则称为 。
◆是否满足热力学第一定律的过程,都能够实现? 怎样实现?条件是什么? 例:①一杯热水放在桌子上,会自发地慢慢变冷。 ②杂技中耍手帕,或热功当量实验。 ③煤气(液化气)泄露事故。 热过程具有方向性。
◆自然界中的一切过程总是自发地朝着一定的方向进行。
◆但非自发过程并不是不可能实现的。非自发过程的实现 要花费一定的代价,需要补偿过程同时进行。 压气机→气体的压缩; 热机→热能转变为机械能; 制冷机→热量由低向高传递。
周围环境:能容量无限大的、定质量系统,内部可逆,
4. 质量流能容量的可用性
质量流的 值: A f
质量交换对系统火用值变化的贡献,总是由流动质量本身 的的火用值及流动功的火用流两部分组成,而且它们总是同 时出现,所以可以把它们的总和看作是质量流本身所固有的 能质属性,定义为质量流的火用值。
质量流的 流: (A)M
热力学电子教案第1章 基本概念.ppt

平衡状态 宏观性质不随时间变化没有外界作用 — 宏观静态。
稳定状态 宏观性质不随时间变化定有外界作用 — 宏观动态。
平衡必定是稳定的,稳定未必平衡。
21
1-3 平 衡 状 态
四、平衡状态与均匀状态区别
平衡状态强调宏观性质的时间特性-各时刻一样 均匀状态强调宏观性质的空间特性-各空间一样
状态方程也可以写为隐函数的形式:
F(p,v,T)= 0
二、状态参数坐标图
(1-17)
任意两个相互独立的状态参数所构成的平面坐标系中 的任意一点就代表热力系的某一平衡(均匀)状态。 热力系的不平衡(不均匀)状态,是无法这样表示。
常用坐标图有p - v 图、T - s图、H - s图、Log - H图 25
2、功和热量都是过程量,它们数值的大小与所经历的 具体过程路线有关。
六、状态量与过程量的区别和联系
区别: 状态量 T、 P、 V、 U、 H、 S — 储 存 量
过程量 Q、W
— 交换量
联系:过程量的传递必然引起状态量的变化,
状态量的变化必然引起过程量的传递。
31
例如孤立系内部进行的过程
8
1- 2 状态和状态参数
9
gz
1- 2 状态和状态参数
4)压力的测量 压力计、真空表、U形管压力计、斜管式 微压计
用U形管压力计,其换算关系如下:
Pg (Pv) =
(1-6)
5)压力单位及换算
国际单位制(SI):Pa(帕) 1Pa = 1N/m2
工 程 常 用:MPa(兆帕) 1MPa = 106Pa
5
1- 2 状态和状态参数
一、状态、状态参数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体C
ptr
理想气体温标
将气体温度计的盛气小泡浸没在大 气压下的饱和水与饱和蒸汽的混合物 中,当温度改变时通过改变水银柱内 水银量 ( 增加或减少 ) ,控制盛气小泡 的气体体积保持不变,记录下该固定 点温度ts与此时的压力ps; 再把盛气小泡浸没在大气压下冰水 混合物中,保持气体容积不变,记录 下该固定点温度ti和小泡内压力pi; 然后再用温度计测量某一目标的温 度,将温度计盛气小泡与目标接触, 记录下温度t与小泡内的压力p。
Q2 (t 2 , t 3 ) Q3
Q1 (t1 , t 3 ) Q3
Q1 Q1 Q2 Q3 Q2 Q3
因此有:
(t1 , t 3 ) (t1 , t 2 ) (t 2 , t 3 )
f (t 2 ) f (t 3 )
f (t1 ) (t1 , t 2 ) f (t 2 )
摄氏温标:将标准大气压下水的冰点和沸点之间 的温度等分为100份,并以冰点作为零点。
华氏温标:水的冰点与沸点分别定义为 32 ℉ 和 212℉。 ts ti
t
t 100 80 60 A 40 20 0 测温参数x C A-任意的 B-线性的 C-抛物线的
B
x xi t ( x)(C) 100 xs xi
关于热力系统
重点掌握开口系、闭口系、绝热系、孤立 系 热力系的选取取决于研究目的和方法,具 有随意性,选取不当将不便于分析。 一旦取定系统,沿边界寻找相互作用。 系统与外界的作用都通过边界,看是否有 质量交换、热量传递、功的传递及其他形 式能量传递。
简单可压缩系统
工程热力学中最常见、最重要的热力系统 • 因为热能动力装置常用工质都是可压缩 流体(水蒸气、空气、燃气等) • 系统与外界只交换热量和一种准静态的 体积变化功(膨胀功和压缩功) • 体积变化功只与工质的压力和体积的变 化量有关 • 工程热力学中讨论的大部分系统都是简 单可压缩系统
p T Ttr p tr
p T ( p) 273 .16 lim (K ) p 0 ptr
tr
理想气体温标
气体的维里方程为:
T
2 3 PV RT (1 B p C p D p
)
气体A
气体B
如左图所示,所有气体 压力当p→0时,其PV性质 都趋于一相同的特性。 特别是定容式温度计内 装的气体量趋于零时,所 有气体的温度指示趋于同 一数值,这说明理想气体 定容式温度计与气体性质 无关。
理想气体温标
国际温标规定,以水的三相点作为绝对温标的基准温度点。 用单固定点作为温标基准的同时,必须要给出温标的单位才 能最终确定温标具体数值。水的三相点的温度Ttr=273.16,水 的三相点 (固、液、汽三相共存 ) 的压力为 ptr,则定容式气体 温度计的读数用下式表示:
T p Ttr ptr p p T Ttr 273.16 ptr ptr
c0 2 M R Tt 0
R kB NA
c0 M kB Tt 0 N A
2
国际温标及其发展
理想气体温度计的主要缺点:
温度特别低的情况下,气体会冷凝,偏离理想气体的 性质; 在高温下发生离解; 容积随温度的升降会张缩,不易准确测定; 不适于实验室或工业过程中的实际温度测量。
温度的测量
温度计的工作原理:当一个物体的温度改变时, 物体的其它性质也随之改变,可根据这些性质中 的某些参数测量物体的温度,指明温度的数值。
温度计的分类: 气体温度计、膨胀式温度计、电 阻温度计、热电偶和光学温度计等。
温度计分类
温度计
气体温度计
膨胀式温度计
测温参数
压力或体积
体积
测温范围/℃
-270-1100
-200~750(液) -30~600(固)
接触式测温
电阻温度计 热电偶 光学温度计
电阻 热电动势 辐射强度
-200~800
-200~1300 -50-2000
非接触式测温
一等标准铂电阻温度计其精度可达0.001℃ 电厂过热器气温等一般采用热电偶测温
温标
温标:为量度物体温度而赋予温度的数值。
外推ptr→0时不同气体对目标物体温度的测量的一致性,并 获得温度测量值。下式定义理想气体温标(开氏):
T ( p ) 273.16 lim
ptr 0
p (V 为常数) ptr
温标
热力学温标、摄氏温标、兰氏温标、和华氏温标的关系
热力学温度
1854 年 , 开 尔 文 提 议 将 水 三 相 点 (triple point) 的 温 度 , Ttr=273.16K,作为热力学温度的基准,于 1954年被第十届国 际计量大会采纳。同时用K表示理想气体绝对温标的单位。 受水中氢氧同位素的影响,不同三相点瓶结果差异达50 μK。 目前国际上通过波尔兹曼常数kB来确定热力学温度。
国际温标及其发展 ITS-90温标
3He和4He
e-H2 e-H2(或He) e-H2(或He) Ne O2 Ar Hg H2O Ga In Sn Zn Al Ag Au Cu
VP TP VP(或CVGT) VP(或CVGT) TP TP TP TP TP MP FP FP FP FP FP FP FP
因此:
t ti
ts ti p 1 ps / pi 1 pi
重复上面的温度测量过程,不同的是需从盛气小泡中取出 一部分气体,使小泡内的压力进一步降低,更加接近理想气 体的性质,分别得出更低压力下的p、t、ti、 pi、 ts、ps。
理想气体温标
t、ti、ts不变,ps /pi和p/pi同步变化,t=f(p/pi)。 随着小泡内的气体不断被取走当p→0时,pi→0与ps→0。 根据前述理想气体一致性特性,此时虽然pi→0与ps→0,但 冰点和沸点的温度对所有气体都趋于ti与ts ,而任意测量的温 度特性对应的温度应该有 p→0、 t→tc的特性,并且不论使用 任何气体,在p→0、 pi →0、ps →0都有t→tc ,这就是A、B、 C三种气体当小泡内测量压力 p→0时趋于一致性的结果,即 理想气体温度计与气体性质无关。 存在一个普遍情况,经多次改变定容式气体温度计内的气 体量,使得冰点和沸点时气体温度计的读数pi与ps不断减小, 达到pi→0与ps →0的目的。结果发现即使pi →0与ps →0时,其 比值ps / pi总是为一固定数值不变: ps / pi =1.3661
温度
温度是表征物体冷热程度的物理量。 微观意义:是物质微观热运动的宏观体现,与分 子平均动能成正比
3kBT mv
2
式中:T是热力学温度,K; kB=1.38054×10-23 J/K,波尔兹曼常 数; v为分子移动的均方根速度。
事实上确定分子的平均速度是非常困难的; 温度还需一个更严谨的定义,这就有赖于热力 学第零定律。
由此可以断定:
(t 2 , t 3 )
三个恒温热源间的卡诺循环
QL f (t L ) QH f (t H )
QL TL QH TH
直接用函数f(t)=T作为温标
理想气体温标
气体压力p→0时,气体呈现出理想气体特性,利 用理想气体定压下体积随温度变化的特性或定容 下压力随温度变化的特性,作为度量温度变化的 标准,这种温标称为理想气体温标。 理想气体温标是一种经验温标; 气体温度计有定容式和定压式,定容式温度计的 测量原理:
需要有一种简单、容易再现,便于使用的二级标 准温度计 。
国际温标及其发展
国际计量委员会于1968年开始采用国际实用温标(IPTS68),以取代早期的温度标度。
1990年开始使用1990年国际温标,以取代1968年国际实用 温标(IPTS-68)。
1990年国际温标明确规定了:(1)容易复现的固定点的 气体温标温度和用以检定仪器的二级参考温度;(2)二 级温度标准的仪器仪表的度数用于根据固定点进行内插的 公式。为了完整起见,这是列出了规定的热力学温标固定 温度点。(ITS-90)将适用于温度测量和内插的方法概括 为四个分区。
国际温标及其发展 ITS-90温标
从0.65到5.0K根据 3He和 4He的蒸气压测量,后者又进一步 分为两段。每一段用 12 项多项式 (polynomial) 表示蒸气压与 温度的关系。 从 3.0 到 24.5561K 用氦气定容气体温度计测量,该温度计 3 到 5K 用氦气的蒸气压测定一个温度点、一个氢气的三相点 温度和一个氖气的三相点温度,共三个固定点标定。 从 13.8033 到 1234.93 K按照技术规范用在表中的固定点标 定的标准铂电阻温度计测量,并在四个子分区内用状态方程 作进一步校正,也可更加细分这些分区。 高于 1234.93K 通过测量可见光谱的辐射强度,与 Ag , Au 或 Cu 凝固点同波长辐射强度比较,并且根据普朗克黑体辐 射方程确定的温度值。
B
毛细管
L
盛气小泡 A
水银柱
定容式气体温计示意图
理想气体温标 理想气体温标
根据理想气体温度计的原理,在1标准大气压下经过冰点(角 标i)和沸点(角标s)标定后,其压力和温度关系如下:
t ti p pi ts ti ps pi
p / pi 1 t ti ts ti p s / p i 1
第一章 基础概念
什么是工质?
定义:实现能量转化的媒介物质
制冷工程中又称为制冷剂 对工质的要求:
1)膨胀性 3)热容量 5)对环境友善 2)流动性 4)稳定性,安全性 6)价廉,易大量获取
物质三态中气态最适宜作为工质
什么是热力系统?
被人为地分割出来,作为热力学研究对象 的有限物质系统 外界:系统以外的所有物质 边界(界面):系统与外界的分界面
