二元恒沸混合物的组成和沸腾温度
一些二元恒沸物的组成及沸点

63.5
36.5
水
异丁酸甲酯
100.0
92.3
77.7
6.8
93.2
水
异丁酸乙酯
100.0
110.1
85.2
15.2
84.8
水
异丁酸正丙酯
100.0
133.9
92.2
30.8
69.2
水
异丁酸异丁酯
100.0
147.3
95.5
39.4
60.6
水
异丁酸异戊酯
100.0
168.9
97.4
56.0
44.0
Ⅰ
Ⅱ
Ⅰ
Ⅱ
混合物(Mixture)
Ⅰ
Ⅱ
水
乙醇
100.0
78.4
78.1
4.5
95.5
水
正丙醇
100.0
97.2
87.7
28.3
71.7
水
异丙醇
100.0
82.5
8.04
12.1
87.9
水
正丁醇
100.0
117.8
92.4
38.0
62.0
水
异丁醇
100.0
108.0
90.0
33.2
66.8
水
仲丁醇
100.0
122.9
89.0
25.0
75.0
水
甲酸(最大值)
100.0
100.8
107.3
22.5
77.5
水
乙酸
100.0
118.1
无(no)
无(no)
无(no)
物理化学考试题库及答案(5)

物理化学试题及答案一、选择题:1. 二组分体系恒温时.可能同时存在的最大相数为 ( )(A) Φ=2 (B) Φ=3 (C) Φ=42. 在α、β两项中都含有A 和B 两种物质,当达相平衡时,下列哪种情况正确( )A B A A A B A B (A ) (C) (D) (B )αααβαβββμμμμμμμμ====3. 在101325Pa 下,水、冰和水蒸气平衡的系统中,自由度为 ( )(A) 0 (B) 1 (C) 24. 在密闭容器中有食盐饱和溶液,并且存在着从溶液中析出的细小食盐结晶,则系统的自由度是 ( )(A) 0 (B) 1 (C) 2 (D) 35. 系统是N 2和O 2两种气体的混合物时,自由度应为 ( )(A) 1 (B) 2 (C) 3 (D) 46. 在101325 Pa 下,水和水蒸气呈平衡的系统,其自由度f 为 ( )(A) 0 (B) 1 (C) 2 (D) 37. NH 4Cl(s)在真空容器中分解达到平衡NH 4Cl(s) → HCl(g) + NH 3(g) ( )(A) K =3, Φ=2, f =2 (B) K =2, Φ=2, f =1(C) K =1, Φ=2, f =1 (D) K =4, Φ=2, f =18. 25 ℃及标准压力下,NaCl(s)与其水溶液平衡共存 ( )(A) K =1, Φ=2, f =1 (B) K =2, Φ=2, f =1(C) K =2, Φ=2, f =0 (D) K =4, Φ=2, f =19. 已知在318 K 时纯丙酮的的蒸气压为43.063 kPa ,今测得氯仿的摩尔分数为0.30的丙酮-氯仿二元溶液上丙酮的蒸气压为26.77 kPa ,则此溶液: ( )(A) 为理想液体混合物 (B) 对丙酮为负偏差(C) 对丙酮为正偏差 (D) 无法确定10. 苯(A)与甲苯(B)形成理想混合物,当把5 mol 苯与5 mol 甲苯混合形成溶液,这时,与溶液相平衡的蒸汽中,苯(A)的摩尔分数是: ( )(A) y A = 0.5 (B) y A < 0.5(C)y A > 0.5 (D) 无法确定11. 二组分理想溶液的沸点的论述正确的是:()(A) 沸点与溶液组成无关(B)沸点在两纯组分的沸点之间(C) 小于任一纯组分的沸点(D) 大于任一纯组分的沸点12. 由A及B二种液体组成理想溶液,A、B的饱和蒸气压分别为p*A、p*B,x为液相组成,y为气相组成,若p*A > p*B( *表示纯态),则:()(A) x A > x B(B) x A > y A(C) 无法确定(D)x A < y A13. 液体A与B混合形成非理想混合物,当A与B分子之间作用力大于同种分子之间作用力时,该混合物对拉乌尔定律而言:()(A) 产生正偏差(B)产生负偏差(C) 不产生偏差(D) 无法确定14. H2O、K+、Na+、Cl- 、I- 体系的组分数是:()(A) K = 3 (B) K = 5(C)K = 4 (D) K = 215. 压力升高时,单组分体系的熔点将如何变化:()(A) 升高(B) 降低(C) 不变(D)不一定16. 硫酸与水可组成三种化合物:H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s),在p下,能与硫酸水溶液共存的化合物最多有几种:()(A) 1 种(B) 2 种(C) 3 种(D) 0 种17. 两组分理想溶液,在任何浓度下,其蒸气压:()(A) 恒大于任一纯组分的蒸气压(B) 恒小于任一纯组分的蒸气压(C)介于两个纯组分的蒸气压之间(D) 与溶液组成无关18.具有最低恒沸温度的某两组分体系,在其T-x相图最低点有()(A)f=0; x g=x l(B) f=1; x g = x l(C) f=0; x g > x l(D) f=1; x g > x l19. 一定温度下,二元理想液态混合物中若纯B的饱和蒸汽压大于纯A的饱和蒸汽压(p B*>p A*),则当x B增大汽液两相达平衡时,系统压力()(A) 不变(B) 减少(C)增大(D) 不一定20. 由A、B二组分组成一理想液态混合物。
常见的共沸混合物的组成及共沸点
共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。
共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。
并非所有的二元液体混合物都可形成共沸物,科学堂在下列表格列出了一些常用的共沸物组成及其共沸点。
这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。
如此点为最高点,则称为正共沸物;如此点为最低点,则称为负共沸物。
大多数共沸物都是负共沸物,即有最低沸点。
值得注意的是:任一共沸物都是针对某一特定外压而言。
对于不同压力,其共沸组分和沸点都将有所不同;实践证明,沸点相差大于30K的两个组分很难形成共(恒)沸物(如水与丙酮就不会形成共沸物)。
(a)与水形成的二元共沸物(水沸点100℃)(b)常见有机溶剂间的共沸混合物常见的共沸物共沸物组分的沸点(度)组成(w/w) 共沸点(度)水--乙醇 100--78.5 5--95 78.15水--正丙醇--97.2 28.8--71.2 87.7水--异丙醇--82.4 12.1--87.9 80.4水--正丁醇--117.7 37.5--62.5 92.2水--异丁醇--108.4 30.2--69.8 89.9水--叔丁醇--82.5 11.8--88.2 79.9水--异戊醇--131.0 49.6--50.4 95.1水--正戊醇--138.3 44.7--55.3 95.4水--氯乙醇--129.0 59.0--41.0 97.8水--乙醚--35 1.0--99.0 34水--乙腈--81.5 14.2--85.8 76水--丙烯腈--78.0 13.0--87 70.0水--甲酸--101 26--74 107水--丙酸--141.4 82.2--17.8 99.1水--乙酸乙酯--78 9.0--91 70水--二氧六环--101.3 18--82 87.8水--氯仿--61.2 2.5--97.5 56.1水--四氯化碳--77.0 4.0--96 66.0水--二氯乙烷--83.7 19.5--80.5 72.0水--苯--80.4 8.8--91.2 69.2水--甲苯--110.5 20--80 85.0水--二甲苯--137-140.5 37.5--62.5 92.0水--吡啶--115.5 42--58 94.0水--二硫化碳--46 2.0--98.0 44甲醇--二氯甲烷 64.7--41 7.3--92.7 37.8甲醇--氯仿--56.2 12--88 55.5甲醇--四氯化碳--77.0 21--79 55.7甲醇--丙酮--56.2 12--88 55.5甲醇--苯--80.6 39.1--60.9 57.6甲醇/甲酸甲酯/环己烷 17.8/48.6/33.6 50.8乙醇--乙酸乙酯 78.3--78.0 30--70 72.0乙醇--苯--80.6 32--68 68.2乙醇--氯仿--61.2 7--93 59.4乙醇--四氯化碳--77.0 16--84 65.1乙醇/苯/水78.3/80.6/100 19/74/7 64.9 乙酸乙酯--四氯化碳78.0--77.0 43--57 75.0乙酸乙酯--环己烷 46--54 71.6 乙酸甲酯--环己烷83--17 54.9 氯仿--丙酮 61.2--56.4 80--20 64.7 甲苯--乙酸 101.5--118.5 72--28 105.4。
物理化学下册考试题库精编版

第六章相平衡选择题1. 二元恒沸混合物的组成(A)固定 (B) 随温度而变 (C) 随压力而变 (D) 无法判断答案:C2. 一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0答案:B。
此为可逆过程故ΔG=0。
5. 以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物 (B) 漂白粉(C) 大小不一的一堆单斜硫碎粒 (D) 墨汁答案:C。
6. NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7. 如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
7. 对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统(B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变(D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B8. 关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点(B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变(D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D9. 用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1(B) 在每个单相区, 自由度F=2(C) 在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D) 在水的沸点曲线上任一点, 压力随温度的变化率都小于零答案:D10. 二组分系统的最大自由度是(A) F=1 (B) F=2 (C) F=3 (D) F=4答案:C。
恒沸精馏

恒沸物恒沸物,又称共沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。
恒沸物是不可能通过常规的蒸馏或分馏手段加以分离的。
并非所有的二元液体混合物都可形成恒沸物,一些例子列在了下面。
这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。
如此点为最高点,则称为正恒沸物;如此点为最低点,则称为负恒沸物。
大多数恒沸物都是负恒沸物,即有最低沸点。
值得注意的是,任一恒沸物都是针对某一特定外压而言。
对于不同压力,其恒沸组分和沸点都将有所不同。
常见恒沸物硝酸 (68.4%) / 水, 沸点122°C高氯酸 (28.4%) / 水, 沸点203°C (负恒沸物)氢氟酸 (35.6%) / 水, 沸点111.35°C (负恒沸物)乙醇 (95%) / 水, 沸点78.2°C (负恒沸物)硫酸 (98.3%) /水, 沸点330°C苯(18.5%) / 乙醇(74%) / 水 组成一个三元共沸物,沸点64.9°C (负恒沸物) 恒沸精馏(1)三组分恒沸精馏在A 、B 双组分恒沸溶液或相对挥发度很小的双组分溶液中加入称为挟带剂的第三组分C ,此挟带剂C 与原溶液中一个或两个组分形成新的恒沸物(AC 或ABC ),新的恒沸物的沸点比纯组分B (或A )或原恒沸物(AB )的沸点低得多,使溶液变成“恒沸物—纯组分”的精馏,其相对挥发度大而易于分离。
例如:乙醇-水恒沸物+苯(挟带剂)→乙醇-水-苯三元恒沸物+纯乙醇A+B (AB )+C →(ABC )+A(ABC )组成:A (乙醇)0.228,B (水)0.233,C (苯)0.539(ABC )中水对乙醇摩尔比x x >>=='022.1228.0233.0,故只要有足量的苯作为挟带剂,在精馏时水将全部集中于三元恒沸物(ABC )中从Ⅰ塔塔顶带出,而I 塔塔底产品为无水酒精,其流程见图,Ⅱ塔用于回收苯,Ⅲ塔用于回收乙醇。
双液系的气液平衡相图
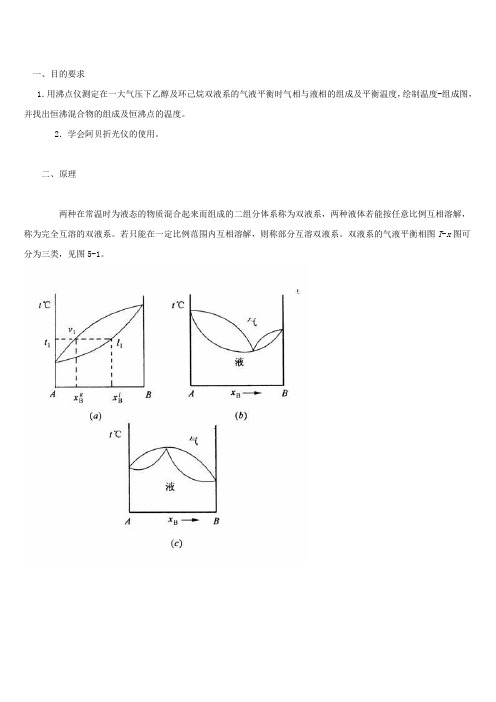
一、目的要求1.用沸点仪测定在一大气压下乙醇及环己烷双液系的气液平衡时气相与液相的组成及平衡温度,绘制温度-组成图,并找出恒沸混合物的组成及恒沸点的温度。
2.学会阿贝折光仪的使用。
二、原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系,两种液体若能按任意比例互相溶解,称为完全互溶的双液系。
若只能在一定比例范围内互相溶解,则称部分互溶双液系。
双液系的气液平衡相图T-x图可分为三类,见图5-1。
例如图x,液相组成点x。
无水乙醇(ml)1234环己烷(ml)43213.用阿贝折光仪测标准溶液以及纯乙醇、纯环己烷的折射率。
4.测定体系的沸点及气液两相的折射率。
测定方法如下:将一配制好的样品注入沸点仪中,液体量应盖过加热丝,处在温度计水银球的中部,旋开冷凝水,接通电源,电压不能超过规定电压,否则会烧断加热丝。
当液体沸腾、温度稳定后,记下沸腾温度及环境温度,并停止加热。
分别用滴管吸取气相及液相的液体用阿贝折光仪测其折射率,每份样品读数二次取平均值。
测定完之后,将沸点仪中的溶液倒回原试剂瓶中,换另一种样品按上述操作进行测定。
五、注意事项1.沸点仪中没有装人溶液之前绝对不能通电加热,如果没有溶液,通电加热丝后沸点仪会炸裂。
2.一定要在停止通电加热之后,方可取样进行分析。
3.使用阿贝折光仪时,棱镜上不能触及硬物(滴管),用擦镜纸擦镜面。
六、数据处理1.将标准溶液的体积百分数按式(5-1)换算成重量百分数,然后以重量百分数对折射作图。
W%=×100%(5-1)式中V1、D1分别代表乙醇的体积及比重,乙醇的比重在20℃为0.7893;V2、D2分别代表环己烷的体积及比重,环己烷的比重在20℃时为0.7791。
2.沸点校正,由于温度计的水银柱未全部浸人待测温度的区域内而须进行露茎校正。
校正公式D t露=K·n·(t测一t环) (5-2)式中K=0.00016,n为露出于被测体系之外的水银柱长度,t测为测量温度计上的读数,t环为环境温度。
物理化学《相平衡》习题及答案

物理化学《相平衡》习题及答案选择题1.二元恒沸混合物的组成(A)固定(B) 随温度而变(C) 随压力而变(D) 无法判断答案:C2.一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4 答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0 答案:B。
此为可逆过程故ΔG=0。
5.以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物 (B) 漂白粉 (C) 大小不一的一堆单斜硫碎粒(D) 墨汁答案:C。
6.NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3 答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7.如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
8.对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统 (B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变 (D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B9.关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点 (B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变 (D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D10.用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1 (B) 在每个单相区, 自由度F=2(C)在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D)在水的沸点曲线上任一点,压力随温度的变化率都小于零。
物理化学习题答案(二)-相平衡

物理化学习题答案(二)一. 选择题1. 当克劳修斯_克拉贝龙方程应用于凝聚相转变为蒸气时,则:( C )(A) p 必随T 之升高而降低 (B) p 必不随T 而变(C) p 必随T 之升高而变大 (D) p 随T 之升高可变大或减少2. 水的三相点,其蒸发热和熔化热分别为和·mol-1。
则在三相点冰的升华热约为: ( B )(A) kJ•mol-1 (B) kJ•mol-1(C) kJ•mol-1 (D) kJ•mol-13. 已知苯一乙醇双液体系中,苯的沸点是,乙醇的沸点是,两者的共沸组成为:含乙醇%(摩尔分数),沸点为。
今有含乙醇%的苯溶液,在达到气、液平衡后,气相中含乙醇为y2,液相中含乙醇为x2。
问:下列结论何者正确(C )(A) y2> x2 (B) y2= x2 (C) y2< x2 (D) 不能确定4. 如上题,若将上述溶液精馏,则能得到:(D )(A) 纯苯 (B) 纯乙醇 (C) 纯苯和恒沸混合物 (D)纯乙醇和恒沸混合物5. 绝热条件下,的NaCl加入的碎冰中,体系的温度将如何变化(B )(A) 不变 (B) 降低 (C) 升高 (D)不能确定6. 体系中含有H2O、H2SO4•4H2O、H2SO4•2H2O、H2SO4•H2O、H2SO4,其组分数C为: ( B )(A) 1 (B) 2 (C) 3 (D)47. 在410 K,Ag2O(s)部分分解成Ag(s)和O2(g),此平衡体系的自由度为:(A )(A) 0 (B) 1 (C) 2(D) 38. 在通常情况下,对于二组分物系能平衡共存的最多相为:(D )(A) 1 (B) 2 (C) 3(D) 49. CaCO3(s)、CaO(s)、 BaCO3(s)、BaO(s)及CO2(g)构成的平衡物系,其组分数为: (B )(A) 2 (B) 3 (C) 4 (D)510. 由CaCO3(s)、CaO(s)、 BaCO3(s)、 BaO(s)及CO2(s)构成的平衡体系其自由度为: ( C)(A) f =2 (B) f = 1 (C) f = 0(D) f = 311. N2的临界温度是124K,室温下想要液化N2, 就必须:( D)(A) 在恒温下增加压力 (B) 在恒温下降低压力(C) 在恒压下升高温度 (D) 在恒压下降低温度12. 对于与本身的蒸气处于平衡状态的液体,通过下列哪种作图法可获得一直线: (C)(A) p对T (B) lg(p/Pa) 对T (C) lg(p/Pa) 对1/T(D) 1/p 对lg(T/K)13. 在相图上,当体系处于下列哪一点时存在二个相:(A )(A) 恒沸点(B) 三相点(C) 临界点(D) 最低共熔点14. 在相图上,当体系处于下列哪一点时存在一个相:(C )(A) 恒沸点(B)熔点(C) 临界点(D) 最低共熔点15. 将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A )(A) 沸点升高 (B) 熔点升高 (C) 蒸气压升高(D) 都不对16. 稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述其中正确的是 ( C)(A)只有溶质不挥发的稀溶液才有这些依数性 (B)所有依数性都与溶剂的性质无关(C)所有依数性都与溶液中溶质的浓度成正比 (D)所有依数性都与溶质的性质有关17. 两只各装有1kg水的烧杯,一只溶蔗糖,另一只溶有,按同样速度降温,则: (A)(A)溶有蔗糖的杯子先结冰 (B)两杯同时结冰(C)溶有NaCl的杯子先结冰 (D)视外压而定18. 下列气体溶于水溶剂中,哪个气体不能用亨利定律(C )。
北京市攻读硕士学位研究生入学考试联合命题物理化学(2012年~2016年)

2012年攻读硕士学位研究生入学考试北京市联合命题物理化学试题(请将答案写在答题纸上,写在试题上的答案无效)一.选择正确的答案:(每小题2分,共计50分)1. 理想气体经可逆与不可逆两种绝热过程,则( A ) 可以从同一始态出发达到同一终态。
( B ) 不可以达到同一终态。
( C ) 不能确定以上A、B中哪一种正确。
( D ) 可以达到同一终态,视绝热膨胀还是绝热压缩而定。
2. ΔH=Q p此式适用于哪一个过程:( A ) 理想气体从101325Pa反抗恒定的10132.5Pa膨胀到10132.5Pa( B ) 在0℃、101325Pa下,冰融化成水( C ) 电解CuSO4的水溶液( D ) 气体从(298K,101325Pa)可逆变化到(373K,10132.5Pa )3. 在实际气体的节流膨胀过程中,哪一组描述是正确的:( A ) Q >0, ∆H=0, ∆p < 0 ( B ) Q=0, ∆H <0, ∆p >0( C ) Q=0, ∆H=0, ∆p <0 ( D ) Q <0, ∆H=0, ∆p <04. 对于等容等熵且不做非体积功的封闭系统的自发过程,下列关系肯定成立的是:( A ) ∆G < 0 ( B ) ∆A < 0( C ) ∆H < 0 ( D ) ∆U < 05. 已知反应C(s) + O2(g) =CO2(g) 的△H,下列说法中,何者不正确?( A ) △H为CO2(g)的生成热;( B ) △H是C(g)的燃烧热;( C ) △H 与反应的△U数值不等;( D ) △H 与反应的△U数值相等;6. 理想气体从状态p1,V1,T等温膨胀到p2,V2,T,此过程的∆A与∆G 的关系为( A ) ∆A> ∆G ( B ) ∆A< ∆G ( C ) ∆A = ∆G( D ).无确定关系7. 已知A,B两液体可组成无最高或无最低恒沸点的液态完全互溶的系统,则将某一组成的溶液蒸馏可以获得:(A)一个纯组分和一个恒沸混合物;(B)两个恒沸混合物;(C)两个纯组分。
6-相平衡 习题

解: 相区
1 2 3 4
相态 l1+ l2 l l+g g
自由度F 1 2 1 2
1: 液相l
F=2
2:液相l + A(s) F=1
1
3:液相l + C(s) F=1
2
4:液相l + B(s) F=1
5:A(s) + C(s)
F=1
3 5
4
6: B(s) + C(s)
F=1
6
C(s) 、 液相l 、 A(s)三相平衡 F=0
+
Q
三相线LS1S2: l β 冷 加却 热 α
Hg
w%
Cd
杠杆规则:
横坐标为xB
nL xM xL nG xG xM
再结合
nL nG n总
横坐标为wB
mL (wM wL ) mG (wG wM )
1) 在单组分系统的相图中,最多只能存在一个三相点。( ) 2) 若恒沸混合物的恒沸点在沸点--组成图上为最低点,则 在压力--组成图上为最高点。( ) 3) 在通常情况下,对于三组分系统能平衡共存的最多相数 为4。( ) 4) 恒沸混合物不是化合物。( ) 5) 二元恒沸混合物的组成随温度而变。( )
xB 0.25
xB,0 0.3
yB 0.4556
nL
nG
nG ( yB xB,0 ) nL (xB,0 xB ) ①
nL nG 5mol ②
解得 nL =3.784mol nG =1.216mol
【6.4】
(1)各点、线和面的相平衡关系 及自由度数? (2)25℃,101.325kPa下,碳以 什么状态稳定存在。 (3)增加压力可以使石墨转变成 金刚石,已知石墨的摩尔体积大 于金刚石的摩尔体积,那么加压 是石墨转变为金刚石的过程是吸 热还是放热?
考研物理化学相平衡历年真题试卷汇编2_真题(含答案与解析)-交互

考研物理化学(相平衡)历年真题试卷汇编2(总分46, 做题时间90分钟)1. 填空题填空题请完成下列各题,在各题的空处填入恰当的答案。
1.二元合金处于低共熔温度时,体系的自由度F=______。
(2012年北京科技大学)SSS_TEXT_QUSTI该题您未回答:х该问题分值: 2答案:正确答案:0解析:二元合金处于低共熔温度时,F=C—P+1,P=3,则F=0。
2.在三相点附近的温度范围内,TaBr3固体和液体的蒸气压方程分别为lgp/Pa=14.691—5 650/T和lgp/Pa=10.291—3 265/T,则TaBr3三相点的温度为______。
(2011年陕西师范大学)SSS_TEXT_QUSTI该题您未回答:х该问题分值: 2答案:正确答案:542.05 K解析:在三相点 p1 =ps即解得 T=542.05 K2. 单项选择题单项选择题下列各题的备选答案中,只有一个是符合题意的。
1.在二组分同液相图中(见图6一1),当系统从物系点P冷却到点L时,系统将出现( )(2015年西北大学)SSS_SINGLE_SELA A(s),E(l),C(s)三相共存B B(s),D(l),C(s)三相共存C C(l)D C(s)该题您未回答:х该问题分值: 2答案:D解析:基本相图中的竖直线段都表示一个纯物质,P点对应于稳定化合物c的组成,故冷却时产生C(S)。
2.水的三相点处自由度数为( )(2013年西北大学)SSS_SINGLE_SELA 1B 2C 3D 0该题您未回答:х该问题分值: 2答案:D解析:相律表达式为F=C—P+2。
水是单组分体系,故C=1,三相点处P=3,所以F=0。
3.某体系存在C(s)、H2 O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡: H2 O(g)+C(s)<=>H2(g)+CO(g) CO2(g)+H2(g)<=>H2O(g)+CO(g) CO2(g)+C(g)<=>2CO(g) 则该系统的独立组分数为( )(2011年北京科技大学)SSS_SINGLE_SELA 4B 3C 2D 1该题您未回答:х该问题分值: 2答案:B解析:系统的独立组分数可表示为C=S—R—R'。
3-2-1恒沸物喝恒沸组成的计算

1)相图
3.2
恒 沸 精 馏
一、恒沸物和恒沸组成的计算 2 恒沸物的特征和恒沸组成的计算 (1) 二元系
① 二元均相恒沸物
在恒沸点下气相组成和液相组成相等. 当 系统的压力不高,气相可看做理想气体时 0 y1 p1 g 1 K1 x1 P 因 y1=x1 , 故 g 1 P 0 (A) p1 同理得: g 2 P 0 (B) p2
(2) 三元系
A 相图
图3-13 甲乙酮-甲苯-正庚烷系统的气液平衡相图
恒沸物:指具有恒沸现象的液体混合物在一 定条件下所生成的产物 恒沸点:恒沸时的温度。
一、恒沸物和恒沸组成的计算 1 恒沸现象与恒沸物 恒沸物又分为最高恒沸物与最低恒沸物两种 若溶液的蒸气压对理想溶液产生最大正偏 差,即g >1,则形成最低恒沸物; 若溶液的蒸气压对理想溶液产生最大负偏 差,即γ<1,则形成最高恒沸物。
一、恒沸物和恒沸组成的计算 1 恒沸现象与恒沸物 d. 对最低恒沸物, 在恒沸点左侧, y>x, a >1; 在恒沸点右侧,y<x,a < 1。 e. 同一物系的恒沸温度与组成随压力的不 同而异,对某些系统可采用变压精馏的方 法分离
一、恒沸物和恒沸组成的计算 2 恒沸物的特征和恒沸组成的计算 (1) 二元系 ① 二元均相恒沸物 1)相图 二元恒沸物的性质: 混合物的蒸汽压组成曲线上之极值 点相当于汽、液平衡相的组成相等。且温 度的极大(或极小)值总是相当于压力的极 小(或极大)值——科诺瓦洛夫定律。
② 二元非均相恒沸物
二元系在三相共存时: f C - 2 1 (C 2 ) 当P或T不变时,f 0
即压力(或温度)一经确定,则平衡的 气相和两个液相的组成就是一定的。
二元恒沸混合物的组成和沸腾温度

II
I
II
混合物(Mixture)
I
II
水
乙醇
100.0
78.4
78.1
4.5
95.5
水
止丙醇
100.0
97.2
87.7
28.3
71.7
水
异丙醇
100.0
82.5
8.04
12.1
87.9
水
止丁醇
100.0
117.8
92.4
38.0
62.0
水
异丁醇
100.0
108.0
90.0
33.2
66.8
水
仲丁醇
74.7
43.5
56.5
异丙醇
氯仿
82.5
61.1
60.8
4.2
95.8
异丙醇
正己烷
82.5
68.9
62.7
23.0
77.0
异丙醇
四氯化碳
82.5
76.8
69.0
18.0
82.0
异丙醇
甲苯
82.5
110.8
81.3
79.0
21.0
异丙醇
甲基乙基酮
82.5
79.0
77.5
32.0
68.0
异丙醇
丙酸甲酯
100.0
249.8
99.9
94.0
6.0
水
苯甲酸异丁酯
100.0
242.2
99.8
92.6
7.4
水
苯甲酸异戊酯
100.0
262.2
99.9
95.6
4.4
恒沸混合物

恒沸混合物1. 简介恒沸混合物是指在一定温度范围内,其组成比例保持不变的混合物。
在该温度下,液相和气相同时存在,并且两个相之间有一个动态平衡。
恒沸混合物具有广泛的应用领域,包括化学工业、石油工业等。
2. 恒沸混合物的原理恒沸混合物的形成基于以下两个原理:2.1 蒸汽压平衡原理恒沸混合物的形成依赖于组成物质的蒸汽压平衡。
对于一个组成物质的混合物,每个组分在液相和气相之间都存在一个平衡蒸汽压。
在温度不变的情况下,液相中组分的蒸汽压和气相中组分的蒸汽压保持相等,从而保持了混合物的组成比例。
2.2 沸点正则原理恒沸混合物的形成还依赖于沸点正则原理。
根据沸点正则,当一个混合物的组分和纯组分的蒸汽压-组分温度曲线相交于同一温度时,该混合物在该温度下将呈现恒沸状态。
这个温度被称为恒沸温度。
3. 恒沸混合物的应用恒沸混合物在化学工业和石油工业等领域有着广泛的应用,主要包括以下几个方面:3.1 分离技术由于恒沸混合物的组成比例在一定温度范围内保持不变,可以利用恒沸混合物进行分离。
其中最常见的是利用恒沸混合物进行蒸馏分离。
通过加热混合物,其中的液相部分汽化成气相,然后再通过冷凝,将气相部分重新液化,最终得到纯的复分馏物。
3.2 质量控制在某些化学反应中,组成比例对于反应的结果至关重要。
通过使用恒沸混合物作为反应物,可以保证反应中某些组分的浓度始终保持不变,从而实现对反应质量的精确控制。
3.3 溶剂系统恒沸混合物可以作为溶剂系统,在化学合成中发挥重要作用。
由于恒沸混合物不会随着温度的变化而发生相变,可以提供一个稳定的反应环境,使得反应条件更易于控制。
3.4 精馏塔系统在石油工业中,恒沸混合物在精馏塔系统中也有广泛应用。
通过将恒沸混合物引入塔系统,可以通过改变温度和压力控制不同组分的分离。
这种方式可以提高分离效率,同时降低能耗。
4. 总结恒沸混合物是在一定温度范围内,其组成比例保持不变的混合物。
它基于蒸汽压平衡和沸点正则原理形成,并在化学工业、石油工业等领域有着重要的应用。
二元恒沸混合物的组成

第四章相平衡1. 二元恒沸混合物的组成(A)固定(B) 随温度而变(C) 随压力而变(D) 无法判断答案:C2. 一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个(B) 4个(C) 5个(D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0答案:B。
此为可逆过程故ΔG=0。
5. 以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物(B) 漂白粉(C) 大小不一的一堆单斜硫碎粒(D) 墨汁答案:C。
6. NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7. 如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
7. 对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统(B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变(D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B8. 关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点(B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变(D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D9. 用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1(B) 在每个单相区, 自由度F=2(C) 在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D) 在水的沸点曲线上任一点, 压力随温度的变化率都小于零答案:D10. 二组分系统的最大自由度是(A) F=1 (B) F=2 (C) F=3 (D) F=4答案:C。
二元恒沸混合物的组成

二元恒沸混合物的组成一、引言二元恒沸混合物是指由两种成分组成的混合物,在特定温度下,其蒸汽与液体处于平衡状态,且具有相同的沸点。
本文将介绍二元恒沸混合物的组成及其相关知识。
二、二元恒沸混合物的概念二元恒沸混合物是指由两种成分组成的混合物,在一定温度下,其蒸汽与液体处于平衡状态,且具有相同的沸点。
这种混合物的组成可以是不同的,但其蒸汽和液体的组成比例是恒定的。
三、二元恒沸混合物的组成1. 组成比例二元恒沸混合物的组成比例是指其蒸汽和液体中两种成分的比例关系。
在恒沸混合物中,两种成分的比例保持不变,无论是在蒸汽相还是在液体相中,其成分比例都保持一致。
2. 成分的选择二元恒沸混合物的成分选择主要取决于两种物质之间的化学性质和物理性质。
通常情况下,选择的两种成分具有相似的化学性质和物理性质,这样才能在特定温度下形成恒沸混合物。
3. 形成条件二元恒沸混合物的形成需要满足一定的条件。
首先,选择的两种成分之间必须具有相似的化学性质和物理性质,这样才能在特定温度下形成恒沸混合物。
其次,需要选择适当的温度,使得两种成分的蒸汽和液体能够达到平衡状态。
四、二元恒沸混合物的应用1. 蒸馏分离二元恒沸混合物的应用之一是在蒸馏分离中。
由于恒沸混合物的蒸汽和液体成分比例恒定,可以通过蒸馏的方式将两种成分有效地分离出来。
这在化工工艺中具有重要的应用价值。
2. 溶剂提取二元恒沸混合物的应用之二是在溶剂提取中。
由于恒沸混合物的蒸汽和液体成分比例恒定,可以利用这一特性进行溶剂的提取。
通过选择适当的溶剂和调节温度,可以实现对特定成分的有效提取。
3. 质量分析二元恒沸混合物的应用之三是在质量分析中。
由于恒沸混合物的组成比例恒定,可以通过测量蒸汽和液体中两种成分的比例来确定样品中特定成分的含量。
这在化学分析和质量检测中具有重要的意义。
五、总结二元恒沸混合物是由两种成分组成的混合物,在特定温度下,其蒸汽和液体处于平衡状态,且具有相同的沸点。
常见的共沸物

常见的共沸物又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分和沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽和液体本身有着完全相同的组成。
共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。
并非所有的二元液体混合物都可形成恒沸物,一些例子列在了下面。
这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)和液相线(液态和气液混合物的交界)有着共同的最高点或最低点。
如此点为最高点,则称为正恒沸物;如此点为最低点,则称为负恒沸物。
大多数恒沸物都是负恒沸物,即有最低沸点。
非均相共沸精馏分离叔丁醇和水的方法专利号:2本发明公开了一种非均相共沸精馏分离叔丁醇和水方法。
采用包括精馏塔的精馏装置,非均相共沸精馏分离叔丁醇和水,其过程,常压下将叔丁醇和水的恒沸物或混合物,按恒沸物或混合物和共沸剂环已烷的质量比为0.3~1.5,加入精馏塔的塔釜中,在塔釜为60-80℃进行全回流,全回流结束后,采出分相器中富集的水,当塔顶在64~83℃,塔釜在70~87℃,以回流比为1~5,采出三元共沸物收集在分相器中,分相器上层的环己烷和叔丁醇有机相采出备用。
再以回流比1-4,在塔顶62-82℃下由塔顶采出环己烷-水及少量环己烷-叔丁醇的混合物后,在塔釜82-88℃,塔顶82-83℃下从塔顶得到纯度为98.2wt%的叔丁醇产品。
本发明的优点是,共沸剂的用量少,叔丁醇的一次收率高。
乙醇沸点78.3 乙醇和水二元共沸沸点 78.1 二元共沸组成:水4.4 %,乙醇95.5% 要想精馏得到无水乙醇需加人苯,三元共沸。
« 【下载】化学滴定分析用标准溶液的制备(国标)15种常用有机溶剂的纯化»常见的共沸混合物的组成及共沸点化学世界 |共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分和沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽和液体本身有着完全相同的组成。
第五章 相平衡

第五章相平衡一、选择题1。
NH4HS (s) 和任意量的NH3 (g) 及H2S (g) 达平衡时有(Ф代表相数) : ( )(A)C = 2,Ф = 2,f = 2 (B)C = 1,Ф = 2,f = 1(C) C = 2,Ф = 3,f = 2 (D) C = 3,Ф = 2,f = 32. FeCl3和H2O 能形成FeCl3·6H2O,2FeCl3·7H2O,2FeCl3·5H2O,FeCl3·2H2O四种水合物,则该体系的独立组分数C和在恒压下最多可能的平衡共存的相数Ф分别为:( )(A) C = 3,Ф = 4 (B) C = 2,Ф = 4 (C)C = 2,Ф = 3 (D) C = 3,Ф = 53. 硫酸与水可形成H2SO4·H2 O (s)、H2SO4·2H2O (s)、H2SO4·4H2O (s)三种水合物,问在101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3 种(B) 2 种(C) 1 种(D)不可能有硫酸水合物与之平衡共存4。
某体系存在C (s)、H2O (g)、CO (g)、CO2 (g)、H2 (g)五种物质,相互建立了下述三个平衡:H2O (g) + C (s) = H2 (g)+ CO (g); CO2 (g)+ H2 (g)= H2O (g)+ CO (g);CO2 (g)+ C (s)= 2CO (g)。
则该体系的独立组分数C 为:( )(A)C = 3 (B)C = 2 (C) C = 1 (D) C = 45. 298K 时,蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度数为()(A)C = 2,Ф = 2,f = 1 (B) C = 2,Ф = 2,f = 2(C) C = 2,Ф = 1,f = 2 (D) C = 2,Ф = 1,f = 36.对恒沸混合物的描述,下列各种叙述中哪一种是不正确的?( )(A)与化合物一样,具有确定的组成(B) 不具有确定的组成(C) 平衡时,气相和液相的组成相同(D)其沸点随外压的改变而改变7. 二元恒沸混合物的组成()(A) 固定(B) 随温度改变(C) 随压力改变(D)无法判断8. 在pΘ下,用水蒸汽蒸镏法提纯某不溶于水的有机物时,体系的沸点: ()(A)必低于373.2K (B) 必高于373。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20.24
89
水
氢溴酸(最大值)
100
-73
126
52.5
47.5
90
水
氢碘酸(最大值)
100
-34
127
43
57
91
水
甲基乙基酮
100
79.6
73.5
11
89
92
水
甲基正丙基酮
100
102
83.3
19.5
80.5
93
水
甲基异丁基酮
100
115.9
87.9
24.3
75.7
94
水
异丙亚基丙酮
71
水
苯甲酸乙酯
100
212.4
99.4
84
16
72
水
苯甲酸正丙酯
100
230.9
99.7
90.9
9.1
73
水
苯甲酸正丁酯
100
249.8
99.9
94
6
74
水
苯甲酸异丁酯
100
242.2
99.8
92.6
7.4
75
水
苯甲酸异戊酯
100
262.2
99.9
95.6
4.4
76
水
苯乙酸乙酯
100
228.8
99.7
19.5
80.5
43
水
乙酸正戊酯
100
148.8
95.2
41
59
44
水
乙酸异戊酯
100
142.1
93.8
36.2
63.8
45
水
乙酸苄甲酯
100
214.9
99.6
87.5
12.5
46
水
乙酸苯酯
100
195.7
98.9
75.1
24.9
47
水
丙酸甲酯
100
79.9
71.4
3.9
96.1
48
水
丙酸乙酯
100
11
水
2-戊醇
100
119.3
92.5
38.5
61.5
12
水
3-戊醇
100
115.4
91.7
36
64
13
水
正己醇
100
157.9
97.8
75
25
14
水
正庚醇
100
176.2
98.7
83
17
15
水
正辛醇
100
195.2
99.4
90
10
16
水
烯丙醇
100
97
88.2
27.1
72.9
17
水
苯甲醇
100
205.2
100
142.8
94.1
36.4
63.6
55
水
丁酸正丁酯
100
165.7
97.2
53
47
56
水
丁酸异丁酯
100
156.8
96.3
46
54
57
水
丁酸异戊酯
100
178.5
98.1
63.5
36.5
58
水
异丁酸甲酯
100
92.3
77.7
6.8
93.2
59
水
异丁酸乙酯
100
110.1
85.2
15.2
84.8
68.4
62.2
4.5
95.5
25
水
乙基正丙基醚
100
63.6
59.5
4
96
26
水
二异丁基醚
100
122.2
88.6
23
77
27
水
二异戊基醚
100
172.6
97.4
54
46
28
水
二苯醚
100
259.3
99.3
96.8
3.2
29
水
苯乙醚
100
170.4
97.3
59
41
30
水
苯甲醚
100
153.9
95.5
99.9
91
9
18
水
糠醇
100
169.4
98.5
80
20
19
水
苯
100
80.2
69.3
8.9
91.1
20
水
甲苯
100
110.8
84.1
19.6
80.4
21
水
二氯乙烷
100
83.7
72
8.3
91.7
22
水
二氯丙烷
100
96.8
78
12
88
23
水
乙醚
100
34.5
34.2
1.3
98.7
24
水二异丙醚ຫໍສະໝຸດ 100二元恒沸混合物的组成和沸腾温度
表中给出的沸点值是在大气压(101.325kPa)下测得的。
序号
组分名称
沸点/℃
质量百分比/%
1
水
乙醇
100
78.4
78.1
4.5
95.5
2
水
正丙醇
100
97.2
87.7
28.3
71.7
3
水
异丙醇
100
82.5
80.4
12.1
87.9
4
水
正丁醇
100
117.8
92.4
38
82.3
17.7
83
水
丁酸
100
163.5
99.4
81.6
18.4
84
水
异丁酸
100
154.5
99.3
79
21
85
水
硝酸(最大值)
100
86
120.5
32
68
86
水
高氯酸(最大值)
100
110
203
28.4
71.6
87
水
氢氟酸(最大值)
100
19.4
120
63
37
88
水
氢氯酸(最大值)
100
-84
110
60
水
异丁酸正丙酯
100
133.9
92.2
30.8
69.2
61
水
异丁酸异丁酯
100
147.3
95.5
39.4
60.6
62
水
异丁酸异戊酯
100
168.9
97.4
56
44
63
水
异戊酸甲酯
100
116.3
87.2
19.2
80.8
64
水
异戊酸乙酯
100
134.7
92.2
30.2
69.8
65
水
异戊酸正丙酯
100
23.5
76.5
37
水
甲酸苄酯
100
202.3
99.2
80
20
38
水
乙酸乙酯
100
77.1
70.4
6.1
93.9
39
水
乙酸正丙酯
100
101.6
82.4
14
86
40
水
乙酸异丙酯
100
91
77.4
6.2
93.8
41
水
乙酸正丁酯
100
126.2
90.2
28.7
71.3
42
水
乙酸异丁酯
100
117.2
87.5
62
5
水
异丁醇
100
108
90
33.2
66.8
6
水
仲丁醇
100
99.5
88.5
32.1
67.9
7
水
叔丁醇
100
82.8
79.9
11.7
88.3
8
水
正戊醇
100
137.8
96
54
46
9
水
2-甲基-1-丁醇
100
131.4
95.2
49.6
50.4
10
水
2-甲基-2-丁醇
100
102.3
87.4
27.5
72.5
40.5
59.5
31
水
间苯二酚二乙醚
100
235
99.7
91
9
32
水
甲酸正丙酯
100
80.9
71.9
3.6
96.4
33
水
甲酸正丁酯
100
106.8
83.8
15
85
34
水
甲酸异丁酯
100
98.4
80.4
7.8
92.2
35
水
甲酸正戊酯
100
132
91.6
28.4
71.6
