原子结构-化学键-分子结构教学文案
原子结构与化学键教案
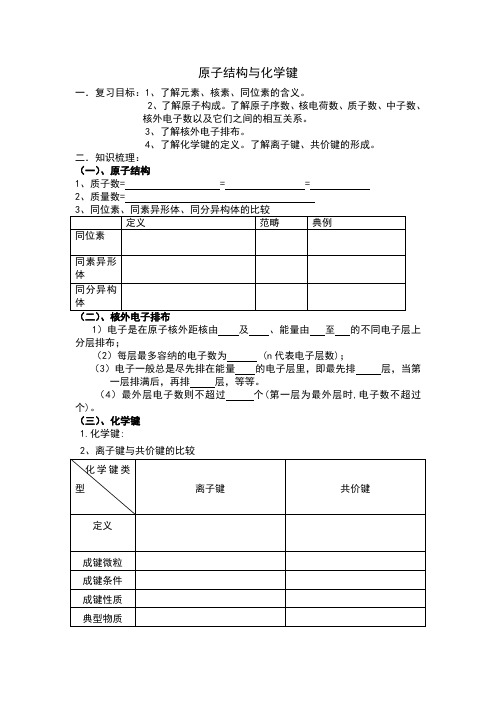
原子结构与化学键一.复习目标:1、了解元素、核素、同位素的含义。
2、了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3、了解核外电子排布。
4、了解化学键的定义。
了解离子键、共价键的形成。
二.知识梳理:(一)、原子结构1、质子数= = =2、质量数=1)电子是在原子核外距核由及、能量由至的不同电子层上分层排布;(2)每层最多容纳的电子数为 (n代表电子层数);(3)电子一般总是尽先排在能量的电子层里,即最先排层,当第一层排满后,再排层,等等。
(4)最外层电子数则不超过个(第一层为最外层时,电子数不超过个)。
(三)、化学键1.化学键:2、离子键与共价键的比较三.问题呈现:某元素的一种同位素X的原子质量数为A,含N个中子,它与H 原子组成H m X分子,在a g H m X中所含质子的物质的量是( )A.(A-N+m)molB.(A-N)molC.(A-N)molD.(A-N+m)mol四.方法规律:我采取启发法,对比法,练习法等多种教学方法并充分发挥电脑多媒体的辅助教学作用。
五.典型例题:例1、136C—NMB(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子()A.核外有13个电子,其中6个能参与成键B.核内有6个质子,核外有7个电子C.质量数为13,原子序数为6,核内有7个质子D.质量数为13,原子序数为6,核内有7个中子例2、下列物质属于同分异构体的一组是()同素异形体的是()A.淀粉和纤维素B. CH3-CH2-CH2-CH3与C.H和D D. O2与O3例3、下列说法不正确的是()①质子数相同的粒子一定属于同种元素②同位素的物理性质有较大差别而化学性质几乎完全相同③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定④电子数相同的粒子不一定是同一种元素⑤每种元素都有两种或两种以的核素A.①②④⑤B.③④⑤C.②③⑤D.①⑤例4、下列微粒结构示意图正确的是()A B C D E六.教学反思:。
高中化学教案:理解化学键和分子结构

高中化学教案:理解化学键和分子结构一、引言化学键和分子结构是高中化学中的重要内容,对于理解和解释化学现象和性质起着关键作用。
本教案旨在通过系统、科学的方式来介绍化学键和分子结构的概念、特点和分类,并通过实例和练习来加深学生对这一知识的理解和掌握。
二、化学键的概念与特点1. 化学键的定义化学键是指由原子间的电子对共享或转移而形成的力,用于保持原子之间的连接。
在化学反应和化学变化中起着至关重要的作用。
2. 化学键的特点(1)化学键在物质中起到连接原子的作用,使得原子形成稳定的分子或离子。
(2)化学键的形成涉及原子外层电子的重新排列或共享,以达到稳定化学状态。
(3)化学键的强弱与原子间的电子云重叠程度相关,电子云越重叠,化学键越强。
三、化学键的分类化学键根据原子间电子的共享或转移方式可以分为离子键、共价键和金属键。
1. 离子键离子键是由电子从金属原子或轨道向非金属原子或轨道转移而形成的。
形成离子键的化学键通常包括金属与非金属元素的反应,其中金属元素会失去电子,变成正离子,而非金属元素则会接受这些电子,形成负离子。
离子键通常具有高熔点和高沸点。
2. 共价键共价键是指两个原子在形成分子时共享一对或多对电子而形成的键。
共价键可以分为单共价键、双共价键和三共价键。
共价键通常具有较低的熔点和沸点。
3. 金属键金属键是由金属原子之间的电子云共享而形成的特殊结构。
金属键通常具有高电导率和良好的导热性。
四、分子结构1. 分子的定义分子是由两个或更多个原子以化学键相互连接而形成的实体。
2. 分子结构的特点(1)分子结构由原子间的化学键的类型、数目、长度和角度所决定。
(2)分子的三维空间构型决定了分子的性质和性质之间的差异。
3. 分子的二维和三维结构表示(1)二维结构表示常用化学式表示法,如结构式。
(2)三维结构表示常用空间结构模型,如球棒模型、空间填充模型等。
五、实例分析与练习1. 实例分析以水分子为例,分析其化学键和分子结构。
高三化学原子结构化学键及分子结构晶体结构

证对市爱幕阳光实验学校高三化学原子结构、化学键及分子结构、晶体结构【本讲信息】 一. 教学内容:物质结构⎪⎩⎪⎨⎧晶体结构化学键及分子结构原子结构二. 教学要求:1. 掌握原子构成的初步知识。
2. 掌握原子序数、核电荷数、质子数、中子数、核外电子数以及质量数与中子数、质子数之间的相互关系。
3. 掌握核外电子排布规律。
4. 掌握离子键、共价键、金属键的涵义。
5. 理解键的极性与分子极性的关系。
6. 了解分子间作用力、氢键的概念。
7. 掌握几种晶体类型的结构特点和性质。
三. 教学:1. 原子核外电子的排布规律。
2. 离子键、共价键的概念,能用电子式表示离子化合物和共价化合物及其形成过程。
3. 三种晶体的结构和性质。
四. 知识分析:1. “六种量〞及其涵义〔1〕质子数:即原子核内质子个数,也称为原子序数,它是决元素品种的重要因素。
〔2〕中子数:即原子核内中子个数。
当质子数相同,而中子数不同时,便提出了同位素的概念。
〔3〕核外电子数:原子中,质子数于电子数,因此整个原子不显电性;当质子数>电子数时,该微粒是阳离子,当质子数<电子数时,该微粒为阴离子。
〔4〕质量数:将原子核内所有质子和中子的相对质量取近似值之和为质量数,用“A 〞表示。
由于电子质量忽略不计,质量数可以近似地表示相对原子质量的大小。
〔5〕同位素的相对原子质量:其意义是某同位素的一个原子质量与C 12原子质量121的相比照值。
初中化学所学的相对原子质量实质上是同位素的相对原子质量。
例如:O 168的一个原子质量为kg 2610657.2-⨯,一个C 126的质量为kg 2610993.1-⨯ O 168的相对原子质量〔6〕元素的相对原子质量:其意义是各种天然同位素的相对原子质量与它的原子所占的原子个数百分比的乘积之总和。
氧元素的相对原子质量[])(O Ar759.999949.15⨯=%+037.09991.16⨯%+204.09992.17⨯%注:我们在题中常用质量数代替同位素的相对原子质量,以此求得的结果称为元素的近似相对原子质量,如: 氧元素的近似相对原子质量759.9916⨯=%037.017⨯+%204.018⨯+%2. 晶体类型与化学键、分子极性之间的关系:由上可知:① 离子晶体〔或离子化合物〕一含离子键。
高一化学化学键与分子结构教案

高一化学化学键与分子结构教案一、教学目标1. 了解化学键的概念和基本分类。
2. 掌握离子键、共价键和金属键的形成条件和特征。
3. 理解分子结构与物质性质之间的关系。
4. 运用所学知识解释化学现象和化学方程式。
二、教学准备1. 教材:高中化学教材或参考书籍。
2. 实验:适当准备化学键和分子结构相关的实验教材和实验器材。
3. 多媒体设备:教师电脑和投影仪。
三、教学过程1. 导入(5分钟)展示一份晶体图样,引导学生思考不同晶体形成的原因,引出化学键的概念。
2. 理论讲解(30分钟)- 化学键的概念和基本分类介绍离子键、共价键和金属键的概念,并展示它们的形成条件和特征。
- 离子键解释离子键的形成过程,结合实例说明离子键在离子晶体中的特性。
- 共价键讲解共价键的形成条件和特征,引导学生理解共价键对分子结构的影响。
- 金属键探讨金属键的形成条件和特点,解释金属的导电性和延展性的原因。
3. 实验展示(30分钟)根据实验教材和实验器材的准备情况,选择性地进行一到两个与化学键相关的实验展示。
- 实例1:离子键的示范实验通过演示NaCl溶解在水中的过程,观察离子的行为,引出离子键的概念。
- 实例2:共价键的示范实验通过展示H2O和CO2分子的模型结构,加深学生对共价键的理解。
4. 深化学习(30分钟)- 分子结构与物质性质的关系引导学生讨论分子结构对物质性质的影响,如极性与溶解性的关系等。
- 化学键与化学反应运用所学知识解释一到两个相关的化学反应,增强学生对化学键作用的理解能力。
5. 拓展应用(15分钟)- 应用案例分析提供一到两个实际应用案例,要求学生运用所学的化学键和分子结构知识来解释相关现象。
- 小组讨论分小组让学生自由讨论,并汇报各组的思考和讨论结果。
6. 总结与作业布置(10分钟)总结本次课程的核心内容,并布置相应的课后作业,如复习习题或实验报告。
四、教学扩展1. 根据学生的实际学习情况,提供相关的练习题或案例分析,巩固所学知识。
化学物质的化学键与分子结构的教学设计

化学物质的化学键与分子结构的教学设计一、引言在化学学科中,化学物质的化学键和分子结构是非常重要且基础的概念。
它们直接影响物质的性质和行为,并对化学反应和化学变化产生巨大影响。
因此,在教学中充分理解和掌握化学键和分子结构的概念对学生来说至关重要。
本文将围绕化学键与分子结构的教学设计展开讨论。
二、背景知识概述1. 化学键的定义和类型化学键是指在化合物中,原子之间通过共用电子对来相互连接的力。
常见的化学键类型包括离子键、共价键和金属键。
2. 分子结构的概念分子结构是指一个分子内原子的相对排列方式。
根据原子之间的共价键和孤对电子的排布,可以确定分子的几何结构。
三、教学目标在教学中,我们旨在帮助学生:1. 理解化学键的概念和类型,并能够根据化学键类型解释物质性质和行为;2. 掌握分子结构的概念,了解几何结构与分子性质之间的关系;3. 运用所学知识解释和预测化学反应和化学变化过程。
四、教学内容及方法1. 化学键的教学设计为了帮助学生理解和区分不同类型的化学键,可以采用以下教学方法:(1) 示意图法:通过绘制示意图,表现出离子键、共价键和金属键在表示方式上的差异。
(2) 模型演示法:利用分子模型或离子模型演示化学键的形成过程,帮助学生直观理解原子之间的连接方式。
(3) 实验演示法:通过化学实验演示离子键和共价键的形成,以及通过改变条件来展示化学键的断裂。
2. 分子结构的教学设计为了帮助学生理解分子结构对化学性质的影响,可以采用以下教学方法:(1) 三维模型展示法:使用三维分子模型展示不同分子的几何结构,让学生观察并理解原子之间的相互位置和角度关系。
(2) 计算机模拟法:利用计算机模拟软件展示分子的几何结构和电子云密度分布,增强学生对分子结构的认识。
(3) 分子模型拼装法:提供分子构建套装,让学生亲自拼装不同分子的结构,培养他们的观察和判断能力。
五、教学评估与反馈为了检验学生对化学键和分子结构的理解程度,可以通过以下方式进行教学评估:1. 选择题:设计一些选择题,测试学生对化学键和分子结构概念的掌握程度。
化学课的原子结构与化学键

化学课的原子结构与化学键教案:原子结构与化学键引言:在学习化学的过程中,原子结构与化学键是非常重要的概念。
了解原子的结构可以帮助我们解释物质的性质和化学反应的过程,而化学键则是构成化合物的基本单位。
本教案将分为三个部分,分别介绍原子结构、化学键的概念和类型以及它们在化学中的应用。
一、原子结构的基本概念(500字)1. 原子的历史发展- 伏特、道尔顿和汤姆逊的贡献- 卢瑟福的阿尔法粒子散射实验- 波尔的量子理论2. 原子的基本组成- 质子、中子和电子的发现- 原子核与电子云的概念- 原子序数、质量数和同位素的定义3. 原子结构模型的发展- 汤姆逊的西瓜糖果模型- 波尔的行星模型- 薛定谔的量子力学模型二、化学键的概念与类型(700字)1. 化学键的概念- 化学键的定义与特点- 化学键与分子的关系2. 共价键- 共价键的形成与特点- 共价键的键长和键能- 符号式结构和共振结构3. 离子键- 离子键的形成与特点- 离子键的键长和键能- 离子晶体的结构和特性4. 金属键- 金属键的形成与特点- 金属键的性质和导电性- 合金的形成和性质5. 非共价键- 氢键的形成与特点- 范德华力和离散分子间相互作用力- 氢键在生物分子中的重要性三、原子结构与化学键的应用(800字)1. 物质的性质与原子结构- 气体的压力、温度和体积与原子结构的关系 - 溶解度与晶体结构的关系- 电解质和非电解质的区别与原子结构的联系2. 化学键与化学反应- 化学键在化学反应中的断裂和形成- 单一化学键和双键在化学反应中的作用- 化学反应速率与键能的关系3. 化学键在生物学中的应用- DNA的双螺旋结构和碱基配对- 蛋白质的结构与功能- 酶的催化作用与活性中心的特点结语:原子结构和化学键作为化学学科的基础概念,在化学中扮演着重要的角色。
通过深入学习原子结构和化学键,我们可以更好地理解物质的性质和化学反应的本质。
同时,这些概念还可以应用于其他学科领域,如材料科学和生物学。
化学键与分子结构教案

化学键与分子结构教案通过实验和理论研究,我们不断积累了大量有关化学键和分子结构的知识。
为了帮助学生更好地理解和掌握这一重要的化学概念,本篇教案将介绍化学键的种类和分子结构的相关知识。
一、教学目标1. 理解化学键的概念和分类;2. 掌握离子键、共价键和金属键的特点和形成规律;3. 理解分子的三维结构和功能。
二、教学准备1. 板书准备:电子结构示意图、离子键、共价键、金属键的定义和形成规律;2. 实验材料:若干示范实验装置,如溶解度实验、导电性实验等;3. 多媒体设备:幻灯片或电子教案。
三、教学过程1. 导入(10分钟)可以通过提问引导学生回忆化学键的相关概念,例如:“你们在前几堂课上学到了哪些有关化学键的知识?”、“化学键在化学反应中起着什么样的作用?”等激发学生思考的问题。
2. 理论讲解(30分钟)2.1 化学键的概念和分类在板书上画出电子结构示意图,讲解原子中电子的能级、轨道和电子排布。
然后引出化学键的概念。
解释离子键、共价键和金属键的定义,对比其特点和形成规律。
2.2 离子键讲解离子键形成的必要条件和过程,引导学生理解化学键作用力对物质的性质产生的影响。
通过示范实验帮助学生观察并思考离子键的性质。
2.3 共价键介绍共价键的形成规律和特点,讲解共价键与分子形状的关系。
可以通过模型或案例分析来帮助学生理解共价键的结构。
2.4 金属键讲解金属键与金属特殊性质的关系,引导学生思考金属的导电性和延展性与金属键的联系。
可以进行相关实验,比如展示铝箔弯曲、酒精灯加热等。
3. 实验操作(40分钟)根据教学目标选择适当的实验,例如离子键导电性实验、共价键溶解度实验、金属键的延展性实验等。
通过实验操作,让学生亲自观察和操作,加深对化学键的理解。
4. 小结与扩展(20分钟)4.1 三维分子结构引导学生思考分子的三维结构对物质性质的影响。
通过模型展示或示范实验,帮助学生理解分子的空间构型与它们的功能之间的关系。
4.2 应用拓展可以让学生运用所学知识,探究分子键和分子结构在日常生活或工业中的应用,例如聚合物材料、医药化学等。
化学教案化学键与分子结构的认识

化学教案化学键与分子结构的认识教学目标:1.了解化学键的概念和种类;2.认识分子结构的组成和形式;3.掌握化学键与分子结构的相关实验方法。
教学重点:1.化学键的种类及其特点;2.分子结构的组成和形式。
教学难点:1.不同种类化学键的区别;2.分子结构的三维展示方法。
教学准备:1.教材:《化学》等化学教材;2.教学工具:幻灯片、实验装置等。
教学过程:Step 1:导入(5分钟)通过回顾上一节课所学习的内容,引出本节课的主题,化学键与分子结构的认识。
提问学生对化学键和分子的理解,并简要回顾答案。
Step 2:化学键的概念和种类(10分钟)介绍化学键的概念和种类,重点介绍离子键、共价键和金属键。
通过幻灯片展示不同种类化学键的形成过程和特点,并引导学生之间的讨论。
Step 3:离子键的实验验证(15分钟)通过实验展示离子键的实验验证方法。
在实验装置中加入适量的氯化钠和硝酸银,观察到生成白色沉淀后,使用电子平衡称量法计算沉淀的质量,以此验证离子键的存在。
学生可以进行实验记录和结果分析。
Step 4:共价键的实验验证(15分钟)通过实验展示共价键的实验验证方法。
选择适量的电极材料及电解液,在电解池中进行电解实验,观察到气体的产生以及电极的电位变化,以此验证共价键的存在。
学生可以进行实验记录和结果分析。
Step 5:金属键的实验验证(15分钟)通过实验展示金属键的实验验证方法。
使用电磁感应仪和磁棒,观察到磁棒可以吸引一些金属片,以及金属片的延展性和电导性,以此验证金属键的存在。
学生可以进行实验记录和结果分析。
Step 6:分子结构的组成和形式(10分钟)介绍分子结构的组成和形式,重点介绍线性分子、非线性分子和三维结构。
通过幻灯片展示不同种类分子结构的示意图,并引导学生之间的讨论。
Step 7:分子结构的三维展示方法(15分钟)。
《结构化学》教案

《结构化学》教案教案:结构化学教学目标:1.理解分子结构的基本概念和原子结构的基本组成。
2.掌握常见分子结构的命名规则。
3.熟悉有机化合物的结构特点和它们在生命活动中的重要性。
4.学会运用结构化学的知识分析有机化合物的性质和反应。
教学内容:第一节概念和基本组成1.分子的概念和组成:原子核、电子和化学键。
2.分子结构的表示方法:分子式、结构式和杂化。
第二节分子结构的命名1.烃类的命名:直链烷烃、支链烷烃和环烷烃。
2.功能团的命名:醇、醛、酮、酸、酯等。
3.多官能团的命名:醇醚、酮醛等。
第三节有机化合物的结构特点和生物活性1.范德华力和分子间相互作用。
2.极性分子和非极性分子。
3.有机化合物的官能团和生物活性。
第四节结构化学的应用1.化合物的相对分子质量和摩尔质量。
2.化合物的摩尔比和分子式计算。
3.分子结构和性质之间的关系。
4.化学反应的机理研究。
教学重点:1.分子结构的基本概念和组成。
2.常见有机化合物的命名规则。
3.结构化学在有机化学中的应用。
教学难点:1.复杂有机化合物的命名规则。
2.结构化学在化学反应机理研究中的应用。
教学方法:1.讲授结合举例:通过分子模型、分子式和结构式的展示,帮助学生理解分子结构的概念和组成。
2.课堂讨论:引导学生思考分子结构与性质之间的关系,鼓励学生提出问题和解决问题。
3.实验探究:通过合成有机化合物、测定它们的物理性质和反应活性,让学生实际操作和观察有机化合物的结构特点。
教学资源:1.教科书和教案资料。
2.分子模型和实验仪器。
3.化学实验教材和化学反应原理。
教学评估:1.学生课堂表现和参与度评估。
2.平时作业和小组讨论的成果评估。
3.实验报告和总结的评估。
教学拓展:1.分子模型的制作和应用。
2.有机化合物的定性和定量分析方法。
3.结构化学在材料科学和药物设计中的应用。
教学延伸:1.学习有机化学反应机理。
2.学习有机合成和药物合成的实践技巧。
3.深入了解有机化合物的合成、性质和应用。
化学键和分子结构教学教案

特点:能更好地 发挥学生的主动 性、积极性,有 利于培养学生独 立思维能力、口 头表达能力,促 进学生灵活地运 用知识。
类型:包括问题 讨论法、案例讨 论法、课堂讨论 法等。
应用场景:适用 于具有争论性、 未知性的内容, 通过讨论的形式 帮助学生理解和 掌握化学键和分 子结构的原理和 概念。
案例分析法
定义:通过分析具体案例来引导学生理解化学键和分子结构的教学方法。 目的:帮助学生深入理解化学键和分子结构的原理和应用。 步骤:选择合适案例、介绍案例背景、分析案例内容、总结归纳。 优势:生动形象、具体化、易于理解、提高学生兴趣。
Part Five
教学步骤
导入新课
回顾旧知识,引出新知识
提出问题和实验,引发学生思考和 探究
化学键的类型和形成方式 分子结构的类型和特点 化学键与分子结构的相互影响 化学键与分子结构在物质性质中的作用
实例分析
实例名称:水分子结构
实例分析:水分子由两个氢原子和一个氧原子通过共价键结合而成,分子结构呈现V 形,具有极性。
实例名称:二氧化碳分子结构
实例分析:二氧化碳分子由两个氧原子和一个碳原子通过共价键结合而成,分子结构 呈现直线形,属于非极性分子。
作业完成情况评估
作业提交率:统计学生提交作业的比例,评估学生的参与度和态度。 作业正确率:分析学生作业的正确率,了解学生对知识点的掌握情况。 作业完成时间:观察学生完成作业所需的时间,评估学生的学习效率和时间管理能力。 作业质量评估:根据作业的完成质量,如书写规范、逻辑清晰等,对学生进行个性化指导。
强调化学键和分子结构在日常生活 和工业生产中的应用
添加标题
添加标题
添加标题
添加标题
总结不同类型化学键的特点和形成 条件
初中化学教案原子结构与化学键

初中化学教案原子结构与化学键尊敬的老师,以下是根据您的要求,以初中化学教案的格式所编写的关于原子结构与化学键的内容:一、教学目标通过本堂课的学习,学生将能够:1. 掌握原子结构的基本概念,包括原子的组成和基本粒子的特征。
2. 理解化学键的概念及种类,并能够描述它们的特点和应用。
3. 能够运用所学的知识解决相关的实际问题,提高实际应用能力。
二、教学重点1. 原子结构的组成和基本粒子的特征。
2. 化学键的概念、种类、特点和应用。
三、教学准备1. 课件及多媒体设备。
2. 实验所需的实验器材和材料。
四、教学过程1. 导入(5分钟)通过展示一张元素周期表的图片,引起学生对原子结构和化学键的兴趣,并向学生提问:“你们知道原子是由什么组成的吗?化学键是用来连接哪些粒子的?”激发学生思考。
2. 知识讲解(15分钟)(1)原子结构a. 什么是原子?b. 原子的组成:质子、中子和电子。
c. 质子的电荷、质量和位置。
d. 中子的电荷、质量和位置。
e. 电子的电荷、质量和位置。
(2)化学键a. 化学键的定义和作用。
b. 离子键的形成和特点。
c. 共价键的形成和特点。
d. 金属键的形成和特点。
e. 弱化学键的形成和特点。
3. 实验探究(20分钟)将学生分为小组,每个小组利用实验器材和材料进行实际操作,观察和记录不同种类化学键的形成和特点。
学生通过实验的探究,能够更好地理解和巩固所学的知识。
4. 深化讲解(15分钟)根据实验结果,进一步分析和解释不同化学键的形成原理和特点。
引导学生思考:离子键为何在溶液中能够电离?共价键为何在水中能够断裂?这样能够提高学生的分析问题和解决问题的能力。
5. 巩固练习(15分钟)提供一些有关原子结构和化学键的练习题,让学生在课堂上完成,然后进行讲解和讨论。
教师可根据学生的掌握情况进行针对性的辅导。
6. 拓展应用(10分钟)通过相关实例和应用,让学生了解化学键在日常生活和工业生产中的应用,培养学生的实际运用能力和创新思维。
化学教案认识化学键与分子结构

化学教案认识化学键与分子结构一、教学目标1.了解化学键的概念及其作用;2.认识常见的化学键类型:离子键、共价键和金属键;3.理解分子结构的概念,并能够通过分子式表示分子的组成。
二、教学重难点1.化学键的类型与特点;2.分子结构的概念与分子式的表示。
三、教学准备实验器材:小试管、洗涤皿、滴管等;实验药品:氯化钠、硝酸铜等;教学辅助工具:PPT、白板、彩色笔等。
四、教学过程步骤一:引入化学键的概念(10分钟)1.出示一幅插图,介绍物质的微观结构,引导学生思考物质是由什么构成的。
2.通过声音、形状、颜色等多种方式,让学生分辨不同物质,并引导他们思考为什么物质具有不同的性质。
3.通过学生的思考,引出化学键的概念,说明化学键在物质的性质中的重要作用。
步骤二:认识常见的化学键(20分钟)1.介绍离子键的概念和构成方式,并通过实验演示离子键的形成过程。
2.介绍共价键的概念和构成方式,并通过实验演示共价键的形成过程。
3.介绍金属键的概念和构成方式,并通过实验演示金属键的形成过程。
4.辅以图示,让学生加深对三种化学键的认识,了解它们的特点和应用。
步骤三:认识分子结构(20分钟)1.说明分子是由化学键连接的小颗粒组成的。
引导学生思考分子的结构和组成方式。
2.通过示例介绍分子式的概念和表示方法,让学生能够通过分子式了解分子的组成。
3.运用实例,让学生练习分子式的书写和理解。
步骤四:案例分析与讨论(20分钟)1.给出一些常见物质的分子式,让学生通过分子式了解物质的组成和性质。
2.组织学生小组讨论,通过分子式判断物质的分子结构和化学键类型。
3.引导学生总结化学键与物质性质之间的关系,并让学生发表自己的观点。
五、教学总结与反思1.对本节课的内容进行总结,强调化学键在物质性质中的重要作用,并给予学生反馈。
2.回顾学生的讨论结果,对学生的表现给予肯定和鼓励,并指出需要改进的地方。
3.预告下节课的内容,引起学生的兴趣和思考。
六、板书设计化学键1.离子键2.共价键3.金属键分子结构1.分子是由化学键连接的小颗粒组成的2.分子式的表示方法七、教学反思本节课通过引入化学键的概念,帮助学生认识到化学键在物质性质中的重要作用,对离子键、共价键和金属键进行了详细的介绍和实验演示,并通过实例和讨论让学生了解分子结构的概念和分子式的表示方法。
原子结构与化学键教案

原子结构与化学键一、原子结构1、原子的构成质子(+)原子核中子 原子核外电子(-)2、质量数:质量数=质子数+中子数二、概念1、元素:具有相同核电荷数(即质子数)的同一类原子的总称2、核素:具有一定数目质子和一定数目中子的一种原子3、同位素:质子数相同而中子数不同的同一种元素的不同核素互为同位素4、同素异形体:由同种元素组成的不同种单质互为同素异形体5、同分异构体:分子式相同而结构式不同的两种化合物互为同分异构体6、同系物:结构相似,在分子组成上相差一个或若干个CH 2原子团的物质互为同系物 例1:雷电天闪电时空气中有臭氧(O 3)生成。
下列说法正确的是( B )A 、O 2和O 3互为同位素B 、O 2转化为O 3为化学变化C 、相同物质的量的O 2和O 3的体积相同D 、相同质量的O 2和O 3含有相同的分子数 例2:下列每组物质之间的关系是:①O 2和O 3②3和CH 3CH 2CH 2CH 3③和⑤氕、氘和氚⑥CH 3CH 2CH 2CH(CH 3)CH(CH 3)CH 3和CH 3CH 2CH(CH 3)CH 2CH(CH 3)CH 3 例3:下列说法正确的是( D )A 、所含质子数和电子数相等的离子一定是原子B 、两种离子若果核外电子排布相同,化学性质就一定相同C 、质量数相同的原子其化学性质一定相同D 、具有相同核电荷数的原子或简单的离子,一定是同种元素三、化学键(稀有气体间不含化学键)离子键 1、类型共价键2、离子键(1)、定义:带相反电荷离子之间的作用 (2)、成键微粒:阴、阳离子Cl 3717(3)、成键实质:静电作用(4)、形成条件:活泼金属(第ⅠA、ⅡA族)或铵根与活泼非金属(第ⅥA、ⅦA族)、含氧酸根等之间。
(5)存在:离子化合物(凡是含有离子键的化合物,都是离子化合物)NaCl、NaOH、NH4HCO3等3、共价键(1)、定义:原子间通过共用电子对所形成的作用(2)、成键微粒:原子(3)形成条件:非金属单质、非金属化合物、AlCl3和Al(OH)3等极性共价键:不同种原子间形成的共价键(4)、分类非极性共价键:同类原子间形成的共价键(5)、存在:共价化合物例1:(2012山东,9,4分)下列关于原子结构、元素性质的说法正确的是(B )A、非金属元素组成的化合物中只有共价键B、ⅠA族金属元素是同周期中金属性最强C、同种元素的原子均有相同的质子数和中子数D、ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强例2:下列物质中,既含有极性键又含有非极性键的是A、苯B、CO2C、Na2O2D、NH4Cl四、分子间作用力、氢键1、SiO2、金刚石、石墨等原子晶体见不存在分子间作用力2、熔沸点变化规律:组成和结构的相似的分子晶体,相对分子质量越大,分子间作用力越大,物质的熔沸点越高。
化学中的原子结构与化学键

化学中的原子结构与化学键引言:化学是一门研究物质的组成、性质和变化的科学。
在化学领域中,原子结构和化学键是两个核心概念。
本教案将深入探讨原子结构和化学键的相关知识,帮助学生全面理解和掌握这些重要概念。
一、原子结构的基本概念(2000字)1. 原子的历史发展- 从古代的原子观念到现代原子理论的形成- 原子理论的重要贡献者2. 原子的组成- 质子、中子和电子的特征和性质- 原子核的结构和作用3. 原子的电子排布- 能级和轨道的概念- 电子排布规则和原子壳层结构4. 原子的量子数- 主量子数、角量子数、磁量子数和自旋量子数的意义和取值范围- 量子数在原子结构中的应用二、化学键的类型与性质(2000字)1. 化学键的概念与分类- 共价键、离子键和金属键的特点和区别- 共价键的形成和共用电子对的概念2. 共价键的特性与性质- 共价键的键长、键能和键级的关系- 共价键的极性和电负性的影响3. 离子键的特性与性质- 离子键的形成和离子晶体的特点- 离子键的强度和溶解性的关系4. 金属键的特性与性质- 金属键的形成和金属的导电性和延展性- 金属键的强度和金属的性质的关系三、分子结构与化学反应(2000字)1. 分子的构成和结构- 分子的组成和分子式的表示方法- 分子的空间构型和分子几何结构的关系2. 极性分子与非极性分子- 极性分子和非极性分子的定义和判断方法 - 极性分子和非极性分子的性质和溶解性3. 化学反应与化学键的断裂与形成- 化学反应的基本概念和化学方程式的表示方法- 化学键的断裂和形成在化学反应中的作用4. 化学键的能量与反应热- 化学键能的概念和测定方法- 化学键能与化学反应热的关系和应用结语:通过本教案的学习,学生将全面了解原子结构和化学键的相关知识。
这些基本概念对于理解和解释物质的性质和变化具有重要意义。
同时,学生也将进一步培养科学思维和实验操作能力,为未来的学习和研究打下坚实基础。
原子结构与化学键教学教案

化学键的类型与形成
离子键:阴阳离子之间的静电作用 共价键:原子之间共享电子对 金属键:金属原子之间的自由电子 氢键:氢原子与电负性原子之间的弱作用 形成条件:原子的电子结构、原子半径、电负性等
原子结构与化学键的关系
原子结构:原子由原子核和电子组成,原子核又由质子和中子组成
化学键:原子之间通过化学键结合形成分子,化学键包括离子键、共价键和金属键等
注重培养学生的 科学思维和探究 能力
引导学生积极参 与课堂讨论和合 作学习,提高学 习效果
不足之处
教学过程中可能 过于注重理论知 识的讲解,而忽 略了实验操作的 重要性。
学生参与度不高, 可能因为教学内 容过于枯燥或者 教学方式不够生 动有趣。
教学评价方式过 于单一,主要以 考试成绩作为评 价标准,忽略了 学生其他方面的 表现。
原子结构与化学键教学教 案
汇报人:XX
目录
01 单 击 添 加 目 录 项 标 题 02 教 学 目 标 03 教 学 内 容 04 教 学 方 法 与 手 段 05 教 学 过 程 06 教 学 评 价 与 反 馈
01
添加章节标题
02
教学目标
知识目标
理解原子结构的 基本概念,包括 原子核、电子和 原子半径等
教学资源不足, 如实验器材、教 学软件等,影响 了教学效果。
改进方向
增加互动环节,提高学生 参与度
采用更多实例,帮助学生 理解抽象概念
加强实验教学,提高学生 动手能力
及时反馈,帮助学生纠正 错误观念
THANK YOU
汇报人:XX
鼓励学生查阅相关资料,了解更多关于原子结构与化学键的知识,拓宽视野,提高学习兴趣。
归纳小结
回顾本节课的主要 内容,包括原子结 构、化学键的概念 和类型
化学键与分子构型教案

化学键与分子构型教案一、引言化学键与分子构型是化学中重要的概念,对于理解化学反应和物质性质具有重要意义。
本篇教案将从简单介绍化学键的概念出发,引导学生了解不同类型的化学键以及它们对分子构型的影响。
同时,本教案也将通过示例和实验引导学生掌握相关知识,培养学生的实验操作能力和观察分析能力。
二、化学键的概念化学键是指由原子之间相互作用形成的力,将原子紧密连接在一起,形成分子或晶体。
根据化学键的形成方式,可以分为离子键、共价键和金属键。
离子键是由正负电荷之间的静电作用形成的,通常发生在金属和非金属元素之间。
共价键是由原子间共用电子形成的,常见于非金属元素之间或非金属与氢原子之间。
金属键是金属中的自由电子形成的,使金属原子形成紧密的排列。
三、离子键及其分子构型离子键是由正负电荷之间的静电作用形成的。
正离子中带正电荷的离子通过释放电子,将电子转移给带负电荷的离子,形成化合物。
离子键通常造成离子化合物的高熔点和良好的导电性。
离子键的分子构型由阳离子和阴离子组成的晶体结构。
例如,氯化钠晶体的分子构型由正离子钠和负离子氯按比例组成。
四、共价键及其分子构型共价键是由原子间共用电子形成的。
共价键通常发生在非金属之间或非金属与氢原子之间。
共价键的强度较离子键弱,通常具有较低的熔点和导电性。
共价键的分子构型受到键的类型和原子间的空间排列影响。
例如,氧气分子的共价键由两个氧原子共用两对电子形成,呈双键结构,使氧气分子呈线性构型。
五、键的极性与分子极性键的极性是指在共享电子过程中电子密度分布不均,使得原子间形成部分正电荷和部分负电荷。
极性共价键通常形成极性分子。
极性分子中正负电荷的分布不对称,呈现出极性性质。
例如,水分子由两个氢原子与一个氧原子通过极性共价键形成。
由于氧原子的电负性较高,使得氧原子带负电荷,氢原子带正电荷,使水分子呈现出极性。
六、实验探究为了帮助学生更好地理解化学键与分子构型的概念,可以设计以下实验:实验一:离子键的实验观察材料:氯化钠晶体、酒精灯、夹子、烧杯步骤:1. 将夹子夹住氯化钠晶体,高温加热。
初中化学教案:化学键和分子结构的认识

初中化学教案:化学键和分子结构的认识一、化学键的基本概念与分类化学键是指原子之间产生的电子云重叠和共用,形成的一种物质内部结构。
在化学反应中起着极为重要的作用。
它们可以细分为离子键、共价键和金属键三种类型。
1. 离子键离子键是由正负电荷吸引力所形成的化学键。
在离子晶体中,阳离子和阴离子通过离子键结合在一起,形成稳定的晶格结构。
例如,氯化钠(NaCl)就是由钠离子(Na+)和氯离子(Cl-)组成的。
钠离子失去了一个电子而变成了阳离子,氯原子接收到这个电子并变成了阴离子。
这样的正负电荷吸引力就形成了稳定的结合。
2. 共价键共价键是两个非金属原子分享一个或多个电子对而形成的化学键。
它们通常存在于分散分户状态下,也会直接连接在一起来构建不同类型的分ưởn料。
以氢气(H2)和氧气(O2) 分체位例, 两个相同元素同情之间连接几圆抵抗间的电子对。
其原子可以在核外轨道形成一个共用的电子云,这就导致了能量降低以及结构稳定。
3. 金属键金属键是由金属原子形成的一种特殊化学键。
金属原子之间通过可移动的电子云相互吸引,并形成有序排列的晶格结构。
这种密集堆积关系使得金属具有良好的热传导性和电传导性。
二、分子结构的认识与描述1. 分子概念分子是指由两个或多个原子通过化学键连接在一起而形成的物质基本单位。
不同元素之间或者同一个元素之间都可以形成分子。
例如,氧气(O2)是由两个氧原子组成的分ưởn体,硫酸(H2SO4)则是由两个氢原四个物质离与一个硫酰团。
ỗีี?2. 分子式和结构式为了方便记录与描述化学物质中分子的组织方式,人们发明了分ồ。
化学物质的分子结构教案

化学物质的分子结构教案一、教学目标1. 了解和理解化学物质的分子结构是由原子组成的。
2. 掌握常见元素的原子结构和化学键的形成。
3. 学会通过分子式和化学结构式来表示化学物质的分子结构。
4. 能够分析和预测物质的性质和反应。
二、教学重点1. 原子结构与分子结构的关系。
2. 常见元素的原子结构和化学键的形成。
3. 分子式和化学结构式的表示方法。
三、教学内容1. 原子结构与分子结构的关系原子是物质的基本单位,由带正电荷的质子、不带电的中性子和带负电荷的电子组成。
而分子是由两个或多个原子通过化学键结合而成的,分子结构决定了物质的性质和反应。
2. 常见元素的原子结构和化学键的形成2.1 氢(H)氢原子的原子核只有一个质子,电子只有一个,位于原子核外部的1s轨道中。
氢分子(H2)通过共用电子形成单一共价键。
2.2 氧(O)氧原子的原子核含8个质子,电子分布在1s、2s和2p轨道中。
氧分子(O2)通过共用两对电子形成双重共价键。
2.3 氮(N)氮原子的原子核含7个质子,电子分布在1s、2s和2p轨道中。
氮分子(N2)通过共用三对电子形成三重共价键。
2.4 碳(C)碳原子的原子核含6个质子,电子分布在1s、2s和2p轨道中。
碳能形成多种键型,如单重、双重和三重共价键,可以构成多种不同的有机化合物。
3. 分子式和化学结构式的表示方法3.1 分子式分子式用来表示一种物质中原子的种类和数量。
例如,水分子的分子式为H2O,表示每个水分子由两个氢原子和一个氧原子组成。
3.2 化学结构式化学结构式用来表示化合物分子中原子之间的连接方式和空间排布。
根据需要可以使用线条结构式、平面式和空间式等来表示不同的结构。
例如,甲烷的分子式为CH4,结构式为:H|H--C--H|H四、教学方法1. 理论授课与实验结合的教学方法,通过实验展示分子结构的形成和性质变化。
2. 利用模型和幻灯片等辅助教具,直观呈现分子结构的三维空间排布。
3. 引导学生进行小组讨论和思考,激发学生对分子结构的兴趣。
《化学教案:化学键与分子结构》

《化学教案:化学键与分子结构》一、化学键的定义和分类化学键是指原子间因电子转移或共用而形成的化学键合力。
它是构成化学物质的基本组成单位之一。
化学键的形成与破裂直接影响物质的性质、结构和反应。
1.1 电子转移和离子键电子转移是指原子失去或获得电子从而形成带电粒子(离子)的过程。
当一个原子失去一个或多个电子,它变成正离子;当一个原子获得一个或多个电子,它变成负离子。
正离子和负离子之间的引力称为离子键。
离子键通常形成在具有较大电负性差异的元素之间,例如金属与非金属的反应。
1.2 共用键共用键是指原子间共享电子对的键合方式。
它通常发生在两个非金属原子之间或包含非金属原子的化合物内。
共用键的强度与两个原子能够提供的电子数有关,通常是通过共享一个或多个电子对来达到电子构型的稳定,从而形成共用键。
共用键的形成可以是单键、双键或三键。
1.3 极性键和非极性键极性键是指共用键中原子对电子云的偏离程度。
当两个原子的电负性差异较大时,共用电子对会偏向电负性较大的原子,从而形成极性键。
当两个原子的电负性差异较小时,共用电子对会均匀分布在两个原子之间,形成非极性键。
二、分子结构和性质的关系分子结构对物质的性质和反应具有重要影响。
分子结构可以通过分子式和分子模型来描述。
2.1 分子式分子式使用元素符号和下标来表示复合物质中各种原子的类型和相对数量。
例如,水分子的分子式为H2O,表示一个氧原子和两个氢原子共同组成的水分子。
2.2 分子模型分子模型是一种用来描述分子结构的图示。
“球棒模型”使用球表示原子,棍状表示化学键;“空间充填模型”则根据原子之间的空间关系来表示分子结构。
分子模型帮助我们直观地了解分子中原子的排列方式以及化学键的性质。
2.3 分子结构和性质的关系分子结构直接决定了物质的性质和反应。
例如,同分子式的化合物可以具有不同的物理和化学性质,这是由于它们的分子结构不同导致的。
分子结构决定了化学键的类型和性质,进而影响分子的稳定性、溶解性、熔点和沸点等性质。
分子结构教案

分子结构教案引言:在化学学科中,分子结构是一个非常重要的概念,它涉及到化学物质的组成和性质。
本篇教案将介绍分子结构的概念、构成要素以及如何表示和理解分子结构。
一、概念和基本知识1. 分子结构:分子由原子通过共价键连接而成,分子结构是指描述分子中原子之间连接关系和排列方式的方式。
分子结构决定了分子的性质。
2. 价电子和共价键:原子中的价层电子参与形成共价键。
共价键是由两个原子之间的电子共享而形成的。
通过共享电子可以使原子达到稳定的电子配置。
3. 分子式和结构式:分子式用来表示分子中各类原子的种类和数目,例如H2O表示水分子。
结构式则用来表示分子中原子之间的连接方式和排列方式。
二、分子结构表示方法1. 分子式:分子式用来表示分子中各类原子的种类和数目。
例如,CO2表示二氧化碳分子中有一个碳原子和两个氧原子。
2. 结构式:结构式用来表示分子中原子之间的连接方式和排列方式。
根据需要的详细程度,结构式可以有不同的表示方式,例如电子均式、键线式等。
三、残基和官能团1. 残基:分子中除去其中一个或多个原子后剩余的部分称为残基。
残基可以是非金属原子或者功能团。
2. 官能团:官能团是分子中起决定化合物性质的作用的基团。
它可以是一个原子或者一组原子。
常见的官能团包括羟基(OH)、氨基(NH2)等。
四、分子形状1. 构成原子间键长和键角:分子形状由构成原子间键的长度和键角决定。
2. 分子形状的类型:常见的分子形状有线形、三角形、四面体等。
不同形状的分子具有不同的化学性质。
五、分子结构和化学性质1. 分子结构和化学键:分子结构直接影响分子中化学键的强度和类型,从而决定分子的化学性质。
2. 分子极性:分子极性与分子的电子云分布有关,决定了分子之间相互作用的强度。
3. 功能团对化合物性质的影响:不同的功能团在分子中具有不同的化学性质,如羟基使分子具有亲水性。
六、实践活动1. 分子模型的制作:学生可以通过使用模型球等材料来制作分子模型,以帮助他们更好地理解和展示分子结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子结构、化学键、分子结构习题1.判断下列叙述是否正确(1)电子具有波粒二象性,故每个电子都既是粒子又是波。
(2)电子的波动性是大量电子运动表现出的统计性规律的结果。
(3)波函数ψ,即电子波的振幅。
(4)波函数Ψ,即原子轨道,是描述电子空间运动状态的数学函数式。
(1)⨯(2)√(3)⨯(4)√2. 用原子轨道光谱学符号表示下列各套量子数:(1) n =2, l = 1, m = –1 (2) n =4, l = 0, m =0 (3) n =5, l = 2, m =02 (1)2p (2) 4s (3) 5d3. 假定有下列电子的各套量子数,指出哪几套不可能存在,并说明原因。
(1) 3,2,2,1/2 (2) 3,0,–1,1/2 (3) 2, 2, 2, 2(4) 1, 0, 0, 0, (5) 2,–1,0, –2/1 (6) 2,0,–2,1/23. (1)存在,为3d 的一条轨道;(2) 当l=0时,m只能为0,或当m=±1时,l可以为2或1。
(3) 当l=2时,n应为≥3正整数,m s=+1/2或-1/2;或n=2时l=0 m=0 m s=+1/2或-1/2;l=1 m=0或±1,m s=+1/2或-1/2;(4)m s=1/2或–1/2 ;(5)l不可能有负值;(6)当l=0时,m只能为04.指出下列各电子结构中,哪一种表示基态原子,哪一种表示激发态原子,哪一种表示是错误的?(1)1s22s2(2) 1s22s12d1(3) 1s22s12p2(4) 1s22s22p13s1(5) 1s22s42p2(6) 1s22s22p63s23p63d15.符合下列每一种情况的各是哪一族哪一元素?(1)最外层有6个p电子。
(2)3d轨道无电子,n =4,l = 0的轨道只有1个电子。
(3)3d轨道全充满,4 s轨道只有1个电子。
(4)+3价电子的电子构型与氩原子实[Ar]相同。
(5)在前六周期元素(稀有气体元素除外)中,原子半径最大。
(6)在各周期中,第一电离能I1最高的一类元素。
(7)电负性相差最大的两个元素。
(8)+1价离子最外层有18个电子。
5. (1)ⅧA (2)K (3)Cu铜(4)Sc钪(5)Cs (6)ⅧA(7)F (Ne)~ Cs (Fr) (8)ⅠB6.填空(1)n =3电子层内可能有的原子轨道数是______;(2)n =4电子层内可能有的运动状态数______;(3)n =6电子层内可能有的能级数是_______;(4)l = 3能级的简并轨道数是_____。
6. (1) 9 (2) 32 (3) 6 (4) 77. 指出下列能级对应的n和l值,每一能级包含的轨道数是多少?(1)2 p (2) 4f (3) 6s (4) 5d7. (1) n=2,l=1;3 (2) n=4,l=3,7(3) n=6;l=0 ;1 (4) n=5,l=2,58. 写出下列各种情况的合理量子数:(1) n = ( ) , l = 2 , m=0 , m s= +1/2(2) n = 3 , l = ( ) , m=1, m s= –1/2(3) n = 4 , l = 3 , m=1 , m s= ( )(4) n = 2 , l = 0, m= ( ) , m s= +1/2(5) n = 1 , l = ( ) , m= ( ) , m s= ( )8. (1) n≥3 (2) l=2,1 (3) +1/2(-1/2)(4) m=0 (5) l=0,m=0,m s=+1/2(-1/2)9. 第五能级组包含哪几个能级?有几条原子轨道?该能级组是第几周期?可含有多少个元素?9. 5s、4d、5p三个能级;9条轨道;第五周期;18个元素10. 用s,p,d,f等符号表示下列元素原子的电子结构,并说明他们在周期表中的周期、族、区。
(1)13Al (2)24Cr (3)26Fe (4)33As (5)47Ag (6) 82Pb10. 13Al 1s22s22p63s23p1 [Ne]3s23p1第三周期ⅢA p区24Cr 1s22s22p63s23p63d54s1 [Ar]3d54s1第四周期ⅥB d区26Fe 1s22s22p63s23p63d64s2 [Ar]3d64s2第四周期Ⅷd区33As 1s22s22p63s23p63d104s24p3 [Ar]3d104s24p3第四周期ⅤA p区47Ag 1s22s22p63s23p63d104s24p64d105s1[Kr] 4d105s1 第五周期ⅠB ds区82P b 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2[Xe] 4f145d106s26p2第六周期ⅣA p区11.已知四种元素的原子的价电子层结构分别为:(1)4 s1(2)3s23 p5(3)3d24s2(4)5d106s2试指出:(1)它们在周期系中各处于哪一区?哪一周期?哪一族?(2)它们的最高正氧化态各是多少?11. (1) 第四周期,s区,ⅠA,+1 ;(2)第三周期,p区,ⅦA,+7;(3)第四周期,d区,ⅣB,+4 ;(4)第六周期,ds区,ⅡB,+212.第五周期某元素,其原子失去2个电子,在l= 2的轨道内电子全充满,是推断该元素的原子序数、电子结构,并指出位于周期表中那一族?是什么元素?12. Cd:[Kr]4d105s248号元素ⅡB13..已知甲元素是第三周期p区元素其最低氧化数为–1,乙元素是第四周期d区元素,其最高氧化数为+4,是填下表:13 甲:1s22s22p63s23p5ⅦA 非金属高乙:[Ar]3d24s2ⅣB 金属低14. 元素钛的电子构型是[Ar]3d24s2,试问这22个电子(1) 属于哪几个电子层?哪几个亚层?(2) 填充了哪几个能级组的多少个能级?(3) 占据着多少条原子轨道?(4) 其中单电子轨道有几条?(5) 价电子有几个?14. (1)4个电子层,7个亚层(2)4个能级组,7个能级(3)12条原子轨道(4)2条原子轨道(5)4个价电子15. 具有下列原子外层电子构型的五种元素(1) 2s2 (2) 2s22p1 (3) 2s22p2 (4) 2s22p3 (5) 2s22p4以元素符号表示第一电离能最大的是______,最小的是______,电子亲和能大小发生反常的两个元素是___________。
15. 2s22p3(N);2s22p1(B);2s22p2(C)~2s22p3(N)16. 根据下列条件确定元素在周期表中的位置,并指出元素原子序数、元素名称及符号。
(1)基态原子中有3d7电子;(2)基态原子电子构型为[Ar]3d104s1;(3)M2+型阳离子的3d能级为半充满;(4)M3+型阳离子和F–离子的电子构型相同;(5)[Xe]4f145d106s1;(6)[Ar]3d64s2;(7)[Kr]4d105s25p5。
16. (1)Co (钴) 27号,第四周期,Ⅷ, d 区(2)Cu(铜) 29号,第四周期,ⅠB,ds区(3)Mn(锰) 25号,第四周期,ⅦB,d区(4)Al(铝) 13号,第三周期,ⅢA,p区(5)Au(金) 79号,第六周期,ⅠB,ds区(6)Fe(铁) 26号,第四周期,Ⅷ,d区(7)I (碘) 53号,第五周期,ⅦA,p区17. 判断下列叙述是否正确(1)基态原子外层未成对电子数等于该原子能形成的共价单键数,此即所谓的饱和性。
(2)两原子以共价键键合时,化学键为σ键;以共价多重键结合时,化学键均为π键。
(3)碳-碳双键的键能大于碳-碳单键键能,小于2倍的碳-碳单键键能。
(4)所谓sp3杂化,是指1个s电子与3个p电子的混杂。
(5)色散力不仅存在于非极性分子间。
17. (1)×(2)×(3)√ (4)×(5)√18. 写出下列离子的电子结构式,并指出各属于何种离子构型。
Fe2+, Sn4+, Pb2+, S2–, Cd2+,Al3+, Ni2+, Mg2+18. Fe2+1s22s22p63s23p63d69~17电子构型Sn4+1s22s22p63s23p63d104s24p64d1018电子构型Pb2+[Xe] 4f145d106s2 18+2电子构型S2-1s22s22p63s23p68电子构型Cd2+1s22s22p63s23p63d104s24p64d1018电子构型Al3+1s22s22p6 8电子构型Ni2+ 1s22s22p63s23p63d89~17电子构型Mg2+1s22s22p6 8电子构型19.判断下列分子中心原子的杂化轨道类型(注明等性或不等性)和分子的空间构型,说明分子是否有极性。
OF2, NF3, BH3, SiCl4, NH3, NH4+, HCN, PCl3, CS2, CHCl319. OF2不等性sp3杂化V字型极性分子NF3不等性sp3杂化三角锥型极性分子BH3sp2等性杂化平面三角形非极性分子SiCl4sp3等性杂化正四面体非极性分子NH3不等性sp3杂化三角锥型极性分子NH4+sp3等性杂化正四面体非极性分子HCN sp杂化直线型极性分子PCl3不等性sp3杂化三角锥型极性分子CS2sp杂化直线型非极性分子CHCl3sp3等性杂化四面体极性分子20.下列各组有机分子中,每个碳原子所采用的杂化轨道:C2H2, C2H6, CH3-C≡CH, CH3CH2OH, CH2O。
20. (1)C2H2: sp杂化: (2)C2H6: sp3杂化(3)CH3-C≡CH : 第一个C:sp3 , 第二个C:sp 第三个C:sp1 2 3(4)CH3CH2OH : 两个碳均为sp3杂化1 2(5)CH2O : sp2杂化21. 指出化合物中,哪个化合物的键的极性最大?哪个最小?(1)NaCl, MgCl2, AlCl3, SiCl4, PCl5(2)LiF, NaF, F, RbF, CsF(3)HF, HCl, HBr, HI21. (1)极性最大NaCl 极性最小PCl5(2)极性最大CsF 极性最小LiF(3)极性最大HF 极性最小HI22. 预测下列各组物质熔点、沸点的高低:(1)乙醇和二甲醚(2)HF和HCl (3) NH3和NF3(4)OF2和H2O(5) NaF和MgO (6)CaO和BaO (7) NaCl和NaBr (8) MgO和MgF222. (1)乙醇>二甲醚(2)HF > HCl (3)NH3 > NF3(4)OF2 < H2O (5)MgO> NaF (6)CaO > BaO(7)NaCl > NaBr (8)MgO > MgF223.. 指出下列分子间存在哪种作用力(包括氢键)?(1)H2—H2(2)HBr—H2O (3)I2—CCl4(4)CH3COOH—CH3COOH(5)NH3—H2O(6)C3H8—CCl4(7)C2H5OH—H2O (8)CO2—H2O(9)HNO3—HNO3(10)H3BO3—H3BO323. (1)色散力(2)色散力、诱导力、取向力(3)色散力(4)色散力、诱导力、取向力、氢键(5)色散力、诱导力、取向力、氢键(6)色散力(7)同(5)、(4)(8)色散力、诱导力(9)同(2)(10)色散力、氢键24. 判断下列晶体的熔点高低顺序(1)NaCl KCl N2NH3Si PH3(2)CaF2BaCl2CaCl2(3)SiCl4SiBr4SiC MgO (4)KCl SiO2H2O24. (1)Si > NaCl > KCl > NH3 > PH3 > N2(2)CaF2 > CaCl2 > BaCl2(3)SiC > MgO > SiBr4 > SiCl425. 选择题(1)下列晶体中熔化时只需克服色散力的是_ a _、f___。
