2015高考化学第一轮复习课件:铝及其化合物
高三一轮复习:《铝及其化合物》课件

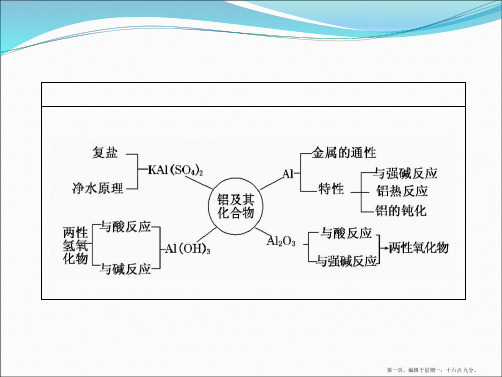
冰晶石(Na3AlF6)降低其熔点。
得12e-
2Al2O3
电解 熔融
4Al+3O2↑
失12e-
(2)氢氧化铝[Al(OH)3]:
(1)物理性质: 氢氧化铝是白色胶状物质,不溶于水, 有强的吸附性,可以吸附水中的悬浮物和 各种色素。 (2)化学性质: 不稳定性:氢氧化铝不稳定,受热易分解。 △ 2Al(OH)3 = Al2O3+2H2O 这是工业上制取纯净氧化铝的方法。
将(1)+(2)×2:
2Al+6H2O +2NaOH
失 2× 3 e-
2NaAlO2+4H2O +3H2↑
2Al+6H2O+2NaOH = 2NaAlO2+3H2↑+4H2O 得 6× e-
(4)与盐溶液的反应
2Al+3CuSO4 =3Cu+Al2(SO4)3
(5)与某些氧化物(Fe2O3 、 Cr2O3 、 MnO2 、 V2O5 等)反应 —铝热反应
考纲展示: 1.了解铝的主要性质及应用。 2.了解铝的重要化合物的主要性质 及应用。
一、铝的性质
铝原子的结构:
第三周期ⅢA族 铝原子核外有三个电子,在化学反应中,容易失去最 外层的三个电子,显+3价
1、铝的物理性质: 银白色金属,硬度和密度小,具有良好的导 电导热性和延展性。在空气中具有很好的耐 腐蚀性。
[现象]:
发出耀眼的光芒、放出大量的 热、有熔融物生成。
[化学方程式]:
2Al + Fe2O3 == 2Fe + Al2O3
铝热剂
铝粉和氧化铁反应装置图
高温
铝热反应的用途: 焊接铁轨、冶炼金属
(新课标)2015届高考化学大一轮复习讲义 第三章 排查落实练五 钠、铝及其化合物课件

3.不用试剂,怎样鉴别 Na2CO3 溶液和稀盐酸?
答案 取一种溶液少量于试管中,滴加另一种溶 液,若开始无气泡产生,滴加一段时间后有气泡, 则试管中溶液为 Na2CO3;若立即有气泡产生,则 试管中溶液为稀盐酸。 (注:类似的还有①AlCl3 和 NaOH、②NaAlO2 和稀 HCl)
4.试用一种试剂鉴别 NaCl、AlCl3、MgCl2 三种溶液, 简述操作步骤。
4.将水滴入用脱脂棉包住的 Na2O2 中,有什么现象?
答案 脱脂棉剧烈燃烧。
5. 向 AlCl3 溶液中逐滴加入 NaOH 溶液, 有什么现象?
答案 有白色沉淀生成,当 NaOH 液混合
答案 立即有白色沉淀生成,且有大量气泡冒出。
⑩向 AlCl3 溶液中加入过量 NaOH 溶液
Al3++4OH-===AlO- 2 +2H2O
⑪向 AlCl3 溶液中加入过量氨水
Al +3NH3· H2O===Al(OH)3↓+3NH4
⑫将 AlCl3 溶液与 NaHCO3 溶液混合
3+
+
Al3++3HCO- 3 ===Al(OH)3↓+3CO2↑
⑤向 NaOH 溶液中通入过量 CO2
OH +CO2===HCO3
- -
⑥将 Na2CO3 溶液与石灰乳混合 - - CO2 + Ca(OH) ===CaCO ↓+ 2OH 3 2 3 ⑦向 Na2CO3 稀溶液中通入过量 CO2 - - CO2 + CO + H O===2HCO 3 2 2 3 ⑧向饱和 Na2CO3 溶液中通入过量 CO2 气体 - 2Na++CO2 3 +CO2+H2O===2NaHCO3↓ ⑨将 NaHCO3 溶液和 NaOH 溶液等物质的量混合 - - 2- HCO3 +OH ===CO3 +H2O
(新课标)2015届高考化学大一轮复习讲义 第三章 第2讲 铝及其重要化合物课件

答案 不恰当。金属性是指元素的原子失电子的能力, 非金属性是指元素的原子得电子的能力。铝不论是与 酸反应还是与碱反应,都是失去 3e-,化合价升高为 +3 价,均是还原剂,因而铝具有较强的金属性。
知识梳理
(3)铝与酸、碱反应的实质是什么?氧化剂是什么?
- 失 3e 3+ 答案 铝与酸、碱反应的实质都是:Al ——→Al , - + 得2e 2H ——→H ,只不过碱中的 H+来源于水的电离。氧
递进题组
题组一
1
2
3
题组二
解析
4
5
2.镁、铝都是较活泼的金属,下列 描述中正确的是
( C ) A.铝的导电性比铜、银更强, 铝的导电性比铜、银的弱,A 错; 所以常用以制造电线、电缆 镁能跟酸反应,不能跟碱反应, B.镁、铝都能跟稀盐酸、稀硫 酸、强碱反应 C.镁在点燃条件下可以与二氧 化碳反应,铝在一定条件下 可以与氧化铁发生氧化还原 反应 D.铝热剂是镁条、铝粉和氧化 铁的混合物
0
2
化剂分别为酸和水。 (4)镁在空气中充分燃烧,所得固体产物可能有哪些:
MgO、Mg3N2、C 用化学式表示)。 ___________________(
递进题组
题组一
1
2
3
题组二
4
5
递进题组
题组一
题组一
1
2
3
题组二
解析
4
5
对比掌握铝、镁的性质
1. 镁、 铝单质的化学性质以相似为 主,但也存在某些重大差异性, 下列物质能用于证明二者存在 较大差异性的是 ①CO2 液 A.①④ C.①③ ②盐酸 ④水 B.②③ D.②③④ ( ) ③NaOH 溶
知识梳理
铝及其化合物一轮复习——课件

Al2O3 过量NaOH溶液 Fe2O3 过滤 SiO2
2016/10/12
AlO2- 过量HCl溶液 SiO2过滤 Fe2O3
等杂质
H2SiO3 Al
3+ 足量NH3 H2O
滤液Ⅱ
过滤
Al(OH)3
Al2O3
电解
Al
活动三
实验研究科学分析
【实验目的】:研究pH变化对Al3+—Al(OH)3—AlO2存在形式的影响; 【实验操作】:向装有0.1mol/L Al2(SO4)3 溶液50ml 的烧杯中逐滴加入1mol/L的NaOH溶液,记录滴加的 NaOH溶液体积和每次滴加后混合溶液的pH;
3、思考:不同金属离子之间通过调节pH法分离应具备
的条件?
2016/10/12
课堂小结
谈谈收获
OHH+
Al3+
PH值:4
Al(OH)3
OHH+
AlO211.3(完全)
4.3(开始)5.4(完全) 10(开始)
XX分校2016/10/1 Nhomakorabea 写。V(NaOH)/ml
意义,分析滴定曲线变化趋势的原因,并完成表格填 : pH变化对Al3+—Al(OH)3—AlO2- 存在形式的影响。
活动四
拓展延伸优化流程
1、完成练习(见学案);
2、根据资料卡片提供的数据,用调节pH法优化铝土矿
“酸溶法” 流程(直接在“酸溶法”流程图中更改);
等杂质
3+
2
过滤
Fe(OH)3 AlO23
过滤 滤液 灼烧
Al2O3 过量HCl溶液 1 Fe2O3 过滤 SiO2
高三化学一轮复习 第四章 第2节 铝及其化合物精品课件 鲁科版必修1

• 同温同压下,在体积和浓度均为100 mL 2 mol·L-1的盐酸及NaOH溶液中各加入等质 量的Al,产生气体的体积之比为5∶6,则 所加Al的质量为________。 • (4)以AlCl3溶液为原料制取无水AlCl3,先制 得AlCl3·6H2O晶体,主要操作包括① ________,②冷却结晶,③过滤。在第① 步操作中应注意的事项是: _____________________________________ ___________________________________。
答案
(1)K[Al(OH)4]
Al2O3
AlCl3
Na[Al(OH)4]
(2)[Al(OH)4]-+CO2===2Al(OH)3+HCO- 3 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
• 2.有镁、铝混合粉末10.2 g,将它溶于500 mL 4 mol·L-1的盐酸中,若要使沉淀质量 达到最大值,则需加入2 mol·L-1的氢氧化 钠溶液的体积为 • A.1 000 mL B.500 mL • C.100 mL D.1 500 mL
2Al(OH)3+3H2↑
• 2.铝的重要化合物 • (1)氧化铝(Al2O3) 白色难熔固体 不 • ①物理性质: 、 溶 于水。 • ②化学性质:Al2O3是典型的两性氧化物, 2Al3++3H2O 既能与酸反应又能与强碱溶液反应。 - 2[Al(OH) ] 4 • 与强酸:Al2O3+6H+=== 。 • 与强碱:Al2O3+2OH-+3H2O=== 。 • ③用途:耐火材料、制取铝的原料。
+ - 、Fe3+、HCO- 、 HSO 3 3 等。
例 如: [Al(OH)4] - + NH + 4 ===Al(OH)3↓+ NH3↑ + H2 O 3[Al(OH)4] +Fe3 ===3Al(OH)3↓+Fe(OH)3↓
高考化学一轮复习 第3章 金属及其化合物 第2讲 镁、铝及其化合物课件.ppt

Ca2++SO24-===CaSO4↓,即产品 1 为 CaSO4。由表中数据,可
知 1 L 浓海水中含有 28.8 g Mg2+,则最多可得到产品 2 的
质
量
为
:
m[Mg(OH)2]
=
28.8 24
g·L-1×1 g·mol-1
L ×58
g · mol - 1 =
69.6 g。
(3)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反 应的化学方程式为:MgCl2(熔融)=电==解==Mg+Cl2↑,熔融 MgCl2 中若有少量的水存在,则会发生 Mg+2H2O=高==温==
1.(高考经典题)某同学通过系列实验探讨Mg及其化 合物的性质,操作正确且能达到目的的是( )
A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探 讨Mg的活泼性
B . 将 NaOH 溶 液 缓 慢 滴 入 MgSO4 溶 液 中 , 观 察 Mg(OH)2沉淀的生成
14
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗 中过滤,洗涤并收集沉淀 D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐 酸,加热蒸干得无水MgCl2固体
21
解析:(1)根据Cl、H、O三种元素守恒可知,在空气 中加热MgCl2·6H2O,除生成Mg(OH)Cl或MgO外, 还有HCl和H2O生成。
(2)为防止引入新杂质,可用MgCl2溶液或Mg(NO3)2 溶液将Ca(OH)2转化为Mg(OH)2,然后过滤、洗涤。
15
解析:本题考查镁及其化合物的性质、常见的基本 实验操作。稀释浓硫酸时,应将浓硫酸沿着器壁或 玻璃棒慢慢加入水中,并及时搅拌,A是错误的; 过滤时需要用玻璃棒引流,因此C不正确;蒸发溶 液时应该用蒸发皿而不是表面皿,由于MgCl2会发 生水解,所以加热时必需在HCl的气氛中加热才能 得到MgCl2固体,所以D不正确。 答案:B
高考化学第一轮复习课件铝及其化合物
全局性掌控
本节的重点知识有:铝、氧化铝、氢氧化铝、明矾
的性质及用途.主要考查Al的性质,Al2O3、Al(OH)3的
两性及Al3+、AlO
2
、Al(OH)3之间的转化.预测2012
年高考仍会突出在铝与碱的反应,Al2O3、Al(OH)3的两
性等基础知识上,还可能涉及铝的重要化合物的用途,
第六页,编辑于星期一:十六点 九分。
1.如何除去铁粉中的铝粉? 提示:加入过量NaOH溶液,然后过滤、洗涤、干燥
.
第七页,编辑于星期一:十六点 九分。
二、铝的重要化合物
1.氧化铝 (1)化学性质(用离子方程式表示)
(2)用途 熔点很高,是一种较好的 耐火材料 ,还可制作各种宝石.
第八页,编辑于星期一:十六点 九分。
第五页,编辑于星期一:十六点 九分。
化学性质
与Cl2、S的 反应
化学方程式 2Al+3Cl2= =△= = = 2AlCl3
2Al+3S= =△= = = Al2S3
与盐酸的 反应
与NaOH溶 液的反应
2Al+6HCl === 2AlCl3+3H2↑ 2Al+2NaOH+2H2O === 2NaAlO2+3H2 ↑
金属与酸或碱反应的实质是金属失电子,金属失去的电子
数等于生成H2中的氢原子数,常用的方法有守恒法和平均值 法(即求混合金属的平均相对原子质量).
第二十二页,编辑于星期一:十六点 九分。
1.将5.4 g Al投入200.0 mL 2.0 mol·L-1的某溶液中有氢气
C 产生,充分反应后有金属剩余,该溶液可能为 ( )
导电、导热性.
第四页,编辑于星期一:十六点 九分。
【导学教程】2015届高考化学总复习课件:3-2铝及其化合物

高考总复习· 化学
第三章
金属及其化合物
考 点 · 核 心 突 破
题组二
考查铝与酸、碱反应的定量计算
3.(2013·山东)足量下列物质与等质量的铝反应, 放出氢气且消耗溶质物质的量最少的是 A.氢氧化钠溶液 B.稀硫酸
C.盐酸
解析
训 练 · 高 效 提 能
D.稀硝酸
首先硝酸与金属铝反应不生成氢气,根据生
(2) 常温下,铝遇浓硝酸、浓硫酸会在表面生成致
密的氧化膜而发生钝化,从而阻止内部金属进一步发生
训 练 · 高 效 提 能
反 应 。 因 此 可 用 铝 制 容 器 盛 放 和 运 输 浓 H2SO4 、 浓 HNO3。 (3) 用铝箔包裹的钠与水反应时,既要考虑钠与水
的反应,又要考虑铝与生成的NaOH的反应。
A.①④
C.①③ 解析
训 练 · 高 效 提 能
B.②③
D.②③④
镁能与 CO2反应而铝不能,铝能与 NaOH 溶 C
液反应而镁不能。 答案
菜
单
高考总复习· 化学
第三章
金属及其化合物
考 点 · 核 心 突 破
◎易错易混 (1) 铝 制 品表 面 的 氧 化 膜 起 着 保 护 内 部 金 属 的 作 用,所以铝制品在空气中能稳定存在,具有很强的抗腐 蚀性。
考 点 · 核 心 突 破
考点· 核心突破
考点一 铝的主要性质及应用
1.铝的结构和存在 第三周期ⅢA族 ,原子结构示 铝位于元素周期表________________
训 练 · 高 效 提 能
意图
为。铝元素在地壳中含量丰富,仅次于
硅 。自然界中的铝全部以________ 化合 态存在。 ______
精品:2015届高考化学大一轮课件:3-7铝及其化合物

助学微博
5.弱酸的酸式盐:NaHCO3、KHS、NaHSO3 等。 氢氧化铝两性的重要应用 1.用过量 NaOH 溶液检验 Al3+的存在。 2.用过量 NaOH 溶液鉴别 Al3 和 Mg2 。
+ + + 3.用互滴法鉴别 Al3+与 OH-、AlO- 与 H 。 2
4.用过量 NaOH 溶液和相应酸溶液分离 Al3+与 Mg2+、 Fe3 等离子或分离 MgO、Al2O3。
2.铝的化学性质
助学微博
一个实质 铝与氢氧化钠溶液反应的实质 铝先与强碱溶液中的水反应生成 H2 和 Al(OH)3 然后 Al(OH)3 再与 NaOH 反应生成 H2O 和 NaAlO2, 反应中铝作还 原剂,水作氧化剂,NaOH 无电子得失。
二、铝的重要化合物的主要性质 1.氧化铝 (1)化学性质(用离子方程式表示):
【典例 1】
甲、乙两烧杯中各盛有 100 mL 3 mol/L 的
盐酸和 NaOH 溶液,向两烧杯中分别加入等质量的铝粉,反 应结束后测得生成的气体体积比为甲∶乙= 1∶2,则加入铝 粉的质量为( A.5.4 g C.2.7 g ) B.3.6 g D.1.8 g
【解析】
解答本题的关键是由题给条件判断出哪种物
第三章 金属及其化合物
第 7讲
铝及其化合物
考基梳理 夯基固本
核心考点 引领通关
递进题组 提升素养
开卷速查 规范特训
考基梳理 夯基固本
夯实基础 厚积薄发
考情考纲 三年 7 考 高考指数★★★★
1.了解铝的主要性质及应用。 2.了解铝的重要化合物的主要性质及应用。
教材回扣 一、铝的性质及用途 1.铝的物理性质及有途
-
-
解析:往 NaAlO2 溶液中通入过量 CO2 时生成 Al(OH)3 和 NaHCO3 而不是 Al(OH)3 和 Na2CO3。 3.铝制餐具可长时间存放酸性或碱性食物。(×) 解析:铝制品的表面有一层致密的氧化膜,对铝起到保 护作用,若长时间存放酸性或碱性食物,会破坏氧化膜,加 速铝的腐蚀。
高三一轮复习课件 铝及其化合物共44页文档

高三一轮复习课件 铝及其化合物
•
6、黄金时代是在我们的前面,而不在 我们的 后面。
•
7、心急吃不了热汤圆。
•
8、你可以很有个性,但某些时候请收 敛。
•
9、只为成功找方法,不为失败找借口 (蹩脚 的工人 总是说 乎 能克服 任何恐 惧。因 为,请 记住, 除了在 脑海中 ,恐惧 无处藏 身。-- 戴尔. 卡耐基 。
谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
2015高考化学总复习讲义:3.2铝及其化合物

第二节 铝及其化合物[考纲定位] 1.了解铝的主要性质及应用。
2.了解铝的重要化合物的主要性质及应用。
知识点一 铝的主要性质及其应用1.铝的结构和存在铝位于元素周期表第三周期ⅢA 族,原子结构示意图为○+13 2 8 3 。
铝元素在地壳中含量丰富,仅次于硅。
自然界中的铝全部以化合态存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.铝的化学性质写出图中有关反应的化学方程式或离子方程式:+④2Al +2OH -+2H 2O===2AlO -2+3H 2↑ ⑤2Al +Fe 2O 3=====高温2Fe +Al 2O 3(用于冶炼Fe) 【小提醒】铝与氢氧化钠溶液反应的实质铝先与强碱溶液中的水反应生成H 2和Al(OH)3然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
【巩固练习】1.同浓度同体积的盐酸和NaOH 溶液与足量的Al 充分反应,放出H 2的质量之比为________。
【答案】1∶32.(写一写)将含氧化膜的铝条放入足量的NaOH溶液中,依次发生的离子方程式为____________________________________________________________________________________________________。
【答案】Al2O3+2OH-===2AlO-2+H2O2Al+2OH-+2H2O===2AlO-2+3H2↑知识点二铝的重要化合物的性质1.氧化铝和氢氧化铝(是离子反应的写离子方程式)2.明矾(1)化学式为KAl(SO4)2·12H2O。
(2)电离方程式KAl(SO4)2===K++Al3++2SO2-4。
(3)应用:净水。
净水原理为明矾电离出的Al3+在水中水解生成Al(OH)3胶体,吸附水中悬浮物而沉淀,使水净化。
高三化学一轮复习 (知识存盘+名师助学+状元笔记)第3章 金属及其化合物 第二讲 铝及其化合物物课件

(4)相同质量(zhìliàng)的金属与足量酸反应产生氢气的量之比 等于其金属失去1 mol电子时质量(zhìliàng)的倒数比。 (5)若产生相同量的氢气,所需金属的物质的量之比等于反应 后对应金属呈现的化合价的倒数比。 (6)若产生相同量的氢气,所需金属的质量(zhìliàng)比等于失 去1 mol电子时金属的质量(zhìliàng)比。
第二(dìèr)讲 铝及其化合物
第一页,共89页。
1.了解铝的主要性质(xìngzhì)及应用。 2.了解铝的重要化合物的主要性质(xìngzhì)及应用。
1.依据铝等金属及其化合物的特征进行的无机推断(简答) 题。
2.有关Al单质及化合物性质(xìngzhì)的实验探究(简答)题。
第二页,共89页。
第七页,共89页。
铝热反应发生(fāshēng)的原因是什么? 提示 镁条燃烧,放出一定的热量,KClO3作为引燃剂在 受热状态下发生分解,使氧化铁粉末和铝粉在较高温度下
高温 发生反应:2Al+Fe2O3 ===== 2Fe+Al2O3,放出氧气、使镁 条燃烧更加剧烈产生高温,从而该反应放出大量的热,发 出耀眼的白光,生成的铁在高温下呈熔化状态。
第二十八页,共89页。
(1)①中反应的化学方程式为 _____________________________________________________ ___________________; (2)化合物I的电子式为 _____________________________________________________ ___________________; (3)1.6 g G溶于盐酸,得到的溶液与铜粉完全(wánquán)反应, 计算至少所需铜粉的质量(写出离子方程式和计算过程);
年高考化学(鲁科版)一轮复习课件:42 铝及其化合物(51张PPT)

2.向 Na[Al(OH)]4 溶液中滴加盐酸至过量
A→B Na[Al(OH)]4+HCl===NaCl+Al(OH)3↓+H2O B→C Al(OH)3+3HCl===AlCl3+3H2O 生成 Al(OH)3 消耗的 HCl 和溶解 Al(OH)3 消耗的 HCl 的物质的 量之比为 1∶3。
(3)鉴别(利用滴加顺序不同,现象不同) ①向 AlCl3 溶液中滴加 NaOH 溶液,先产生白色沉淀,后沉淀 溶解。 ②向 NaOH 溶液中滴加 AlCl3 溶液,开始无明显现象,后产生 白色沉淀,沉淀不溶解。 (4)分离提纯 ①利用 Al 能溶于强碱溶液,分离 Al 与其他金属的混合物。 ②利用 Al2O3 能与强碱溶液反应,分离 Al2O3 与其他金属氧化物。 ③利用 Al(OH)3 能与强碱溶液反应,分离 Al3+与其他金属阳离 子。
13、He who seize the right moment, is the right man.谁把握机遇,谁就心想事成。2021/9/192021/9/192021/9/192021/9/199/19/2021 •14、谁要是自己还没有发展培养和教育好,他就不能发展培养和教育别人。2021年9月19日星期日2021/9/192021/9/192021/9/19 •15、一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。2021年9月2021/9/192021/9/192021/9/199/19/2021 •16、教学的目的是培养学生自己学习,自己研究,用自己的头脑来想,用自己的眼睛看,用自己的手来做这种精神。2021/9/192021/9/19September 19, 2021 •17、儿童是中心,教育的措施便围绕他们而组织起来。2021/9/192021/9/192021/9/192021/9/19
高三一轮复习化学:铝及其化合物——课件(共9张)

过 滤
滤 液 Ⅱ 电 解
A l(O H )3 A l2O 3 A l
活动三 实验研究科学分析
【实验目的】:研究pH变化对Al3+—Al(OH)3—AlO2存在形式的影响; 【实验操作】:向装有0.1mol/L Al2(SO4)3 溶液50ml 的烧杯中逐滴加入1mol/L的NaOH溶液,记录滴加的 NaOH溶液体积和每次滴加后混合溶液的pH;
活动二 迁移应用设计流程
1、模仿“酸溶法”, 设计用“碱溶法”从铝土矿中提 取铝的流程,并写出前三步中涉及铝元素反应的离子方 程式。
A l2O 3过 量 N aO H 溶 液
F e2O 3过 滤 S iO 2
A lO 2-过 量 H C l溶 液 S iO 2- 过 滤
F e2O 3
等 杂 质
H 2S iO 3
【实验视生频成】沉淀 没有沉淀
沉淀增加
【实验现象】
【实验数据记录及绘图】
沉淀溶解
溶P液HpH值:4
11.3 10
开始沉淀
5.4
b
4.3
4a
4.3(开始)5.4(恰好完全) 10(开始) 11.3(完全)
开始溶解
d
恰好沉淀
f
pH接近最大
e
溶解完全
c
水解显酸性
21、尝结试合结现合象A理l(解O滴H)定3在曲水线溶上液a、中b的、两c、种d电、离e方、式f点解V的(释NaOH)/ml :意p义H,变分化析对滴A定l3+曲—线A变l(O化H趋)3势—的A原lO因2-,存并在完形成式表的格影填响。 写。
PH值:4
4.3(开始)5.4(完全) 10(开始) 11.3(完全)
高考化学一轮复习课件第讲铝及其化合物

• C.8mol·L-1 NaOH D.18mol·L-1 H2SO4
第二十五页,编辑于星期一:十四点 三十九分。
•
在镁、铝混合物中加入HNO3和浓
H2SO4都不能产生H2,加入NaOH溶液,只有
Al与之反应,加入盐酸,镁和铝都与盐酸反应
生成H2,所以生成的H2的量最多。
方法指导:本题主要考查Mg、Al与硝酸
排在前面的金属能把 排在后面的金属从其 盐溶液中置换出来
溶于王水 不反应
加热分解
常温分解
化合态
游离态
热分解或其他方法
第二十四页,编辑于星期一:十四点 三十九分。
•
(考查单质铝的性质)将等物质的量
的镁和铝相混合,平均分成4份,分别加到足
量的下列溶液中,充分反应后,放出氢气最多
的是( )A
• A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
Al(OH)3+3H+=Al3++3H2O, Al(OH)3+OH-=AlO-2+2H2O 3.明矾的化学式是KAl(SO4)2·12H2O,它
是一种复盐,它能净水的原因是
Al3++3H2O Al(OH)3(胶体)+3H+。
第八页,编辑于星期一:十四点 三十九分。
• 四、从铝土矿中提取铝 • 1.工艺流程
是含量最多的金属,它属于有色金属和轻金 属,自然界中的铝全部以化合态存在;铝土
矿的主要成分是Al2O3。 • 二、铝单质
• 1.物理性质 • 银白色有金属光泽的固体,有良好的延展性、
导电性和导热性等。
第三页,编辑于星期一:十四点 三十九分。
• 2.化学性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解析: A项,铝在空气中会与O2反应生成致密的氧化
物薄膜.C项中明矾溶于水生成氢氧化铝胶体,具有 吸附色素和杂质的性能,通常用作净水剂,但不能用 于杀菌消毒.D项,铵盐都溶于水. 答案:B
3.将表面已完全钝化的铝条插入下列溶液中,不会发生
反应的是
A.稀硝酸 B.稀盐酸
(
)
C.硝酸铜
D.氢氧化钠
解析:钝化了的铝条表面上覆盖着致密的氧化铝薄膜, 使金属铝与外界隔绝.氧化铝是两性氧化物,既能跟 酸反应又能跟碱反应,但不能跟硝酸铜等盐溶液反应. 答案:C
(2)溶液a中存在的离子有____________________;在溶液a
中加入盐酸时需控制溶液的pH,为什么?_____________; 为此,改进方法是__________________. (3)为了研究AlCl3晶体的性质,在得到AlCl3溶液后,如何 得到AlCl3晶体?________.
2.(2011· 东北名校二模)铝是一种低毒金属元素,它并非 人体需要的微量元素,不会导致急性中毒,但食品中 铝的含量超过国家标准就会对人体造成危害.下列关 于铝元素的说法正确的是 ( )
A.铝在空气中不易氧化是因为性质不活泼
B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物 C.明矾可用于饮用水的杀菌消毒 D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水
1.将5.4 g Al投入200.0 mL 2.0 mol· L-1的某溶液中有氢气 产生,充分反应后有金属剩余,该溶液可能为 ( )
A.HNO3溶液
C.H2SO4溶液
B.Ba(OH)2溶液
D.HCl溶液
解析:5.4 g Al即为0.2 mol,200.0 mL 2.0 mol· L-1的溶液中
2Al+6HCl === 2AlCl3+3H2↑ 2Al+2NaOH+2H2O === 2NaAlO2+3H2 ↑ ↑
液的反应
1.如何除去铁粉中的铝粉? 提示:加入过量NaOH溶液,然后过滤、洗涤、 干燥.
二、铝的重要化合物
1.氧化铝
(1)化学性质(用离子方程式表示)
(2)用途 熔点很高,是一种较好的 耐火材料 ,还可制作各种宝石.
2.氢氧化铝
(1)化学性质
△ ②受热分解: 2Al(OH)3= = = = = Al2O3+3H2O .
2.既能与酸反应又能与碱反应的物质有哪些? 提示: ①Al、②Al2O3、③Al(OH)3、④弱酸的 铵盐,如:(NH4)2CO3、CH3COONH4、⑤弱酸 的酸式盐,如:NaHCO3、NaHSO3、NaHS等
Al(OH)3 可溶于盐酸,因此需要控制 pH,若通入 CO2 也可 使 AlO- 2 转化为 Al(OH)3,且 CO2 过量 Al(OH)3 也不会溶解. (3)为防止 AlCl3 水解,应在 HCl 酸性气氛中进行蒸发结晶.
答案: (1)Mg2++2OH- = = = Mg(OH)2↓ Al(OH)3↓
+ - - + AlO- + H +H2O = = = Al(OH)3↓ 2 + 3+ AlO- + 4H = = = Al +2H2O 2 - -
Al3 +3AlO2 +6H2O = = = 4Al(OH)3↓
+ -
2.应用 (1)制取 Al(OH)3.
+ Al3++3NH3· H2O = = = Al(OH)3↓+3NH4
解析:(1)与 NaOH 反应的有 Mg2+和 Al3+,生成的 Al(OH)3 又可与过量的 NaOH 反应. 若把 Al(OH)3 和 Mg(OH)2 分开, 只能用强碱,不能用氨水,因为 Al(OH)3 不溶于氨水.
- (2)除去 Mg2+后,溶液中有 K+、Cl-、Na+、AlO2 、OH-,
所含的溶质为0.4 mol,在A选项中硝酸与Al反应没有H2生
成.在B选项中Al和Ba(OH)2反应是2Al+Ba(OH)2+2H2O === Ba(AlO2)+3H2↑,可以看出金属无剩余,是Ba(OH)2 过量.在C选项中根据电子守恒,0.2 mol的铝可提供电子 0.6 mol,而0.4 mol的硫酸可提供H+ 0.8 mol,Al不剩余.
答案:AD
1.“铝三角”是指Al3+、Al(OH) 系(如下图)
3和AlO
2
相互转化的三角关
相关反应 Al(OH)3+OH = = = AlO2 +2H2O Al(OH)3+3H+= = = Al3++3H2O Al3++3OH-= = = Al(OH)3↓ Al3 +4OH = = = AlO2 +2H2O
解析:2Al+2OH +2H2O = = = 2AlO2 +3H2↑,Mg 和碱 液不反应,过滤后向 NaAlO2 溶液中通入过量 CO2 生成 Al(OH)3 沉淀,再次过滤.
-
-
答案:C
5.某校化学兴趣小组用如下图所示过程除去AlCl3中含有 的Mg2+、K+杂质离子并尽可能减少AlCl3的损失.
4.(2011· 聊城联考)用含有少量Mg的Al片制取纯净的Al(OH)3, 下列操作中最恰当的组合是 ①加入盐酸溶解 ②加NaOH溶液 ③过滤 ( ) ④通入过量
CO2生成Al(OH)3 ⑤加盐酸生成Al(OH)3 ⑥加过量氨水
生成Al(OH)3
A.①⑥③ C.②③④③ B.①③⑥③ D.②③⑤③
2.足量铝分别与等物质的量的盐酸和氢氧化钠反应,产 VHClH2 生 H2 的体积比 =1∶3. VNaOHH2 3.当生成 H2 相等时,消耗铝单质一定相等,消耗 HCl 与 NaOH 的物质的量之比为 3∶1.
[例1]
(2009· 上海高考)镁和铝分
别与等浓度、等体积的过量稀硫 酸反应,产生气体的体积(V)与时 间(t)关系如右图.反应中镁和铝 的 A.物质的量之比为3∶2 B.质量之比为3∶2 ( )
请回答下列问题.
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反 应的离子方程式___________________________________. 氢氧化钠溶液能否用氨水代替,为什么?______________ __________________________________________________.
(2)制备 ①向铝盐溶液中加入氨水
Al3++3NH3· H2O = = = Al(OH)3↓+3NH+ 4
②向偏铝酸盐溶液中通入足量CO2 - - AlO2 +CO2+2H2O = = = Al(OH)3↓+HCO3 .
3.明矾
12H2O 明矾的化学式:KAl(SO4)2· 净水原理涉及的反应:Al3++3H2O === Al(OH)3 (胶体)+3H+ .
第二节 铝及其化合物
全局性掌控
全局性掌控
本节的重点知识有:铝、氧化铝、氢氧化铝、明矾
的性质及用途.主要考查Al的性质,Al2O3、Al(OH)3的 两性及Al3+、AlO 2 、Al(OH)3之间的转化.预测2012 年高考仍会突出在铝与碱的反应,Al2O3、Al(OH)3的两 性等基础知识上,还可能涉及铝的重要化合物的用途, 如明矾净水、含铝药品、食品的摄入等与生活联系密切 的内容.
Al3++3OH-= = =
- Al(OH)3+OH-= = = AlO2 +2H2O
不能,因为 Al3+与氨水反应生成 Al(OH)3 后,不能继续与 氨水反应,从而不能将 Al(OH)3 与 Mg(OH)2 分开.
- (2)K+、 Cl-、 Na+、 AlO- 、 OH 2
因为 Al(OH)3 能溶于强酸,
[例2]
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶
液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示, 则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比(
)
A.6∶1 C.2∶1
B.3∶1 D.1∶2
[名师精析] 从图上可以看出:从 50~60 mL 时,发生反应: Al(OH)3+OH- = = = AlO- 2 +2H2O,设消耗 NaOH 为 1 mol, 从 0~50 mL 时发生反应:Al3++3OH-===Al(OH)3↓,Mg2+ +2OH-= = = Mg(OH)2↓,因此根据反应的量的关系,可得出 Al2(SO4)3 生成沉淀消耗 NaOH 的物质的量为 3 mol; 而 MgSO4 消耗 NaOH 为 2 mol; 故 Al2(SO4)3 为 0.5 mol, MgSO4 为 1 mol, 又因为体积相同,故它们的物质的量浓度之比为 1∶2.
1.下列有关金属铝及其化合物的叙述正确的是 A.铝在常温下不能与氧气反应 B.铝不能与氯气反应 C.铝既能溶于酸,又能溶于碱 D.氧化铝只能与酸反应,不能与碱反应
(
)
解析:铝在常温下能与O2反应生成致密的氧化膜; 铝与Cl2反应生成AlCl3;Al2O3与NaOH反应生成 NaAlO2. 答案:C
AlO2 +CO2+2H2O = = = Al(OH)3↓+HCO3 (HS-、S2-、AlO- 、 HCO 、 CO 2 3 3 等因水解相互促进 + 3+ 3+ 而不能大量共存;AlO- 与 NH 、 Al 、 Fe 等也不能大量 2 4
共存. (3)分离除杂.如除去 Mg2+中的 Al3+.
化学方程式 4Al+3O2 === 2Al2O3
应)
铝热反应(与 Fe2O3和V2O5 的反应)
高温 2Al+Fe2O3= = = = = Al2O3+2Fe 高温 10Al+3V2O5= = = = = 5Al2O3+6V
化学性质
与Cl2、S的 反应 与盐酸的 反应 与NaOH溶
化学方程式
△ 2Al+3Cl2= = = = = 2AlCl3 △ 2Al+3S= = = = = Al2S3
+
所以需控制 pH,防止部分 Al(OH)3 转化成 Al3 中通入过量 CO2 气体
