食品中叶酸的测定原始记录表格
叶酸测定

1.原理叶酸是酪乳酸杆菌(Lactobacillus casei, L. C,ATCC7469)生长所必需的营养素。
在一定条件下,L.C的生长繁殖与培养基中叶酸含量呈正比关系,细菌增殖的量以光密度值计,通过与标准曲线相比较,计算出样品中叶酸的含量。
2.适用范围参考《Methods of Vitamin Assay》,第4版。
本方法适用于各类食物中叶酸的测定。
检测限为0.1ng。
3.仪器与设备(1)恒温培养箱(2)离心机(3)高压消毒锅(4)震荡器(5)接种针和接种环(6)分光光度计4.试剂除特殊说明外,本实验中所有试剂均为分析纯,水为蒸馏水。
(1)菌种:酪乳酸杆菌(Lactobacillus casei, L.C, ATCC 7469)(2)磷酸缓冲液(0.05mol/L, pH6.8):称取4.35gNa3PO4·12H2O,10.39gNa2HPO4·7H2O溶解于800ml水中。
临用前用约5g抗坏血酸调节pH至6.8。
(注:叶酸对光、热敏感,易被氧化破坏,抗坏血酸有助于保护叶酸被氧化。
)(3)鸡胰酶溶液:称取100mg干燥的鸡胰酶(Difco公司)(注:含有叶酸轭合酶,用于水解叶酸多谷氨酸盐),加入20ml磷酸缓冲液制成匀浆,3000rpm离心10min,取上清液备用。
临用前现配。
(4)蛋白酶-淀粉酶溶液:分别称取200mg蛋白酶(Sigma公司)和淀粉酶(Sigma公司),加入20ml磷酸缓冲液制成匀浆,离心3000rpm10min,取上清液备用。
临用前配制。
(5) 2+8乙醇溶液:量取20ml无水乙醇溶液,加入80ml水混匀。
(6) 0.1mol/L NaOH: 称取0.4g氢氧化钠,加2+8乙醇溶液溶解并稀释至1L。
(7) 10mol/L NaOH。
称取400g氢氧化钠,加水溶解并稀释至1L。
(8)叶酸标准储备液(200mg/ml):准确称取200mg叶酸标准品(Sigma公司,纯度大于98%),用0.01mol/LNaOH溶解并定容至1L。
食品中亚硝酸盐含量测定原始记录表
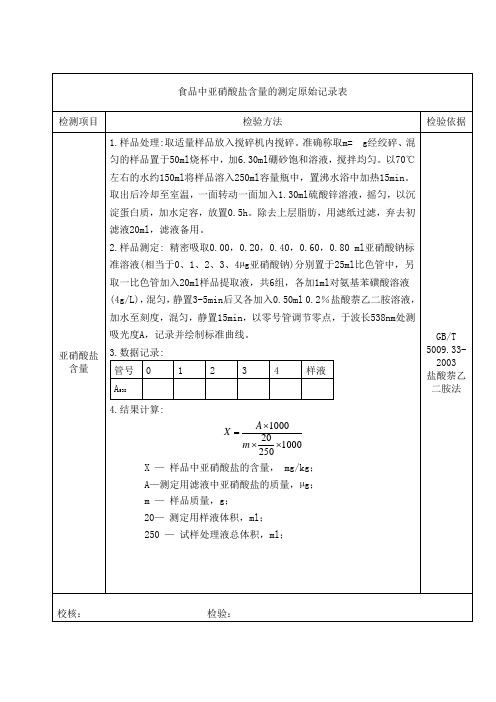
食品中亚硝酸盐含量的测定原始记录表
检测项目检验方法检验依据
亚硝酸盐含量1.样品处理:取适量样品放入搅碎机内搅碎。
准确称取m= g经绞碎、混
匀的样品置于50ml烧杯中,加6.30ml硼砂饱和溶液,搅拌均匀。
以70℃
左右的水约150ml将样品溶入250ml容量瓶中,置沸水浴中加热15min。
取出后冷却至室温,一面转动一面加入1.30ml硫酸锌溶液,摇匀,以沉
淀蛋白质,加水定容,放置0.5h。
除去上层脂肪,用滤纸过滤,弃去初
滤液20ml,滤液备用。
2.样品测定: 精密吸取0.00,0.20,0.40,0.60,0.80 ml亚硝酸钠标
准溶液(相当于0、1、2、3、4µg亚硝酸钠)分别置于25ml比色管中,另
取一比色管加入20ml样品提取液,共6组,各加1ml对氨基苯磺酸溶液
(4g/L),混匀,静置3-5min后又各加入0.50ml 0.2%盐酸萘乙二胺溶液,
加水至刻度,混匀,静置15min,以零号管调节零点,于波长538nm处测
吸光度A,记录并绘制标准曲线。
3.数据记录:
管号0 1 2 3 4 样液
A538
4.结果计算:
1000
250
20
1000
⨯
⨯
⨯
=
m
A
X
X —样品中亚硝酸盐的含量, mg/kg;
A—测定用滤液中亚硝酸盐的质量,µg;
m —样品质量,g;
20—测定用样液体积,ml;
250 —试样处理液总体积,ml;
GB/T
5009.33-
2003
盐酸萘乙
二胺法
校核:检验:。
高效液相色谱法测定叶酸片中叶酸含量

( h r c u ia o l g , i i g M e ia Un v r i Rih o 2 6 2 Ch n ) P a ma e t lC l e J n n d c l c e ie st y, z a 7 8 6。 i a
Abta tOb e t e Toe tbiha L to o h ee miaino li A i n F l cd T bes sr c : j ei v sa l n HP C me h dfrte d tr n t fF 1 cdi oi A i a lt . s o 0c c
( O: 0 6 4 )wi h lw aea . / n. s l Th ie a g f oi i s2 . 81 / -8 . 2 ̄ / t tef h o rt t1 0mlmi Reu t s el rr n eo l Acdwa O O g ml 1 0 7 g ml n F c a
叶酸 是治 疗 贫 血 的 特 效药 物 。近 年来 叶酸 成 为 了营养 医学 界 的新 宠 , 目前 市 场上销 售 的营养 保
限公 司) KQ 5 , 0型 超 声 波 清 洗 器 ( 山 市 超 声 波 昆
仪 器有 限公 司 ) S 一5 , YZ 5 0型石 英 亚 沸 高 纯 水 蒸 馏 器 ( 苏金坛 市金 城 国胜 实验 仪 器 厂) B 2 4S型 江 , S 2
M eho FolcAcd wa e e m i d o t ds i i s d t r ne n HPLC nsr i tumen i d a D im o i t fxe a nsl c18 ol c umn (2 0 5 m m × 4 m m . .6 5
( = 0 99 r .9 9), nd t e a r ge r o er s 1 0. a h ve a ec v y wa 0 5% wih RS 1 2% . t D . Con l s o Th e ho Ssm pl s ns. cu in e m t d i i e, e i
叶酸代谢能力测定

MTHFR基因及相关SNP位点
• MTHFR全称5,10-亚甲基四氢叶酸还原酶,位于第一号
染色体1p36.3位置,全长19.3kb,共有外显子12个,mRNA 全长7,105 nt,编码657个氨基酸残基组成的蛋白。 SNP: (1)MTHFR C677T rs1801133;
(2)MTHFR A1298C rs1801131;
缺血性心脏病前瞻性研究和MTHFR突变文献数据汇总
研究类型 研究数
缺血性心脏病
MTHFR
46
Prospective
16
静脉血栓
MTHFR
26
脑卒中
MTHFR
7
Prospective
8
样本量
12193 3144 3439 1217 676
血清同型半胱氨酸浓度上升 5μmol/l
Summary odds ratio (95% CI)
随机、对照研究。在对2万余例中国高血压患者平均4.5年的随访中显示, 在降压治疗同时补充叶酸,可以显著降低首次卒中的风险。
补充叶酸
中美脑卒中一级预防研究
MTHFR基因型的影响
叶酸水平在基 准1/4以下
叶酸水平在基 准1/4以上
CT基因型
TT基因型
脑卒中发病率
注:TT基因型脑卒中风险最高
为什么需要MTHFR基因检测?
合
肝脏吸收合成叶酸的量有限,未被吸收的过量合成叶酸会进入 血液,有可能引起白血病、关节炎等疾病
常见血清学叶酸水平低的原因
➢ 巨幼细胞性贫血,溶血性贫血 ➢ 甲亢 ➢ 营养不良,慢性腹泻,吸收不良 ➢ 酒精中毒 ➢ 重症皮肤病 ➢ 恶性肿瘤 ➢ 骨髓增生性疾病 ➢ 肝脏疾病 ➢ 正常妊娠
食品检验原始记录表

食品检验原始记录表一、引言食品安全是人们关注的重要问题之一,食品检验是保障食品安全的重要手段之一。
食品检验原始记录表是食品检验过程中的重要文件,记录了食品样品的检验过程和结果,对于保障食品质量和消费者健康具有重要意义。
二、食品检验原始记录表的作用食品检验原始记录表是食品检验工作的重要组成部分,其作用主要体现在以下几个方面:1. 提供检验依据食品检验原始记录表记录了食品样品的检验项目、方法、仪器设备等信息,为后续的食品检验提供了重要依据。
在进行食品检验时,可以根据原始记录表中的信息选择合适的检验项目和方法,确保食品检验的准确性和可靠性。
2. 保障食品质量食品检验原始记录表记录了食品样品的检验结果,可以及时了解食品的质量状况。
通过食品检验原始记录表的结果,可以判断食品是否符合相关标准和法规的要求,及时采取相应的措施,保障食品质量。
3. 追溯食品安全问题在食品安全问题发生时,食品检验原始记录表可以作为证据,帮助追溯食品安全问题的起因和责任。
通过对原始记录表的分析和比对,可以找出食品安全问题的源头,采取相应的措施加以解决。
三、食品检验原始记录表的内容食品检验原始记录表的内容应当包括以下几个方面:1. 样品信息食品检验原始记录表应当记录样品的基本信息,包括样品的名称、产地、生产日期、保质期等。
这些信息对于后续的食品检验和食品追溯具有重要意义。
2. 检验项目和方法食品检验原始记录表应当记录检验项目和方法,包括检验项目的名称、检验方法的编号和描述等。
这些信息可以帮助食品检验人员选择合适的检验项目和方法,确保食品检验的准确性和可靠性。
3. 仪器设备和试剂食品检验原始记录表应当记录使用的仪器设备和试剂,包括仪器设备的名称、型号、生产厂家等信息,试剂的名称、批号、有效期等信息。
这些信息对于食品检验的可追溯性和结果的可靠性具有重要意义。
4. 检验结果和评定标准食品检验原始记录表应当记录检验结果和评定标准,包括检验结果的数值、单位、评定标准的编号和描述等信息。
叶酸的测定方法

叶酸的测定方法微生物法1.原理叶酸是酪乳酸杆菌(Lactobacillus casei, L. C, ATCC 7469)生长所必需的营养素。
在一定条件下,L.C的生长繁殖与培养基中叶酸含量呈正比关系,细菌增殖的量以光密度值计,通过与标准曲线相比较,计算出样品中叶酸的含量。
2.适用范围参考《Methods of Vitamin Assay》,第4版。
本方法适用于各类食物中叶酸的测定。
检测限为0.1ng。
3.仪器与设备(1)恒温培养箱(2)离心机(3)高压消毒锅(4)震荡器(5)接种针和接种环(6)分光光度计4.试剂除特殊说明外,本实验中所有试剂均为分析纯,水为蒸馏水。
(1)菌种:酪乳酸杆菌(Lactobacillus casei, L.C, ATCC 7469)(2)磷酸缓冲液(0.05mol/L, pH6.8):称取4.35g Na3PO4·12H2O,10.39g Na2HPO4·7H2O溶解于800ml水中。
临用前用约5g抗坏血酸调节pH至6.8。
(注:叶酸对光、热敏感,易被氧化破坏,抗坏血酸有助于保护叶酸被氧化。
)(3)鸡胰酶溶液:称取100mg干燥的鸡胰酶(Difco公司)(注:含有叶酸轭合酶,用于水解叶酸多谷氨酸盐),加入20ml磷酸缓冲液制成匀浆,3000rpm离心10min,取上清液备用。
临用前现配。
(4)蛋白酶-淀粉酶溶液:分别称取200mg蛋白酶(Sigma公司)和淀粉酶(Sigma公司),加入20ml磷酸缓冲液制成匀浆,离心3000rpm 10min,取上清液备用。
临用前配制。
(5) 2+8乙醇溶液:量取20ml无水乙醇溶液,加入80ml水混匀。
(6) 01mol/L NaOH: 称取0.4g氢氧化钠,加2+8乙醇溶液溶解并稀释至1L。
(7) 10mol/L NaOH。
称取400g氢氧化钠,加水溶解并稀释至1L。
(8)叶酸标准储备液(200mg/ml):准确称取200mg叶酸标准品(Sigma公司,纯度大于98%),用0.01mol/L NaOH溶解并定容至1L。
食品卫生微生物检验原始记录表
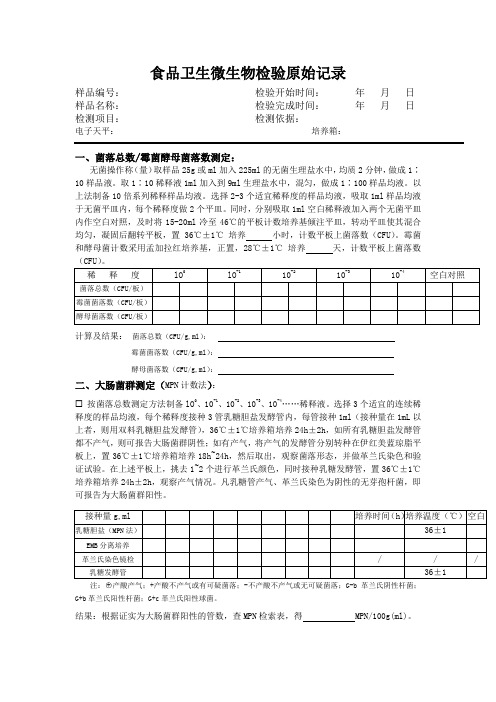
食品卫生微生物检验原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:检测依据:电子天平:培养箱:一、菌落总数/霉菌酵母菌落数测定:无菌操作称(量)取样品25g或ml加入225ml的无菌生理盐水中,均质2分钟,做成1∶10样品液。
取1∶10稀释液1ml加入到9ml生理盐水中,混匀,做成1∶100样品均液。
以上法制备10倍系列稀释样品均液。
选择2-3个适宜稀释度的样品均液,吸取1ml样品均液于无菌平皿内,每个稀释度做2个平皿。
同时,分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照,及时将15-20ml冷至46℃的平板计数培养基倾注平皿,转动平皿使其混合均匀,凝固后翻转平板,置 36℃±1℃培养小时,计数平板上菌落数(CFU)。
霉菌和酵母菌计数采用孟加拉红培养基,正置,28℃±1℃培养天,计数平板上菌落数(CFU)。
计算及结果:菌落总数(CFU/g,ml):霉菌菌落数(CFU/g,ml):酵母菌落数(CFU/g,ml):二、大肠菌群测定(MPN计数法):按菌落总数测定方法制备lO0、10-1、10-2、10-3、10-4……稀释液。
选择3个适宜的连续稀释度的样品均液,每个稀释度接种3管乳糖胆盐发酵管内,每管接种1ml(接种量在1mL以上者,则用双料乳糖胆盐发酵管),36℃±1℃培养箱培养24h±2h,如所有乳糖胆盐发酵管都不产气,则可报告大肠菌群阴性;如有产气,将产气的发酵管分别转种在伊红美蓝琼脂平板上,置36℃±1℃培养箱培养18h~24h,然后取出,观察菌落形态,并做革兰氏染色和验证试验。
在上述平板上,挑去1~2个进行革兰氏颜色,同时接种乳糖发酵管,置36℃±1℃培养箱培养24h±2h,观察产气情况。
凡乳糖管产气、革兰氏染色为阴性的无芽孢杆菌,即可报告为大肠菌群阳性。
注:○+产酸产气;+产酸不产气或有可疑菌落;-不产酸不产气或无可疑菌落;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌。
食品中酸价测定的原始记录
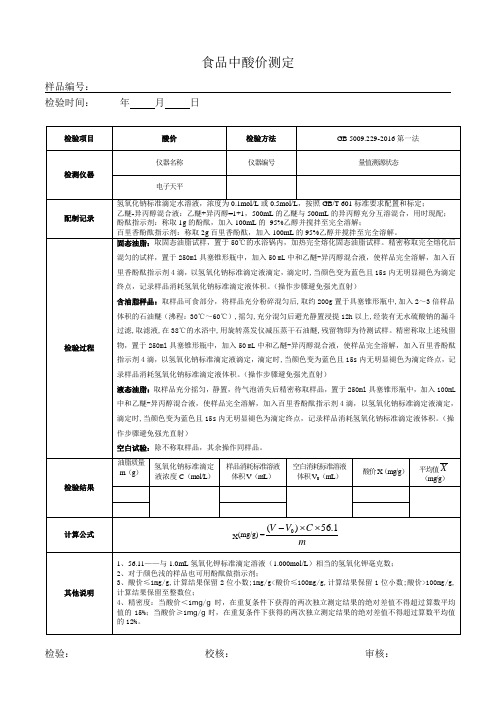
百里香酚酞指示剂:称取2g百里香酚酞,加入100mL的95%乙醇并搅拌至完全溶解。
检验过程
固态油脂:取固态油脂试样,置于50℃的水浴锅内,加热完全熔化固态油脂试样。精密称取完全熔化后混匀的试样,置于250ml具塞锥形瓶中,加入50 mL中和乙醚-异丙醇混合液,使样品完全溶解,加入百里香酚酞指示剂4滴,以氢氧化钠标准滴定液滴定,滴定时,当颜色变为蓝色且15s内无明显褪色为滴定终点,记录样品消耗氢氧化钠标准滴定液体积。(操作步骤避免强光直射)
检验时间:_____年月日
含油脂样品:取样品可食部分,将样品充分粉碎混匀后,取约200g置于具塞锥形瓶中,加入2~3倍样品体积的石油醚(沸程:30℃~60℃),摇匀,充分混匀后避光静置浸提12h以上,经装有无水硫酸钠的漏斗过滤,取滤液,在38℃的水浴中,用旋转蒸发仪减压蒸干石油醚,残留物即为待测试样。精密称取上述残留物,置于250ml具塞锥形瓶中,加入50 mL中和乙醚-异丙醇混合液,使样品完全溶解,加入百里香酚酞指示剂4滴,以氢氧化钠标准滴定液滴定,滴定时,当颜色变为蓝色且15s内无明显褪色为滴定终点,记录样品消耗氢氧化钠标准滴定液体积。(操作步骤避免强光直射)
液态油脂:取样品充分摇匀,静置,待气泡消失后精密称取样品,置于250ml具塞锥形瓶中,加入100mL中和乙醚-异丙醇混合液,使样品完全溶解,加入百里香酚酞指示剂4滴,以氢氧化钠标准滴定液滴定,滴定时,当颜色变为蓝色且15s内无明显褪色为滴定终点,记录样品消耗氢氧化钠标准滴定液体积。(操作步骤避免强光直射)
空白试验:除不称取样品,其余操作同样品。
检验结果
油脂质量m(g)
氢氧化钠标准滴定液浓度C(mol/L)
食品检验报告检验原始记录
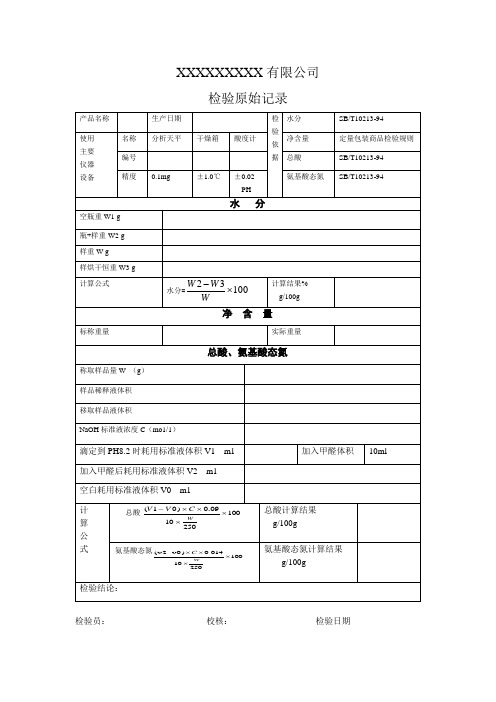
公
式
总酸
总酸计算结果
g/100g
氨基酸态氮
氨基酸态氮计算结果
g/100g
检验结论:
检验员:校核:检验日期
XXXXXXXXX有限公司
产品名称
生产日期
检验依据
食盐
SB/T10213-94
使用主要
仪器设备
名称
分析天平
干燥箱
分光光度计
恒温培
养箱
亚硝
酸盐
GB/T5009.33
—2010
编号
大肠
菌群
GB/T4789.3
吸取亚硝酸盐标准使用液ml
0
0.2
0.4
0.6
0.8
1.0
1.5
样品
吸光度
计算公式
测定用样液中亚硝酸盐质量ug
计算
结果
mg/kg
大肠菌群(MPN/100ml) 培养温度36±1℃
LST肉汤发酵
平行1
平行2
10-1
10-2
10-3
10-1
10-2
10-3
产气管数
发酵结果
平均值
检验校核:检验日期
XXXXXX有限公司
出厂检验报告
产品名称
商标
生产厂
规格型号
生产日期
检验日期
检验批量
生产班组
检验依据
序号
检验项目
单位
技术要求
检验结果
单项判定
1
净含量
g
300-9
2
感官
应符合标准要求
3
水分
g/100g
≤85
4
食盐含量
g/100g
叶酸食品级fcc质量标准

叶酸是一种重要的维生素,对于人体的发育和健康起着至关重要的作用。
为了确保叶酸产品的质量和安全性,制定了一系列的质量标准。
其中,食品级FCC(Food Chemicals Codex)质量标准是广泛应用于食品行业的一项标准。
本文将详细介绍叶酸食品级FCC 质量标准,包括其定义、要求和相关检测方法。
一、叶酸食品级FCC质量标准的定义叶酸食品级FCC质量标准是指符合食品化学法典(Food Chemicals Codex)规定的叶酸质量要求的产品。
该标准包括对叶酸产品的纯度、含量、物理性质、微生物指标等方面的要求。
二、叶酸食品级FCC质量标准的要求1. 纯度要求:叶酸食品级FCC标准要求叶酸产品的纯度达到一定的标准。
其中,有机杂质的含量要低于规定的限量,无机盐类的含量也要符合要求。
此外,还要求叶酸产品不得含有对人体有害的物质,如重金属等。
2. 含量要求:叶酸食品级FCC标准对叶酸产品的含量有详细的规定。
一般来说,叶酸产品的含量应在一定的范围内,并且要与产品标签上所示的含量相符合。
3. 物理性质要求:叶酸食品级FCC标准还对叶酸产品的物理性质进行了要求。
例如,叶酸产品的外观应为无色结晶或结晶性粉末,不应有异物。
此外,还要求叶酸产品的溶解度、熔点、旋光度等物理性质符合规定。
4. 微生物指标要求:叶酸食品级FCC标准对叶酸产品的微生物指标也有一定的要求。
例如,叶酸产品的总菌落数、霉菌和酵母菌的数量都应低于规定的限值。
另外,对大肠杆菌和沙门氏菌等致病菌的检测结果也必须符合相关标准。
三、叶酸食品级FCC质量标准的检测方法为了评估叶酸产品是否符合食品级FCC质量标准的要求,需要进行相应的检测。
以下是常用的叶酸检测方法:1. 高效液相色谱法(HPLC):该方法是目前最常用的叶酸含量测定方法。
通过将叶酸样品与特定试剂反应后,利用高效液相色谱仪进行分离和定量分析,可以准确测定叶酸的含量。
2. 紫外分光光度法:该方法是一种快速测定叶酸含量的方法。
食品检验原始记录

革兰氏染色
净含量
kg (g)
修约值
检验人:
检验日期:
(此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容,供参考,感谢您的支持)
(以脂肪计,
KO)/ (mg/g
w3
样品质量
m(g)
标液
浓度C(mol/L)
样品测定消耗标 液体积V1(mL
空白试验消耗标 液体积V2(mL
计算 值
平均
值
修约
值
(V1A/2)O 56.11
X=
m
取检样25g至225ml灭菌N..S,稀释成1 : 10悬液,充分混匀后,取
培养条件:菌落总数 36C,48h,大肠菌群
XXXXXXX
检验原始记录
生产日期(批号):规格:样品数量:检测环境条件(温、湿度):检测依据(方法):GB/T22165检测仪器名称:分析天平、干燥箱、灭菌器、培养箱
检验项目
标准 要求
试 验 数论
感官
水分
(g/ioog)
w
称量瓶和试样 的质量m1(g)
称量瓶和试样干燥后的质量m2(g)
及1ml+9 ml灭菌N..S连续稀释 乍36C,24h,
菌落总数
w1000
(只做油炸类)
稀释液浓度
空白
10-1
10-2
10-3
-4
10
报告菌落总数(CFU/g)
菌洛数(个)
大 肠 菌 群
w30
接种量ml(g)
10X3
管
1X3管
0.1X 3 管
0.01X 3 管
报告大肠菌群MPN/100g
乳糖胆盐发酵管
称量瓶的质量m3(g)
叶酸测定

紫外分光光度法测定产品——中叶酸含量:
缺专属性实验,样品的稳定性实验、回收率实验
吸收波长的确定,B液在最大吸收波长有无吸收,下来再做标准曲线,完了后做回收率和稳定性。
1、绘制标准曲线
1)以亚甲蓝等其他组分不变的溶液(记为B液)为溶剂,配制一系列不同浓度的叶酸溶液,取值分别为6g/L,8g/L,10g/L,12 g/L,14 g/L。
2)紫外分光光度计下测量上述溶液在λmax处的吸光值A,每种溶液测定3次取平均值,得到A6,A8,A10,A12,A14。
3)根据吸光值A与浓度C的关系绘制标准曲线,并得到A关于C的线性回归方程式。
2、样品的测定:
取FRD样品溶液1ml,置50ml容量瓶中,加B液稀释至刻度,摇匀。
以B液为空白,在λmax波长处测定吸收值,从线性回归方程,可以求出样品中叶酸含量。
注:FRD中叶酸理论含量为9.95g/L~10.05g/L。
FRD由叶酸衍生物、还原态亚甲蓝、乙酸等组成。
叶酸测定微生物法

叶酸测定微生物法叶酸测定微生物法是一种利用微生物的生物学特性来测定食品、药品、营养补充剂等物质中叶酸含量的方法。
在此方法中,通常使用特定的微生物菌株(如粪链球菌ATCC 8043)作为指示生物,因为这些菌株的生长需要叶酸。
基本原理:1.培养基制备:制备一种特定的培养基,这种培养基除了叶酸以外的所有营养成分都需包含,以确保接种的微生物能够生长。
2.接种与培养:将待测样品或标准溶液接种到制备好的培养基上,然后在适宜的温度和湿度下培养。
3.生长观察:在培养过程中,如果样品中含有叶酸,那么粪链球菌等指示微生物就会生长。
4.结果判断:通过观察微生物的生长情况来判断样品中叶酸的含量。
通常,生长程度越强,表明样品中叶酸含量越高。
方法步骤:1.标准溶液制备:准备一系列不同浓度的叶酸标准溶液,用于制作标准曲线。
2.样品处理:将待测样品按照一定的方法处理,提取叶酸。
3.接种培养:将处理好的样品或标准溶液接种到培养基上,进行培养。
4.生长测定:通过比色、浊度计测量等方式,测定指示微生物的生长情况。
5.数据分析:将测定结果与标准曲线对比,计算样品中叶酸的含量。
注意事项:培养基的成分和制备方法需要严格按照标准进行,以确保结果的准确性。
接种和培养的条件(如温度、湿度、时间等)也需要严格控制。
微生物的生长可能会受到其他维生素和营养因素的影响,因此需要排除这些干扰因素。
在操作过程中,需要遵循无菌操作的原则,避免污染。
应用范围:叶酸测定微生物法不仅用于食品检测,还可用于医药、营养补充剂等领域的叶酸含量测定。
这种方法因其准确性和可靠性,被广泛应用于叶酸的定量分析。
但需要注意的是,具体操作时还需参照最新的国家标准和行业规范,确保检测结果的科学性和法律效力。
食品出厂检验原始记录表格

检验依据□GB4789.3-2010检验时间报告时间
稀释度
LST
BGLB
检验结果
MPN/100 g
标准值
单项判定
10mD3
1mL(g)>3
0.1mL(g)3
备注:“+”表示阳性结果,“一”表示阴性结果。
检验员:复核
1
十人‘扶埠□GB/5009.3(直接干燥法)检验报告
检验依据□其它时间时间
标准值
检验依据
测定用样液中亚硝酸 钠的质里Ai(ug)
试样质量m g
测定用样液体积Vi
(mL)
试样处理液总体积
Vo(mL)
1
2
试样中亚硝酸盐 的含量Xmg/kg
平均值(mg/kg)
结果
(mg/kg)
1.
2.
可 溶 性 无 盐 固 形 物
检验次数
实 测值
1
2
X2-样品中可溶性总固形物含量,g/100ml
m2-恒重后可溶性总固形物和称量瓶质量,g
样品名称: 样品数量: 批 量:
生产日期: 检验日期: 规 格:
1.
检验依据
检验时间
报告时间
项目
感官描述
符合
不符合
形态单项判定
3■
检验依据GB 4789.2-2010
检验时间报告时间
稀释度
10-2
10-3
空白
检验结CFU/ g
菌落数「
平均数
标准值CFU/ g单项判定
m1烘前皿样重,g
m2皿重,g
m3烘后皿样重,g
、八mi-m
水分%
m1-m2
x100
实测值
食品中叶酸的不确定度评定报告

食品中叶酸的不确定度评定报告测量不确定度是表征合理赋予被测量之值的分散性,与测量结果相联系的参数,其决定了测量结果的使用价值。
本分析方法根据GB5009.211-2014 《食品安全国家标准食品中叶酸的测定》的方法,建立叶酸的测定方法,进行不确定度的测量和评定,以期为评定测量结果质量提供科学依据。
1 材料与方法1.1材料与试剂1.2材料与试剂叶酸标准品:SUPELCO 500mg/瓶。
叶酸标准品:纯度≥99%。
氢氧化钠分析纯无水乙醇色谱纯叶酸测定培养基MRS培养基鼠李糖乳杆菌(ATCC 7469)1.3 仪器与设备分析天平:万分之一天平梅特勒-托利多仪器有限公司编号:Y-024 精确度0.0001g。
酶标仪:美国伯腾仪器有限公司Y-012超声波振荡器:湖南湘仪实验仪器开发有限公司F-038电热恒温培养箱:北京市永光明医疗仪器厂36℃±1℃ Y-003高压蒸汽灭菌器:121℃(0.10MPa-0.12MPa)Y-010离心机:转速≥3000r/min 湖南湘仪实验仪器开发有限公司Y-0331.4方法简述1.4.1准确称取固体试样1g,精确至0.001g。
转入100ml锥形瓶中,加入80ml氢氧化钠乙醇溶液,具塞,超声4h至试样完全溶解或分散,用水定容至刻度。
根据试样中叶酸含量用水对试样提取液进行适当的稀释,使试样稀释液中叶酸含量在0.2ng/ml-0.6ng/ml范围内。
所用试管使用前洗刷干净,沸水浴30min,沥干后放入盐酸浸泡液中浸泡2小时,经170±2℃烘干3h后使用。
1.4.2试样和酶空白系列管取3支试管,分别加入0.5ml 、1ml 、2.0ml 试样稀释液(V1),补水至5.0ml 。
加入5ml 叶酸测定用培养液,混匀。
制备3套以上系列管。
1.4.3标准系列管取试管分别加入标准工作液0.00ml 、0.25ml 、0.50ml 、1.00ml 、1.50ml 、2.00ml 、2.50ml 、3.00ml 、4.00ml 和5.00ml ,补水至5.00ml ,相当于标准系列管中叶酸含量为0.00ng 、0.05ng 、0.10ng 、0.20ng 、0.30ng 、0.40ng 、0.50ng 、0.60ng 、0.80ng 、1.00ng ,再加入5.0ml 叶酸测定培养液,混匀。
中国药典2020叶酸

中国药典2020叶酸《中国药典(2020年版)》中对叶酸的描述如下:- 化学名称:N-(4-((2-氨基-4-氧代-1,4-二氢-6-蝶啶)甲氨基)苯甲酰基)-L-谷氨酸。
- 化学式:C19H19N7O6。
- 相对分子质量:441.40。
- 性状:本品为黄色至橙黄色结晶性粉末;无臭。
在水、乙醇、丙酮、三氯甲烷或乙醚中不溶;在氢氧化钠试液或10%碳酸钠溶液中易溶。
- 比旋度:+18°至+22°。
- 鉴别:- (1)取本品约0.2mg,加0.4%氢氧化钠溶液10ml,振摇使溶解,加高锰酸钾试液1滴,振摇混匀后,溶液显蓝绿色;在紫外光灯下,显蓝绿色荧光。
- (2)取本品,加0.4%氢氧化钠溶液制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在256nm、283nm与365nm±4nm的波长处有最大吸收,在256nm与365nm波长处的吸光度比值应为2.8至3.0。
- (3)本品的红外光吸收图谱应与对照的图谱(光谱集93图)一致。
- 检查:- 有关物质:照高效液相色谱法(通则0512)测定。
避光操作。
供试品溶液的色谱图中,蝶酸与其他单个杂质峰面积均不得大于对照溶液主峰面积的0.6倍(0.6%),除蝶酸峰外各杂质峰面积之和不得大于对照溶液主峰面积的2倍(2.0%),小于对照溶液主峰面积0.05倍的峰忽略不计。
- 水分:取本品约0.1g,精密称定,加三氯甲烷-无水甲醇(4∶1)5ml,照水分测定法(通则0832第一法1)测定,含水分不得过8.5%。
- 炽灼残渣:不得过0.1%(通则0841)。
- 含量测定:照高效液相色谱法(通则0512)测定。
避光操作。
取本品约10mg,精密称定,置50ml量瓶中,加0.5%氨溶液约30ml溶解后,用水稀释至刻度,摇匀。
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GB/T 5009.211-2008食品中叶酸的测定
检出限
仪器名称
紫外可见分光光度计
仪器型号
754PC
仪器编号
N-12-06-009
仪器条件
波长540 nm 比色皿1 cm
环境条件
温度(℃):湿度(%RH):
分析步骤:
按照GB/T 5009.211-2008中6.1制备接种液,按7.1进行试样的处理提取,按需按7.2稀释,按照7.3制备测定管,按照7.4进行培养,按7.5步骤进行分析测定。操作需避光进行
标准曲线的绘制
标准溶液名称:叶酸标准工作液标准曲线工作液:0.200ng/ml
试管号
S1
S2
S3
S4
S5
S6
S7
S8
S9
S10
0.200ng/ml标准曲线工作液
0.00
0.25
0.50
1.00
1.50
2.00
2.50
3.00
4.00
5.00
叶酸含量ng
0.00
0.05
0.10
0.20
0.30
0.40
试样中叶酸含量ug/100g
a2
b2
c2
a3
b3
c3
计算公式:
————————————(1)
————————(2)
备注:
检验日期:
0.50
0.60
0.80
1.00
透光率两次测定均值%
回归方程
样品测定
提取液定容体积V2ml;
空白
吸取酶空白液液体积V1
透光率%
从曲线查得叶酸含量m3(ng)
酶液中叶酸含量m1(ng)
/
/
试样中叶酸含量X
ug/100g
相对偏差%
a1
b1
c1
序号
试样质量m(g)
稀释倍数f
吸取试样液体积V1
透光率%
从曲线查得叶酸含量m2(ng)
