2018年高考化学总复习:1-3章 含解析
2018年高考全国卷Ⅰ化学试题解析(解析版)
的贡献为1。
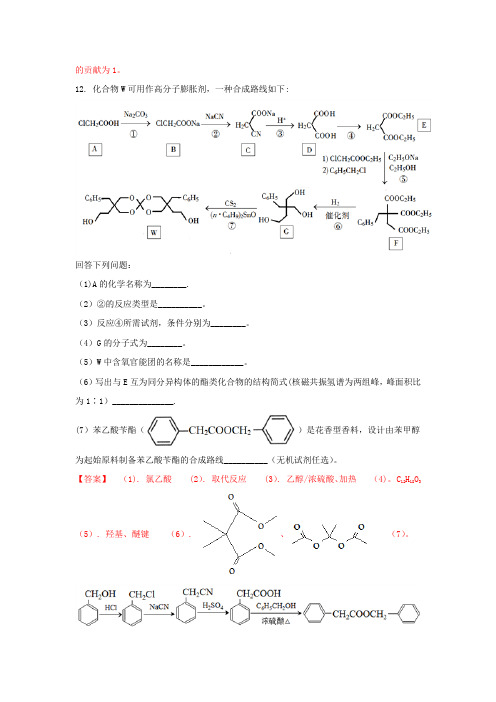
12. 化合物W可用作高分子膨胀剂,一种合成路线如下:回答下列问题:(1)A的化学名称为________.(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________.(7)苯乙酸苄酯()是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
【答案】(1). 氯乙酸 (2). 取代反应 (3). 乙醇/浓硫酸、加热(4)。
C12H18O3(5). 羟基、醚键(6). 、(7)。
【解析】分析:A是氯乙酸与碳酸钠反应生成氯乙酸钠,氯乙酸钠与NaCN发生取代反应生成C,C水解又引入1个羧基.D与乙醇发生酯化反应生成E,E发生取代反应生成F,在催化剂作用下F与氢气发生加成反应将酯基均转化为醇羟基,2分子G发生羟基的脱水反应成环,据此解答.详解:(1)根据A的结构简式可知A是氯乙酸;(2)反应②中氯原子被-CN取代,属于取代反应。
(3)反应④是酯化反应,所需试剂和条件分别是乙醇/浓硫酸、加热;(4)根据G的键线式可知其分子式为C12H18O3;(5)根据W的结构简式可知分子中含有的官能团是醚键和羟基;(6)属于酯类,说明含有酯基。
核磁共振氢谱为两组峰,峰面积比为1:1,说明氢原子分为两类,各是6个氢原子,因此符合条件的有机物结构简式为或;(7)根据已知信息结合逆推法可知合成苯乙酸卞酯的路线图为。
点睛:本题考查有机物的推断和合成,涉及官能团的性质、有机物反应类型、同分异构体的书写、合成路线设计等知识,利用已经掌握的知识来考查有机合成与推断、反应条件的选择、物质的结构简式、化学方程式、同分异构体的书写的知识。
考查学生对知识的掌握程度、自学能力、接受新知识、新信息的能力;考查了学生应用所学知识进行必要的分析来解决实际问题的能力。
2018年高考化学知识点总结

2018年高考化学知识点总结考点一把握分类标准,理清物质类别1.物质常见的分类情况2.氧化物的常见分类方法氧化物错误!3.正误判断,辨析“一定”与“不一定”(1)同种元素组成的物质一定是纯净物(×)(2)强碱一定是离子化合物,盐也一定是离子化合物(×)(3)碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物(√)(4)酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物(√)(5)能电离出H+的一定是酸,溶液呈碱性的一定是碱(×)(6)在酸中有几个H原子就一定是几元酸(×)(7)含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键(√)(8)盐中一定含金属元素(×)(9)能导电的一定是电解质,不导电的一定是非电解质(×)(10)强电解质的导电性一定大于弱电解质的导电性(×)4.识记常见混合物的成分与俗名(1)水煤气:CO、H2(2)天然气(沼气):主要成分是CH4(3)液化石油气:以C3H8、C4H10为主(4)裂解气:以C2H4为主(5)水玻璃:Na2SiO3的水溶液(6)王水:浓盐酸与浓硝酸的混合物(体积比3∶1)(7)波尔多液:主要成分是CuSO4和Ca(OH)2(8)肥皂:主要成分是C17H35COONa(9)碱石灰:NaOH、CaO(10)铝热剂:铝粉和金属氧化物的混合物(11)漂白粉:Ca(ClO)2和CaCl2的混合物考点一洞悉陷阱设置,突破阿伏加德罗常数应用一、抓“两看”,突破“状态、状况”陷阱一看“气体”是否处于“标准状况”。
二看“标准状况”下,物质是否为“气体”(如CCl4、H2O、Br2、SO3、HF、己烷、苯等在标准状况下不为气体)。
题组一气体摩尔体积的适用条件及物质的聚集状态1.正误判断,正确的划“√”,错误的划“×”。
(1)2.24 L CO2中含有的原子数为0.3N A(×)(2)常温下,11.2 L甲烷气体含有的甲烷分子数为0.5N A(×)(3)标准状况下,22.4 L己烷中含共价键数目为19N A(×)(4)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A(×)(2012·新课标全国卷,9D)(5)标准状况下,2.24 L HF含有的HF分子数为0.1N A(×)二、排“干扰”,突破“质量、状况”陷阱题组二物质的量或质量与状况2.正误判断,正确的划“√”,错误的划“×”。
2018版高中化学总复习资料(全)

化学第一轮复习——基础理论实质:有电子转移(得失与偏移) 特征:反应前后元素的化合价有变化还原性 化合价升高 弱氧化性↑还原剂氧化反应 氧化产物氧化剂 还原反应 还原产物↓ 氧化性 化合价降低 弱还原性氧化还原反应:有元素化合价升降的化学反应是氧化还原反应。
有电子转移(得失或偏移)的反应都是氧化还原反应。
概念: 氧化剂:反应中得到电子(或电子对偏向)的物质(反应中所含元素化合价降低物)还原剂:反应中失去电子(或电子对偏离)的物质(反应中所含元素化合价升高物) 氧化产物:还原剂被氧化所得生成物; 还原产物:氧化剂被还原所得生成物。
失电子,化合价升高,被氧化双线桥:氧化剂 + 还原剂 = 还原产物 + 氧化产物得电子,化合价降低,被还原电子转移表示方法 单线桥: 电子还原剂 + 氧化剂 = 还原产物 + 氧化产物 二者的主 表示意义、箭号起止 要区别: 电子数目等依据原则:氧化剂化合价降低总数=还原剂化合价升高总数找出价态变化,看两剂分子式,确定升降总数;方法步骤:求最小公倍数,得出两剂系数,观察配平其它。
有关计算:关键是依据氧化剂得电子数与还原剂失电子数相等,列出守恒关系式求解。
配平 氧化还原反应变化反应物→概念及转化关系→产物①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周期律) ②、由反应条件的难易比较;③、由氧化还原反应方向比较;(氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物) ④、根据(氧化剂、还原剂)元素的价态与氧化还原性关系比较。
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
①、活泼的非金属,如Cl 2、Br 2、O 2 等;②、元素(如Mn 等)处于高化合价的氧化物,如MnO 2、KMnO 4等氧化剂: ③、元素(如S 、N 等)处于高化合价时的含氧酸,如浓H 2SO 4、HNO 3 等④、元素(如Mn 、Cl 、Fe 等)处于高化合价时的盐,如KMnO 4、KClO 3、FeCl 3、 ⑤、过氧化物,如Na 2O 2、H 2O 2等。
2018年高考全国卷1化学试题答案解析

2018年高考全国卷1化学试题答案解析2018年高考全国卷1化学试题解析版硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属。
其回收流程如下:A。
合理处理废旧电池有利于保护环境和资源再利用。
B。
从正极片中可回收的金属元素有Al、Fe、Li。
C。
“沉淀”反应的金属离子为Fe3+。
D。
上述流程中可用硫酸钠代替碳酸钠。
答案:D解析:正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀,据此解答。
详解:废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用。
从流程的转化可知,从正极片中可回收的金属元素有Al、Fe、Li。
得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe。
硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠。
答案选D。
本题以废旧电池的回收为载体考查金属元素的回收,明确流程中元素的转化关系是解答的关键,题目难度不大。
在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是:A。
A。
B。
B。
C。
C。
D。
D答案:D详解:A、螺[2,2]戊烷与环戊烯分子式相同但结构不同,因此互为同分异构体,A正确;B、根据螺[2,2]戊烷分子中氢原子的种类可知,二氯代物最多有4种,B错误;C、螺[2,2]戊烷分子中的所有碳原子不处于同一平面,因为螺环结构中的碳原子存在空间位阻,C错误;D、生成1 mol C5H12需要10 mol H2因为螺[2,2]戊烷分子中有10个氢原子,氢原子守恒,D 正确。
答案选C。
点睛:本题考查对螺环化合物的基本概念和结构特点的理解,同时也考查了对氢原子守恒定律的应用。
注意选项B的干扰,需要根据分子中氢原子的种类进行判断。
A、螺[2,2]戊烷和环戊烯的分子式分别为C5H8虽然结构不同,但它们是互为同分异构体的关系,因此A 正确;B、分子中的8个氢原子完全相同,二氯代物中可以取代同一个碳原子上的氢原子,也可以取代相邻或不相邻的碳原子上的氢原子,所以二氯代物的种类超过两种,B正确;C、由于分子中4个碳原子均是饱和碳原子,而与饱和碳原子相连的4个原子一定构成四面体,因此分子中所有碳原子不可能均处在同一平面上,C错误;D、戊烷比螺[2,2]戊烷多4个氢原子,因此生成1 mol C5H12至少需要2 mol H2D正确。
2018年高考全国卷Ⅲ理综化学试题解析(精编版)(解析版)

2018 年普通高等学校招生全国统一考试理科综合能力测试试题卷(化学)注意事项:1.答卷前,考生务必将自己的姓名、准考证填写在答题卡上。
2.作答时,务必将答案写在答题卡上。
写在本试卷及草稿纸上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 P 31 S 32 Fe 56 一、选择题 1. 化学与生活密切相关。
下列说法错误的是A. 泡沫灭火器可用于一般的起火,也适用于电器起火B. 疫苗一般应冷藏存放,以避免蛋白质变性C. 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境D. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法【答案】 A【解析】分析:本题考查的是化学知识在具体的生产生活中的应用,进行判断时,应该先考虑清楚对应化 学物质的成分,再结合题目说明判断该过程的化学反应或对应物质的性质即可解答。
详解: A .泡沫灭火器中加入的主要是碳酸氢钠和硫酸铝溶液,两者混合的时候发生双水解反应,生成大量 的二氧化碳气体泡沫,该泡沫喷出进行灭火。
但是,喷出的二氧化碳气体泡沫中一定含水,形成电解质溶 液,具有一定的导电能力,可能导致触电或电器短路, A 错误。
B .疫苗是指用各类病原微生物制作的用于预防接种的生物制品。
由于疫苗对温度比较敏感,温度较高时, 会因为蛋白质变性,而失去活性,所以疫苗一般应该冷藏保存, B 正确。
C .油性漆是指用有机物作为溶剂或分散剂的油漆;水性漆是指用水作为溶剂或分散剂的油漆,使用水性漆 可以减少有机物的挥发对人体健康和室内环境造成的影响, C 正确。
D .电热水器内胆连接一个镁棒,就形成了原电池,因为镁棒比较活泼所以应该是原电池的负极,从而对正 极的热水器内胆 (多为不锈钢或铜制) 起到了保护作用, 这种保护方法为: 牺牲阳极的阴极保护法, 点睛:本题是一道比较传统的化学与生产生活相关的问题,需要学生能够熟悉常见化学物质的性质和用途,同时能用化学原理解释生产生活中的某些过程。
(完整word版)2018高考理综化学部分(含答案),推荐文档

2018高考理综化学部分(含答案)7.磷酸亚铁锂(LiFePOQ电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:好2LNaAlO滤液小生L►沉淀止赎1 H S。
,HNO L含L、P、Fe等滤液------ 通标懵」含曲暇亚铁锂滤清…」「谑一碟酸帔■含Li沉淀L■炭黑等窿渣下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用8.从正极片”中可回收的金属元素有Al、Fe、LiC.沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B .酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br2/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10. N A是阿伏加德罗常数的值。
下列说法正确的是A . 16.25 g FeCl3水解形成的Fe (OH)3胶体粒子数为0.1 N AB.22.4 L (标准状况)僦气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为 1.0N AD. 1.0 mol CH 4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A11.环之间共用一个碳原子的化合物称为螺环化合物,螺 [2, 2]戊烷(,X该化合物的说法错误的是学 &科网A .与环戊烯互为同分异构体 B.二氯代物超过两种 C.所有碳原子均处同一平面D.生成1 mol C 5H 12至少需要 2 mol H 212 .主族元素 W 、X 、Y 、Z 的原子序数依次增加,且均不大于20。
W 、X 、Z 最外层电子数之和为 10; W与Y 同族;W 与Z 形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是A .常温常压下X 的单质为气态B . Z 的氢化物为离子化合物C. Y 和Z 形成的化合物的水溶液呈碱性 D . W 与Y 具有相同的最高化合价13 .最近我国科学家设计了一种 CO 2+H 2s 协同转化装置,实现对天然气中CO 2和H 2s 的高效去除。
【高考必备资料】2018年全国各地化学高考真题汇总Word版含解析

【高考必备资料】2018年全国各地化学高考真题汇总2018年全国各套解析版化学高考真题页码范围如下:2018年高考真题——理综化学部分(全国Ⅰ卷)……………………第2~12页2018年高考真题——理综化学部分(全国II卷)……………………. 第13~25页2018年高考真题——理综化学部分(全国Ⅲ卷)……………………第26~37页2018年高考真题——理综化学部分(北京卷)………………………. 第38~51页2018年高考真题——理综化学部分(天津卷)………………………. 第52~62页2018年高考真题——理综化学部分(江苏卷)………………………. 第63~85页2018年高考真题——理综化学部分(海南卷)………………………. 第86~93页绝密★启用前2018年普通高等学校招生全国统一考试(全国Ⅰ卷)理科综合能力测试(化学部分)注意事项:1.答卷前,考生务必将自己的姓名和座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:本题共7个小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】分析:正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀,据此解答。
2018年高考化学知识点总结

考点一把握分类标准,理清物质类别1.物质常见的分类情况2.氧化物的常见分类方法氧化物⎩⎪⎪⎪⎨⎪⎪⎪⎧按组成元素⎩⎨⎧金属氧化物:如K2O、CaO、Fe2O3非金属氧化物:如SO2、CO2、SO3、P2O5按性质⎩⎪⎨⎪⎧成盐氧化物⎩⎨⎧酸性氧化物:如CO2、SO3碱性氧化物:如Na2O、CuO两性氧化物:如Al2O3不成盐氧化物:如CO、NO特殊氧化物:如Fe3O4、Na2O2、H2O23.正误判断,辨析“一定”与“不一定”(1)同种元素组成的物质一定是纯净物(×)(2)强碱一定是离子化合物,盐也一定是离子化合物(×)(3)碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物(√)(4)酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物(√)(5)能电离出H+的一定是酸,溶液呈碱性的一定是碱(×)(6)在酸中有几个H原子就一定是几元酸(×)(7)含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键(√)(8)盐中一定含金属元素(×)(9)能导电的一定是电解质,不导电的一定是非电解质(×)(10)强电解质的导电性一定大于弱电解质的导电性(×)4.识记常见混合物的成分与俗名(1)水煤气:CO、H2(2)天然气(沼气):主要成分是CH4(3)液化石油气:以C3H8、C4H10为主(4)裂解气:以C2H4为主(5)水玻璃:Na2SiO3的水溶液(6)王水:浓盐酸与浓硝酸的混合物(体积比3∶1)(7)波尔多液:主要成分是CuSO4和Ca(OH)2(8)肥皂:主要成分是C17H35COONa(9)碱石灰:NaOH、CaO(10)铝热剂:铝粉和金属氧化物的混合物(11)漂白粉:Ca(ClO)2和CaCl2的混合物考点一洞悉陷阱设置,突破阿伏加德罗常数应用一、抓“两看”,突破“状态、状况”陷阱一看“气体”是否处于“标准状况”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时1 物质的量 气体摩尔体积 [2018备考·最新考纲]
1.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、阿伏加德罗常数的含义。
2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
考点一 物质的量 摩尔质量 (考点层次A →自学、识记、辨析)
1.物质的量、摩尔、阿伏加德罗常数
(1)基本概念间的关系
说明:可以和其它物理量及单位对比讲解。
(2)物质的量的表示方法
x mol H 2SO 4 ↓ ↓ ↓
数值 单位 指定化学式或微粒名称 例如:0.2 mol H 2,3 mol H 2O 等。
提醒:①摩尔后面应为确切的微粒名称;如1 mol 氢(不确切)和1 mol 大米(宏观物质)皆为错误说法。
②6.02×1023是个纯数值没有任何物理意义,而阿伏加德罗常数(N A )是指1 mol 任何微粒所含的粒子数,它与0.012 kg 12C 所含的碳原子数相同,数值约为6.02×1023。
(3)物质的量与微粒个数、阿伏加德罗常数之间的关系
应用:已知物理量――→计算物质的量――→依据组成
计算微粒数目 2.摩尔质量
提醒:(1)相对原子(或分子)质量与摩尔质量不是同一个物理量,单位不同,只是在数值上相等。
(2)摩尔质量也等于N A m 0(m 0为单个粒子的质量)。
(3)注意掌握气体摩尔质量的求算:①标况密度法:M =22.4 L ·mol -1×ρ g ·L
-1。
②相对密度法:例如M r =ρ(对空气)×29。
教材 VS
高考
1.(RJ 必修1·P 17)在0.5 mol Na 2SO 4中含有离子和氧原子的物质的量分别是
( )
A .1.5 mol 0.5 mol
B .1.5 mol 2 mol
C .0.5 mol 4 mol
D .1 mol 2 mol
解析 在0.5 mol Na 2SO 4中含有Na +的物质的量是1 mol 、SO 2-4的物质的量是
0.5 mol ,离子的总物质的量为1.5 mol ,氧原子的物质的量为0.5 mol ×4=2 mol 。
答案 B
2.(LK 必修1·P 21迁移应用改编)填空
3.(溯源题)(1)(2015·课标全国Ⅰ,8)N A 为阿伏加德罗常数的值。
判断下列说法是否正确
(1)18 g D 2O 和18 g H 2O 中含有的质子数均为10N A (×) (2)2 L 0.5 mol ·L -1
亚硫酸溶液中含有的H +
离子数为2N A (×)
(3)过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2N A (√) (4)密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A (×) 探源:本考题源于RJ 必修1 P 13“学与问”及拓展,对物质的量、质量、微粒数及摩尔质量等关系进行考查,突出了物质的量在转换过程中的桥梁作用。
[诊断性题组]
1.易混概念判断,对的打“√”错误的打“×” (1)摩尔是表示物质的量多少的基本物理量(×) (2)物质的量就是1 mol 物质的质量(×)
(3)0.012 kg 12C 中含有约6.02×1023个碳原子(√) (4)1 mol H 2O 中含有2 mol 氢和1 mol 氧(×) (5)氢氧化钠的摩尔质量是40 g(×)
(6)2 mol 水的摩尔质量是1 mol 水的摩尔质量的2倍(×) (7)18 g 水含有10N A 个质子(√) (8)1 mol OH -的质量为17 g ·mol -1(×) (9)CO 、N 2、C 2H 4的摩尔质量都是28(×) (10)84 g NaHCO 3中离子总数为2N A (√)
2.(名师原创)有以下四种气体 ①3.01×1023个HCl 分子 ②13.6 g H 2S ③2g D 2 ④0.2 mol NH 3。
下列关系正确的是( ) A .质量:②>①>④>③ B .分子个数:①>③>②>④。
