蛋白质等电点测定
蛋白质等电点的测定实验报告

蛋白质等电点的测定实验报告一、实验目的。
本实验旨在通过离子交换色谱法测定蛋白质的等电点,探究蛋白质在不同 pH 条件下的电荷状态变化,进而确定蛋白质的等电点。
二、实验原理。
蛋白质的等电点是指蛋白质在溶液中呈电中性的 pH 值。
在等电点条件下,蛋白质的带电量最小,导致其在电场作用下停止迁移。
本实验采用离子交换色谱法,利用色谱柱对蛋白质在不同 pH 条件下的迁移情况进行监测,从而确定蛋白质的等电点。
三、实验步骤。
1. 将色谱柱连接至色谱仪,并进行平衡处理;2. 取一定浓度的蛋白质溶液,分别调节 pH 值至不同条件下;3. 将不同 pH 条件下的蛋白质溶液加入色谱柱,进行色谱分离;4. 监测蛋白质在色谱柱中的迁移情况,记录不同 pH 条件下的保留时间;5. 根据实验数据绘制蛋白质的等电点曲线,确定蛋白质的等电点。
四、实验数据及结果分析。
通过实验数据处理和分析,我们得到了不同 pH 条件下蛋白质的保留时间,绘制出了蛋白质的等电点曲线。
通过曲线的交叉点,我们可以确定蛋白质的等电点为X。
五、实验结论。
根据实验结果,我们成功测定出了蛋白质的等电点为 X。
这一结果对于进一步研究蛋白质的性质和功能具有重要意义。
六、实验总结。
本实验通过离子交换色谱法测定蛋白质的等电点,取得了较好的实验结果。
然而,在实验过程中仍然存在一些问题,例如实验操作的精度和准确度有待提高。
未来我们将进一步完善实验方法,提高实验数据的可靠性和准确性。
七、参考文献。
1. Smith, A. B., & Jones, C. D. (2017). A review of protein isoelectric focusing: methods, applications, and advances. Critical Reviews in Biotechnology, 37(4), 399-408.2. Wang, L., & Smith, R. (2019). Determination of protein isoelectric point by capillary isoelectric focusing. Journal of Chromatography A, 1601, 132-137.八、致谢。
蛋白质等电点测定
蛋白质等电点测定及性质实验一、目的:了解等电点的意义及其与蛋白质分子聚沉能力的关系。
初步学会测定蛋白质等电点的基本方法,了解蛋白质的性质。
二、原理:固体颗粒在液体中为什么能够带电?当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,由于电中性的要求,带电表面附近的液体中必有与固体表面电荷数量相等但符号相反的多余的反离子。
在界面上带电表面和反离子形成了双电层的结构。
在两种不同物质的界面上,正负电荷分别排列成的面层。
对于双电层的具体结构,一百多年来不同学者提出了不同的看法。
最早于1879年Helmholz提出平板型模型;1910年Gouy和1913年Chapman修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型。
根据O.斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用(例如范德华力)而和表面紧密结合,构成吸附层(或称紧密层、斯特恩层)。
其余的离子则扩散地分布在溶液中,构成双电层的扩散层(或称滑移面)。
由于带电表面的吸引作用,在扩散层中反离子的浓度远大于同号离子。
离表面越远,过剩的反离子越少,直至在溶液内部反离子的浓度与同号离子相等。
紧密层:溶液中反离子及溶剂分子受到足够大的静电力,范德华力或特性吸附力,而紧密吸附在固体表面上。
其余反离子则构成扩散层。
滑动面:指固液两相发生相对移动的界面,是凹凸不平的曲面。
滑动面至溶液本体间的电势差称为ζ电势。
固体颗粒带电量的大小及测量方式?ζ电势只有在固液两相发生相对移动时才能呈现出来。
ζ电势的大小由Zeta电位表示,其数值的大小反映了胶粒带电的程度,其数值越高表明胶粒带电越多,扩散层越厚。
一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应的pH值即为等电点。
对于蛋白质分子来说:蛋白质分子的大小在胶粒范围内,约1~100微米。
蛋白质等电点的测定实验原理

蛋白质等电点的测定实验原理蛋白质是一种重要的生物大分子,其功能和结构都与其电荷特性密切相关。
蛋白质的等电点(isoelectric point,pI)是指在一定条件下,蛋白质具有净电荷为零的pH值。
蛋白质等电点的测定实验原理主要基于蛋白质的电荷特性。
蛋白质分子由氨基酸组成,氨基酸在不同pH值下会带有不同的电荷。
当溶液的pH小于蛋白质等电点时,溶液中的氢离子浓度高于氢离子的解离平衡,蛋白质会带正电荷;当溶液的pH大于蛋白质等电点时,溶液中的氢离子浓度低于氢离子的解离平衡,蛋白质会带负电荷。
只有当溶液的pH等于蛋白质的等电点时,蛋白质带的电荷为零。
蛋白质等电点的测定实验通常采用凝胶电泳技术。
实验首先需要制备一系列pH值递增的缓冲液,将这些缓冲液倒入一个凝胶胶槽中,形成一个pH梯度。
接下来,将待测蛋白质样品与一种带负电荷的实验辅助物质,通常是SDS(十二烷基硫酸钠),混合并进行变性处理。
然后将混合样品加载到凝胶胶槽中,并通电使蛋白质在凝胶中进行迁移。
在凝胶胶槽中,蛋白质会在电场作用下向凝胶胶槽两端的电极迁移。
当蛋白质的pH低于等电点时,蛋白质呈现带有正电荷的状态,会向负极迁移;当蛋白质的pH高于等电点时,蛋白质呈现带有负电荷的状态,会向正极迁移。
只有当蛋白质的pH等于等电点时,电荷为零,蛋白质停止迁移,即在凝胶上形成一个落花电点。
这时,在凝胶上可以看到蛋白质在凝胶中的分离位置,通过分析这个位置可以确定蛋白质的等电点。
蛋白质等电点的测定实验可以通过不同方法进一步优化。
常用的方法有改变凝胶胶槽中的pH梯度范围,改变实验辅助物质的类型和浓度,以及改变电场强度和时间等。
蛋白质等电点的测定是非常重要的,它对于理解蛋白质的电荷状态、性质以及在生物学过程中的功能有着深远的影响。
例如,在药物研发和基因工程中,等电点的测定可以用于纯化和分离蛋白质,同时也可以用于研究蛋白质的结构和功能。
因此,掌握蛋白质等电点的测定方法,对于生物化学和生物技术领域的研究具有重要的指导意义。
实验三蛋白质的等电点测定和沉淀反应

❖ 3 蛋白质的沉淀与变性的关系?
放映结束 感谢各位的批评指导!
谢 谢!
让我们共同进步
❖ 操作步骤
❖ 〔一酪蛋白等电点的测定 ❖ 1 取同样规格的试管4支,按下表顺序分别精确地加
入各试剂,然后混匀; ❖ 2 向以上试管中各加酪蛋白的醋酸钠溶液1mL,加一
管,摇匀一管.此时1、2、3、4管的pH依次为5.9、5.5、 4.7、3.5.观察其混浊度.静置10分钟后,再观察其混浊度. 最混浊的一管pH即为酪蛋白的等电点.
❖ 〔二蛋白质的沉淀
❖
在水溶液中的蛋白质分子由于表面生成水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质
颗粒可因失去电荷和脱水而沉淀.
❖
蛋白质的沉淀反应可分为两类.
❖ 〔1可逆的沉淀反应 此时蛋白质分子的结构尚未发生显著变化,除去引起沉淀的因素后,蛋白质的沉淀仍能溶解于原来溶 剂中,并保持其天然性质而不变性.
实验三 蛋白质的等电点测定和沉淀反应
实验目的
1、了解蛋白质的两性解离性质. 2、学习测定蛋白质等电点的一
种方法. 3、加深对蛋白质胶体溶液稳定
因素的认识. 4、了解沉淀蛋白质的几种方法
实验原理
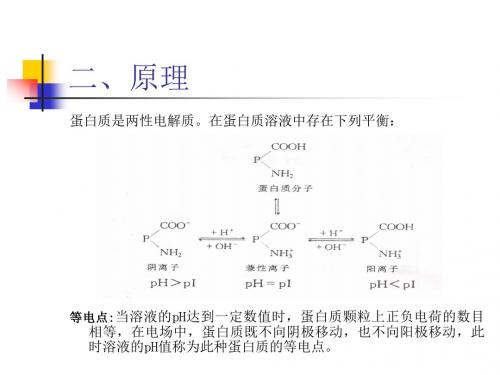
〔一蛋白质是两性电解质.在蛋白 质溶液中
存在下列平衡:
电场中移向阴极
不移动
移向阳极
❖ 蛋白质的等电点: 蛋白质分子的解离状态和解离程度 受溶液的酸碱度影响.当溶液的pH达到一定数值时,蛋 白质颗粒上正负电荷的数目相等,在电场中,蛋白质既 不向阴极移动,也不向阳极移动,此时溶液的pH值称为 此种蛋白质的等电点.
❖ 不同蛋白质各有特异的等电点.在等电点时,蛋白 质的理化性质都有变化,可利用此种性质的变化测定各 种蛋白质的等电点.最常用的方法是测其溶解度最低时 的溶液pH值.
蛋白质等电点的测定

蛋白质等电点的测定蛋白质是生命体内构成最广泛的一类生物大分子,具有各种生物功能。
在生物体内,蛋白质具有正负电荷,并在不同PH值的溶液中表现出不同的电性质。
蛋白质在pH等于其等电点时,蛋白质的电荷处于中性状态,亦是纯蛋白质最稳定的情况,因此准确测定蛋白质等电点对于分离、纯化和鉴定蛋白质具有重要意义。
本文中将介绍三种测定蛋白质等电点的方法。
方法1. 等电点电泳法等电点电泳法是一种电泳分离方法,利用蛋白质在不同pH值下的电荷变化探测其等电点。
该方法的原理为将蛋白质经过电泳分离,直到电泳缓冲液pH等于蛋白质的等电点,此时蛋白质处于中性带中心。
与常规电泳仪不同的是,该仪器在酸性电极和碱性电极之间加入溶液,以确保酸碱缓冲系统能够维持所需的pH值。
等电点电泳法可以快速而准确地测定蛋白质等电点,但需要特殊仪器和耗时较长,且样品纯度较高。
方法2. 等电聚焦法等电聚焦法是一种电泳技术,利用在连续的pH梯度中,使具有等电点的蛋白质依次停止迁移,从而分离蛋白质。
该方法的原理是,利用蛋白质在不同pH值下的等电点特性,将样品置于pH梯度中,通过电压控制,使蛋白质在等电点处停止迁移,从而实现蛋白质分离。
等电聚焦法具有高分辨率和高分离效率,同时还可以同时分离出等电点相似但分子量不同的蛋白质,但样品量较小,需要特殊仪器和大量控制。
方法3. pH梯度管柱法pH梯度管柱法是一种可溶性蛋白质的标准测定方法,也是等电点法中最广泛应用的方法之一。
该方法的基本原理是,在含有不同pH值的缓冲液梯度的柱子上,蛋白质会在不同的pH值时呈现出不同的电荷状态。
在pH值等于其等电点时,蛋白质处于中性状态,停止迁移。
通过检测蛋白质在不同pH值下的吸收值,可以确定样品的等电点。
pH梯度管柱法的优点包括样品量较大,操作简单,数据可靠,但分辨率较低,需要特殊的柱子。
三种测定蛋白质等电点的方法各有侧重,实验操作难度大小也不同,一般来说,选择合适的测定方法应根据样品特点和实验条件。
蛋白质等电点的测定(“蛋白质”相关文档)共8张

实验步骤
(2) 向以上试管中各加酪蛋白的醋酸钠溶液1毫升, 加一管,摇句一管。此时1、2、3、4管的pH值依 次为5.9、5.3、4.7、3.5。观察其混浊度。静置 10分钟后,再观察其混浊度。最混浊的一管锅、温度计、200毫升锥形瓶、100毫升容量瓶、
吸管、试管、试管架、乳钵
试剂: (1)0.4%酪蛋白醋酸钠溶液 (2)1.00摩尔/升醋酸溶液 (3)0.10摩尔/升醋酸溶液
(4)0.01摩尔/升醋酸溶液
水浴锅、温度计、200毫升锥形瓶、100毫升容量瓶、吸管、试管、试管架、乳钵 用醋酸与酷酸钠(醋酸钠混合在酪蛋白溶液中)配制成各种不同pH值的缓冲液。 10摩尔/升醋酸溶液 本向实诸验 缓借冲观溶察液在中不加同入酪pH蛋溶白液后中,的沉溶淀解出度现以最测多定的酪缓蛋冲白液的的等p电H点值。即为酪蛋白的等电点。 此时1、2、3、4管的pH值依次为5. 用醋酸与酷酸钠(醋酸钠混合在酪蛋白溶液中)配制成各种不同pH值的缓冲液。 在向蛋诸白 缓质冲溶液中存加在入下酪列蛋平白衡后:,沉淀出现最多的缓冲液的pH值即为酪蛋白的等电点。 (021)摩向尔以/上升试醋管酸中溶各液加酪蛋白的醋酸钠溶液1毫升,加一管,摇句一管。 此4%时酪1、蛋2白、醋3酸、钠4管溶的液pH值依次为5. 00摩尔/升醋酸溶液 0(21)摩向尔以/上升试醋管酸中溶各液加酪蛋白的醋酸钠溶液1毫升,加一管,摇句一管。 向00诸摩缓尔冲/溶升液醋中酸加溶入液酪蛋白后,沉淀出现最多的缓冲液的pH值即为酪蛋白的等电点。 本用实醋验 酸借与观酷察酸在钠不(醋同酸p钠H溶混液合中在的酪溶蛋解白度溶以液测中定)配酪制蛋成白各的种等不电同点pH。值的缓冲液。 01摩尔/升醋酸溶液 4%酪蛋白醋酸钠溶液 (2) 向以上试管中各加酪蛋白的醋酸钠溶液1毫升,加一管,摇句一管。
蛋白质等电点的测定

百泰派克生物科技
蛋白质等电点的测定
蛋白质表面存在一些酸碱性离子基团,如氨基、羧基、酚基、巯基等,因此蛋白质与氨基酸一样本身带有净电荷。
在不同pH的溶液中解离所带的正负电荷不同,在
某一pH值的溶液中,其解离的正负电荷相等,这时溶液的pH值就称为蛋白的等电点(isoelectric point, pI)。
蛋白质的等电点与其空间结构有关,因此对于某一特定蛋白质来说其等电点也是固定的。
当蛋白质处于与其等电点相同pH的溶液中时,在该溶液中的溶解度最小,可以从
溶液中沉淀出来,故蛋白质等电点常用于蛋白质的分离和提纯。
蛋白等电点的测定方法有传统的沉淀法和经典的等电聚焦法等。
沉淀法利用蛋白质在等电点时溶解度最低的原理,在醋酸与醋酸钠配制的不同pH
缓冲液中加入待测的样品蛋白质,比较其在不同pH的缓冲液中的沉淀量,沉淀量
最多的缓冲液所对应的pH就是该蛋白的等电点。
等电聚焦法利用蛋白质在等电点时净电荷为零的原理将待测蛋白质在特殊的缓冲液中进行聚丙烯凝胶电泳,这种特殊的缓冲液为两性电解质,可以在凝胶内形成连续的pH梯度,当电泳完毕时,蛋白质迁移到的位置对应的pH就是该蛋白质的等电点。
百泰派克生物科技基于毛细导管等电聚焦(cIEF)提供蛋白等电点的测定一站式技术服务,适用于多种氨基酸、多肽、重组蛋白、酶类、单克隆抗体等样品的等电点测定,欢迎免费咨询。
实验八 蛋白质的等电点测定和沉淀反应

(二)实 验 原 理
水溶液中的氨基酸为两性离子,因而不能直接
用碱滴定氨基酸的羧基。用甲醛处理氨基酸,甲醛
生 物
与氨基结合,可形成—NH—CH2OH,—N(CH2—OH)2等
化 羟甲基衍生物,使NH3+上的H+游离出来,这样就可
学
实 用碱滴定NH3+放出的H+,测出氨基氮,从而计算氨
在第2、3号管中加一滴甲基红,在分别用
0.1mol/L醋酸溶液和0.2mol/L碳酸钠溶液中和之。
观察各管颜色的变化和沉淀的生成。每管再加
0.1mol/LHCL溶液数滴,观察沉淀的再溶解。溶
生 物
解后各试管调pH至7后加入乙醇1mL。解释各管发
化 生的全部现象。
学
实
验
三思考题
1.名词解释:
水化层;双电层;蛋白质变性;盐溶与盐析;蛋白 质等电点沉淀。
甲醛滴定法常用以测定蛋白质水解程度,随着水解 程度的增加,滴定值增加,当水解完全后,滴定值即保
实 持恒定。
验
四 甲醛滴定法(补充材料)
(三)操 作 方 法
取一只烧杯,加入甲醛溶液50ml,加0.5% 酚酞指示剂约3ml,滴加0.1mol/LNaOH溶液, 使溶液成为微粉红色,临用前中和。取3只锥 形瓶,按下表操作。
由于电位离子的静电引 力,在其周围又吸附了 大量的异号离子,形成 了所谓的“双电层”。
二 蛋白质的沉淀及变性
(三)操 作 方 法
1、蛋白质的盐析
加5%卵清蛋白溶液5ml于试管中,再加等量
的饱和硫酸铵溶液,混匀后静置数分钟则析出
球蛋白的沉淀。倒出少量混浊沉淀,加少量水
生 物
实验一 蛋白质的等电点测定和沉淀反应
4、有机溶剂沉淀蛋白质
取1支试管,加入2mL蛋白质溶液,再加入2mL95%乙 醇。观察沉淀的生成(如果沉淀不明显,加点NaCl, 混匀。
5、乙醇引起的变性与沉淀
取3支试管,编号。依下表顺序加入试剂
1.向各管内加水4ml,在2,3管内各加一滴甲基红
2.第二管中用0.1mol/L醋酸溶液中和。第三管用0.05mol/L碳酸钠溶液 中和,观察各管的颜色变化和沉淀生成
2、重金属离子沉淀蛋白质
重金属离子与蛋白质结合成不溶于水的复合物。 取1支试管,加入蛋白质溶液2mL,再加3%硝酸银溶液 1—2滴,振荡试管,有沉淀产生。放置片刻,倾去上 清液,向沉淀中加入少量的水,沉淀是否溶解?为什 么?
3、某些有机酸沉淀蛋白质
取1支试管,加入蛋白质溶液2mL,再加入1ml5%三氯 乙酸溶液,振荡试管,观察沉淀的生成。放置片刻倾 出清液,向沉淀中加入少量水,观察沉淀是否溶解。
二、原理
蛋白质是两性电解质。在蛋白质溶液中存在下列平衡:
等电点 : 当溶液的pH 达到一定数值时,蛋质颗粒上正负电荷的数目
相等,在电场中,蛋白质既不向阴极移动,也不向阳极移动,此 时溶液的pH值称为此种蛋白质的等电点。
1. 四、操作步骤
(一)酪蛋白等电点的测定 (1)取同样规格的试管4支,加入各试剂,然后混匀。此时 4个管的pH依次为5.9、5.5、4.7、3.5。
(2)各加酪蛋白的醋酸钠溶液1mL, 加一管,摇匀一管。观 察其混浊度。静置10分钟后,再观察其混浊度。最混浊的一 管pH即为酪蛋白的等电点。
(二)蛋白质的沉淀及变性 1、蛋白质的盐析
蛋白质的盐析: 无机盐(硫酸铵、硫酸钠、氯化钠等)的浓溶液能 析出蛋白质。盐的浓度不同,析出的蛋白质也不同。如球蛋白可 在半饱和硫酸铵溶液中析出,而清蛋白则在饱和硫酸铵溶液中才 能析出。 盐溶:由盐析获得的蛋白质沉淀,当降低其盐类浓度时,又能再溶 解,故蛋白质的盐析作用是可逆过程。 于试管中加入蛋白质溶液5mL ,再加等量的饱和硫酸铵溶液,混 匀后静置数分钟则析出球蛋白的沉淀。倒出少量混浊沉淀,加少 量水,观察是否溶解,为什么?将管内容物过滤,向滤液中添加 硫酸铵粉末到不再溶解为止。此时析出沉淀为清蛋白。取出部分 清蛋白,加少量蒸馏水,观察沉淀的再溶解。
实验7 蛋白质的等电点测定与沉淀反应

沉淀溶 观察现象 解情况
为什么
2ml
2ml 2ml
3%AgNO3
5%三氯乙酸 9 5%乙醇
加热沉点蛋白质 几乎所有的蛋白质都因加熱变性而凝固,变成 不可逆的不溶状态。盐类和氢离子浓度对蛋白质加 热凝固有重要影响。少量盐类促进蛋白质的加热凝 固。当蛋白质处于等电点时,加热凝固最完全、最 迅速。在酸性或碱性溶液中,蛋白质分子带正电荷 或负电荷,虽加热蛋白质也不会凝固。若同时有足 量的中性盐存在,则蛋白质可因加热而凝固。
冲液的pH值即为酪蛋白的等电点。
三、器材
1.水浴锅 2.温度计 3.200mL锥型瓶 4.100mL容量瓶 5.吸管 6.试管及试管架 8.小玻璃漏斗 9.500mL烧杯 10.10 mL量筒。 滤纸,玻璃棒,
四.试剂: 1. 2. 3. 4. 0.4%酪蛋白醋酸钠溶液 1.00mol/L醋酸溶液 0.10mol/L醋酸溶液 0.01mol/L醋酸溶液 200mL 100mL 100mL 50mL
2.重金属离子沉淀蛋白质 重金属离子与蛋白质结合成不溶 于水的复合物。解毒 取1支试管,加入蛋白质溶液2 ml,再加3%硝酸银溶液 1~2滴,振荡试管,有沉淀产生。放置片刻,倾去上清液, 向沉淀中加入少量的水,沉淀是否溶解?为什么? 3.某些有机酸沉淀蛋白质 取试管加蛋白质溶液2 ml,再加 1 ml 5%三氯乙酸溶液,振荡试管,观察沉淀的生成。放 置片刻,倾出上清液,向沉淀中加入少量水,观察沉淀是 否溶解。三氯乙酸和磺基水杨酸能将血清等生物体液中的 蛋白质完全除去,因此得到广泛使用。生物碱中常用鞣酸、 苦味酸、磷钨酸等。 4.有机溶剂沉淀蛋白质 取试管加2 ml蛋白质溶液,再加入 2 ml 95%乙醇。混匀,观察沉淀的生成。
振摇混匀后,观察各管有何变化。放置片 刻,向各管内加水8 ml,然后在第2、3号管 中各加一滴甲基红,再分别用0.1 mol· L-1醋酸 溶液及0.05 mol· L-1碳酸钠溶液中和之。观察 各管颜色的变化和沉淀的生成。每管再加0.1 mol· L-1盐酸溶液数滴,观察沉淀的再溶解。 解释各管发生的全部现象。
蛋白质的等电点测定与沉淀实验

实验项目一、蛋白质的等电点测定及沉淀反应姓名:指导教师:实验室:组员:成绩:第三部分:实验记录与分析实验现象记录及分析:(一)蛋白质等电点测定(二)蛋白质的盐析1.蛋白质的盐析2.重金属离子沉淀蛋白质3.有机酸沉淀蛋白质4.有机溶剂沉淀蛋白质5.乙醇引起的变性与沉淀第四部分:课后研讨题1.通过本次合作实验后,有否对该项目改进的合理建议。
适当增加对照组和空白组,使实验数据更加科学可信。
2.鸡蛋清为何可做铅、汞中毒的解素剂?铅、汞是重金属离子,与蛋白质结合能使蛋白质分子内部结构发生重大改变,发生变性而沉淀,不再溶于原来的溶剂中。
3.氯化汞为何能做为杀菌剂?细菌由蛋白质构成,氧化汞是重金属盐,与蛋白质结合能使蛋白质分子内部结构发生重大改变,发生变性而沉淀,不再溶于原来的溶剂中。
4.在等电点时,蛋白质溶液为什么容易发生沉淀?蛋白质颗粒上正负电荷的数目相等,在水溶液中的蛋白质分子由于表面生产水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质颗粒可因失去电荷和脱水而沉淀。
5.将本实验中所涉及到的几种蛋白质沉淀方法各举一应用实例加以说明。
(1)盐析:硫酸铵的浓溶液能析出蛋白质。
(2)乙醇引起的变性与沉淀:低温下用乙醇或丙酮短时间作用于蛋白质,用于提纯蛋白质。
(3)重金属离子沉淀蛋白质:取一支离心管,加入2ml的蛋白质溶液,再加入3%硝酸银溶液1-2滴,振荡试管,观察现象。
(4)某些有机酸沉淀蛋白质:取一支离心管,加入2ml蛋白质溶液,再加入1ml 5%三氯乙酸溶液,振荡试管,观察现象。
(5)有机溶剂沉淀蛋白质:取一支离心管,加入2ml蛋白质溶液,再加入2ml 95%乙醇,观察现象。
教师评阅:签名(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。
蛋白质的等电点测定和沉淀反应

实验3蛋白质的等电点测定和沉淀反应一、目的1、了解蛋白质的两性解离性质。
2、学习测定蛋白质等电点的一种方法。
3、加深对蛋白质胶体溶液稳定因素的认识。
4、了解沉淀蛋白质的几种方法及其实用意义。
二、原理蛋白质是两性电解质。
在蛋白质溶液中存在下列平衡:C∞HP zNH2蛋白质分子C∞^ KNH2+ H* + OW阴离子兼性离子COOH PNH;阳离子pH>pI pH = pl pH<pI蛋白质分子的解离状态和解离程度受溶液的酸碱度影响。
当溶液的PH达到一定数值时, 蛋白质颗粒上正负电荷的数目相等,在电场中,蛋白质既不向阴极移动,也不向阳极移动,此时溶液的PH值称为此种蛋白质的等电点。
不同蛋白质各有特异的等电点。
在等电点时,蛋白质的理化性质都有变化,可利用此种性质的变化测定各种蛋白质的等电点。
最常用的方法是测其溶解度最低时的溶液PH值。
本实验通过观察不同PH溶液中的溶解度以测定酪蛋白的等电点。
用醋酸与醋酸钠(醋酸钠混合在酪蛋白溶液中)配制各种不同PH值的缓冲液。
向诸缓冲溶液中加入酪蛋白后,沉淀出现最多的缓冲液的PH值即为酪蛋白的等电点。
在水溶液中的蛋白质分子由于表面生成水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质颗粒可因失去电荷和脱水而沉淀。
蛋白质的沉淀反应可分为两类。
(1)可逆的沉淀反应此时蛋白质分子的结构尚未发生显著变化,除去引起沉淀的因素后,蛋白质的沉淀仍能溶解于原来溶剂中,并保持其天然性质而不变性。
如大多数蛋白质的盐析作用或在低温下用乙醇(或丙酮)短时间作用于蛋白质。
提纯蛋白质时,常利用此类反应。
(2)不可逆沉淀反应此时蛋白质分子内部结构发生重大改变,蛋白质常变性而沉淀,不再溶于原来溶剂中。
加热引起的蛋白质沉淀与凝固。
蛋白质与重金属离子或某些有机酸的反应都属于此类。
蛋白质变性后,有时由于维持溶液稳定的条件仍然存在(如电荷),并不析出。
因此变性蛋白质并不一定都表现为沉淀,而沉淀的蛋白质也未必都已变性。
蛋白质等电点测定

蛋白质等电点测定及性质实验一、目得:了解等电点得意义及其与蛋白质分子聚沉能力得关系。
初步学会测定蛋白质等电点得基本方法,了解蛋白质得性质。
二、原理:固体颗粒在液体中为什么能够带电?当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以就是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号得电荷,由于电中性得要求,带电表面附近得液体中必有与固体表面电荷数量相等但符号相反得多余得反离子。
在界面上带电表面与反离子形成了双电层得结构。
在两种不同物质得界面上,正负电荷分别排列成得面层。
对于双电层得具体结构,一百多年来不同学者提出了不同得瞧法。
最早于1879年He lmholz提出平板型模型;1910年Gouy与1913年Chapman修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型.根据O、斯特恩得观点,一部分反离子由于电性吸引或非电性得特性吸引作用(例如范德华力)而与表面紧密结合,构成吸附层(或称紧密层、斯特恩层).其余得离子则扩散地分布在溶液中,构成双电层得扩散层(或称滑移面).由于带电表面得吸引作用,在扩散层中反离子得浓度远大于同号离子。
离表面越远,过剩得反离子越少,直至在溶液内部反离子得浓度与同号离子相等.紧密层:溶液中反离子及溶剂分子受到足够大得静电力,范德华力或特性吸附力,而紧密吸附在固体表面上.其余反离子则构成扩散层。
滑动面:指固液两相发生相对移动得界面,就是凹凸不平得曲面。
滑动面至溶液本体间得电势差称为ζ电势。
固体颗粒带电量得大小及测量方式?ζ电势只有在固液两相发生相对移动时才能呈现出来。
ζ电势得大小由Zeta电位表示,其数值得大小反映了胶粒带电得程度,其数值越高表明胶粒带电越多,扩散层越厚。
一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应得pH值即为等电点。
对于蛋白质分子来说:蛋白质分子得大小在胶粒范围内,约1~100微米。
蛋白质的等电点测定与沉淀反应

❖ 加5%卵清蛋白溶液5 ml于试管中,再加等量的饱和硫酸 铵溶液,混匀后静置数分钟则析出球蛋白的沉淀。倒出少 量混浊沉淀,加少量水,观察是否溶解,为什么?将管中 内容物过滤,向滤液中添加硫酸铵粉末到不再溶解为止, 此时析出的沉淀为清蛋白。
-
-
1
2 8.7 -0.3 -1来自3 8.0 -1.0 -
1
4 7.4 -
- 1.6 1
最浑浊的一管的p可H编辑为ppt 酪蛋白的等电点。 7
六.等电点测定实验结果
几号管最混浊,溶液pH为?由于等电点 时蛋白质溶解度最小,所以酪蛋白的等电点 为?
可编辑ppt
8
Ⅱ.蛋白质的沉淀反应
一、目的: 1.加深对蛋白质胶体溶液稳定因素的认识。 2.了解沉淀蛋白质的几种方法及其实用意义。 3.了解蛋白质变性与沉淀的关系。
❖ 3.某些有机酸沉淀蛋白质 取1支试管,加入蛋 白质溶液2 ml,再加1 ml 5%三氯乙酸溶液,振荡
试管,观察沉淀的生成。放置片刻,倾出上清液, 向沉淀中加入少量水,观察沉淀是否溶解。
❖ 4.有机溶剂沉淀蛋白质 取1支试管,加入2 ml蛋
白质溶液,再加入2 ml 95%乙醇。混匀,观察沉
淀的生成。
❖ 取出部分清蛋白,加少量可蒸编馏辑p水pt ,观察沉淀的再溶解。 12
❖ 2.重金属离子沉淀蛋白质 重金属离子与蛋白质 结合成不溶于水的复合物。
❖ 取1支试管,加入蛋白质溶液2 ml,再加3%硝酸 银溶液1~2滴,振荡试管,有沉淀产生。放置片
刻,倾去上清液,向沉淀中加入少量的水,沉淀 是否溶解?为什么?
+ OH+ H+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离表面越远,过剩的反离子越少, 直至在溶液内部反离子蛋白质等电点测定 及性质实验、目的:了解等电点的意义及其与蛋白质分子聚沉能力的关系。
初步学会测定蛋白质等电点的基本方法,了解蛋白质的性质。
、原理:固体颗粒在液体中为什么能够带电?当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以是固体分子本 身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,由于电中性的要求,带电表面附近的液体中必有与固体 表面电荷 数量相等但符号相反的多余的反离子。
在界面上 带电表面和反离子 形成了双电层的结构。
在两种不同物质的 界面上,正负电荷分别排列成的面层。
对于双电层的具体结构,一百多年来不同学者提出了不同的看法。
最早于 1879年 Helmholz 提出平板型模型;1910年Gouy 和1913年Chap man 修正了平板型模型, 提出了扩散双电层模型;后来 Stern 又提出了 Stern 模型。
根据O.斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用(例如范 德华力)而和表面紧密结合,构成 吸附层(或称紧密层、斯特恩层)。
其余的离子则扩散地分布在溶液中,构成双电层的 扩散层(或称滑移面)。
由于带电表面的吸引作用,在 扩散层中反离子的浓度远大于同号离子。
紧密层(Stern 层〉+++++^+++9反号离子溶剂分子扩散层紧密层:溶液中反离子及溶剂分子受到足够大的静电力,范德华力或特性吸附力,而紧密吸附在固体表面上。
其余反离子则构成扩散层。
滑动面:指固液两相发生相对移动的界面,是凹凸不平的曲面。
滑动面至溶液本体间的电势差称为Z电势。
固体颗粒带电量的大小及测量方式?Z电势只有在固液两相发生相对移动时才能呈现出来。
Z电势的大小由Zeta电位表示,其数值的大小反映了胶粒带电的程度,其数值越高表明胶粒带电越多,扩散层越厚。
一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应的pH值即为等电点。
对于蛋白质分子来说:蛋白质分子的大小在胶粒范围内,约1〜100微米。
大部分蛋白质分子的表面都有很多亲水集团,这些集团以氢键形式与水分子进行水合作用,使水分子吸附在蛋白质分子表面而形成一层水合膜,具有亲水性;又由于蛋白质分子表面的亲水集团都带有电荷,会与极性水分子中的异性电荷吸引形成双电层。
而水合膜和双电层的存在,使蛋白质的分子与分子之间不会相互凝聚,成为比较稳定的胶体溶液。
如果消除水合膜或双电层其中一个因素,蛋白质溶液就会变得不稳定,两种因素都消除时,蛋白质分子就会互相凝聚成较大的分子而产生沉淀。
在生活实践中,常利用蛋白质的胶体性质沉淀或分离蛋白质。
如做豆腐、肉皮冻就是利用蛋白质的胶凝作用。
蛋白质分子所带的电荷与溶液的pH值有很大关系,蛋白质是两性电解质,在酸性溶液在碱性溶液中羧基形成-C00-而带负电中的氨基酸分子氨基形成-NH3+而带正电,COO-COOJp\+ 0H-NH2兼性痒孑pH>pI pK = pl pl电殛申:拓向配覆不暮动蛋白质分子所带净电荷为零时的pH值称为蛋白质的等电点(PI)。
其定义为:在某一pH的溶液中,蛋白质解离成阳离子和阴离子的趋势或程度相等时,呈电中性,此时溶液的pH称为该蛋白质的等电点。
等电点的应用:主要用于蛋白质等两性电解质的分离、提纯和电泳。
蛋白质等电点的测量方式:溶解度最低时的溶液pH。
在等电点时,蛋白质分子在电场中不向任何一极移动,而且分子与分子间因碰撞而引起聚沉的倾向增加,所以这时可以使蛋白质溶液的粘度、渗透压均减到最低,且溶液变混浊。
蛋白质在等电点时溶解度最小,最容易沉淀析出。
蛋白质等电点的测定各种蛋白质的等电点都不相同,但偏酸性的较多,如牛乳中的酪蛋白的等电点是4.7~4.8,血红蛋白等电点为6.7~6.8,胰岛素是5.3~5.4,鱼精蛋白是一个典型的碱性蛋白,其等电点在pH 12.0~12.4。
本实验采用蛋白质在不同pH溶液中形成的混浊度来确定,即混浊度最大时的pH值即为该种蛋白质的等电点值,这个方法虽然不很准确,但在一般实验条件下都能进行,操作也简便。
蛋白质的等电点比较准确的方法是采用等电聚焦技术加以准确测定,但需一定的实验条件。
等电聚焦电泳(IEF,isoelectric focusing electrophoresis利用特殊的一种缓冲液(两性电解质)在凝胶(常用聚丙烯酰胺凝胶)内制造一个pH梯度,电泳时每种蛋白质就将迁移到等于其等电点(pl)的pH处(此时此蛋白质不再带有净的正或负电荷),形成一个很窄的区带。
IEF的基本原理在IEF的电泳中,具有pH梯度的介质其分布是从阳极到阴极,pH值逐渐增大。
如前所述,蛋白质分子具有两性解离及等电点的特征,这样在碱性区域蛋白质分子带负电荷向阳极移动,直至某一pH位点时失去电荷而停止移动,此处介质的pH恰好等于聚焦蛋白质分子的等电点(pl)。
同理,位于酸性区域的蛋白质分子带正电荷向阴极移动,直到它们的等电点上聚焦为止。
可见在该方法中,等电点是蛋白质组分的特性量度,将等电点不同的蛋白质混合物加入有pH梯度的凝胶介质中,在电场内经过一定时间后,各组分将分别聚焦在各自等电点相应的pH 位置上,形成分离的蛋白质区带。
沉淀反应:蛋白质在某种理化条件下,蛋白胶体溶液的水化层或者电荷层破坏,蛋白胶体相互聚集的现象。
主要的沉淀现象有(1)盐析:在蛋白质水溶液中加入足量的盐类(如硫酸铵),可析出沉淀,稀释后能溶解并仍保持原来的性质,不影响蛋白质的活性。
这是一个可逆的过程,可用于蛋白质的分离与初级提纯。
(2)变性:在重金属盐、强酸、强碱、加热、紫外线等作用下,引起蛋白质某些理性质改变和生物学功能丧失。
这是一个不可逆过程。
(3)加入一定量的溶剂如乙醇、丙酮,它们与蛋白质分子争夺水分子,破坏水化膜,短时间内是可逆反应;(4 )加入生物碱试剂(含氮的碱性物质):能使生物碱沉淀或作用产生颜酪蛋白是牛奶蛋白质的主要成分,常温下在水中可溶解 0.8~1.2%,微溶于25度水和有机溶剂,溶于稀碱和浓酸中,能吸收水分。
当浸入水中则迅速膨胀。
在牛奶中以磷酸二钙、 三钙或两者的复合物形式存在。
构造极为复杂,没有确定的分子式。
分子量约为 57000~375000,在牛奶中约含 3%,占牛奶蛋白质的 80%。
三、 器材及试剂:1 .器材:① 试管1.5X 厘米(X 9)。
② 吸管1毫升(X 2) , 2毫升(X 2), 10毫升(X 2)。
③ 容量瓶50毫升(X 2) , 500毫升(X 1)。
④ 试管架。
2. 试剂:①0.01mol • L -1醋酸溶液。
②0.1mol • L -1醋酸溶液。
③ 1 mol • L -1醋酸溶液。
④ 1 mol • L -1氢氧化钠溶液(氢氧化钠和醋酸溶液的浓度要标定) 。
⑤ 酪蛋白。
四、 操作步骤:1 .制备蛋白质胶液(1) 称取酪蛋白3克,放在烧杯中,加入 40C 的蒸馏水。
(2) 加入50毫升1 mol • L -1氢氧化钠溶液,微热搅拌直到蛋白质完全溶解为止。
将溶 解好的蛋白溶液转移到 500毫升容量瓶中,并用少量蒸馏水洗净烧杯,一并倒入容量瓶。
(3) 在容量瓶中再加入 1 mol • L -1醋酸溶液50毫升,摇匀。
(4) 加入蒸馏水定容至 500毫升,得到略现浑浊的,在0.1 mol • L -1NaAC 溶液中的酪 蛋白胶体。
2. 等电点测定按下表顺序在各管中加入蛋白质胶液,并准确地加入蒸馏水和各种浓度的醋酸溶液, 加入后立即摇匀。
色反应的物质,称为生物碱试剂。
当溶液的 试剂的阴离子结合而生成沉淀。
pH 小于PI 时,蛋白质为阳离子,能与生物碱观察各管产生的混浊并根据混浊度来判断酪蛋白的等电点。
观察时可用+, ++, +++,表示浑浊度。
3.蛋白质性质实验(1)蛋白质的盐析在试管里加入1~2毫升蛋白质的水溶液,然后逐滴加入硫酸铵饱和溶液,观察现象,有无白色浑浊产生。
滴加过程中不要摇动试管,现象不明显时,多加几滴硫酸铵饱和溶液。
(2)蛋白质的变性在试管里加入2毫升蛋白质的水溶液,沸水浴加热5分钟,观察现象。
把试管里的下层物质取出一些放在水里,观察现象。
在试管里加入3毫升蛋白质的水溶液,加入1毫升硫酸铜溶液,观察现象。
(有无淡蓝色絮状浑浊沉淀产生)。
把少量沉淀放入盛有蒸馏水的试管里,观察沉淀是否溶解。
五、思考题1、在等电点时蛋白质的溶解度为什么最低?请结合你的实验结果和蛋白质的胶体性质加以说明。
在等电点时,蛋白质分子以两性离子形式存在,其分子净电荷为零(即正负电荷相等),此时蛋白质分子颗粒在溶液中因没有相同电荷的相互排斥,分子相互之间的作用力减弱,其颗粒极易碰撞、凝聚而产生沉淀,所以蛋白质在等电点时,其溶解度最小,最易形成沉淀物。
2、本实验中,酪蛋白质在等电点时从溶液中沉淀析出,所以说凡是蛋白质在等电点时必然沉淀出来。
这种结论对吗?为什么?不一定会沉淀,因为蛋白质表面有亲水基团,只是在等电点的时候颗粒无电荷间的排斥作用易凝集成大颗粒,因而最不稳定,溶解度最小,易沉淀析出。
3、在分离蛋白质时等电点有何实际应用意义?不同的蛋白质有不同的等电点,在分离蛋白质的时候只要调节混合蛋白质溶液的可以在不同的pH 值,就pH 下得到不同的蛋白质。
