高一化学第一章知识点思维导图
第1章物质及其变化思维导图

第 1 章物质及其变化思维导图目录硝酸铅和碘 化钾亦Pb(NO 5)2 ÷2KI = PbIJ {÷ 2 K^O 5无色黄色 溶液 渚液沉淀颜色的变化、沉淀生成无色化学变化的实质是构 成物质分子的原子重 新进行组合f 形成了 新的分子化学变化 没有生成新的物质 物理变化 常见的变化化学变化 的例证化学变化一走伴随着物理变化 物理变化中不一走有化学变化堡 氯化铁沿 液j 師漓 化钾溶液琉乐化<T I*JS氨化挾玖亀化钾氯化快 淳浪 津液加入玖鼠化 钾潯浪后黄色沿茨变成了红色潘液水的电解-有气体产生,产生了新的物质生成沉淀、颜色改变、气体产 生、温度变化、性质变化、发 光发热、PH 变化、状态变化等 变化在变化过程中I 以沉 淀、气体、变色等形式 产生了新的物质•就判I 断为发生了化学变化 /在变化过程中,物质 仅仅发生形状.状 态、位置的改变 < 则 雇于物理变化 物质变化 的证据澄清石灰水 滴加碳酸钠 溶液变化规律的应用澄清石灰水中出现白色沉淀推测物质性质和用途白色硫酸铜粉未 可以检测水分寻找发现未知物质 建立物质变化模型酹、胃液等θ酸性物质盐酸:HCI = ;H1 +f CP ■■: 硫酸:H2SO4 = 2H*: + ∙SO42^:^ 硝酸:HNO3 = ⅛+ LNO√ j电离时生成的阳离子全部是氢离子的化合物酸溶液*战性溶液酸溶液显酸性,一走是酸性溶液显酸性的溶液不一走雇于酸溶液。
如硫酸氢羿溶液碱性物质・熟石灰、肥皂、洗涤液等e辨析PH值反映物质酸碱性强弱用洁净的玻璃棒Si取破测试的溶液;滴在PH试纸上;将试纸显示PH试纸的颜色与标准比色卡对照;与哪种'使用方法J 颜色最接近■从而确走溶液的PH J -----------------可使用酸度计O精确的测试]-酸性物质的酸碱性氢氣化钠:NaOH = Na÷ + OH1:氢氧化钙:Ca(OH)2 = Ca2* + 20H*;畝水:NH3 出0 = NH4* ÷ JOHj 电离时生成的阴离子全部是氢氧根离子的化合物辨析■/碱溶液*附隣液(纯碱是碱性溶液,但不是碱溶液在酸性或碱性酒液里能显示出不同颜色的物质酸碱性的强弱酸碱指示剂指示剂酸性滨液(PH<7)緘性港液(PH>7)酚吐试液(无色)蓝色石茨试纸红色蓝色无色红色不变色红色不变色蓝色无色、粘稠、油状的液体I 帛见的浓硫酸的 质量分数为98% f 言度为1.84克每立方厘米能使紫色石洗试液变红I 无色诙试P 能与掲示剂反应@盐酸是氯化氢(HCl)气体的水溶液 打开浓盐酸的试剂瓶,会挥发出有剌 浓盐酸具\ 激性气味的塔体,在瓶□有白雾形成’有挥发性)盐酸个性 硫酸 个性 /浓硫酸具有很强的腐蚀性ArI 浓硫酸具有脱水性浓硫酸具有吸水性液不变色 ) ------------------ ®跆铁钉反应 ------------- e 會猖全雇反应 ⑥ ------------------------ g>帥锈融 ■昭金雇氧 毎与氧化臓分未反应F 化物反应θ青猖氢氧化铝反应 + ≡⅛⅛⅛⅛⅛>⅛⅛-AV ®育猖礎钙反应 能使紫色石蕊试能与指示剂反应二液变红■无色酚 ----------------- [猷试液不变色G 肖猖碱融 θ晦盐. 盐酸的化学性纯硝酸是无色、易挥发、有剌激性气味的液休 浓硝酸具有挥发性;硝酸具有很强的氧化性和 腐蚀性;浓硝酸见光易分解(棕色的瓶保存)4 HNO3 垄 4 NO?] + 2 H 2θ ÷ °2 ↑用途硫酸的 吐与泣虫又应能与详吆又竺+化学性r能与金雇氧站氧化铁粉 化物融ef粘氧化铜粉-晦≡M 化铜融®[能与- 粘氯化顿溶液融÷土满 重要化工产品•用于金雇表面除锈、制造 泄「药物,人休胃液中含有盐酸,可帮助消化重要化工料,用于生产化肥、农药、火 咖药.染料以及冶炼全雇、精炼石油和全雇 吨 .除锈等.浓硫酸有吸水性■在实验室中常用它做干燥剂浓硫酸溶于水会放出大呈的热©隔溶液能使紫色石茨试液变蓝 色f 能使无色酚猷变红色Ca(OH)2 + 2HCI = CaCI 2 + 2 H 2O Ca(OH)2 + 乍0产 CaSO4 +2战0 二:劉牛CuCI 2 + 2NaOH = Cu(OH)21÷ 2NaClFeCI 3 + 3NaOH = Fe(OH)3 ∣+ 3 NaCI \θ氢氧化钠易潮解r易溶于水■ 溶解时会放出大量的热r 氢氧 化钠有较强的腐蚀性-种重要的化工原料r 广泛 用于月隨、石油、造纸、纺 织、印染等工业白色粉末状回体r 微溶于水f 溶解 度随溫度的升离而减小r 具有一走 的腐蚀性 建筑上做粉刷材斜r 农业上改良酸性 土壤,工业上制备漂白粉r 实验室制 少呈NaOH .配制农药波尔多液SO 3+ 2 NaOH = Na 2SO 4+H 2OjA丙能与非金属 "氧化物反应 CO 2 + Ca(OH)2= CaCO 31+H 2O 1 SiO 2+2 NaOH = Na 2SiO 3+H 2O λ条件:非金雇氧化物为酸性气体NaOHA氢氧化钠与酸溶液 发生反应酸碱指示別常见的碱画Ca(OH)2 —Ca(OH)2 + Na 2CO 3 = CaCO 31+ 2 NaOH 条件:反应物均可溶r 生成物至少一种难溶不溶性嗨酸溶液发不溶性碱• 的共性CU(OH)2 4 CUO + H 2O 2 Fe(OH)3 ≈ Fe 2O 3 +3 H 2O 不溶性題瞬解熟石灰或消石灰SO 2 +2 NaOH = Na 2SO 3+ H 2O能与某 些盐溶 液反应烧碱、火觀、苛性钠酸+≡=盐+水HCl + NaOH = NaCl + H2OIOlnl氢I讹钠帧酚猷试液由红色变为无色来判断实验土壤取样取1克左右土样放入试管中r加入5毫升蒸徭水,振荡30秒钟后静置。
(完整word版)高中化学必修一知识网络结构图.doc
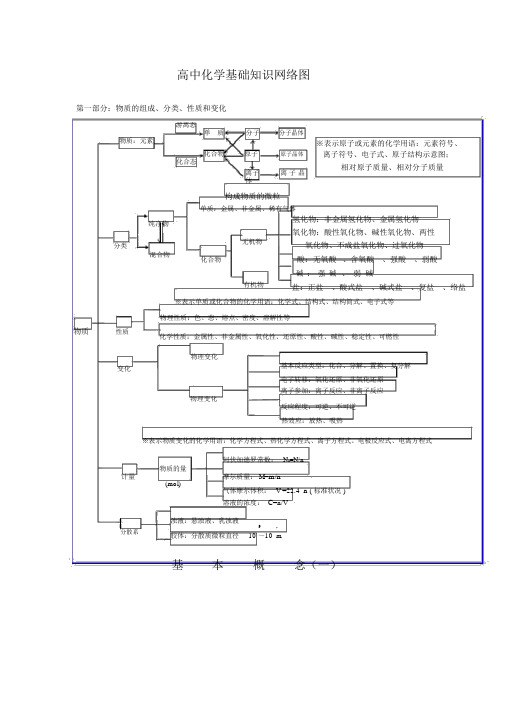
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化游离态分子分子晶体单质物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:N A=N/n物质的量摩尔质量: M=m/n(mol)气体摩尔体积:V =22.4 n ( 标准状况 )溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~10 m基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性游离态物理性质单质宏观元素金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属纯净物稀有气体化合物化合态化合物组大多数有机物稀有气体分子晶体分酸子气态及挥发性物质原子晶体原石墨(混合晶体)子微观金属晶体大多数盐强碱离子晶体离碱性氧化物子部分过氧化物性质分类无机物物质氢化物氧化物变化酸碱盐有机物金属氢化物酸性非金属氢化物碱性成盐氧化物两性特殊不成盐氧化物含氧酸、无氧酸强酸、弱酸强碱、弱碱可溶碱、难容碱正盐酸式盐碱式盐复盐;络盐潮解、分馏混合物升华、萃取有机、无机物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子化分分分子子子学的的间运键形极作成性用动力状共离金(态范价子属极非德特键键键性极华殊分性共离金力性子分)价子属子电化化单影子合合质物物及响云合物金理性晶质体结构简图类型电子式金分原离属子子子晶晶晶晶横:周期体体体体原子核外电子原子核(分排层布)规律最次各能外外层量层层最最不不多低超超容原过过纳理8 18 2n个个 2个表示方法表的结构元素种类起止序号中子质量数同位素核电荷数元素质子性规质原子序数变律化元素周期律表现形式元素实周质期律元编元元核素素归素决外周制周纳性定电期期质子表律的排周布期周性期性n=1 n=2 n=3 n=4 n=5 n=6 n=7 纵:族2短周期1~ 28 3~10周元素性质8 11~ 18 原18长周期19~36 期子18 37~54 表结位32 55~86 构置21 不完全周期87~111主族:ⅠA ~Ⅶ A副族:ⅢB ~Ⅶ B 、Ⅰ B Ⅱ BⅧ族0族比较类型离子晶体原子晶体分子晶体构成晶体微粒阴、阳离子原子分子形成晶体作用力离子键共价键范德华力熔沸点较高很高低硬度硬而脆大小物导电性不良熔融.导电绝缘体 ( 半导体 ) 不良理水溶液性传热性不良不良不良质延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCl ,KBr 单质:金刚石、 SiC 、单质:H2、O2 Si 、SiO2 化合物:冰、干冰化表示方法学反特点速率算:v A =△c A /△t 位: mol/L ·s(min 或 h )是平均速率,均取正同一反用不同的物表示速率,数可能不同各物表示的速率比等于反方程式的系数比化和化学化反学学反平衡速率影响因素用条合件成的氨化适于学平衡内因 (主 )外因()可逆反化学平衡建立的条件: v 正=v 逆≠ 0化学平衡的特征(平衡志的判断)反物的构、性度温度催化其他条件光、超声波、激光、放射⋯定各成分百分含量保持不等v 正 =v 逆≠ 0平衡条件改,平衡状改化学平衡、化学反应速率度影响化学平衡因素平衡移原理(勒沙特列原理 )温度强电解质(完全电离 ) AB A -+B -已电离的弱电解质分子数(电离度的定义 (电离度α = ×100%)电离平衡 AB A -+B - 弱电解质的分子总数电 弱 部解 电 分电离度平衡的移动化 质解 电质 离水的离子积 K W =1× 10-14(25℃ )合物) 水的电离平衡 H 2OH ++OH-溶液的酸碱性: PH=-log[H + ]实质装置发生条件表示方式-离子方程式离子反应非氧化还原常见类型氧化还原类型盐类的水解规律(酸碱性性判断)影响因素复分解反应水解反应络合反应置换反应溶液中氧化还原反应原理蓄电池化 能应用电源干电池高能电池学 的 原电池能 转化学能电解池电能与 换原理氯碱工业(电解饱和食盐水)电 :电镀应用非电解精练(精练铜)电解 电冶炼金属(冶炼铝)质电解 质 溶 液比较装置能量转换 (实质) 装置特点电极名称电子流向电极反应原电池 电解池化学能→电能电能→化学能(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)外电路无电源;两极为活泼性不同 外电路必须有直流电源;两极材料均(或其中之一为能导电的非金属)的金属 能导电即可负极(-)——较活泼 阴极——连接电源负极正极(+)较不活泼 阳极——连接电源正极e ee负极(-)→正极(+)电源负极→阴极电源正极→阳极氧化n+活泼金属失去电子+还原n+还原负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M + ne → M被氧化、被溶解、被腐蚀。
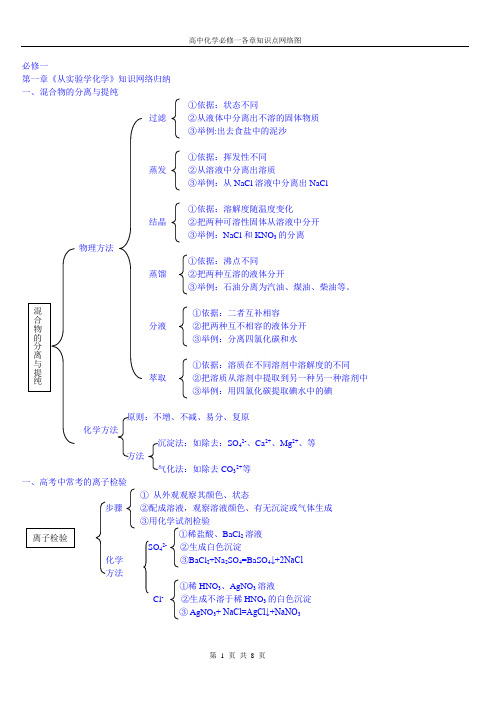
高中化学必修一各章知识点网络图
硅酸盐产品:玻璃、水泥、陶瓷、高温结构陶瓷、压电陶瓷、透明陶瓷、超导陶瓷等
二、氯
物理性质:黄绿色气体,密度大,较容易液化,有刺激性气味,有毒,能溶于水
Cl2+H2O HClO+HCl
与水反应
Cl2应用于消毒和漂白
1、氯气
2NaOH+Cl2NaCl+NaClO+H2O
NaOH
化NaClO应用于消毒剂和漂白剂
2、用途CaSiO3
Si SiO2H2SiO3(或H4SiO4)
Na2SiO3
用途:既可用于制造玻璃、陶瓷等多种传统的无机非金属材料,又可用于制造压电材料、光导纤维等多种个性非无机非金属材料
制法:SiO2+2NaOH Na2SiO3+H2O
Na2SiO3性质:可溶于水,水溶液呈碱性、有粘性、不燃烧
用途:用作肥皂填料、木材防火剂及胶黏剂等
强氧化性
用途C+2H2SO4(浓) CO2↑+2H2O+2SO2↑
四、氮及其化合物
存在:占空气体积的4/5
单质N2+O22NO无色有毒、不溶于水
性质2NO+O22NO2红棕色、有毒、易溶于水、易液化
3NO+H2O 2HNO3+NO形成酸雨
物理性质:无色、有刺激性气味、极易容易水
水:NH3+H2O NH3·H2O NH4++OH-弱碱性
电解①O2点燃
② Fe2O3高温
Al2O3
△
NaAlO3NaOHAl(OH)3AlCl3
H2O
KAl(SO4)2
3、铁及其重要化合物之间的转化关系
Fe2O3Fe FeCl2Fe(OH)2Fe(OH)3FeCl3Fe(SCN)3
二、金属的化学性质
常温下:Na+O2Na2O
高中化学必修一知识网络结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化(<…@%第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)}$:~> 】!&<{!第三部分:元素化合物转化关系、&¥$第四部分:有机化学有机抓住官能团的性质烃 烃的衍生物链烃(脂肪烃)环烃饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3) 芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2有机化合物。
化学必修一思维导图

化学必修一思维导图一、物质及其变化1. 物质的结构原子结构:由原子核和核外电子组成,原子核由质子和中子组成。
分子结构:由原子通过化学键连接而成。
晶体结构:由原子、分子或离子按照一定的规律排列而成。
2. 物质的分类纯净物:由同种元素或化合物组成,具有固定的组成和性质。
3. 物质的性质物理性质:不涉及物质组成和结构变化的性质,如颜色、状态、密度等。
化学性质:涉及物质组成和结构变化的性质,如可燃性、氧化性等。
二、化学键与化学反应1. 化学键离子键:由正负离子之间的静电作用力形成。
共价键:由原子间共享电子对形成。
金属键:由金属原子间的自由电子云形成。
2. 化学反应化学反应类型:合成反应、分解反应、置换反应、复分解反应等。
化学反应条件:温度、压力、催化剂等。
化学反应速率:反应物浓度、温度、催化剂等。
三、元素周期表1. 元素周期律元素周期表按照原子序数排列,具有周期性变化的规律。
元素周期表中,同一周期的元素具有相似的化学性质,同一族的元素具有相似的物理性质。
2. 元素周期表的应用元素周期表可以用于预测元素的化学性质和物理性质。
元素周期表可以用于解释元素的电子结构和化学键的形成。
四、化学计量学1. 物质的量物质的量:表示物质中含有的基本粒子数,单位为摩尔。
摩尔质量:表示1摩尔物质的质量,单位为克/摩尔。
2. 化学反应的计量关系化学方程式:表示化学反应的物质及其量的关系。
化学方程式的平衡:反应物和物的物质的量保持一定的比例。
3. 化学反应的热力学焓变:表示化学反应中能量的变化,单位为焦耳。
反应热:表示化学反应中吸收或释放的热量,单位为焦耳。
五、溶液与胶体1. 溶液溶液的定义:由溶质和溶剂组成的均匀混合物。
溶液的浓度:表示溶液中溶质的含量,单位为摩尔/升。
2. 胶体胶体的定义:由分散相和分散介质组成的混合物,分散相粒子的大小介于分子和宏观粒子之间。
胶体的性质:具有丁达尔效应、布朗运动等特性。
六、酸碱反应1. 酸碱理论酸碱质子理论:酸是质子(H+)的供体,碱是质子的受体。
高中化学必修一知识网络结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化氧化物、不成盐氧化物、过氧化物酸:无氧酸、含氧酸、强酸、弱酸决表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等反应程度:可逆、不可逆决表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式阿伏加德罗常数:M=N/n念(一)物质:元素化章L ►纯净物|—刑I 物有机物•盐:正盐、酸式盐、碱式盐、复盐、络盐物质 生质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化-变化基本反应类型:化合、分解、置换、复分解 电子转移:氧化还原、非氧化还原物理变化离子参加:离子反应、非离子反应物质的量摩尔质量:M=m/n (mol)---- 气体摩尔体积:V =22.4 n (标准状况)色、态、味溶解度、熔点、沸点 密度、硬度、导电性导热性、塑性「单质兀素游离态宏观化合态原子晶体物质变化分类石墨(混合晶体)金属晶体微观大多数盐离子晶体pl 纯净物-无机物碱性氧化物*6分过氧化新潮解、分储升华、萃取溶解、盐析裂化、裂解念(二)第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)金属 稀有气体-氢化物--氧化物一不成盐氧化物含氧酸、无氧酸 强酸、弱酸,可溶碱、难容碱 正盐 酸式盐 碱式盐 复盐;络盐物质结构荷电 一实质.Si排布规律、分层1能 量最低原理层最多容纳29个次外层不超过18个最外层不超过8个一运动状态——特殊性•,电子云分子间作用力{范德华力•分子的极性L分子的形成属键一L葛子健 化学键I n ———共价键核外电子排布周期性元素性质的周期性元素周期律编制一 元素周期表表的结构示方法,影响物理性质2812---8188213Bn ABw WA BI m••族族族族 、王副o族 56 7 一一 一一 一L化学反应速率和化学平衡表示方法 :V A = △ C A /△ t 单位:mol/L - s(min 或 h是平均速率,均取正值同一反应选用不同的物质表示速率,数值可能不同 各物质表示的速率比等于该反应方程式的系数比化学平衡件学平衡、化学 反应速率反应物的结构、性质 浓度温度]催化剂 ___________________ 其他条件—光、超声 波、激光、放射线…影响化学平衡因素压强 温度平衡移动原理强电解质(完全电离)AB -^A '+B化合物电解质弱电解质装:能的转换:化学能与电化学能非电解质电冶炼金属(冶炼铝)电解质溶液第三部分:元素化合物转化关系H2O H2OMg(OH) ------ MgCO3NaOH /H2O/HCI/ CO:/ HCl .. /OHCaCl2 ・JHClCl2 为/ HCl Na2CO3HClCl* CaCO3飞CO2+ H2OAlCl 3(AI 3+)[、NaOHHClHCW " Ji/电解1Al 2O3.、O2NaOHCl HCl *Fl H2°(沸腾).»OH)3NaOH 或H C z^C02ZT S^u NaOHNaAl O 2NaOHKSCNFe(ScN)3FeSNa2SH2SO4FeONaOH H2SO4Fe3O4Fe(OH) 2O2 和H2O・ FeCl2Cl FeKSCNFeCl3 :Fe(SCN)3NaOH HCl♦ Fe(OH)3SCU2S 一HNO3 或H2SO4(浓NH3H2O 2+• Cu(OH) 2 ■ [Cu(NH 3)4]CuS ♦Na2S Cu2+(NO3、S°42)金属部分:按照单质-氧化物一氢氧化物一►盐为线索进行搜罗寻找关系非金属:按照化合价寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐第四部分:有机化学—醇 (官能团:一OH ):饱和一元醇C n H 2n+1OH (n 法1)R — OH 酬 C n H 2n+2O (n A2)R O R _____ 酚(苯酚)(官能团:OH ) C n H 2n-6。
化学必修一思维导图

化学必修一思维导图一、物质及其变化1. 物质物质是构成宇宙的基本实体,具有质量和体积。
物质由分子、原子和离子等基本粒子组成。
物质可以分为纯净物和混合物。
2. 变化变化是指物质在时间和空间上的状态改变。
变化可以分为物理变化和化学变化。
物理变化是指物质的形态、状态或性质发生改变,但化学组成不变。
化学变化是指物质的化学组成发生改变,新的物质。
二、物质的分类与性质1. 纯净物纯净物是指由一种物质组成的物质。
纯净物可以分为元素和化合物。
2. 混合物混合物可以分为均匀混合物和非均匀混合物。
3. 物质的性质物质的性质是指物质所具有的特定属性。
物质的性质可以分为物理性质和化学性质。
物理性质是指物质在不发生化学变化的情况下所表现出来的性质,如颜色、气味、密度等。
化学性质是指物质在发生化学变化时所表现出来的性质,如可燃性、氧化性等。
三、物质的量与计量1. 物质的量物质的量是指物质所含有的粒子数目的多少。
物质的量可以用摩尔(mol)来表示。
2. 计量计量是指对物质的量进行测量的过程。
计量可以采用天平、量筒等工具进行。
四、化学反应与能量1. 化学反应化学反应是指物质在化学变化过程中发生的原子、离子或分子之间的相互作用。
化学反应可以分为合成反应、分解反应、置换反应和复分解反应。
2. 能量能量是物质所具有的做功的能力。
能量可以分为内能、热能、电能等。
五、溶液与溶解度1. 溶液溶液是指一种或多种物质分散在另一种物质中形成的均匀混合物。
溶液可以分为饱和溶液和不饱和溶液。
2. 溶解度溶解度是指在一定条件下,溶质在溶剂中达到饱和时所能溶解的最大量。
溶解度受到温度、压力等因素的影响。
六、酸碱反应与中和1. 酸碱反应酸碱反应是指酸和碱在溶液中发生的化学反应。
酸碱反应可以分为酸碱中和反应、酸碱盐反应等。
2. 中和中和是指酸和碱在反应中相互抵消,水和盐的过程。
中和反应是酸碱反应的一种特殊情况,是酸碱反应的典型代表。
七、氧化还原反应与电子转移1. 氧化还原反应氧化还原反应是指物质在化学反应中发生电子转移的过程。
高中化学必修1知识网络图

====Word 行业资料分享--可编辑版本--双击可删====
源-于-网-络-收-集
化学必修1 知识框架图
化学1
化学实验基础
实验基本方法 实验安全知识 化学计量的应用
溶液的配制
混合物的分离与提纯离子的检验
过滤与蒸发
蒸馏与萃取
粗盐提纯 自来水蒸馏 物质的量浓度
气体摩尔体
物质的量
摩尔质量
化学物质及变化
常见无机物及 应用
金属及其化合物
非金属及其化合物
钠及化合物
铝及化合物 铁及化合物
合金及应用
钠单质性质
氧化钠 过氧化钠
碳酸钠 碳酸氢钠
铝单质性质
两性物质
氧化铝
氢氧化铝
铁的氧化物
铁盐与亚铁盐的转化
铁与水蒸气反应
化学物质
化学反应
纯净物 混合物
单质 化合物
溶液
胶体
浊液 分散系
离子反应
氧化还原反应
电解质 非电解质
化合反应 分解反应
置换反应
二氧化硅 硅酸盐
硅及化合物 硫的化合物
氮及化合物
二氧化硫 三氧化硫 硫酸
一氧化氮二氧化氮硝酸
氯气及次氯酸
酸雨。
