溶液物质的量浓度(molL)-课件·PPT
合集下载
物质的量浓度PPT优秀课件

试试看
请填写下列空白:
(1)、在1mol/L的MgCl2溶液中,Mg2+的物质的量浓度为
( 1 )mol/L,Cl-的物质的量浓度为( 2 )mol/L。
(2)、在0.5mol/L的H2SO4中,H+的物质的量浓度为
( 1 )mol/L,SO42-的物质的量浓度为( 0.5 )mol/L。
(3)、在0.1mol/L的Al2(SO4)3溶液中,Al3+的物质的量浓度为
c(H2SO4)=
n(H2SO4) V[H2SO4(aq)]
1000mL×1.84g/cm3×98% =
98g/mol×1L
=18.4mol/L
答:该市售浓硫酸中H2SO4的物质的量浓度为18.4mol/L。
75毫升2摩尔/升得氢氧化钠溶液 的质量是80克,求w.
3、一定物质的量浓度溶液的稀释
在稀释浓溶液时,溶液的体积发生了变化,但溶液中溶质 的物质的量不变。即在浓溶液稀释前后,溶液中溶质的物 质的量相等。
帮你解惑
下列各溶液中,Na+的浓度最大的是( B ) Na+的物质的量最大的是( A )
A、4L 0.5mol/L的NaCl溶液
B、1L 0.3mol/L的Na2SO4溶液 C、0.8L 0.4mol/L的NaOH溶液 D、2L 0.15mol/L的Na3PO4溶液
0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的
V×d×w n=
M
由上述公式可得:
c= n V
c(B)= 1000VmL×dg/mL×w Mg·mol-1×VL
= 1000×d×w M
mol/L
互相换算:
1:c(B)= 1000VmL×dg/mL×w
物质的量浓度及其计算 ppt课件

a c Aa m c M m c H b c B b n c N n
c OH
ppt课件
22
例1:某盐的混合物中Na+、Mg2+、Cl-的物质的量浓 度分别为0.2 mol/L、0.4 mol/L、0.4 mol/L,则SO42的物质的量浓度为( C ) A、0.1 mol/L C、 0.3 mol/L [解析] B 、0.2 mol/L D、 0.4 mol/L
20% 混合,ω(HCl)=__________
(2) 90%的浓硫酸与水等质量混合,
45% ω(H2SO4 ) =___________
ppt课件 28
b) 等体积混合:因溶液的密度不同,溶质的质量分
数可能大于或小于平均值。
ρ 1 V ω 1 ρ 2 V ω 2 ρ 1ω 1 ρ 2 ω 2 ω混 ρ1 V ρ 2 V ρ1 ρ 2 ω1 ω 2 ρ 1g cm ,ω 混 2 ω1 ω 2 3 ρ 1g cm ,ω 混 2
3
ppt课件 29
注意:
当溶液密度ρ > 1g· cm-3时,通常浓度(质量分数
或物质的量浓度)越大,密度也越大。等体积混合
ω1 ω 2 后质量分数 ω 混 2
(硫酸、硝酸等)
如:质量分数为50%与 30%的硫酸等体积混合, 所得溶液中 ω (H2SO4) > 40%
ppt课件 30
当溶液密度ρ < 1g· cm-3时,浓度(质量分数或 物质的量浓度)越大,密度越小。等体积混合后, ω1 ω 2 质量分数 ω 混 (氨水、酒精) 2
1000dS c mol L1 _____________________ 。 58.5(100 S)
c OH
ppt课件
22
例1:某盐的混合物中Na+、Mg2+、Cl-的物质的量浓 度分别为0.2 mol/L、0.4 mol/L、0.4 mol/L,则SO42的物质的量浓度为( C ) A、0.1 mol/L C、 0.3 mol/L [解析] B 、0.2 mol/L D、 0.4 mol/L
20% 混合,ω(HCl)=__________
(2) 90%的浓硫酸与水等质量混合,
45% ω(H2SO4 ) =___________
ppt课件 28
b) 等体积混合:因溶液的密度不同,溶质的质量分
数可能大于或小于平均值。
ρ 1 V ω 1 ρ 2 V ω 2 ρ 1ω 1 ρ 2 ω 2 ω混 ρ1 V ρ 2 V ρ1 ρ 2 ω1 ω 2 ρ 1g cm ,ω 混 2 ω1 ω 2 3 ρ 1g cm ,ω 混 2
3
ppt课件 29
注意:
当溶液密度ρ > 1g· cm-3时,通常浓度(质量分数
或物质的量浓度)越大,密度也越大。等体积混合
ω1 ω 2 后质量分数 ω 混 2
(硫酸、硝酸等)
如:质量分数为50%与 30%的硫酸等体积混合, 所得溶液中 ω (H2SO4) > 40%
ppt课件 30
当溶液密度ρ < 1g· cm-3时,浓度(质量分数或 物质的量浓度)越大,密度越小。等体积混合后, ω1 ω 2 质量分数 ω 混 (氨水、酒精) 2
1000dS c mol L1 _____________________ 。 58.5(100 S)
物质的量浓度PPT课件

高中化学 必修第一册
第二章
第三节
物质的量
第3课时 物质的量浓度
学习目标
1.了解物质的量浓度的概念。能运用物质的量浓度进行简单计算。 2.掌握一定物质的量浓度溶液的配制方法
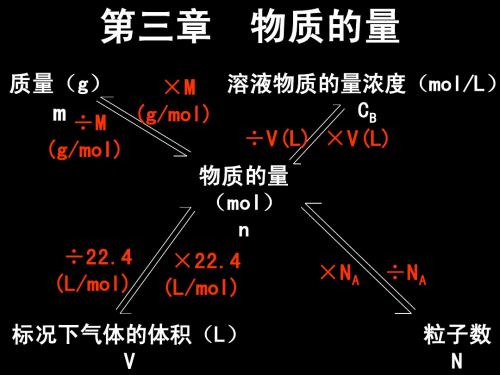
一、物质的量浓度
1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理 量,叫做溶质B的物质的量浓度。
2、符号:cB 3、表达式:物质的量浓度=
溶液稀释的计算
溶液稀释h或浓缩前后,溶液的质量或体积发生变化,但溶 质的量(质量或物质的量)均不变。
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
c1·V1=c2·V2
【例1】要配制500 mL 0.6 mol/L 的NaOH溶液,需 6 mol/L 的NaOH溶液多少毫升?
解:设需6 mol/L NaOH 溶液的体积为V 6 mol/L×V = 0.6mol/L ×0.5 L V = 0.05 L
3、将10 g NaOH溶解在250 mL水中,所得溶液中溶质的物质的量 浓度是否为1mol/L?
答:否,体积指的是溶液的体积,而不是溶剂的体积。
4.与50 mL 0.1 mol/L Na2CO3溶液中Na+的
物质的量浓度相同的溶液是( C )
A.50 mL 0.1 mol/L的NaCl溶液 B.25 mL 0.2 mol/L的Na2SO4溶液 C.100 mL0.2 mol/L的NaNO3溶液 D.10 mL 0.5 mol/L的Na2CO3溶液
答:不能,必须重新配制
7.摇匀 把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞, 用另一只手托住瓶底,把容量瓶倒转和摇动几次,混合均 匀。
思考:摇匀后发现液面低于刻度线,能否补充水?
答:不能。液面低于刻线是因为还有溶液挂壁,当静置后就会恢复原 状。
第二章
第三节
物质的量
第3课时 物质的量浓度
学习目标
1.了解物质的量浓度的概念。能运用物质的量浓度进行简单计算。 2.掌握一定物质的量浓度溶液的配制方法
一、物质的量浓度
1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理 量,叫做溶质B的物质的量浓度。
2、符号:cB 3、表达式:物质的量浓度=
溶液稀释的计算
溶液稀释h或浓缩前后,溶液的质量或体积发生变化,但溶 质的量(质量或物质的量)均不变。
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
c1·V1=c2·V2
【例1】要配制500 mL 0.6 mol/L 的NaOH溶液,需 6 mol/L 的NaOH溶液多少毫升?
解:设需6 mol/L NaOH 溶液的体积为V 6 mol/L×V = 0.6mol/L ×0.5 L V = 0.05 L
3、将10 g NaOH溶解在250 mL水中,所得溶液中溶质的物质的量 浓度是否为1mol/L?
答:否,体积指的是溶液的体积,而不是溶剂的体积。
4.与50 mL 0.1 mol/L Na2CO3溶液中Na+的
物质的量浓度相同的溶液是( C )
A.50 mL 0.1 mol/L的NaCl溶液 B.25 mL 0.2 mol/L的Na2SO4溶液 C.100 mL0.2 mol/L的NaNO3溶液 D.10 mL 0.5 mol/L的Na2CO3溶液
答:不能,必须重新配制
7.摇匀 把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞, 用另一只手托住瓶底,把容量瓶倒转和摇动几次,混合均 匀。
思考:摇匀后发现液面低于刻度线,能否补充水?
答:不能。液面低于刻线是因为还有溶液挂壁,当静置后就会恢复原 状。
溶液物质的量浓度(molL)
把碳酸钾换成Na 把碳酸钾换成Na2CO3·10H20又 10H 怎样呢? 怎样呢? 27. 水中, 4 、 27.6g 碳酸钾溶解在 g 水中 , 才能使每10 个水分子中含有一个钾离子, 10个水分子中含有一个钾离子 才能使每 10 个水分子中含有一个钾离子 , 所得溶液的密度为1 所得溶液的密度为1.2g/cm3,则溶液的物质 的量浓度为 。 5、7.8g金属钾溶解在 7.8g金属钾溶解在 g水中才能使 50个水分子中含有一个钾离子 个水分子中含有一个钾离子, 每50个水分子中含有一个钾离子,所得溶 液溶质的质量Cl溶解 在标准状况下,500体积的HCl溶解 体积的HCl 体积的水中,所得溶液的密度为d 在1体积的水中,所得溶液的密度为d ),则所得溶液的质量分数和 (g/mL ),则所得溶液的质量分数和 物质的量浓度分别为多少? 物质的量浓度分别为多少?
10、 10、等物质的量的氢气和氦气具有相同的 A、原子数 B、质子数 C、质量 D、中子数 11、在同温同压下, 11、在同温同压下,A容器中的氢气和 容器中的氨气, B容器中的氨气,若它们所含的分子总 数相等, 数相等,则两容器的体积比为 。
Na2O2
6、37%的盐酸,密度为1.19g/cm3,求 37%的盐酸,密度为1.19g/cm 的盐酸 其物质的量浓度? 其物质的量浓度? 7、98%的硫酸,密度为1.84g/cm3,求 98%的硫酸,密度为1.84g/cm 的硫酸 其物质的量浓度? 其物质的量浓度? 8、某气体在标准状况下的密度为 1.977g/L, 1.977g/L,则这种气体的摩尔质量 为 。
18、如图, 18、如图,一密闭气缸被 一不漏气可滑动的活塞隔 H2和O2 开成两部分, 开成两部分,左边充有氮 N2 右边充有H 气,右边充有H2和O2.在 室温下将右边的气体点燃, 室温下将右边的气体点燃, 反应后冷却至原室温, 反应后冷却至原室温,活 N2 塞最终静止于气缸的中点 液体体积忽略不计) (液体体积忽略不计),则 原来氢气和氧气的体积比可能是( 原来氢气和氧气的体积比可能是( ) A.2∶7 B.7∶2 C.4∶5 D.8∶1
物质的量浓度溶液PPT教学课件

典例精析【例1】某化学课外小组的学生提出实验室制取氨气
的几种方法,其中比较简便易行的方案是 ( B ) A.硫酸铵固体与石灰石共热 B.浓氨水逐滴加到新制生石灰中 C.在一定条件下H2与N2化合 D.加热分解氯化铵固体
【评注】制备实验方案的选择应根据原理正确、条件简单、 操作简便、易于分离等原则进行分析、取舍。
液的密度为ρ g/ml,质量分数为ω,求CB=?
分析:1L (aq)
含有
nB(mol)
1000 ml (aq) m (aq) = 1000ml·ρg/ml
M g/mol
mB = m(aq) × ω= 1000ml·ρg/ml ·ω
有:CB=
1000 ·ρ·ω
M
mol/L
CB= 1000M ·ρ·ω mol/1L
课前体验5.化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材
料,实验室可以用如下的方法来制备这种材料并测定这 种材料的组成。
Ⅰ.制备
(1)结晶时应将溶液用冰水冷却并在黑暗处等待晶体的
析出,这样操作的原因是 用冰水冷却有利于析出更多
的晶体、黑暗可以防止晶体分解
(2)操作Ⅲ的名称是
过滤、洗涤
8、将5mol / L的Mg(NO3)2溶液 amL取出一半加水稀释至bmL,问稀 释后的溶液中NO3-的物质的量浓 度为____
9.用密度为ρ1g/cm3,质量分数是ω的 浓盐酸,配制成体积比为1:4的稀盐酸,密 度为ρ2g/cm3,则所配制稀盐酸的物质的
量浓度为(C )
A.1000ρ1ρ2ω
课前体验Ⅱ.组成测定
称取一定量的晶体置于锥形瓶中,加入足量的蒸馏水和
稀 硫 酸 , 将 C2O42− 转 化 为 H2C2O4 后 用 0.1000 mol/L KMnO4溶液滴定,当消耗KMnO4溶液24.00 mL时恰好 完全反应;再向溶液中加入适量的还原剂,恰好将Fe 3+完
