小鼠硫氧还蛋白还原酶(TrxR)酶联免疫分析试剂盒使用说明书
硫氧还蛋白_Trx_的研究进展

分子植物育种,2006年,第4卷,第6(S)期,第78-82页MolecularPlantBreeding,2006,Vol.4,No.6(S),78-82专题介绍Review硫氧还蛋白(Trx)的研究进展郑琼马旭俊杨传平*教育部林木遗传育种与生物技术重点实验室,东北林业大学林木遗传育种省级重点实验室,东北林业大学林学院,哈尔滨,150040*通讯作者,yangcp@nefu.edu.cn摘要硫氧还蛋白Thioredoxin(Trx)是一类高度保守的低分子量蛋白质。
Trx广泛分布于植物、细菌、酵母和动物中。
根据氨基酸序列的不同,Trx分为家族Ⅰ和家族Ⅱ2个家族。
根据最初结构的不同,Trx家族Ⅰ又被分为6大类型:h,f,m,o,x和y。
不同类型的Trx在不同生物以及细胞内的不同区域分布不同。
硫氧还蛋白具有多种生物学功能,对维持体内稳定的氧化还原状态具有重要的作用。
Trx具有调节细胞生长、抑制凋亡、调节基因转录等功能。
Trx还与植物抗逆性相关,如参与植物抗旱、耐热和抗氧化胁迫过程,调节抗逆基因的表达。
因此,我们可以将硫氧还蛋白基因通过转基因技术导入植物体中,在植物遗传性状改良等方面具有广泛的应用前景。
本文综述了硫氧还蛋白的类型、组织分布、生物学功能以及与植物抗逆性的关系。
关键词硫氧还蛋白(Trx),氧化还原,抗逆性FunctionalRolesofThioredoxin(Trx)ZhengQiongMaXujunYangChuanping*LaboratoryofForestryGeneticsandBreedingandBio-technology,KeyLaboratoryofMinistryofEducation,TheProvincialKeyLabofForestryGe-neticsandBreeding,CollegeofForestry,NortheastForestryUniversity,Harbin,150040*Correspondingauthor,yangcp@nefu.edu.cnAbstractThioredoxin(Trx)isasmallandconservativeprotein.Trxisubiquitouslyfoundinplants,bacteria,yeastsandanimals.Accordingtotheaminoacidsequences,TrxisdividedintofamilyⅠandfamilyⅡ.Accordingtothedifferenceoftheinitialstructure,TrxfamilyⅠisclassifiedinto6groups:h,f,m,o,xandy.DifferentgroupsofTrxexistindifferentorganismsanddifferentapartmentsofacell.Trxhasvariousbiologicalfunctionsinkeepingstableredoxstatusofcells.Trxplayscrucialrolesinregulatingcellgrowth,apoptosisandgenetranscrip-tion.Itisalsoinvolvedinplantstresstoleranceandregulatetheexpressionofstressrelatedgenes.Thestressesin-cludedrought,heatandotherreactiveoxygenstresses.SoweexpectTrxgenecanbefurtherusedinplanttraitmodificationbytransferringthisgeneintoplants.Thispaperreviewedthetype,distributionandbiologicalfunc-tionsofTrxanditsrelationshipwithplantstresstolerance.KeywordsThioredoxin(Trx),Redox,Stresstolerance硫氧还蛋白(thioredoxin,Trx)是一类分布广泛的低分子量的蛋白质,它们在进化上相当保守,有一个二硫化物活性中心Trp-Cys-Gly-Pro-Cys(CGPC),CGPC中的2个Cys分别为Cys32和Cys35,人和其它哺乳动物Trx还含有另外3个Cys残基,即Cys62、Cys69和Cys73,这些Cys残基能可逆地催化许多氧化还原反应,赋予Trx独特的生物学特性。
硫氧还蛋白还原酶小分子抑制剂的发现及抗肿瘤机制探讨

硫氧还蛋白还原酶小分子抑制剂的发现及抗肿瘤机制探讨硫氧还蛋白还原酶小分子抑制剂的发现及抗肿瘤机制探讨概述:肿瘤是全球范围内的主要致死疾病之一,因此,研究肿瘤的发生机制及开发新的治疗方法一直是科学家们的重要任务。
近年来,对肿瘤细胞内还原酶的研究表明,硫氧还蛋白还原酶(thioredoxin reductase, TrxR)在肿瘤细胞中起着重要的作用。
本文将介绍硫氧还蛋白还原酶小分子抑制剂的发现以及其在抗肿瘤机制方面的探讨。
硫氧还蛋白还原酶小分子抑制剂的发现:硫氧还蛋白还原酶是一种钴卟啉依赖的酶,可以将还原型硫氧还蛋白还原酶(Trx)重新还原为活性的二硫键形式。
研究表明,TrxR在许多肿瘤细胞中高度表达,并且与肿瘤细胞的增殖、转移和抗药性密切相关。
因此,开发高选择性的TrxR抑制剂成为治疗肿瘤的潜在策略。
研究人员通过化学合成和药物筛选等方法发现了许多TrxR抑制剂。
其中,一些小分子化合物显示出很高的抑制活性,并且被证实对多种肿瘤细胞有显著的抗肿瘤作用。
通过结构活性关系研究,研究人员发现这些抑制剂能够与TrxR活性中心的蛋白质残基形成稳定的非共价连接,从而抑制其催化活性。
在抗肿瘤机制方面:通过研究,发现TrxR抑制剂能够通过多种途径发挥抗肿瘤作用。
首先,抑制TrxR可以干扰细胞内的氧化还原平衡,导致细胞内氧化应激增加,从而减少肿瘤细胞的生存能力。
其次,TrxR抑制剂还可以通过抑制肿瘤细胞的增殖和诱导细胞凋亡来发挥抗肿瘤作用。
最后,一些研究表明TrxR抑制剂还具有抑制肿瘤细胞迁移和侵袭的能力。
此外,一些研究还发现TrxR抑制剂可以增强化疗药物对肿瘤细胞的敏感性,并减少肿瘤细胞对药物的耐药性。
这一发现为联合应用TrxR抑制剂和化疗药物提供了新的治疗策略。
结论:硫氧还蛋白还原酶小分子抑制剂的发现为肿瘤治疗提供了新的方向,其抗肿瘤机制主要通过干扰细胞内的氧化还原平衡、抑制肿瘤细胞增殖和诱导细胞凋亡等方式实现。
小鼠活性氧ROS酶联免疫分析ELISA
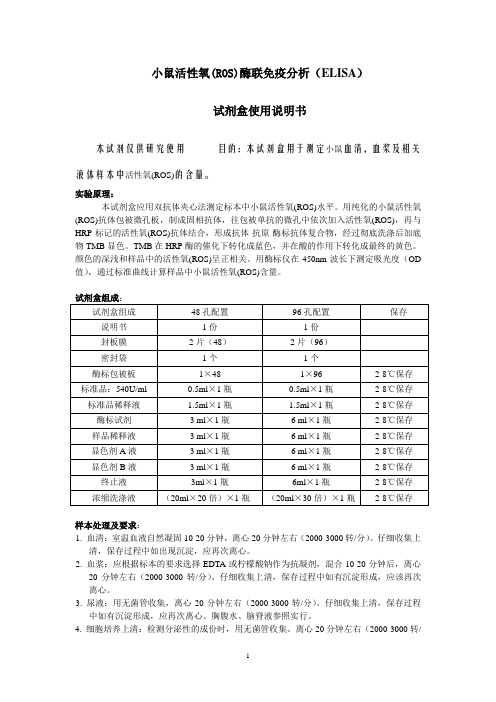
小鼠活性氧(ROS)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定小鼠血清,血浆及相关液体样本中活性氧(ROS)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中小鼠活性氧(ROS)水平。
用纯化的小鼠活性氧(ROS)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入活性氧(ROS),再与HRP标记的活性氧(ROS)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的活性氧(ROS)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠活性氧(ROS)含量。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
硫氧化还原蛋白试剂盒介绍

硫氧化还原蛋白试剂盒介绍本试剂盒用于体外定量检测血清、血浆、组织匀浆及相关液体样本中小鼠硫氧化还原蛋白(Trx)的含量。
有效期:6个月保存条件:2-8℃本试剂盒仅供科研使用,不得用于临床诊断实验原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被小鼠硫氧化还原蛋白(Trx)捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成终的黄色。
颜色的深浅和样品中的小鼠硫氧化还原蛋白(Trx)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),计算样品浓度。
样本处理及要求1.血清:将收集于血清分离管的全血标本在室温放置2小时或4℃过夜,然后1000×g离心20 分钟,取上清即可,或将上清置于-20℃或-80℃保存,但应避免反复冻融。
2.血浆:用EDTA或肝素作为抗凝剂采集标本,并将标本在采集后的30分钟内于2-8℃1000×g离心15分钟,取上清即可检测,或将上清置于-20℃或-80℃保存,但应避免反复冻融。
3. 组织匀浆:用预冷的PBS (0.01M, pH=7.4)冲洗组织,去除残留血液(匀浆中裂解的红细胞会影响测量结果),称重后将组织剪碎。
将剪碎的组织与对应体积的PBS(一般按1:9的重量体积比,比如1g的组织样品对应9mL的PBS,具体体积可根据实验需要适当调整,并做好记录。
推荐在PBS中加入蛋白酶抑制剂)加入玻璃匀浆器中,于冰上充分研磨。
为了进一步裂解组织细胞,可以对匀浆液进行超声破碎,或反复冻融。
后将匀浆液于5000×g离心5~10分钟,取上清检测。
4. 细胞培养物上清或其它生物标本:请1000×g离心20分钟,取上清即可检测,或将上清置于-20℃或-80℃保存,但应避免反复冻融。
注:标本溶血会影响后检测结果,因此溶血标本不宜进行此项检测。
小鼠活性氧ROS酶联免疫分析ELISA

小鼠活性氧(ROS)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定小鼠血清,血浆及相关液体样本中活性氧(ROS)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中小鼠活性氧(ROS)水平。
用纯化的小鼠活性氧(ROS)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入活性氧(ROS),再与HRP标记的活性氧(ROS)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的活性氧(ROS)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠活性氧(ROS)含量。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
硫氧还蛋白氧化还原酶(TrxR)活性检测试剂盒说明书 微量法

硫氧还蛋白氧化还原酶(TrxR)活性检测试剂盒说明书微量法注意:正式测定前务必取2-3个预期差异较大的样本做预测定货号:BC1155规格:100T/96S产品内容:试剂一:液体120mL×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃避光保存。
临用前加入2mL蒸馏水溶解。
试剂三:粉剂×1瓶,4℃避光保存。
临用前加入2mL蒸馏水溶解。
试剂四:液体×1支,-20℃避光保存。
产品说明:TrxR是一种NADPH依赖的包含FAD结构域的二聚体硒酶,属于吡啶核苷酸-二硫化物氧化还原酶家族成员,与硫氧还蛋白以及NADPH共同构成了硫氧还蛋白系统。
TrxR与GR活性类似,催化GSSG还原生成GSH,是谷胱甘肽氧化还原循环关键酶之一。
TrxR催化NADPH还原DTNB生成TNB和NADP+,TNB在412nm有特征吸收峰,通过测定412nm波长处TNB 的增加速率,即可计算TrxR活性。
自备仪器和用品:低温离心机、可调节移液器、可见分光光度计/酶标仪、微量玻璃比色皿/96孔板、蒸馏水。
操作步骤:一、粗酶液提取:1、称约0.1g样品,加入1mL试剂一,冰上充分研磨,10000rpm4℃离心10min,取上清液待测。
2、细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3s,间隔7s,总时间3min),然后10000rpm,4℃,离心10min,取上清置于冰上待测。
测定前将上清液与试剂四以50:1的体积比混匀(即取100μL上清液加入2μL试剂四混合)37℃水浴30min后至冰上。
二、TrxR测定操作:1.分光光度计或酶标仪预热30min后,调节波长到412nm,用蒸馏水调零。
2.试剂一在25℃(一般物种)或者37℃(哺乳动物)预热30min。
3.空白管:取微量玻璃比色皿或96孔板,加入20μL试剂二,20μL试剂三,160μL试剂一,迅速混匀后于412nm测定10s时的吸光度,37℃水浴5min迅速拿出测量412nm下的吸光度记为A1和A2。
硫氧还蛋白还原酶1及其相关信号通路研究进展

硫氧还蛋白还原酶1及其相关信号通路研究进展李宝荣;熊咏民【摘要】硫氧还蛋白还原酶1(thioredoxin reductase 1,TrxR1)是维持机体稳态重要屏障的抗氧化系统成员.近年来,TrxR1相关信号通路的研究逐步受到关注.因此,本文将从硫氧还蛋白系统着手,对TrxR1及其相关信号通路的研究进展进行阐述,以期为TrxR1在疾病中的作用机制阐明提供新思路.【期刊名称】《国外医学(医学地理分册)》【年(卷),期】2018(039)003【总页数】4页(P272-275)【关键词】硫氧还蛋白还原酶1;核因子E2相关因子-2;c-Jun N-端激酶;κ基因结合核因【作者】李宝荣;熊咏民【作者单位】西安交通大学医学部公共卫生学院地方病研究所,国家卫计委微量元素与地方病重点实验室,陕西西安710061;西安交通大学医学部公共卫生学院地方病研究所,国家卫计委微量元素与地方病重点实验室,陕西西安710061【正文语种】中文【中图分类】R684人体抗氧化系统是机体应对各种内外环境刺激以及维持机体代谢平衡的重要屏障,其可分为酶性抗氧化系统和非酶性抗氧化系统。
前者主要由硫氧还蛋白还原酶(thioredoxin reductase,TrxR)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)等组成;后者主要包括具有氧化还原活性的非酶性物质(例如:谷胱甘肽、硫氧还蛋白(Trx)、维生素E、维生素C等)。
硫氧还蛋白系统是机体酶性抗氧化系统的重要组成部分,主要通过信号通路的转导参与细胞呼吸、代谢、免疫及其目标信号蛋白活性和功能的调节等生物学过程,进而在维持机体稳态以及调节氧化还原信号等过程中发挥至关重要的作用。
1 硫氧还蛋白系统TrxR、Trx和还原型辅酶(nicotinamide adenine dinucleotide phosphate,NADPH)共同构成了硫氧还蛋白系统,是细胞内重要的抗氧化系统之一。
过表达TrxR1重组HEK293细胞株的构建和鉴定

硫氧还蛋白还原酶1(TrxR1)属于吡啶核苷酸二硫化物氧化还原酶家族,作为目前已知的唯一能够还原硫氧还蛋白(Trx )的酶,TrxR1可以将氧化型的Trx 还原成还原型Trx [1]。
还原型的Trx 能够还原多种蛋白的二硫键,进而调控细胞的多种生物进程,如细胞增殖、分化以及凋亡等等[2]。
肿瘤细胞的代谢水平远高于正常细胞,因而在细胞内会产生大量活性氧[3]。
因此,肿瘤细胞往往会通过诱导抗氧化酶的表达来维持自身的氧化还原稳态,而TrxR1是其中一种被诱导的抗氧化酶。
近年来研究发现,TrxR1在多种肿瘤组织和细胞中高表达,如乳腺癌[4]、胃癌[5]、肺癌[6]和肠癌[7]等,并通过蛋白激酶B (PKB,又名AKT )、丝裂原活化蛋白激酶(MAPK )及信号传导及转录激活蛋白3(Stat3)等信号通路促进肿瘤细胞增殖、抑制凋亡及诱导耐药,是一个理想的抗肿瘤药物开发靶点[3,8]。
目前靶向TrxR1的药物具有丰富的骨架结构,但尚无进入临床使用的TrxR1靶向药物,其中一大制约因素就是Construction and identification of a HEK293cell line with stable TrxR1overexpressionLÜXiaomei 1,ZHOU Zhiyin 1,ZHU Li 1,ZHOU Ji 2,HUANG Huidan 1,ZHANG Chao 1,LIU Xiaoping 11Center of Drug Screening and Evaluation,Wannan Medical College,Wuhu 241000,China;2Center for Reproductive Medicine,First Affiliated Hospital of Wannan Medical College,Wuhu 241000,China摘要:目的构建稳定过表达硫氧还蛋白还原酶1(TrxR1)的HEK293细胞株,为TrxR1的功能研究以及靶向TrxR1药物筛选提供细胞模型。
ELISA试剂盒说明书……IFN-γ

(IFN-γγ)酶联免疫分析(ELISA)小鼠γ干扰素(IFN-试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定小鼠血清,组织及相关液体样本中γ干扰素(IFN-γ)含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中小鼠γ干扰素(IFN-γ)水平。
用纯化的小鼠γ干扰素(IFN-γ)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入γ干扰素(IFN-γ),再与HRP标记的羊抗鼠抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的γ干扰素(IFN-γ)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠γ干扰素(IFN-γ)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:1800ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA、柠檬酸钠或肝素作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
【豆丁推荐】-硫氧还蛋白_1_Trx1_氧化还原状态的检测

豆 丁 推 荐 ↓精 品 文 档(首都医科大学细胞生物学系,肝脏保护与再生调节北京市重点实验室,北京100069)摘要硫氧还蛋白-1(thioredoxin-1,Trx1)是一种广泛存在于生物体内的氧化还原调节蛋白,其氧化还原状态的变化是细胞内发挥氧化还原调控作用的重要过程.本文建立了Trx1氧化还原状态的检测方法—氧化还原蛋白免疫印迹法(redox Western blot ),即通过碘乙酸(IAA )标记Trx1,根据蛋白所带负电荷的不同,达到分离蛋白氧化与还原状态的目的,并根据能斯特方程计算出相应的氧化还原电势.本方法是在蛋白免疫印迹(Western blot )的基础上建立的,具有低成本、易操作的特点.实验中分别采用H 2O 2和DTT 处理样本,利用此方法检测了细胞裂解液中、细胞内及过表达Trx1氧化还原电势的变化;并检测了HEK293细胞不同生长时期Trx1的氧化还原状态.关键词硫氧还蛋白-1;氧化还原;碘乙酸;氧化还原蛋白免疫印迹法中图分类号Q33Assay for Thioredoxin-1(Trx1)Redox StateGAO Wei ,GU Li ,YANG Hui-Min ,ZHANG Hong(Department of Cell Biology ,Municipal Laboratory for Liver Protection and Regulation of Regeneration ,Capital Medical University ,Beijing100069,China )Abstract Thioredoxin-1(Trx1)is a 12kD redox regulatory protein that is ubiquitously expressed in avariety of organisms.We have established a Western Blot-based method to distinguish the oxidized Trx1from the reduced form that carrying difference charges when labeled with iodoacetic acid (IAA ).The redox potentials can be calculated according to the Nernst equation.This method is cost-effective and easy-to-use in measuring the redox potentials in cell lysates ,wild type or trx1-overexpresssion cells with /without either H2O2or DTT treatmemt.With the method ,we detected that the Trx1redox state varied at different stages of cell growth.Key words thioredoxin-1;redox ;iodoacetic acid ;redox Western blot 收稿日期:2009-12-25;接受日期:2010-03-12国家自然科学基金项目(No.30973406),北京市自然科学基金(No.5102011)和北京市教育委员会科技发展计划项目(No.KM200910025001)*联系人Tel :010-********;E-mail :hzhang@Received :November 25,2009;Accepted :March 12,2010细胞的增殖、分化及凋亡受细胞内外多种因素的调节,而氧化还原状态的改变对调控细胞的生存或死亡尤为重要.细胞内氧化还原状态的变化受到细胞内的氧化还原因子的调控.细胞内存在的氧化还原调控系统有多种,其中,谷氧还蛋白氧化还原系统和硫氧还蛋白氧化还原系统[1,2]颇受重视.硫氧还蛋白系统由硫氧还蛋白还原酶(TrxR )、烟酰胺腺嘌呤二核苷酸磷酸(NADPH )和硫氧还蛋白(Trx )组成[3].Trx1是一种小分子蛋白(12kD ),由104个氨而实现[5].Trx1作为一种氧化还原调控蛋白在细胞的各种生理活动中发挥着重要的作用,其调控方式主要第4期高卫等:硫氧还蛋白-1(Trx1)氧化还原状态的检测通过氧化还原状态的变化实现.Trx1不仅可以通过清除ROS来抵抗细胞内的氧化应激,还可以作为一种生长因子促进细胞的生长[4].除此之外,Trx1还能够与某些含有半胱氨酸残基的蛋白质相互作用从而调控这种蛋白的功能[6].另外,Trx1还与某些疾病的发病机制密切相关[7].氧化应激参与体内多种生理活动及疾病的发生[8,9],因此,寻找能够探测体内氧化还原状态的生物学指标对研究氧化应激参与的细胞生理活动极为重要.目前,已知的检测细胞内氧化还原电势的方法,通常通过检测还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)的含量比值,计算其氧化还原电势.对于对细胞氧化应激起重要调控作用的Trx1蛋白,目前还没有一种直接有效的方法来检测其氧化还原状态的变化.因此,我们建立了氧化还原蛋白免疫印迹法(redox Western blot)检测Trx1的氧化还原状态及电势.此方法是在蛋白免疫印迹(Westernblot)基础上,通过碘乙酸(IAA)标记达到分离蛋白的目的.由于还原型Trx1中含有巯基(-SH),可以与带负电荷的碘乙酸结合,而氧化型的Trx1含有二硫键(-S-S-),不能与碘乙酸结合,根据还原型和氧化型Trx1所带负电荷的不同,通过非变性丙烯酰胺凝胶电泳可以将其分离出来.本实验中,我们采用H2O2和DTT处理细胞,建立Trx1氧化还原体系,通过本方法有效地分离氧化状态和还原状态的Trx1,并根据能斯特方程计算出相应的氧化还原电势.1材料与方法1.1材料HeLa细胞与HEK293细胞均为本实验室液氮保存细胞株.将细胞复苏后,用含10%新生牛血清、100U/mL青霉素和链霉素的DMEM全培养基培养在为37ħ、5%CO2培养箱中.pcDNA3.1质粒为本实验室保存,pcDNA3.1-Trx1为美国Emory大学赠送.垂直板电泳装置(0.75mm)购于Bio-Rad公司;恒温水浴箱购于北京市长风仪器仪表公司;转移脱色摇床TS-8型和脱色摇床TS-1型购于江苏海门市其林贝尔仪器制造有限公司;G-25microspin柱购于GE-Healthcare公司;Tween-20、EDTA、二硫苏糖醇(DTT)、Trition X-100、碘乙酸(IAA)、盐酸胍(guanidine HCl)均购于Sigma公司;甘氨酸购于Merck公司;H2O2购于Alfa Aesar公司;丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、TEMED均购于北京鼎国生物技术有限公司;脱脂奶粉为国产伊利奶粉;Western blot超敏发光液购于北京普利莱基因技术有限公司;兔抗人Trx1购于Abcam公司;鼠抗人V5购于Invitrogen公司;羊抗兔IgG和羊抗鼠IgG购于Jackson Immuno Research公司.1.2试剂配制非变性丙烯酰胺凝胶无SDS,SDS的量用水补齐,其他部分同丙烯酰胺凝胶的配制;G-lysis缓冲液为细胞裂解液,其成分为:pH值为8.3的50 mmol/L Tris,3mmol/L EDTA,6mol/L盐酸胍,0.5% TritonX-100组成.每次使用之前,加入9.3mg/mL或18.6mg/mL的IAA,用10mmol/L NaOH调pH到8.3,配成含有IAA的G-lysis缓冲液使用液;5ˑ蛋白上样缓冲液主要成分为:310mmol/L pH值为6.8的Tris,50%甘油,加溴酚蓝至饱和浓度;非变性凝胶电泳缓冲液,成分为25mmol/L Tris-HCl,192 mmol/L甘氨酸;其他试剂及缓冲液同丙烯酰胺凝胶电泳.1.3氧化还原蛋白印迹法(redox Western blot)Trx1蛋白质氧化还原状态的检测:用G-lysis缓冲液收集细胞蛋白,加入等体积的含有100mmol/L IAA的G-lysis缓冲液,充分混匀,37ħ避光放置30 min,取出后G-25microspin柱过滤(按说明书操作).加入蛋白上样缓冲液电泳至溴酚蓝带泳出胶外8min,转至PVDF膜(40V,3h),5%封闭液室温封闭1h.加一抗(兔抗人Trx11ʒ15000)4ħ过夜,加二抗(1ʒ3000)室温1h.最后用超敏发光液化学发光,显影,定影.细胞内Trx1氧化还原状态的检测:用含有50 mmol/L IAA的G-lysis缓冲液收集细胞蛋白质,37ħ避光放置30min,取出后G-25microspin柱过滤.加入蛋白上样缓冲液电泳至溴酚蓝带泳出胶外8min,转至PVDF膜(40V,3h),5%封闭液室温封闭1h.加一抗(兔抗人Trx11ʒ15000)4ħ过夜,加二抗(1ʒ3000)室温1h.最后用超敏发光液化学发光,显影,定影.1.4能斯特方程计算氧化还原电势用Image J计算出氧化态Trx1和还原态Trx1黑度值即为其蛋白含量值,根据能斯特方程计算其氧化还原电势值.Eh=-254+30ˑlog(氧化态/还原态)2结果2.1Trx1蛋白质氧化还原状态的检测573中国生物化学与分子生物学报第26卷为了检测本实验方法的可行性,我们首先检测了细胞裂解液中Trx1蛋白氧化还原状态的变化.2.1.1细胞裂解处理将HeLa 细胞及HEK293细胞裂解,分别加入H 2O 2和DTT ,终浓度为0.5mmol /L 和5mmol /L ,作用30min 后,加入等体积含100mmol /L IAA 的G-lysis 缓冲液,用氧化还原蛋白免疫印迹法检测Trx1蛋白氧化还原状态.2.1.2细胞裂解液中Trx1蛋白氧化还原状态变化在HeLa 细胞中(Fig.1A ),未处理组,由于Trx1在空气中暴露一定时间,显示3种不同状态:部分Trx1未被氧化,为还原状态(第1条带);部分Trx1上只有1对半胱氨酸对Cys 32、Cys 35被氧化(第2条带);部分Trx1上Cys 32、Cys 35和Cys 62、Cys 69的2个半胱氨酸对均被氧化(第3条带).根据能斯特方程计算其氧化还原电势为-228mV.H 2O 2处理组中,Trx1全部被氧化(第3条带),氧化还原电势为-118mV.DTT 处理组中,Trx1全部被还原,呈现还原态(第1条带),氧化还原电势为-387mV.另外,用HEK293细胞做同样实验(Fig.1B ).结果表明:由于细胞系不同,未处理组的Trx1中2对半胱氨酸并没有完全被氧化,所以只检测到还原型和Cys 32、Cys 35被氧化的2条带,氧化还原电势为-248mV.在H 2O 2处理组和DTT 处理组中,Trx1氧化还原电势值分别为-45mV 和-460mV.Fig.1The detection of Trx1protein redox states in HeLa and HEK293cell lysates (A )HeLa cells and (B )HEK293cells were lysated with G-lysis buffer and treated with either 5mmol /L DTT or 0.5mmol /L H 2O 2for 30min.An equal volume of G-lysis buffer with 100mmol /L IAA was added and the samples were incubated in the dark for 30min at 37ħ.The proteins were separated by 15%non-reducing -PAGE.After transferred to the membrane ,the blots were probed with anti-Trx1antibody.Trx1redox potential was calculated by the Nernst equation.The results showed that in no-treated group ,Trx1had three bands which represented oxidized ,partially oxidized and reduced states ,respectively.In H 2O 2-treated group ,Trx1was totally oxidized ,therefore ,only oxidized band was observed.In DTT-treated group ,Trx1was reduced ,therefore ,only reduced band was observed.Values were mean ʃSE2.2细胞内Trx1蛋白氧化还原状态的检测由2.1实验可看出,本方法可以检测到细胞外处理Trx1蛋白其氧化还原状态的变化.由于Trx1的氧化还原反应主要发生于细胞内,为此我们进一步检测了细胞内处理Trx1其氧化还原状态的改变.2.2.1样品处理分别将H 2O 2(0.5mmol /L )和DTT (5mmol /L )加入HeLa 及HEK293细胞培养基中,30min 后用含50mmol /L IAA 的G-lysis 缓冲液收集细胞,采用氧化还原蛋白免疫印迹法检测Trx1氧化还原状态.2.2.2细胞内Trx1蛋白氧化还原状态变化在Fig.2A 中,未处理组Trx1几乎全部以还原状态存在,其氧化还原电势与DTT 处理组相近(未处理组电势:-285mV ,DTT 组电势:-282mV ).当加入H 2O 2后,Trx1抵抗细胞中由H 2O 2造成的氧化应激而被部分氧化,氧化还原电势为-247mV.我们同样检测了HeLa 细胞中的Trx1氧化还原状态的变化(Fig.2B ).正常生长的HeLa 细胞内,Trx1的氧化还原状态和HEK293细胞内的Trx1氧化还原状态相同,全部为还原状态(结果未显示).HeLa 细胞经H 2O 2处理,Trx1形成2条蛋白条带,其中还原带型(第1条带)深而宽,氧化带型(第2条带)浅而窄,673第4期高卫等:硫氧还蛋白-1(Trx1)氧化还原状态的检测表明0.5mmol/L H2O2只能氧化HeLa细胞内较少部分Trx1,能斯特方程计算电势为-263mV.在DTT处理组中,由于Trx1全部被还原,只检测到还原态的Trx1(第1条带),能斯特方程计算电势为-327mV.在这2种细胞中,由于不同的细胞承受氧化应激的能力不同,所以Trx1发挥抗氧化作用的能力也不同.在2.1中的体外实验中,H2O2直接处理细胞裂解液,Trx1氧化程度明显高于H2O2处理细胞后Trx1在体内的氧化程度.这可能由于在检测细胞内Trx1氧化还原状态变化时,H2O2被加入到培养基中,只有部分进入细胞内;另外,体内其它抗氧化系统如GSH可能也参与了对H2O2的抵抗作用.Fig.2The detection of Trx1redox state in vivo(A)HEK293cells and(B)HeLa cells were treated with5mmol/LDTT and0.5mmol/L H2O2for30min,respectively,and lysated with G-lysis buffer with50mmol/L IAA.The extracts were incubated in the dark for30min at37ħ.The proteins were separated by15%non-reducing-PAGE.After transferred to the membrane,the blots were probed with anti-Trx1antibody.Trx1redox potential was calculated by the Nernst equation.The results showed that in no-treated group,three distinct bands corresponding to Trx1were visualized,which represented a fully oxidized,a partially oxidized and a reduced band,respectively.Trx1was essentially completely oxidized by0.5mmol/LH2O2and therefore only oxidized band was observed.In the groups treated with5mmol/L DTT for30min,Trx1was reduced and therefore only reduced band was observed.Values were meanʃSE2.3过表达Trx1蛋白体外氧化还原状态的检测为了验证本方法是否同样可以检测过表达Trx1氧化还原状态的变化,我们分别将带有V5标签的空载体pcDNA3.1和pcDNA3.1-Trx1质粒瞬时转染入HEK293细胞中,48h后,用G-lysis缓冲液将细胞裂解,然后分别加入0.5mmol/L H2O2和5mmol/L DTT处理30min,再加入等体积含有100mmol/L IAA的G-lysis缓冲液标记还原型的Trx1,采用氧化还原蛋白免疫印迹法,利用V5抗体检测过表达的Trx1蛋白氧化还原状态的变化.如Fig.3所示,转染空载体组未检测到带有V5标签的Trx1的表达.H2O2和DTT直接处理细胞裂解液中提取出来的过表达Trx1,由于未处理组中的Trx1有少部分被空气氧化,出现1条浅而窄的氧化状态Trx1(第2条带),氧化还原电势为-248mV;H2O2处理后Trx1全部被氧化(第3条带),氧化还原电势为-38mV;DTT处理组Trx1全部为还原状态(第1条带)氧化还原电势为-478mV.体外处理带V5标签Trx1的氧化还原状态变化结果和Fig.1B中Trx1蛋白氧化还原状态的变化一致,这说明本方法对过表达的Trx1(带有V5标签)同样具有适用性.2.4细胞在不同生长时期Trx1氧化还原电势不同据文献[10]报道,活性氧(ROS)对细胞周期具有影响作用,由于Trx1可作为一种ROS清除剂,为此我们检测了不同细胞生长时期Trx1氧化还原状态的变化.将HeLa细胞饥饿24h后,使细胞停滞在G1期,然后加入含有10%血清的DMEM培养基,分别在不同的培养时间(6h、7.5h、9h、12h)收集细胞,用redox Western blot方法检测细胞内Trx1蛋白氧化还原状态,并计算其对应的氧化还原电势.从Fig.4A中可以看出,在细胞的不同生长期,氧化状态的Trx1含量有所不同,从培养时间0至9h逐渐增多,能斯特方程计算其氧化还原电势(Fig.4B)由-289mV升高至-266mV.在12h,Trx1大部分又恢复到还原状态,电势又下降到-286mV左右.773中国生物化学与分子生物学报第26卷Trx1在不同时间内氧化还原状态的变化也可以间接说明,ROS 可以影响细胞的生长,并且Trx1在不同的细胞生长时期起到了一定的调控作用.Fig.3The detection of over-expressed Trx1redox state HEK293cells were transfected with either vectorpcDNA3.1or pcDNA3.1-v5-Trx1.After 48hours posttransfection ,cells were lysated with G-lysis buffer and treated with 5mmol /L DTT and 0.5mmol /L H 2O 2for 30min ,respectively.An equal volume of G-lysis buffer with 100mmol /L IAA and the samples were incubated in the dark for 30min at 37ħ.The proteins lysates were separated by 15%non-reducing-PAGE.After transferred to the membrane ,the blots were probed with anti-V5tag antibody.Trx1redox potential was calculated by the Nernst equation.The results showed that in no-treated group ,three distinct bands corresponding to V5-Trx1were visualized ,which represented a fully oxidized ,a partially oxidized and a reduced band ,respectively.V5-Trx1was essentially completely oxidized by 0.5mmol /L H 2O 2and therefore only oxidized band was observed.In the groups treated with 5mmol /L DTT for 30min ,V5-Trx1was reduced and therefore only reduced band was observed.Values were mean ʃSEFig.4The detection of Trx1redox potential at different periods of cell growth HeLa cells were starved in serum-freeDMEM for 24hours ,and incubated with DMEM containing 10%serum for the indicated time.Then the cells were harvested with G-lysis buffer with 50mmol /L IAA and incubated in dark for 30min at 37ħ.The proteins lysates were separated by 15%non -reducing -PAGE.After transferred to the membrane ,the blots were probed with anti-Trx1antibody.The Trx1redox potential was calculate by the Nernst equation.The results showed that Trx1redox potential increased from -289mV to -266mV in a time dependent manner within 9hours and then decreased to -286mV at 12hours.Values were mean ʃSE3讨论硫氧还蛋白自上世纪60年代被发现以后[11],越来越受到人们的重视.研究表明,这种蛋白质广泛存在于各种生物体内.Trx 家族如TrxR 等在细胞内外发挥着非常重要的作用.Trx 蛋白在不同种属的生物体中结构有所不同,在同一细胞系中也存在着发挥不同作用的不同结构形式,但是其发挥作用的方式基本相同,因为它们共同拥有一个保守序列-Cys 32-Gly -Pro -Cys35-,并通过这段序列上的2个半胱氨酸残基上的-SH /-S-S-之间的转换发挥作用[12].由于还原状态和氧化状态的Trx1是通过巯基形成二硫键区分的,还原态的Trx1只脱掉氢离子形成氧化状态Trx1,因此2种状态的Trx1分子量并无明显差异,所以传统的利用蛋白质分子量的差异区分不同蛋白的方法无法将其分开.碘乙酸(IAA )很早被用于蛋白变性后封闭蛋白上的巯基,抑制蛋白复性.而我们的实验中,不仅利用了碘乙酸可以和巯基-SH 结合而不能和二硫键-S-S-结合的特性,而且引入了碘乙酸使蛋白带有较多负电荷的特点,通过蛋白所带负电荷的差异有效地将氧化还原状态不同的Trx1分离开.本方法不仅可以直接检测Trx1氧化还原状873第4期高卫等:硫氧还蛋白-1(Trx1)氧化还原状态的检测态的变化,而且提供了一种利用Trx1为抗氧化应激生物标志物研究细胞氧化还原调控的新方法.Trx1在细胞内具有非常重要的调控作用.据报道,这种蛋白质和癌症及心血管疾病的发生密切相关[7,10 12],特别在对癌症或和氧化应激有关的疾病的发病机制的研究中,Trx1更是一种热点蛋白质.在对这些疾病的研究中,Trx1被视为治疗或者预防癌症的新的药物靶位点.为此,氧化还原蛋白免疫印迹法(redox Western blot)不仅可以用来探测培养细胞的氧化还原状态的变化,还可以应用到动物实验以及肿瘤组织内氧化还原状态的研究中.本实验室利用此方法发现,烷化剂甲磺酸甲酯(MMS)可以有效改变细胞内Trx1氧化还原状态,但是烷化剂Cisplatin和引起DNA双链断裂的试剂4NQO却不能使细胞内Trx1氧化还原状态改变.而且,我们还发现,某种G蛋白偶联受体的激活也可以改变细胞内的Trx1氧化还原状态(待发表).所以,这种方法可以有效地应用在某些和氧化应激有关的实验研究中,直接反映细胞内氧化还原状态.另外,除了Trx1,参与调控细胞氧化还原状态的其它小分子蛋白,如TrxR、Prx3和Grx1,均有可能利用本方法检测其氧化还原状态的变化.我们的实验还显示,此方法对检测分子量较大的蛋白,效果不很理想.原因可能是,这些蛋白较大的分子量和复杂的分子结构,对其氧化还原状态的分离造成影响.总之,氧化应激作为影响细胞生理活动的重要因素之一,越来越多地引起研究者的关注.氧化应激和多种疾病密切关系的发现,使得细胞内参与氧化应激的蛋白成为人们研究的热点.本方法的建立可以有效地为寻找相关疾病中氧化还原调控的药物靶位点提供一种可行的研究方法.参考文献(References)[1]周彦,袁建刚,范凤朝,等.硫氧化还原蛋白与细胞内的氧化还原调控[J].生物工程进展(Zhou Yan,Yuan Jiang-Gang,Fan Feng-Chao,et al.Thioredoxin and redox regulation of theCell[J].Prog Biotechnol),2000,20(6):22-25[2]Go YM,Ziegler TR,Johnson JM,et al.Selective protection of nuclear thioredoxin-1and glutathione redox systems againstoxidation during glucose and glutamine deficiency in humancolonic epithelial cells[J].Free Rad Biol Med,2007,42:363-370[3]Spyrou G,Enmark E,Miranda-Vizuete A,et al.Cloning and expression of a novel mammalian thioredoxin[J].J Boil Chem,1997,272(5):2936-2941[4]董文甫,李艳红,岳文斌.硫氧还蛋白研究进展[J].草食家畜(Dong Wen-Fu,Li Yan-Hong,Yue Wen-Bin.Progress in thestudy of Thioredoxin[J].Grass-feeding livestock),2006,133(4):4-6[5]Walter H W,Jan P,William R M,et al.Redox potential of human thioredoxin1and identification of a second dithiol/disulfide motif[J].J Biol Chem,2003,278(35):33408-33415[6]Hirota K,Nakamura H,Masutani H,et al.Thioredoxin superfamily and thioredoxin-inducing agents[J].Ann N Y AcadSci,2002,957:189-199[7]梁鹏,张一娜,滕宗艳.硫氧还蛋白生物活性及其与人类疾病的关系[J].老年学杂志(Liang Peng,Zhang Yi-Na,TengZong-Yan.Thioredoxin biological activity and its relationshipwith human diseases[J].J Gerontol),2001,24(5):478-481[8]李梅,侯敢,黄迪南.肌肉萎缩与氧化应激[J].中国生物化学与分子生物学报(Li Mei,Hou Gan,Huang Di-Nan.Muscleatrophy and oxidative stress[J].Chin J Biochem Mol Biol),2009,25(5):415-420[9]海春旭,冯安吉,梁欣,等.自由基医学[M].西安:第四军医大学出版社(Hai Chun-Xu,Feng An-Ji,Liang Xin,et al.FreeRadical Medicine[M].Xi’an:Fourth Military MedicalUniversity Press),2006[10]Boonstra J,Post J A.Molecular events associated with reactive oxygen species and cell cycle progression in mammalian cells[J].Gene,2004,337(4):1-13[11]Powis G,Mustacich D,Coon A..The role of the redox protein thioredoxin in cell growth and cancer[J].Free Radic Biol Med,2000,29(3-4):312-322[12]Arnér ES,Holmgren A.The thioredoxin system in cancer[J].Semin Cancer Biol,2006,16(6):420-426973。
原虫硫氧还蛋白研究进展

原虫硫氧还蛋白研究进展熊康;周金林【摘要】硫氧还蛋白(Trx )是一种广泛存在于原核生物和真核生物中的小分子蛋白质,它和硫氧还蛋白还原酶(TrxR)、还原型烟酰胺腺嘌呤二核苷酸磷酸Ⅱ(NADPH)共同构成了硫氧还蛋白系统,是硫氧还蛋白系统的重要组成部分。
顶复门原虫作为胞内寄生虫,自身缺乏抗氧化的过氧化氢酶和谷胱甘肽过氧化物酶,依靠硫氧还蛋白系统抵抗宿主的氧化作用。
论文介绍了原虫 Trx 的结构,从抗氧化应激和蛋白结合等方面阐述了 Trx 的生物学活性及功能,介绍了 Trx 及其抑制剂在抗肿瘤等方面的研究进展,为抗原虫药物的发现提供参考。
%Thioredoxin (Trx),involved in the thioredoxin system with thioredoxin reductase (TrxR)and NADPH,is a small molecule protein and widely presents in prokaryotes and eukaryotes.Apicomplexan pro-tozoa,as intracellular parasites,are lack of antioxidant enzymes catalase and glutathione peroxidase.They rely on the thioredoxin system to resist host oxidation.This paper described the structure of protozoa Trx and the biological activity and function of Trx from oxidative stress and protein binding,and also intro-duced the research progress about Trx inhibitors on anti-tumor,and provided new research directions for the discovery of anti-protozoal drugs.【期刊名称】《动物医学进展》【年(卷),期】2016(037)004【总页数】5页(P77-81)【关键词】原虫;硫氧还蛋白;结构;功能;抑制剂【作者】熊康;周金林【作者单位】上海师范大学生命与环境科学学院,上海 200234; 中国农业科学院上海兽医研究所农业部动物寄生虫病重点实验室,上海 200241;中国农业科学院上海兽医研究所农业部动物寄生虫病重点实验室,上海 200241【正文语种】中文【中图分类】S852.72;Q51顶复门原虫是一类专一性的细胞内寄生原虫,包括巴贝斯虫(Babesia spp.)、弓形虫(Toxoplasma gondii)、隐孢子虫(Cryptosporidium spp.)、疟原虫(Plasmodium spp.)及艾美耳球虫(Eimeria spp.)等,是人和动物的重要病原。
硫氧还蛋白还原酶结构与功能研究进展

动物医学进展,2019,40(9):79-83Progress in Veterinary Medicine硫氧还蛋白还原酶结构与功能研究进展陆金苗⑺,韦娜娜2,周金林2*(1.上海师范大学生命与环境科学学院,上海200241,2.中国农业科学院上海兽医研究所,上海200241)摘 要:硫氧还蛋白还原酶(TrxR)是硫氧还蛋白系统里主要的功能蛋白,广泛存在于从原核生物到哺乳动物等多个物种之中。
TrxR 属于毗吱核昔酸/二硫氧化还原酶家族的成员,TrxR 主要通过氧化还原反应,传递电子.解除机体氧化应激反应,是机体抵抗体内外因素导致的氧化应激损伤的主要途径。
同时其参 与碳水化合物合成、胰岛素产生、脂肪代谢等多种生理过程,以及慢性炎症、肿瘤、动脉粥样硬化等疾病的发 生发展。
论文从TrxR 的结构和功能等方面进行综述,以对TrxR 研究提供参考。
关键词:硫氧还蛋白还原酶;氧化还原;结构与功能中图分类号:S852.3;Q554文献标识码:A 文章编号:1007-5038(2019)09-0079-05硫氧还蛋白(thioredoxin,Trx)系统是多个物种 普遍存在的二硫化物还原酶系统.由硫氧还蛋白 (Trx),硫氧还蛋白还原酶(thioredoxin reductase.TrxR)和还原型辅酶 U (triphosphopyridine nucleo tide, NADPH )组成TrxR 是目前已知的,唯一能够还原Trx 的酶⑵,通过二硫键还原酶活性调节 蛋白质的二硫醇/二硫键平衡。
TrxR 还原能力与氧化应激保持动态平衡,是保证机体正常的关键因素。
氧化应激因素包含超氧离子、轻自由基、过氧化氢等活性氧。
活性氧(reacti veoxygenspecies , ROS)通收稿日期:2018-09-14基金项目:国家重点基础研究发展计划(973计划)项目(2015CB150300)作者简介:陆金苗(1992-),女,陕西宝鸡人,硕士研究生,主要从事蝉和病原体研究。
新型硫氧还蛋白还原酶抑制剂的药物设计及生物应用

新型硫氧还蛋白还原酶抑制剂的药物设计及生物应用新型硫氧还蛋白还原酶抑制剂的药物设计及生物应用近年来,新型硫氧还蛋白还原酶(thioredoxin reductase,TrxR)抑制剂作为潜在的抗癌药物备受关注。
硫氧还蛋白还原酶是一种重要的氧化还原酶,参与细胞内氧化还原平衡的维持。
然而,一些研究证实,某些癌细胞中TrxR异常活跃,与肿瘤的发展和药物耐药性相关。
因此,开发TrxR抑制剂具有巨大的潜力成为肿瘤治疗以及其他相关疾病的新策略。
药物设计是药物研发过程中的核心环节,通过寻找合适的分子骨架,结合合适的活性基团和药物靶点进行灵敏性衍生,以达到最佳的药效与稳定性。
在新型硫氧还蛋白还原酶抑制剂的设计过程中,研究人员通常从天然产物、已知药物及合成化合物中发现具有抑制TrxR活性的分子。
通过结构改造和组合,优化药物分子的抑制效果和柔软度。
其中,结构修改和构效关系的研究是不可或缺的一部分。
这项工作展示了合理设计的重要性,参考结构活性关系,以及其他理论方法在药物分子的骨架构建和优化过程中的应用。
新型硫氧还蛋白还原酶抑制剂的设计不仅需要考虑药物的抑制效果,还需要考虑其生物利用度以及毒性。
因此,药物设计师需要充分理解分子的生物利用度和药代动力学特性,以确保药物的有效性和安全性。
此外,合适的药物制剂和给药途径也是非常重要的,可影响药物的稳定性、溶解度和吸收性。
当新型硫氧还蛋白还原酶抑制剂成功设计并合成后,其在生物体内的应用是至关重要的。
许多研究表明,TrxR抑制剂能够抑制肿瘤细胞的生长和增殖,并诱导细胞凋亡。
一些TrxR抑制剂还显示出对药物耐药性细胞株的抑制效果。
此外,一些研究指出TrxR抑制剂可用于治疗其他疾病,如炎症和神经系统疾病。
这些发现表明,新型硫氧还蛋白还原酶抑制剂具有广阔的生物应用前景。
尽管新型硫氧还蛋白还原酶抑制剂在肿瘤治疗和其他疾病治疗中显示出巨大的潜力,但是其临床应用仍然面临着许多挑战。
药物的选择性、药物代谢和排泄途径以及药物剂量和给药方式的优化,都是需要进一步研究的方向。
硫氧还蛋白还原酶(TrxR)活性检测试剂盒说明书

硫氧还蛋白还原酶(TrxR )活性检测试剂盒说明书微量法注意:本产品试剂有所变动,请注意并严格按照该说明书操作。
货号:AC10253规格:100T/96S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系本公司工作人员。
试剂名称规格保存条件试剂一液体120 mL×1瓶4℃保存试剂二液体3 mL×1瓶4℃保存试剂三粉剂×2支-20℃保存试剂四液体30μL ×1支-20℃保存溶液的配制:1、试剂三:临用前取1支加入1.667 mL 蒸馏水溶解,用不完的试剂-20℃保存1周。
2、试剂四:临用前根据样本数量将试剂四用无水乙醇稀释10倍后使用。
产品说明: TrxR 是一种NADPH 依赖的包含FAD 结构域的二聚体硒酶,属于吡啶核苷酸-二硫化物氧化还原酶家族成员,与硫氧还蛋白以及NADPH 共同构成了硫氧还蛋白系统。
TrxR 与GR 活性类似,催化GSSG 还原生成GSH ,是谷胱甘肽氧化还原循环关键酶之一。
TrxR 催化NADPH 还原DTNB 生成TNB 和NADP +,TNB 在412nm 有特征吸收峰,但还原型谷胱甘肽与DTNB 同样能反应生成TNB ,因此本试剂盒利用2-乙烯吡啶抑制样本中原有的还原型谷胱甘肽,通过测定412nm 波长处TNB 的增加速率,即可计算TrxR 活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:低温离心机、可调节移液器、可见分光光度计/酶标仪、微量玻璃比色皿/96孔板、研钵/匀浆器、蒸馏水、无水乙醇。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1、组织:按照组织质量(g ):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g 组织,加入1mL 试剂一)进行冰浴匀浆。
10000rpm ,4℃离心10min ,取上清置冰上待检测。
硫氧还蛋白的结构及在生物抗氧化中的功能

硫氧还蛋白的结构及在生物抗氧化中的功能硫氧还蛋白(Thioredoxin,Trx)是一类广泛存在于原核和真核生物体内的小分子蛋白质,具有维持生物体内氧化还原平衡和调控生物信号传导等多种功能。
Trx通过对目标蛋白质进行还原,从而调节机体的氧化还原平衡。
Trx与硫氧还蛋白还原酶(thioredoxinreductase,TrxR)及NADPH共同组成硫氧还蛋白系统参与众多生理过程。
细胞中的活性氧是导致生物氧化胁迫的一个主要方面。
Trx可以通过对细胞内被氧化的二硫键的还原来修复机体的氧化损伤,并通过这种方式防止机体衰老。
同时,Trx系统可以与其它氧化还原系统如谷胱甘肽(GSH)系统协调配合,并消除体内过多的活性氧。
硫氧还蛋白在生物抗氧化中起着重要的作用,能够调节细胞的氧化还原反应,保护细胞免受氧化损伤,促进细胞的健康生长。
48T 组织 小鼠细胞色素C氧化酶(COX)酶联免疫检测试剂盒使用说明书

小鼠细胞色素C氧化酶(COX)酶联免疫检测试剂盒使用说明书种属小鼠适用样本组织保存条件 2-8℃仅用于科研,不得用于医学诊断使用前仔细阅读本说明书。
本酶联免疫试剂盒是基于生物素双抗体夹心技术原理,来检测小鼠细胞色素C氧化酶(COX),只能用于研究用途,不得用于医学诊断。
一、用途:用于小鼠组织及相关液体样本中细胞色素C氧化酶(COX)的测定。
二、工作原理本试剂盒采用的是生物素双抗体夹心酶联免疫吸附法 (ELISA) 测定样品中细胞色素C氧化酶(COX)的水平。
向预先包被了小鼠细胞色素C氧化酶(COX)单克隆抗体的酶标孔中加入细胞色素C氧化酶(COX),温育;温育后加入生物素标记的抗COX抗体,再与链霉亲和素-HRP 结合,形成免疫复合物,再经过温育和洗涤,去除未结合的酶,然后加入底物A、B,产生蓝色,并在酸的作用下转化成最终的黄色。
颜色深浅与样品中细胞色素C氧化酶(COX)的浓度呈正相关。
三、试剂盒组成编号产品名称48T 96T1 标准品(80ng/ml)0.5ml 0.5ml2 标准品稀释液3ml3ml3 酶标包被板12孔×4条12孔×8条4 链霉亲和素-HRP3ml6ml5 浓缩洗涤液20×20ml30×20ml6 生物素标记的抗-COX抗体1ml1ml7 显色剂A液3ml6ml8 显色剂B液3ml6ml9 终止液3ml6ml10 说明书1份1份11 封板膜2张(48T)2张(96T)12 密封袋1个1个四、需要而未提供的试剂和器材1、37℃恒温箱2、标准规格酶标仪3、精密移液器及一次性吸头4、蒸馏水5、一次性试管6、吸水纸五、注意事项1、从2-8℃取出的试剂盒,在开启试剂盒之前要室温平衡至少30分钟。
酶标包被板开封后如未用完,板条应装入密封袋中保存。
2、各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。
3、严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准。
小鼠髓过氧化物酶(MPO)检测试剂盒说明书

小鼠髓过氧化物酶(MPO)检测试剂盒说明书本试剂盒仅供研究使用。
检测范围:96T3µg/L -160µg/L小鼠髓过氧化物酶(MPO)检测试剂盒使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中氧化低密度脂蛋白(ox-LDL)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人氧化低密度脂蛋白(ox-LDL)水平。
用纯化的人氧化低密度脂蛋白(ox-LDL)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入氧化低密度脂蛋白(ox-LDL),再与HRP 标记的氧化低密度脂蛋白(ox-LDL)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的氧化低密度脂蛋白(ox-LDL)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中人氧化低密度脂蛋白(ox-LDL)浓度。
试剂盒组成1 30 倍浓缩洗涤液20ml×1 瓶7 终止液6ml×1 瓶2 酶标试剂6ml×1 瓶8 标准品(320µg/L)0.5ml×1 瓶3 酶标包被板12 孔×8 条9 标准品稀释液1.5ml×1 瓶4 样品稀释液6ml×1 瓶10 说明书1 份5 显色剂A 液6ml×1 瓶11 封板膜2 张6 显色剂B 液6ml×1/瓶12 密封袋1 个标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3 的样品,因NaN3 抑制辣根过氧化物酶的(HRP)活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
160µg/L 5 号标准品150µl 的原倍标准品加入150µl 标准品稀释液80µg/L 4 号标准品150µl 的5 号标准品加入150µl 标准品稀释液40µg/L 3 号标准品150µl 的4 号标准品加入150µl 标准品稀释液20µg/L 2 号标准品150µl 的3 号标准品加入150µl 标准品稀释液10µg/L 1 号标准品150µl 的2 号标准品加入150µl 标准品稀释液2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
硫氧还蛋白_Trx_的研究进展

分子植物育种,2006年,第4卷,第6(S)期,第78-82页MolecularPlantBreeding,2006,Vol.4,No.6(S),78-82专题介绍Review硫氧还蛋白(Trx)的研究进展郑琼马旭俊杨传平*教育部林木遗传育种与生物技术重点实验室,东北林业大学林木遗传育种省级重点实验室,东北林业大学林学院,哈尔滨,150040*通讯作者,yangcp@nefu.edu.cn摘要硫氧还蛋白Thioredoxin(Trx)是一类高度保守的低分子量蛋白质。
Trx广泛分布于植物、细菌、酵母和动物中。
根据氨基酸序列的不同,Trx分为家族Ⅰ和家族Ⅱ2个家族。
根据最初结构的不同,Trx家族Ⅰ又被分为6大类型:h,f,m,o,x和y。
不同类型的Trx在不同生物以及细胞内的不同区域分布不同。
硫氧还蛋白具有多种生物学功能,对维持体内稳定的氧化还原状态具有重要的作用。
Trx具有调节细胞生长、抑制凋亡、调节基因转录等功能。
Trx还与植物抗逆性相关,如参与植物抗旱、耐热和抗氧化胁迫过程,调节抗逆基因的表达。
因此,我们可以将硫氧还蛋白基因通过转基因技术导入植物体中,在植物遗传性状改良等方面具有广泛的应用前景。
本文综述了硫氧还蛋白的类型、组织分布、生物学功能以及与植物抗逆性的关系。
关键词硫氧还蛋白(Trx),氧化还原,抗逆性FunctionalRolesofThioredoxin(Trx)ZhengQiongMaXujunYangChuanping*LaboratoryofForestryGeneticsandBreedingandBio-technology,KeyLaboratoryofMinistryofEducation,TheProvincialKeyLabofForestryGe-neticsandBreeding,CollegeofForestry,NortheastForestryUniversity,Harbin,150040*Correspondingauthor,yangcp@nefu.edu.cnAbstractThioredoxin(Trx)isasmallandconservativeprotein.Trxisubiquitouslyfoundinplants,bacteria,yeastsandanimals.Accordingtotheaminoacidsequences,TrxisdividedintofamilyⅠandfamilyⅡ.Accordingtothedifferenceoftheinitialstructure,TrxfamilyⅠisclassifiedinto6groups:h,f,m,o,xandy.DifferentgroupsofTrxexistindifferentorganismsanddifferentapartmentsofacell.Trxhasvariousbiologicalfunctionsinkeepingstableredoxstatusofcells.Trxplayscrucialrolesinregulatingcellgrowth,apoptosisandgenetranscrip-tion.Itisalsoinvolvedinplantstresstoleranceandregulatetheexpressionofstressrelatedgenes.Thestressesin-cludedrought,heatandotherreactiveoxygenstresses.SoweexpectTrxgenecanbefurtherusedinplanttraitmodificationbytransferringthisgeneintoplants.Thispaperreviewedthetype,distributionandbiologicalfunc-tionsofTrxanditsrelationshipwithplantstresstolerance.KeywordsThioredoxin(Trx),Redox,Stresstolerance硫氧还蛋白(thioredoxin,Trx)是一类分布广泛的低分子量的蛋白质,它们在进化上相当保守,有一个二硫化物活性中心Trp-Cys-Gly-Pro-Cys(CGPC),CGPC中的2个Cys分别为Cys32和Cys35,人和其它哺乳动物Trx还含有另外3个Cys残基,即Cys62、Cys69和Cys73,这些Cys残基能可逆地催化许多氧化还原反应,赋予Trx独特的生物学特性。
小鼠相关转录因子试剂盒说明书模板

小鼠Runt相关转录因子2 (RUNX2)酶联免疫吸附测定试剂盒使用说明书产品编号:E-EL-M1030(本试剂盒仅供体外研究使用、不用于临床诊断!)声明:尊敬的客户,感谢您选用本公司的产品。
本产品选用世界著名生产厂家的原料,采用专业ELISA kit生产技术制造。
适用于体外定量检测小鼠血清、血浆、组织匀浆或细胞培养上清液中天然和重组RUNX2浓度。
使用前请仔细阅读说明书并检查试剂组分!如有疑问,请及时联系伊莱瑞特生物科技有限公司试剂盒组成:[96T/48T](打开包装后请及时检查所有物品是否齐全完整)检测原理:本试剂盒采用双抗体夹心ELISA法。
用抗小鼠RUNX2抗体包被于酶标板上,实验时标本或标准品中的RUNX2会与包被抗体结合,游离的成分被洗去。
依次加入生物素化的抗小鼠RUNX2抗体和辣根过氧化物酶标记的亲和素。
抗小鼠RUNX2抗体与结合在包被抗体上的小鼠RUNX2结合、生物素与亲和素特异性结合而形成免疫复合物,游离的成分被洗去。
加入显色底物(TMB), TMB在辣根过氧化物酶的催化下现蓝色,加终止液后变黄。
用酶标仪在450nm波长处测0D值,RUNX2浓度与OD450值之间呈正比,经过绘制标准曲线求出标本中RUNX2的浓度。
标本收集:1. 血清:全血标本于室温放置2小时或4C过夜后于1000为离心20分钟, 取上清即可检测, 收集血液的试管应为一次性的无热原, 无内毒素试管。
2. 血浆:抗凝剂推荐使用EDTA.Na2,标本采集后30分钟内于1000 >g 离心15分钟, 取上清即可检测。
避免使用溶血, 高血脂标本。
3. 组织匀浆:用预冷的PBS (0.01M, pH=7.4)冲洗组织,以去除残留血液(匀浆中裂解的红细胞会影响测量结果) , 称重后将组织剪碎。
将剪碎的组织与对应体积的PBS(一般按1:9的重量体积比,比如1g的组织样本对应9mL的PBS,具体体积可根据实验需要适当调整,并做好记录。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠硫氧还蛋白还原酶(TrxR)酶联免疫分析
试剂盒使用说明书
本试剂盒仅供研究使用
预期应用
ELISA法定量测定小鼠血清、血浆、细胞培养物上清或其它相关液体中硫氧还蛋白还原酶(TrxR)含量。
实验原理
本试剂盒应用双抗体夹心酶标免疫分析法测定标本中TrxR水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入TrxR、生物素化的抗小鼠TrxR抗体、HRP 标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的TrxR呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制
1.酶联板:一块(96孔)
2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为100ng/ml,做系列倍比稀释后,分别稀释成50 ng/ml,25ng/ml,12.5ng/ml,6.25ng/ml,
3.12ng/ml,1.56ng/ml,0.78ng/ml,样品稀释液直接作为标准浓度0ng/ml,临用前15分钟内配制。
如配制50ng/ml标准品:取0.5ml100ng/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml/瓶。
4.检测稀释液A:1×10ml/瓶。
5.检测稀释液B:1×10ml/瓶。
6.检测溶液A:1×120ul/瓶(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预
先计算好的每次实验所需的总量配制(每孔100ul),实际配制时应多配制0.1-0.2ml。
如1ul 检测溶液A加99ul检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7.检测溶液B:1×120ul/瓶(1:100)临用前以检测稀释液B1:100稀释。
稀释方法同检测溶液A。
8.底物溶液:1×10ml/瓶。
9.浓洗涤液:1×30ml/瓶,使用时每瓶用蒸馏水稀释25倍。
10.终止液:1×10ml/瓶(2N H2SO4)。
标本的采集及保存
1.细胞培养物上清:请离心后收集上清,并将标本保存于-20℃,且应避免反复冻融。
2.血清:标本请于室温放置2小时或4℃过夜后于1000x g离心20分钟,取上清即可检测,或将标本放于-20℃保存,但应避免反复冻融。
3.血浆:可用EDTA或肝素作为抗凝剂,标本采集后30分钟内于2-8°C1000x g离心15分钟,或将标本放于-20℃保存,但应避免反复冻融。
注:标本溶血会影响最后检测结果,因此溶血标本不宜进行此项检测。
操作步骤
实验开始前,请提前配置好所有试剂,试剂或样品稀释时,均需混匀,混匀时尽量避免起泡。
每次检测都应该做标准曲线。
如样品浓度过高时,用样品稀释液进行稀释,以使样品符合试剂盒的检测范围。
1.加样:分别设空白孔、标准孔、待测样品孔。
空白孔加样品稀释液100ul,余孔分别加标准品或待测样品100ul,注意不要有气泡,加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀,酶标板加上盖或覆膜,37℃反应120分钟。
为保证实验结果有效性,每次实验请使用新的标准品溶液。
2.弃去液体,甩干,不用洗涤。
每孔加检测溶液A工作液100ul(取1ul检测溶液A加99ul 检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制),37℃,60分钟。
3.温育60分钟后,弃去孔内液体,甩干,洗板3次,每次浸泡1-2分钟,350ul/每孔,甩干。
4.每孔加检测溶液B工作液(同检测A工作液)100ul,37℃,60分钟。
5.温育60分钟后,弃去孔内液体,甩干,洗板5次,每次浸泡1-2分钟,350ul/每孔,甩干。
6.依序每孔加底物溶液90ul,37℃避光显色(30分钟内,此时肉眼可见标准品的前3-4孔有明显的梯度兰色,后3-4孔梯度不明显,即可终止)。
7.依序每孔加终止溶液50ul,终止反应(此时蓝色立转黄色)。
终止液的加入顺序应尽量与底物液的加入顺序相同。
为了保证实验结果的准确性,底物反应时间到后应尽快加入终止液。
8.用酶联仪在450nm波长依序测量各孔的光密度(OD值)。
在加终止液后15分钟以内进行检测。
注:
1.每次实验留一孔作为空白调零孔,该孔不加任何试剂,只是最后加底物溶液及2NH2SO4。
测量时先用此孔调OD值至零。
2.为防止样品蒸发,试验时将反应板放于铺有湿布的密闭盒内,酶标板加上盖或覆膜。
3.未使用完的酶标板或者试剂,请于2-8℃保存。
标准品、检测溶液A工作液、检测溶液B 工作液请依据所需的量配置使用。
请勿重复使用已稀释过的标准品、检测溶液A工作液或检测溶液B工作液。
4.建议检测样品时均设双孔测定,以保证检测结果的准确性。
洗板方法
手工洗板方法:吸去(不可触及板壁)或甩掉酶标板内的液体;在实验台上铺垫几层吸水纸,酶标板朝下用力拍几次;将推荐的洗涤缓冲液至少0.3ml注入孔内,浸泡1-2分钟,根据需
要,重复此过程数次。
自动洗板:如果有自动洗板机,应在熟练使用后再用到正式实验过程中。
特异性
本试剂盒可同时检测重组或天然的小鼠TrxR,且与其它相关蛋白无交叉反应。
计算
以标准物的浓度为横坐标(对数坐标),OD值为纵坐标(普通坐标),在半对数坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
注意事项
1.洗涤过程非常重要,不充分的洗涤易造成假阳性。
2.一次加样时间最好控制在5分钟内,如标本数量多,推荐使用排枪加样。
3.请每次测定的同时做标准曲线,最好做复孔。
4.如标本中待测物质含量过高,请先稀释后再测定,计算时请最后乘以稀释倍数。
5.在配制标准品、检测溶液工作液时,请以相应的稀释液配制,不能混淆。
6.底物请避光保存。
说明
1.在储存及孵育过程中避免将试剂暴露在强光中。
所有试剂瓶盖须盖紧以防止蒸发和污染,试剂避免受到微生物的污染,因为蛋白水解酶的干扰将导致出现错误的结果。
2.小心吸取试剂并严格遵守给定的孵育时间和温度。
请注意在吸取标本/标准品,酶结合物或底物时,第一个孔与最后一个孔加样之间的时间间隔如果太大,将会导致不同的“预孵育”时间,从而明显地影响到测量值的准确性及重复性。
而且,洗涤不充分将影响试验结果。
3.试剂盒保存:部分试剂保存于-20℃,部分试剂保存于2-8℃,具体以标签上的标示为准。
4.浓洗涤液会有盐析出,稀释时可在水浴中加温助溶。
5.刚开启的酶联板孔中可能会含有少许水样物质,此为正常现象,不会对实验结果造成任何影响。
6.中、英文说明书可能会有不一致之处,请以英文说明书为准。
7.所有的样品都应管理好,按照规定的程序处理样品和检测装置。
8.有效期:6个月。
