九年级化学用语大全(1至8单元)
初中化学用语(全)
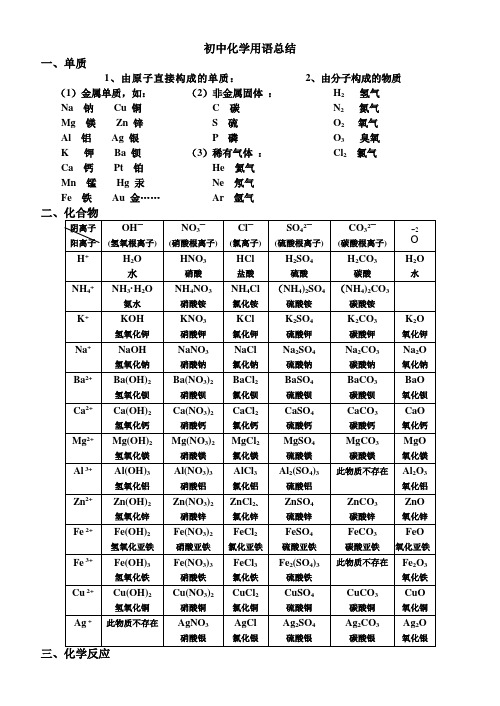
初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金……(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧: 五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+ 9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+ 8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
人教版九年级化学全册知识点汇总,中考复习必备

人教版九年级化学全册知识点汇总,中考复习必备一、化学用语1、常见元素及原子团的名称和符号非金属:O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属:K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根OH- NO3- CO3 2-硫酸根磷酸根铵根SO4 2- PO43- NH4+2、化合价口诀(1)常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;二、四、六硫四价碳;三、许多元素有变价,四、条件不同价不同。
(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
(3)熟练默写常见元素的常用的化合价+1价 K+ 、Na+ 、H+ 、Ag+ 、NH4++2价 Ca2+ 、Ba2+ 、Mg2+ 、Zn2+ 、Cu2+ 、 Hg2+、亚Fe2++3价 Fe3+ ,Al3+-1价 Cl-、OH-、NO3-3.必须熟记的制取物质的化学方程式(1)实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二:2H2O2 ===2H2O+O2↑(3)实验室制取氧气三:2KClO3===2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气:2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理:3CO+Fe2O3===2Fe+3CO2(9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:Ca CO3 ===CaO+CO2↑二、金属活动性顺序:金属活动性由至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(完整版)最完整的九年级化学用语2021

九年级化学用语(包括元素符号、结构示意图、化合价、离子符号、化学式、化学方程式)黔西县思源实验学校:白晋阳一、记住30 种元素的名称和符号。
H 氢Ar 氩He氦K钾Li锂Ca钙Be铍Zn锌B硼Fe铁C碳Sn锡N氮Cu铜O氧Hg汞F氟Ag银Ne氖Au金Na钠I碘Mg镁Ba钡Al铝Mn锰Si硅P磷S硫Cl氯二、原子结构示意图1~20 号元素原子结构示意图氢氦Li 锂铍硼H He Be B碳C氮O氧氟氖N F Ne钠Na镁铝硅磷Mg Al Si P钾K钙Ca硫氯氩S Cl Ar K Ca三、常见元素和根在化合物中的化合价一 价 氯 银 钠 钾 氢 , -1 +1 +1 +1 +1Cl Ag K Na H-2 +2 +2 +2 +2Mg Zn二 价 氧 钙 钡 镁 锌 , O +3 Al -2 Ca Ba +4Si-2铝 三 硅 四 要 记 住 , 碳 酸 硫 酸 二 价 根 , C O 3 -1 OH -3PO 4 SO 4+1N O 3 -1 氢 氧 硝 酸 铵 根 一 , NH 4还 有 三 价 磷 酸 根 。
说明:在初中化学中,具有可变化合价的元素是如下 8 种:C N P S Cl Cu Fe Mn但是它们的化合价不用去记! 在初中化学中,除了以上根的化合价需要记住以外,其它的根的化合价也不用去记。
四、常见离子符号(共 25 个):―(氯离子)、Ag + (银离子 )、 K + (钾离子 ) 、 Na + (钠离子 )、 H + (氢离子 ) ClO 2-(氧离子)、 Al 3+(铝离子 )Ca 2+ (钙离子 )、 Ba 2+ (钡离子 )、 Mg 2+ (镁离子 )、 Zn 2+ (锌离子 ) CO 32-(碳酸根离子 )、 OH -(氢氧根离子 )、 PO 43-( 磷酸根离子 )2- SO 4 (硫酸根离子 ) - + NO 3 (硝酸根离子 )、 NH 4 (铵根离子 )Fe 2+ (亚铁离子 )、 F e 3+ (铁离子 )、、Cu 2+ (铜离子 )、HCO 3-(碳酸氢根离子 )以及 4-(高锰酸根离子 )、 MnO 4 (锰酸根离子 )、 ClO 3 (氯酸根离子 2- - 2- )、SO 3 (亚硫酸根离 MnO 子 )、五、记住下列物质的化学式,且能将它正确分类㈠、单质氢气H 2氮气氯气氧气臭氧氦气N2 Cl 2 O2 O3 He氖气氩气Ne Ar碳硅硫磷碘C Si S P I2钾钙钠镁铝锌K Ca Na Mg Al Zn 铁铜汞银Fe Cu Hg Ag㈡、化合物1、氧化物水HSO3 CO2O 三氧化硫一氧化碳二氧化碳CO 2五氧化二磷过氧化氢P2O 5 H 2O 2二氧化氮NO 2二氧化硫氧化钙SO2CaO氧化亚铁氧化铁FeO Fe2 O3 四氧化三铁Fe3 O4 氧化镁氧化锌二氧化锰MgO ZnO MnO 2氧化汞氧化铝HgO Al 2O 3氧化铜CuO 2、酸碱盐硝酸HNO 硫酸盐酸H 2SO4HCl3碳酸H 2CO 3 硫化氢H 2S氢氧化钠氢氧化钾氢氧化钙NaOH KOH Ca(OH) 2氢氧化镁Mg(OH) 氢氧化铝氢氧化锌Al(OH) Zn(OH)232氢氧化铁Fe(OH) 氢氧化亚铁氢氧化铜Fe(OH) Cu(OH)322氢氧化钡Ba(OH) 氨水NH 3·H 2O2氯化钠氯化铜NaCl CuCl 氯化铝AlCl 32氯化钾氯化亚铁KCl FeCl 2氯化铁FeCl 3氯化银氯化钙AgCl CaCl 氯化镁MgCl22氯化钡BaCl 2氯化锌硫酸铜ZnCl 2 CuSO 4 高锰酸钾KMnO 锰酸钾氯酸钾K 2MnO KClO443碳酸钙CaCO 硝酸钾硝酸钠KNO NaNO333硝酸铁 Fe(NO 3)3 硝酸亚铁 硝酸铝 Fe(NO 3)2 Al(NO 3)3碳酸钠 Na 2CO 3 碳酸钙 碳酸铵 CaCO (NH 4)2CO 33 碳酸氢钠 NaHCO 硫酸铁 硫酸亚铁 Fe 2(SO 4)3 FeSO 43 硝酸银 AgNO 硝酸钡 硝酸铵 Ba(NO 3) 2 NH 4NO 33 硫酸钡 BaSO 43、有机化合物甲烷 CH 乙醇 葡萄糖 C 2H 5OH C 6 H 12O 64 六、记住下列反应的化学方程式㈠、化合反应1、红磷在空气(或氧气)中燃烧: 4P + 5O 2 2P 2O 5点燃 2H 2O点燃2、氢气在空气中燃烧生成水: 2H 2 + O 2 点燃3、硫磺在空气(或氧气)中燃烧:4、镁条在空气(或氧气)中燃烧: S + O 2 SO 2点燃2Mg + O 2 2MgO点燃5、铁丝在氧气中燃烧: 3Fe + 2O 2 Fe 3O 4点燃 6、木炭在空气(或氧气)中完全燃烧: C + O 2 CO 2点燃7、木炭不充分燃烧: 2C + O 2 8、一氧化碳燃烧: 2CO + O 2 2CO点燃 2CO 29、二氧化碳和水反应生成碳酸: CO 2 + H 2O == H 2CO 3高温10、二氧化碳通过灼热的炭层: CO 2 + C 2CO11、生石灰作为干燥剂: CaO + H 2O == Ca(OH)2㈡、分解反应11、高锰酸钾制氧气: 2KMnO 4K 2MnO 4 + MnO 2 + O 2↑△ MnO 22KCl + 3O 2↑12、氯酸钾制氧气: 2KClO 3 △ MnO 213、双氧水制氧气: 2H 2O 2 2H 2O + O 2↑通电 14、电解水: 2H 2O 2H 2↑+ O 2↑H 2O + CO 2↑15、碳酸分解: H 2 CO 3 高温 16、高温煅烧石灰石(工业制取二氧化碳): CaCO 3 CaO +CO 2↑㈢、置换反应17、铜和硝酸银溶液反应: 18、铁和硫酸铜溶液反应: Cu + 2AgNO 3 == 2Ag + Cu(NO 3)2Fe + CuSO 4 == Cu + FeSO 419、锌和硫酸反应制取氢气: Zn + H 2SO 4 == ZnSO 4 + H 2↑20、铝和稀硫酸反应: 2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑高温 21、木炭还原氧化铁: 木炭还原氧化铜: 3C + 2Fe 2O 3 4Fe + 3CO 2↑高温 C + 2CuO 2Cu + CO 2↑高温 木炭还原四氧化三铁: 2C + Fe 3O 4 3Fe +2CO 2↑氢气还原氧化铜: H 2 + CuO Cu + H 2 O高温 ㈣、复分解反应A 、酸 + 碱 → 盐 + 水22、氢氧化钠与盐酸反应: 23、氢氧化钠与硫酸反应: NaOH + HCl == NaCl + H 2O2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O24、氢氧化铝治疗胃酸过多: Al(OH) + 3HCl == AlCl 3 + 3H 2O3 25、氢氧化镁与硫酸反应: Mg(OH) 2 + H 2SO4 == MgSO 4 + 2H 2OB 、酸 + 盐 → 新酸 + 新盐26、盐酸与硝酸银溶液反应: HCl + AgNO 3 == AgCl ↓+ HNO 327、氯化钡溶液与硫酸溶液反应: BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl28、碳酸钠与稀盐酸: Na 2CO 3 + 2HCl == 2NaCl+ H 2O + CO 2碳酸氢钠与稀盐酸: NaHCO 3 + HCl == NaCl+ H 2O + CO 229、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO 3+2HCl = CaCl 2+H 2O+CO 2C 、碱 + 盐 → 另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应: 31、氯化铁溶液和氢氧化钠溶液反应: CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓FeCl 3 +3NaOH==Fe(OH)3↓+3NaClD 、盐 + 盐 → 两种新盐32、硝酸银溶液与氯化钠溶液反应: 33、氯化钡溶液与碳酸钠溶液反应: AgNO 3 + NaCl == AgCl ↓+ NaNO 3BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaClE 、金属氧化物 + 酸 → 盐 + 水34、稀盐酸清洗铁锈: 6HCl + Fe 2O 3 == 2FeCl 3 + 3H 2O35、氧化铜与稀硫酸反应: CuO + H 2SO 4== CuSO 4+ H 2O㈤、其他反应类型A 、非金属氧化物 + 碱 → 盐 + 水36、二氧化碳通入澄清石灰水中: CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O37、氢氧化钠在空气中变质: CO 2+ 2NaOH = Na 2CO 3 + H 2O38、氢氧化钠溶液吸收二氧化硫: 39、氢氧化钠溶液吸收三氧化硫: SO 2 + 2NaOH ==Na 2 SO 3+ H 2OSO 3 + 2NaOH ==Na 2 SO 4+ H 2OB 、其它情形40、一氧化碳还原氧化铜: CO + CuO Cu + CO 2高温 41、一氧化碳还原氧化铁: 3CO + Fe 2 O 3 2Fe + 3CO 2↑高温 42、一氧化碳还原四氧化三铁: 4CO + Fe 3O 4 3Fe + 4CO 2↑点燃43、酒精燃烧: 44、甲烷燃烧: C 2H 5OH + 3O 2 2CO 2 + 3H 2 O点燃 CH 4 + 2O 2 CO 2 + 2H 2O。
初三化学中考必记的化学用语(带答案)

初三化学中考必记的化学用语一、元素名称及符号三、化学式四、化合价1.元素化合价:+1价:K、Na、Ag、H ;+2价:Ca、Mg、Ba、Zn、Hg ;+3价:Al ;+4价:Si ;+1、+2价Cu ;+2、+3价Fe ;+2、+4价C;+2、+4、+6价:S;-1价:F、Cl ;-2价:O、S;-3价:N、P2.原子团化合价:(化合价数目与离子所带电荷数目相等,符号相同,但位置顺序相反)名称:铵根氢氧根硝酸根硫酸根碳酸根磷酸根符号:NH4OH NO3SO4CO3PO4化合价:+1 -1 -1 -2 -2 -3离子符号:NH4+OH—NO3—SO42—CO32—PO43—五、金属活动性顺序(由强到弱):元素符号:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au元素名称:钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金六、部分酸、碱、盐的溶解性规律:1、酸:全部溶于水;2、碱:大多数不溶于水,NH3·H2O、KOH、NaOH、Ba(OH)2溶于水,Ca(OH)2微溶;3、盐:a、钾盐、钠盐、铵盐、硝酸盐四类盐都易溶于水;b、盐酸盐(即氯化物)绝大多数溶于水,只有AgCl不溶于水;c、硫酸盐绝大多数溶于水,只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水;d、碳酸盐绝大多数不溶于水,Na2CO3、K2CO3、(NH4)2CO3溶于水,MgCO3微溶于水。
七、物质的俗名、学名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)硫磺、硫:S(4) 生石灰、氧化钙:CaO (5)干冰(固体二氧化碳):CO2 (6)盐酸、氢氯酸:HCl (7)亚硫酸:H2SO3(8)氢硫酸:H2S (9)熟石灰、消石灰、氢氧化钙:Ca(OH)2 (10)苛性钠、火碱、烧碱:NaOH (11)食盐氯化钠:NaCl(12)纯碱、碳酸钠:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3·10H2O(13)碳酸氢钠、酸式碳酸钠:NaHCO3(也叫小苏打)碳铵、碳酸氢铵:NH4HCO3(14)胆矾、蓝矾、硫酸铜晶体:CuSO4·5H2O(五水合硫酸铜)(15)铜绿、孔雀石、碱式碳酸铜:Cu2(OH)2CO3(分解生成三种氧化物的物质)(16)甲醇:CH3OH 有毒、失明、死亡(17)酒精、乙醇:C2H5OH (18) )氨气:NH3(碱性气体)(19)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(20) 氨水、一水合氨:NH3·H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(21)亚硝酸钠:NaNO2(工业用盐、有毒)八、常见物质的颜色及状态1、白色固体:白磷P、P2O5、MgO、CaO、NaOH、Ca(OH)2、KClO3、KCl、NaCl、Na2CO3、NaHCO3、无水CuSO4;CaCO3、BaCO3、Mg(OH)2、AgCl、BaSO4;银白色固体:铁(铁粉为黑色)、铝、镁等多数金属(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4、I2为紫黑色(碘蒸气为紫红色)3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、绿色固体:Cu(OH)2CO3、K2MnO4 蓝色固体:CuSO4·5H2O 淡黄色固体:S5、溶液的颜色:含Cu2+的溶液——蓝色;含Fe2+的溶液——浅绿色;含Fe3+的溶液——黄色,含MnO4—高锰酸根离子的溶液——紫红色;其余溶液一般——无色。
九年级化学的全部化学用语

Байду номын сангаас
氧化物 酸 酸 酸 盐 盐 盐
盐
盐 盐 盐 盐 盐 盐 盐
盐
盐 有机物 有机物
氢氧化钠 氢氧化钙 氢氧化铁 氢氧化铜 硫酸铝 硫酸镁 硫酸亚铁 硫酸铁 硫酸铜 硫酸钠 亚硫酸钠 硫酸锌 硫酸钡 硝酸银 硝酸钡 硝酸铜 硝酸钾 高锰酸钾 锰酸钾
NaOH Ca(OH)2 Fe(OH)3 Cu(OH)2 Al2(SO4)3 MgSO4 FeSO4 Fe2(SO4)3 CuSO4 Na2SO4 Na2SO3 ZnSO4 BaSO4 AgNO3 Ba(NO3)2 Cu(NO3)2 KNO3 KMnO4 K2MnO4
2
12、生石灰溶于水:CaO + H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4 5H2O 14、钠在氯气中燃烧:2Na + Cl2 点燃 2NaCl 分解反应 15、实验室用双氧水制氧气:2H2O2+MnO2===2H2O+ O2↑ 16、加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑ 17、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑ 18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑ 20、加热氯酸钾(有少量的二氧化锰):2KClO3 = 2KCl + 3O2 ↑ 置换反应 21、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 22、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑ 23、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑ 24、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 25、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 26、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 27、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO 28、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑ 其他 29、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4 30、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 31、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 32、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2 33、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2 34、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 35、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O 36、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法): CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 37、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
九年级化学用语大全(1至8单元)

化学用语一、元素符号氢 H 氦 He 碳 C 氮 N 氧 O 氟 F 氖 Ne钠 Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩 Ar 钾 K 钙 Ca 锰 Mn 铁 Fe 铜 Cu 锌 Zn 银 Ag 钡 Ba 铂 Pt 金 Au 汞 Hg 碘 I 锂 Li 铍 Be 硼 B 铅 Pb 锡 Sn 钛 Ti 溴 Br 钨 W 二、化学式氧气 O2氢气 H2氮气 N2氟气 F2氯气 Cl2氦气 He氖气 Ne 氩气 Ar 溴 Br2碘 I2臭氧 O3碳 C硫 S 磷 P 硅 Si 碳60 C60铁 Fe 铝 Al 镁 Mg 锌 Zn 铜 Cu 银 Ag 水银 Hg 钠 Na水 H2O 过氧化氢 H2O2二氧化碳 CO2一氧化碳 CO 二氧化氮 NO2一氧化二氮 N2O 一氧化氮 NO 二氧化硅 SiO2五氧化二磷 P2O5二氧化硫 SO2三氧化硫 SO3二氧化氯 ClO2氧化钠 Na2O氧化镁 MgO 氧化铝 Al2O3氧化钾 K2O 氧化钙 CaO二氧化锰 MnO2四氧化三铁 Fe3O4氧化铁 Fe2O3氧化亚铁 FeO氧化铜 CuO 氧化锌 ZnO 氧化钡 BaO 氧化汞 HgO盐酸 HCl 硫酸 H2SO4硝酸 HNO3碳酸 H2CO3磷酸 H3PO4氨气 NH3氨水 NH3·H2O 氢氧化钾 KOH 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2氢氧化钡 Ba(OH)2氢氧化镁 Mg(OH)2氢氧化铝 Al(OH)3氢氧化锌 Zn(OH)2氢氧化铁 Fe(OH)3氢氧化亚铁 Fe(OH)2氢氧化铜 Cu(OH)2乙酸 CH3COOH甲烷 CH4乙醇 C2H5OH 葡萄糖 C6H12O6淀粉 (C6H10O5)n 蔗糖 C12H22O11氯化钾 KCl 氯化钠 NaCl 氯化钡 BaCl2氯化钙 CaCl2氯化镁 MgCl2氯化铝 AlCl3氯化锌 ZnCl2氯化铁 FeCl3氯化亚铁 FeCl2氯化铜 CuCl2氯化银 AgCl 硫酸钾 K2SO4硫酸钠 Na2SO4硫酸钡 BaSO4硫酸钙 CaSO4硫酸镁 MgSO4硫酸铝 Al2(SO4)3硫酸锌 ZnSO4硫酸铁 Fe2(SO4)3硫酸亚铁 FeSO4硫酸铜 CuSO4硫酸银 Ag2SO4硝酸钾 KNO3硝酸钠 NaNO3硝酸钙 Ca(NO3)2硝酸钡 Ba(NO3)2硝酸镁 Mg(NO3)2硝酸铝 Al(NO3)3硝酸锌 Zn(NO3)2硝酸铁 Fe(NO3)3硝酸亚铁 Fe(NO3)2硝酸铜 Cu(NO3)2硝酸银 AgNO3高锰酸钾 KMnO4锰酸钾 K2MnO4氯酸钾 KClO3碳酸钾 K2CO3碳酸钠 Na2CO3碳酸钙 CaCO3碳酸钡 BaCO3碳酸镁 MgCO3碳酸锌 ZnCO3碳酸亚铁 FeCO3碳酸银 Ag2CO3氯化铵 NH4Cl 硝酸铵 NH4NO3硫酸铵 (NH4)2SO4碳酸氢铵 NH4HCO3碳酸铵 (NH4)2CO3磷酸钙 Ca3(PO4)2三、常见的离子符号氧离子 O2-氟离子 F-硫离子 S2-氯离子 Cl-钠离子 Na+镁离子 Mg2+铝离子 Al3+钾离子 K+钙离子 Ca2+氢离子 H+锂离子 Li+铍离子 Be2+铁离子 Fe3+亚铁离子 Fe2+铜离子 Cu2+2++ 2+--四、化学方程式1.红磷在氧气中燃烧2.硫在氧气中燃烧3.铁丝在氧气中燃烧4.加热高锰酸钾5.过氧化氢溶液与二氧化锰混合6.加热氯酸钾与二氧化锰的混合物7.在氧气中加热汞8.氧化汞受热分解9.氢气在氯气中燃烧10.氢气在氧气中燃烧11.电解水12.镁条在氧气中燃烧13.铝箔在氧气中燃烧14.铜在空气中加热15.氢气还原氧化铜16.木炭在氧气中完全燃烧17.木炭在氧气中不完全燃烧18.碳还原氧化铜19.碳还原氧化铁20.碳还原二氧化碳21.碳还原水蒸气22.实验室制取二氧化碳23.碳酸分解24.工业上制备二氧化碳25.二氧化碳与水反应26.检验二氧化碳的反应27.一氧化碳燃烧28.一氧化碳还原氧化铜29.一氧化碳还原四氧化三铁30.灭火器的反应原理31.氧化钙与水反应32.甲烷燃烧33.乙醇(酒精)燃烧34.实验室制取氢气35.铝常温下氧化36.镁与盐酸反应37.铝与盐酸反应38.锌与盐酸反应39.铁与盐酸反应40.镁与稀硫酸反应41.铝与稀硫酸反应42.铁与稀硫酸反应43.铁与硫酸铜溶液反应44.锌与硫酸铜溶液反应45.铝与硫酸铜溶液反应46.铜与硝酸银溶液反应47.铝与硝酸银溶液反应48.铁与硝酸银溶液反应49.锌与硝酸银溶液反应50.工业上炼铁的反应原理。
最完整的九年级化学用语

九年级化学用语(包括元素符号、结构示意图、化合价、离子符号、化学式、化学方程式)黔西县思源实验学校:白晋阳一、记住30种元素的名称和符号。
二、原子结构示意图1~20号元素原子结构示意图氢氦锂铍硼H He Li Be B碳氮氧氟氖C N O F Ne钠镁铝硅磷Na Mg Al Si P硫氯氩钾钙S Cl Ar K Ca三、常见元素和根在化合物中的化合价一价氯银钠钾氢,-1 +1 +1 +1 +1Cl Ag K Na H-2 +2 +2 +2 +2二价氧钙钡镁锌, O Ca Ba Mg Zn+3 +4铝三硅四要记住,Al Si-2 -2碳酸硫酸二价根,CO3SO4-1 -1 +1氢氧硝酸铵根一,OH NO3NH4-3还有三价磷酸根。
PO4说明:在初中化学中,具有可变化合价的元素是如下8种:C N P S Cl Cu Fe Mn但是它们的化合价不用去记!在初中化学中,除了以上根的化合价需要记住以外,其它的根的化合价也不用去记。
四、常见离子符号(共25个):Cl―(氯离子)、Ag+ (银离子)、K+ (钾离子) 、Na+ (钠离子)、H+ (氢离子)O2-(氧离子)、Ca2+ (钙离子)、Ba2+ (钡离子)、Mg2+ (镁离子)、Zn2+ (锌离子)Al3+ (铝离子)CO32-(碳酸根离子)、SO42-(硫酸根离子)OH-(氢氧根离子)、NO3-(硝酸根离子)、NH4+(铵根离子)PO43-(磷酸根离子)以及Fe2+ (亚铁离子)、Fe3+ (铁离子)、、Cu2+ (铜离子)、HCO3-(碳酸氢根离子)MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO32-(亚硫酸根离子)、五、记住下列物质的化学式,且能将它正确分类㈡、化合物六、记住下列反应的化学方程式㈠、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O 2 2P 2O 52、氢气在空气中燃烧生成水:2H 2 + O 2 2H 2O3、硫磺在空气(或氧气)中燃烧:S + O 2 SO 24、镁条在空气(或氧气)中燃烧:2Mg + O 2 2MgO5、铁丝在氧气中燃烧:3Fe + 2O 2 Fe 3O 46、木炭在空气(或氧气)中完全燃烧:C + O 2 CO 27、木炭不充分燃烧:2C + O 2 2CO8、一氧化碳燃烧:2CO + O 2 2CO 29、二氧化碳和水反应生成碳酸:CO 2 + H 2O == H 2CO 310、二氧化碳通过灼热的炭层:CO 2 + C 2CO11、生石灰作为干燥剂:CaO + H 2O == Ca(OH)2㈡、分解反应11、高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑12、氯酸钾制氧气:2KClO 3 2KCl + 3O 2↑13、双氧水制氧气:2H 2O 2 2H 2O + O 2↑14、电解水:2H 2O 2H 2↑+ O 2↑15、碳酸分解:H 2CO 3 H 2O + CO 2↑16、高温煅烧石灰石(工业制取二氧化碳):CaCO 3 CaO +CO 2↑ 点燃点燃 点燃点燃 点燃 点燃高温 △ MnO 2△MnO 2 通电高温 点燃 点燃㈢、置换反应17、铜和硝酸银溶液反应:Cu + 2AgNO 3 == 2Ag + Cu(NO 3)218、铁和硫酸铜溶液反应:Fe + CuSO 4 == Cu + FeSO 419、锌和硫酸反应制取氢气:Zn + H 2SO 4 == ZnSO 4 + H 2↑20、铝和稀硫酸反应:2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑21、木炭还原氧化铁:3C + 2Fe 2O 3 4Fe + 3CO 2↑ 木炭还原氧化铜:C + 2CuO 2Cu + CO 2↑ 木炭还原四氧化三铁:2C + Fe 3O 4 3Fe +2CO 2↑ 氢气还原氧化铜:H 2 + CuO Cu + H 2O㈣、复分解反应A 、酸 + 碱 → 盐 + 水22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H 2O23、氢氧化钠与硫酸反应:2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl 3 + 3H 2O25、氢氧化镁与硫酸反应:Mg(OH)2 + H 2SO 4 == MgSO 4 + 2H 2OB 、酸 + 盐 → 新酸 + 新盐26、盐酸与硝酸银溶液反应:HCl + AgNO 3 == AgCl ↓+ HNO 327、氯化钡溶液与硫酸溶液反应:BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl28、碳酸钠与稀盐酸:Na 2CO 3 + 2HCl == 2NaCl+ H 2O + CO 2↑ 碳酸氢钠与稀盐酸:NaHCO 3 + HCl == NaCl+ H 2O + CO 2↑29、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO 3+2HCl = CaCl 2+H 2O+CO 2↑C 、碱 + 盐 → 另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓31、氯化铁溶液和氢氧化钠溶液反应:FeCl 3+3NaOH==Fe(OH)3↓+3NaClD 、盐 + 盐 → 两种新盐高温 高温 高温 高温32、硝酸银溶液与氯化钠溶液反应:AgNO 3 + NaCl == AgCl ↓+ NaNO 333、氯化钡溶液与碳酸钠溶液反应:BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaClE 、金属氧化物 + 酸 → 盐 + 水34、稀盐酸清洗铁锈:6HCl + Fe 2O 3 == 2FeCl 3 + 3H 2O35、氧化铜与稀硫酸反应:CuO + H 2SO 4== CuSO 4+ H 2O㈤、其他反应类型A 、非金属氧化物 + 碱 → 盐 + 水36、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O37、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O38、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O39、氢氧化钠溶液吸收三氧化硫:SO 3 + 2NaOH ==Na 2SO 4+ H 2OB 、其它情形40、一氧化碳还原氧化铜:CO + CuO Cu + CO 241、一氧化碳还原氧化铁:3CO + Fe 2O 3 2Fe + 3CO 2↑42、一氧化碳还原四氧化三铁:4CO + Fe 3O 4 3Fe + 4CO 2↑43、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O44、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O点燃点燃 高温 高温。
初三化学中考必须记住的化学用语

一、元素的名称及符号 原子序数 l 元素符号 H 元素名称 钾 元素符号 K 二、离子符号 名称 钠离子 钙离子 氢离子 铜离子 镁离子 铝离子 符号 名称 符 K+ Fe2+ Fe3+ NH4+ Zn2+ Ag+ 符号 HCl HN03 H2S04 H2CO3 NaOH KOH Mg(OH)2 Ca(OH)2 Ba(OH)2 Al(OH)3 Fe(OH)3 Cu(OH)2 N2 02 N2 硫酸钠 硫酸钾 硫酸锌 Na2S04 K2S04 ZnS04 名 称 符 号 名 称 符 号 氯化钠 NaCl 硫酸铝 A12(S04)3 氯化钾 氯化锌 氯化镁 氯化钙 氢氧化钠 氢氧化钾 氢氧化镁 氢氧化钙 氢氧化钡 氢氧化铝 氢氧化铁 氢氧化铜 氮气 氧气 氮气 氯化铁 氯化铜 氯化铝 氯化钡 氯化银 硫化钠 硫化钾 KCl ZnCl2 MgCl2 CaCl2 FeCl3 CuCl2 AlCl3 BaCl2 AgCl Na2S K2S 硫酸亚铁 FeSO4 硫酸铁 硫酸铜 硝酸钾 硝酸铜 硝酸铝 硝酸铁 硝酸银 硝酸铵 氯化铵 硫酸铵 碳酸铵 氯酸钾 锰酸钾 Fe2(S04)3 CuS04 KN03 Cu(N03)2 Al(N03)3 Fe(N03)3 AgN03 NH4NO3 NH4Cl (NH4)2S04 (NH4)2C03 KCl03 K2Mn04 号 名 氯离子 氧离子 硫离子 氢氧根离子 硝酸根离子 称 符 Cl02S2OHN03号 名 称 符号 Mn04Mn042SO42C032HCO3Na’+ 钾离子 Ca2+ 亚铁离子 H+ 铁离子 Cu2+ 铵根离子 Mg2+ 锌离子 Al3+ 银离子 高锰酸根离子 锰酸根离子 硫酸根离子 碳酸根离子 碳酸氢根离子 2 3 4 5 6 C 锌 Zn 7 N 银 Ag 8 O 9 F 钡 Ba lO ll 12 13 14 15 16 17 18 Ne Na Mg Al Si P 碘 I 汞 Hg 铜 Cu 锡 Sn 铅 Pb S 铂 Pt Cl Ar 金 Au 元素名称 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩 He Li Be B 钙 Ca 锰 Mn 铁 Fe
九年级必记化学用语(单元版)

得化学用语者得天下!——中考化学用语约占总分40%九年级必记化学用语(单元版)绪言一、请记忆元素符号(41种):参见《九年级化学导学案》P5A:Ag银108、Al铝27、Ar氩40、Au金197。
B:B硼11、Ba钡137、Be铍9、Br溴80。
C:C碳12、Ca钙40、Cl氯35.5、Co钴60、Cu铜63.5。
F:F氟19、Fe铁56。
H:H氢1、He氦4、Hg汞201。
I:I碘127。
K:K钾39、Kr氪84。
L:Li锂7。
M:Mg镁24、Mn锰55。
N:N氮14、Na钠23、Ne氖20。
O:O氧16。
P:P磷31、Pb铅207、Pt铂195。
R:Rn氡222。
S:S硫32、Sb锑122、Si硅28、Sn锡119。
T:Ti钛48。
U:U铀238。
W:W钨184。
X:Xe氙131。
Z:Zn锌65。
二、请记忆化学符号U1:走进化学世界#第二周期:锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne 第三周期:钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 第四周期:钾K 钙Ca二、请记忆金属活动性顺序1.石蜡+氧气二氧化碳+水2. 硫酸铜氢氧化铜硫酸铜氢氧化钠+→+2NaOH +CuSO 4=Cu(OH )2↓+Na 2SO 4 (CuSO 4溶液为蓝色,Cu(OH)2为蓝色沉淀)3.二氧化碳水氯化钙盐酸碳酸钙++→+4.水二氧化碳氧化铜碱式碳酸铜加热++−−→− Cu 2(OH )2CO 3Δ2CuO +H 2O +CO 2↑5.二氧化碳氧气碳点燃−−→−+ C+O 2CO 26.水碳酸钙氢氧化钙二氧化碳+→+7.碳酸钠+盐酸→氯化钠+水+二氧化碳 Na 2CO 3+2HCl===2NaCl+H 2O+CO 2↑8.锌+盐酸→氯化锌+氢气9.氢氧化铜→氧化铜+水 Cu(OH)2 CuO+H 2OU2:我们周围的空气一、请记忆化学反应的文字表达式1.汞+氧气→氧化汞;2Hg+O 22HgO2.氧气汞氧化汞加热+−−→− ;↑+2O Hg 2Og H 2△3.五氧化二磷氧气磷点燃−−→−+ ;4P+5O 22P 2O 5 4.二氧化硫氧气硫点燃−−→−+ ;S+ O 2SO 25.四氧化三铁点燃氧气铁−−→−+ ;3Fe+2O 2Fe 3O 46.氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电7.水氧气氢气点燃−−→−+ ;2H 2+O 22H 2O9.氧气水过氧化氢二氧化锰+−−−−→− ;2H 2O 22H 2O+O 2↑ 10.氧气二氧化锰锰酸钾高锰酸钾加热++−−→− ;2KMnO 4K 2MnO 4+MnO 2+O 2↑11.2KClO 32KCl+3O 2↑二、请记忆化合价(包括元素&原子团):参见《九年级化学导学案》P 7 1.元素的化合价氢+1,氧-2,银锂钠钾+l 价, 锌镁钙钡+2价,铝+3,硅+4;只遇金属或是氢,氮磷-3、硫-2,氟氯溴碘总-1。
人教版九年级化学常用的化学用语大全

初中必背的化学用语
一、元素符号必记
1、1至20
2
+1 +1 -1 +1 +1
k Na Cl H Ag -2 +2 +2 +2 +2
O Ca Ba Mg Zn +2 +3 +2 +4 Fe F e C C
+3 +4 +5
Al Si P +2 +4 +6 S S S +2 +2 Cu Hg 0 0 H 2 O 2
负一氢氧硝酸根,负二硫酸碳酸根,负三记住磷酸根,唯有正一是铵根。
1 -1 -
2 OH - NO 3- SO 42- (三)离子和原子团
(1)常见的离子
氢离子一H + 钠离子一Na + 钾离子一K + 镁离子一Mg 2+钙离子一Ca 2+ 钡离子一Ba 2+ 锌离子一Zn 2+
铝离子一AI 3+银离子-Ag + 氧离子一O 2-
氯离子一Cl -
亚铁离子一562+(浅绿色) 铜离子一Cu 2+(蓝色) 铁离子一563+(黄色)
二、元素的化合价
(一)常见元素的化合价口诀
一价钾钠氯氢银 二价氧钙钡镁锌 二三铁 二四碳 三铝四硅五价磷 二四六硫都齐全 铜汞二价最常见 莫忘单质都为零
(二)常见原子团的化合价 -2
-3
+1 CO 32- P043-
NH 4+
⑵常见的原子团
氢氧根——OH- 碳酸根——CO32- 硫酸根SO42-
硝酸根——NO3-磷酸根PO43-铵根——NH4+三、常见的化学式
(一)、常见的单质
(二)、化合物
5、常见有机化合物
6、其他化合物
四、化学反应方程式。
九年级常见化学用语和化学方程式

九年级常见化学用语和化学方程式五、课本中的化学方程式:第二单元:1、红磷在氧气中燃烧4 P + 5 O2 2 P2O52、碳在氧气中燃烧 C + O2CO23、硫在氧气中燃烧S + O2 SO24、铁在氧气中燃烧 3 Fe + 2 O2Fe3O45、铝在氧气中燃烧 4 Al + 3 O2 2 Al2O36、用过氧化氢制氧气 2 H2O2 2 H2O + O2↑7、用高锰酸钾制氧气2KMnO4K2MnO4+ MnO2+ O2↑8、用氯酸钾和二氧化锰的混合物制氧气 2 KClO3 2 KCl + 3 O2↑第三单元:9、水通电分解(电解水) 2 H2O 2 H2↑+ O2↑10、汞受热2Hg+O22HgO11、氧化汞受热分解2HgO2Hg+O2↑12、氢气在空气中燃烧 2 H2 + O2 2 H2O13、氢气还原氧化铜H2 + CuO Cu + H2O第四单元:第五单元:14、铁和硫酸铜溶液反应Fe + CuSO 4FeSO4 + Cu15、碳酸钠和盐酸反应Na 2CO3+2HCl2NaCl+H2O+CO2↑16、镁条在空气中燃烧 2 Mg + O2 2 MgO17、高温煅烧石灰石(二氧化碳的工业制法)CaCO3CaO + CO2↑第六单元:2 CO18、碳在氧气中不充分燃烧 2 C + O2 (不足)19、碳跟氧化铜反应 C + 2 CuO 2 Cu + CO2↑20、碳跟氧化铁反应 3 C + 2 Fe2O3 4 Fe + 3 CO2 ↑21、碳跟二氧化碳反应C+CO22CO+ 2HCl CaCl2 + CO2↑+ H2O22、实验室制取二氧化碳CaCO23、二氧化碳与水反应CO 2 + H2O H2CO324、碳酸分解H 2CO3CO2 ↑+ H2O25、二氧化碳与氢氧化钙溶液反应(二氧化碳的检验方法)CO 2 + Ca(OH)2CaCO3↓+ H2O26、一氧化碳燃烧 2 CO + O2 2 CO227、一氧化碳还原氧化铜CO +CuO Cu + CO228、一氧化碳还原氧化铁 3 CO +Fe2O3 2 Fe + 3 CO2第七单元:29、甲烷燃烧CH4 + 2 O2CO2 + 2 H2O30、酒精燃烧C2H5OH + 3 O2 2 CO2 + 3 H2O第八单元:31、镁和稀盐酸反应镁和稀硫酸反应Mg + 2 HCl MgCl+ H2↑Mg + H2SO4MgSO4 + H2↑32、锌和稀盐酸反应锌和稀硫酸反应(实验室制取氢气)Zn + 2 HCl ZnCl+ H2↑Zn + H2SO4ZnSO4 + H2↑33、铁和稀盐酸反应铁和稀硫酸反应+ H2↑Fe + H2SO4FeSO4 + H2↑Fe + 2 HCl FeCl34、铝和稀盐酸反应铝和稀硫酸反应+3H2↑2Al+ 3H2SO4Al2(SO4)3 +3 H2↑2Al+6HCl2AlCl35、铝和硫酸铜溶液反应 2 A l + 3 CuSO 4Al2(SO4)3 + 3CuCu(NO3)2 + 2 Ag36、铜和硝酸银溶液反应Cu + 2 AgNO第十单元:37、铁锈与稀盐酸反应铁锈与稀硫酸反应FeO3+6HCl2FeCl3+3H2O Fe2O3+3H2SO4Fe2(SO4)3+3H2O38、氧化铜与稀硫酸反应H2SO4+ CuO Cu SO4+ H2O39、氧化钙与水的反应CaO+HO Ca(OH)240、氢氧化钠溶液与二氧化碳反应2NaOH+CO 2Na2CO3+H2O41、二氧化硫与氢氧化钠溶液反应2NaOH+SO 2Na2SO3+H2O42、三氧化硫与氢氧化钠溶液反应2NaOH+SO 3Na2SO4+H2O43、氢氧化钠与盐酸反应氢氧化钠与硫酸反应NaOH+HCl NaCl+H 2O 2NaOH+H2SO4Na2SO4+H2O44、氢氧化钙与盐酸反应氢氧化钙与硫酸反应+2HCl CaCl2+2H2O Ca(OH)2+H2SO4CaSO4+2H2OCa(OH)第十一单元:45、碳酸氢钠与盐酸反应NaHCO 3+HCl NaCl+H2O+CO2↑CO3+Ca(OH)2CaCO3↓+2NaOH46、碳酸钠溶液与氢氧化钙溶液反应Na初中化学常见物质的颜色(后面是物质化学式或物质名称,前面是颜色)1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
初三化学常化学用语必背

初三化学常化学用语必背“化学是一门记忆加实验的科学”,这也许不太符合一些同学的思维习惯。
下面是小偏整理的初三化学常化学用语必背,感谢您的每一次阅读。
初三化学常化学用语必背一、熟记下列元素名称及符号: 1、H氢O氧 N氮 Cl氯 C碳 P 磷 S硫 2、K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag 银 Mn锰 Ba钡二、熟记下列物质的化学式: 1、单质: H2氢气 O2氧气 N2氮气 C碳 P磷 S硫 Fe铁 Cu铜 Hg汞 2、化合物 (1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷 Fe2O3氧化铁Fe3O4四氧化三铁 CaO氧化钙 MgO氧化镁 CuO氧化铜 ZnO氧化锌 FeO氧化亚铁MnO2二氧化锰-Na2O氧化钠(2)酸:HCl盐酸H2SO4硫酸HNO3硝酸 H2CO3碳酸 -H2SO3亚硫酸(3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡 Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁(4)盐:NaCl氯化钠Na2CO3碳酸钠NaHCO3碳酸氢钠 CaCO3碳酸钙 CaCl2氯化钙 KCl氯化钾ZnCl2氯化锌AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝 BaCl2氯化钡 Na2SO4硫酸钠CuSO4硫酸铜FeSO4硫酸亚铁Fe2(SO4)3硫酸铁ZnSO4硫酸锌BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾 Ag NO3硝酸银 Cu(NO3)2硝酸铜-NH4Cl氯化铵-NH4NO3硝酸铵-(NH4)2SO4硫酸铵- NH4HCO3碳酸氢铵(5)有机物:CH4甲烷C2H5OH乙醇(酒精) C6H12O6葡萄糖(C6H10O5)n淀粉 -CO(NH2)2尿素三、熟记下列元素在化合物中的化合价:(1) 正价(多为金属)+1 +1 +1 +1 +2 +2 +2 +2 +2 +3 +2 +3 H K Na Ag Ca Mg Zn Ba Cu Al Fe(FeO) Fe(Fe2O3) (2) 负价(非金属)-2 -1 -2 O Cl S (3) 原子团+1 -1 -1 -1 -1 -2 -2 -2 -3 -1 NH4 OH NO3 ClO3 MnO4(KMnO4) CO3 SO4 SO3 PO4 HCO3四、熟记下列常用离子(比较与相应化合价的联系)(1)阳离子H+ K+ Na+ Ca2+ Fe2+ Mg2+ Cu2+ Fe3+(2)阴离子Cl- OH - NO3- CO32- SO4 2-五、熟记下列化学方程式:(一)化合反应(A+B→C):1、木炭在氧气中燃烧:C+O2 点燃CO2 2、硫在氧气中燃烧:S+O2 点燃SO2 3、镁在空气中燃烧:2Mg+O2 点燃 2MgO 4、铁在氧气中燃烧: 3Fe+2O2 点燃 Fe3O4 5、磷在氧气中燃烧:4P+5O2 点燃2P2O5 6、铜在空气中加热:2Cu+O2 △ 2CuO 7、氢气在氧气中燃烧:2H2+O2 点燃 2H2O8、一氧化碳在空气中燃烧:2CO+O2 点燃2CO2 9、碳不充分燃烧:2C+O2(不充分)点燃2CO 10、二氧化碳通过灼热的碳层:CO2 + C 高温2CO 11、二氧化碳与水反应:CO2+H2O === H2CO3-12、三氧化硫溶于水:SO3+H2O === H2SO4 (酸雨的成因)13、生石灰和水化合:CaO+H2O === Ca(OH)2(二)分解反应(C→A+B):14 过氧化氢用二氧化锰作催化剂分解(实验室制O2):2H2O2 2 H2O + O2↑15、氯酸钾与二氧化锰共热(实验室制O2):2KClO3 2KCl+3O2↑ 16、加热高锰酸钾:2KMn O4 △ K2MnO4 + MnO2 + O2↑ 17、电解水:2H2O通电2H2↑ + O2↑18、碳酸不稳定分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石:CaCO3 高温 CaO + CO2↑-20、氢氧化铜受热分解:Cu(OH)2 △ CuO + H2O(三)置换反应(A+BC→B+AC):21、锌和稀硫酸反应(实验室制H2):Zn+H2SO4 === ZnSO4 + H2↑ 22、锌和盐酸的反应:Zn+2HCl === ZnCl2 + H2↑ 23、铁和盐酸: Fe+2HCl === FeCl2 + H2↑ 24、铁和稀硫酸:Fe+H2SO4 === FeSO4 + H2↑ 25、氢气还原氧化铜:H2+CuO △ Cu + H2O26、氢气还原氧化铁:3H2 + Fe2O3 △ 2Fe + 2H2O27、木炭还原氧化铜:C+2CuO高温2Cu + CO2↑ 28、焦碳还原氧化铁:3C+2Fe2O3 高温4Fe+3CO2↑ 29、铁和硫酸铜溶液:Fe + CuSO4 === Cu + FeSO4 30、铜和硝酸银溶液:Cu + 2AgNO3 === 2Ag + Cu(NO3)231、铝和稀硫酸:2Al+3H2SO4 === Al2(SO4)3 + 3H2↑32、铝和硫酸铜溶液:2Al + 3CuSO4 === 3Cu + Al2(SO4)3-33、钠和水反应:2Na+2H2O === 2NaOH+H2↑(四)复分解反应(AB+CD→AD+CB):34、大理石和稀盐酸(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 35、碳酸钠和盐酸(灭火器原理):Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑36、碳酸氢钠和盐酸:NaHCO3 + HCl === NaCl + H2O + CO2↑37、碳酸钾(草木灰)和盐酸:K2CO3 + 2HCl === 2KCl + H2O + CO2↑38、盐酸和氢氧化钠(中和反应):HCl + NaOH === NaCl + H2O 39、硫酸和氢氧化钠溶液:H2SO4 + 2NaOH === Na2SO4 + 2H2O 40、硫酸与氯化钡溶液:H2SO4 + BaCl2 === BaSO4↓(白)+ 2HCl 41、盐酸与硝酸银溶液:HCl + AgN O3 === AgCl↓(白)+ HNO342、氢氧化钠和硫酸铜:2NaOH+CuSO4 === Cu(OH)2↓(蓝色) + Na2SO443、氢氧化钠和氯化铁溶液:3NaOH+FeCl3 === Fe(OH)3↓(红褐色)+ 3NaCl44、碳酸钠和石灰水:Na2CO3 + Ca(OH)2 === CaCO3↓ + 2NaOH45、硫酸钠和氯化钡:Na2SO4 + BaCl2 === BaSO4↓ + 2NaCl 46、氯化钠和硝酸银:NaCl + AgNO3 === AgCl↓ + NaNO347、氢氧化铝和盐酸(中和胃酸):Al(OH)3 + 3HCl === AlCl3 + 3H2O 48、氢氧化镁和盐酸(去除水垢):Mg(OH)2 + 2HCl === MgCl2 + 2 H2O 49、盐酸除铁锈:Fe2O3 + 6HCl === 2FeCl3 + 3H2O 50、氧化铜和硫酸:CuO + H2SO4 === CuSO4 + H2O -51、硝酸铵和氢氧化钠:NH4NO3 + NaOH △ NaNO3 + H2O + NH3↑(五)其他:52、二氧化碳使澄清石灰水变浑浊(实验室用于鉴定CO2):CO2 + Ca(OH)2 === CaCO3↓ + H2O 53、二氧化碳通入氢氧化钠溶液(实验室用于吸收CO2): CO2 + 2NaOH === Na2CO3 + H2O 54、用氢氧化钠溶液吸收三氧化硫:SO3 + 2NaOH === Na2SO4 + H2O 55、一氧化碳还原氧化铜:CO + CuO △ Cu + CO256、一氧化碳还原氧化铁(炼铁):3CO + Fe2O3 高温 2Fe + 3CO257、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 58、乙醇在空气中燃烧:C2H5OH+3O2 点燃 2CO2+3H2O-59、葡萄糖在人体组织中氧化:C6H12O6 + 6O2 =酶6CO2+6H2O化学学习经典方法技巧一:形成网络,优化忆技巧二:突出关键,浓缩记忆技巧三:分析对比,理解记忆技巧四:形象比喻,增强记忆技巧五:口诀韵语,灵活记忆技巧六:前后联想,巩固记忆“化学是一门记忆加实验的科学”,这也许不太符合一些同学的思维习惯。
初三化学中考必须记住的化学用语

初三化学必须记住的化学用语一、元素的名称及符号二、离子符号三、化学式四、化学方程式2.氧化物的化学性质:1、空气中氧气含量的测定:实验现象:①红磷(不能用木炭、硫磺、铁丝等代替)燃烧时有大量白烟生成,②同时钟罩内水面逐渐上升,冷却后,水面上升约1/5体积。
若测得水面上升小于1/5体积的原因可能是:①红磷不足,氧气没有全部消耗完②装置漏气③没有冷却到室温就打开弹簧夹。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。
)②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的。
纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。
氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
3、决定元素的种类是核电荷数(或质子数),(即一种元素和另一种元素的本质区别是质子数不同或者核电荷数不同);决定元素的化学性质的是最外层电子数。
同种元素具有相同的核电荷数,如Fe、Fe2+、Fe3+因核电荷数相同,都称为铁元素,但最外层电子数不同,所以他们的化学性质也不同。
核电荷数相同的粒子不一定是同种元素,如Ne、HF、H2O、NH3、CH4。
已知RO32-有32个电子,则R的质子数为:R+8×3+2=324、盐中一定含有金属离子或金属元素(×)碱中一定含有金属元素(×)化合物中一定含有非金属元素(√)碱中一定含有氢氧元素(√)酸中一定含有氢元素(√)5、溶液的酸碱度常用pH来表示,pH=7时溶液呈中性,pH<7时呈酸性,pH>7时呈碱性。
PH=0时呈酸性,pH越小,酸性越强,pH越大,碱性越强。
蒸馏水的pH=7(雨水的pH<7显弱酸性),SO3溶于水,溶液pH<7,CO2溶于水,溶液pH<7;pH升高可加碱(可溶性碱)或水,pH降低可加酸或水。
化学用语(初三化学)

化学用语一、常见元素的符号及意义世界是由物质组成的,物质是由元素组成的,然而物质的化学式又是用元素符号和数字的组合来表示。
1、常见元素的符号(书写1-20号元素及常见金属的元素符号)书写原则:一大二小H He Li Be B C N O F Ne1 氢2 氦3 锂4 铍5 硼6 碳7 氮8 氧9 氟10 氖Na Mg Al Si P S Cl Ar K Ca11 钠12 镁13 铝14 硅15 磷16硫17 氯18氩19 钾20 钙Fe Cu Zn Ag Ba Hg Mn铁铜锌银钡汞锰2、元素符号的意义宏观上表示一种元素;微光上表示该元素的一个原子例如,H既表示氢元素,又表示1个氢原子3、离子符号带电荷的原子或原子团叫离子,由几个原子形成的原子团带有电荷的叫根,它们也叫离子。
金属原子容易失去最外层的电子,带正电荷形成阳离子。
非金属原子容易得到电子,形成带负电荷的阴离子。
熟练书写离子符号:阳离子:K+、Ca2+、Na+、Mg2+、Zn2+、Al3+、Fe3+(铁离子)、Fe2+(亚铁离子)、Ag+、H+、NH4+(铵根离子)等阴离子:Cl-、O2-、S2-、SO42-、NO3-、CO32-、OH-等二、常见元素的化合价1.化合价的定义元素的化合价是元素的原子在形成化合物时表现出来的性质,因此在单质中所有元素化合价都为0.化合价有正负之分,要在元素符号的正上方标出。
2.元素化合价的表示方法化合价用+1,+2,+3,-1,-2,…表示,标在元素符号的正上方,如,,,。
注意:化合价数值的符号与离子所带电荷数的符号有区别。
离子所带电荷符号用+,2+,-,2-,…表示,标在元素符号右上方,如Na+,Cl-,Mg2+,O2-。
3.化合价规则①在化合物中各元素化合价代数和为零。
如:。
(+1)+(+7)+(-2)×4=0。
②单质的化合价为零。
如、。
③在原子团形成的离子中,各元素的化合价代数和等于离子所带电荷数。
九年级化学知识点单词

九年级化学知识点单词一、化学基本概念化学:chemistry物质:substance化学物质:chemical元素:element化合物:compound分子:molecule原子:atom二、物质的性质性质:property物理性质:physical property化学性质:chemical property固体:solid液体:liquid气体:gas可燃性:flammability溶解性:solubility酸性:acidity碱性:alkalinity导电性:conductivity三、化学反应反应:reaction化学方程式:chemical equation 反应物:reactant生成物:product摩尔质量:molar mass摩尔比例:stoichiometry离子:ion氧化还原反应:redox reaction 催化剂:catalyst四、元素和化合物周期表:periodic table金属:metal非金属:nonmetal稀有气体:noble gas硫酸:sulfuric acid氯化钠:sodium chloride氨水:ammonia五、酸碱和盐酸:acid碱:base盐:salt中和反应:neutralization酸性溶液:acidic solution碱性溶液:alkaline solution酸雨:acid rain盐类化合物:ionic compound 六、能量和化学反应能量:energy放热反应:exothermic reaction 吸热反应:endothermic reaction 焓变:enthalpy change活化能:activation energy燃烧:combustion热力学:thermodynamics熵:entropy七、溶液和浓度溶液:solution溶剂:solvent溶质:solute浓度:concentration饱和度:saturation溶解:dissolution洗涤剂:detergent晶体:crystal八、化学反应速率速率:rate反应速率:reaction rate催化剂:catalyst化学平衡:chemical equilibrium反应机理:reaction mechanism速率常数:rate constant表观活化能:apparent activation energy动力学:kinetics九、化学平衡平衡:equilibrium平衡常数:equilibrium constant化学反应:chemical reaction正反应:forward reaction逆反应:reverse reaction摩尔浓度:molar concentration平衡表达式:equilibrium expression热力学平衡常数:thermodynamic equilibrium constant 十、化学实验实验:experiment实验方法:experimental method实验步骤:experimental procedure实验室:laboratory酸碱中和指示剂:acid-base indicator试剂:reagent测量误差:measurement error安全注意事项:safety precautions以上是九年级化学知识点的一些常见术语和单词。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学用语大全(1至8单元)
一、元素符号氢 H 氦 He 碳 C 氮 N 氧 O 氟 F 氖 Ne 钠Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩 Ar 钾 K 钙 Ca 锰Mn 铁 Fe 铜 Cu 锌 Zn 银 Ag 钡 Ba 铂 Pt 金 Au 汞 Hg 碘 I 锂 Li 铍 Be 硼 B 铅 Pb 锡 Sn 钛 Ti 溴 Br 钨 W
二、化学式氧气 O2 氢气 H2 氮气 N2 氟气 F2 氯气 Cl2 氦气 He 氖气 Ne 氩气 Ar 溴 Br2 碘 I2 臭氧 O3 碳 C 硫 S 磷 P 硅 Si 碳60 C60 铁 Fe 铝 Al 镁 Mg 锌 Zn 铜 Cu 银 Ag 水银Hg 钠 Na 水 H2O 过氧化氢 H2O2 二氧化碳 CO2 一氧化碳 CO 二氧化氮 NO2 一氧化二氮 N2O 一氧化氮 NO 二氧化硅 SiO2 五氧化二磷 P2O5 二氧化硫 SO2 三氧化硫 SO3 二氧化氯 ClO2 氧化钠 Na2O 氧化镁 MgO 氧化铝 Al2O3 氧化钾 K2O 氧化钙 CaO 二氧化锰 MnO2 四氧化三铁 Fe3O4 氧化铁 Fe2O3 氧化亚铁 FeO 氧化铜 CuO 氧化锌 ZnO 氧化钡 BaO 氧化汞 HgO 盐酸 HCl 硫酸
H2SO4 硝酸 HNO3 碳酸 H2CO3 磷酸 H3PO4 氨气 NH3 氨水
NH3H2O 氢氧化钾 KOH 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2 氢氧化钡 Ba(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌
Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜
Cu(OH)2 乙酸 CH3COOH 甲烷 CH4 乙醇 C2H5OH 葡萄糖 C6H12O6 淀粉 (C6H10O5)n 蔗糖 C12H22O11 氯化钾 KCl 氯化钠 NaCl 氯化钡 BaCl2 氯化钙 CaCl2 氯化镁 MgCl2 氯化铝 AlCl3 氯化锌
ZnCl2 氯化铁 FeCl3 氯化亚铁 FeCl2 氯化铜 CuCl2 氯化银AgCl 硫酸钾 K2SO4 硫酸钠 Na2SO4 硫酸钡 BaSO4 硫酸钙 CaSO4 硫酸镁 MgSO4 硫酸铝 Al2(SO4)3 硫酸锌 ZnSO4 硫酸铁
Fe2(SO4)3 硫酸亚铁 FeSO4 硫酸铜 CuSO4 硫酸银 Ag2SO4 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸钙 Ca(NO3)2 硝酸钡 Ba(NO3)2 硝酸镁 Mg(NO3)2 硝酸铝 Al(NO3)3 硝酸锌 Zn(NO3)2 硝酸铁
Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铜 Cu(NO3)2 硝酸银 AgNO3 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钾 K2CO3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸钡 BaCO3 碳酸镁 MgCO3 碳酸锌ZnCO3 碳酸亚铁 FeCO3 碳酸银 Ag2CO3 氯化铵 NH4Cl 硝酸铵
NH4NO3 硫酸铵 (NH4)2SO4 碳酸氢铵 NH4HCO3 碳酸铵 (NH4)2CO3 磷酸钙 Ca3(PO4)2
三、常见的离子符号氧离子 O2- 氟离子 F- 硫离子 S2- 氯离子 Cl- 钠离子 Na+ 镁离子 Mg2+ 铝离子 Al3+ 钾离子 K+ 钙离子 Ca2+ 氢离子 H+ 锂离子 Li+ 铍离子 Be2+ 铁离子 Fe3+ 亚铁离子 Fe2+ 铜离子 Cu2+ MnO4-ClO3-NO3-锌离子 Zn2+ 银离子Ag+ 钡离子 Ba2+ 碘离子 I- 溴离子 Br- HCO3-MnO42-SO42-
CO32-氢氧根离子 OH- 硝酸根离子氯酸根离子高锰酸根离子
NH4+PO43-SO32-碳酸氢根离子硫酸根离子碳酸根离子锰酸根离子亚硫酸根离子磷酸根离子铵根离子4P+5O22P2O5 点燃
四、化学方程式S+ O2 SO2点燃
1、红磷在氧气中燃烧3Fe+2O2 Fe3O4点燃
2、硫在氧气中燃烧2KMnO4 K2MnO4+MnO2 + O2↑ △
3、铁丝在氧气中燃烧
4、加热高锰酸钾2H2O22H2O+ O2↑ MnO22KClO32KCl+3O2↑ MnO2△
5、过氧化氢溶液与二氧化锰混合2Hg + O22HgO2HgO2Hg +
O2↑△△
6、加热氯酸钾与二氧化锰的混合物
7、在氧气中加热汞H2 + Cl22HCl点燃
8、氧化汞受热分解
9、氢气在氯气中燃烧2H2+ O22H2O点燃2H2O2H2↑+ O2↑ 通电
10、氢气在氧气中燃烧2Mg+ O22MgO点燃
11、电解水4Al+3O22Al2O3点燃
12、镁条在氧气中燃烧2Cu + O22CuO△
13、铝箔在氧气中燃烧H2 + CuO Cu+H2O△
14、铜在空气中加热C+ O2 CO2点燃
15、氢气还原氧化铜2C+ O22CO点燃
16、木炭在氧气中完全燃烧C +2CuO2Cu+ CO2↑ 高温
17、木炭在氧气中不完全燃烧3C +2Fe2O34Fe+3CO2↑ 高温
18、碳还原氧化铜C + CO22CO 高温
19、碳还原氧化铁C + H2O CO + H2 高温
20、碳还原二氧化碳
21、碳还原水蒸气CaCO3+2HCl CaCl2+CO2↑+H2O H2CO3
CO2↑+ H2O
22、实验室制取二氧化碳CaCO3 CaO + CO2↑ 高温
23、碳酸分解CO2 + H2O H2CO3
24、工业上制备二氧化碳
25、二氧化碳与水反应2CO+ O22CO2点燃CO2 + Ca(OH)2 CaCO3↓+ H2O
26、检验二氧化碳的反应
27、一氧化碳燃烧4CO + Fe3O43Fe +4CO2 高温CO + CuO Cu + CO2 △
28、一氧化碳还原氧化铜
29、一氧化碳还原四氧化三铁 CaO + H2O Ca(OH)2Na2CO3
+2HCl2NaCl+ CO2↑+H2O
30、灭火器的反应原理 CH4+2O2 CO2 +2H2O点燃
31、氧化钙与水反应 C2H5OH +3O22CO2 +3H2O点燃
32、甲烷燃烧
33、乙醇(酒精)燃烧Zn + H2SO4 ZnSO4 + H2↑
34、实验室制取氢气4Al +3O22Al2O3
35、铝常温下氧化Mg +2HCl MgCl2 + H2↑
36、镁与盐酸反应2Al +6HCl2AlCl3 +3H2↑Zn +2HCl ZnCl2 + H2↑
37、铝与盐酸反应Fe +2HCl FeCl2 + H2↑
38、锌与盐酸反应Mg + H2SO4 MgSO4 + H2↑
39、铁与盐酸反应
40、镁与稀硫酸反应2Al +3H2SO4 Al2(SO4)3 +3H2↑
41、铝与稀硫酸反应Fe + H2SO4 FeSO4 + H2↑
42、铁与稀硫酸反应 Fe + CuSO4 Cu + FeSO4
43、铁与硫酸铜溶液反应 Zn + CuSO4 Cu + ZnSO4
44、锌与硫酸铜溶液反应2Al +3CuSO43Cu + Al2(SO4)3
45、铝与硫酸铜溶液反应 Cu +2AgNO32Ag + Cu(NO3)2
46、铜与硝酸银溶液反应 Al +3AgNO33Ag + Al(NO3)3
47、铝与硝酸银溶液反应 Fe +2AgNO32Ag + Fe(NO3)2
48、铁与硝酸银溶液反应3CO + Fe2O32Fe +3CO2 高温Zn +2AgNO32Ag + Zn(NO3)2
49、锌与硝酸银溶液反应
50、工业上炼铁的反应原理。
