材料科学基础 第一章 原子排列()
《材料科学基础》作业答案

• 3、Fick扩散第二方程的高斯解适合求解总量为M 的扩散元素沉积为一薄层扩散问题 ;Fick扩散 第二方程的误差函数解适合求解 无限长棒(扩 散偶)或半无限长棒的扩散问题。
• 4、扩散的微观机理有 空位扩散 、 间隙扩散、 位 错扩散 、 表面扩散、晶界扩散 等。
• 5、空位扩散的阻力比间隙扩散 大 ,激活能 高。
第三章 晶体结构缺陷 P116
• 一、填空题 • 1、按几何组态,晶体中的缺陷分为 点缺陷 、 线
缺陷 、面缺陷 和体缺陷。 • 2、点缺陷主要包括 空位、 间隙原子、置换原子 ;
线缺陷有 位错 ;面缺陷包括 晶界、相界、表面 等。 • 3、描述位错性质及特征的是 柏氏矢量b 。 • 4、位错的类型有 刃位错 、 螺位错 和 混合位 错。
• 11、MgO晶体具有 NaCl型结构,其对称型是
3L4 4L36L29PC ,晶族是 高级晶族 ,晶系是 立 方晶系 ,晶体的键型是 离子键 。
• 12、硅酸盐晶体结构中的基本结构单元是 硅 氧四面体[SiO4]。
• 13、几种硅酸盐晶体的络阴离子分别为[Si2O7]6-、 [Si2O6]4-、[Si4O10]4-、[AlSi3O8]1-,它们的晶体 结构类型分别为 组群状 , 链状 , 层状 ,和 架状 。
• MgO的分子量为(24.305 +15.999 )40.30, •阿佛加得罗常数是6.0238×1023, •每个MgO 分子的质量A为: 40.30/(6.0238×1023)。
MgO结构:z=4 • MgO的密度ρ
Z M a /3 N A 4 4 (0 0 ..3 4 0 2 4 /( 6 .1 0 0 2 7 )1 3 0 2 3 ) 3 .5 1 (g /c m 3 )
材料科学基础 第一章

第一章晶体学基础材料中的原子(离子、分子)在三维空间呈规则,周期性排列。
原子无规则堆积。
非晶体:蜂蜡、玻璃金刚石、NaCl、冰等。
YX§1-1 空间点阵一、空间点阵的概念为了便于分析研究晶体的结构,进行如下处理:组成晶体的原子(或分子、原子集团)抽象几何点(点阵的结点自然形成三维阵列(空间点阵平行线连接空间格子(原子(离子)的刚球模型原子中心位置X Y Z a bcX Zab c §1-2晶面指数、晶向指数——Miller 指数晶面——穿过晶体中原子的平面。
晶向——晶体中任意原子列的直线方向。
§1-3常见晶体结构常见的晶体结构主要有:体心立方一、体心立方(BCC)体心立方结构可以缩写为BCC 钢球模型质点模型(face-centered cubic)a从晶体结构的钢球模型可以看出,原子与原子之间存在许多间隙。
分析这些间隙的数量、位置、形状和大小,对于了解晶体的性能、合金的相结构以及相变、扩散等问题都是十分重要的。
一、FCC 晶体FCC 中的间隙有2种:八面体间隙,四面体间隙1、正八面体间隙边长为:2a §1-4常见晶体结构的间隙八面体间隙四面体间隙§1-5 晶体的堆垛方式任何晶体都可以看作是由任意晶面的。
一般是以最密排晶面的堆垛方式作为晶体的堆垛方式。
一、BCC晶体视频最密排晶面:(110)堆垛次序:ABAB……§1-6 晶带所有相交于某一直线的或平行于此直线的晶面构成一个此直线称为晶带轴。
晶带轴[uvw]与该晶带的晶面存在如下关系——晶带方程hu+kv+lw例如:在正交(立方、正方、四方)点阵中,(101(100)、(010)、(110)、向平行,构成以[001]为晶带轴的晶带。
材料科学基础试题及答案

第一章 原子排列与晶体构造1. fcc 构造的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,把原子视为刚性球时,原子的半径r 与点阵常数a 的关系是 ;bcc 构造的密排方向是 ,密排面是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 ;hcp 构造的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 。
2. Al 的点阵常数为,其构造原子体积是,每一个晶胞中八面体间隙数为 ,四面体间隙数为 。
3. 纯铁冷却时在912e 发生同素异晶转变是从 构造转变成 构造,配位数 ,致密度降低 ,晶体体积 ,原子半径发生 。
4. 在面心立方晶胞中画出)(211晶面和]211[晶向,指出﹤110﹥中位于〔111〕平面上的方向。
在hcp 晶胞的〔0001〕面上标出)(0121晶面和]0121[晶向。
5. 求]111[和]120[两晶向所决定的晶面。
6 在铅的〔100〕平面上,1mm 2有多少原子?铅为fcc 面心立方构造,其原子半径R=×10-6mm 。
第二章 合金相构造一、 填空1〕 随着溶质浓度的增大,单相固溶体合金的强度 ,塑性 ,导电性 ,形成间隙固溶体时,固溶体的点阵常数 。
2〕 阻碍置换固溶体溶解度大小的要紧因素是〔1〕 ;〔2〕 ;〔3〕 ;〔4〕 和环境因素。
3〕 置换式固溶体的不均匀性要紧表现为 和 。
4〕 依照溶质原子进入溶剂点阵的位置区分,固溶体可分为 和 。
5〕 无序固溶体转变成有序固溶体时,合金性能转变的一样规律是强度和硬度 ,塑性 ,导电性 。
6〕间隙固溶体是 ,间隙化合物是 。
二、问答1、 分析氢,氮,碳,硼在-Fe 和-Fe 中形成固溶体的类型,进入点阵中的位置和固溶度大小。
元素的原子半径如下:氢:,氮:,碳:,硼:,-Fe :,-Fe :。
材料科学基础材料结构的基本知识

负性很强的原子之间形成一个桥梁,把 两者结合起来,形成氢键。所以氢键可 表达为:
X–H——Y 三、混合键
实际材料中单一结合键并不多,大 部分材料的内部原子结合键往往是各种 键的混合。例如: (1)ⅣA族的Si、Ge、Sn元素的结合
材料科学基础材料结构的基本知识
是共价键与金属键的混合。 (2)陶瓷化合物中出现离子键与共价键 混合的情况。
四、结合键的本质与原子间距
固体原子中存在两种力:吸引力 和排斥力。它们随原子间距的增大而 减小。当距离很远时,排斥力很小, 只有当原子间接近至电子轨道互相重
材料科学基础材料结构的基本知识
叠时斥力才明显增大,并超过了吸引力。
在某一距离下引力和斥力相等,这一距
离r0相当于原子的平衡距离,称原子间距。 力(F)核能量(E)之间的转换关
键的形成——在凝聚状态下,原子间距 离十分接近,便产生了原子间的作用力, 使原子结合在一起,就形成了键。 键分为一次键和二次键: 一次键——结合力较强,包括离子键、 共价键和金属键。 二次键——结合力较弱,包括范德瓦耳 斯键和氢键。
材料科学基础材料结构的基本知识
一、一次键
离子键——当两类原子结合时,金属原 子的外层电子很可能转移到非金属原子 外壳层上,使两者都得到稳定的电子结 构,从而降低体系的能量,此时金属原 子和非金属原子分别形成正离子和负离 子,正负离子间相互吸引,使原子结合 在一起,这就是离子键。(如NaCl)
原子核外电子的分部与四个量子数 有关,且服从下述两个基本原理: (1)泡利不相容原理 一个原子中不 可能存在有四个量子数完全相同的两个 电子。 (2)最低能量原理 电子总是优先占 据能量低的轨道,使系统处于最低的能 量状态。
材料科学基础课后习题答案1-4章

第一章原子结构与键合1. 主量子数n、轨道角动量量子数l i、磁量子数m i和自旋角动量量子数S i。
2. 能量最低原理、Pauli不相容原理,Hund规则。
3. 同一周期元素具有相同原子核外电子层数,但从左→右,核电荷依次增多,原子半径逐渐减小,电离能增加,失电子能力降低,得电子能力增加,金属性减弱,非金属性增强;同一主族元素核外电子数相同,但从上→下,电子层数增多,原子半径增大,电离能降低,失电子能力增加,得电子能力降低,金属性增加,非金属性降低;4. 在元素周期表中占据同一位置,尽管它们的质量不同,然它们的化学性质相同的物质称为同位素。
由于各同位素的含中子量不同(质子数相同),故具有不同含量同位素的元素总的相对原子质量不为正整数。
5. 52.0576. 73% (Cu63); 27% (Cu65)8. a:高分子材料;b:金属材料;c:离子晶体10.a) Al2O3的相对分子质量为M=26.98×2+16×3=101.961mm3中所含原子数为1.12*1020(个)b) 1g中所含原子数为2.95*1022(个)11. 由于HF分子间结合力是氢键,而HCl分子间结合力是范德化力,氢键的键能高于范德化力的键能,故此HF的沸点要比HCl的高。
第2章固体结构1.每单位晶胞内20个原子2.CsCl型结构系离子晶体结构中最简单一种,属立方晶系,简单立方点阵,Pm3m空间群,离子半径之比为0.167/0.181=0.92265,其晶体结构如图2-13所示。
从图中可知,在<111> 方向离子相接处,<100>方向不接触。
每个晶胞有一个Cs+和一个Cl-,的配位数均为8。
3.金刚石的晶体结构为复杂的面心立方结构,每个晶胞共含有8个碳原子。
金刚石的密度(g/cm3)对于1g碳,当它为金刚石结构时的体积(cm3)当它为石墨结构时的体积(cm3)故由金刚石转变为石墨结构时其体积膨胀4.]101[方向上的线密度为1.6. 晶面族{123}=(123)+(132)+(213)+(231)+(321)+(312)+)231(+)321(+)132(+)312(+)213(+)123(+)321(+)231(+)312(+)132(+)123(+)213(+)312(+)213(+)321(+)123(+)132(+)231(晶向族﹤221﹥=[221]+[212]+[122]+]212[+]122[+]221[+]122[+]212[+]221[+]122[+]221[+]212[7. 晶带轴[uvw]与该晶带的晶面(hkl)之间存在以下关系:hu+kv+lw=0;将晶带轴[001]代入,则h×0+k×0+l×1=0;当l=0时对任何h,k取值均能满足上式,故晶带轴[001]的所有晶带面的晶面指数一般形式为(hk0)。
中南大学材料科学基础课后习题答案

中南大学材料科学基础课后习题答案(总12页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第一章 原子排列与晶体结构1. [110], (111), ABCABC…, , 12 , 4 , a r 42=; [111], (110) , , 8 , 2 , a r 43= ; ]0211[, (0001) , ABAB , , 12 , 6 , 2a r =。
2., 4 , 8 。
3.FCC , BCC ,减少 ,降低 ,膨胀 ,收缩 。
4.解答:见图1-1 5. 解答:设所决定的晶面为(hkl ),晶面指数与面上的直线[uvw]之间有hu+kv+lw=0,故有:h+k-l=0,2h-l=0。
可以求得(hkl )=(112)。
6 解答:Pb 为fcc 结构,原子半径R 与点阵常数a 的关系为a r 42=,故可求得a =×10-6mm 。
则(100)平面的面积S =a 2=×0-12mm 2,每个(100)面上的原子个数为2。
所以1 mm 2上的原子个数s n 1==×1012。
第二章 合金相结构一、 填空1) 提高,降低,变差,变大。
2) (1)晶体结构;(2)元素之间电负性差;(3)电子浓度 ;(4)元素之间尺寸差别3) 存在溶质原子偏聚 和短程有序 。
4) 置换固溶体 和间隙固溶体 。
5) 提高 ,降低 ,降低 。
6) 溶质原子溶入点阵原子溶入溶剂点阵间隙中形成的固溶体,非金属原子与金属原子半径的比值大于时形成的复杂结构的化合物。
二、 问答1、 解答: -Fe 为bcc 结构,致密度虽然较小,但是它的间隙数目多且分散,间隙半径很小,四面体间隙半径为,即R =,八面体间隙半径为,即R =。
氢,氮,碳,硼由于与-Fe 的尺寸差别较大,在-Fe 中形成间隙固溶体,固溶度很小。
-Fe 的八面体间隙的[110]方向R= Ra ,间隙元素溶入时只引起一个方向上的点阵畸变,故多数处于-Fe 的八面体间隙中心。
考研必备之《材料科学基础》学霸笔记

考研必备之《材料科学基础》学霸笔记材料科学基础笔记第⼀章原⼦结构与键合概述:决定材料性能的最根本的因素是组成材料的各元素的原⼦结构,原⼦间的相互作⽤、相互结合,原⼦或分⼦在空间的排列分布和运动规律以及原⼦集合体的形貌特征等。
为此,我们需要了解材料的微观构造,即其内部结构和组织状态,以便从其内部的⽭盾性找出改善和发展材料的途径。
第⼀节原⼦结构1 物质的组成物质是由⽆数微粒按⼀定⽅式聚集⽽成的,这些微粒可能是原⼦、分⼦或离⼦;分⼦是能单独存在且保持物质化学特性的⼀种微粒;原⼦是化学变化中的最⼩微粒。
2 原⼦的结构(原⼦结构直接影响原⼦间的结合⽅式)3 原⼦的电⼦结构3.1电⼦既有粒⼦性⼜具有波动性,具有波粒⼆象性。
3.2电⼦的状态和在某处出现的机率可⽤薛定谔⽅程的解/波函数来描述,即原⼦中每个电⼦的空间位置和能量可⽤四个量⼦数来确定:a主量⼦数(n):决定原⼦中电⼦的能量及与核的平均距离(⼀般能量低的趋向近轨道,r较⼩,反之则反),即表⽰电⼦所处的量⼦壳层。
如K、L、M…,n=1,2,3;b 轨道⾓动量量⼦数(l):表⽰电⼦在同⼀壳层内所处的能级,与电⼦运动的⾓动量有关。
如s、p、d、f…(0,1,2,…n-1);c 磁量⼦数(m):给出每个轨道⾓动量量⼦数的能级数或轨道数,为2l+1,决定电⼦云的空间取向;d ⾃旋⾓动量量⼦数(s):反映电⼦不同的⾃旋⽅向,其值可取*只有n,l决定能量和能级3.3能级和能级图把电⼦不同状态对应着相同能量的现象称为简并。
将所有元素的各种电⼦态(n,l)按能量⽔平排列成能级图。
3.4核外电⼦的排布规则a 能量最低原理:电⼦的排布总是尽可能使体系的能量最低;b Pauling不相容原理:在⼀个原⼦中,不可能有上述运动状态完全相同的两个电⼦,即不能有上述四个量⼦数都相同的两个电⼦;c 洪德Hund规则:在同⼀个亚层中的各个能级中,电⼦的排布尽可能分占不同的能级,⽽且⾃旋⽅向相同(尽可能保持⾃旋不成对);3.5 元素周期表元素是具有相同核电荷数的同⼀类原⼦的总称;元素的外层电⼦结构随着原⼦序数的递增⽽呈周期性的变化规律称为元素周期律;元素周期表是元素周期律的表现形式;元素的性质、原⼦结构和该元素在周期表中的位置三者之间有着密切的关系。
材料科学基础Powerpoint(上交大)第一章 原子排列03

5
二、线缺陷
6/10/2021
西北工业大学 材料科学基础CAI课件 王永欣主编
6
原子面整体滑移——塑变
发现问题
理论强度远大于实测值
促使
探求新理论——位错理论
核心
位错逐排依次运动——塑变
结果
计算强度值 实测值
6/10/2021
西北工业大学 材料科学基础CAI课件 王永欣主编
7
1. 位错基本类型
1 1 cos2
,
为混合位错的位错线与b 夹角
6/10/2021
西北工业大学 材料科学基础CAI课件 王永欣主编
45
(a)比较
wE
wS
(1 )
wE
1.5wS
其中: 0.3 ~ 0.4
wE > wS
(b)一般公式
w Gb2
其中:α为几何因素系数,约0.5~1.0
6/10/2021
西北工业大学 材料科学基础CAI课件 王永欣主编
部分原子获得足够高的能量
克服约束,迁移到新的位置
形成
空位、间隙原子
引起
局部点阵畸变
6/10/2021
西北工业大学 材料科学基础CAI课件 王永欣主编
2
2. 分类
➢肖脱基缺陷——原子迁移到表面——仅形成空位 ➢弗兰克缺陷——原子迁移到间隙中——形成空位-间隙对 ➢杂质或溶质原子——间隙式(小原子)或置换式(大原子)
6/10/2021
西北工业大学 材料科学基础CAI课件 王永欣主编
44
(3)位错应变能
单位长度螺位错应变能:
wS
(W L
)S
Gb2
4
ln
R r0
材料科学基础第一章

5)晶体中原子的堆垛方式
39
40
6)晶体结构的多晶型性
多晶型性:有些金属(如Fe, Mn,Ti,Co,Sn,Zr等) 固 态下在 不同温 度或不 同 范 围内具 有不同 的晶体 结 构的性质。 同素异构转变:多晶型的金属在温度或压力变 化时,由一种结构转变为另一种结构的过程称 为多晶型性转变,也称为同素异构转变。
晶胞-空间点阵中反映晶格特征的最小的几何 单元。
10
通常是在晶格中取一个最小的平行六面体作为 晶胞。 晶胞参数: 点阵常数晶胞大小 晶轴夹角晶胞形状
11
晶胞选取原则:
a 能够充分反映空间点阵的对称性;
b 相等的棱和角的数目最多;
c 具有尽可能多的直角;
d 体积最小。
12
结构晶胞:构成了晶体结构中有代表性的部分 的晶胞。 特点:空间重复堆垛,就得到晶体结构。
44
SiC型:类似于金刚石型 SiO2型:面心立方 点阵,1个硅原子 被4个氧原子所包 围,每个氧原子则 介于两个硅原子之 间,起着连接两个 四面体的作用。单 胞共有24个原子。
45
第三节 原子的不规则排列
原子的不规则排列产生晶体缺陷(在晶体中所 占比例低)。 晶体缺陷:晶体中原子偏离其平衡位置而出现 不完整性的区域。 晶体缺陷是以一定的形态存在,按一定的规律 产生、发展、运动和交互作用,对晶体的性能 和物理化学变化有重要的影响。
53
2)螺型位错 screw dislocation
模型:滑移面//位错线。(位错线//晶体滑移方 向,位错线┻位错运动方向,晶体滑移方向┻位 错运动方向。) 分类:左螺型位错,右螺型位错。 左螺型位错和右螺型位错有着本质的区别。 无论位置如何摆放也不会改变其类型。 螺型位错特征:滑移方向//位错线
材料科学第一章-111-12

离子晶体性质: 1. 离子键正负离子静电引力较强,结合牢固,故熔点 高、硬度高、热膨胀系数小、脆性大; 2. 很难产生自由运动的电子,是良好的电绝缘体; 3. 高温熔融状态时正负离子在外电场作用下可以自由 运动,呈现离子导电性。
2019/9/14
材料科学基础 第一章
14
§Байду номын сангаас.1 原子键合
氢键(Hydrogen bonding)
存在于HF、H2O、NH3和带有-COOH、-OH、 -NH2原子团的高分子聚合物中的极性分子键。
氢原子中唯一电子被其它原子所共有(共价键结合), 裸露的氢原子核将与近邻分子的负端相互吸引氢桥, 可表示为:X-H—Y
2019/9/14
材料科学基础 第一章
16
§1.2 原子的规则排列—晶体学基础
固体材料可分为:晶体、非晶体
晶体:原子(分子,离子或原子集团)在三维空间按一定
规律作周期性重复排列的固体。
非晶体:原子散乱分布,或局部区域为短程规则排列。
主要差别:
晶体
非晶体
长程有序
短程有序
有固定熔点 液、固转变温度不定
材料科学基础
2019.9
第一章 工程材料中的原子排列
决定材料性质最为本质的内在因素是组成材料 各元素原子结构,原子间相互作用,相互结合,原 子或分子在空间的排列,运动规律,以及原子集合 体的形貌特征。
硅表面硅原子的排列 Ti系超导氧化物的二维结构像
2019/9/14
材料科学基础 第一章
2
第一章 工程材料中的原子排列
体心正方 [0 0 0],[1/2 1/2 1/2]
材料科学基础作业详细答案
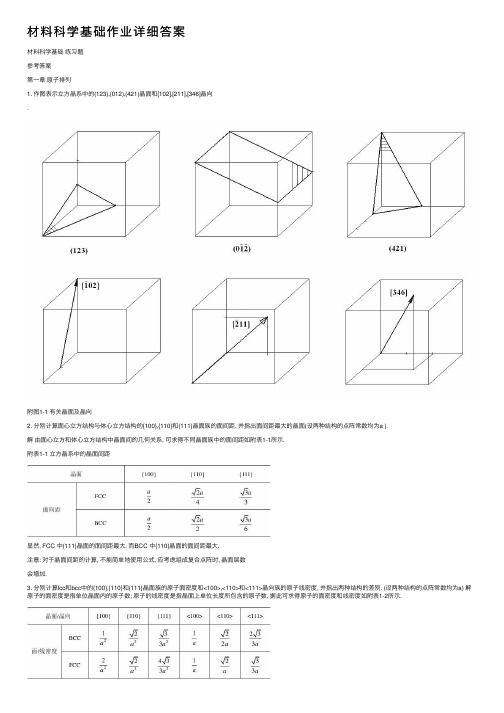
材料科学基础作业详细答案材料科学基础练习题参考答案第⼀章原⼦排列1. 作图表⽰⽴⽅晶系中的(123),(012),(421)晶⾯和[102],[211],[346]晶向.附图1-1 有关晶⾯及晶向2. 分别计算⾯⼼⽴⽅结构与体⼼⽴⽅结构的{100},{110}和{111}晶⾯族的⾯间距, 并指出⾯间距最⼤的晶⾯(设两种结构的点阵常数均为a ).解由⾯⼼⽴⽅和体⼼⽴⽅结构中晶⾯间的⼏何关系, 可求得不同晶⾯族中的⾯间距如附表1-1所⽰.附表1-1 ⽴⽅晶系中的晶⾯间距显然, FCC 中{111}晶⾯的⾯间距最⼤, ⽽BCC 中{110}晶⾯的⾯间距最⼤.注意: 对于晶⾯间距的计算, 不能简单地使⽤公式, 应考虑组成复合点阵时, 晶⾯层数会增加.3. 分别计算fcc和bcc中的{100},{110}和{111}晶⾯族的原⼦⾯密度和<100>,<110>和<111>晶向族的原⼦线密度, 并指出两种结构的差别. (设两种结构的点阵常数均为a) 解原⼦的⾯密度是指单位晶⾯内的原⼦数; 原⼦的线密度是指晶⾯上单位长度所包含的原⼦数. 据此可求得原⼦的⾯密度和线密度如附表1-2所⽰.可见, 在BCC中, 原⼦密度最⼤的晶⾯为{110}, 原⼦密度最⼤的晶向为<111>; 在FCC 中, 原⼦密度最⼤的晶⾯为{111}, 原⼦密度最⼤的晶向为<110>.4. 在(0110)晶⾯上绘出[2113]晶向.解详见附图1-2.附图1-2 六⽅晶系中的晶向5. 在⼀个简单⽴⽅⼆维晶体中, 画出⼀个正刃型位错和⼀个负刃型位错. 试求:(1) ⽤柏⽒回路求出正、负刃型位错的柏⽒⽮量.(2) 若将正、负刃型位错反向时, 说明其柏⽒⽮量是否也随之反向.(3) 具体写出该柏⽒⽮量的⽅向和⼤⼩.(4) 求出此两位错的柏⽒⽮量和.解正负刃型位错⽰意图见附图1-3(a)和附图1-4(a).(1) 正负刃型位错的柏⽒⽮量见附图1-3(b)和附图1-4(b).(2) 显然, 若正、负刃型位错线反向, 则其柏⽒⽮量也随之反向.(3) 假设⼆维平⾯位于YOZ坐标⾯, ⽔平⽅向为Y轴, 则图⽰正、负刃型位错⽅向分别为[010]和[010], ⼤⼩均为⼀个原⼦间距(即点阵常数a).(4) 上述两位错的柏⽒⽮量⼤⼩相等, ⽅向相反, 故其⽮量和等于0.6. 设图1-72所⽰⽴⽅晶体的滑移⾯ABCD平⾏于晶体的上下底⾯, 该滑移⾯上有⼀正⽅形位错环. 如果位错环的各段分别与滑移⾯各边平⾏, 其柏⽒⽮量b // AB, 试解答:(1) 有⼈认为“此位错环运动离开晶体后, 滑移⾯上产⽣的滑移台阶应为4个b”, 这种说法是否正确? 为什么?(2) 指出位错环上各段位错线的类型, 并画出位错移出晶体后, 晶体的外形、滑移⽅向和滑移量. (设位错环线的⽅向为顺时针⽅向)图1-72 滑移⾯上的正⽅形位错环附图1-5 位错环移出晶体引起的滑移解 (1) 这种看法不正确. 在位错环运动移出晶体后, 滑移⾯上下两部分晶体相对移动的距离是由其柏⽒⽮量决定的. 位错环的柏⽒⽮量为b , 故其相对滑移了⼀个b 的距离.(2) A ′B ′为右螺型位错, C ′D ′为左螺型位错, B ′C ′为正刃型位错, D ′A ′为负刃型位错. 位错运动移出晶体后滑移⽅向及滑移量见附图1-5.7. 设⾯⼼⽴⽅晶体中的(111)晶⾯为滑移⾯, 位错滑移后的滑移⽮量为[110]2a .(1) 在晶胞中画出此柏⽒⽮量b 的⽅向并计算出其⼤⼩.(2) 在晶胞中画出引起该滑移的刃型位错和螺型位错的位错线⽅向, 并写出此⼆位错线的晶向指数.解 (1) 柏⽒⽮量等于滑移⽮量, 因此柏⽒⽮量的⽅向为[110], /2.(2) 刃型位错与柏⽒⽮量垂直, 螺型位错与柏⽒⽮量平⾏, 晶向指数分别为[112]和[110], 详见附图1-6.附图1-6 位错线与其柏⽒⽮量、滑移⽮量8. 若⾯⼼⽴⽅晶体中有[101]2a b =的单位位错及[121]6a b =的不全位错, 此⼆位错相遇后产⽣位错反应.(1) 此反应能否进⾏? 为什么?(2) 写出合成位错的柏⽒⽮量, 并说明合成位错的性质.解 (1) 能够进⾏.因为既满⾜⼏何条件:[111]3a b b ==∑∑后前,⼜满⾜能量条件: . 22222133b a b a =>=∑∑后前. (2) [111]3a b =合, 该位错为弗兰克不全位错. 9. 已知柏⽒⽮量的⼤⼩为b = 0.25nm, 如果对称倾侧晶界的取向差θ = 1° 和10°, 求晶界上位错之间的距离. 从计算结果可得到什么结论?解根据bD θ≈, 得到θ = 1°,10° 时, D ≈14.3nm, 1.43nm. 由此可知, θ = 10° 时位错之间仅隔5~6个原⼦间距, 位错密度太⼤, 表明位错模型已经不适⽤了.第⼆章固体中的相结构1. 已知Cd, In, Sn, Sb 等元素在Ag 中的固熔度极限(摩尔分数)分别为0.435, 0.210, 0.130, 0.078; 它们的原⼦直径分别为0.3042 nm, 0.314 nm, 0.316 nm, 0.3228 nm; Ag 的原⼦直径为0.2883 nm. 试分析其固熔度极限差异的原因, 并计算它们在固熔度极限时的电⼦浓度.答: 在原⼦尺⼨因素相近的情况下, 熔质元素在⼀价贵⾦属中的固熔度(摩尔分数)受原⼦价因素的影响较⼤, 即电⼦浓度e /a 是决定固熔度(摩尔分数)的⼀个重要因素, ⽽且电⼦浓度存在⼀个极限值(约为1.4). 电⼦浓度可⽤公式A B B B (1)c Z x Z x =-+计算. 式中, Z A , Z B 分别为A, B 组元的价电⼦数; x B 为B 组元的摩尔分数. 因此, 随着熔质元素价电⼦数的增加, 极限固熔度会越来越⼩.Cd, In, Sn, Sb 等元素与Ag 的原⼦直径相差不超过15%(最⼩的Cd 为5.5%, 最⼤的Sb 为11.96%), 满⾜尺⼨相近原则, 这些元素的原⼦价分别为2, 3, 4, 5价, Ag 为1价, 据此推断它们的固熔度极限越来越⼩, 实际情况正好反映了这⼀规律; 根据上⾯的公式可以计算出它们在固熔度(摩尔分数)极限时的电⼦浓度分别为1.435, 1.420, 1.390, 1.312.2. 碳可以熔⼊铁中⽽形成间隙固熔体, 试分析是α-Fe 还是γ-Fe 能熔⼊较多的碳.答: α-Fe 为体⼼⽴⽅结构, 致密度为0.68; γ-Fe 为⾯⼼⽴⽅结构, 致密度为0.74. 显然, α-Fe 中的间隙总体积⾼于γ-Fe, 但由于α-Fe 的间隙数量多, 单个间隙半径却较⼩, 熔⼊碳原⼦将会产⽣较⼤的畸变, 因此, 碳在γ-Fe 中的固熔度较α-Fe 的⼤.3. 为什么只有置换固熔体的两个组元之间才能⽆限互熔, ⽽间隙固熔体则不能?答: 这是因为形成固熔体时, 熔质原⼦的熔⼊会使熔剂结构产⽣点阵畸变, 从⽽使体系能量升⾼. 熔质原⼦与熔剂原⼦尺⼨相差越⼤, 点阵畸变的程度也越⼤, 则畸变能越⾼,结构的稳定性越低, 熔解度越⼩. ⼀般来说, 间隙固熔体中熔质原⼦引起的点阵畸变较⼤, 故不能⽆限互熔, 只能有限熔解.第三章凝固1. 分析纯⾦属⽣长形态与温度梯度的关系.答: 纯⾦属⽣长形态是指晶体宏观长⼤时固-液界⾯的形貌. 界⾯形貌取决于界⾯前沿液相中的温度梯度.(1) 平⾯状长⼤: 当液相具有正温度梯度时, 晶体以平直界⾯⽅式推移长⼤. 此时, 界⾯上任何偶然的、⼩的凸起深⼊液相时, 都会使其过冷度减⼩, 长⼤速率降低或停⽌长⼤,⽽被周围部分赶上, 因⽽能保持平直界⾯的推移. 长⼤过程中晶体沿平⾏温度梯度的⽅向⽣长, 或沿散热的反⽅向⽣长, ⽽其它⽅向的⽣长则受到限制.(2) 树枝状长⼤: 当液相具有负温度梯度时, 晶体将以树枝状⽅式⽣长. 此时, 界⾯上偶然的凸起深⼊液相时, 由于过冷度的增⼤, 长⼤速率越来越⼤; ⽽它本⾝⽣长时⼜要释放结晶潜热, 不利于近旁的晶体⽣长, 只能在较远处形成另⼀凸起. 这就形成了枝晶的⼀次轴, 在⼀次轴成长变粗的同时, 由于释放潜热使晶枝侧旁液体中也呈现负温度梯度, 于是在⼀次轴上⼜会长出⼩枝来, 称为⼆次轴, 在⼆次轴上⼜长出三次轴……由此⽽形成树枝状⾻架, 故称为树枝晶(简称枝晶).2. 简述纯⾦属晶体长⼤机制及其与固-液界⾯微观结构的关系.答: 晶体长⼤机制是指晶体微观长⼤⽅式, 即液相原⼦添加到固相的⽅式, 它与固-液界⾯的微观结构有关.(1) 垂直长⼤⽅式: 具有粗糙界⾯的物质, 因界⾯上约有50% 的原⼦位置空着, 这些空位都可以接受原⼦, 故液相原⼦可以进⼊空位, 与晶体连接, 界⾯沿其法线⽅向垂直推移,呈连续式长⼤.(2) 横向(台阶)长⼤⽅式: 包括⼆维晶核台阶长⼤机制和晶体缺陷台阶长⼤机制, 具有光滑界⾯的晶体长⼤往往采取该⽅式. ⼆维晶核模式, 认为其⽣长主要是利⽤系统的能量起伏, 使液相原⼦在界⾯上通过均匀形核形成⼀个原⼦厚度的⼆维薄层状稳定的原⼦集团, 然后依靠其周围台阶填充原⼦, 使⼆维晶核横向长⼤, 在该层填满后, 则在新的界⾯上形成新的⼆维晶核, 继续填满, 如此反复进⾏.晶体缺陷⽅式, 认为晶体⽣长是利⽤晶体缺陷存在的永不消失的台阶(如螺型位错的台阶或挛晶的沟槽)长⼤的.第四章相图1. 在Al-Mg 合⾦中, x Mg 为0.15, 计算该合⾦中镁的w Mg 为多少.解设Al 的相对原⼦量为M Al , 镁的相对原⼦量为M Mg , 按1mol Al-Mg 合⾦计算, 则镁的质量分数可表⽰为Mg MgMg Al Al Mg Mg 100%x M w x M x M =?+.将x Mg = 0.15, x Al = 0.85, M Mg = 24, M Al = 27代⼊上式中, 得到w Mg = 13.56%.2. 根据图4-117所⽰⼆元共晶相图, 试完成:(1) 分析合⾦I, II 的结晶过程, 并画出冷却曲线.(2) 说明室温下合⾦I, II 的相和组织是什么, 并计算出相和组织组成物的相对量.(3) 如果希望得到共晶组织加上相对量为5%的β初的合⾦, 求该合⾦的成分.图4-117 ⼆元共晶相图附图4-1 合⾦I的冷却曲线附图4-2 合⾦II的冷却曲线解(1) 合⾦I的冷却曲线参见附图4-1, 其结晶过程如下:1以上, 合⾦处于液相;1~2时, 发⽣匀晶转变L→α, 即从液相L中析出固熔体α, L和α的成分沿液相线和固相线变化, 达到2时, 凝固过程结束;2时, 为α相;2~3时, 发⽣脱熔转变, α→βII.合⾦II的冷却曲线参见附图4-2, 其结晶过程如下:1以上, 处于均匀液相;1~2时, 进⾏匀晶转变L→β;2时, 两相平衡共存, 0.50.9L β ;2~2′时, 剩余液相发⽣共晶转变0.50.20.9L βα+ ;2~3时, 发⽣脱熔转变α→βII .(2) 室温下, 合⾦I 的相组成物为α + β, 组织组成物为α + βII .相组成物相对量计算如下:αβ0.900.20100%82%0.900.050.200.05100%18%0.900.05w w -==--==- 组织组成物的相对量与相的⼀致.室温下, 合⾦II 的相组成物为α + β, 组织组成物为β初 + (α+β).相组成物相对量计算如下:αβ0.900.80100%12%0.900.050.800.05100%88%0.900.05w w -==--==- 组织组成物相对量计算如下:β(α+β)0.800.50100%75%0.900.500.900.80100%25%0.900.50w w -==--==-初 (3) 设合⾦的成分为w B = x , 由题意知该合⾦为过共晶成分, 于是有β0.50100%5%0.900.50x w -==-初所以, x = 0.52, 即该合⾦的成分为w B = 0.52.3. 计算w C 为0.04的铁碳合⾦按亚稳态冷却到室温后组织中的珠光体、⼆次渗碳体和莱⽒体的相对量, 并计算组成物珠光体中渗碳体和铁素体及莱⽒体中⼆次渗碳体、共晶渗碳体与共析渗碳体的相对量.解根据Fe-Fe 3C 相图, w C = 4%的铁碳合⾦为亚共晶铸铁, 室温下平衡组织为 P + Fe 3C II + L d ′, 其中P 和Fe 3C II 系由初⽣奥⽒体转变⽽来, 莱⽒体则由共晶成分的液相转变⽽成, 因此莱⽒体可由杠杆定律直接计算, ⽽珠光体和⼆次渗碳体则可通过两次使⽤杠杆定律间接计算出来.L d ′相对量: d L 4 2.11100%86.3%4.3 2.11w '-==-.Fe 3C II 相对量: 3II Fe C 4.34 2.110.77100% 3.1%4.3 2.11 6.690.77w --=??=--. P 相对量: P 4.34 6.69 2.11100%10.6%4.3 2.11 6.690.77w --=??=--. 珠光体中渗碳体和铁素体的相对量的计算则以共析成分点作为⽀点, 以w C = 0.001%和w C = 6.69%为端点使⽤杠杆定律计算并与上⾯计算得到的珠光体相对量级联得到.P 中F 相对量: F P 6.690.77100%9.38%6.690.001w w -=??=-. P 中Fe 3C 相对量: 3Fe C 10.6%9.38% 1.22%w =-=.⾄于莱⽒体中共晶渗碳体、⼆次渗碳体及共析渗碳体的相对量的计算, 也需采取杠杆定律的级联⽅式, 但必须注意⼀点, 共晶渗碳体在共晶转变线处计算, ⽽⼆次渗碳体及共析渗碳体则在共析转变线处计算.L d ′中共晶渗碳体相对量: d Cm L4.3 2.11100%41.27%6.69 2.11w w '-=??=-共晶 L d ′中⼆次渗碳体相对量: d Cm L 6.69 4.3 2.110.77100%10.2%6.69 2.11 6.690.77w w '--==--IIL d ′中共析渗碳体相对量: d Cm L 6.69 4.3 6.69 2.110.770.0218100% 3.9%6.69 2.11 6.690.77 6.690.0218w w '---==---共析 4. 根据下列数据绘制Au-V ⼆元相图. 已知⾦和钒的熔点分别为1064℃和1920℃. ⾦与钒可形成中间相β(AuV 3); 钒在⾦中的固熔体为α, 其室温下的熔解度为w V = 0.19; ⾦在钒中的固熔体为γ, 其室温下的熔解度为w Au = 0.25. 合⾦系中有两个包晶转变, 即1400V V V 1522V V V (1) β(0.4)L(0.25)α(0.27)(2) γ(0.52)L(0.345)β(0.45)w w w w w w =+===+== ℃℃解根据已知数据绘制的Au-V ⼆元相图参见附图4-3.附图4-3 Au-V ⼆元相图第五章材料中的扩散1. 设有⼀条直径为3cm 的厚壁管道, 被厚度为0.001cm 的铁膜隔开, 通过输⼊氮⽓以保持在膜⽚⼀边氮⽓浓度为1000 mol/m 3; 膜⽚另⼀边氮⽓浓度为100 mol/m 3. 若氮在铁中700℃时的扩散系数为4×10-7 cm 2 /s, 试计算通过铁膜⽚的氮原⼦总数.解设铁膜⽚左右两边的氮⽓浓度分别为c 1, c 2, 则铁膜⽚处浓度梯度为7421510010009.010 mol /m 110c c c c x x x --??-≈===- 根据扩散第⼀定律计算出氮⽓扩散通量为722732410(10)(9.010) 3.610 mol/(m s)c J D x---?=-=--?=?? 于是, 单位时间通过铁膜⽚的氮⽓量为 3-22-63.610(310) 2.5410 mol/s 4J A π-==?最终得到单位时间通过铁膜⽚的氮原⼦总数为-62318-1A () 2.5410 6.02102 3.0610 s N J A N =?==?第六章塑性变形1. 铜单晶体拉伸时, 若⼒轴为 [001] ⽅向, 临界分切应⼒为0.64 MPa, 问需要多⼤的拉伸应⼒才能使晶体开始塑性变形?解铜为⾯⼼⽴⽅⾦属, 其滑移系为 {111}<110>, 4个 {111} ⾯构成⼀个⼋⾯体, 详见教材P219中的图6-12.当拉⼒轴为 [001] ⽅向时, 所有滑移⾯与⼒轴间的夹⾓相同, 且每个滑移⾯上的三个滑移⽅向中有两个与⼒轴的夹⾓相同, 另⼀个为硬取向(λ = 90°). 于是, 取滑移系(111)[101]进⾏计算.ks cos cos cos cos 0.64 1.57 MPa.m m ?λ?λτσ========= 即⾄少需要1.57 MPa 的拉伸应⼒才能使晶体产⽣塑性变形.2. 什么是滑移、滑移线、滑移带和滑移系? 作图表⽰α-Fe, Al, Mg 中的最重要滑移系. 那种晶体的塑性最好, 为什么?答: 滑移是晶体在切应⼒作⽤下⼀部分相对于另⼀部分沿⼀定的晶⾯和晶向所作的平⾏移动; 晶体的滑移是不均匀的, 滑移部分与未滑移部分晶体结构相同. 滑移后在晶体表⾯留下台阶, 这就是滑移线的本质. 相互平⾏的⼀系列滑移线构成所谓滑移带. 晶体发⽣滑移时, 某⼀滑移⾯及其上的⼀个滑移⽅向就构成了⼀个滑移系.附图6-1 三种晶体点阵的主要滑移系α-Fe具有体⼼⽴⽅结构, 主要滑移系可表⽰为{110}<111>, 共有6×2 = 12个; Al具有⾯⼼⽴⽅结构, 其滑移系可表⽰为{111}<110>, 共有4×3 = 12个; Mg具有密排六⽅结构, 主要滑移系可表⽰为{0001}1120<>, 共有1×3 = 3个. 晶体的塑性与其滑移系的数量有直接关系, 滑移系越多, 塑性越好; 滑移系数量相同时, ⼜受滑移⽅向影响, 滑移⽅向多者塑性较好, 因此, 对于α-Fe, Al, Mg三种⾦属, Al的塑性最好, Mg的最差, α-Fe居中. 三种典型结构晶体的重要滑移系如附图6-1所⽰.3. 什么是临界分切应⼒? 影响临界分切应⼒的主要因素是什么? 单晶体的屈服强度与外⼒轴⽅向有关吗? 为什么?答:滑移系开动所需的作⽤于滑移⾯上、沿滑移⽅向的最⼩分切应⼒称为临界分切应⼒.临界分切应⼒τk的⼤⼩主要取决于⾦属的本性, 与外⼒⽆关. 当条件⼀定时, 各种晶体的临界分切应⼒各有其定值. 但它是⼀个组织敏感参数, ⾦属的纯度、变形速度和温度、⾦属的加⼯和热处理状态都对它有很⼤影响.如前所述, 在⼀定条件下, 单晶体的临界分切应⼒保持为定值, 则根据分切应⼒与外加轴向应⼒的关系: σs= τk/ m, m为取向因⼦, 反映了外⼒轴与滑移系之间的位向关系, 因此, 单晶体的屈服强度与外⼒轴⽅向关系密切. m越⼤, 则屈服强度越⼩, 越有利于滑移.4. 孪⽣与滑移主要异同点是什么? 为什么在⼀般条件下进⾏塑性变形时锌中容易出现挛晶, ⽽纯铁中容易出现滑移带?答:孪⽣与滑移的异同点如附表6-1所⽰.锌为密排六⽅结构⾦属, 主要滑移系仅3个, 因此塑性较差, 滑移困难, 往往发⽣孪⽣变形, 容易出现挛晶; 纯铁为体⼼⽴⽅结构⾦属, 滑移系较多, 共有48个, 其中主要滑移系有12个, 因此塑性较好, 往往发⽣滑移变形, 容易出现滑移带.第七章回复与再结晶1. 已知锌单晶体的回复激活能为8.37×104 J/mol, 将冷变形的锌单晶体在-50 ℃进⾏回复处理, 如去除加⼯硬化效应的25% 需要17 d, 问若在5 min 内达到同样效果, 需将温度提⾼多少摄⽒度?解根据回复动⼒学, 采⽤两个不同温度将同⼀冷变形⾦属的加⼯硬化效应回复到同样程度, 回复时间、温度满⾜下述关系:122111exp t Q t R T T =-- ? ?整理后得到221111ln T t R T Q t =+. 将41211223 K,/5/(172460),8.3710 J/mol, 8.314 J/(mol K)4896T t t Q R ==??==?=?代⼊上式得到2274.7 K T =.因此, 需将温度提⾼21274.722351.7 T T T ?=-=-=℃.2. 纯铝在553 ℃和627 ℃等温退⽕⾄完成再结晶分别需要40 h 和1 h, 试求此材料的再结晶激活能.解再结晶速率v 再与温度T 的关系符合阿累尼乌斯(Arrhenius)公式, 即exp()Q v A RT=-再其中, Q 为再结晶激活能, R 为⽓体常数.如果在两个不同温度T 1, T 2进⾏等温退⽕, 欲产⽣同样程度的再结晶所需时间分别为t 1, t 2, 则122112122111 exp[()]ln(/)t Q t R T T RTT t t Q T T =--?=- 依题意, 有T 1 = 553 + 273 = 826 K, T 2 = 627 + 273 = 900 K, t 1 = 40 h, t 2 = 1 h, 则58.314826900ln(40/1) 3.0810J/mol 900826Q =?-3. 说明⾦属在冷变形、回复、再结晶及晶粒长⼤各阶段的显微组织、机械性能特点与主要区别.答: ⾦属在冷变形、回复、再结晶及晶粒长⼤各阶段的显微组织、机械性能特点与主要区别详见附表7-1.附表7-1 ⾦属在冷变形、回复、再结晶及晶粒长⼤各阶段的显微组织、机械性能第⼋章固态相变。
材料科学基础习题上册

9:画出hcp晶胞,并画出(10-10)晶面及[11-20]晶向。
10:画出bcc晶胞下列晶面上原子平面排列情况:(110),(111)
12:画出两个面心晶胞组成的体心正方晶胞,并画出(111)fcc,(011)体心正方晶面与[-211]fcc,[01-1]体心正方晶向,并指出两晶面与两晶向存在何种关系。
10.获得非晶合金的基本方法是_____________________________。
11铸锭典型的三层组织是______________, __________________, ___________________。
7动态过冷度是_______________________________________________。
8在工厂生产条件下,过冷度增大,则临界晶核半径_____,金属结晶冷却速度越快,N/G比值___________,晶粒越___。
9制备单晶的基本原理是_____________________________,主要方法有_____________法和______________法。。
A FCC,B BCC,C hcp
6.在有序固溶体中,异类原子结合力小于同类原子结合力。()
7.所有金属间化合物都能提高合金的强度。()
8.Nb的原子半径为1.47A,C原子半径为0.77A,则NbC为间隙化合物()
9.纯金属发生同素异性转变将产生成分和有序度方面的改变。()
10.与固溶体相比,金属化合物具有高硬度低塑性。()
4在面心立方fcc晶胞中,﹤110﹥方向中位于(111)平面上的有哪些方向。
5画出一个体心立方晶胞,在晶胞上画出:
材料科学基础复习.

积
第三章 典型金属晶体结构
基本参数
点阵常数
fcc
2 R a 4
bcc
3 R a 4
1/ 8 8 1 2
hcp
R 1 a 2
晶胞内原子数 1 / 8 8 1 / 2 6 4 配位数 致密度 最近原子间距
12 0.74 8
1 / 6 12 1 / 2 2 3 6
材料科学基础复习
2019/4/14
第一章 原子结构与键合
◆ 原子的电子结构 核外电子排布规律:能量最低原理、泡利( Pauli )不 相容原理、洪德( Hund )法则。 要求: 熟悉且能写出一般 元素的核外电子排布式。如C、O、N、Na、Mg、Al等。 ◆ 原子间的键合
物理键:范德华力、氢键
主要依靠原子间的偶极吸引力结合 化学键:金属键、离子键、共价键(极性和非极性)
2
2
2
2019/4/14
第四章 晶体缺陷
例:
b1 a[100]
a b 2 [101] 2
b1 a
a b2 2
1 0 0 a
1
2
2
2
2
0
2
1
2
2 a 2
a b 2 [101] 2
b1 a[100]
第四章 晶体缺陷
根据位错理论的提出背景,当位错受到力的作用时,会 发生运动。
扩散的热力学理论
第五章 固体材料中的扩散
诱发原因:
1)弹性应力场的作用:应力梯度抵消了浓度梯度。 2)电场、磁场的作用:电场、磁场对带电粒子的运动产生影响。
3)晶界内吸附作用:溶质原子向晶界偏聚。
4)调 幅 分 解:典型的化学位梯度与浓度梯度方向相反。
《材料科学基础》习题及参考答案

形核功,还是可以成核的。
答案
(7)测定某纯金属铸件结晶时的最大过冷度,其实测
值与用公式ΔT=0.2Tm计算值基本一致。
答案
(8) 某些铸件结晶时,由于冷却较快,均匀形核率N1
提高,非均匀形核率N2也提高,故总的形核率为N=
N1 +N2。
答案
返回
53
(9) 若在过冷液体中,外加10 000颗形核剂,则结晶
❖ ②比较Cu-10% Sn合金铸件和Cu-30%合金铸件的铸造性能 及铸造组织,说明Cu-10% Sn合金铸件中有许多分散砂眼的 原因。
③ω(Sn}分别为2%,11%和15%的青铜合金,哪一种可进行 压力加工?哪种可利用铸造法来制造机件?
答案
返7回8
❖ 9.如下图所示,已知A,B,C三组元固态完全不互溶,质量 分数分别84%A,,10%B,10%C的O合金在冷却过程中将进 行二元共晶反应和三元共晶反应,在二元共晶反应开始时, 该合金液相成分(a点)为60%A,20%B,20%C,而三元共 晶反应开始时的液相成分(E点)为50%A,10%B,40%C。
答案
返回
6
❖ 6.位错受力后运动方向处处垂直于位错线,在运动
过程中是可变的,晶体作相对滑动的方向应是什么
方向?
答案
❖ 7.位错线上的割阶一般如何形成?
答案
❖ 8.界面能最低的界面是什么界面?
答案
❖ 9. “小角度晶界都是由刃型位错排成墙而构成的”这
种说法对吗?
答案
返回
7
三、综合题
❖ 1. 作图表示立方晶体的(123)(0 -1 -2) (421)晶面及[-102][-211][346]晶向。 答案
❖ 9. 在Fe中形成1mol 空位的能量为104. 67kJ,
材料科学基础第一章材料结构的基本知识

1、对物理性能的影响 1) 熔点:共价键、离子键的最高
,高分子材料
的最低. 2) 密度:金属键的25 最高,共价键
2、对力学性能的影响 (1) 强度:结合键强,则强度
也高,但还受组织的影响. (2) 塑韧性:金属键最好,共
价键、离子键最低. (3) 弹性模量:共价键、离子
键最高,金属键次之,二次键 最低
26
第三节 原子排列方式
• 晶体与非晶体 • 原子排列的研究方法 一、晶体与非晶体 1、晶体
原子(原子团或分子)在空间有规则的周期 性重复排列的固体。
一般情况下,金属、大多数陶瓷、少 数高分子材料为晶体。
27
• 非晶体:
排列无序,不存在长程的周期 规则排列。
二氧化硅结构示意图 28
• 材料最终得到什么结构,必须综合考虑 结构形成的热力学条件和动力学条件。
1、热力学条件 结构形成时必须沿着36 能量降低的方向进
• 等温等容过程:
亥姆过霍程兹自由能变化A,T, V 0
自发
•吉布等斯温自等由压能过变程化:G,T, P 0
程
自发过
2、动力学条件
反应速度。
化学反应动力学的Arhennius方程:
一、一次键 1、离子键 • 通过正负离子间相互吸引力
使原子结合的结10 合键.
• 例如:NaCl, MgO 对于 NaCl: Na:1S22S22P63S1 Cl: 1S22S22P63S23P5 Na 原子失去一个外层电子,变成
正离子,带正电 Cl 原子得到一个外层电子,变成
负离子,带负电
11
12
第一章 材料结构的基本知识
结构分4个层次: • 原子结构 • 结合键 • 原子的排列 • 显微组织
材料科学基础-复习题纲

第一部分材料的原子结构1、原子结构与原子的电子结构;原子结构、原子排列对材料性能的影响。
原子结构:原子由质子和中子组成的原子核以及核外的电子所构成。
原子核内的中子显电中性,质子带有正电荷。
对电子的描述需要四个量子数:主量子数n:决定原子中电子能量以及与核的平均距离。
角动量量子数l: 给出电子在同一个量子壳层内所处的能级,与电子运动的角动量有关。
磁量子数m:给出每个轨道角动量量子数的能级数或轨道数。
自旋角动量量子数s:反映电子不同的自旋方向。
原子排列对材料性能影响:固体材料根据原子的排列可分为两大类:晶体与非晶体。
(有无固定的熔点和体积突变)晶体:内部原子按某种特定的方式在三维空间呈周期性重复排列的固体。
(常考名词解释)非晶体:指组成物质的分子(或原子、离子)不呈空间有规则周期性排列的固体。
(名词解释)各向异性:晶体的各向异性即沿晶格的不同方向,原子排列的周期性和疏密程度不尽相同,由此导致晶体在不同方向的物理化学特性也不同,这就是晶体的各向异性。
(名词解释)2、材料中的结合键的类型、本质,各结合键对材料性能的影响,键-能曲线及其应用。
(常考简答题或是论述题,很重要)一次键离子键:离子键指正、负离子间通过静电作用形成的化学键。
(无方向性和饱和性)共价键:由两个或多个电负性相差不大的原子间通过共用电子对而形成的化学键。
(有方向性和饱和性)金属键:金属中的自由电子与金属正离子相互作用所构成的键合二次键范德瓦耳斯力:(又称分子间作用力)产生于分子或原子之间的静电相互作用。
氢键:与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的键,称为氢键。
(X与Y可以是同一种类原子,如水分子之间的氢键)各结合键对材料性能的影响:1.金属材料:金属材料的结合键主要是金属键。
由于自由电子的存在,当金属受到外加电场作用时,其内部的自由电子将沿电场方向作定向运动,形成电子流,所以金属具有良好的导电性;金属除依靠正离子的振动传递热能外,自由电子的运动也能传递热能,所以金属的导热性好;随着金属温度的升高,正离子的热振动加剧,使自由电子的定向运动阻力增加,电阻升高,所以金属具有正的电阻温度系数;当金属的两部分发生相对位移时,金属的正离子仍然保持金属键,所以具有良好的变形能力;自由电子可以吸收光的能量,因而金属不透明;而所吸收的能量在电子回复到原来状态时产生辐射,使金属具有光泽。
中南大学 材料科学基础 课后习题

第一章 原子排列与晶体结构1. fcc 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,把原子视为刚性球时,原子的半径r与点阵常数a 的关系是 ;bcc 结构的密排方向是 ,密排面是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 ;hcp 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,,晶胞中原子数为 ,原子的半径r 与点阵常数a的关系是 。
2. Al 的点阵常数为0.4049nm ,其结构原子体积是 ,每个晶胞中八面体间隙数为 ,四面体间隙数为 。
3. 纯铁冷却时在912e 发生同素异晶转变是从 结构转变为 结构,配位数 ,致密度降低 ,晶体体积 ,原子半径发生 。
4. 在面心立方晶胞中画出)(211晶面和]211[晶向,指出﹤110﹥中位于(111)平面上的方向。
在hcp 晶胞的(0001)面上标出)(0121晶面和]0121[晶向。
5. 求]111[和]120[两晶向所决定的晶面。
6 在铅的(100)平面上,1mm 2有多少原子?已知铅为fcc 面心立方结构,其原子半径R=0.175×10-6mm 。
第二章 合金相结构一、 填空1) 随着溶质浓度的增大,单相固溶体合金的强度 ,塑性 ,导电性 ,形成间隙固溶体时,固溶体的点阵常数 。
2) 影响置换固溶体溶解度大小的主要因素是(1) ;(2) ;(3) ;(4) 和环境因素。
3) 置换式固溶体的不均匀性主要表现为 和 。
4) 按照溶质原子进入溶剂点阵的位置区分,固溶体可分为 和 。
5) 无序固溶体转变为有序固溶体时,合金性能变化的一般规律是强度和硬度 ,塑性 ,导电性 。
6)间隙固溶体是 ,间隙化合物是 。
二、 问答1、 分析氢,氮,碳,硼在a-Fe 和g-Fe 中形成固溶体的类型,进入点阵中的位置和固溶度大小。
已知元素的原子半径如下:氢:0.046nm ,氮:0.071nm ,碳:0.077nm ,硼:0.091nm ,a-Fe :0.124nm ,g-Fe :0.126nm 。
材料科学基础试题及标准答案考研专用

一、名词:相图:表示合金系中的合金状态与温度、成分之间关系的图解。
匀晶转变:从液相结晶出单相固溶体的结晶过程。
平衡结晶:合金在极缓慢冷却条件下进行结晶的过程。
成分起伏:液相中成分、大小和位置不断变化着的微小体积。
异分结晶:结晶出的晶体与母相化学成分不同的结晶。
枝晶偏析:固溶体树枝状晶体枝干和枝间化学成分不同的现象。
共晶转变:在一定温度下,由—定成分的液相同时结晶出两个成分一定的固相的转变过程。
脱溶:由固溶体中析出另一个固相的过程,也称之为二次结晶。
包晶转变:在一定温度下,由一定成分的固相与一定成分的液相作用,形成另一个一定成分的固相的转变过程。
成分过冷:成分过冷:由液相成分变化而引起的过冷度。
二、简答:1. 固溶体合金结晶特点?答:异分结晶;需要一定的温度范围。
2. 晶内偏析程度与哪些因素有关?答:溶质平衡分配系数k0;溶质原子扩散能力;冷却速度。
3. 影响成分过冷的因素?答:合金成分;液相内温度梯度;凝固速度。
三、书后习题1、何谓相图?有何用途?答:相图:表示合金系中的合金状态与温度、成分之间关系的图解。
相图的作用:由相图可以知道各种成分的合金在不同温度下存在哪些相、各个相的成分及其相对含量。
2、什么是异分结晶?什么是分配系数?答:异分结晶:结晶出的晶体与母相化学成分不同的结晶。
分配系数:在一定温度下,固液两平衡相中溶质浓度之比值。
3、何谓晶内偏析?是如何形成的?影响因素有哪些?对金属性能有何影响,如何消除?答:晶内偏析:一个晶粒内部化学成分不均匀的现象形成过程:固溶体合金平衡结晶使前后从液相中结晶出的固相成分不同,实际生产中,液态合金冷却速度较大,在一定温度下扩散过程尚未进行完全时温度就继续下降,使每个晶粒内部的化学成分布均匀,先结晶的含高熔点组元较多,后结晶的含低熔点组元较多,在晶粒内部存在着浓度差。
影响因素:1)分配系数k0:当k0<1时,k0值越小,则偏析越大;当k0>1时,k0越大,偏析也越大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
节
无机非金属材料 耐火材料
原
陶瓷:传统陶瓷、特种陶瓷
子
树脂基 颗粒增强
结
复合材料 金属基 纤维增强 陶瓷基 晶须增强
合
编织结构增强
方
新型材料与功能材料
式 2
第
一 章
第一章 工程材料中的原子排列
硅表面原子排列
碳表面原子排列
18h
3
第 一 节 原 子 结 合 方 式
4
第一节 原子的结合方式
© 2003 Brooks/Cole Publishing / Thomson Learning™ © 2003 Brooks/Cole Publishing / Thomson Learning™
列 14
第
一 章
第二节 原子的规则排列
3 布拉菲点阵 14种点阵分属7个晶系。
第 二 节 原 子 规 则 排 列
15
第
一 章
第二节 原子的规则排列
4 晶向指数与晶面指数
晶向:空间点阵中各阵点列的方向。
晶面:通过空间点阵中任意一组阵点的平面。
第
二
国际上通用米勒指数标定晶向和晶面。
节
原
子
规
则
排
列 16
第
大、导电性差。
© 2003 Brooks/Cole Publishing / Thomson Learning™ © 2003 Brooks/Cole Publishing / Thomson Learning™
一
节
原
子
结
合
方
式 6
第
一 章
第一节 原子的结合方式
(3)金属键与金属晶体
金属元素失去最外层电子,形成正离子,电子围绕
原
子
结
合
方
式
© 2003 Brooks/Cole Publishing / Thomson
Learning™
10
第
一 章
第一节 原子的结合方式
(4)分子键与分子晶体
氢键:(离子结合)X-H---Y(氢键结合),有方向性, 如O-H—O
第 一 节 原 子 结 合 方 式
© 2003 Brooks/Cole Publishing /
节
原
子
结
合
方 式
© 2003 Brooks/Cole Publishing / Thomson Learning™
5
第 第一节 原子的结合方式
一
章
(2)共价键与原子晶体
两个相邻原子共用一对电子,形成稳定的共价键。
原子结合:电子共用,结合力大,有方向性和饱和性;
原子晶体:强度高、硬度高(金刚石)、熔点高、脆性
第
一 章
第二节 原子的规则排列
(1)晶向指数的标定
[uvw]
第
二
节
原
子
规
则
排
列
2h 17
第
一 章
第二节 原子的规则排列
说明:
a 指数意义:代表相互平行、方向一致的所有晶向。
第
b 负值:标于数字上方,表示同一晶向的相反方向。
二
c 晶向族:晶体中原子排列情况相同但空间位向不同的一组晶向。
节 用<uvw>表示,数字相同,但排列顺序不同或正负号不同的晶向
结
程无序,各向同性。
合
方
式 12
第
一 章
第二节 原子的规则排列
一 晶体学基础
1 空间点阵与晶体结构
(1)空间点阵:由几何点做周期性的规则排列所形成的三维阵列。
第
特征:a 原子的理想排列;b 有14种。其中:
二
阵点-空间点阵中的点。它是纯粹的几何点,各点周围环境相同。
节 晶格-描述晶体中原子排列规律的空间格架。
1 原子结构
一 章
第
第 一
第一节 原子的结合方式
章
2 原子结合键
(1)离子键与离子晶体
正电性元素和负电性元素接触时,前者失去最外层电子成为正 离子,而后者得到电子成为满壳层负离子,正离子和负离子静电吸 引和排斥形成稳定的离子键。
第
原子结合:电子转移,结合力大,无方向性和饱和性;
一
离子晶体;硬度高,脆性大,熔点高、导电性差。如氧化物陶瓷。
Thomson Learning™
11
第
一 章
第一节 原子的结合方式
3 结合键分类
(1)一次键 (化学键):金属键、共价键、离子键。
(2)二次键 (物理键):分子键和氢键。
第
4 原子的排列方式
一 节 原
(1)晶体:原子在三维空间内的周期性规则排列。长 程有序,各向异性。
子
(2)非晶体:――――――――――不规则排列。长
9
© 2003 Brooks/Cole Publishing / Thomson Learning™
第
一 章
第一节 原子的结合方式
(4)分子键与分子晶体
大分子中带正电的部分与另一分子带负电的部分形成教 弱的静电吸引力,形成分子键.
第 一
原子结合:电子云偏移,结合力很小,无方向性和饱和 性。
节
分子晶体:熔点低,硬度低。如高分子材料。
第
一 章
第一章 工程材料中的原子排列
本章要点
1认识材料的类别,金属、聚合物和陶瓷及其 分类的基础,复习原子结构的特性
2建立单位晶胞的概念,了解原子排列和堆积 3熟悉常见晶体中原子的规则排列形式 4掌握晶向、晶面指数的标定方法 5认识晶体缺陷的基本类型、基本特征、基本 性质
1
第 材料的种类
一
章
黑色金属 钢:碳钢、合金钢、特殊性能钢等
节
c 具有尽可能多的直角;
原
d 体积最小。
子
(3)形状和大小
规 则
有三个棱边的长度a,b,c及其夹角α,β,γ表示。
Smith W F. Foundations of Materials Science and Engineering. McGRAW.HILL.3/E
排
(4)晶胞中点的位置表示(坐标法)。
正离子形成自由电子云,依靠正离子与构成电子气的自
由电子之间的静电引力而使诸原子结合到一起的方式形
第
成金属键.
一
节 原
原子结合:电子逸出共有,结合力较大,无方向性和饱 和性;
子
金属晶体:导电性、导热性、延展性好,熔点较高。如
结
金属。
合
方
式 7
8
© 2003 Brooks/Cole Publishing / Thomson Learning™
金属材料
铸铁:灰铸铁、球墨铸铁、可锻铸铁、蠕墨铸铁等
有色金属 铜及其合金:纯铜、黄铜、青铜、白铜
铝及其合金:纯铝、形变铝合金、铸造铝合金
其 它:轴承合金、镁合金、钛合金、镍合金
纤维:天然纤维、合成纤维
高分子材料 橡胶:通用橡胶、特种橡胶
第
塑料:通用塑料、工程塑料、特种塑料、粘胶剂
一
工程材料
水泥 玻璃
原 晶胞-空间点阵中最小的几何单元。
子 规
(2)晶体结构:原子、离子或
则
原子团按照空间点阵的实际排列。
排
特征:a 可能存在局部缺陷;
列
b 可有无限多种。
13
第
一 章
第二节 原子的规则排列
2 晶胞
(1)晶胞:构成空间点阵的最基本单元。
(2)选取原则:
a 能够充分反映空间点阵的对称性;
第 二
b 相等的棱和角的数目最多;
