常用pH缓冲液 缓冲液缓冲范围
常用缓冲液的配置

(一)甘氨酸-盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCl,再加水稀释至200毫升。
甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾+Y毫升0.2 mol/L HCl,再加水稀释至20毫升。
邻苯二甲酸氢钾分子量=204.23。
0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
(三)磷酸氢二钠-柠檬酸缓冲液Na 2HPO 4分子量=141.98;0.2 mol/L 溶液为28.40 g/L 。
Na 2HPO 4·2H 2O 分子量=178.05;0.2 mol/L 溶液为35.61 g/L 。
Na 2HPO 4·12H 2O 分子量=358.22;0.2 mol/L 溶液为71.64 g/L 。
C 6H 8O 7·H 2O 分子量=210.14;0.1 mol/L 溶液为21.01 g/L 。
(四)柠檬酸-氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克酚,若最后pH 值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
(五)柠檬酸-柠檬酸钠缓冲液(0.1 mol/L )柠檬酸:C 6H 8O 7·H 2O 分子量=210.14 ;0.1 mol/L 溶液为21.01 g/L 。
柠檬酸钠:Na 3C 6H 5O 7·2H 2O 分子量=294.12 ;0.1 mol/L 溶液为29.41 g/L 。
(六)醋酸-醋酸钠缓冲液(0.2 mol/L ) NaAc ·3H 2O 分子量=136.09;0.2 mol/L 溶液为27.22 g/L 。
冰乙酸11.8 mL 稀释至1 L (需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)X 毫升 0.2 mol/L KH2PO4+Y毫升0.2 mol/L NaOH 加水稀释至20毫升。
最全常用缓冲液配方及缓冲范围

最全常用缓冲液配方及缓冲范围缓冲液是一种能够维持溶液pH值相对稳定的溶液。
它可以减少酸碱反应的影响,使物质在酸碱环境中保持稳定。
在生命科学实验室和工业生产中,常用的缓冲液有许多种。
下面是最常用的一些缓冲液配方及其缓冲范围。
1. Phosphate缓冲液:Phosphate缓冲液通常由磷酸二氢盐和磷酸氢二盐组成。
它的pH范围为2.1-7.4,在生物化学和细胞生物学实验中得到广泛应用。
配方1:-0.1M磷酸二氢盐,pH2.0-2.8-0.2M磷酸氢二盐,pH5.8-7.4配方2:-0.1M磷酸二氢盐,pH2.1-3.1-0.2M磷酸氢二盐,pH5.6-7.42. Tris缓冲液:Tris缓冲液由三羟甲基氨基甲烷(Tris)和其酸盐组成。
它的pH范围为7-9,在分子生物学和生化实验中广泛使用。
配方:- 1 M Tris HCl,pH 7.4-9.0- 1 M Tris base,pH 7.0-9.23.MES缓冲液:MES缓冲液是一种针对中性pH值(5.5-6.7)的缓冲液,常用于细胞生物学和酶活性实验。
配方:-0.1MMES,pH5.5-6.74.HEPES缓冲液:HEPES缓冲液是一种适用于细胞培养和酶活性实验的缓冲液,其pH 范围为6.8-8.2配方:-0.1MHEPES,pH6.8-8.25.CAPS缓冲液:CAPS缓冲液是一种适用于生化实验的缓冲液,其pH范围为9.7-11.1配方:-0.1MCAPS,pH9.7-11.1这些是最常用的缓冲液配方及其缓冲范围,可以根据实验的需要选择合适的缓冲液。
需要注意的是,在配制缓冲液时应使用高纯度的化学品,并根据实验要求精确控制缓冲液的pH值。
此外,在实验过程中应注意缓冲液的保存和稳定性,以确保实验结果的准确性。
常用缓冲体系缓冲能力

缓冲体系的缓冲能力是指其抵抗pH变化的能力,即在加入酸或碱后,能够保持溶液pH相对稳定的性质。
缓冲体系的缓冲能力受到多种因素的影响,包括缓冲对的浓度、解离常数以及溶液的离子强度等。
在生物化学和分子生物学实验中,常用的缓冲体系包括磷酸盐缓冲液(PBS)、Tris-HCl缓冲液、HEPES缓冲液等。
这些缓冲体系具有不同的缓冲范围和缓冲能力,适用于不同的实验条件和需求。
磷酸盐缓冲液(PBS)是一种常用的缓冲体系,其缓冲范围在pH 6.8-7.8之间。
PBS的缓冲能力主要来自于其组分中的磷酸氢二钠和磷酸二氢钾,这两种物质在水中可以解离出氢离子和氢氧根离子,从而起到缓冲作用。
PBS的缓冲能力相对较强,适用于大多数生物化学和分子生物学实验。
Tris-HCl缓冲液的缓冲范围在pH 7.0-9.0之间,其缓冲能力主要来自于Tris 分子中的氨基和羧基。
Tris-HCl缓冲液的缓冲能力较强,且对温度和离子强度的变化不太敏感,因此在许多生物化学和分子生物学实验中也得到广泛应用。
HEPES缓冲液的缓冲范围在pH 6.8-8.2之间,其缓冲能力主要来自于HEPES分子中的磺酸基和氨基。
HEPES缓冲液具有较好的缓冲能力和稳定性,适用于需要较长时间保持pH稳定的实验,如细胞培养和酶学反应等。
总的来说,不同缓冲体系的缓冲能力因其组分和浓度不同而有所差异。
在选择缓冲体系时,需要根据实验条件和需求来选择具有适当缓冲范围和缓冲能力的缓冲液。
同时,还需要注意缓冲液的离子强度、温度敏感性等因素对实验结果的影响。
ph计标定时所用的第二个标准缓冲溶液

ph计标定时所用的第二个标准缓冲溶液pH计标定是取得准确测试结果的前置工作。
在标定过程中,需要用到至少两种标准缓冲溶液,一种是7.00 pH的标准缓冲液,另一种则可以不同于7.00 pH的标准缓冲液。
在此,我们将详细介绍第二种缓冲液的选用、制备以及使用。
在选择第二个标准缓冲溶液时,需要先确定待测样品所处的pH范围。
通常情况下,每种pH计都有自己所对应的pH值范围。
在这个范围内,第二个标准缓冲液需要具有反应快、稳定性好、精度高的特点。
常用的第二个标准缓冲液有:1. 4.01 pH标准缓冲液:适合用于检测酸性物质需要注意的是,在使用不同类型的缓冲液时,需要对pH计进行重新校准,确保获得准确的测试结果。
制备第二个标准缓冲液需要用到相应的化学品。
在使用化学品时需要注意安全,保护好口鼻和眼睛,避免吸入和接触。
(1)准备化学品:0.05mol/L柠檬酸钠盐(Na2C6H5O7)及0.05mol/L苯酚红溶液(2)将50mL柠檬酸钠盐溶液倒入250mL烧瓶中,并加入2~3滴苯酚红指示剂(3)用0.1mol/L的硝酸钠溶液慢慢滴加至溶液刚好变成红色,即制备完成。
2. 制备9.18 pH标准缓冲液:(3)用去离子水加满烧瓶,制备完成。
在制备过程中,需要注意化学品的选用、精确称量和操作过程中的安全保护。
制备完成后,将标准缓冲液保存在有盖的玻璃瓶中,置于阴凉干燥处,避免阳光直射。
在使用第二个标准缓冲液时,需要先将pH计插入待测液体中,调整电极与液体接触,使其达到浸没全电极的水平,然后等待pH计读数稳定。
稳定后,将pH计重新校准,选择对应的第二个标准缓冲液进行标定。
将pH计插入4.01 pH标准缓冲液中,等待读数稳定。
若读数不为4.01 pH,则按照仪器说明书所示,调整pH计。
在使用过程中,需要定期校准pH计,保证测试结果的准确性。
同时,需要及时更换标准缓冲液,避免其过期或受污染,影响测试结果。
常用缓冲液配方及缓冲范围

常用缓冲液配方及缓冲范围缓冲液是一种水溶液,其中含有在酸性或碱性条件下能够保持pH稳定的化学物质。
缓冲液广泛应用于生物化学、分子生物学、生物技术和医学等领域的实验和研究中。
下面是一些常用的缓冲液配方及其应用范围。
1. Tris缓冲液Tris缓冲液是一种中性缓冲液,常用于生物化学和分子生物学实验。
它的配方通常为:- 10 mM Tris base-1mMEDTA-向溶剂中调整pH至7.4Tris缓冲液可用于DNA和RNA的电泳、酶反应、细胞培养等实验中。
2.PBS缓冲液PBS(磷酸盐缓冲液)是一种常用的生物学缓冲液,具有缓冲能力强和与生物体液成分相似的特点。
它的配方通常为:-137mMNaCl-2.7mMKCl-10mMNa2HPO4-2mMKH2PO4-向溶剂中调整pH至7.4PBS缓冲液可用于细胞培养、免疫荧光染色、蛋白质凝胶电泳等实验中。
3.TAE缓冲液TAE(三乙酸缓冲液)是一种常用的核酸电泳缓冲液,其配方为:- 40 mM Tris base-20mM醋酸-1mMEDTA-向溶剂中调整pH至8.0TAE缓冲液可用于DNA和RNA的琼脂糖凝胶电泳,如聚丙烯酰胺凝胶电泳()和琼脂糖凝胶电泳(agarose gel electrophoresis)。
4. Tris-HCl缓冲液Tris-HCl缓冲液是一种常用的酸性或碱性缓冲液。
它的配方基于Tris缓冲液,在Tris缓冲液基础上调整pH的方法是在配方中加入稀盐酸或稀氢氧化钠。
例如,对于Tris-HCl缓冲液的配方为:- 50 mM Tris base-向溶剂中加入HCl调整pH至所需的值(通常为7.2至9.0)Tris-HCl缓冲液可用于酶反应、蛋白质组学研究、PCR等实验中。
这只是一些常用的缓冲液配方,根据不同实验需求和物质稀释要求,还有其他许多缓冲液的配方。
对于缓冲液的选择,关键在于根据实验要求选取适当的缓冲体系,并对缓冲液中所需的化学物质浓度、pH值等进行精确调整。
生物化学常用缓冲液

生物化学常用缓冲液⑴ 磷酸盐缓冲液磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由於它们是二级解离,有二个pKa值,所以用它们配制的缓冲液,pH范围最宽:NaH2PO4: pKa1=2.12, pKa2=7.21Na2HPO4: pKa1=7.21, pKa2=12.32配酸性缓冲液:用 NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用 Na2HPO4,pH=10~12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH 范围宽;③pH受温度的影响小;④缓冲液稀释后pH变化小,如稀释十倍后pH的变化小于0.1。
其缺点为:①易与常见的钙Ca++离子、镁Mg++离子以及重金属离子缔合生成沉淀;②会抑制某些生物化学过程,如对某些酶的催化作用会产生某种程度的抑制作用。
⑵Tris(三羟甲基氨基甲烷,N-Tris(hydroxymethyl)aminomethane)缓冲液Tris缓冲液在生物化学研究中使用的越来越多,有超过磷酸盐缓冲液的趋势,如在SDS-聚丙烯酰胺凝胶电泳中已都使用Tris缓冲液,而很少再用磷酸盐。
Tris缓冲液的常用有效pH范围是在“中性”范围,例如:Tris-HCl缓冲液: pH=7.5~8.5Tris-磷酸盐缓冲液: pH=5.0~9.0配制常用的缓冲液的方法有两种:①按书后附录中所列该缓冲液表中的方法,分别配制0.05mol/L Tris和0.05mol/L HCl溶液,然后按表中所列体积混合。
由于标准浓度的稀盐酸不易配制,所以常用另一种方法;②若配1L0.1mol/L的Tris-HCl缓冲液:先称12.11g Tris碱溶于950mL~970mL 无离子水中,边搅拌边滴加4N HCl,用pH计测定溶液pH值至所需的pH值,然后再加水补足到1L。
pH缓冲溶液

缓冲溶液的选择
缓冲溶液的选择
为了保证缓冲溶液有足够强的缓冲能
力,在配制缓冲溶液时,需要做到:
使共轭酸碱对的浓度比接近于1,应根
01
据所需要维持的pH范围选择合适的缓
冲对,使其中的弱酸的pKa等于或接
近于所要求的pH。
缓冲溶液的选择
例如,生物培养液中需用pH=7.0的
缓冲溶液,已知H2PO4-的
02
不少缓冲溶液都含有易挥发组分,如,
氨-氯化铵中的氨酷1
缓冲溶液的调节
不能用强酸或强碱进行调节,否则会
破坏缓冲体系。
03
缓冲溶液的使用
使用时要慎重地选择缓冲体系,避免
缓冲液中的某种离子在使用时产生不
02
需要的化学反应。
谢谢
pKa2=7.21,因此,H2PO4-—
HPO42-是可以选择的合适的缓冲对。
如若配制pH=9.0的缓冲溶液,则可
选择NH3·H2O-NH4Cl缓冲对(pKa (NH4+)=9.25)。可见弱酸的pKa 是选择缓冲溶液的主要依据,表中列
出了几种常用的缓冲溶液。
常见缓冲液组成
缓冲溶液的注意事项
缓冲溶液的存放
PBS缓冲液
缓冲液原理
1、水合氢离子的浓度取决于弱酸与其共轭碱的浓度比。
2、当加入少量强碱时,酸被中和,导致了氢氧根离子在溶液中很少累积,从而C(A-) 的浓度增加, C(HA)的浓 度减少。因为二者的浓度较大,相对的变化小,两者比值几乎无变化,因此根据公式,水合氢离子的浓度变化很小。 3、加入弱酸则是同样的道理。由于在大浓度基数上的微小变化不会改变比值,也因此维持了体系内氢离子和氢氧根离 子浓度的平衡。
缓冲溶液
什么是缓冲溶液?
醋酸缓冲液的缓冲范围

醋酸缓冲液的缓冲范围一、引言醋酸缓冲液是一种常见的缓冲液,在生物化学实验中广泛应用。
它的缓冲机理是通过醋酸和其共轭碱性物质乙酸根离子(Ac-)之间的平衡反应来维持pH值的稳定。
本文将探讨醋酸缓冲液的缓冲范围。
二、理论基础在生物化学实验中,细胞内外环境对pH值的要求非常严格。
许多生化反应都需要特定的pH值才能正常进行。
因此,为了保持实验条件的稳定性和可重复性,需要使用缓冲剂来调节溶液的pH值。
醋酸缓冲液是一种弱酸弱碱缓冲剂,其化学式为CH3COOH/CH3COO-。
在水中溶解时,它会分解成相应的离子,并达到平衡状态:CH3COOH + H2O ⇌ H3O+ + CH3COO-该反应可以看作是一个弱酸(CH3COOH)和其共轭碱性物质(CH3COO-)之间的平衡反应。
当溶液中加入酸性或碱性物质时,这个平衡反应会重新分配离子,从而维持溶液的pH值稳定不变。
三、缓冲范围醋酸缓冲液的缓冲范围是指它可以有效维持pH值稳定的范围。
具体来说,缓冲范围可以通过醋酸和其共轭碱性物质之间的离子化程度来描述。
在一般情况下,醋酸缓冲液的最适pH值为4.76。
在这个pH值下,醋酸和其共轭碱性物质之间的浓度比为1:1。
当溶液中加入少量强酸或强碱时,会导致平衡反应向右或向左移动,从而使溶液的pH值发生变化。
但是,在一定范围内,这种变化是可控制的,并且可以通过加入适量的醋酸或乙酸钠来调节。
具体来说,在缓冲液中加入强碱时,会使CH3COOH转化为CH3COO-,从而使平衡反应向左移动。
这会导致CH3COOH和CH3COO-之间的浓度比发生变化,并且pH值会升高。
同样地,在缓冲液中加入强酸时,会使CH3COO-转化为CH3COOH,从而使平衡反应向右移动。
这会导致CH3COOH和CH3COO-之间的浓度比发生变化,并且pH值会降低。
在实际应用中,醋酸缓冲液的缓冲范围通常在pH 4.0-6.0之间。
这个范围可以通过调整醋酸和乙酸钠的浓度比例来实现。
ph标准缓冲液购买

ph标准缓冲液购买在生物化学实验中,常常需要使用ph标准缓冲液来调节溶液的酸碱度,以维持实验环境的稳定。
ph标准缓冲液的选择对实验结果具有重要影响,因此购买适合的ph标准缓冲液至关重要。
本文将介绍ph标准缓冲液的选择和购买注意事项,帮助您在实验中获得准确可靠的结果。
首先,选择ph标准缓冲液时需考虑实验需要的ph范围。
不同的实验可能需要不同ph值的缓冲液,因此在购买前需要明确实验所需的ph范围。
一般来说,实验室常用的ph标准缓冲液包括ph 4.01、ph 7.00和ph 10.01三种,可以满足大部分生物化学实验的需求。
如果实验需要其他ph值的缓冲液,也可以根据具体需求进行定制购买。
其次,选择ph标准缓冲液时需要考虑其稳定性和准确性。
优质的ph标准缓冲液应具有稳定的ph值和高度准确的浓度,以确保实验结果的可靠性。
在购买时,建议选择知名品牌的产品,或者通过查阅相关资料和用户评价来了解产品的质量和性能。
另外,注意检查产品的保质期和储存条件,避免购买过期或受损的产品影响实验结果。
另外,购买ph标准缓冲液时还需要考虑其包装规格和价格。
根据实验的频率和规模,选择适合的包装规格以避免浪费和过期。
一般来说,ph标准缓冲液的包装规格有100ml、500ml、1L等多种选择,可以根据实验需要进行购买。
此外,也需要考虑产品的价格和性价比,选择质量好、价格合理的产品。
最后,建议在正规渠道购买ph标准缓冲液,避免购买假冒伪劣产品。
可以选择生物试剂公司、实验室耗材供应商或者正规的网上商城进行购买,确保产品的质量和售后服务。
在购买前,可以咨询相关专业人士或者参考用户评价,选择信誉良好的供应商和产品。
总之,选择和购买适合的ph标准缓冲液对于生物化学实验至关重要。
在购买前需要明确实验所需的ph范围,选择稳定准确的产品,考虑包装规格和价格,并选择正规渠道购买,以确保实验结果的准确性和可靠性。
希望本文的介绍能够帮助您在实验中选择和购买合适的ph标准缓冲液,获得满意的实验结果。
各种缓冲液配制方法

各种缓冲液配制方法缓冲液是一种用于调节溶液的pH值的溶液,常用于实验室中的生物化学和分子生物学实验中。
根据所需的pH范围和实验目的,可以使用不同的缓冲液配制方法。
以下是一些常见的缓冲液配制方法:1.磷酸盐缓冲液(PBS)磷酸盐缓冲液是一种常见的生物学实验中使用的缓冲液。
它的制备方法如下:-取一个容器,加入8克氯化钠(NaCl),0.2克磷酸二氢钠(NaH2PO4),和1.44克磷酸氢二钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
2. Tris缓冲液Tris缓冲液适用于pH 7-9范围内的实验。
制备方法如下:- 取一个容器,加入121.14克Tris(羟甲基氨基甲烷)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
3.醋酸盐缓冲液醋酸盐缓冲液适用于pH3-5范围内的实验。
制备方法如下:-取一个容器,加入20毫升醋酸钠三水合物(NaC2H3O2·3H2O)。
-加入6毫升醋酸。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
4.磷酸缓冲液磷酸缓冲液适用于pH2-8范围内的实验。
制备方法如下:-取一个容器,加入0.126克磷酸二氢钾(KH2PO4)。
-加入0.680克磷酸二氢钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
5.碳酸氢盐缓冲液(HEPES缓冲液)HEPES缓冲液适用于pH6-8范围内的实验。
-取一个容器,加入10克HEPES。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
各种缓冲液配制方法

各种缓冲液配制方法不同缓冲液的缓冲范围pH缓冲液是化学实验室中常用的一种试剂,可以帮助维持溶液的酸碱度。
下面介绍三种常用缓冲液的配制方法和缓冲范围。
一、甘氨酸-盐酸缓冲液(0.05 mol/L)配制方法:取X毫升0.2 mol/L甘氨酸和Y毫升0.2 mol/L 盐酸,加入适量的水稀释至200毫升。
缓冲范围:pH值在2.2至3.6之间,X和Y的取值见上表。
二、邻苯二甲酸-盐酸缓冲液(0.05 mol/L)配制方法:取X毫升0.2 mol/L邻苯二甲酸氢钾和Y毫升0.2 mol/L盐酸,加入适量的水稀释至20毫升。
缓冲范围:pH值在2.2至3.8之间,X和Y的取值见上表。
三、磷酸氢二钠-柠檬酸缓冲液配制方法:根据上表中的数据,取相应的0.2 mol/L和0.1 mol/L的Na2HPO4和柠檬酸,加入适量的水稀释至20毫升。
缓冲范围:pH值在2.2至8.0之间,具体取值见上表。
以上缓冲液的配制方法和缓冲范围可根据实验需要进行调整和改变。
在实验过程中,正确选择缓冲液可以提高实验的成功率和准确性。
以下是已经修改好的文章:柠檬酸的浓度可以用毫升表示,其浓度数据如下:9.28 mL8.85 mL8.40 mL7.91 mL7.37 mL6.78 mL6.15 mL5.45 mL4.55 mL3.53 mL2.61 mL1.83 mL1.27 mL0.85 mL0.55 mL对于Na2HPO4,其分子量为141.98,0.2 mol/L的溶液需要28.40 g/L。
而Na2HPO4·2H2O的分子量为178.05,0.2 mol/L的溶液需要35.61 g/L。
最后,Na2HPO4·12H2O的分子量为358.22,0.2 mol/L的溶液需要71.64 g/L。
对于C6H8O7·H2O,其分子量为210.14,0.1 mol/L的溶液需要21.01 g/L。
以下是柠檬酸-氢氧化钠-盐酸缓冲液的相关数据:pH: 2.2.3.1.3.3.4.3.5.3.5.8.6.5钠离子浓度(mol/L): 0.20.0.20.0.20.0.20.0.35.0.45.0.38柠檬酸(g) 氢氧化钠(g) 盐酸(mL)C6H8O7·H2O NaOH 97% HCl (浓)210 210 210210 245 285266 84 8383 144 186156 160 116106 45 68105 126最终体积(L):10使用时可以每升中加入1克酚。
缓冲液缓冲范围

常见缓冲液的缓冲范围缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES (2吗啉代乙磺酸) 5.5-6.7 195.2Bis-Tris 5.8-7.2 209.2HEPES 6.8-8.2 238.3PIPES 6.1-7.5 302.4MOPS 6.5-7.9 209.3Tricine 7.4-8.8 179.2TEA (三乙醇胺) 7.4-8.3 149.2甘氨酸-盐酸缓冲液(0.05mol/L) 2.2-5.0 甘氨酸Mr=75.07邻苯二甲酸-盐酸缓冲液(0.05mol/L) 2.2-3.8 邻苯二甲酸氢钾Mr=204.23磷酸氢二钠-柠檬酸缓冲液 2.2-8.0 磷酸氢二钠Mr=141.98柠檬酸-氢氧化钠-盐酸缓冲液 2.2-6.5 柠檬酸Mr=192.06柠檬酸-柠檬酸钠缓冲液(0.1mol/L) 3.0-6.6 柠檬酸Mr=192.06 柠檬酸钠Mr=257.96乙酸-乙酸钠缓冲液(0.2mol/L) 3.6-5.8 乙酸钠Mr=81.76 乙酸Mr=60.05邻苯二甲酸氢钾-氢氧化钠缓冲液 4.1-5.9 邻苯二甲酸氢钾Mr=204.23磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L) 5.8-8.0磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL) 4.92-8.18磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L) 5.8-8.0巴比妥钠-盐酸缓冲液(18℃) 6.8-9.6 巴比妥钠Mr=206.18 Tris-盐酸缓冲液(0.05mol/L 25℃) 7.10-9.00 三羟甲基氨基甲烷(Tris)Mr=121.14甘氨酸-氢氧化钠缓冲液(0.05mol/L) 8.6-10.6 甘氨酸Mr=75.07硼砂-氢氧化钠缓冲液(0.05mol/L) 9.3-10.1 硼砂Na2B4O7?10H2O Mr=381.43碳酸钠-碳酸氢钠缓冲液(0.1mol/L) 9.16-10.83 碳酸钠Mr=286.2 碳酸氢钠Mr=84.0碳酸钠-氢氧化钠缓冲液(0.025mol/L) 9.6-11.0磷酸氢二钠-氢氧化钠缓冲液 10.9-12.0氯化钾-盐酸缓冲液(0.2mol/L) 1.0-2.2 氯化钾Mr=74.55氯化钾-氢氧化钠缓冲液(0.2mol/L)12.0-13.0 氯化钾Mr=74.55。
pbs缓冲范围

pbs缓冲范围PBS(Phosphate-buffered saline)缓冲范围是一种常用的生物化学缓冲液,它在生物学研究和临床实验中起着重要的作用。
本文将从不同角度介绍PBS缓冲范围的应用和意义,以及其在实验中的注意事项。
一、PBS缓冲范围的概述PBS是一种含磷的盐溶液,主要由磷酸盐、氯化钠和氯化钾组成。
它的pH值通常在7.2-7.4之间,与生理盐水的pH值相似。
PBS具有良好的缓冲能力,能够维持生物体内细胞和组织的正常酸碱平衡。
因此,它被广泛用于细胞培养、细胞冻存、蛋白质和核酸的提取、免疫染色等实验中。
二、PBS缓冲范围的应用1. 细胞培养在细胞培养中,PBS被用于洗涤细胞,以去除培养基中的残留物和细胞分泌物。
同时,PBS也可以用作稀释细胞培养基或蛋白质溶液,以达到所需的浓度。
2. 细胞冻存在细胞冻存过程中,PBS被用作细胞的冻存液。
其缓冲能力可以保护细胞免受冷冻和解冻过程中的损伤。
此外,PBS还可以与冷冻保护剂一起使用,提高细胞的冷冻保存效果。
3. 蛋白质和核酸的提取在蛋白质和核酸提取实验中,PBS被用作细胞或组织的裂解缓冲液。
它能够维持细胞或组织的生理状态,并保持其中的蛋白质和核酸的稳定性。
此外,PBS还可以用于洗涤蛋白质和核酸的沉淀物,以去除杂质。
4. 免疫染色在免疫染色实验中,PBS被用作抗体和抗原的稀释缓冲液。
它能够维持抗体和抗原的稳定性,并提供适当的离子环境,以促进抗体和抗原的结合。
三、PBS缓冲范围的注意事项1. 在准备PBS缓冲液时,应严格按照配方比例混合各种成分。
过高或过低的浓度都会影响其缓冲能力。
2. 在实验过程中,应避免PBS缓冲液的污染。
使用无菌技术操作,并在实验前对PBS进行灭菌处理。
3. 在保存PBS缓冲液时,应避免阳光直射和高温环境,以防止其pH值的变化。
4. 在使用PBS洗涤细胞或组织时,应注意洗涤的时间和次数。
过长或过多的洗涤会导致细胞或组织的损伤。
5. 在免疫染色实验中,应根据实验需求调整PBS的pH值和离子浓度,以提高抗体和抗原的结合效率。
常用缓冲液配方

常见缓冲液的缓冲范围缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES (2吗啉代乙磺酸) 5.5-6.7 195.2Bis-Tris 5.8-7.2 209.2HEPES 6.8-8.2 238.3PIPES 6.1-7.5 302.4MOPS 6.5-7.9 209.3Tricine 7.4-8.8 179.2TEA (三乙醇胺) 7.4-8.3 149.2甘氨酸-盐酸缓冲液(0.05mol/L) 2.2-5.0 甘氨酸Mr=75.07邻苯二甲酸-盐酸缓冲液(0.05mol/L)2.2-3.8 邻苯二甲酸氢钾Mr=204.23 磷酸氢二钠-柠檬酸缓冲液 2.2-8.0 磷酸氢二钠Mr=141.98柠檬酸-氢氧化钠-盐酸缓冲液 2.2-6.5 柠檬酸Mr=192.06柠檬酸-柠檬酸钠缓冲液(0.1mol/L)3.0-6.6 柠檬酸Mr=192.06 柠檬酸钠Mr=257.96 乙酸-乙酸钠缓冲液(0.2mol/L) 3.6-5.8 乙酸钠Mr=81.76 乙酸Mr=60.05 邻苯二甲酸氢钾-氢氧化钠缓冲液 4.1-5.9 氢钾Mr=204.23磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L) 5.8-8.0磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL) 4.92-8.18磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L) 5.8-8.0巴比妥钠-盐酸缓冲液(18℃) 6.8-9.6 巴比妥钠Mr=206.18 Tris-盐酸缓冲液(0.05mol/L 25℃) 7.10-9.00 三羟甲基氨基甲烷(Tris)Mr=121.14 甘氨酸-氢氧化钠缓冲液(0.05mol/L) 8.6-10.6 甘氨酸Mr=75.07硼砂-氢氧化钠缓冲液(0.05mol/L) 9.3-10.1 硼砂Na2B4O7?10H2O Mr=381.43 碳酸钠-碳酸氢钠缓冲液(0.1mol/L) 9.16-10.83 碳酸钠Mr=286.2 碳酸氢钠Mr=84.0 碳酸钠-氢氧化钠缓冲液(0.025mol/L) 9.6-11.0磷酸氢二钠-氢氧化钠缓冲液10.9-12.0氯化钾-盐酸缓冲液(0.2mol/L) 1.0-2.2 氯化钾Mr=74.55氯化钾-氢氧化钠缓冲液(0.2mol/L)12.0-13.0 氯化钾Mr=74.55参考下图:常见缓冲液的缓冲范围参考下图:常见缓冲液的缓冲范围常用缓冲液的配制方法1.甘氨酸-盐酸缓冲液(0.05M)X ml 0.2M甘氨酸+Y ml 0.2M盐酸再加水稀释至200mlpH X/ml Y/ml pH X/ml Y/ml2.2 50 44.03.0 50 11.42.4 50 32.43.2 50 8.22.6 50 24.23.4 50 6.42.8 50 16.83.6 50 5.0甘氨酸分子量=75.07 0.2M甘氨酸溶液含15.01g/L2.邻苯二甲酸-盐酸缓冲液(0.05M)X ml 0.2M邻苯二甲酸氢钾+Y ml 0.2M盐酸再加水稀释至200mlpH X Y pH X Y2.2 5 4.6703.2 5 1.4702.4 53.960 3.4 5 0.9902.6 53.295 3.6 5 0.5972.8 5 2.6423.8 5 0.2633.0 5 2.032邻苯二甲酸氢钾分子量=2.4.23 0.2M邻苯二甲酸氢钾溶液含40.85g/L3.磷酸氢二钠-柠檬酸缓冲液pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml 2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L4.柠檬酸-氢氧化钠-盐酸缓冲液pH 钠离子浓度/M 柠檬酸C6H8O7·H2O/g 氢氧化钠NaOH/g 浓盐酸HCl/ml 终体积/L2.2 0.20 210 84 160 103.1 0.20 210 83 116 103.3 0.20 210 83 106 104.3 0.20 210 83 45 105.3 0.35 245 144 68 105.8 0.45 285 186 105 106.5 0.38 266 156 126 10使用时可以每升中加入1g酚,若最后pH有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
最全常用缓冲液配方及缓冲范围

最全常用缓冲液配方及缓冲范围缓冲液是一种能够帮助控制溶液酸碱性的化学物质,它可以通过接受或释放氢离子来防止溶液的pH值发生剧烈变化。
缓冲液在许多科学实验、生物学研究、工业生产以及医药领域中都有广泛应用。
常用的缓冲液配方包括以下几种:1.乙二胺四乙酸(EDTA)缓冲液:EDTA缓冲液是一种用来稳定金属离子浓度、防止金属离子的沉淀和垢痕形成的缓冲液。
其配方如下:-0.1MEDTA(乙二胺四乙酸)溶液10mL- 0.2 M Tris-HCl缓冲液(pH 8.0) 90 mL-蒸馏水900mL2.乙醇胺缓冲液:乙醇胺缓冲液通常用于DNA或RNA的电泳和杂交实验中。
其配方如下:-1M乙醇胺9mL-0.5MEDTA1mL-蒸馏水90mL将乙醇胺缓冲液通过添加适量的盐酸来调节pH值至所需的范围。
3.乙二醇缓冲液:乙二醇缓冲液常用于蛋白质的纯化和储存过程中。
其配方如下:-0.2M乙二醇10mL- 0.1 M Tris-HCl 缓冲液(pH 7.0) 90 mL按需添加其他添加剂如蛋白酶抑制剂或抗菌剂。
4.磷酸盐缓冲液:磷酸盐缓冲液是一种常用的生物学缓冲液,适用于酶反应、DNA/RNA杂交等实验。
常用的三种pH值的配方如下:-pH5.8:0.05MNa2HPO4溶液和0.05MNaH2PO4溶液的体积比为1:4-pH7.0:0.1MNa2HPO4溶液和0.1MNaH2PO4溶液的体积比为1:9-pH8.0:0.2MNa2HPO4溶液和0.2MNaH2PO4溶液的体积比为1:95.PBS缓冲液:PBS缓冲液是一种常用的生物学缓冲液,适用于细胞培养、免疫染色、蛋白质浸泡实验等。
其配方如下:-8gNaCl-0.2gKCl-1.44gNa2HPO4-0.24gKH2PO4-蒸馏水1L将以上成分溶解在蒸馏水中,调节pH至7.4这些缓冲液可以满足大多数实验和应用的需求,每种缓冲液的最佳使用范围可能略有不同。
在实验前应该仔细阅读相关文献,了解所使用缓冲液的特点和最适宜的pH范围。
不同缓冲液用途

不同缓冲液用途缓冲液是一种具有稳定pH值的溶液,常用于实验室、生物技术和医药等领域。
不同的缓冲液在这些领域中有着各自的用途。
下面我将分别介绍一些常见的缓冲液及其用途。
1. 磷酸缓冲液磷酸缓冲液是最常用的缓冲液之一,通常由二元酸(H2PO4^-)和一元酸(HPO4^2^-)组成。
它的pH值在酸性范围内(pH 2.1-7.4),主要用于DNA 和RNA的电泳、核酸杂交、PCR等分子生物学实验中。
2. 三氯醋酸缓冲液三氯醋酸缓冲液是一种低温缓冲液,也常用于分子生物学实验中。
它可以沉淀DNA、RNA和蛋白质,常用于核酸和蛋白质的提取、纯化和鉴定实验中。
3. Tris缓冲液Tris缓冲液是一种常用的碱性缓冲液,由三乙醇胺与盐酸反应得到。
它的pH值在碱性范围内(pH 7.0-9.4),主要用于电泳、蛋白质的提取和纯化、酶反应等生物化学实验中。
4. PBS缓冲液PBS(磷酸盐缓冲盐水)是一种生理盐水,由磷酸、氯化钠和氯化钾等成分组成。
它的pH值在中性范围内(pH 7.2-7.4),是细胞培养和免疫学实验中常用的缓冲液。
它可以稳定生物试样的离子平衡,并具有与细胞渗透性相似的离子浓度,用于洗涤、稀释和保存细胞。
5. HEPES缓冲液HEPES缓冲液是一种羧酸缓冲液,可以调节生理pH范围内的细胞培养液。
由于其pKa接近细胞的pH(7.2-7.4),对细胞具有较小的影响,因此常用于体外细胞培养与生物化学研究中。
6. MES缓冲液MES(2-(N-甲基-2-氨基乙基)-邻苯二甲酸)缓冲液是一种中性pH值的缓冲液,主要用于蛋白质电泳、DNA电泳和酶反应等实验中。
它在pH 5.5-6.7之间比较稳定,并可以缓冲许多生物反应。
7. Acetate缓冲液Acetate缓冲液是由乙酸和乙酸钠或乙酸铵组成的缓冲液,常用于生物技术和分子生物学实验中。
它的pH值通常在酸性范围内(pH 4.0-6.0),具有良好的稳定性,可用于DNA和RNA的沉淀、纯化和浓缩。
十标准缓冲液pH值对照参考表
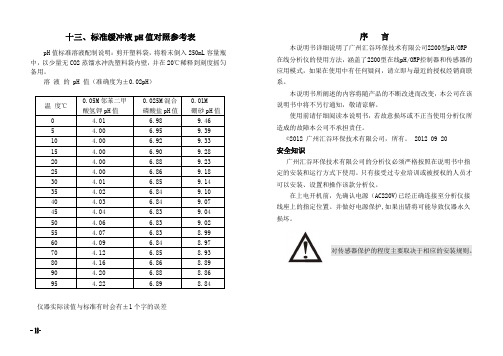
十三、标准缓冲液pH值对照参考表pH值标准溶液配制说明:剪开塑料袋,将粉末倒入250mL容量瓶中,以少量无CO2蒸馏水冲洗塑料袋内壁,并在20℃稀释到刻度摇匀备用。
溶液的 pH 值(准确度为±0.02pH)温度℃0.05M邻苯二甲酸氢钾pH值0.025M混合磷酸盐pH值0.01M硼砂pH值0 4.01 6.98 9.465 4.00 6.95 9.3910 4.00 6.92 9.3315 4.00 6.90 9.2820 4.00 6.88 9.2325 4.00 6.86 9.1830 4.01 6.85 9.1435 4.02 6.84 9.1040 4.03 6.84 9.0745 4.04 6.83 9.0450 4.06 6.83 9.0255 4.07 6.83 8.9960 4.09 6.84 8.9770 4.12 6.85 8.9380 4.16 6.86 8.8990 4.20 6.88 8.8695 4.22 6.89 8.84 仪器实际读值与标准有时会有±1个字的误差序言本说明书详细说明了广州汇谷环保技术有限公司2200型pH/ORP在线分析仪的使用方法,涵盖了2200型在线pH/ORP控制器和传感器的应用模式,如果在使用中有任何疑问,请立即与最近的授权经销商联系。
本说明书所阐述的内容将随产品的不断改进而改变,本公司在该说明书中将不另行通知,敬请谅解。
使用前请仔细阅读本说明书,若故意损坏或不正当使用分析仪所造成的故障本公司不承担责任。
©2012 广州汇谷环保技术有限公司,所有。
2012 09 20安全知识广州汇谷环保技术有限公司的分析仪必须严格按照在说明书中指定的安装和运行方式下使用。
只有接受过专业培训或被授权的人员才可以安装、设置和操作该款分析仪。
在上电开机前,先确认电源(AC220V)已经正确连接至分析仪接线座上的指定位置。
并做好电源保护,如果出错将可能导致仪器永久损坏。
如何计算缓冲液缓冲范围的公式

如何计算缓冲液缓冲范围的公式缓冲液是一种能够维持溶液pH稳定的溶液,它能够抵抗外界对溶液pH值的变化。
在实验室中,我们经常需要制备一定pH值的缓冲液,以用于酶活性实验、DNA/RNA电泳等实验中。
而为了确保缓冲液的缓冲效果,我们需要计算缓冲液的缓冲范围。
本文将介绍如何计算缓冲液缓冲范围的公式。
缓冲液的缓冲范围是指缓冲液在一定浓度范围内能够保持稳定的pH 值。
一般来说,缓冲液的缓冲范围可以通过以下公式计算得出:pH = pKa ± log([A-]/[HA])其中,pH为缓冲液的目标pH值,pKa为缓冲液的酸解离常数,[A-]为缓冲液中酸根离子(碱)的浓度,[HA]为缓冲液中酸(酸根离子的共轭酸)的浓度。
在计算缓冲范围时,我们需要先确定pKa值,pKa值是指缓冲液中酸解离常数的负对数。
pKa值越小,该酸的酸性越强,缓冲范围越窄;pKa值越大,该酸的酸性越弱,缓冲范围越宽。
接下来,我们需要确定缓冲液中酸(酸根离子的共轭酸)和酸根离子(碱)的浓度。
通常情况下,我们可以通过向溶液中加入已知浓度的酸或碱来调节缓冲液的pH值。
然后,我们可以使用酸碱滴定法或分光光度法等实验方法来确定酸和碱的浓度。
根据上述公式,我们可以计算出缓冲液的缓冲范围。
根据计算结果,我们可以调整缓冲液中酸和碱的浓度,以使缓冲液的缓冲范围达到实验要求。
需要注意的是,缓冲液的缓冲范围并不是无限的。
当酸根离子(碱)的浓度与酸(酸根离子的共轭酸)的浓度相差很大时,缓冲液的缓冲范围会变得很窄,无法保持稳定的pH值。
因此,在实验中,我们需要根据实际情况选择合适的酸和碱的浓度,以确保缓冲液的缓冲范围能够满足实验要求。
计算缓冲液的缓冲范围是一项重要的实验技术。
通过合理选择酸和碱的浓度,并使用上述公式进行计算,我们可以制备出具有稳定pH 值的缓冲液,以满足实验的需要。
当然,在实际操作中,我们还需要注意其他因素的影响,如温度、离子浓度等,以确保实验结果的准确性和可靠性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
资料]常用pH缓冲溶液的配制和pH值常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
(三)0.15Mol/L PB液Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
NaH2PO4·2H2O分子量=156.03 0.15Mol/L溶液含23.4g/L。
(四)0.2Mol/L PB缓冲液0.2Mol/L Na2HPO4·2 H2O溶液35.61g/LNa2HPO4·12 H2O溶液含71.64g/L0.2Mol/LNaH2PO4·H2O溶液含27.60g/LNaH2PO4·2 H2O溶液含31.21g/L欲配0.1Mol/L PB缓冲液则在0.2Mol/L PB缓冲液的基础上加H2O稀释1倍即可。
欲配制PBS 液时,则在溶液中加0.85%的NaCl溶液即可。
(五)无钙镁离子磷酸缓冲盐水(PBS)(0.15Mol/L PH 7.2)NaCl 8.0gKCl 0.2gNa2HPO4 1.15g(如为Na2HPO4·12H2O,则为2.89g)KH2PO4 0.2g将上述试剂依次溶于1 000ml去离子水中,完全溶解后,115℃高压灭菌10min~15min,存在4℃冰箱中备用。
此液可用于配制和稀释细胞分散剂以及洗涤细胞培养物。
(六)硼酸盐缓冲液(Borate saline buffer)1.硼酸(H3BO3)0.2Mol/L硼酸:硼酸12.37g加水至1 000ml。
2.硼砂(Na2B4O7)0.05Mol/L硼砂:硼砂19.07g加水至1 000ml。
(七)巴比妥缓冲液1.pH8.2离子强度0.05Mol/L巴比妥缓冲液巴比妥钠 47.6g蒸馏水 3 000ml1.17N HCl 55.0ml(1.17 N HCl=193ml浓HCl加1 807ml蒸馏水)⑴ 将4.76g巴比妥钠溶于3 000ml蒸馏水。
⑵ 加1.17 N HCl 55ml。
⑶ 用HCl调节pH到8.2,并加蒸馏水至4 265ml。
2.pH8.4 0.06Mol/L巴比妥缓冲液巴比妥 1.84g巴比妥钠 10.30g加蒸馏水至 1 000.00ml3.pH8.6 0.06Mol/L巴比妥缓冲液巴比妥 1.66g巴比妥钠 12.76g加蒸馏水 1 000.00ml(八)0.2Mol/L醋酸盐缓冲液见表附表5(九)三羟甲基甲烷—盐酸缓冲液(Tris—HCl缓冲液)不同pH,0.05Mol/L25ml0.2Mol/L三羟甲基氨基甲烷加хml0.1NHCl,加水稀释至100ml(见下表)三羟甲基氨基甲烷(Tris)分子量=121.140.2Mol/L三羟甲基氨基甲烷:Tris24.23g,加水至1 000ml。
0.1NHCl:取HCl8.6ml,加水至1 000ml。
(十)0.5Mol/L pH9.5碳酸盐缓冲液NaHCO3 3.70gNa2CO3 0.60g溶于600.00ml蒸馏水中即得。
不用时塞紧瓶塞,以免吸收空气中二氧化碳使PH下降。
最好小量配制。
(十一)甘油磷酸缓冲液1.配制pH8.0磷酸缓冲液0.1Mol/L Na2HPO4 94.50ml0.1N NaH2PO4 5.50ml混合即可2.9份甘油与1份pH8.0磷酸缓冲液混合,即为甘油磷酸缓冲液。
用途:用于免疫荧光试验。
(十二)Hank’s液1.贮存液NaCl 80.00gKCl 4.00gNa2HPO4·12 H2O 1.52gKH2PO4 0.60g葡萄糖 4.00g0.4%酚红液 50.00ml双馏水加至 100.00ml115℃高压灭菌15min,冰冻保存。
2.工作液贮存液 1份双馏水 9份115℃高压灭菌15min。
临用时用灭菌的5.6%NaHCO3液调pH值至7.2左右(溶液呈橙红色)。
(十三)萘(钠)氏试剂(Nessler’s reagent)配方1:氯化汞 6.0g碘化钾 12.4g20%NaOH 30ml加蒸馏水至 100ml配方2:碘化汞 11.5g碘化钾 8g蒸馏水 50ml(完全溶解后)过滤,加20%NaOH 50ml。
用途:检测溶液中氨离子。
(十四)阿氏(Alsever’s)液葡萄糖 2.05g柠檬酸钠 0.80g氯化钠 0.42g蒸馏水 100ml溶解后,以10%柠檬酸调节pH至6.1,过滤,分装,10磅10min灭菌,4℃保存。
(十五)青、链霉素混合液(简称S.P.液或双抗液)青霉素(40万U) 5支链霉素(200万μg) 1支分别溶于100ml灭菌无离子水中或共同溶于200ml灭菌无离子水中,混合后分装小瓶,置-10℃~-20℃冰箱保存备用(1万单位μg/ml)。
临用时,按1%的量加入营养液或其他溶液中,最后浓度是青霉素100U/ml,链霉素100ug/ml。
(十六)洗液(清洁液)配方1:重铬酸钾 150g蒸馏水 300ml浓硫酸 3 000ml将重铬酸钾加入蒸馏水中,使之自然溶解或水浴溶解,亦可在大坩埚中加热溶解,然后慢慢加入浓硫酸,边加边搅拌,见发热过剧则稍停,冷却后再继续加。
此为强洗液。
盛清洁液的容器要坚固,上加厚玻璃盖,操作时要穿橡皮围裙、长统胶靴、戴上眼镜和厚胶皮手套,以保安全。
洗液一旦变绿,表示铬酸已经还原,失去了氧化能力,不宜再用。
如将这样洗液加热,再加适量重铬酸钾,又可重新使用。
配方2:浓硫酸 50%蒸馏水 50%重铬酸钾 5%此为中等强度洗液。
配方3:重铬酸钾 100g蒸馏水 1 000ml加热溶解,冷却后缓慢加入工业硫酸 100ml此液为弱洗液,为棕红色。
使用此液时,必须预先用热肥皂水将玻璃器皿洗净,经自来水冲洗,沥干然后才能浸入,否则该洗液很快失效。
缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES (2吗啉代乙磺酸) 5.5-6.7 195.2Bis-Tris 5.8-7.2 209.2HEPES 6.8-8.2 238.3PIPES 6.1-7.5 302.4MOPS 6.5-7.9 209.3Tricine 7.4-8.8 179.2TEA (三乙醇胺) 7.4-8.3 149.2甘氨酸-盐酸缓冲液(0.05mol/L) 2.2-5.0 甘氨酸Mr=75.07邻苯二甲酸-盐酸缓冲液(0.05mol/L)2.2-3.8 邻苯二甲酸氢钾Mr=204.23磷酸氢二钠-柠檬酸缓冲液 2.2-8.0 磷酸氢二钠Mr=141.98柠檬酸-氢氧化钠-盐酸缓冲液 2.2-6.5 柠檬酸Mr=192.06柠檬酸-柠檬酸钠缓冲液(0.1mol/L) 3.0-6.6 柠檬酸Mr=192.06 柠檬酸钠Mr=257.96 乙酸-乙酸钠缓冲液(0.2mol/L) 3.6-5.8 乙酸钠Mr=81.76 乙酸Mr=60.05 邻苯二甲酸氢钾-氢氧化钠缓冲液 4.1-5.9 邻苯二甲酸氢钾Mr=204.23 磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L) 5.8-8.0磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL)4.92-8.18磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L) 5.8-8.0巴比妥钠-盐酸缓冲液(18℃) 6.8-9.6 巴比妥钠Mr=206.18Tris-盐酸缓冲液(0.05mol/L 25℃) 7.10-9.00 三羟甲基氨基甲烷(Tris)Mr=121.14 甘氨酸-氢氧化钠缓冲液(0.05mol/L) 8.6-10.6 甘氨酸Mr=75.07硼砂-氢氧化钠缓冲液(0.05mol/L) 9.3-10.1 硼砂Na2B4O7?10H2O Mr=381.43碳酸钠-碳酸氢钠缓冲液(0.1mol/L) 9.16-10.83 碳酸钠Mr=286.2 碳酸氢钠Mr=84.0碳酸钠-氢氧化钠缓冲液(0.025mol/L) 9.6-11.0磷酸氢二钠-氢氧化钠缓冲液10.9-12.0氯化钾-盐酸缓冲液(0.2mol/L) 1.0-2.2 氯化钾Mr=74.55氯化钾-氢氧化钠缓冲液(0.2mol/L)12.0-13.0 氯化钾Mr=74.55。
