SVA-FCR U20H明细申报操作步骤
二类有源医疗器械全套注册申报资料(共157页)

目录1.《医疗器械注册证》核发申请表2.营业执照(副本)3.医疗器械安全有效基本要求清单4.综述资料5.1研究资料5.2有效期验证报告5.3软件描述文档6.生产制造信息7.临床评价资料8.产品风险分析资料9.1干式荧光免疫分析仪产品技术要求9.2声明10.1干式荧光免疫分析仪-检验报告10.2干式荧光免疫分析仪-EMC检验报告11.1声明11.2干式荧光免疫分析仪最小销售单元标签11.3说明书12.1符合性声明12.2产品符合现行国家标准、行业标准的清单医疗器械安全有效基本要求清单条款号要求适用证明符合性采用的方法为符合性提供客观证据的文件A通用原则A1医疗器械的设计和生产应确保其在预期条件和用途下,由具有相应技术知识、经验、教育背景、培训经历、医疗和硬件条件的预期使用者(若适用),按照预期使用方式使用,不会损害医疗环境、患者安全、使用者及他人的安全和健康;使用时潜在风险与患者受益相比较可以接受,并具有高水平的健康和安全保护方法。
是ISO13485、YY/T0316八、产品风险分析资料A2医疗器械的设计和生产应遵循安全原则并兼顾现有技术能力,应当采用以下原则,确保每一危害的剩余风险是可接受的:(1)识别已知或可预期的危害并且评估预期使用和可预期的不当使用下的风险。
(2)设计和生产中尽可能地消除风险。
(3)采用充分防护如报警等措施尽可能地减少剩余风险。
(4)告知剩余风险。
是ISO13485、YY/T0316八、产品风险分析资料A3医疗器械在规定使用条件下应当达到其预期性能,满足适用范围要求。
是临床评价技术指导原则七、临床评价资料A4在生命周期内,正常使用和维护情况下,医疗器械的特性和性能的退化程度不会影响其安全性。
是产品适用的实际效期测试方法、模拟加速效期测试方法(YYT0681.1-2009)五、研究资料(有效期和包装研究)A5医疗器械的设计、生产和包装应当能够保证其说明书规定的运输、贮存条件(如温度和湿度变化),不对产品特性及性能造成不利影响。
进出境运输工具动态申报系统用户申请和使用指南

进出境运输工具动态申报系统用户申请和使用指南
办理流程:
1、用户按照《中华人民共和国海关进出境运输工具舱单管理办法》(署令第172号)和上海海关有关规定,准备好相关材料,用户向主管海关办理企业备案手续,取得经上海海关有关现场海关签注备案意见和盖章的《备案登记表》。
2、企业用户登录上海数据分中心业务管理网站()。
在应用项目模块下,点击“动态申报系统”对应的“办事”链接。
如实填写《上海海关进出境运输工具动态申报系统用户登记表》(以下简称“用户登记表”),需在声明栏内填写组织机构代码证号。
确认无误后点击提交按钮上传网站并保存。
需在声明栏内注明动态子系统或供应子系统。
3、点击打印按钮,打印用户登记表。
签章处须填写经办人姓名并加盖企业公章。
4、企业用户准备好以下加盖企业公章的材料:
送交上海分中心(地址::962116)
办公时间:周一至周五、上午8:30-11:30;下午1:30-5:00:
5、企业可根据业务量实际需求,选择VPN网络接入或拨号网络接入;业务量大的企业建议使用VPN;VPN申请使用指南详见上海数据分中心网站相关办事指南;
6、上海分中心在收到企业有效申请资料后的10个工作日内安排技术人员为用户安装和调试软件。
CFDA认证全过程介绍

CFDA认证全过程介绍1.CFDA申请流程1.1分类(确认设备属于医疗器械的哪一类)第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
如:外科用手术器械(刀、剪、钳、镊、钩)、刮痧板、医用X光胶片、手术衣、手术帽、检查手套、纱布绷带、引流袋等。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
如:医用缝合针、血压计、体温计、心电图机、脑电图机、显微镜、针灸针、生化分析系统、助听器、超声消毒设备、不可吸收缝合线、避孕套等。
第三类是具有较高风险、需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
如:植入式心脏起搏器、角膜接触镜、人工晶体、超声肿瘤聚焦刀、血液透析装置、植入器材、血管支架、综合麻醉机、齿科植入材料、医用可吸收缝合线、血管内导管等。
注:一般是根据产品的说明书来判断设备属于哪一类设备医疗器械产品分类可以先查询分类目录,如产品不在分类目录中,就需要在中国食品药品检定研究院网站进行分类界定来确定产品类别。
分类界定一般是根据产品的工作原理,结构组成及预期用途来判定类别,并不会单纯因为其使用方式是可穿戴而改变类别。
但是需要注意的是,产品可能会因为被设计为可穿戴式而改变工作原理、使用方式、产品特性等等而造成产品的类别变化。
1.2注册检测注册检测流程图产品立项至检测预计4-7个月左右,不含开发过程时间(并行)1.3临床评价临床流程图临床预计6个月以上1年左右,视产品而定。
申请免于临床试验、通过同品种医疗器械临床试验获得的数据或者开展临床试验。
需要注意的是,对于想要申请免临床的产品,即使满足了免临床目录中的要求,还需要提交申报产品与《目录》中已获准境内注册医疗器械的对比说明。
1.4提交注册审批和体系考核申报注册流程图申报注册全过程8个月(158工日,20工日/月,不计节假),体考时间(并行),不含整改、资料发布耗时。
注册准备资料如下:1.申请表;2.证明性文件3.医疗器械安全有效基本要求清单;4.综述材料;5.研究材料;6.生产制造信息;7.临床评价材料;8.产品风险分析材料;9.产品技术要求;10.产品注册检验报告;11.说明书和标签样稿;12.符合性声明13.包含软件的设备需要进行软件注册1.5申请生产许可申请生产许可流程图申请生产许可流程时间预计在60WD 1.6经营备案经营备案流程图经营备案时间预计在5WD。
进口医疗器械注册流程细解

进口医疗器械注册流程细解1.实施依据:《医疗器械监督管理条例》、《医疗器械注册管理办法》2.申请人提交材料目录:资料编号(一)境外医疗器械注册申请表资料编号(二)医疗器械生产企业资格证明资料编号(三)申报者的营业执照副本和生产企业授予的代理注册的委托书资料编号(四)境外政府医疗器械主管部门批准或认可的该产品作为医疗器械进入该国(地区)市场证明文件资料编号(五)适用的产品标准资料编号(六)医疗器械说明书资料编号(七)医疗器械检测机构出具的产品注册检测报告(适用于第二、三类医疗器械)资料编号(八)医疗器械临床试验资料资料编号(九)生产企业出具的产品质量保证书资料编号(十)生产企业在中国指定代理人的委托书、代理人的承诺书及营业执照或者机构登记证明资料编号(十一)在中国指定售后服务机构的委托书、受委托机构的承诺书及资格证明文件资料编号(十二)所提交材料真实性的自我保证声明3.对申报资料的要求(一)申报资料的一般要求:1.申报资料首页为申报资料项目目录,目录中申报资料项目按《医疗器械注册管理办法》附件6的顺序列。
每项资料加封页,封页上注明产品名称、申请人名称,右上角注明该项资料名称。
各项资料之间应当使用明显的区分标志,并标明各项资料名称或该项资料所在目录中的序号。
整套资料应装订成册。
2.申报资料一式一份,申报资料应使用A4规格纸张打印,内容完整、清楚、不得涂改,政府及其他机构出具的文件按原件尺寸提供。
3.申报资料的复印件应清晰。
4.各项(上市批件、标准、检测报告、说明书)申报资料中的产品名称应与申请表中填写的产品名称实质性内容相对应。
若有商品名,应标注商品名。
申报资料应当使用中文,根据外文资料翻译的申报资料,应当同时提供原文。
中文的签章执行[2004]499号文。
(二)申报资料的具体要求:1.境外医疗器械注册申请表(1)医疗器械注册申请表可从下载“医疗器械(体外诊断试剂)注册电子申报软件2010(含使用手册)”;(2)医疗器械注册申请表是注册申请的重要资料之一,表内各项应符合填表说明要求。
计量器具检定申报流程

计量器具检定申报流程1.计量器具检定申报流程非常重要。
The process of declaring the verification of measuring instruments is very important.2.首先,申报人需要填写完整的申报表格。
First, the applicant needs to fill out the complete declaration form.3.然后,需要准备好相关的计量器具和检定资料。
Then, the relevant measuring instruments and verification materials need to be prepared.4.接着,将填写好的申报表格和相关资料提交给指定的检定机构。
Next, the completed declaration form and relatedmaterials are submitted to the designated verification organization.5.申报人可以选择邮寄或者亲自送达。
The applicant can choose to mail or deliver in person.6.检定机构收到申报材料后会进行初审。
The verification organization will conduct an initial review upon receipt of the application materials.7.若初审合格,将安排具体的检定时间。
If the initial review is qualified, a specific verification time will be arranged.8.申报人需要按时将计量器具送到指定的检定地点。
The applicant needs to deliver the measuring instruments to the designated verification location on time.9.在检定过程中,申报人需要配合检定人员进行操作。
危废月度年度申报操作指引

危废月度年度申报操作指引
以下是关于危险废物的月度和年度申报操作指引:
1. 登录系统:,登录相关的危险废物管理系统。
根据所在的地区和行业,选择合适的系统进行登录。
2. 选择申报时间:进入系统后,选择需要申报的时间段,可以是月度或年度申报。
根据实际情况,选择合适的时间段进行申报。
3. 填写基本信息:根据系统提示,填写废物产生单位的基本信息,包括单位名称、地质、联系人等。
4. 填写废物信息:根据废物产生情况,逐一填写废物的相关信息,包括废物名称、数量、处理方式等。
根据实际情况,可能需要提供废物的安全数据表或处理证明文件。
5. 计算申报数据:根据填写的废物信息,系统会自动计算出相应的申报数据,包括废物总量、主要废物种类等。
6. 附件:根据系统要求,将必要的附件进行,包括废物运输、处理的相关文件、报废设备的清单等。
7. 审核提交:确认填写无误后,提交申报信息进行审核。
系统会对申报信息进行审核,确保申报数据的准确性和完整性。
8. 缴费报送:根据系统要求,进行相应的缴费报送工作。
视实际情况而定,可能需要缴纳相应的危废管理费用。
9. 打印申报表:经过审核和缴费后,可以在系统中打印相关的申报表。
根据实际需求,可以选择打印月度或年度的申报表。
10. 归档备份:将打印好的申报表进行归档备份,以备日后的查阅和需要。
值得注意的是,以上的操作指引仅为一般情况下的参考,具体的操作流程可能因地区和行业的不同而有所差异。
在进行危险废物的申报工作时,建议参考当地相关的政策法规和操作规范。
二类医疗注册证申报流程

二类医疗注册证申报流程英文回答:Process for Medical Device Registration Certificate Application (Class II)。
1. Pre-application Preparation.Determine the classification of the medical device based on its risk level.Prepare a detailed technical dossier that includes information on the device's design, manufacturing, and testing.Secure a Certificate of Free Sale (CFS) from the country of origin, if applicable.2. Application Submission.Submit the technical dossier and other required documents to the regulatory authority responsible for medical device regulation in the target country.Pay the appropriate application fees.3. Technical Review.The regulatory authority will review the technical dossier to ensure that it meets the requirements for the classification of the medical device.The authority may request additional information or conduct inspections as needed.4. Risk Management Assessment.The regulatory authority will conduct a risk management assessment to evaluate the potential risks associated with the use of the medical device.The assessment may include a review of clinical data,literature review, and consultations with experts.5. Approval Decision.Based on the technical review and risk management assessment, the regulatory authority will make a decision on whether to approve the application for the medical device registration certificate.If approved, the certificate will be issued and the device may be marketed in the target country.Additional Requirements.Quality Management System (QMS) Certification.Compliance with Good Manufacturing Practices (GMP)。
企业申报操作流程

企业申报操作流程
一、系统登录
打开网址:/,使用获取的账号及密码登陆“医用耗材申报投标系统”
二、录入投标资质信息
2.01、点击投标资质申报
2.02、点击最右边操作的资质维护
3.03、创建资质
3.04、保存
2.1、点击常规产品申报
2.2、创建常规产品信息
2.3、填写产品信息并保存
2.4、确认产品信息无误后发送审核(发送审核后将不能修改)
三、目录产品申报
3.1、点击常规产品申报
3.2、创建目录产品信息
3.3、填写产品信息并保存填写如图1
注:选择目录,产品名称和规格根据目录信息自动填写,产品名称和规格不允许手动填写。
保存如图2
3.4、确认产品信息无误后发送审核(发送审核后将不能修改)
注:根据各地区招标原则或方式不同,相关操作步骤会有少许不同,如有变动,所有相关通知以深圳三方诚信招标有限公司武汉分公司网站为准。
供应商市级政府采购网上报名流程

供应商市级政府采购网上报名流程Revised by Petrel at 2021供应商市级政府采购网上报名流程供应商注册流程1.访问苏州市政府采购网(),找到如图1-1所示,可以进入网上报名系统:图1-12.点击供应商在线报名,跳转至图2-1:图2-13.点击注册,进行供应商会员注册如图3-1所示:图3-14.跳转到注册页面,系统弹出供应商注册流程,如图4-1所示,请下载右下角的“报名注册流程及数字认证业务申请单”。
图4-15.点击【确认】,供应商按照要求填完信息(数据解释详见表5-1),点击提交,如图5-1所示:图5-1 页面信息解释如下表:表6.注册成功后,请带上资质信息到苏州CA各网点(报名注册流程及数字认证业务申请单中有网点地址)进行审核并绑定CA。
供应商报名流程7.访问苏州市政府采购网(),找到如图7-1所示,可以进入网上报名系统:图7-18.点击供应商在线报名,跳转至图8-1:图8-19.插入CA,输入密码,点击【登录】,如图9-1所示:图9-110.登录成功后跳转到供应商网上报名首页,如图10-1所示:图10-111.点击采购公告进行报名如图11-1所示:图11-112.点击【报名】会弹出提示,如图12-1所示,点击【确定】继续报名:图12-113.点击【确定】,会弹出图13-1资质是否满足的提示,点击红色字体跳转到采购网查看公告详情,点击确定后,弹出报名结果,如图13-2所示:图13-1图13-214.点击菜单【报名项目】,可以查看已经报名的项目,点击【报名信息打印】可打印报名信息,如图14-1、图14-2所示,点击【附件信息下载】,可下载工程图纸如图14-3所示:图14-1图14-2图14-3供应商询问15.如供应商对所投公告有疑问,可以进行公告询问。
点击菜单【公告询问】,可对采购公告进行询问,如图15-1、15-2、15-3所示:图15-1图15-2图15-316.点击菜单【我的询问】,可查看询问的历史信息,并可查看问题详情及回复内容,如图16-1、图16-2所示:图16-1图16-2供应商会员中心单位业绩点击【单位业绩】进入单位业绩页面,如图17-1图17-1增加单位业绩点击【新增】,弹出新增单位业绩窗口,如图17-2图17-2 页面信息如下表17-1:表17-1 ➢成功新增一条单位业绩:1、点击【新增】,弹出新增单位业绩窗口2、正确输入各项,点击【确定】结果:新增单位业绩成功。
2018年佛山市医疗机构医用耗材及检验试剂集中采购企业用户平台申报操作手册

2018年佛山市医疗机构医用耗材及检验试剂集中采购企业用户平台申报操作手册海虹医药电子交易中心有限公司目录一、如何使用手册 (3)1.1约定 (3)1.2遇到更多问题 (3)二、系统基本操作 (3)2.1注册 (3)2.2登陆 (6)2.3退出 (8)三、公告 (9)3.1公告通知 (9)四、基本信息 (10)4.1企业用户管理 (10)4.2企业基本信息 (11)4.3用户基本信息 (11)4.4企业注册信息 (12)4.5注册信息修改 (13)4.6用户密码修改 (13)五、器械管理 (14)5.1维护生产企业 (14)5.2企业资质管理 (20)5.3注册证管理 (22)5.4产品管理 (26)5.5产品资质管理 (29)5.6企业审核任务 (33)六、项目管理 (35)6.1项目授权 (35)6.2项目数据管理 (38)6.3项目资质管理 (49)6.4项目问题咨询 (50)6.5项目配送方案 (52)6.6填报境内最近成交价格或销售价格操作流程如下 (55)6.7检验试剂选择目录投放操作如下 (56)一、如何使用手册1.1约定本系统所有列表信息均可进行条件查询、翻页、设置每页显示数量等操作。
点击本系统所有列表的可链接表头,均可按其相应信息重新排列顺序。
本系统主窗口状态栏,列出当前项目信息。
1.2遇到更多问题在您使用本系统过程中遇到问题,我们强烈建议您首先查阅本手册,本手册可以帮助您解决遇到的大部分问题。
如果通过查询本手册,您的问题依然没有得到有效解决,您可以通过电话或者通过电子邮件联系我们的专业技术支持人员。
二、系统基本操作2.1注册由于不同浏览器存在兼容性问题,如在用的浏览器影响正常浏览或操作,建议使用最新版的谷歌浏览器。
路径:功能说明:注册新账户。
操作步骤:1.打开浏览器,输入企业数据管理平台网络地址。
在(图2.1.1)所示的页面中点击【用户注册】链接,打开注册页面(图2.1.2)。
流行性感冒病毒核酸检测试剂注册申报资料指导原则

流行性感冒病毒核酸检测试剂注册申报资料指导原则一、前言本指导原则旨在指导注册申请人对流行性感冒病毒(以下简称流感病毒)核酸检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对流感病毒核酸检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
二、适用范围流感病毒核酸检测试剂是指利用荧光探针聚合酶链式反应(PCR)或其他类分子生物学方法,以特定的流感病毒基因序列为检测目标,对人咽拭子、呼吸道洗液、抽吸液或其他呼吸道分泌物样本中的流感病毒进行体外定性检测的试剂。
本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
三、注册申报资料要求(一)综述资料流感病毒包括甲、乙、丙三型,甲型最容易引起流行,乙型次之,丙型极少引起流行。
依据病毒颗粒外膜血凝素(HA)和神经氨酸酶(NA)蛋白抗原性的不同,甲型流感病毒目前可分为16个H亚型(H1-H16)和9个N亚型(N1-N9),目前已有H1、H2、H3、H5、H7和H9等亚型有人感染的报道。
由于编码HA和(或)NA的核苷酸序列容易发生突变,致使HA和(或)NA的抗原表位发生改变,这种抗原性的改变使人群原有的特异性免疫力失效,故甲型流感病毒常引起较大规模甚至世界性的流感流行。
按照流行特点,造成人间流感流行的流感病毒可区分为季节性流感病毒和新型甲型流感病毒。
海关通用数据采集软件操作步骤

通用数据采集软件一般纳税人软件的操作方法
从网站的下载空间里下载第9项:通用数据采集软件
下载站:
下载完--安装
双击通用数据采集软件一般纳税人软件
登录口令:123456
1、增企业――填写企业名称和税号—确定
2、点目录中“海关完税凭证抵扣清单”—新增报表—选择会计期间以做帐所属的会计期间为准—确定
3、双击专用缴款书号码下面的格子
出现:
根据"上海海关进口增值税专用交款书"来填写:
①专用缴款书号码:为增值税专用缴款书上右上角22位;――②进口口岸代码:为①专用缴款书号码的前4位数据例:2248;――③进口口岸名称:为增值税专用缴款书上的印章例:中华人民共和国洋山海关;――④填发日期:缴款书上的日期;――⑤税款金额:缴款书上的税额;填完点保存并新增—把之前填的内容再输入一次—点确定—点取消;
4、数据申报—点指定的路径—选择要保存的路径—开始导出
5、清单打印-打印出来和专用缴款书粘贴在一起保存
打开网上报税软件:
6、在网上报税软件打开“增值税纳税申报表及附表”-点向导的第4步如有通用税务数
据采集软件输入的发票清单,按附件添加—添加刚才保存的文件通用税务数据采集软件导出的文件
7、在网上报税软件增值税报表二本期进项税额明细第5行“其中海关进口增值税专用缴款书”内填写好份数、金额、税额,并使得第59行=17行;。
体外诊断试剂注册申报资料模板-产品技术要求

医疗器械产品技术要求编号:XXXXX检测试剂盒(XXX法)1. 产品规格示例1:48人份/盒示例2:2. 性能指标示例1:定性产品2.1外观试剂盒内各组分包装应完整,无污渍,字迹清晰。
各组分应为透明溶液,无沉淀及絮状物,无肉眼可见颗粒。
试剂盒内各组分名称、数量应符合产品说明书的要求。
2.2准确性检测试剂盒范围内的国家阳性参考品或者经标化的企业阳性参考品P1-P3,结果应为相应的基因突变型。
2.3特异性2.3.1检测国家阴性参考品或者经标化的企业阴性参考品N,结果应为未检出相应的基因突变型。
2.3.2检测试剂盒范围外国家阳性参考品,结果应为未检出相应的基因突变型。
2.4检测限检测突变频率不高于5%。
2.5 重复性使用经标化的重复性参考品J1,重复检测10次,结果应为相应的基因突变型。
使用经标化的重复性参考品J2,重复检测10次,结果应为未检出相应的基因突变型。
示例2:定量产品2.1 试剂性能指标2.1.1外观和性状2.1.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.1.2 试剂1组分应为无色至黄色澄清液体。
2.1.1.3 试剂2组分应为无色至黄色澄清液体。
2.1.2 净含量液体试剂净含量不少于标示值。
2.1.3 试剂空白用指定的空白样品测试试剂(盒),在光径1cm下,波长505nm处,试剂空白吸光度值A≤0.500。
空白2.1.4 分析灵敏度浓度为20U/L时,吸光度差值≥0.010。
2.1.5线性范围在(0.1-200)U/L线性范围内,r≥0.990,在(30-200)U/L范围内的相对偏差不超过15%;测定结果(0.1-30]U/L时绝对偏差不超过4.5 U/L。
2.1.6 精密度2.1.6.1重复性变异系数(CV)应≤5%。
2.1.6.2 批间差相对偏差(R)应≤8%。
2.1.7 准确度准确度应符合以下要求之一:a)相对偏差:用参考物质作为样本进行检测,其测量结果的相对偏差应不超过15%。
上海第二类体外诊断试剂注册申报资料要求

上海市第二类体外诊断试剂注册申报资料要求一、申请表申请表应填写完整,无相关内容应填写“/”。
申请表的封面、表格下方签章处应分别加盖公章(及骑缝章)。
二、证明性文件(受理时需校验原件)1。
提交有效期内的企业营业执照副本复印件,企业名称、地址与申请表中相关字段一致,企业营业执照副本复印件应加盖公章,以及“内容与原件一致”的章或手写并签字确认。
2。
提交有效期内的组织机构代码证复印件,企业名称、机构代码号与申请表中相关字段一致,组织机构代码证复印件应加盖公章,以及“内容与原件一致"的章或手写并签字确认.3.提交注册申请人委托相关人员办理第二类体外诊断试剂注册事务的委托书,并加盖公章。
4.提交被委托人身份证复印件并加盖公章,以及“内容与原件一致”的章或手写并签字确认。
5.按照《创新医疗器械特别审批程序审批》的境内医疗器械申请注册时,应当提交创新医疗器械特别审批申请审查通知单,样品委托其他企业生产的,应当提供受托企业生产许可证和委托协议。
生产许可证生产范围应涵盖申报产品类别.申报资料应加盖公章(及骑缝章),如有复印件,需在复印资料上加盖“内容与原件一致”的章。
(或可手写并签字确认)三、综述资料纸质及Word文档应将综述资料的Word文档上传至申请信息平台.提交综述资料时需提交如下承诺和声明:本公司承诺:按照国家食品药品监督管理总局《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2014年第44号公告)中,关于“综述资料”的相关要求,提交了(产品名称)的综述资料。
本公司声明:此次提交(产品名称)的综述资料Word文档内容与综述资料纸质文档内容完全一致.申报资料应加盖公章(及骑缝章).附件:综述资料内容(一)产品预期用途.描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(二)产品描述。
描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。
新冠肺炎疫情防控期间,申请医用防护服、医用口罩等第二类医疗器械注册证申报标准及流程

附件2新冠肺炎疫情防控期间,申请医用防护服、医用口罩等第二类医疗器械注册证申报标准及流程申报标准:1.医疗器械注册申请人应当建立与产品研制、生产有关的质量管理体系,并保持有效运行;2.防疫期间临床急需的医用防护服、医用口罩等第二类医疗器械产品。
申报流程:申请人向天津市药品监督管理局提出医用防护服、医用口罩等第二类医疗器械注册证的申请,天津市药品监督管理局依据《天津市第二类医疗器械优先审批程序》(津药监规〔2019〕3号,见附件)进行审批,对于符合我市第二类医疗器械优先审批的新冠病毒疫情防护产品,产品的检测、审评、审批按照法定时限减半完成,对于新冠病毒疫情临床急需的重点防护产品,进一步缩短时限,产品的检测、审评、审批按照法定时限三分之一完成。
天津市第二类医疗器械优先审批程序第一条为鼓励创新、保障临床使用需求、优化医疗器械行业营商环境、优化本市医疗器械审评审批程序,依据中共中央、国务院《关于改革药品医疗器械审评审批制度的意见》和《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,以及《医疗器械监督管理条例》《天津市优化营商环境条例》《医疗器械注册管理办法》《体外诊断试剂注册管理办法》《创新医疗器械特别审查程序》《医疗器械优先审批程序》等有关规定,制定本程序。
第二条符合下列情形之一的产品,纳入本市医疗器械鼓励清单,其注册申请实施优先审批程序:(一)经国家药品监督管理局认定属于本市第二类创新医疗器械的产品;技术领先,填补本市空白的医疗器械产品;获得国家项目支持或本市科技重大专项、重点研发计划支持的医疗器械产品;获得省部级科学技术奖励二等奖及以上奖励的医疗器械产品;具有核心技术发明专利且有显著临床应用价值的医疗器械产品;(二)已在外省市取得产品注册证且产品符合国家或本市行业发展规划的医疗器械生产企业,携已注册产品迁入本市生产的医疗器械产品;已在国外取得上市许可文件落户本市生产的医疗器械产品;(三)属于智能康复、人工医疗设备、口腔充填修复材料、口腔正畸材料及制品、口腔植入及组织重建材料、组织修复与可再生材料、分子诊断仪器及试剂、人工器官与生命支持设备、健康监测装备、机器人等医疗器械产品,应用增材制造(3D打印)、微纳制造等先进加工工艺的医疗器械产品,涉及远程医疗、智能穿戴、人工智能,基因工程等高科技类型医疗器械产品以及诊断或者治疗罕见病且具有明显临床优势的医疗器械产品;(四)诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段的医疗器械产品;专用于儿童,且具有明显临床优势的医疗器械产品;临床急需的医疗器械产品。
上海市医疗器械经营企业产品信息追溯申报系统V2.0操作说明
上海市医疗器械经营企业产品信息追溯申报系统V2.0培训手册-----------三类医疗器械追溯系统新手操作版本只要认真看一遍本文,99%的人都可以直接操作,本文通俗易懂,手把手的教步骤。
上海市医疗器械经营企业产品信息追溯申报系统V2.0登陆网址:/login 需要登陆用户名和密码。
首次使用需要注册,老用户需要找回。
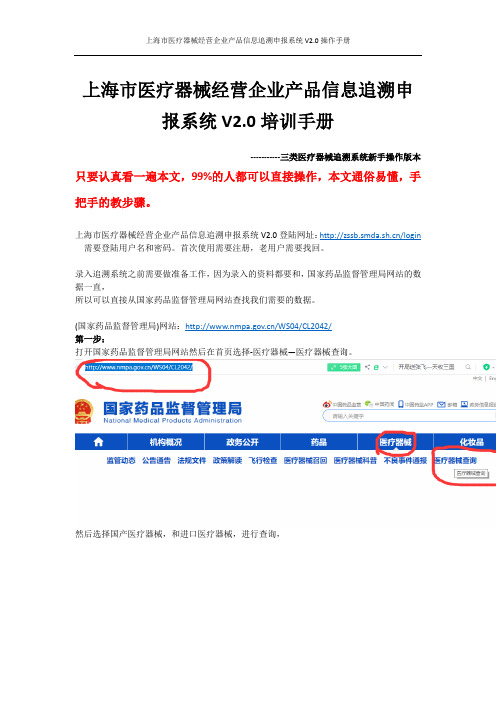
录入追溯系统之前需要做准备工作,因为录入的资料都要和,国家药品监督管理局网站的数据一直,所以可以直接从国家药品监督管理局网站查找我们需要的数据。
(国家药品监督管理局)网站:/WS04/CL2042/第一步:打开国家药品监督管理局网站然后在首页选择-医疗器械—医疗器械查询。
然后选择国产医疗器械,和进口医疗器械,进行查询,可以通过产品的名称,和产品的注册证2个关键词进行查询输入注册证:国械注准20143462100 查询出现数据。
点开查询到产品信息。
可以直接把国家药品监督管理局数据进行复制,然后输入到上海市医疗器械经营企业产品信息追溯申报系统V2.0这样做的好处,可以直接复制进行产品名称,地址的数据,而且你的数据准确。
这个2个系统的数据是相互比对,如果你在上海市医疗器械经营企业产品信息追溯申报系统V2.0里录入的数据和国家药品监督管理局不一样,会产生错误,需要你进行修改。
第二步:现在打开上海市医疗器械经营企业产品信息追溯申报系统V2.0用户名和密码登陆上去。
有3个模块需要我们操作,第一个是年报,也叫自查报告,填报是时间是每年的1月份。
需要填写年报信息。
是每次都要申报一次。
第三个是企业人员信息,点击进入,把企业的人员按注册证申请时候的人员信息,进行录入上去就可以了,这里需要主要的是需要把1个人设置为企业的常用联系人。
如果有电话通知会联系到这个人。
第二个模块就是中间的,就是追溯系统,是需要每个企业都要填写的。
这个是国家药品监督管理局要求的,在年度审核,飞行检查等都需要审核医疗器械企业,特别是三类医疗器械企业有没有填写这个追溯系统,如果不填写是需要罚款的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SVA-FCR U20H明细申报方法
第一步“自然月”申报
在税控器上插上“用户卡”登录软件后在工具栏上按“报税”;
在弹出窗口中单击“汇总申报数据”后再点击“写卡”,然后根据实际要求选择“自然月申报”或“截止日期申报”后按“确定”,申报成功后退出此窗口。
第二步“日记录申报”
点击在菜单栏中的“税务管理”然后在“日记录申报”中点击“用户卡申报”,申报成功后按“确定”。
第三步“明细申报”
先在电脑的USB接口上插入U盘,然后点击菜单栏中的“税务管理”然后在“明细申报”中单击“U盘申报”申报成功后按“确定”退出即可。
上海爱信诺航天信息有限公司。
