Imageproplus使用指南.
ImagePro的使用汇总

二. 颜色分割
使用Imagpe-Pro Plus处理图片数据
(一)概念 将图像中的某种(些)颜色整体从图像中分别出来的过程.分别 出来的区域可以被删除或保存,而无视图像的其余局部. (二)颜色分割的两种类型 1. 基于阈值 利用segmentation工具 完成颜色分割. 2. 基于边界微分的原理 在两种不同颜色的边界上,象素点的颜色与亮度随位置的而 变动,通过检测边界上颜色与亮度变化,以差异最大值点作为 分界的阈值. 一般利用轨迹工具条来完成对象选择.
”通过阅读科技书籍,我们能丰富学问, 培育规律思维力气;
通过阅读文学作品,我们能提高文学鉴赏水平, 培育文学情趣;
通过阅读报刊,我们能增长见识,扩大自己的学问面。 有很多书籍还能培育我们的道德情操, 给我们巨大的精神力气, 鼓舞我们前进。
二. 颜色分割
使用Imagpe-Pro Plus处理图片数据
(三)利用 segmentation工具 完成颜色分割 2. 基于彩色立方体
二. 颜色分割
使用Imagpe-Pro Plus处理图片数据
(四)基于边界微分原理完成颜色分割 基于边界微分原理的颜色分割利用轨迹(Trace)工具完成. 调出轨迹工具的方法:创立不规章AOI 轨迹工具包括两种工作模式:轨迹和魔术棒(Wand),二者可相互 切换.
使用Imagpe-Pro Plus处理图片数据
(四)基于边界微分原理完成颜色分割 2.魔术棒工作模式 (1)Trace 切换至轨迹工作模式. (2)Range 指定鼠标所在点像素与四周像素间的颜色强度范围的差异大小 (容差区间)作为分界阈值.Range越大,选择的范围越大(越不准确 ). (3)Smooth 同Trace工作模式.
(1)RGB模型
Image Pro Plus教程

分析测量图象软件Imagepro-Plus教程一、入门Imageproplus(IPP)的主要用途是分析测量图象。
本人使用该程序进行生物图象分析有一段时间,写此帖的主要目的还是与大家交流使用心得,并总结一下使用方法。
如果你是刚接触IPP,最好先从本帖看起,并同时打开你电脑上的IPP程序照着操作。
学会一个软件需要花一段时间的,两分钟不可能学会。
两小时也太短。
但我相信,照着我这几个帖子作下来,至少是可以用IPP干一点事情了。
打开IPP后的界面是这样的,该从何处下手呢?既然是处理图片,当然是先要打开一张要处理的图片嘛这张照片中的黄色部分是免疫组化染色的阳性表达成分。
处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的“量”。
对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,所以首先要把图片中呈现黄色的区域给挑选出来,这部分区域是我们最感兴趣的地方,叫作AOI(area of interest)。
AOI是IPP中最有用最重要的概念。
如何能够准确地选取AOI就是使用IPP的关键操作。
一旦准确地选取了AOI,下面的测量分析就好办了。
对不同的图片,需灵活地使用各种适当的AOI工具,就这张图片来说,AOI是黄色区域,因此用颜色分类的AOI工具是最有效的。
点击measure---count/size,弹出分类测量窗口在窗口中选中manual,再点击select color,弹出颜色选择窗口segmentation,这个工具是IPP最有特色的颜色选取工具之一。
用好这个工具是使用IPP的要点。
对于目标颜色鲜明的图片,用吸管工具是最简单的。
点一下吸管图标,在目标区域点一下,就可以选中该点的颜色,当然一下是不可能完全选中所需要指定的全部区域,可以在未选中的地方接着再点,这样多次选取,直到把想选中的区域全部选中为止。
在这张示例图中,选中的蓝色细胞核部分被标上了红色。
(完整版)imageproplus教程

Image pro plus 教程 1.打开图片:i.i 打开软件 双击图标,弹出窗口进入软件,会弹出:Macro PlayerMacros :S ar o chr on e &出CiuiitSmillJZslls MeasureSt&in 三CountAndClassifyM«&siur»Ir cnPh 陌全 EThraughfocusS e queue eM ®管Au t or a. di * graphSpr a cJc» tC ountD em oD^zciri pti (D«monstrati.Qn (naciras'L QPP旨Jv* Stop for ii£电厂 rsspo0 Shew g St ur tuj^Shftw Ovsrvi 旦吨 "■*■ ■■■■! ■■■■ ■■■■ ■■ ■■ ■*■ ■ ■■■«■■■■ IKI■■■■:■■Er^wss... F 如直接叉掉。
1.2打开图片点击工具栏第一的图标" ope n docume nt点击0K 就行了。
L —a-」选择图片:i£-n F S S-2.设置标尺2.1设置标尺点击” Measure'。
Calibration(标度)f Spatial ,弹出设置标尺的对话框(如下图)Spatial Calibrati on 。
2.2给标尺命名点击对话框右下角"From resolution ”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)Sp刖id O卜疝阳,■汀if2.3设置标尺长度点击"Image”,出现一个白色的标尺,见下图,和" Scali ng”对话框,在"Scali ng"对话框内输入1 (对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)sJEr■■LG . DkV IiE*10/11/201511311:20LO.orv LBD鼠标右键点击,将标尺拖到图片标尺的位置, 见下图。
imageproplus教程

Image pro plus 教程1. 打开图片:打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框内输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框内点击“OK”。
回到“Spatial Calibration”对话框。
设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
如下图:Style:表示标尺样式,我一般用第一个。
Marker length:标尺长度,因为图片标尺是1um,刚才我们设置的标尺长度也是1um,所以这里标尺长度为1。
Image-Pro Plus数细胞

用Image-Pro Plus数细胞,自己总结的。
方法一:手工标点计数。
Measure/measurements,点measurements面板features工具第一列第二个create point feature,在图片窗口点选即可。
点软件主菜单下快捷工具按纽第二行那个像照相机的按纽(snap picture of image with measurement overlays)可以将标记了的图片以快照方式另存。
方法二:逐一定义AOI(area of interest)法。
点快捷工具按纽第一行13个(irregular AOI),弹出Magic ward或Trace,两者可互相切换。
Magic ward下,鼠标在图片窗口变成魔术棒,点击可大致沿细胞边缘选中。
再点快捷工具按纽第一行14个(Multiple AOI),选Add,再用魔术棒点下一个细胞,再Add,依次重复。
Measure/count/size,弹出的count/size面板,菜单栏点edit/convert AOIs to Objects,即在count/size面板上total count显示计数,图片同时显示计数标记。
这种方法的好处是选中的细胞可以用来测量,测量结果可以输出到excel作统计。
方法三:定义class,自动计数法。
Measure/count/size,弹出count/size面板,Intensity range selection区域内有三个选择:automatic bright objects和automatic dark objects分别定义灰度在128-255和0-128的对象,选中后点count即自动计数。
这多用于荧光照片。
点delete恢复到计数前。
更常用的是第一种选择:Manual,点select colors,弹出segmentation面板,选color cube based页,用吸管工具选取细胞色彩,相近色彩的细胞即自动被选中。
Image-ProPlus数细胞

用Image-Pro Plus数细胞,自己总结的。
方法一:手工标点计数。
Measure/measurements,点measurements面板features工具第一列第二个create point feature,在图片窗口点选即可。
点软件主菜单下快捷工具按纽第二行那个像照相机的按纽(snap picture of image with measurement overlays)可以将标记了的图片以快照方式另存。
方法二:逐一定义AOI(area of interest)法。
点快捷工具按纽第一行13个(irregular AOI),弹出Magic ward或Trace,两者可互相切换。
Magic ward下,鼠标在图片窗口变成魔术棒,点击可大致沿细胞边缘选中。
再点快捷工具按纽第一行14个(Multiple AOI),选Add,再用魔术棒点下一个细胞,再Add,依次重复。
Measure/count/size,弹出的count/size面板,菜单栏点edit/convert AOIs to Objects,即在count/size面板上total count显示计数,图片同时显示计数标记。
这种方法的好处是选中的细胞可以用来测量,测量结果可以输出到excel作统计。
方法三:定义class,自动计数法。
Measure/count/size,弹出count/size面板,Intensity range selection区域内有三个选择:automatic bright objects和automatic dark objects分别定义灰度在128-255和0-128的对象,选中后点count即自动计数。
这多用于荧光照片。
点delete恢复到计数前。
更常用的是第一种选择: Manual,点select colors,弹出segmentation面板,选color cube based页,用吸管工具选取细胞色彩,相近色彩的细胞即自动被选中。
image pro plus教程

Image pro plus 教程1. 打开图片:1.1 打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
1.2 打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺2.1 设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
2.2 给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)2.3 设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框点击“OK”。
回到“Spatial Calibration”对话框。
2.4 设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm 是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:2.5 将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
如下图:Style:表示标尺样式,我一般用第一个。
image pro plus教程
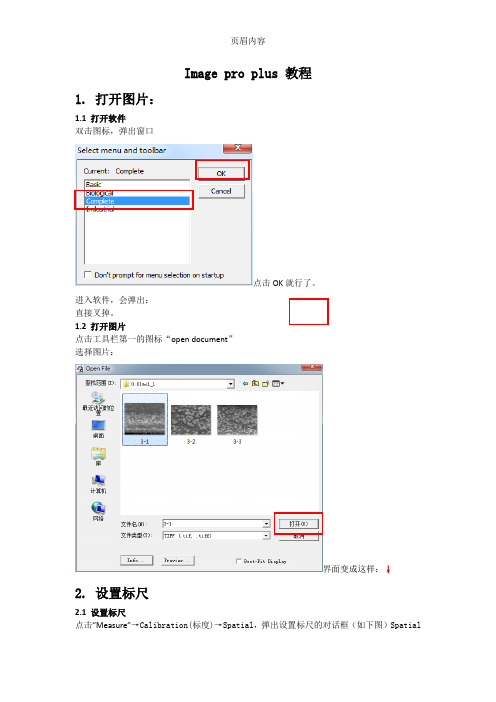
Image pro plus 教程1. 打开图片:1.1 打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
1.2 打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺2.1 设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)SpatialCalibration。
2.2 给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)2.3 设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框内输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框内点击“OK”。
回到“Spatial Calibration”对话框。
2.4 设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm 是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:2.5 将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
如下图:Style:表示标尺样式,我一般用第一个。
手把手教你使用Imagepro-Plus(1.入门

手把手教你使用Imagepro-Plus(1.入门)(修订0700905) - Welcome to Forum
mxh8174
2006-07-12 10:22
非常感谢,我已从网上下载下来了一个图像分析软件可是自己研究了好一阵还是一 头雾水,谢谢无私的奉献,使我有为实验节省了一点经费。祝工作顺利!
发贴: 2 积分: 0 得票: 0 状态: 离线
锦上添花:SCI论文修改润饰
举报
2006-04-21 07:54 陈老师,可否给我发一个中文说明书呢?英文水平太差了!感谢哦! andybalake@
• 国际著名遗传学家谈家桢院士迎来百岁华诞
举报
2006-04-22 17:23
jss2004
• 【交流】甘露醇的临床应用误区及经验
2006-09-22 15:59 受益非浅,谢谢
举报
发贴: 64 积分: 3 得票: 5 状态: 离线
• "星光灿烂"的大地
举报
/bbs/post/view?bid=10&id=3554359&sty=1&tpg=2&ppg=2&age=0(第 7/12 页)2008-9-20 7:55:05
SCI医学论文翻译
举报
/bbs/post/view?bid=10&id=3554359&sty=1&tpg=2&ppg=2&age=0(第 2/12 页)2008-9-20 7:55:05
手把手教你使用Imagepro-Plus(1.入门)(修订0700905) - Welcome to Forum
医学文献看不懂怎么办?
举报
2005-12-30 11:03
Imageproplus气孔率使用教程

ImageProPlus(IPP)软件教学
1.教学解决方向关键词:
金相组织、气孔率分析
2.具体教学:
2.1软件打开:
软件图标:
双击后,选择compelete,点击OK。
然后出现下图这个界面,点击Done,(这个没什么用,不用在意)
点击file选择自己的金相图片,如下图所示:
选择自己想统计的范围:
要了解一个这个软件的术语就是AOI(Area of interesting),即你感兴趣的地方。
如下图所示,我通常使用圆形,或者正方形。
规划好自己想统计的范围以后,点击下图所示按钮,count,即计算。
出现count/size 表格。
点击select colors
点击钢笔,选择气孔位置。
(由于是粗糙选择,可以放大以后精细的选一下)
随后点击close,关闭当前页面,回到count页面,点击count 按钮进行计算。
进行组织图片被识别:
点击Measure、select measerements
选择per Area,点击Measure
点击count界面中的View、Statistics
观察数据即可。
手把手教你使用Imagepro-plus(第二版)-A4双面大版

教你使用Imagepro Plus第二版作 者 hbchendl编辑 doctor_li目录第一篇 Imagepro plus基础入门 (1)1.图像分析入门 (1)2.图像分析软件-Imagepro plus (2)3.简单的测量操作过程 (3)4.选择测量对象的工具 (6)5.选择测量对象的工具(续) (9)6.简单的测量方法 (13)7.最重要的测量工具count/size (14)8.提高测量效率的必须技术-宏操作 (20)9.修饰图片 (22)10.计量-关于标尺的操作 (23)11.如何在图片上加标尺 (26)12.灰度相关的事 (29)第二篇 Imagepro plus应用实例 (30)1.细胞计数 (30)2.免疫组化照片密度分析 (32)3.免疫组化照片密度(自动)分析 (38)4.细胞核的免疫组化照片密度分析 (40)5.荧光强度分析 (41)6.合成荧光照片 (42)7.Western Blot照片的密度分析 (43)第一篇 Imagepro plus基础入门第一篇 Imagepro plus基础入门1.图像分析入门什么是图像分析?好象很多人对此还很糊涂呢,所以有必要首先回答一下这个问题。
图像分析就是通过分析图片的方法来测量图片上测量对象的测量数值。
举例来说吧,如果需要测量一个足球的直径,就可以使用一根皮尺,绕着足球最大周长量一下,得到最大周长的值,直径就是周长除以圆周率。
或者用一个大卡尺直接去量足球的直径。
这,叫作测量。
还有一个方法,在足球边上放一根直尺,然后用数码相机拍摄下足球与其旁边的直尺的照片,然后在图像分析软件上先测量照片上足球图像的直径,再与直尺图像进行比较,最后得到足球的实际直径尺寸数值。
这,叫作图像分析。
图像分析是一种间接的测量方法,在许多情况下,无法进行实际的测量时,使用图像分析的方法能有效地完成准确的测量。
采用图像分析的方法进行测量分析时,一般是下列这个过程:1.明确需要测量分析的对象。
(完整版)imageproplus教程

Image pro plus 教程1. 打开图片:1.1 打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
1.2 打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺2.1 设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
2.2 给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)2.3 设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框内输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框内点击“OK”。
回到“Spatial Calibration”对话框。
2.4 设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm 是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:2.5 将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
如下图:Style:表示标尺样式,我一般用第一个。
image proplus 操作规程

Image-Pro®Plus 6.0(IPP) 操作规程1.简介Image-Pro®Plus (IPP)是一款运行在windows操作系统环境的付费图像分析软件。
目前最新的版本是6.0。
该软件可分析常见格式的图像,如.jpg,.tif,.bmp等。
IPP可以用来分析图片中目标区域的多种参数,如数量,面积,长度,角度,光密度等。
通过该软件可以得到统计结果,并且可以直接将结果输出到Microsoft Office Excel。
2.系统要求IPP可以运行在目前windows各版本的操作系统中,如Windows 2000,XP,Vista和7. 至少需要奔腾三(1.0Ghz)处理器,512M内存(推荐1G),3G剩余硬盘空间。
3.工具使用IPP分析图片,最重要的是在图片上选取要分析的目标区域,该区域被称之为感兴趣的区域(Area of interest, AOI)。
在IPP中选取目标区域常用的工具有很多,我们在这里仅介绍分析Western Blot和RT-PCR图片使用到工具——Irregular Tool。
该工具有自动和手动两种方式,分别对应“Wand”和“Trance”。
3.1 开启Irregular Tool如图1所示,点击红圈处按钮,即可开启Irregular Tool。
图13.2 Wand开启“Irregular Tool”后,会出现图2中的工具框,此时显示“Trace”,对应的模式是“Wand”图2此工具的使用方法是用鼠标左键点击目标区域(如WB 中的条带),直至选中满意的目标区域为止。
软件会自动识别AOI,如果选中的AOI不能很好的覆盖目标区域,可以调节“Range”中的数字,一般来说条带越深该数字应越大,反之越小。
“Smooth”中的数字一般为1。
3.3 Trace对于界限模糊或者背景很深的图片,用“Wand”可能很难选到满意的AOI,这时可以使用手动选取AOI的工具“Trace”。
Imageproplus使用指南
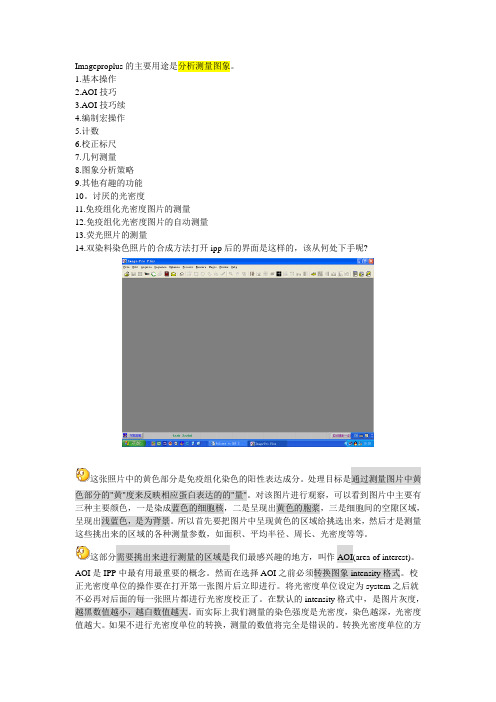
Imageproplus的主要用途是分析测量图象。
1.基本操作2.AOI技巧3.AOI技巧续4.编制宏操作5.计数6.校正标尺7.几何测量8.图象分析策略9.其他有趣的功能10。
讨厌的光密度11.免疫组化光密度图片的测量12.免疫组化光密度图片的自动测量13.荧光照片的测量14.双染料染色照片的合成方法打开ipp后的界面是这样的,该从何处下手呢?这张照片中的黄色部分是免疫组化染色的阳性表达成分。
处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的"量"。
对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,呈现出浅蓝色,是为背景。
所以首先要把图片中呈现黄色的区域给挑选出来,然后才是测量这些挑出来的区域的各种测量参数,如面积、平均半径、周长、光密度等等。
这部分需要挑出来进行测量的区域是我们最感兴趣的地方,叫作AOI(area of interest)。
AOI是IPP中最有用最重要的概念。
然而在选择AOI之前必须转换图象intensity格式。
校正光密度单位的操作要在打开第一张图片后立即进行。
将光密度单位设定为system之后就不必再对后面的每一张照片都进行光密度校正了。
在默认的intensity格式中,是图片灰度,越黑数值越小,越白数值越大。
而实际上我们测量的染色强度是光密度,染色越深,光密度值越大。
如果不进行光密度单位的转换,测量的数值将完全是错误的。
转换光密度单位的方法如下:点击:measure--carliberation--intensity,调出intensity校正窗口。
然后在窗口中点new 按纽,再点一下下面的std optical density选项,这时可以看到窗口中的直线变成了反向的曲线。
然后还要点一下最上面的system按纽。
最后点close关闭窗口。
这样就把程序系统的灰度单位转换成了光密度单位。
image-pro-plus教程

i m a g e-p r o-p l u s教程-CAL-FENGHAI.-(YICAI)-Company One1Image pro plus 教程1. 打开图片:打开软件双击图标,弹出窗口点击OK就行了。
进入软件,会弹出:直接叉掉。
打开图片点击工具栏第一的图标“open document”选择图片:界面变成这样:↓2. 设置标尺设置标尺点击”Measure”→Calibration(标度)→Spatial,弹出设置标尺的对话框(如下图)Spatial Calibration。
给标尺命名点击对话框右下角“From resolution”,见上图,将标尺命名为所选图片的名称,也可以点击“Name”右边的下拉箭头(见上图),选择已有的标尺(加入你的SEM图是5W倍的,而你之前处理过5W倍的图片,建立过5W倍的标尺,那么你就可以在下拉菜单里直接找出那个标尺)设置标尺长度点击“Image”,出现一个白色的标尺,见下图,和“Scaling”对话框,在“Scaling”对话框内输入1(对应图片的标尺是1um,如果你的图片标尺是100nm的话,此处应输入100)鼠标右键点击,将标尺拖到图片标尺的位置,见下图。
并调整标尺大小,使之与图片标尺一样大小。
在“Scaling”对话框内点击“OK”。
回到“Spatial Calibration”对话框。
设置标尺单位下面要设置标尺的单位。
因为我们选择的图片标尺是1um,这里我们要选择um 为单位。
点击“Spatial Calibration”对话框里的“Unit”下拉箭头,出现很多单位,其中um和nm是我们常用的。
如果你的标尺单位是nm,这里就要选择nm。
如下图所示:将标尺应用到图片上以上,我们设置好了标尺的长度和标尺单位,下面我们将标尺应用到我们的图片上面:在“Spatial Calibration”对话框点击“Apply”,再点击“Mark”,出现“Spatial Calibration Marker”对话框。
使用Imagepro plus脑片梗死体积测量)
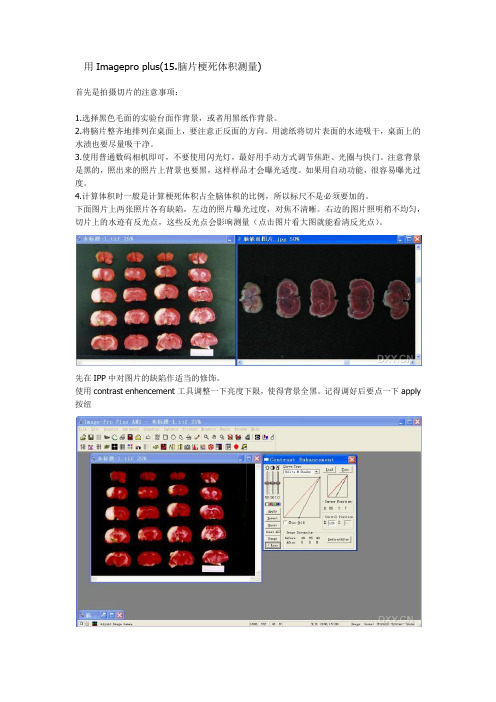
用Imagepro plus(15.脑片梗死体积测量)首先是拍摄切片的注意事项:1.选择黑色毛面的实验台面作背景,或者用黑纸作背景。
2.将脑片整齐地排列在桌面上,要注意正反面的方向。
用滤纸将切片表面的水迹吸干,桌面上的水渍也要尽量吸干净。
3.使用普通数码相机即可,不要使用闪光灯,最好用手动方式调节焦距、光圈与快门。
注意背景是黑的,照出来的照片上背景也要黑,这样样品才会曝光适度。
如果用自动功能,很容易曝光过度。
4.计算体积时一般是计算梗死体积占全脑体积的比例,所以标尺不是必须要加的。
下面图片上两张照片各有缺陷,左边的照片曝光过度,对焦不清晰。
右边的图片照明稍不均匀,切片上的水迹有反光点,这些反光点会影响测量(点击图片看大图就能看清反光点)。
先在IPP中对图片的缺陷作适当的修饰。
使用contrast enhencement工具调整一下亮度下限,使得背景全黑。
记得调好后要点一下apply 按纽用filter的median工具能有效去除那种细小而明亮的斑点现在可以测量了,先测量脑片本身的截面积。
使用segmentation选色时,只需选择I的值10-255就能把脑片从黑色背景中分离出来。
因为脑片本身是红色,所以使用绿色作标记色能够使选择更准确。
回到count/size上,点count,结果就有了。
这个图片上的效果只需在count窗口里的option中设置一下就行。
要注意右下角的样品与标记纸连到一起了,数据当然是错误的。
可以用count/size中的edit split 功能把它们俩分开。
右边的一些杂点就不管它们了。
由此可见,照片照干净点,测量起来会省很多事下一步再测量缺血部位的截面积。
缺血部位是白色,亮度很高,所以简单选择I的下限为一个较高的值就能选择到回到count/size窗口点count,这回会测量出很多区域,有一些并不是缺血区域。
把图片放大一点,用edit toggle工具把那些错误的区域删除掉。
手把手教你使用Imagepro-Plus
hbchendl
发贴: 958 积分: 79 得票: 32 状态: 离线
(缩略图,点击图片链接看原图)
hbchendl edited on 2007-03-07 20:27
• 国际著名遗传学家谈家桢院士迎来百岁华诞 2005-06-09 10:24
举报
这张照片中的黄色部分是免疫组化染色的阳性表达成分。处理目标是通过测量图片中黄色部分的"黄"度来反映相 应蛋白表达的的"量"。
打印话题
寄给朋友
手把手教你使用Imagepro-Plus(1.入门)(修订0700905) [精华]
dl
2005-06-09 10:01
1234567
发贴: 958 积分: 79 得票: 32 状态: 离线
Imageproplus的主要用途是分析测量图象。本人使用该程序进行生物图象分析有一段时间,写此帖的主要目的还 是与大家交流使用心得。并总结一下使用方法。看过火锅的多个帖子,大受教益,也在此班门弄斧,希望能与大 家各得其需。混点积分。首先要感谢火锅。我这里的一些内容"抄袭"了他的作法。其次要感谢super270,别看他 发言不多,但一说话就击中要害,此乃真人不露相也。特此致谢各位。 如果你是刚接触IPP,最好先从本帖看起,并同时打开你电脑上的IPP程序照着操作。学会一个软件需要花一段时 间的,两分钟不可能学会。两小时也太短。但我相信,照着我这几个帖子作下来,至少是可以用IPP干一点事情 了。 看完这一主题后,再请继续看下行链接的帖子。以后还将继续有新的帖子。 2.AOI技巧 /bbs/post/view?bid=10&id=3560052&sty=1&tpg=1&age=0
Image pro plus使用教程

Image Pro Plus使用方法(ipwin32) 陈冠-中南大学材料院一、添加标尺1.首先打开一张图片,选择Measure→Calibration→Spatial界面如下所示。
2.点击New→Name(可以按照倍数命名,如1000x)→Unit(μm)→Pixels/Unit(选择Pixels/unit)→Image(第一个),得到右图界面。
在Scaling界面点击,出现Local Zoom界面,此界面可以显示标尺摆放的细节。
.3.将绿色工字型摆放到图片标尺处,然后将Scaling界面的10μm改成100μm,然后点击OK。
关掉原来的页面就行了。
4.标尺已经新建好了,下次使用前把标尺调出来就行了。
点击,选择需要的标尺。
每次打开新图片,都要重新选择标尺。
二、定量分析1.打开一张图片,点击,出现如下页面。
2.点击,出现如下页面。
此时是系统默认的选取颜色,你也可以点击,然后重新拾取自己想要统计的颜色。
然后点击close,在count/size界面点击count进行计算。
3.count/size界面,选择measure的选项。
点击select measurements...左侧有相关选项,包括area、diameter等测量选项,点击后会出现在右侧窗口,然后选择measure就返回到count/size界面。
查看相关结果,如下所示。
选择statistic,4.有时统计的时候部分孔粘合在一起,可以通过“count/size--Eidt---watershed split”将其分开,同样可以通过view查看数据结果,但是此时不能再点击count,否则又会合并在一起。
5.过滤(除去不合适的)就是把部分不需要的过滤掉,过滤的标准可以选择很多,比方说太小或者太大、不圆等等均可以过滤掉。
例如,在filter ranges 中选择area识别过滤(或者其他过滤标准),然后调整下面start和end,然后点击measure即可,通过图片窗口可以查看到过滤后的情况通过蓝色区域读取过滤的信息。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Imageproplus的主要用途是分析测量图象。
1.基本操作2.AOI技巧3.AOI技巧续4.编制宏操作5.计数6.校正标尺7.几何测量8.图象分析策略9.其他有趣的功能10。
讨厌的光密度11.免疫组化光密度图片的测量12.免疫组化光密度图片的自动测量13.荧光照片的测量14.双染料染色照片的合成方法打开ipp后的界面是这样的,该从何处下手呢?这张照片中的黄色部分是免疫组化染色的阳性表达成分。
处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的"量"。
对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,呈现出浅蓝色,是为背景。
所以首先要把图片中呈现黄色的区域给挑选出来,然后才是测量这些挑出来的区域的各种测量参数,如面积、平均半径、周长、光密度等等。
这部分需要挑出来进行测量的区域是我们最感兴趣的地方,叫作AOI(area of interest)。
AOI是IPP中最有用最重要的概念。
然而在选择AOI之前必须转换图象intensity格式。
校正光密度单位的操作要在打开第一张图片后立即进行。
将光密度单位设定为system之后就不必再对后面的每一张照片都进行光密度校正了。
在默认的intensity格式中,是图片灰度,越黑数值越小,越白数值越大。
而实际上我们测量的染色强度是光密度,染色越深,光密度值越大。
如果不进行光密度单位的转换,测量的数值将完全是错误的。
转换光密度单位的方法如下:点击:measure--carliberation--intensity,调出intensity校正窗口。
然后在窗口中点new 按纽,再点一下下面的std optical density选项,这时可以看到窗口中的直线变成了反向的曲线。
然后还要点一下最上面的system按纽。
最后点close关闭窗口。
这样就把程序系统的灰度单位转换成了光密度单位。
然后就是如何能够准确地选取AOI就是使用IPP的关键操作。
一旦准确地选取了AOI,下面的测量分析就好办了。
在其他的测量软件中,选择这种不规则的区域一般只能用手拖着鼠标来画,而在IPP程序里,可以通过设置颜色范围让电脑来帮助你选择这些不规则区域,这样的选择就准确多了。
可以说,使用IPP的要点就是灵活地使用各种AOI工具准确地把那些需要测量的区域给挑选出来。
对不同的图片,需灵活地使用各种适当的AOI工具,先用最简单的,当然,简单的工具只能作简单的事,就这张图片来说,用简单工具选黄色有点困难,我们先用它来选择蓝色的细胞核吧。
点击measure---count/size,弹出分类测量窗口。
在窗口中选中manual,再点击select color,弹出颜色选择窗口segmentation,这个工具是IPP最有特色的颜色选取工具之一。
用好这个工具是使用IPP的要点。
对于目标颜色鲜明的图片,用吸管工具是最简单的。
点一下吸管图标,在目标区域点一下,就可以选中该点的颜色,当然一下是不可能完全选中所需要指定的全部区域,可以在未选中的地方接着再点,这样多次选取,直到把想选中的区域全部选中为止。
在这张示例图中,选中的蓝色细胞核部分被标上了红色。
用红框圈起来的四个工具按纽分别是:吸管、撒消上一步操作、橡皮擦、全部清除。
下在的小方框里则是吸管位置的选取颜色。
图片中被标上红色的区域被定义为一个class,其中每一个独立的小区块被定义为这个class中的一个object。
以此图为例,图中深蓝色的部分是细胞核,因此所有的细胞核都被选中成一个class,其中每一个细胞核就是一个object。
选取完AOI后,点击close回到count/size窗口,下一步就可以对选中的object进行测量操作了。
点击count/size窗口中的measure菜单,点select measure,这是选择要进行何种测量操作,在弹出的测量选择窗口左侧列出了各种可用的测量选项,最常用的测量有:area面积、density(mean)平均光密度、diameter直径、IOD(integrated optical density)累积光密度。
在相应的项目上点一下,该测量项目就被选到中间的窗口中了,同时关于该测量的详细说明会显示在最右边。
如果想取消某个已选中的测量项目,则在左边窗口中该项目上再点击一下就可以了。
选好了待测量的区域,也指定了测量项目,就可以进行测量统计了,点击一下测量选择窗口的OK纽,关闭这个窗口,就回到了count/size窗口,再点击一下count按纽,就可以看到程序在进行测量,稍等几秒钟即可读取测量数据。
分别点击count/size窗口中view菜单中的measurement data和statistics,就分别弹出这两个数据窗口。
前者是这个calss中每一个object的测量数据,后者是这些测量数据的统计参数,如总数、平均值、累加、标准差等。
本例中得到的就是每个细胞核的面积、平均光密度值、直径、累积光密度值。
统计数据则可得到这张图片中所有细胞核的平均面积、平均光密度值,平均直径、累积光密度值,当然还有细胞核的数目,就是所有object的数目。
测量数据转入EXCEL处理起来最方便。
只要在数据菜单中点file - DDE to EXCEL。
数据就传到EXCEL的sheet1里去了。
在这个示例图片的统计数据中samples为图中所有细胞核的个数。
第一列为area,其中的Mean值为各个核的平均面积,后面就是平均灰度、平均直径,这些是有意义的测量统计数值。
但IOD却是SUM值更有意义。
AOI技巧在IPP中,最有特色,最有用处的工具有两个。
一个就是我们已经看过的segmentation 工具,另一个是irregular工具。
我们先看irregular工具。
这是一个用来描绘不规则孤立对象边界的工具。
图中一个个棕黄色形状是免疫组化染色的贴壁培养细胞,为了计算每个细胞的面积及蛋白表达,首先就是要选取每个细胞的边界线。
这就可以用到irregular工具了。
在工具栏上点一下那个不规则园形的按纽,就调出了irregular工具条。
这个工具的标题叫Magic wand,就是photoshop中的魔棒呀。
将鼠标移至图中一个细胞的中间,光标就变成魔棒了,在一个位置左键点一下,就选中了这个位置及其周围灰度相似的区域。
这里"相似"的定量范围由Range的值来决定。
较大的值为较大的灰度范围,点一下能选中一大片区域。
较小的range值则为较小的灰度范围。
在一个区域上多点几下,就能选中这个区域的整个边界了。
最后点一下右键,就确定了一个不规则形状的选定区域。
点一下左边的问号,就能看到相应的使用说明。
smooth值是用来平滑区域边界的。
一般不需要平滑,因此默认值为零。
选中一个区域后如果还要在同一张图片上再选另一个区域(最后点一次右键),不能直接点选,要先点击一下工具栏上的Multiple AOI按纽,再点击add,接下去就可以到另一个选择区域点选。
选好一个新的区域后再回去点Multiple AOI--add确认,再继续下一个,直到选取完所有的AOI。
最后在图片上任一处点一下右键结束选择操作。
结束后如果又想再增加选择区域,只要再点一下newAOI按纽,就可以调出工具条继续增加选择区域。
这个irregular工具还有另一个操作方式,在问号旁边有个trace按纽,点一下它,工具条就变成另一个样子了。
这种操作方式是沿着孤立图像的边缘寻迹,从而画出一个沿着孤立形状边缘围成的一个AOI。
第一种是手画法。
确认工具条右边的Auto选项没有打勾,将光标移至目标图形处按住左键拖出一个闭合图形,点右键结束。
用鼠标画当然是不会准确的。
实在没别的招了才会出此下策。
第二种方法是自动寻迹。
把那个Auto给选上,speed值给减到1(慢速看得清楚),在目标图形的边缘处左键点一下鼠标,然后沿着边缘稍移动一下鼠标后再点击一下左键,这是给程序指明一个寻迹的方向,马上就能看到光标自动沿着边界走起来了,一直会走到起点处才会停止。
这样就自动围成了一个闭合区域,点一下右键就确认了这个AOI。
重复选取多个AOI的方法与楼上一样。
如果目标图形边界清晰,那么这个工具是非常管用的。
可惜的是在许多情况下边界是模糊不清的,光标走到此处时会乱走一气。
这时就要及时先点一下鼠标使光标暂停下来,然后在期望的方向延长再点一下左键,给程序指明一下前进的方向,如此多次,直到光标回到起点为止。
最后点一下右键围成一个闭合的AOI。
围好的AOI边界是绿色框。
自动寻迹挺好玩吧?不过别忘了我们的目的。
选好了一个个的AOI后当然是要测量每个区域的几何尺寸及光密度啦。
下面该怎么作呢?点开count/size窗口,点菜单EDIT---convert AOI to Objects.这样就把刚才选中的一个个AOI变成了要测量的object了,那些小区域的颜色也由AOI绿色外框线变成了object的标记了。
object的标记类型是可以自己设定的。
在count/size窗口右边有一个option按纽,点开它就能设定object标记的外观了。
在option窗口中,outline style可以选outline(轮廓线)或filled(填充class颜色)。
label style 可以选择为object序号或测量值。
再下面是label的文字颜色。
右上角还有一个class的颜色选择按纽。
下一步是点measure菜单下的select measurements。
选上要测量的项目。
注意,选完后要点击这个菜单中的measure按纽(而不是count/size窗口中的count按纽)。
然后是OK按纽关闭measure窗口,点开view菜单下的measurement date和statistics数据窗口。
几个object 的测量数据就已经在里面了。
如果你还想继续增加objcet,可以直接用irregular工具画AOI,然后点convert AOI to object。
这期间把数据窗口留着不关闭,可以看到新增的object测量数据会立即被更新。
在上一主题中讨论的主要是irregular工具,它对于大个的孤立图形对象的选取是有用的。
而面对组织切片中密密麻麻的细胞,就得用本主题讨论的segmentation工具了。
实际上,在第一部分入门中所用的就是segmentation工具,在那里我用颜色吸管选取了图片中蓝色的细胞核,但是如果仔细观察一下选取的效果就会发现,有一些挨在一起的两个以上的细胞核被识别成了一个,另有一些蓝色的杂质颗粒被错误地识别成了细胞核。
如果你试着用吸管工具选取一下图中黄色的免疫反应表达区域,就会发现因为黄色很浅,很不容易准确地选取。
