高中化学必修一物质的量练习题(有答案)
人教版高中化学必修一物质的量同步试题(含有答案)

高中化学学习材料金戈铁骑整理制作§1-2物质的量(1)一、选择题1.下列叙述正确的是( )A .每摩尔物质约含有6.02×1023个粒子B .摩尔是七个基本物理量之一C .摩尔是物质的质量单位D .摩尔是物质的数量单位解析:根据物质的量的概念要点分析,每摩尔物质约含有6.02×1023个粒子,故A 项正确;物质的量是七个基本物理量之一,摩尔是其单位,故B 项错;摩尔是物质的量的单位,而不是质量和数量的单位,质量的单位是kg ,数量是一个值,无单位,故C 、D 两项均错。
答案:A2.(双选题)下列说法正确的是( )A .H 2的摩尔质量是2 gB .1 mol H 2O 的质量是18 gC .氧气的摩尔质量是32 g·mol -1D .2 g H 2含1 mol H解析:摩尔质量的单位是g·mol -1,故A 项错误,C 项正确;1 mol H 2O 的质量是18 g ,故B 项正确;2 g H 2的物质的量是1 mol ,含有2 mol H ,故D 项错误。
答案:BC3.设N A 为阿伏加德罗常数的值,下列说法错误的是( )A .32 g O 2所含的原子数目为N AB .0.5 mol H 2O 含有的原子数目为1.5 N AC .1 mol SO 2含有的SO 2分子数目为N AD .0.5 N A 个Cl 2的物质的量是0.5 mol 解析:32 g÷32 g/mol =1 mol ,故32 g O 2所含分子数为N A ,原子数为2N A ,A 项错误。
答案:A4.下列物质含分子数最多的是( )A .0.8 mol SO 2B .1.806×1022 H 2OC .11.2 g COD .32 g SO 2解析:根据公式计算,B 项是0.3 mol ,C 项是0.4 mol ,D 项是0.5 mol 。
答案:A5.1 mol MgSO 4·7H 2O 含有结晶水的质量为( )A .16 gB .18 gC .112 gD .126 g答案:D6.在0.1 mol Na 2SO 4中所含Na +数目为( )A .6.02×1022 个B .1.202×1023 个C .0.1个D .0.2个解析:0.1 mol Na 2SO 4中含Na +0.2 mol,0.2×6.02×1023=1.204×1023个。
高考化学物质的量的综合题试题及答案解析
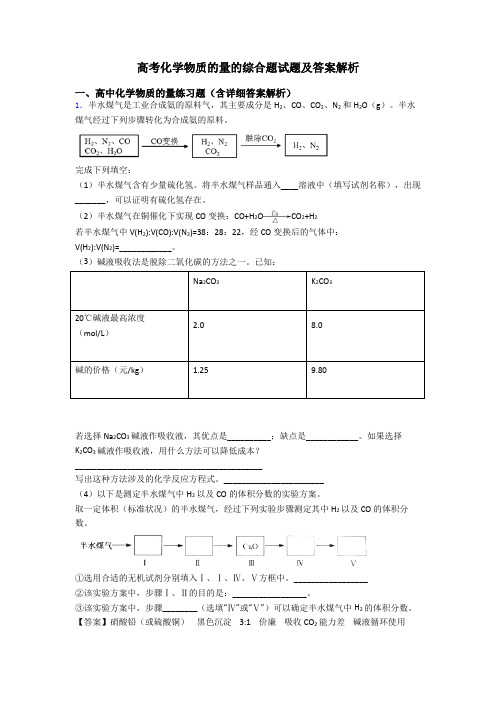
高考化学物质的量的综合题试题及答案解析一、高中化学物质的量练习题(含详细答案解析)1.半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。
半水煤气经过下列步骤转化为合成氨的原料。
完成下列填空:(1)半水煤气含有少量硫化氢。
将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O CO2+H2若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。
已知:Na2CO3K2CO320℃碱液最高浓度(mol/L)2.08.0碱的价格(元/kg) 1.259.80若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。
如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?___________________________________________写出这种方法涉及的化学反应方程式。
_______________________(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
_________________②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
【答案】硝酸铅(或硫酸铜)黑色沉淀 3:1 价廉吸收CO2能力差碱液循环使用2KHCO3→K2CO3+CO2↑+H2O除去半水煤气中的CO2(包括H2S)和H2O IV【解析】【分析】【详解】(1)硫化氢能与重金属生成沉淀,所以将半水煤气样品通入硝酸铅(或硫酸铜)溶液中,出现黑色沉淀可以证明有硫化氢存在。
高考化学物质的量(大题培优)附答案解析

高考化学物质的量(大题培优)附答案解析一、高中化学物质的量1.在实验室里,用足量的浓盐酸与一定量的高锰酸钾反应(不加热),来制取氯气。
反应:2KMnO 4+16HCl=2KCl+2MnCl 2+5Cl 2↑+8H 2O(1)“双线桥法”标出电子转移情况________ 。
(2)若生成2.24L 标准状况时的氯气,请计算(写出必要的计算过程):①理论上需要多少克KMnO 4参加反应?________。
②被氧化的HCl 的物质的量为多少?________。
【答案】 6.32g 0.2 mol【解析】【分析】(1)根据元素化合价升降数目等于反应过程中电子转移数目分析,标出电子转移情况;(2)先计算Cl 2的物质的量,然后根据方程式中KMnO 4、HCl 与Cl 2之间的反应转化关系计算。
【详解】(1)在该反应中,Mn 元素化合价由反应前KMnO 4中的+7价变为反应后MnCl 2中的+2价,化合价降低,得到5个电子,Cl 元素化合价由反应前HCl 中的-1价变为反应后Cl 2中的0价,化合价升高,失去2个电子,电子得失最小公倍数是10,所以KMnO 4、MnCl 2前的系数是2,HCl 前的系数是10,Cl 2前的系数是5,根据原子守恒,KCl 的系数是2,这样反应中有6个Cl 原子未参加氧化还原反应,所有Cl 原子都是由HCl 提供,因此HCl 前的系数为10+6=16,结合H 原子反应前后相等,可知H 2O 的系数是8,用“双线桥”表示电子转移为:;(2)在标准状态下, 2.24LCl 2的物质的量n(Cl 2)=m V 2.24L V 22.4L /mol=0.1mol 。
①根据反应的化学方程式可知:生成0.1molCl 2时,参与反应的KMnO 4的物质的量为0.1mol×25=0.04mol ,则参与反应的KMnO 4的质量m(KMnO 4)=0.04mol×158g/mol=6.32g ; ②由反应化学方程式可知,HCl 被氧化后生成Cl 2,因此根据Cl 元素守恒可知:被氧化的HCl 的物质的量n(HCl)氧化=0.1mol×2=0.2mol 。
2020-2021备战高考化学易错题专题复习-物质的量练习题含答案(1)

2020-2021备战高考化学易错题专题复习-物质的量练习题含答案一、高中化学物质的量练习题(含详细答案解析)1.(1)在标准状况下①6.72L CH 4②3.01×1023个HCl 分子③13.6g H 2S ④0.2mol NH 3,体积最大的是____,密最大的是度___,质量最小的是___,氢原子个数最多的是____。
(填写序号)(2)等温等压下,质子数相等的CO 、N 2两种气体,质量之比为____,体积之比为____,摩尔质量之比____。
(3)某物质在一定条件下加热分解,产物都是气体。
分解方程式为:3A =B +3C +2D 。
测得生成的混合气体的平均相对分子质量为2a ,则A 的摩尔质量为____。
【答案】② ② ④ ① 1:1 1:1 1:1 4a g/mol【解析】【详解】(1)①6.72L CH 4中:n(CH 4)= 6.72L 22.4L/mol=0.3mol ,m(CH 4)=0.3mol×16g/mol=4.8g ,ρ(CH 4)= m m M 16==g/L V V 22.4,N(H)=4N(CH 4)=1.2N A ; ②3.01×1023个HCl 分子中:n(HCl)=23233.01106.0210⨯⨯=0.5mol ,V(HCl)=0.5mol×22.4L/mol=11.2L ,ρ(HCl)=m m M 36.5==g/L V V 22.4,m(HCl)=0.5mol×36.5g/mol=18.25g ,N(H)=N(HCl)=0.5N A ; ③13.6g H 2S 中:n(H 2S)=13.6g 34g/mol=0.4mol ,V(H 2S)=0.4mol×22.4L/mol=8.96L ,ρ(H 2S)= m m M 34==g/L V V 22.4,N(H)=2N(H 2S)=0.8N A ; ④0.2mol NH 3中:m(NH 3)=0.2mol×17g/mol=3.4g ,V(NH 3)=0.2mol×22.4L/mol=4.48L ,ρ(NH 3)= m m M 17==g/L V V 22.4,N(H)=3N(NH 3)=0.6N A . 所以:体积最大的是②,密度最大的是②,质量最小的是④,含氢原子数最多的是①; (2)CO 、N 2两种气体涉及的元素有C 、O 、N 质子数分别为6、8、7,所以两种气体的分子的质子数分别为:14、14,质子数相等的CO 、N 2,物质的量相等;CO 、N 2摩尔质量分别为28g/mol 、28g/mol ,故摩尔质量之比1:1;根据m=nM 知:质量之比与摩尔质量成正比为28:28=1:1;根据阿伏伽德罗定律,相同条件下物质的量相等的气体具有相同的体积,故体积之比为1:1;(3)化学方程式系数的意义:表示物质的量。
高一物质的量练习题及答案

高中化学必修一《物质的量综合复习题》1.下列叙述中,正确的是()A.12g碳所含的原子数就是阿伏加德罗常数 B.阿伏加德罗常数没有单位C.“物质的量”指物质的质量D.摩尔表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒2.下列说法正确的是()A.1 molH2的质量是1 g B.1 mol HCl的质量是36.5 g·mol-1C.Cl2的摩尔质量等于它的相对分子质量 D.硫酸根离子的摩尔质量是96 g·mol-1 3.下列说法错误的是()A.1 mol 氢B.1 mol 的氧原子C.1 mol 二氧化碳D.1 mol水4.下列各组物质中,含原子数最多的是()A.0.4 mol NH3B.4℃时5.4 mL水 C.10 g氖气 D.6.02×1023个硫酸分子5.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。
如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。
那么一个铅笔字含有的碳原子数约为()A.2.5×1019个B.2.5×1022个 C.5×1019个D. 5×1022个6.下列说法错误的是()A.6.02×1023是阿伏加德罗常数的近似值B.1 mol 12C的质量是12 gC.含有阿伏加德罗常数个粒子的物质就是1 molD.1 mol O2含有6.02×1023个氧原子7.下列物质里含氢原子数最多的是()A.1 mol H2 B.0.5molNH3C.6.02×1023个的CH4分子 D.0.3molH3PO48.0.1 mol NaHCO3中含有()A.0.2 mol Na+B.0.05 mol CO 23C.6.02×1023个 O D.0.1 mol H9.1g O2和1g O3相比,下列表述正确的是()A.所含分子数相同 B.所含原子数相同C.所含原子数不同 D.1g O3中所含分子数较多10. 2.16 g X2O5中含有0.1 molO,则X的相对原子质量为()A.21.6B.28C.14D.3111.某气体物质质量为6.4 g,含有6.02×1022个分子,则该气体的相对分子质量为() A. 64 B. 32 C.96 D.3212.如果1g水中含有n个氢原子,则阿伏加德罗常数是()A.1/n mol-1 B.9n mol-1 C.2n mol-1 D.n mol-113.①1molH2O约含个H2O;②1molO约含个e-;③2molH+约含个H+;④ 3× 6.02×1023个电子的物质的量是 mol e-;⑤1.204×1024个水分子的物质的量为mol。
人教版高中化学必修一《物质的量在化学实验中的应用》同步习题及答案

人教版高中化学必修一《物质的量在化学实验中的应用》同步习题及答案第二节化学计量在实验中的应用(第三课时)同步习题〖基础达标〗1.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的()A.②④⑥B③⑤⑥C.①②④D.①③⑤2.将VLHCl气体(STP)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为 ( )A.V/22400mol/L B.1000V/22.4mol/LC.V/22.4mol/L D.V/11.2mol/L3.下列溶液中的氯离子数目与50 mL 1 mol·L-1的AlCl3溶液中氯离子数目相等的是 ( )A.150 mL 1 mol·L-1的NaCl B.75 mL 2 mol·L-1的NH4ClC.150 mL 3 mol·L-1的KCl D.75 mL 2 mol·L-1的CaCl24.某10% NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20% NaOH 溶液的物质的量浓度为 ( )A.6.25mol/L B.12.5mol/L C.7mol/L D.7.5mol/L5.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是 ( )A.950mL,111.2g B.500mL,117gC.1000mL,117g D.任意规格,111.2g6.要配制物质的量浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是()A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mLC.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中7、在100ml水溶液里有5.85gNaCl和11.1gCaCl2,该溶液中c(Cl-)为()A. 1mol/LB. 2mol/LC. 3 mol/LD. 4mol/L8、将4gNaOH溶解在10ml水中,再稀释成1L,从中取出10ml,这10ml溶液的物质的量浓度是( )A.1mol.L-1B.0.1mol.L-1C.0.001mol.L-1D.10mol.L-19、0.5L1mol/LFeCl3溶液与0.2L1mol/LKCl溶液中的Cl-的数目之比为()A、1:3B、3:1C、5:2D、15:210、将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为()A、0.03mol/LB、0.3mol/LC、0.05mol/LD、0.04mol/11、(1)用18mol/L 的硫酸配制100mL 1.0mol/L 硫酸,若实验仪器有A.100mL 量筒B.托盘天平C.玻璃棒D.50mL 容量瓶E.10mL 量筒F.胶头滴管G.50mL 烧杯H.100mL 容量瓶 实验时应选用仪器的先后顺序是(填入编号) .(2)在容量瓶的使用方法中,下列操作不正确的是(填写标号).A.使用容量瓶前检查它是否漏水.B.容量瓶用蒸馏水洗净后,再用待配溶液润洗.C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm ~3cm 处,用滴管滴加蒸馏水到标线.D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm ~3cm 处,用滴管滴加蒸馏水到标线.E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.【能力提升】1.300mL 某浓度的NaOH 溶液中含有60g 溶质。
高考化学复习《物质的量》专项综合练习

高考化学复习《物质的量》专项综合练习一、高中化学物质的量练习题(含详细答案解析)1.(1)在标准状况下①6.72L CH 4②3.01×1023个HCl 分子③13.6g H 2S ④0.2mol NH 3,体积最大的是____,密最大的是度___,质量最小的是___,氢原子个数最多的是____。
(填写序号)(2)等温等压下,质子数相等的CO 、N 2两种气体,质量之比为____,体积之比为____,摩尔质量之比____。
(3)某物质在一定条件下加热分解,产物都是气体。
分解方程式为:3A =B +3C +2D 。
测得生成的混合气体的平均相对分子质量为2a ,则A 的摩尔质量为____。
【答案】② ② ④ ① 1:1 1:1 1:1 4a g/mol【解析】【详解】(1)①6.72L CH 4中:n(CH 4)= 6.72L 22.4L/mol=0.3mol ,m(CH 4)=0.3mol×16g/mol=4.8g ,ρ(CH 4)= m m M 16==g/L V V 22.4,N(H)=4N(CH 4)=1.2N A ; ②3.01×1023个HCl 分子中:n(HCl)=23233.01106.0210⨯⨯=0.5mol ,V(HCl)=0.5mol×22.4L/mol=11.2L ,ρ(HCl)=m m M 36.5==g/L V V 22.4,m(HCl)=0.5mol×36.5g/mol=18.25g ,N(H)=N(HCl)=0.5N A ; ③13.6g H 2S 中:n(H 2S)=13.6g 34g/mol=0.4mol ,V(H 2S)=0.4mol×22.4L/mol=8.96L ,ρ(H 2S)= m m M 34==g/L V V 22.4,N(H)=2N(H 2S)=0.8N A ; ④0.2mol NH 3中:m(NH 3)=0.2mol×17g/mol=3.4g ,V(NH 3)=0.2mol×22.4L/mol=4.48L ,ρ(NH 3)= m m M 17==g/L V V 22.4,N(H)=3N(NH 3)=0.6N A . 所以:体积最大的是②,密度最大的是②,质量最小的是④,含氢原子数最多的是①; (2)CO 、N 2两种气体涉及的元素有C 、O 、N 质子数分别为6、8、7,所以两种气体的分子的质子数分别为:14、14,质子数相等的CO 、N 2,物质的量相等;CO 、N 2摩尔质量分别为28g/mol 、28g/mol ,故摩尔质量之比1:1;根据m=nM 知:质量之比与摩尔质量成正比为28:28=1:1;根据阿伏伽德罗定律,相同条件下物质的量相等的气体具有相同的体积,故体积之比为1:1;(3)化学方程式系数的意义:表示物质的量。
高考化学考点复习《物质的量》真题练习含答案

高考化学考点复习《物质的量》真题练习含答案1.(2023年黑龙江省春季普通高中学业水平合格性考试)下列关于物质的量及其单位摩尔使用正确的是 A .1mol 钠原子B .1mol 香蕉C .1mol 铅笔D .1mol 大米 【答案】A【解析】物质的量是描述微观粒子的数目多少的物理量;香蕉、铅笔、大米均为宏观物质,不能使用物质的量描述;1mol 钠原子化学用语使用正确;故选A 。
2.(2023年江苏省普通高中学业水平合格性考试)N 2的摩尔质量为28 g·mol −1,下列说法正确的是 A .1 mol 氮原子的质量为28 gB .1 mol 氮气的质量为28 gC .1个氮分子的质量为28 gD .1 g 氮气的物质的量为28 mol 【答案】B【解析】A .N 2的摩尔质量为28 g·mol −1,1 mol 氮气中由2mol 氮原子,1 mol 氮原子的质量为-1228 g mol 1mol ⋅⨯=14g ,A 错误;B .N 2的摩尔质量为28 g·mol −1,说明1 mol 氮气的质量为28 g ,B 正确;C .1 mol 氮气含有N A 个分子,1个氮分子的质量为A 28g N ,C 错误; D .1 g 氮气的物质的量为-128 g mo l l 1g 1mo 28=⋅,D 错误; 故答案为:B 。
3.(2022年7月浙江省普通高中学业水平考试 )下列物理量的单位为“摩尔(mol)”的是A .质量B .物质的量C .时间D .温度 【答案】B【解析】A .质量的国际单位制单位是“千克”,故不选A ;B .物质的量的单位是“摩尔”,故选B ;C .时间的国际单位制单位是“秒”,故不选C ;D .温度的国际单位制单位是“开尔文”,故不选D ;选B 。
4.(2022年夏季山东普通高中学业水平考试)对于相同物质的量的2H O 和22H O ,下列说法错误的是 A .氧原子数之比为1:2 B .原子总数之比为3:4C .分子数之比为1:1D .质量之比为1:1 【答案】D 【解析】A .相同物质的量的2H O 和22H O ,分子数比为1:1,所以氧原子数之比为1:2,故A 正确; B .相同物质的量的2H O 和22H O ,分子数比为1:1,所以原子总数之比为3:4,故B 正确;C .相同物质的量的2H O 和22H O ,分子数比为1:1,故C 正确;D .相同物质的量的2H O 和22H O ,假设物质的量都是1mol ,1molH 2O 的质量为18g ,1molH 2O 2的质量为34g ,质量之比为9:17,故D 错误;选D 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的量练习题
一、选择题(每小题1~2个正确答案)
1、下列关于摩尔质量的说法正确的是()
A、氯气的摩尔质量是71克
B、氯化氢的摩尔质量为36.5 g/moL
C、1摩氢气的质量为2克
D、O2的摩尔质量为16 g/moL。
2、对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是()
A、含氧原子的个数比为2∶3
B、含硫元素的质量比是5∶4
C、含氧元素的质量比为5∶6
D、含硫原子的个数比为1∶1
3、1克氯气含有n个Cl2分子,则阿佛加德罗常数可表示为()
A、71n
B、(1/71)n
C、35.5n
D、(1/35.5).n
4、将a g氯化钾溶于1.8L水中,恰使K+离子数与水分子数之比为1∶100,则a值为()
A.0.745 B.0.39 C.39 D.74.5
5、在一定体积的容器中加入1.5 mol氙气(Xe)和7.5 mol氟气,于400 ℃和2633 kPa压
强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5 mol 氟气,则所得无色晶体产物中,氙与氟的原子个数之比是()
A.1∶2 B.1∶3 C.1∶4 D.1∶6
6、下列各指定粒子数目不等于阿伏加德罗常数值的是()
A.1 g H2所含的原子个数
B.4 g氦气所含的原子个数
C.23 g金属Na全部转变为金属离子时失去的电子个数
D.16 g O2所含的分子个数
7、过氧化钠与水反应时,氧化剂与还原剂物质的量之比是()
A.1:1 B.1:2 C.2:1 D.2:3
8、设N A表示阿伏加德罗常数,下列说法中正确的是()
A.N A个N2分子和N A个CO分子质量比为1∶1
B.1 mol H2O的质量等于N A个H2O质量的总和
C.在任何条件下1mol H2所含的原子数为N A
D.1 mol H2SO4中所含的粒子数目一定是N A
9、若某氖原子质量是a g,12C的原子质量是b g,N A是阿伏加德罗常数的值,下列说法正
确的是()
A.氖元素的相对原子质量一定是12a/b B.该氖原子的摩尔质量是a N A g C.Wg该氖原子的物质的量一定是W/(a N A)mol D.Wg该氖原子所含质子数是10W/a 10、a mol H2和2a mol氦气具有相同的()
A.分子数B.原子数C.质子数D.质量
11、下列说法错误的是()
A.1 mol任何物质都含有约6.02×1023个原子
B.0.012 kg12C约含有6.02×1023个碳原子
C.使用物质的量时,应用化学式指明粒子的种类
D.1mol H2的质量是1g
二、判断正误
1、摩尔是七个物理量之一()
2、摩尔是物质的质量单位()
3、摩尔是物质的数量单位()
4、1摩尔小麦含有6.02 ×1023个麦粒()
5、3 mol氢()
6、4.5 mol NH3( )
7.摩尔是国际科学界建议采用的一种物理量( ) 8.摩尔是物质的量的单位,简称摩,符号为mol ( ) 9.我们把含有约6.02×1023个粒子的任何粒子的集体计量为1摩尔( ) 10.1mol氧含6.02×1023个O2( )
三、填空题
1、1.5 mol H2SO4的物质的量为_____,所含H+的物质的量为____________.
硫酸根离子的物质的量为__________,所含硫酸分子的数目为_________.
2、1 mol CO和______mol CO2所含氧原子数相等?
3、0.5 mol H2O中有________mol原子.
4、0.2 mol Al2(SO4)3中含有Al3+mol、SO42-g。
5、8 g氧气为mol;0.1mol氧气共有mol电子。
6、已知铁的相对原子质量是56,则1个铁原子的质量是g。
7、在60 g碳中,所有碳原子的最外层电子数共为个,质子的总
数为个。
8、某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是,
该溶液中Na2SO4的质量为克。
9、与16 g氧气所含有分子数相同的氨气是g,与16 g氧气所含原子总数
相同的氨气是g。
10、已知1 mol Al 所含Al原子的个数为阿佛伽德罗常数,那么0.5 mol Al 所含Al原子的个数为,2 mol Al 所含Al原子的个数为。
11、9.03×1023个H2O的物质的量为.所含H的物质的量为所含氧原子的物质的量为.
四、计算题
1、2.3 g钠溶于多少克水中,才能使每10个H2O分子中溶有一个Na+
2、某物质中含有6.02×1022个Na+,则Na+ 物质的量为多少?
3、2.5 mol O2多少个O原子?
参考答案
二、1、错;2、对;3、错;4、错;5、错;6、对;7、错;8、对;9、对;10、错
三、填空题
1、1.5mol;3mol;1.5 mol;1.5 N A
2、0.5;
3、1.5
4、0.4;57.6
5、0.25;1.6
6、56g /N A
7、20N A;30N A 8、0.025mol;3.559、8.5;4.25
10、0.5N A;2N A 11、1.5 mol;3 mol;1.5 mol
四、解答题
1、19.8 g;
2、0.1mol;
3、5 mol。
