2 第八章 醇酚醚
第八章醇酚醚

+ HIO4
R C H O
+
H C R' +HIO3 + H O 2 O
三个或三个以上羟基相邻
R' R C CH CH2+ 2 HIO4 R C O R'
+H
C O
OH
+
H
C O
H
OH OH OH
酮
酸
醛
O C
OH C
羟基醛或 羟基酮 羟基酮也能被高碘酸氧化 α-羟基醛或α-羟基酮也能被高碘酸氧化 羟基醛
19
C
O
-COOH
或 CO2
R CH O
CH R' OH
+
HIO4
R
C O
OH
+
H
C O
R'
R CH OH
CH CHO + 2 HIO4 OH
R
C H+ H O
C OH + H O
C OH O
R CH OH
C O
CH2OH + 2 HIO4
R
C H + CO2 + H O
C O
H
不相邻的醇 R-CH-CH2-CH-R
7
为叔C或季 的醇, 或季C的醇 (1)β − C 为叔 或季 的醇,与HX反应时易发生分 ) 反应时易发生分 子重排
CH3 CH3 CH CH CH3 OH HBr CH3 CH3 CH CH CH3 Br + CH3 CH3 C Br CH2 CH3
解释: 解释:
CH3 CH3 C H CH CH3 OH
第八章 醇、酚、醚

2-丁醇(仲丁醇)
CH3 CH CH CH2 CH2 OH CH2 CH2 CH
2-甲基-1-丙醇(异丁醇)
CH3
3-丙基-2-己醇
9
2-甲基-2-丙醇 (叔丁醇)
芳醇的命名,把芳基作为取代基。 多元醇的命名,要选择含-OH尽可能多的碳链为主链,羟基的位次要标明。 例如:
H2C CH2 CH3 CH CH2 OH OH CH2 CH2 CH2 OH OH CH2 CH CH2 OH OH OH OH OH
H R sp3 C H
10 8.9 ° H
sp3 O
3 sp 杂化 O 原子为 3 由于在 sp 杂化轨道上有未共用电子对,
两对之间产生斥力,使得∠ C-O-H 小于 109.5 °
碳原子上电子密度较低,分子呈极性。
饱和一元醇通式
CnH2n+1OH,简写 ROH
4
命
名
根据分子中烃基的类别分为:脂肪醇、不饱和醇、脂环醇、芳香醇 (芳环侧链有羟基的化合物,羟基直接连在芳环上的不是醇而是酚)。
17
2) 醇与HX的反应为亲核取代反应,伯醇为SN2历程,叔醇、烯丙醇 为SN1历程,仲醇多为 SN1历程。
CH3 CH 3 OH + + HX CH3 C CH 3 质子化的醇 CH3 CH3 C CH3 CH3 CH3 C + + CH3 X 快 + OH2 慢 CH3 CH3 C + CH3 CH3 CH3 C CH3 X + H 2O + OH 2 + X -
CH 3 CH CH 2OH 异丁醇 CH 3 C OH CH 3 环己醇 OH 苄醇 CH 2OH
CH 3
CH 3
有机化学-第八章 醇酚醚考点

OH OH CH3 CH3 CH CH CH CH3
4-甲基-2,3-戊二醇
二、醇的物理性质
醇的沸点高于分子量接近的烷烃,因为:(1)醇的极性大于烷烃; (2)醇可形成分子间氢键。
CH3
δ+ δ-O
δ+
H
H
氢键
CH3
CH3
O
δ- H
O
O
H
H
O
CH3
氢键
氢键 CH3
醇分子间形成氢键示意图
2、酚与三氯化铁的反应(酚的鉴定)
OH
6
+ FeCl3
3-
O
Fe 6
紫色
多数酚可以与三氯化铁溶液作用生成有色物质,其颜色随酚结 构的不同而不同。
三氯化铁溶液可作为具有烯醇式结构化合物的定性鉴定试剂。
3、苯酚的取代反应
C–O键加强,–OH难取代
苯环被活化,邻对位易亲电取代
(苯环亲电取代反应无需催化剂)
CH3
+ C H 3 C OH
CH3
CH3
CH3
+ + C+
X-
H2O
CH3
CH3
CH3 C XCl CH3
决定亲核取代反应速度快慢的因素:
(1)X- 的亲核能力:I- > Br - > Cl所以反应活性:HI- > HBr - > HCl-
HI可以直接与醇反应, HBr需要在硫酸催化下发生反应,HCl 则在 无水ZnCl2的作用下发生反应。
发生酯化反应时,酸脱-OH,醇脱 – H。
CH3 O-H + HO-SO2OH
H2C OH
HC OH + HO-NO2
第八章醇酚醚

C-O键断裂 取代或消除
碱性
孤对电子
1. 氧孤对电子导致的化学性质——Lewis碱
①溶于强酸
ROH 浓H2SO4 ROH H
应用: 钼羊盐
稀释或受热
ROH
▪除去烷烃或卤代烃中的少量醇 ▪区分醇与烷烃、卤代烃
②与金属离子的络合
MgCl2•6ROH CaCl2•4ROH
结晶醇 (溶于水不溶于有机溶剂)
第八章:醇、酚、醚
一. 醇的分类与命名
1. 分类
①按羟基所连碳原子的类型分:
10 伯醇( RCH2OH ): CH3CH2OH
20 仲醇( R CH OH ): CH 3CHCH 2CH 3
OH
R'
OH
R
30 叔醇( R' C OH ):
R''
(CH3)3COH
②按羟基所连的烃基分:
饱和醇:
CH3CH2OH (CH3)3COH
不饱和醇:CH2=CHCH2OH
CH3C≡ CCH2OH
芳香醇:
CH OH 2
OH OH
CH OH 2
③按羟基的数目分:
一元醇C:H3CH2CH2OH
OH
二元醇:H2C CH CH3 OH OH
OH OH
三元醇:H2C CH CH 2 OH OH OH
2. 命名
①普通命名法
CH3CH2CH2OH 正丙醇
R C OH
*源自格式试剂
H3C C O + R MgX 干醚
H
H3C C OMgX H R
H2O
*源自羰基碳
R
*源自格式试剂
H
C CH3 OH
3. 醛、酮还原制醇
8章-醇酚醚

H2O + Na C2H5OH + Na
反应随R基团的增大而减慢
NaOH + 1/2 H2 C2H5ONa + 1/2 H2
HOH > CH3OH >1o醇 > 2o 醇 > 3o醇
2. 与氢卤酸的反应,断裂醇分子中的 C-OH 键
R-OH
A 活性
HX
RX + H2O
HI > HBr > HCl 这主要是依卤原子的原子半径所致,I 是最大,依次减小,
第八章 醇、 酚、 醚
1
醇 酚 醚可看成是水分子中的 H 被烷基,芳基取代的产物
如下图所示
R H O H Ar 2R
ROH ArOH ROR
醇 酚 醚
8.1
醇
醇的代表物,醇的分类及命名
醇的制备
醇的物理性质 醇的化学性质
硫醇(十二章部分内容)
3
一. 醇的代表物,分类及命名
CH3CH2OH
乙醇
CH3OH
OH OH OH
+ HO NO2 - 3 H2O HC H2C
H2SO4
三硝酸甘油酯是一种炸药,也是人药,治疗心肌病 从上面的例子中可以看出,醇出H,酸出OH。
例 2 烷基磷酸酯
HO ROH + HO P HO RO O HO P HO RO O + RO P HO RO O + RO P RO O
因此,实验室不能用氯化钙干燥醇类化合物。
四. 醇的化学性质
由于电负性的不同,如 O: 3.5; C: 2.5; H: 2.1
因而,在醇分子中,C-O 和 O-H 两种键均有极性,可发 生两种反应形式
第八章醇酚醚

O R2CHOH + CH3CCH3
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH R2CH=O + CH3CHCH3
反应方向的控制
减压蒸餾
-H2SO4
CH3OSO2OCH3 硫酸二甲酯
C2H5OH NaOH
甲基化反应
C2H5OCH3 + CH3OSO3Na + H2O
2oROH , 3oROH在硫酸作用下消除。
五 氧化反应
ROH
氧化剂 反应条件
产物
氧化剂
氧化剂
RCH2OH
RCHO
RCOOH
O
氧化剂
R2CHOH
RC R
O
H+
氧化剂
反应机理
C OH C OH
OH
CO
OH
C O I O-
O
OH
HO HO
I
OH O-
O
-2H2O
I = +7
-H2O
C=O + C=O + IO3-
I = +5
邻二醇被高碘酸氧化的分析
OH OH
OH
OH OH
OH
OH OH
?
OH
(CH3)3C
OH
OH
OH
-羟基酸、 -二酮、 -氨基酮、1-氨基2-羟基化合物也能发生类似的反应。
100%
Br
3oROH 、大多数2oROH和空阻大 的 1oROH按SN1机理进行反应。
高教版 有机化学 第八章 醇 酚 醚

C2H5ONa+H2
(C 2H 5O)2Mg+H 2
6CH 3CHCH 3 + 2 Al OH
[HgCl2或 AlCl3]
[(CH 3)2CHO] 3Al + 3 H 2 异丙 醇 铝
7
说明 R—OH H—OH 1)醇与金属反应比水与金属反应缓和一些。 2)醇(如甲醇的pKa=16) 的酸性比水的酸性 (pKa=15.4)稍弱,故醇不能使石蕊变红。和氢氧化钠 的作用也很难,是一个可逆反应。
OH OH Ph C C CH3 Ph CH3 Ph CH3 C C Ph CH3
+ H3O
Ph CH3 C C
O
Ph CH3
+ H3O O
25
O + H3O OH OH
Ph Ph OH OH + H 3O
O Ph Ph
26
5 欧芬脑尔(Oppenauer, R.V.)氧化
OH CH R1 R2 Al[OC(CH3)3]3 CH3COCH3 R1 O C OH
36
酚的命名
OH OH OH
Me CH3
间甲酚
CH3
C(CH3)3
对甲酚
3-甲基-4-叔丁基苯酚
O2N HO
OH
Cl H3CO
OH
HO
CO2H 对羟基苯甲酸
4-硝基间苯二酚 or 4-硝基-1,3-苯二酚
6-甲氧基-7-氯-2-萘酚 or 6-甲氧基-7-氯--萘酚
or 4-羟基苯甲酸
37
二、酚的物理性质
13
3)、与SOCl2、PCl3、PBr3、PCl5的反应
SOCl2
RCl + SO2 + HCl RX + H3PO3 (Br2 / P, I2 / P) RCl + POCl3
第八章醇酚醚

一. 醇
醇的分类
1、按烃基结构分为
饱和醇 CH3CH2CH2CH2OH 不饱和醇 CH2 脂环醇 芳香醇
OH
CH2OH
丁醇 CHCH2OH 烯丙醇 环戊醇 苯甲醇
2、按醇分子中所含羟基的数目分为
一元醇 二元醇
CH3 OH CH2 CH2
甲醇 乙二醇 丙三醇
多元醇 CH2 CH CH2
OH OH OH
OH OH CHO SO 3H COOH OH
对羟基苯磺酸
邻羟基苯甲醛
对羟基苯甲酸
三、酚的制备 1. 磺酸盐碱熔法
SO3Na
ONa
NaOH >300℃ (融 熔)
H+
OH
2. 氯苯水解法
O Na NaOH , 400℃
Cl
H+
OH
200atm
氯苯难以发生亲核取代,当卤原子的邻对 位有吸电子基团时,水解反应容易进行。
(二) 乙醇(CH3CH2OH) 俗称“酒精”
(三) 丙三醇(CH2OH—CHOH—CH2OH) 又称“甘油”
CH2 ONO2 CH CH2 ONO2 ONO2
阿尔弗里德.伯恩纳德 .诺贝尔(Alfred Bernhard Nobel) 诺贝尔的一生中 ,仅在英国申请 的发明专利就有 355项之多。
CH3CH3OH
Cu
250~350 ℃
CH3CHO + H2
CH3CCH3 + H2 O
CH3 CHCH3 OH
Cu
500 ℃ , 0.3 MPa
叔醇:分子中没有α-H,不发生脱氢反应。
三、几种重要的醇 (一) 甲醇(CH3OH)
又称“木醇”, 毒性大,误服10ml可致失明,误服30ml可致死亡 。
第八章醇酚醚习题答案
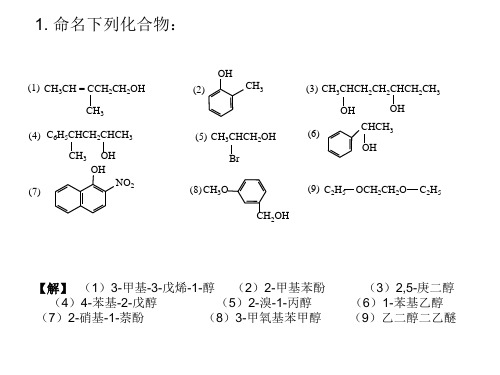
CH3 CH3 (8) CH3OCH2CH2OCH 3
3. 写出下列醇在硫酸作用下发生消除反应的产物: (1)1-丁醇 (2)2-甲基-2-丁醇 (3)4,4-二甲基-3-己醇 (4)3-甲基-1-苯基-2-丁醇 (5)1-乙基-3-环己烯-1-醇 【解】 这些醇在硫酸作用下发生消除反应,所得产物的结构 式如下:
(+) 蓝绿色,比苄醇慢
(2)CH3
OH OCH3 FeCl3
(+)显色
(-)
K2Cr2O7 H+
(-) 橙黄色 (+) 蓝绿色
CH2OH (3) CH3CH2CH2CH2Cl CH3CH2OCH2CH2CH3 CH3(CH2)4CH2OH AgNO3 C2H5OH
(-)
(+)白色↓ (-) (-) K2Cr2O7 H+ (-) 橙黄色 (+)蓝绿色
(1)
CH2OH
CHCH3 OH
C(CH3)2 OH CH2OH CH3(CH2)4CH2OH
(2) (3)
CH3
OH
OCH3
CH3CH2CH2CH2Cl CH3CH2OCH2CH2CH3
【解】 (1)
CH2OH C(CH3)2 OH CHCH3 OH K2Cr2O7 H+
(+) 蓝绿色
(-) 橙黄色
CH3CH2CH2CH2Cl CH3CH2C CH
KOH/醇
CH3CH2CH
KOH/醇
O (3) HOCH2CH (4) H2C C2H5ONa CH2 CHCH2Cl O2 /Ag 加压 Na NaOCH2CH CH2 HCN CHCH2Cl 醇 H2/Ni SOCl2
O
H2C
HOCH2CH2CN
【解】 (1)√ 分子间 (2)× (3)√ 分子间 (4)√ 分子内 (5)√ 分子 (6)√ 分子内 (7) × (8)√ 分子间
《医用化学》第八章

一、醇的分类和命名
(二)醇的命名
2.系统命名法
脂环醇的命名
以醇为母体,从羟基所连的碳原子开始编号,并使环上其他取代基 处于较小位次;而芳香醇的命名,则以侧链的脂肪醇为母体,将芳基作 为取代基。
OH OH
CH CH2 CH3
环己醇
1苯基1丙醇
一、醇的分类和命名
醚的 盐不稳定,与水发生水解,重新生成醚。
R—O—R′ + HCl
H [R—O—R′ ]+Cl
二、醚的性质
(二)醚的化学性质
2.烷基醚的氧化
含有α-H的烷基醚由于受烃氧基的影响,在空气中放置时会被氧 气氧化,生成过氧化物。该过氧化物性质不稳定,受热易分解而发生 爆炸。因此,在使用醚类时,应尽量避免将它们直接暴露在空气中。 贮存时应避光、密封,并可加入少量抗氧化剂。
一、酚的分类和命名
酚的命名
• 简单酚的命名是在“酚”字前面加上芳环的名称作为母 体,再在母体名称前标注取代基的位次、数目和名称。
• 多元酚命名时,要写出酚羟基的相对位置。 • 结构复杂的酚类可将羟基作为取代基来命名。
OH
OH
OH
OH
苯酚
CH3 2甲基苯酚
2萘酚
OH 1,2苯二酚
二、酚的性质
CH3 CH2 OH 乙醇(饱和醇)
CH2 CH CH2 OH 2丙烯1醇(不饱和醇)
一、醇的分类和命名 (一)醇的分类
根据分子中所含羟基数目的不同
CH3 CH2 OH 乙醇(一元醇)
CH2 OH CH2 OH 乙二醇(二元醇)
CH2 OH CH OH CH2 OH 丙三醇(三元醇)
一、醇的分类和命名 (一)醇的分类
第八章-醇酚醚2.

✓碱性:可以作为质子
的接受体。氧原子上 的未共用电子对与强 H O 2 + HC l H O 3++ C l
酸中的质子结合,故 醇可溶解于浓强酸中。R O H+H C l
R O H + 2+ C l_
✓ 与CaCl2成盐
钅羊离子
C aC l24C H 3O H C a C l24 C H 3 C H 2 O H
乙二醇 丙三醇
2021/3/16
9
② 按烃基结 构分类:
脂肪醇: 饱和醇:RCH2-OH 不饱和醇:CH2=CHCH2OH
芳香醇:
-CH2-OH
脂环醇:
-OH
2021/3/16
10
• 饱和醇
CH3CH2OH CH3—CH—CH3
OH
乙醇
异丙醇
新戊醇
OH
环己醇
• 不饱和醇 CH2=CH-CH2-OH CHC-CH2-OH
例:
乙二醇沸点:197℃ 甘油(丙三醇)沸点:290℃。
2021/3/16
23
醇的制法
➢ 烯烃水合 ➢ 硼氢化-氧化 ➢ 醛、酮、羧酸及其酯还原 ➢ 格利雅试剂 ➢ 卤烷水解
2021/3/16
24
醇的化学性质
•醇的性质主要是由它的官能团(—OH) 决定的。
• 烃基结构的不同也会影响反应性能,或 导致反应历程的改变:如分子重排反应。
2021/3/16
27
与活泼金属的反应
• 醇与水都含有羟基,都属于极性化合物,具有相似的性 质:如与活泼金属(Na,K,Mg,Al等)反应,放出氢气:
RCH 2O H+Na (CH 3)3CO H+K
第八章 醇酚醚

CH3CH2CH2CH2 OH + HCl
ZnCl2 CH3CH2CH2CH2Cl + H O 2 20℃ 常温无变化, 常温无变化,加热后反应
利用上述不同的反应速度, 区别伯、 叔醇。 利用上述不同的反应速度,可区别伯、仲、叔醇。只 适用于含六个碳原子以下醇的鉴别。 六个碳原子以下醇的鉴别 适用于含六个碳原子以下醇的鉴别。
苯酚分子中的p-π共轭体系 共轭体系 苯酚分子中的
由于p-π共轭,使苯环上电子云密度增加;酚羟基 共轭,使苯环上电子云密度增加; 由于 共轭 电子云密度增加 氢更易离去 。
2.酚的命名 .
酚的命名按照官能团优先规则。若苯环上没有比 酚的命名按照官能团优先规则。若苯环上没有比— OH优先的基团,则—OH与苯环一起为母体,环上其他 优先的基团, 与苯环一起为母体, 优先的基团 与苯环一起为母体 基团为取代基,按位次和名称写在前面,称为“某酚” 基团为取代基,按位次和名称写在前面,称为“某酚”。 例如: 例如: OH OH H3C CH3 NO2
第八章 醇 酚 醚
醇是烃分子中的氢原子被羟基取代的化合物; 是烃分子中的氢原子被羟基取代的化合物; 酚是芳环上氢原子被羟基取代的化合物;醚是醇或 是芳环上氢原子被羟基取代的化合物; 酚羟基上的氢被烃基取代的化合物。 酚羟基上的氢被烃基取代的化合物。 R—OH醇 Ar—OH 酚 R—O—R’醚 醇 醚
仲醇被氧化生成酮 叔醇在上述条件下不被氧化。 仲醇被氧化生成酮;叔醇在上述条件下不被氧化。 被氧化生成 在上述条件下不被氧化
四、重要的醇
1.甲醇 . 2.乙醇 .
它是应用最广的一种醇。 它是应用最广的一种醇。
3.乙二醇 . 4.丙三醇 .
丙三醇又名甘油,是重要的三元醇。 丙三醇又名甘油,是重要的三元醇。
有机化学第8章醇酚醚

8.7.1酚羟基的反响
8.7.1.1酸性
酚的酸性比醇强,但比碳酸弱
可以看出来,酚的酸性比醇和水强,所以酚能与强碱NaOH、KOH 反响而溶于其水溶液。但不溶于NaHCO3,不能与Na2CO3、NaHCO3 作用放出CO2,反之通入CO2于酚钠水溶液中,酚即游离出来。利 用酚的这种能溶于碱,而又可用酸将它从碱溶液中有离出来的性 质,工业上常被用来回收和处理含酚污水。 例如:
有机化学第8章醇酚醚
8.1 醇的构造、分类和命名
8.1.1醇的构造
氧上还有未共用的孤对电子,所以它是一个路易斯碱,还 可与强酸作用形成盐。它又是一个弱的亲核试剂,能发生 亲核取代反响。
8.1.2醇的分类
1、根据羟基所连碳原子种类分为:一级醇〔伯醇〕、 二级醇〔仲醇〕、三级醇〔叔醇〕。
2、根据分子中烃基的类别分为:脂肪醇、脂环醇和 芳香醇〔芳环侧链有羟基的化合物,羟基直接连在芳 环上的不是醇而是酚〕。
芳香混醚与浓HI作用时,总是断裂烷氧键,生成酚和碘代烷。
总结: ◆反响活性:HI>HBr>HCl ◆伯烷基醚按SN2机制断裂, ◆叔烷基醚按SN1机制断裂, ◆芳基烷基醚总是烷氧键断裂
8.11.3过氧化物的生成
醚对氧化剂比较稳定,但是,遇空气长期接触,却能被空气中 的氧逐渐氧化生成过氧化物。一般认为氧化是首先发生在
8.7.2.2硝化
邻硝基苯酚易形成分子内氢键而成螯环,这样就削弱了分子 内的引力;而对硝基苯酚不能形成分子内氢键,但能形成分 子间氢键而缔合。因此邻硝基苯酚的沸点和在水中的溶解度 比其异构体低得多,故可随水蒸气蒸馏出来。
8.7.2.3磺化
8.7.2.4 Reimer-Tiemann(瑞穆尔-悌曼)反响 8.7.2.5 Kolb-Schmitt(柯尔伯-施密特)反响
有机化学第08章__醇酚醚

例如: 化合物 乙 醇 丙 烷
M 46 44
b.p. (℃) 78.4 -42.1
b.p. (℃)
(2)同系列
直链 b.p. 支链
例如:正丁醇(118℃)和异丁醇(108.1℃); 直链:羟基在链端 b.p. 羟基不在链端 例如:正丁醇(118℃)和仲丁醇(99. 5℃)。
(3)—OH数目↑→ b.p.↑
C5以内的醇类,可以溶于卢卡斯试剂中,而反 应产物氯代烷是难溶于卢卡斯试剂中的油状液体, 因此反应体系中产生明显的浑浊或分层现象,标志 着反应的发生。C6以上的醇类,因本身不溶于卢卡 斯试剂,同样产生浑浊,以致无法判别反应与否。 利用伯、仲、叔醇的反应速率不同,可用该试剂来 鉴别三类醇。
醇的卤代反应是在酸催化下的亲核取代
第八章 醇酚醚
【本章重点】 醇酚醚的结构与性质 【必须掌握的内容】 1.醇酚醚的结构与性质。 2.醇的取代反应的试剂,条件,影响因素,生成物及其应 用; 3.醇的消除反应的试剂,条件,消除取向及影响因素; 4.酚苯环上的亲电取代反应。
第八章
醇(Alcohol) —OH
醇、酚、醚
醇、酚、醚都是烃的含氧衍生物。
CH3CHOH CH3CH2CH2CHCHCH2OH CH2 OH OH
3-丙基-1,2,4-戊三醇
CH2OH CH CH 2 OH
2-羟甲基-1,3-丙二醇
⑥多官能团化合物 多官能团化合物命名 时应选择优先官能团为主。主要官能团的优先 次序为: —COOH,—SO3H,—CN,—CHO, C O —OH(醇),—OH(酚), —NH2,
§8-1
1.分类
醇
同卤代烃
伯 1° 仲 2° 叔 3°
一、分类和命名
第八章-醇酚醚

2-乙基-2-丁烯-1-醇
2-苯乙醇
命名芳香醇时,将芳环作为取代基。
CH=CH
CH 2OH
CHCH 2OH CH 3
3-苯基-2-丙烯-1-醇(肉桂醇)
2-苯基-1-丙醇
命名多元醇时,主链应包含尽可能 多的羟基。
CH 3 CH 3CH OH CH CHCH 3 OH 3-甲基-2,4-戊二醇
CH 2 OH CH OH CH 2 CH 2 OH
CH3 O CH3 CH3CH2 O CH2CH3
二甲(基)醚
O
二乙(基)醚
二苯醚
两个烃基不相同时,脂肪醚将小的烃 基放在前面;芳香醚则把芳基放在前面
CH3 CH3 O CH CH3 CH3CH2 O CH CH2
甲基异丙基醚
OCH2CH3
乙基乙烯基醚
OCH3
苯甲醚
β—萘甲醚
系统命名法: 较长链为母体,有不饱和烃基时,选择 不饱和度较大的烃基为母体,烃氧基为取 代基。
CH3 O CH2CH2CH2CH3
1-甲氧基丁烷
CH3 O CH2CH2 O CH3
1,2-二甲氧基乙烷
CH3CH2CHCH2CH2CH3 OCH2CH3
3-乙氧基己烷
CH3CH2 O CH CH CH2 CH3
3-乙氧基-1-丁烯
对三、四元环环醚,以“环氧某烷”来命名。
CH2 O CHCH3
OH
一.酚的分类和命名
分类:根据羟基所连芳环酚类可分为苯酚、萘酚、 蒽酚;根据羟基的数目,酚类又可分为一元酚、 OH 二元酚和多元酚。
一元酚 二元酚 多元酚
OH
OH
OH OH
OH OH OH OH
OH
大学有机化学第八章 醇酚醚

2)生成酚醚
酚与醇相似,也可生成醚。但因酚羟基的C-O键比醇 牢固,所以不能直接失水成醚,而必须用间接的方法。 ONa CH3I ONa CH3OSO2OCH3
硫酸二甲酯
OCH3 NaI OCH3 CH3SO4Na
3)生成酚酯
又称阿司匹林,白色针 状晶体。是解热镇痛药, 酚与酰氯、酸酐等作用可以生成酚酯。 也用于防治心脑血管病。
醇的同分异构体中,直链醇的沸点比支链醇高。
R R O O H H O R H H O R
氢键
水溶性:C1~C3的醇可以任意比例与水混溶,C4以上的 醇随相对分子量的增加,在水中的溶解度明显 降低,C9以上醇实际上已不溶于水。 相对密度:饱和一元醇的相对密度小于1,比水轻。芳香醇和多 元醇的相对密度大于1,比水重。 生成结晶醇:低级醇能与某些无机盐类生成结晶醇。 例如:MgCl2· 6CH3OH、CaCl2· 2H5OH等。 4C 结晶醇可溶于水,不溶于有机溶剂。可以利用这一性质与 其他化合物分离,或从反应产物中除去少量醇类杂质。
无色或淡黄色晶体,有毒。 主要用作合成医药非那西丁 和扑热息痛的中间体,也用 作染料和杀虫剂1605的原料, 还可用作皮革防腐剂。
3)烷基化
OH OH
+
2 (H3C)2C
CH2
H2SO4
(H3C)3C
C(CH3)3
CH3
CH3
反应条件
又叫做防老剂264, 白色或微黄色晶体。 主要用作橡胶和塑料 得防老化剂,也可用 作汽油、变压器油的 抗氧剂。
COOH
COOH
OH + (CH3CO)2O
H2SO4 85℃
O
C O
CH3
+ CH3COOH
第八章 醇酚醚

取代酚的酸性
取代基 邻
表9.2 取代 酚的酸性常数
pKa (25℃)
间
对
取代基
―H ――CHC3l ――ONCOH23
9.89 9.89 9.89 10.29 10.09 10.26 8.11 8.80 9.20
7.22 8.39 7.15 9.98 9.65 10.21
2,4 –二硝基 2,4,6–三硝基
─OH,羟基(hydroxyl group)醇和酚的官能团
HO 连在饱和碳原子上-醇 氧原子sp3杂化 HO 直接连在芳环上-酚 氧原子sp2杂化
CH3CH2OH
乙醇
环己醇
2–苯基乙醇
苯酚
对甲酚
α –萘酚
8.1.1 醇和酚的分类
(b) 按与羟基相连的碳原子的种类
伯(1°)醇
仲(2°)醇
(c) 按与羟基相连的烃基
(苦味酸) (picric acid)
pKa (25℃)
3.96 0.38
取代基在邻、对位时: 供电子基使酚的酸性明显降低; 吸电子基团使酚的酸性明显增强。
35
8.6.2 酚醚的生成
36
8.6.3 与三氯化铁的显色反应
蓝紫色 绿色 蓝色
37
8.6.4 芳环上的亲电取代反应
• (1) 卤化 • (2) 磺化 • (3) 硝化 • (4) Friedel-Crafts反应 • (5) 与甲醛缩合——酚醛树脂及杯芳烃 • (6) 与丙酮缩合——双酚A及环氧树脂
醇与水,哪个酸性较强?
醇钠遇水即水解:
RO-Na+ + HOH
较强碱 较强酸
Na+OH- + ROH
较弱碱 较弱酸
工业分析技术专业《醇酚醚电子教材》

模块二 有机化合物性质单元八 醇酚醚醇、酚、醚是烃的含氧衍生物之一。
醇和酚的分子中均含有羟基〔—OH 〕官能团。
羟基直接与脂肪烃基相连的是醇类化合物,直接与芳基相连的是酚类化合物。
例如:OHOHOHCH 3CH 2OHCH 2OH醇 酚醚是氧原子直接与两个烃基相连的化合物〔R —O —R 、Ar —O —Ar 或R —O —Ar 〕,通常是由醇或酚制得,是醇或酚的官能团异构体。
一、醇醇是脂肪烃分子中的氢原子被羟基〔—OH 〕取代的衍生物,也可看作是水中的氢原子被脂肪烃基取代的产物。
〔一〕醇的分类和命名 1.醇的分类根据羟基所连烃基的结构,可把醇分为脂肪醇、脂环醇、芳香醇〔羟基连在芳烃侧链上的醇〕等。
例如:脂肪醇 脂环醇 芳香醇根据羟基所连烃基的饱和程度,可把醇分为饱和醇和不饱和醇。
例如:CH 3CH 2CH 2OH CH 2=CH —CH 2OH 饱和醇不饱和醇根据分子中羟基的数目,可把醇分为一元醇、二元醇和多元醇。
饱和一元醇的通式为C n H 2n2O 。
在二元醇中,两个羟基连在相邻碳原子上的称为邻二醇,两个羟基连在同一碳原子上的称为胞二醇〔不稳定〕。
例如:一元醇 二元醇 二元醇〔邻二醇〕根据羟基所连碳原子的类型,可把醇分为伯醇〔一级醇〕、仲醇〔二级醇〕和叔醇〔三级醇〕。
例如:CH 3CH 2OHOHCH 2CH 2OHCH 3CHCH 3OHCH 2CH 2OHOHCH 2CH 2CH 2OHOHRCH 2OHRCH 2CHR'OHRC R'OHR"123。
伯醇〔一级醇〕 仲醇〔二级醇〕叔醇〔三级醇〕2.醇的命名结构简单的醇可用普通命名法命名,即在“醇〞字前加上烃基的名称,“基〞字一般可以省去。
例如:CH 3CHCH 2OHCH 2=CH CH 2OHCH 3CH 3CH 2CHCH 3OH异丁醇 仲丁醇 烯丙醇 苄醇结构复杂的醇那么采用系统命名法命名。
首先选择连有羟基的最长碳链为主链,从距羟基最近的一端给主链编号,按主链所含碳原子的数目称为“某醇〞,取代基的位次、数目、名称以及羟基的位次分别注于母体名称前。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1°ROH >CH3OH
卢卡斯(Lucas)试剂:
浓HCl/无水ZnCl2
CH3 CH3 C OH + HCl CH3
ZnCl2 20℃
CH3 CH3 C Cl + H2O CH3 立即混浊分层
CH3 CHCH2CH3 OH
+
HCl
ZnCl2 20℃
CH3 CHCH2CH3 + H2O Cl
放置片刻混浊分层
75%H2SO4
CH3CH2CH2CH2OH
£ 140 C
Al2O3 350 C
CH3CH£ £CHCH3 CH3CH2CH=CH2
£
CH3 CH3-C CH-CH3 CH3 OH
Al 2O3 气相,
CH3 CH3-C CH=CH2 + H 2O CH3
(主要产物)
2. 分子间脱水 (亲核取代SN2,制备单醚)
OH + NaHC O 3
应用:可用于分离提纯有机化合物。 工业上利用苯酚能溶于碱,而又可用酸分离析出 的性质来处理和回收含酚废水。
?
如何除去环己醇中含有的少量苯酚?
酚羟基的邻、对位连有供电子基时,将使酸性↓;
相反,连有吸电子基时,将使酸性↑。
OH OH OH OH OH NO2 CH3 Cl NO2 NO2
酸性: H2CO3 > PhOH > H2O > ROH pKa : 6.38 ~10 14-15 15~19 故酚可溶于NaOH但不溶于NaHCO3,不能与Na2CO3、 NaHCO3作用放出CO2,反之通CO2于酚钠水溶液中,酚即游
离出来。
O Na + H2C O3 ( CO2 + H2O )
性质:如与活泼金属(Na,K,Mg,Al等)反应,放出氢气: HOH + Na NaOH + ½ H2 (剧烈)
R OH + Na
RONa +
1 2
H2
(缓和)
醇的酸性比水弱 醇的反应活性为: 甲醇 > 伯醇 > 仲醇 > 叔醇
ROH + 2 Na
2 RO Na
-
+
H +2
弱酸
强碱
RONa + H2O
C
+
E1
C H
C +
H+
C
C
O H2
醇的反应活性: 3°ROH> 2°ROH >1°ROH
CH3 浓H2SO4 CH3 C CH2 CH3 OH
CH3
CH3 C CH CH3
醇分子内脱水遵守查依采夫(Saytzeff)规则: 羟基与含氢少的β-碳原子上的氢脱去一分子水, 生成含取代基较多的烯烃。
若采用氧化铝为催化剂,醇在高温气相条件下脱水, 往往不发生重排。例如:
CH3CH2CH2CH2 OH + HCl
ZnCl2 CH3CH2CH2CH2Cl + H 2O 20℃
常温无变化,加热后反应
叔醇 仲醇 伯醇
立即浑浊分层
卢卡斯试剂
10min出现浑浊分层
加热后才反应
三、 与无机酸反应(SN反应)
O HO N O
硝酸
O HO S OH O
硫酸
O HO P OH OH
OH + Br2(H2O) Br Br OH Br + 3HBr
OH
20%HNO3 25℃
OH + NO2
OH NO2
OH + C6H13CO Cl
(1) AlCl3, 140 ℃ (2) H3O
+
OH CO C 6H13 +
OH
CO C 6H13
SO3H OH + H2SO4(浓
) 100℃ 25℃
C H3 C H3 C Br C H2 C H3
主产物
C H3 C H3 C H C H C H3 OH
H+
C H3 C H3 C H C H C H3
+
C H3
H2O
C H3 C
C H C H3
+
O H2
H 2° 碳正离子
Br
重 排
C H3 C H3 C
+
C H C H3 H
C H3
3° 碳正离子
O H
●●
O
H
SP2杂化
P-π共轭
a.C-O键加强,不发生OH的取代 b.O-H削弱,酸性比醇强 c.电子云向苯环转移,邻对位亲电取代活性增大 8.2.3 酚的物理性质
8.2.4 酚的化学性质
1. 酸性 (酚的酸性比碳酸弱)
O Na H2C O3 +
NaHCO 3
OH
NaOH
O Na + H 2O
氯化亚砜
ROH + HX
RX + H2O
醇与HX的反应 1. SN1: 烯丙醇、苄醇、叔醇、仲醇。
R R C R OH H
+
R R C R O H2
+
①
H2O
R R C R
+
②
X
R R C R X
C H3 C H3 C H C H C H3 OH
HBr
C H3 C H3 C H C H C H3 Br +
硫酸氢乙酯 乙 醚 脱 水
乙 烯
醇的脱水有两种方式,即分子内脱水和分子间脱水。
至于按哪种方式脱水,取决于醇的结构和反应条件。
• 温度的影响——低温有利于取代反应,分子间脱水生成醚;
高温有利于消除反应,即分子内脱水生成烯烃。
•
醇结构的影响——一般叔醇脱水生成烯烃。
五、 氧化与脱氢反应
1.氧化
H R C H OH R' R C H OH
SN2历程:
C H3C H2 OH
H+
C H3C H2
O H2
+
HO
C H2C H3 SN2
C H3C H2
O H
+
C H2C H3
H+
C H3C H2
O
C H2C H3
醇的分子间脱水一般不适合制备混醚。
<100℃ C H3C H2O H
H2SO4 140℃ 170℃
C H3C H2O S O 3H (C H3C H2)2O C H2 = C H2
烷基磷酸酯 -H2O
O ROPOH ROH OR
二烷基磷酸酯 -H2O
O ROPOR OR
三烷基磷酸酯
磷酸三丁酯可用作萃取剂、消泡剂和增塑剂等
四、脱水反应
1.分子内脱水反应(消除反应E1,制备烯烃)
CH3CH2OH
浓 H2SO4 170 ℃
H2C CH2
+ H2O
E1历程:
C H C OH
H+
C H
氧原子采取不等性sp3杂化,具有四面体结构:
O£ £2s 2p p
2
4
Ó » Ô ¯ s sp3
H
O R
H C H H sp
3
O H
由于氧的电负性大于碳,醇分子中的C-O键是极性 键,ROH是极性分子。
:
:
8.1.3 醇的物理性质
①
沸点:
与相对分子质量相近的其他有机物相比,醇的沸点较 高。如: £ CH3OH (M=32) b.p 65 C £ b.p=153.6 C £ CH3CH3 (M=30) b.p -88.6 C
磷酸
1.与硫酸的反应
O CH3OH + H2SO4 CH3OSOH O
硫酸氢甲酯
CH3OH
O CH3OSOCH3 O
硫酸二甲酯
硫酸二甲酯、硫酸二乙是常用的
合成洗涤剂之一。如 C12H25OSO2ONa(十二烷基磺酸钠)。
R H O H O R H R O H O R H R O H O R
②
溶解度:
醇在水中有一定的溶解度。3个C以下的醇与水 混溶,4个C以上的醇随C数↑,溶解度↓。
R O H O H H R O H O H H R O H O H H
甲醇、乙醇、丙醇都能与水混溶,混溶时有热量放出, 并使体积缩小。 多元醇分子中所含羟基越多,可以形成更多的氢键, 沸点越高,在水中的溶解度也越大。
CH3
异丁醇 2-甲基-1-丙醇 新戊醇 2,2-二甲基丙醇
(2) 系统命名法:
CH2OH
CH2=CH-CH2OH
2-丙烯-1-醇 (烯丙醇)
CH3 OH
CH3CH2CH2CH-CH-CH2CH3 CH=CH2 2-乙基-3-丙基-4-戊烯-1-醇
OH
CH3CHCH2CH2CHCH2CH3 OH OH
Br
C H3 C H C H C H3 Br
C H3 C H3 C Br C H2 C H3
(重排产物为主)
2. SN2:大多数伯醇,且没有重排反应。
RC H2 OH
H
+
R H RC H2 O H2
+
X
δ
X
C H
δ
O H2
H2O
X C H2R
反应活性: ① HI>HBr>HCl; ② 烯 丙 醇 ( 或 芐 醇 ) > 3°ROH > 2°ROH >
[O]
(常用的氧化剂:高锰酸钾、重铬酸钾、铬酸)
[O]
RCHO
[O]
RCOOH
R C R' O
OH R C R' R''
[O]
(—)
