2016澳洲国立大学化学
中外合作大学有哪些

中外合作大学有哪些2004年宁波诺丁汉大学学费8万元宁波诺丁汉大学(TheUniversity of Nottingham NingboChina,UNNC)成立于2004年。
中国政府定义学校为中外合作大学,英国政府定义学校为英国诺丁汉大学中国校区。
学校实行全英文教学。
教材及课程设置、师资、教学资源、教学质量保障体系、校园管理条例均采用英制。
颁发英国诺丁汉大学相同的文凭。
宁波诺丁汉大学是经中国教育部批准,由英国诺丁汉大学与浙江万里学院合作创办,在中国设立的第一家引进世界一流大学优质教学资源、具有独立法人资格和独立校区的中外合作大学。
学校由中国科学院院士、前复旦大学校长、前英国诺丁汉大学校长杨福家教授担任校长,尼可迈尔斯教授担任执行校长。
学校位于宁波市高教园区,占地面积887亩,建筑面积20万余平方米,截至2015年,在校生6000余人,教职员工600余人,来自于世界上70多个国家和地区。
学校面向全国28个省市进行高考招生,考生成绩要求在第一批录取分数线以上,且英语单科成绩不低于115分(江苏90分,海南630分)。
截至2015年,学校已建立社会科学学院、人文教育学院和理工学院三大学院,下设诺丁汉大学商学院(中国)、国际传播系、国际事务与国际关系系、英语系、经济系、教育学系计算机科学系和工程系等。
2005年北京师范大学-香港浸会大学联合国际学院学费8万元北京师范大学-香港浸会大学联合国际学院,即BNU-HKBU United International College,简称UIC。
2005年,UIC获教育部批准,由北京师范大学和香港浸会大学携手创立,建校于广东珠海,成为港陆合办第一校,也是中国第一所以博雅教育为理念的创新型大学。
成立至今,UIC已迅速发展成为一所拥有独特的教育理念的国际化大学。
学院设有工商管理、人文与社会科学和理工科技三个学部,下设二十个专业,在校生近四千七百人。
学院拥有一支来自二十多个国家和地区的优秀师资队伍,境外教师占所有教师比例逾77%。
澳洲最好的大学排名前十

澳洲最好的大学排名前十澳大利亚各著名城市都有哪些知名大学?对于一些赫赫有名的大学,你应该听说过。
在澳洲著名大学中,哪一所学校的排名是位居榜首的呢?下面是小编给大家整理的澳洲著名的大学排名,欢迎阅读。
澳洲著名的大学排名榜澳洲著名的大学排名1:澳大利亚国立大学澳大利亚国立大学是今年澳大利亚排名第1以及世界排名第22位的学校,澳大利亚国立大学位于澳大利亚的首都城市堪培拉。
澳大利亚国立大学是唯一一所由澳大利亚议会创建的大学,不同于澳大利亚其它的公立大学是由各地州议会立法设立。
澳大利亚国立大学有超过22,500名学生在此就读,并且在澳大利亚国立大学的校友和教师间已经产生了六位诺贝尔奖得主。
澳大利亚国立大学是澳大利亚八大名校之一,在大洋洲享有特殊的学术地位。
澳大利亚国立大学有人文艺术和社会科学院、物理和数学科学院、医学生物和环境学院、工商和经济学院、工程和计算机科学学院、亚洲和太平洋学院和法律学院这七大学院。
在澳大利亚国立大学的学生中,本科生较少,以研究生为主,学生总数不多,但学术气氛浓厚,学术水平极高。
澳洲著名的大学排名2:墨尔本大学墨尔本大学继续保持了其位于世界排名第42位的位置,墨尔本大学成立于1853年,是澳大利亚第二古老的大学。
墨尔本大学的校友包括四位澳大利亚总理,并且墨尔本大学也产生了九位诺贝尔奖获得者。
墨尔本大学也是澳大利亚八校联盟中唯一不认可中国高考成绩的大学。
是不是犹豫如何在澳大利亚国立大学和墨尔本大学这两所顶尖大学之间进行选择?你可以查看店铺为大家进行的澳大利亚国立大学和墨尔本大学的比较。
墨尔本大学位于澳大利亚城市墨尔本,墨尔本连续多年被联合国人居署评为“全球最适合人类居住的城市”。
墨尔本大学的优势专业包括有法学、医学、金融与会计、建筑学、工程学、计算机科学等等,这些专业全部都位于世界前50名中,这也是澳大利亚唯一一所能够做到这些的大学。
澳洲著名的大学排名3:悉尼大学悉尼大学今年位列澳大利亚大学排名第3位,并且与美国的纽约大学一起并列世界大学排名第46位。
固体化学导论-单原子催化剂

单原子 分散
优越的催化性 能和选择性
单原子催化剂的优缺点
优点
缺点
• 金属用量少,成本降低 • 金属原子利用率高 • 催化性能优越 • 选择性高
• 容易团聚耦合,稳定性差 • 金属负载量低 • 大批量生产困难
单原子催化剂制备方法
质量分离软着陆法
共沉淀法
湿浸渍法
原子层沉积法
静电吸附法
水热合成法
质量分离软着陆法
CO吸附结合的原位FT-IR技术
(a)Cu/SiO2, (b)CuPd0.006/SiO2, (c)CuPd0.025/SiO2 (d)Pd0.006 / SiO2
Pei, G. X. ACS Catal. 2017, 7 (2), 1491-1500.
X射线衍射
X 射线衍射( XRD )用于鉴定晶相、确定晶格参数、估 算晶粒尺寸以及对混合晶相的定量分析。以同步辐射作为 XRD的X射线源具有很大优势,具有更好的信噪比,检测采 样时间大大缩短、可以测量粒度更小的样品,适于原位和时 间分辨的XRD。
单原子催化界的大牛
张涛院士 CAS
李亚栋院士 THU
李隽教授 THU
以及
未来的我 UCAS
Merry Christmas
学识有限,请大家多多指教
刘小春 2018年12月
(1)X光电子能谱(XPS)是催化研究中最常用的表征 技术之一,它能提供催化剂的元素组成、元素氧化态、某一 相在其他相的分散情况等信息。 (2)紫外光电子能谱(UPS)较少用于负载型催化剂研 究,可以用于探测金属以及吸附分子和物种中的键合,得到 价电子和价带结构特征。
红外光谱技术
红外光谱方法利用分子探针与固体表面或载体表面的相 互作用来提取关于吸附探测分子的实体性质的信息。通过监 测探头模式的振动频率和强度的变化,可以通过适当的校准 推断出催化活性中心的特性。
澳洲国立大学三大热门金融硕士专业介绍

澳洲国立大学澳洲国立大学是当之无愧的世界名校,它在2015-2016年的QS世界大学排行榜中排名全球第19位,名列全澳第一。
可以说ANU排名高,教学质量优异,无论在澳洲还是回国发展前景很不错。
澳洲国立大学金融硕士专业尤为突出,吸引了众多澳洲留学生前来求学。
澳洲国立大学三大热门金融专业:金融硕士Master of Finance、应用金融硕士Master of Applied Finance和金融管理学硕士Master of Financial Management,这些专业享誉全球,颇受澳洲留学生青睐。
86留学网下面为大家汇总介绍。
一. 澳洲国立大学三大金融硕士专业详解:1. 金融硕士专业 Master of Finance 学制:2年金融硕士专业受CFA特许金融分析师资格认证,国内持有该证的人员,大多都进入了知名的证券公司、投行、外资银行和四大会计师事务所。
金融硕士专业为没有金融背景的学生提供机会,帮助学生获得金融专业知识的提升,打下扎实的金融理论基础。
金融或相近专业领域毕业的学生,可以申请减免学分。
2. 应用金融硕士专业Master of Applied Finance 学制:1.5年大部分澳洲大学的应用金融硕士专业都需要金融或其相近专业领域背景,对数学有一定的课程要求,澳洲国立大学也不例外。
不过,澳洲国立大学为这类学生提供了另外一种途径:只要你先在ANU读一个半年制的金融与精算统计研究生证书课程(Graduate Certificate of Finance and Actuarial Statistics),最后考试的平均分在65%以上,就可以读应用金融硕士(Master of Applied Finance)了。
3. 金融管理硕士专业Master of Financial Management 学制:1年澳洲国立大学金融管理硕士为期1年,学习时间短,课程设置与金融行业专业人士一起研发,课程非常实用,更加适合毕业生,帮助毕业生成为优秀的全球化人才。
第一批本科A1类

院校名称类别专业名称合作情况机械类(机械电子工程)材料类(纳米材料与技术)4525531452552845665734564572 20172016计划数及最低分、最高分北京交通大学理工中澳合作,澳大利亚伍伦贡大学中加合作,加拿大滑铁卢大学交通运输类(交通运输)4531540未招生中荷合作,荷兰代尔夫特理工大学机械类:全盘引入伍伦贡大学国际领先的机械电子专业课程体系,以机械(45%)、电子(45%)和计算机控制技术(10%)的系统有机融合为特色,服务于我国制造业的信息化和智能化发展,以本校“载运工具运用工程”国家级重点学科和“机械工程”一级学科为学科支持,依托交大国家级“机械工程实验教学中心”特色实践平台。
基本学制四年,采取“3+1”的培养模式,专业课程培养体系与伍伦贡大学完全相同。
学生前三年在本校学习,满足学业和英语成绩要求后(IELTS6.0或托福79),第四年赴伍伦贡大学主校区完成后续学业;学生也可通过国际交流形式提前申请在第三年赴澳学习。
学生赴澳学习至少一年,达到双方学业要求后可以获得本校本科毕业证书、学士学位证书和伍伦贡大学学士学位证书。
学生赴澳完成学士学位学习后,可不用考试直接申请攻读伍伦贡大学硕士或博士研究生,并获得10%的学费减免。
国内学费人民币4.2万元/学年;住宿费:750-1200人民币/学年。
伍伦贡大学学费按照澳方标准收取,2017年为3.24万澳元/学年(约17万人民币/年)。
伍伦贡市的生活费约1.5万澳元/年(约8.2万元人民币,为悉尼的一半),市区有免费公交,学校提供学生宿舍和免费机场接机服务。
本项目提供优厚的奖学金,学生在本校期间平均成绩达到75分,可获得赴澳期间25%的伍伦贡大学学费减免;如平均成绩达90分以上,可获得高达50%(8.5万元人民币)的澳方学费减免。
澳大利亚伍伦贡大学创建于1951年,位于新南威尔士州的风光秀丽、气候宜人的海滨城市———伍伦贡市,距悉尼开车仅90分钟。
2016世界大学星级榜单全球大学及美国商学院星级排名要你好看

2016QS世界大学星级榜单全球大学及美国商学院星级排名要你好看对于留学生来讲,在选校的时候一定会参考不同的院校排行榜,而作为全球院校排行榜中最权威最具有知名度的院校排行榜,除了USNews之外,最受学生重视的便是QS和THE(泰晤士高等教育院校排行榜!)。
想要看到这三个机构发布的最新全球院校排名,你可以点击查看点课台教育“名校排名”除了综合的全球院校排行榜之外,各个机构为了使得自己的排行榜更有针对性,相应维度的院校排行榜也会发布。
类似区域国家某某专业的院校排名,校园安全排名等等院校排行榜!今天点课台教育将为大家介绍的QS星级院校排行榜(QS Stars UniversityRatings)便是这样的排行榜。
不同于点课台君之前为大家介绍的QS世界大学排行榜那样。
QS星级院校排行榜使得申请者可以更加全面的了解自己想要申请的院校,这远远不止院校排名和教学实力。
排行榜将毕业生的就业能力,学生的体育活动的参与度以及社区集体活动的参与度都考量在内!QS星级院校排行榜发布的意义便是更生动地体现学校以及其职责之间的细微不同,同时也是为了满足于那些关注点不仅仅是传统的院校综合排名的申请者!QS星级院校排行在评选院校排名的时候一共统筹了将近50个不同的因素!而这些不同的因素被QS分成了9个大项:设备:IT基础设施图书馆设施体育馆和食堂设施国际化&多样化:国家化多样性性别平衡种族融合学术合作国际师生比例教学质量&生源质量:师生比例教学满意度 PHD教师占比毕业率人才吸引力就业能力:雇员声誉毕业生就业率就业服务支持校友科研:学术荣誉科研论文发表科研影响力国际科研刊物论文发表创业能力:教师的业务整合校友创业风险资金积极性:社区投资和发展奖学金&大学库房地区人力资本发展排名和大众评估:信赖度国内认可度院校国际排名项目能力:毕业生就业率平均工作年限学生满意度/信任度师生比例地区申请比根据以上的各个大项及其下级维度,QS推出了最新的星级院校排行榜,快和点课台教育一起来看看哪些大学能够忽的最高的荣誉——5+stars。
2016莫纳什大学留学条件

澳洲莫纳什大学留学条件盘点。
蒙(莫)纳士大学(MonashUniversity)是澳大利亚规模最大的国立大学之一、其综合实力在各大学中名列前茅,被评为澳大利亚五星级大学。
留学360就来了解一下澳洲莫纳什大学留学条件:
本科申请条件
开学时间:每年2月1日、7月1日
申请截至日:每年5月1日、12月31日
学士学位:已在中国大学就读1年,或高中毕业但须先上1年大学预科;IELTS6.5分到7分(专业)。
商科:据留学360介绍,雅思7分(2012年9月已经降低要求,为6.5分,各单项不低于6分)。
此外蒙纳士大学要求211大学毕业生平均分不低于75分,非211大学的毕业生平均分不低于80分.
研究生申请条件
开学时间:每年2月1日、7月1日
申请截至日:每年5月1日、12月31日
研究生:要求在正规大学已经完成至少4年的学士学位学习;IELTS一般为6.5分到7.0分(不同专业不同要求如:法律学要求高于6.5分)。
留学360-A股上市留学机构,连续8年常青藤大满贯获得者,公司与美国、加拿大、英国、澳洲、新西兰、爱尔兰、瑞士、新加坡、马来西亚、泰国等30多个国家的800多家教育机构签约建立合作关系,协议覆盖了3000多所海外大中小学。
出国留学“10”人留学世界名校,至少“8”人选择留学360;留学360名校录取数业内领先!留学360,教育部认证的权威留学机构,专注互联网留学9年。
中山大学2016年优秀本科生国际交流项目资助项目一览表【模板】
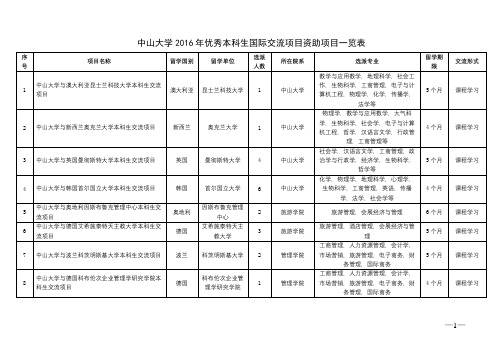
31
中山大学与英国兰开夏大学优秀本科生国际交流项目
英国
兰开夏大学
2
法学院
法学
4个月
课程学习
32
中山大学与英国伯明翰大学本科生交流项目
英国
伯明翰大学
3
外国语学院
英语
6个月
课程学习
33
中山大学与英国格拉斯哥大学本科生交流项目
英国
格拉斯哥大学
2
外国语学院
英语
12个月
课程学习
34
中山大学与英国曼彻斯特大学英文、语言和文化学院本科生交流项目
丹麦
哥本哈根商学院
4
岭南学院
经济学,国际经济与贸易,金融学,物流管理,保险学,财政学
6个月
课程学习
17
中山大学与英国华威大学本科生国际交换项目
英国
华威大学
4
岭南学院
金融学,经济学,财政学,物流管理,国际经济与贸易,保险学
6个月
课程学习
18
中山大学与荷兰蒂尔堡大学经济与管理学院优秀学生国际交换项目
荷兰
德国
科隆大学
3
地理科学与规划学院
人文地理与城乡规划,城市规划
10个月
课程学习
21
中山大学与德国慕尼黑大学文化学院本科生交流项目
德国
慕尼黑大学
1
中国语言文学系
汉语言文学
5个月
课程学习
22
中山大学与德国泽佩林大学本科生交换项目
德国
泽佩林大学
6
政治与公共事务管理学院
行政管理
5个月
课程学习
23
中山大学与韩国首尔市立大学本科交流项目
色谱分析法专业知识培训

俄国植物学家 茨维特
➢ Tswett植物色素分离 试验图示:
样 品:植物色素 固定相:CaCO3颗粒 流动相:石油醚
色谱柱
固定相 碳酸钙
流动相 石油醚
混合色素 叶绿素 叶黄素 胡萝卜素
分离组分
表1 色谱法旳发展简史 年代 发明者 发明旳色谱措施或主要应用
1906 Tswett
用碳酸钙作吸附剂分离植物色素。最先 提杰出谱概念。
蒂塞利乌斯(Tiselius)因电泳分析和分析措施旳研究,发觉 血清蛋白组分,获1948年诺贝尔化学奖
1941,马丁(Martin)和辛格(Synge)创始分配色谱尤其是纸 色谱而共获1952年诺贝尔化学奖
氨基酸自动分析仪发明人S.穆尔(Stanford Moore)和W.H. 斯坦(William Howard Stein),定量分析措施处理了有关 氨基酸、多肽、蛋白质等复杂旳生物化学问题,获1972年 诺贝尔化学奖
12.1 概述>>
一、色谱法简介
➢ 1923年,俄国植物学家M.Tswett刊登了他旳试验 成果:为了分离植物色素,他将具有植物色素旳 石油醚提取液倒入装有碳酸钙粉末旳玻璃管中, 并用石油醚自上而下淋洗,因为不同旳色素在 CaCO3颗粒表面旳吸附力不同,伴随淋洗旳进行, 不同色素向下移动旳速度不同,从而形成一圈圈 不同颜色旳色带,使各色素成份得到了分离。他 将这种分离措施命名为色谱法(chromatography)。 在今后旳20数年里,几乎无人问津这一技术。到 了1931年,德国旳Kuhn等用一样旳措施成功地分 离了胡萝卜素和叶黄素,从此色谱法开始为人们 所注重,相继出现了多种色谱措施。
2. 基本术语
➢ 保存值是色谱定性分析 和色谱过程热力学特征 旳主要参数。
QS世界大学排名2016

QS世界大学排名2016QS世界大学排名20162015年9月15日,QS世界大学排名组织公布了QS世界大学排名2016,其中排名第一的是麻省理工学院,排名第二的是哈佛大学,排名第三的是剑桥大学,中国区排名第一的是清华大学,以下是QS世界大学排名2016完整榜单,供大家参考。
QS世界大学排名(英文:QS World University Rankings),是由教育组织Quacquarelli Symonds(QS)所发表的年度世界大学排名。
排名包括主要的世界大学综合排名及学科排名。
《QS世界大学排名》与《泰晤士高等教育世界大学排名》及《世界大学学术排名》共同获公认是世界三大最具影响力的全球性大学排名。
排名学校名称国家/地区1麻省理工学院美国2哈佛大学美国3剑桥大学英国3斯坦福大学美国5加州理工学院美国6牛津大学英国7伦敦大学学院英国8帝国理工学院英国9苏黎世联邦理工学院瑞士10芝加哥大学美国11普林斯顿大学美国12新加坡国立大学新加坡13南洋理工大学新加坡14洛桑联邦理工学院瑞士15耶鲁大学美国16约翰霍普金斯大学美国17康奈尔大学美国18宾夕法尼亚大学美国19伦敦大学国王学院英国19澳洲国立大学澳大利亚21爱丁堡大学英国22哥伦比亚大学美国23巴黎高等师范学院法国24麦吉尔大学加拿大25清华大学中国26加州大学伯克利分校美国27加州大学洛杉矶分校美国28香港科技大学香港29杜克大学美国30香港大学香港30密歇根大学安娜堡分校美国32西北大学美国33曼彻斯特大学英国34多伦多大学加拿大35伦敦政治经济学院英国36首尔国立大学韩国37布里斯托大学英国38京都大学日本39东京大学日本40巴黎高等理工学院法国41北京大学中国42墨尔本大学澳大利亚43韩国高等科技学院韩国44加州大学圣地亚哥分校美国45悉尼大学澳大利亚46新南威尔士大学澳大利亚46昆士兰大学澳大利亚48华威大学英国49布朗大学美国50英属哥伦比亚大学加拿大51香港中文大学香港51复旦大学中国53纽约大学美国54威斯康辛大学麦迪逊分校美国55阿姆斯特丹大学荷兰56东京工业大学日本57香港城市大学香港58大阪大学日本59伊利诺伊大学厄本那-香槟分校美国60慕尼黑工业大学德国61杜伦大学英国62卡耐基梅隆大学美国62格拉斯哥大学英国64代尔夫特理工大学荷兰65华盛顿大学美国66海德堡大学德国67莫纳什大学澳大利亚68圣安德鲁斯大学英国69哥本哈根大学丹麦70诺丁汉大学英国70隆德大学瑞典70国立台湾大学台湾70上海交通大学中国74东北大学日本75慕尼黑大学德国76伯明翰大学英国77德克萨斯大学奥斯汀分校美国78都柏林圣三一学院爱尔兰79北卡罗来纳大学教堂山分校美国80谢菲尔德大学英国81南安普顿大学英国82奥克兰大学新西兰82鲁汶大学(荷语)比利时84佐治亚理工学院美国85苏黎世大学瑞士85加州大学戴维斯分校美国87利兹大学英国87浦项科技大学韩国89日内瓦大学瑞士89普渡大学西拉法叶分校美国91波士顿大学美国92瑞典皇家理工学院瑞典93卡尔斯鲁厄理工学院德国94乌得勒支大学荷兰95莱顿大学荷兰96阿尔伯塔大学加拿大96赫尔辛基大学芬兰98西澳大学澳大利亚99俄亥俄州立大学美国100格罗宁根大学荷兰101宾州州立大学公园分校美国乌普萨拉大学瑞典103约克大学(英国)英国104高丽大学韩国105延世大学韩国106莱斯大学107奥胡斯大学丹麦108莫斯科国立大学俄罗斯109伦敦大学玛丽女王学院英国110圣路易斯华盛顿大学美国110浙江大学中国112丹麦理工大学丹麦113阿德雷德大学澳大利亚113中国科学技术大学中国115蒙特利尔大学加拿大116香港理工大学香港117埃因霍温科技大学荷兰118成均馆大学韩国119柏林自由大学德国120名古屋大学日本121兰卡斯特大学英国122卡迪夫大学英国123明尼苏达大学双城分校美国124布宜诺斯艾利斯大学阿根廷124根特大学比利时126鹿特丹伊拉斯姆斯大学荷兰126柏林洪堡大学德国126马里兰大学学院公园分校美国129加州大学圣塔芭芭拉分校美国130南加州大学美国130南京大学中国132查尔姆斯理工大学瑞典133弗莱堡大学德国133匹兹堡大学美国135瓦格宁根大学荷兰135奥斯陆大学挪威137阿伯丁大学英国137皮埃尔和玛丽·居里大学法国139巴塞尔大学瑞士139阿尔托大学芬兰139北海道大学日本142九州大学日本143洛桑大学瑞士143圣保罗大学巴西145亚琛工业大学德国146马来亚大学马来西亚147印度理工学院班加罗尔分校印度148耶路撒冷希伯来大学以色列149鲁汶大学(法语)比利时149麦克马斯特大学加拿大151利物浦大学英国152滑铁卢大学加拿大153维也纳大学奥地利154都柏林大学爱尔兰155国立清华大学台湾156巴黎中央理工学院法国156雷丁大学英国158达特茅斯学院美国159巴斯大学英国159德州农工大学美国160墨西哥国立自治大学墨西哥161埃克塞特大学英国162纽卡斯尔大学(英国)英国163加州大学尔湾分校美国164密歇根州立大学美国165艾茉莉大学美国166伯尔尼大学瑞士166巴塞罗那大学西班牙168哥廷根大学德国169马斯特里赫特大学荷兰170智利天主大学智利171开普敦大学南非172弗吉尼亚大学美国173奥塔戈大学新西兰173蒂宾根大学德国175科罗拉多大学博尔德分校美国176阿姆斯特丹自由大学荷兰177奈梅亨大学荷兰178柏林工业大学德国179印度理工学院德里分校印度180佛罗里达大学美国181卑尔根大学挪威182贝尔法斯特女王大学英国182国立交通大学台湾182斯德哥尔摩大学瑞典185伊利诺伊大学芝加哥分校美国186马德里自治大学西班牙187萨塞克斯大学英国187米兰理工大学意大利188特文特大学荷兰188巴黎高等师范学院法国190罗切斯特大学美国190巴塞罗那自治大学西班牙192西安大略大学加拿大193汉阳大学韩国194布鲁塞尔自由大学比利时195圣母大学美国195坎皮纳斯州立大学巴西197维也纳大学奥地利198以色列理工学院以色列199法赫德国王石油与矿产大学沙特202印度理工学院孟买分校印度203特拉维夫大学以色列204卡尔加里大学加拿大204博罗尼亚大学意大利206皇后大学加拿大207布鲁塞尔自由大学(法语)比利时208安特卫普大学比利时209智利大学智利210波恩大学德国211坎特伯雷大学新西兰212早稻田大学日本213乔治敦大学美国213罗马第一大学意大利215凯斯西储大学美国216范德堡大学。
第3章溶解与沉淀(1)

例2 排出下列稀溶液的渗透压由小到大的顺序:
1. c(C6H12O6 )=0.2mol· -1 2. c(Na2CO3)=0.2mol · -1 L L
3. c(Na3PO4)=0.2mol · -1 4. c(NaCl)=0.2mol · -1 L L 解:cos (C6H12O6 )= 0.2(mol· -1 ) L cos (Na2CO3)= 0.2×3 = 0.6(mol· -1 ) L
较稀溶液扩散进入较浓溶液的过
程,称为渗透(Osmosis )。
2、产生渗透现象的必要条件:
①存在半透膜;
②膜两侧单位体积内溶剂分子数不等。
3、渗透的方向:
溶剂分子
纯溶剂 或 稀溶液
溶剂分子
溶液
浓溶液
4﹑渗透压力 (osmotic pressure)Π 渗透压(Π):将纯溶剂 与溶液以半透膜隔开 时,恰能维持溶液和 纯溶剂之间的渗透平 衡而需要的额外的压 力,称为溶液的渗透 压。 单位: Pa或kPa
一、溶液(solution)
两种或两种以上物质的均匀混合物。 通常所说的溶液指液态溶液。
溶液组成:溶剂+溶质
注意:本书中的溶液,如无特殊说 明则指以水为溶剂的液态溶液。
第一章 溶液
二、溶液的分类
溶质溶解于溶剂中,根据溶质的存 在形式及溶液是否导电分为电解质溶液 和非电解质溶液。 电解质溶液:溶质以离子的形式存在,溶液 具有导电性。如: HCl ,NaOH ,NaCl
1.蒸汽压与液体的本性有关,在一定 温度下纯净物质具有一定的蒸汽压,不 同的物质有不同的蒸汽压。 2.蒸汽压与温度有关。温度升高,蒸汽压 增大。 3.固体也具有一定的蒸汽压 ,温度升高,固 体的蒸汽压增大。
2016QS世界大学排名

70
隆德大学
Lund University
瑞典
70
国立台湾大学
National Taiwan University
中国台湾
70
上海交通大学
Shanghai Jiao Tong University
中国
74
日本东北大学
Tohoku University
日本
75
慕尼黑大学
Ludwig-Maximilians-Universit?t München
美国
28
香港科技大学
The Hong Kong University of Science and Technology
中国香港
29
杜克大学
Duke University
美国
30
香港大学
The University of Hong Kong
中国香港
30
密歇根大学
University of Michigan
英国
36
首尔大学
Seoul National University
南韩
37
布里斯托大学
University of Bristol
英国
38
京都大学
Kyoto University
日本
39
东京大学
The University of Tokyo
日本
40
巴黎综合理工大学
Ecole Polytechnique
2016QS世界大学排名
排名
学校名称
学校英文名
国家
1
麻省理工学院
Massachusetts Institute of Technology
2016年澳洲国立大学世界排名

澳大利亚国立大学(Australian National University),简称ANU,坐落在澳大利亚首都堪培拉,是澳大利亚唯一由联邦国会专门单独立法而创立的大学。
澳大利亚国立大学的教学及研究水平在国际上享有极高的声望。
在英国泰晤士高等教育、QS世界大学排名、美国新闻周刊、美国新闻与世界报道、澳大利亚联邦政府研究理事会等各式主流大学排行榜上,ANU 多次被评为澳大利亚大学的前两名,多次名列全世界前30,稳居世界前50大,是南半球的学术重镇之一。
澳大利亚国立大学曾两度被澳大利亚高等教育品质保证委员会评议为第一等级大学,也曾被《亚洲周刊》列为澳大利亚最顶级的多元教育大学,并多次位居澳大利亚大学综合排名第1名。
据立思辰留学360介绍,澳大利亚国立大学的杰出校友包括6名诺贝尔奖得主,居澳大利亚首位;其澳大利亚联邦院士人数超过270名,居澳大利亚首位;其皇家学会的会员人数比澳大利亚的其它所有大学的总和还多。
它的光学研究中心,凭借着光纤通讯方面的研究成果,获马可尼国际奖;青霉素发现者弗洛里爵士、杰出的历史学家汉考克爵士、经济学家库姆斯爵士,以及新一代众多知名学者让它熠熠生辉。
根据2009年的QS世界大学排名,澳大利亚国立大学排名全世界17,是除了美国和英国的几所著名大学之外,全球排名最高的学府,名次紧接在斯坦福大学和常春藤联盟的康乃尔大学之后。
2008年英国《泰晤士报》高等教育-QS 世界100强大学排名第16位
2011-2012年QS世界大学排行榜,澳大利亚国立大学高居世界第26位,澳大利亚大学排名第一位。
2011-2012年泰晤士报高等教育大学排行榜(THE),澳大利亚国立大学位居世界第38位,在澳大利亚各大学中排名第二,仅低于澳大利亚墨尔本大学一位(37位)。
澳洲留学:盘点新澳世界级大学TOP10

澳洲留学:盘点新澳世界级大学TOP10一说到澳洲留学,很多人可能只是将关注点放在了澳大利亚,却将其实比较与实力也非常强悍的新西兰置之度外!因为坦白的将澳大利亚的国土面积在整个澳洲占据绝大部分,同时澳大利亚的8大有名声显赫,所以对于新西兰的关注就会相对的减少很多!但是新西兰教育并没有像他的国土面积那么小。
今天小站留学编辑将带着大家一起来看看澳大利亚+新西兰最好的10所大学!快和小编一起来看看吧!>>>点击查看:澳洲留学申请流程10. University of Otago 奥塔哥大学奥塔哥大学(University of Otago)位于新西兰南岛奥塔哥省首府达尼丁市,成立于1869年,是新西兰第一所大学,也是新西兰唯一能够提供消费者与应用科学、牙医学、人类营养学、药学、体育、理疗及测量学等专业的综合性大学。
该校有商学、健康科学、人文科学、理学四所学院,目前有超过21700名学生在此就读,其中包括来自90多个国家/地区超过2800名的国际学生。
该大学研究课题宽泛,学术强项包括生物科学、心理学、人类学、历史和艺术史等,其中奥塔哥大学医学院有很强的科研能力,在海内外颇负盛名。
该校位居2012年世界大学排行榜133名。
9. University of Adelaide 阿德莱德大学阿德莱德大学(The University of Adelaide)简称阿大,位于澳大利亚南部阿德莱德市,是澳大利亚历史上的第三所大学,也是澳洲八大名校(Group of Eight)的盟校成员,被评为为澳洲五星级大学。
自1874年创校以来,阿德莱德大学一直位居澳大利亚顶尖大学之列。
截至2008年,阿德莱德大学曾培养出5个诺贝尔奖为澳洲最多,和108个罗德奖的获得者。
新加坡两任总统毕业于此校。
阿德莱德大学现有16447名学生,国际生比例为28%,其中包括来自88个国家的4604名国际学生,分别就读于阿德莱德大学“北特里斯”、“罗斯沃斯”、“怀特”、“费巴顿”四个校区。
2016年度泰晤士高等教育提高世界大学排名
60
悉尼大学
University of Sydney
澳大利亚
63
阿姆斯特丹大学
University of Amsterdam
荷兰
64
波士顿大学
Boston University
美国
65
瓦格宁根大学
Wageningen University & Research
荷兰
66
巴黎高等师范学院
École Normale Supérieure
挪威
133
利兹大学
University of Leeds
英国
134
佛罗里达大学
University of Florida
美国
135
塔夫斯大学
Tufts University
美国
135
乌尔姆大学
Ulm University
德国
137
日内瓦大学
University of Geneva
瑞士
137
兰卡斯特大学
韩国
106
苏黎世大学
University of Zurich
瑞士
107
阿尔伯塔大学
University of Alberta
加拿大
108
范德堡大学
Vanderbilt University
美国
109
谢菲尔德大学
University of Sheffield
英国
110
伯尔尼大学
University of Bern
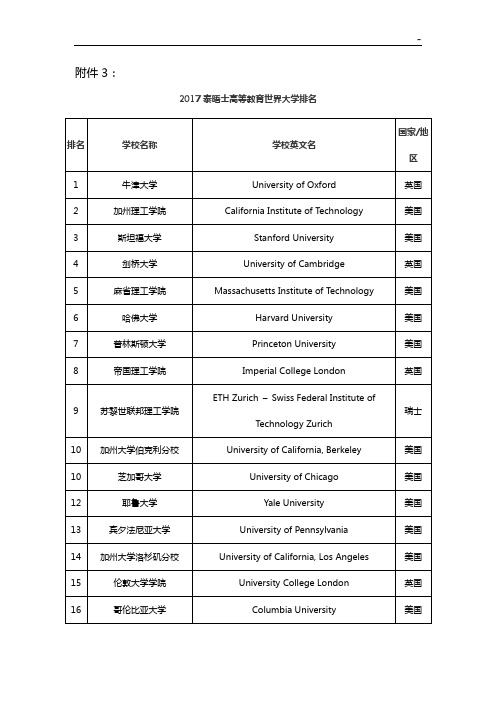
附件3:
2017泰晤士高等教育世界大学排名
排名
学校名称
学校英文名
国家/地区
Angew. Chem. Int. Ed. 2000, 39, 3772

1.IntroductionIn general,an ionic liquid is a liquid that consists only of ions.However,this term includes an additional special definition to distinguish it from the classical definition of a molten salt.[1]While a molten salt is generally thought to refer to a high-melting,highly viscous and very corrosive medium, ionic liquids are already liquid at low temperatures(<1008C) and have relatively low viscosity.The apparently somewhat arbitrary line drawn between molten salts and ionic liquids at a melt temperature of1008C can be justified by the abrupt improvement in the range of applications for liquid salts below this temperature.Even though some examples are known in which high-temperature salt melts have been successfully used as reaction media for synthetic applica-tions,[2]only a liquid range below1008C can enable the versatile substitution of conventional,organic solvents by ionic liquids.The development of ionic liquids goes back to1914.First research efforts dealt with the synthesis of ethylammonium nitrate.[3]This salt is liquid at room temperature but usually contains a small amount of water(200±600ppm).[4]The first ionic liquids with chloroaluminate ions were developed in1948by Hurley and Wier at the Rice Institute in Texas as bath solutions for electroplating aluminum.[5]How-ever,these systems were not studied further until the late 1970s when the groups of Osteryoung and Wilkes rediscov-ered them.For the first time,they succeeded in preparing room±temperature liquid chloroaluminate melts.[6]Research and development concentrated mainly on electrochemical applications at this time.As early as1967,a publication by Swain et al described the use of tetra-n-hexylammonium benzoate as a solvent for kinetic and electrochemical investigations.[7]Even though the liquid salt was a hemihydrate at room temperature,this research work had a pioneering significance because it already contained a quantitative determination of the ioniza-tion strength of the ionic medium.In the early1980s the groups of Seddon and Hussey began to use chloroaluminate melts as nonaqueous,polar solvents for the investigation of transition metal complexes.The investigations generally started with the electrochemical aspects of the relevant transition metal complexes;[8]spectro-scopic and complex chemistry experiments followed.[9]It is specially thanks to Seddon s work that ionic liquids became more familiar to a broad public.The first publications in which ionic liquids were described as new reaction media and catalysts for organic synthesis appeared at the end of the1980s.Acidic ionic liquids with chloroaluminate ions proved to be effective Friedel±Crafts catalysts;[10]phosphonium halide melts were used successfully in nucleophilic aromatic substitution reactions.[11]The use of ionic liquids as solvents for homogeneous transition metal catalysts was described for the first time inIonic LiquidsÐNewªSolutionsºfor Transition Metal CatalysisPeter Wa sserscheid*a nd WilhelmKeim[*]Dr.P.Wasserscheid,Prof.W.KeimInstitut für Technische Chemie undMakromolekulare Chemie der RWTH AachenWorringer Weg1,52074Aachen(Germany)Fax:( 49)241-8888177E-mail:Wasserscheidp@itc.rwth-aachen.deREVIEWSREVIEWS P.Wasserscheid and W.Keim1990by Chauvin et al.and by Wilkes et al.Chauvin s group dissolved nickel catalysts in weakly acidic chloroaluminate melts and investigated the resulting ionic catalyst solutions for the dimerization of propene.[12]Wilkes et ed also weekly acidic chloroaluminate melts and studied therein the ethylene polymerization with Ziegler±Natta catalysts.[13]The concept of ionic liquids received a substantial boost by the work of Wilkes s group when they described in1992the synthesis of systems with significantly enhanced stability against hydrolysis,for example low melting tetrafluoroborate melts.[14]In contrast to chloroaluminate ionic liquids,these systems offer high tolerance versus functional groups which opens up a much larger range of applications especially for transition metal catalysis.Ionic liquids with tetrafluoroborate ions have been successfully used,for example,in the rodium-catalyzed hydroformylation of olefins.[15]Based on Wilkes s work,it became clearly apparent that ionic liuids were by no means limited to chloroaluminate melts,quite to the contrary,a whole range of cation/anion combinations can form low-melting salts.The most recent publications are concerned with the synthesis of new ionic liquids,[16]with the systematic inves-tigation of their physical and chemical properties,[17]and with further applications as solvents and catalysts.[18]Two excellent reviews by Welton[19]and by Seddon and Holbrey[20]have been already published describing in special detail the use of chloroaluminate ionic liquids in synthetic and catalytic applications.Electrochemical[21]and complex chem-istry[22]investigations in ionic liquids have already been reviewed,too.The aim of our review is to describe the synthesis,proper-ties,and potential of ionic liquids with respect to their application as solvent in transition metal catalysis.In this context,we would like to offer especially to the chemist working in the field of homogeneous catalysis a set of criteria to identify suitable candidates out of the large number of ionic liquids(some authors speak about1018possible cation/anion combinations[20]).This section will be followed by a selection of examples which demonstrate that ionic liquids can be successful alternativeªsolutionsºfor many applications. Hereby,we will focus our attention on recently published work describing transition metal catalysis inªnon-chloroalu-minateºsystems.2.Ionic Liquid SynthesisThe initial step in the synthesis of ionic liquids is the quaternization,of an amine or phosphane for example,to form the cation.[6c,22]The most important,reported cation types are shown in Scheme1.Salts with different anionsareScheme1.Important types of cations in ionic liquids.obtained by the quaternization reaction depending on the alkylation reagent.Interestingly,melting points under1008C can be obtained for a series of cation/anion combinations in this way(Table1).REVIEWS Ionic LiquidsIn cases where it is not possible to form the desired anion directly by the quaternization reaction,a further step follows (synthesis steps IIa or IIb in Scheme 2).For example,starting from an ammonium halide [R 'R 3N] X À,two different paths to vary the anion are possible.First,the halide [R 'R 3N] X Àcan be treated with a Lewis acid MX y .This leads to an ionic liquid of the type [R 'R 3N] [MX y 1]À(synthesis step IIa,Scheme2).Scheme 2.Synthesis paths for the preparation of ionic liquids examplified for an ammonium salt.Alternatively it is possible to exchange the halide ion X Àfor the desired anion.This can be done by the addition of a metal salt M [A]À(with precipitation of M X À)over an ion exchanger or by displacement of the halide ion by a strong acid H [A]À(with the release of H X À)(synthesis step IIb,Scheme 2).In the first case,several anion species are often present in equilibrium,which depends on the ratio of the two compo-nents [R 'R 3N] X Àand MX y [Eq.(1)].With an excess of the Lewis acid MX y additional anion species can be formed from further acid ±base reactions with the already present anion.Such behavior is displayed by chloroaluminate melts,for example [Eq.(2)and (3)].[26]Theformation of different anions occurs as a function of the chloride/AlCl 3ratio.From Figure 1it can be seen that addition of aluminum trichloride to the chloride initially results in the formation of the AlCl 4Àion.With an aluminum trichloride mole fraction of exactly 0.5,this is essentially the only anion present.In systems with x (AlCl 3)>0.5multi-nuclear chloroaluminate anions are formed which are in equilibrium with each other,the AlCl 4Àion and,at very high AlCl 3contents,with dimeric aluminum trichloride.[26]Figure 1.Mole fraction x m of different anion species Xn in chloroalumi-nate melts (X1 Cl À;X4 AlCl 4À;X7 Al 2Cl 7À;X10 Al 3Cl 10À;X13 Al 4Cl 13À;X6 Al 2Cl 6).Chloroaluminates are the best known but not the only ionic liquids that can be prepared by the reaction of a halide with a Lewis acid.Further examples are shown in Table 2.When the anion is varied by anion exchange ionic liquids of the type [cation] [A]Àare formed (synthesis step IIb,Scheme 2),which contain only one anion species when the exchange reaction has proceeded to completion (Table 3).At this point it should be noted that the synthesis of highly pure,binary ionic liquids places particular demands on the Table 1.Examples of ionic liquids that can be formed by direct quater-nization.Ionic liqiud Alkylation reagent M.p.[8C]Ref.[EMIM]CF 3SO 3[a]methyl triflate À9[16a][BMIM]CF 3SO 3[b]methyl triflate 16[16a][Ph 3POc]OTs [c]OcOTs 70±71[24][Bu 3NMe]OTs MeOTs 62[25][BMIM]Cl chlorobutane 65±69[6c][a]EMIM 1-ethyl-3-methylimidazolium;CF 3SO 3 triflate anion.[b]BMIM 1-n -butyl-3-methylimidazolium.[c]Oc octyl;Ts H 3CC 6H 4-SO 2(tosyl).Table 2.Examples of ionic liquids that can be generated by the reaction of a halide with a Lewis acid.Ionic liquid [a]Established anion Ref.[cation]Cl/AlCl 3Cl À,AlCl 4À,Al 2Cl 7À,Al 3Cl 10À[27][cation]Cl/AlEtCl 2AlEtCl 3À,Al 2Et 2Cl 5À[28][cation]Cl/BCl 3Cl À,BCl 4À[29][cation]Cl/CuCl CuCl 2À,Cu 2Cl 3À,Cu 3Cl 4À[30][cation]Cl/SnCl 2SnCl 3À,Sn 2Cl 5À[31][a]cation pyridinium,imidazolium ion.Table 3.Examples of ionic liquids that can be prepared by anion exchange.Ionic liquid [a]Ref.[cation]BF 4[14,32][cation]PF 6[32,33][cation]SbF 6[30][cation]NO 3[14][cation]CH 3CO 2[14][cation]HSO 4[16f][cation]B(Et 3Hex)[34][a]cation pyridinium,imidazolium,ammonium ion.REVIEWSP .Wasserscheid and W.Keim preparative work.The purity of the system is essential for many solvent applications and for the characterization of their physical and chemical properties.Whereas organic solvents are usually purified by distillation before use,this method is not suitable to clean up ionic liquids due to their nonvolatile character.For this reason,the highest purity possible must be attained during the synthesis itself.For example,during the exchange of chloride ions for the desired anions,it must be ensured that no halide ions remain in the system.Also traces of the acid used in the synthesis can lead to unwanted chemical reactivity.High purity in the synthesis of binary ionic liquids is usually achieved by anion exchange over an ion exchanger.The described methods can,of course,also be used to prepare previously unknown combinations of cations and anions which could also result in low-melting salts.In addition there is the possibility to obtain ionic liquids with new properties by the mixture of several different salts.[35]3.Characteristic Properties of Ionic LiquidsThe physical and chemical properties of ionic liquids can be specifically varied over a wide range by the selection of suitable cations and anions.The possibility arises to optimize the ionic reaction medium for a specific application by stepwise tuning the relevant solvent properties.For this reason ionic liquids have been referred to as ªdesigner solventsºin several publications.[36]In the following section,we attempt to illustrate the relationships between the structural features of an ionic liquid and its important physical and chemical properties,on the basis of a few selected examples.3.1.Melting PointThe key criterion for the evaluation of an ionic liquid is,by definition,its melting point.Of particular significance is therefore the question of the relationship between the structure and chemical composition of an ionic liquid and its melting parison of the melting points of different chloride salts illustrates the influence of the cation clearly:High melting points are characteristic for alkali metal chlorides,whereas chlorides with suitable organic cations melt at temperatures below 1508C (Table 4).[6c,37]In the literature,the following features are discussed for cations of low-melting salts:low symmetry,[1]weak intermo-lecular interactions (such as the avoidance of hydrogen bonding),[16a,38]and a good distribution of charge in the cation.[39]Besides the cation,the anion influences the melting point,parison of the melting points of different salts with the 1-ethyl-3-methylimidazolium (EMIM)ion emphasizes that,in most cases,an increasing size of the anion with the same charge leads to a further decrease in the melting point (Table 5).For ionic liquids prepared by reaction of a halide [cati-on] X Àwith a Lewis acid MX y ,the molar ratio of the two reactants influences the melting points (Figure 2).[40]As already shown in Figure 1,a quasi-binary system with the AlCl 4Àion only exists for exact 1:1mixtures in the system [EMIM]Cl/AlCl 3.The fact that a local maximum in melting temperature is observed at exactly this composition indicates that the presence of several anions in the ionic liquid has the effect of decreasing the meltingpoint.Figure 2.Experimental phase diagram in the system [EMIM]Cl/AlCl 3(EMIM 1-ethyl-3-methylimidazolium ion).3.2.Vapor Pressure and Thermal Stability Ionic liquids have no measurable vapor pressure.This is a great advantage from a process engineering viewpoint,since separation by distillation of a reaction mixture becomes more effective as a method of product isolation.The well-known problem of azeotrope formation between the solvent and the products does not arise.The thermal stability of ionic liquids is limited by the strength of their heteroatom Àcarbon and their heteroa-tom Àhydrogen bonds,respectively.Ionic liquids synthesized by direct protonation of an amine or phosphane show,for Table 4.Melting points of various chlorides.Salt M.p.[8C]NaCl 803KCl772R R ' methyl ([MMIM]Cl)[a]125R methyl,R ' ethyl ([EMIM]Cl)87R methyl,R ' n -butyl ([BMIM]Cl)65[a]MMIM 1,3-dimethylimidazolium.Table 5.Influence of different anions on the melting point of imidazolium salts.Imidazolium salt M.p.[8C]Ref.[EMIM]Cl 87[6c][EMIM]NO 255[14][EMIM]NO 338[14][EMIM]AlCl 47[40][EMIM]BF 46[a][17d][EMIM]CF 3SO 3À9[16a][EMIM]CF 3CO 2À14[16a][a]Glass transition.REVIEWS Ionic Liquidsexample,significantly restricted thermal stability.Many melts with trialkylammonium ions already decompose at a temper-ature below808C in vacuo(depending on the boiling point of the related amine or acid).For ionic liquids obtained by alkylation of an amine or phosphane the tendency to undergo thermally induced transalkylation or dealkylation reactions (retro-quaternization reaction)is strongly related to the nature of their anion.While1508C has to be considered as maximum working temperature for most of the quaternary ammonium chloride salts,1-ethyl-3-methylimidazolium (EMIM)tetrafluoroborate,for example,has been reported to be stable to about3008C[41]and[EMIM][(CF3SO2)2N] (m.p.À38C)is stable up to even more than4008C.[16a] Consequently,some ionic liquids have,in contrast to water and most organic solvents,a liquid range of up to more than 4008C.3.3.DensityThe dependence of the density of an ionic liquid on the type of cation and anion can be illustrated clearly by the example of chloroaluminate and bromoaluminate melts.A comparison of chloroaluminate melts with different cations reveals an almost linear relationship between the density and the length of the N-alkyl chain on the imidazolium cation(Figure3).[40]Figure3.Dependence of the density1of1,3-dialkylimidazolium tetra-chloroaluminate melts on the type of both alkyl groups;measurement temperature at608C,x(AlCl3) 0.5.More generally,it can be concluded that the density of comparable ionic liquids decreases as the bulkiness of the organic cation increases.Slight structural changes in the cation allow a fine adjustment of the density.Varying the anion results in more obvious effects in several cases.With bromoaluminate melts for example,it was possible to achieve densities unusual for normal organic solvents(Figure4).[42]Density measurements of ionic liquids with triflate or trifluoroacetate ions confirmed the more general result that a certain density range is established by the choice of anion,within which a fine adjustment is possible by careful choice of the cation.[16a]3.4.ViscosityThe viscosity of ionic liquids is essentially determined by their tendency to form hydrogen bonding and by the strength of their van der Waals interactions.[16a]Figure4.Dependence of the density1of two1-ethyl-3-methylimidazo-lium tetrahaloaluminate melts on the mole fraction of aluminum trihalide at608C.The effect of hydrogen bonding becomes clear when,for example,the viscosities of chloroaluminate melts of different compositions are compared(Figure5).[40]The increase in viscosity of more than a factor of ten in ionic liquidswithFigure5.Dependence of the dynamic viscosity h[cP]of two1,3-dialkylimidazolium tetrachloroaluminate melts on the mole fraction of aluminum trichloride at258C.x(AlCl3)<0.5is a result of the formation of hydrogen bonds between the hydrogen atoms of the imidazolium cation and the basic chloride ion.This statement is supported by IR[43] and X-ray spectroscopy,[44]ROESY-NMR,and theoretical calculations.[45]In acidic mixtures,however,the anions AlCl4Àand Al2Cl7Àare present,in which the negative charge is much better distributed.This leads to the formation of weaker hydrogen bonds and a much lower viscosity. Comparison of the viscosity of different,hydrophobic ionic liquids with1-n-butyl-3-methylimidazolium(BMIM)ions emphasizes,in addition,the interplay between van der Waals interactions and hydrogen bonding(Table6).[16a]The transi-tion from the triflate ion to the n-C4F9SO3Àion,and from the trifluoroacetate ion to the n-C3F7COOÀion reveals anTable6.Dynamic viscosities h of various1-n-butyl-3-methylimidazolium (BMIM)salts at208C.Anion[A]Àh[cP]CF3SO3À90n-C4F9SO3À373CF3COOÀ73n-C3F7COOÀ182(CF3SO2)2NÀ52REVIEWS P.Wasserscheid and W.Keimobvious increase in viscosity.It is apparent that the stronger van der Waals interactions in the case of the n-C4F9SO3Àand n-C3F7COOÀions result in a higher viscosity of the ionic parison of the viscosities of[BMIM]CF3SO3with [BMIM](CF3SO2)2N,reveals a lower viscosity despite stron-ger van der Waals interactions for ionic liquids with the (CF3SO2)2NÀion.In this case,the almost complete suppres-sion of hydrogen bonding overcompensates for the expected increase in viscosity.[16a]The structure of the cation also influences the viscosity of the ionic liquid.The lowest viscosities are usually obtained for melts with the1-ethyl-3-methylimidazolium(EMIM)ion,in which a side chain with sufficient mobility is combined with a low molar mass.Longer or fluorinated alkyl chains result in higher viscosities because of stronger van der Waals inter-actions.[16a]The viscosity of ionic liquids can be lowered,drastically in some cases,by only slight increases in temperature[40,46]or by the addition of small amounts of organic cosolvents.[47]3.5.Solvation Strength and Solubility CharacteristicsThe tuning of solubility properties of an ionic liquid by the careful choice of cation and anion deserves particular attention.The influence of the cation,for example,is shown by investigations of the solubility of1-octene in different tosylate melts(Figure6).[25]It can be seen that with increasing nonpolar character of the cation,the solubility of1-octene in the melt increases markedly.In methyl-tri-n-octylammo-nium tosylate a single-phase reaction mixture is obtained.This example shows that stepwise variation of the solubility properties can be achieved by variation of the alkyl group on the cation.The influence of the anion on the solubility characteristics of ionic liquids can be demonstrated in an impressive fashion by the example of the water solubility of different melts containing the BMIM ion.While[BMIM]Br,[BMIM]-CF3COO,and[BMIM]CF3SO3are highly water-soluble,ionic liquids with the same cation but with a PF6Àor(CF3SO2)2NÀion form biphasic mixtures with water.The water content of the ionic liquid[BMIM](CF3SO2)2N at208C is only1.4weight percent.[16a]Several ionic liquids showing a miscibility gap with water have been considered as interesting candidates for separation processes by liquid±liquid extraction.Rogers et al.inves-tigated,for example,the solubility of different acids and bases in water/[BMIM]PF6at different pH values of the aqueous phase.[48]Interestingly,their results reveal a higher solubility of neutral substrates in the ionic liquid,while ionic species dissolve preferentially in the aqueous layer.The authors conclude that the solubility properties of[BMIM]PF6versus water show high similarity to organic solvents.The substitu-tion of volatile organic solvents by ionic liquids in extractive separation processes may therefore be an interesting option. Many ionic liquids are completely miscible with organic solvents if their dielectric constants exceed a characteristic limit.This limit appears to be specific for each cation/anion combination(Table7).[16a]The solubility of supercritical CO2in[BMIM]PF6that has recently been investigated by Brennecke s group is remark-able,too.[49]In the biphasic system scCO2/[BMIM]PF6 60mol%of CO2dissolve in the ionic liquid at80bar CO2 pressure.Hereby,the volume of the ionic liquidincreases only by10±20%,however.As a firstapplication of this interesting biphasic system,theauthors investigated the extraction of naphthalenefrom the ionic liquid.They succeeded in recoveringthe naphthalene quantitatively without any detect-able contamination of the extract by the ionic liquid.Without doubt,the key to the successful use ofionic liquids lies in the skillful exploitation of theirexceptional solubility characteristics.Further system-atic investigations are necessary,however,to take fulladvantage of this huge potential.One very promising possibility is,for example,theinvestigation of the polarity of ionic liquids.Thepolarity of a solvent is usually determined in a purelyempirical fashion.A well-understood,easily measur-able and strongly solvent-dependent process is deter-Figure6.Solubility of1-octene in four different tri-n-alkylmethylammonium tosylatemelts at808C.n(C) number of C atoms of the alkyl residue.Table7.Miscibility of various ionic liquids with the1-ethyl-3-methylimidazolium(EMIM)ion in organic solvents with the dielectric constant e.[a] Solvent e[EMIM]CF3SO3[EMIM]CF3COO[EMIM]n-C3F7COO[BMIM]CF3COO[b][BMIM]n-C3F7COO CH2Cl28.93m m m m mTHF7.58m m m m methyl acetate 6.02m pm pm m mtoluene 2.38im im im im im1,4-dioxane 2.01im im im im im[a]m:miscible;pm:partially miscible;im:immiscible.REVIEWS Ionic Liquids mined in a large number of different solvents,for example the spectral absorption of a solvatochromic dye.Empirical solvent polarity parameters are derived from the measured absorption maxima,which reflect the solvating ability of a solvent much more comprehensively than the individual physical constants.[50]Amongst the many empiri-cal polarity scales,the E (T)(30)scale introduced by Dimroth et al.in 1963[51]and further devel-oped by Reichhardt et al.in 1971has proven successful,and is based on the solvatochromism of a pyridinium-N -phenolate betaine dye.[52]This method has also been used successfully to determine the polarity of a small number of ionic liquids.The results obtained confirm the considerable width of variation of solvent polarity of ionic liquids.While,for example,tetra-n -hexylammonium benzoate with an E (T)(30)value of 0.41lies within the polarity range of DMF,[53]an E (T)(30)value of 0.95was determined for ethyl-ammonium nitrate corresponding to a polarity between CF 3CH 2OH and water.[4,54][BMIM]PF 6was investigated by using the same method and its E (T)(30)value was found to correspond to a polarity in the range of methanol.[55]However,recent work by Armstrong et al.gave rise to the question whether the chemical nature of the solvatochromic dye influences the result of the polarity determination of an ionic liquid.These authors coated GC columns with several ionic liquids and compared the retention times of a large number of substances.[56]The results of their study indicate different polarity of ionic liquids depending on the nature of the tested compounds.While [BMIM]PF 6,for example,acts like an unpolar stationary phase versus unpolar molecules (like n -octane),very long retention times are observed with proton-donor compounds.The authors attribute a dual polarity behavior to the ionic liquids under investigation.Unfortunately the number of systematic investigations concerning the polarity of ionic liquids is still very limited.More research in this field should be encouraged in order to establish efficient criteria to determine the right ionic liquid candidate for a given solvent application.3.6.Acidity and Coordination AbilityThe acidity and coordination properties of an ionic liquid are essentially determined by the nature of its anion.Many intermediate levels between ªstrongly basic/strongly coordi-natingºand ªstrongly acidic/practically noncoordinatingºcan be realized by careful choice of the anion (Table 8).[30]In this context,those ionic liquids have to be mentioned which form a neutral anion (e.g.AlCl 4À)or an acidic anion (e.g.Al 2Cl 7À)from a basic anion (e.g.Cl À)by addition of a Lewis acid (e.g.AlCl 3).In Scheme 3this behavior is illustrated by the example of a EMIM chloroaluminate melt.Chloroaluminate melts are designated as basic when the molar ratio of AlCl 3is smaller than 0.5.A neutral melt is referred to at an AlCl 3ratio of exactly 0.5,where essentially only the anion AlCl 4Àis present.[22a]Finally,an acidic chloroaluminate melt is one in which the AlCl 3ratio is larger than 0.5.In such acidic melts,the anions Al 2Cl 7Àand Al 3Cl 10Àexist,which act as very strong Lewis acids.[27]Two further phenomena in the field of acid/base chemistry of ionic liquids deserve to be mentioned.These are the so-called ªlatent acidityºand ªsuperacidityºof protons in ionic liquids.The latent acidity of ionic liquids arises when weak bases are added to buffered neutral chloroaluminate melts.Such melts are formed when,for example,excess alkali metal chloride (MCl)is added to an acidic chloroaluminate melt.[57]The alkali metal chloride MCl reacts according to Equa-tion (4)with the acidic chloroaluminate dimers until themelt becomes neutral.A buffered melt is one in which the neutrality of the melt is maintained by reaction of excess alkali metal chloride when acid AlCl 3is added.The latent acidity of this neutral system becomes noticeable when a weak base (B)such as N ,N -dimethylaniline,pyrrole,or acetylferro-cene is added.[58]An adduct is formed between the added base and AlCl 3with precipitation of the alkali chloride MCl [Eq.(5)].This reaction is not observed in the absence of excess alkali metal cations.The latent acidity of different ionic liquids has already been quantitatively measured.[59]In our group,ionic liquids with latent acidity have been successfully used as solvents in the Ni-catalyzed oligomerization of 1-butene (see Section 4.8).[60]The superacidity of protons in several ionic liquids is also worth mentioning.It has been observed when strong mineral acids were dissolved in acidic chloroaluminate ionic liquids.[61]Smith and co-workers investigated the acidity of such protons in ionic liquids by the protonation of aryl compounds with a solution of HCl gas in acidic [EMIM]Cl/AlCl 3melts.The acidity of the protons in the melt were measured quantita-Table 8.Coordinative characteristics of various anions.Acidity/coordination basic/strongly coordinating neutral/weakly coordinating acidic/non-coordinatingCl ÀAlCl 4ÀAl 2Cl 7ÀAc ÀCuCl 2ÀAl 3Cl 10ÀNO 3ÀSbF 6ÀSO 42ÀBF 4ÀCu 2Cl 3ÀPF 6ÀCu 3Cl 4ÀScheme 3.Control of the acidity of ionic liquids by the ratio of halide to Lewis acid examplified for 1-ethyl-3-methylimidazolium (EMIM)chloroaluminate melt.。
mse-16

The Nobel Prize in Physiology or Medicine 1962
Francis Harry Compton Crick (1916 -) James Dewey Watson (1928 -) Maurice Hugh Frederick Wilkins(1916 ) "for their discoveries concerning the molecular structure of nucleic acids and its significance for information transfer in living material"
熱塑性、熱固性高分子
依高溫機械性質分類
熱塑性高分子(thermoplastic polymer,thermoplasts):高溫 軟化,冷卻硬化,完全可逆 加 熱、加壓 過高溫破壞主鏈 線性、彈性鏈分支
熱固性(thermosetting polymer,thermosets):永久 硬化 不可逆
PU,橡膠,PS,PVC
先進(advanced)高分子材料
超高分子量聚乙烯: 4 x 106 g/mol 衝擊抵抗性、耐磨、低 磨擦係數、自潤、不黏、抗 一般溶劑、優良低溫特性、 優良隔音與能量吸收、電絕 緣與介電性
液晶高分子
半結晶、非晶、液晶 液晶:熱穩定性、強而 剛硬、高衝擊強度、化 學惰性、耐燃、燃燒產 物較無毒性
The Nobel Prize in Chemistry 1974 Paul J. Flory(1910 - 1985)
澳洲国立大学现任校长是谁

1 澳洲国立大学校长介绍
据立思辰留学360介绍,澳洲国立大学是澳洲知名大学,该校高品质的教育质量吸引了大批海外学子,下面是澳洲国立大学现任校长:
校长名:布莱恩·保罗·施密特(Brian Paul Schmidt),
介绍:1967年出生于美国,27岁移民至澳大利亚,拥有美、澳双重国籍,是澳大利亚国立大学斯特罗姆勒山天文台天体物理学家,也是该大学天文学与天文物理学研究学院澳大利亚研究理事会教授,其重要研究是使用超新星作为“宇宙探测器”。
2011年10月4日荣获诺贝尔物理学奖。
2 澳洲国立大学知名校友列表
澳洲国立大学知名校友介绍:
青霉素的发现者Howard Florey爵士
杰出的历史学家Keith Hancock爵士
参议员Nick Minchin;
美国驻以色列大使(1995-1997)Martin Indyk
探险家Tim Macartney-Snape
联邦法院法官Justice Tony Whitlam
3 澳洲国立大学教育优势
澳洲国立大学教育优势介绍:
澳洲国立大学是一所位于澳洲首都特区堪培拉的研究型国立大学。
它同时也是国际研究型大学联盟、澳洲八大名校、大学天文研究协会以及环太平洋大学联盟的盟校之一。
ANU在大洋洲具特殊学术地位,澳洲四大国家科学院就有三座是设立在ANU校园,分别是:澳洲科学院、澳洲人文科学院、澳洲社会科学院。
校内学者获选为澳洲联邦院士人数更超过270名,居所有澳洲大学之冠;而英国皇家学会的成员人数亦是澳洲第一。
杰出校友包括了六名诺贝尔奖得主与两名澳洲总理等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
澳大利亚国立大学坐拥南半球规模最大的图书馆,澳大利亚国立大学附近还坐落着众多的国家级文化和学术机构,如澳大利亚国家图书馆、澳大利亚国立美术馆、澳大利亚国家博物馆、澳洲国家档案馆、澳大利亚联邦科学与工业研究组织(CSIRO)、澳洲国家植物园、澳洲国立影片与声音档案馆、澳洲国家生物标准实验室、澳洲地质调查组织(AGSO)、澳洲犯罪学研究所(AIC)、澳洲战争纪念馆、国家肖像美术馆、堪培拉博物馆暨美术馆和国家首都展览馆等等。
ANU与这些机构有着紧密的联系和合作。
澳洲国立大学化学专业基本信息:
注:
(1)上表的排名是2015年QS化学专业的排名,在该榜单中,澳洲国立大学排名世界第51-100位,澳洲第4位(前3位依次是:墨尔本大学、莫纳什大学和悉尼大学)
(2)TOEFL单项阅读与写作要求不低于20分,口语与听力要求不低于18分;IELTS单项要求不低于6.0分
(3)研究型项目实质全年皆可申请,全年皆可入学。
但如欲申请奖学金的话,第一学期需在8月31日前申请,第二学期需在5月31日前申请。
一般而言,研究型项目亦有一定的课程学习要求,所以大多数情况下,研究型项目的入学一般与授课型项目是相同的——也是第一学期或第二学期开学季入学
(4)注意,此处的本科均分要求是按澳洲国立大学的标准设定的;本科学校质量不能与澳洲国立大学相提并论的话,均分要求会更高,具体视学校给予学生的条件Offer而定,最高甚至可达85以上。
一般而言,泰晤士、上交大或QS世界排名上榜甚至靠前的学校会比较占优;985、211看情形,也可能会具有一定的优势
申请说明
据留学360介绍,澳洲国立大学化学(Chemistry)专业研究生只开设有研究型项目,分别是:
化学硕士(M.Phil in Chemistry):为期2年,属研究型项目,要求申请者拥有化学或其相近专业领域背景。
需要提前选定研究项目,联系并确定导师,具体导师及项目列表请见下方的外部链接
化学博士(PhD in Chemistry):为期2-4年,属研究型项目,要求申请者拥有化学或其相近专业领域背景。
需要提前选定研究项目,联系并确定导师,具体导师及项目列表请见下方的外部链接
注:化学专业四年制(Honours)本科、授课型硕士或研究生文凭课程学位,均可满足该专业的学位背景要求
专业设置
澳洲国立大学化学专业开设的研究领域分生物化学、无机化学、有机化学、理论与物理化学四个领域,具体如下:。
