酸碱盐表--原始
常见的酸碱盐资料

指示剂
使石蕊试液变__蓝__色, 使酚酞试液变__红___色
使石蕊试液变__蓝__色 使酚酞试液变__红___色
化 学
非金属
CO2+ 2NaOH=Na2CO3+H2O
性 氧化物SO2+2NaOH=Na2SO3+H2O
CO2+Ca(OH)2= CaCO3 +H2O
质 酸 NaOH+HCl=
Ca(OH)2+ 2HCl=
碱
NaOH+HCl= NaCl+H2O
2NaOH+H2SO4= Na2SO4+2H2O
盐 AgNO3+HCl=
BaCl2+H2SO4=
AgCl +HNO3
BaSO4 +2HCl
总结:酸的通性
1.能使指示剂变色
酸能使石蕊变红, 不 能使酚酞变色 ,使PH试纸变棕--红色
2.酸+金属=盐+氢气
条件:(1)金属指排在H
5. 酸+盐=新酸+新盐条件:生成物中有↑ 或↓或水
AgNO3+HCl=AgCl ↓ + HNO3
Ba(NO3)2+H2SO4=BaSO4 ↓+ 2HNO3
CaCO3+2HCl=CaCl2 + H2O + CO 2↑
金属活动性顺序表(强到弱)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
Zn+H2SO4=ZnSO4+H2↑
前面的活泼金属 Fe +H2SO4=FeSO4+H2↑
3.酸+金属氧化物=盐+水
酸碱盐溶液表格一览
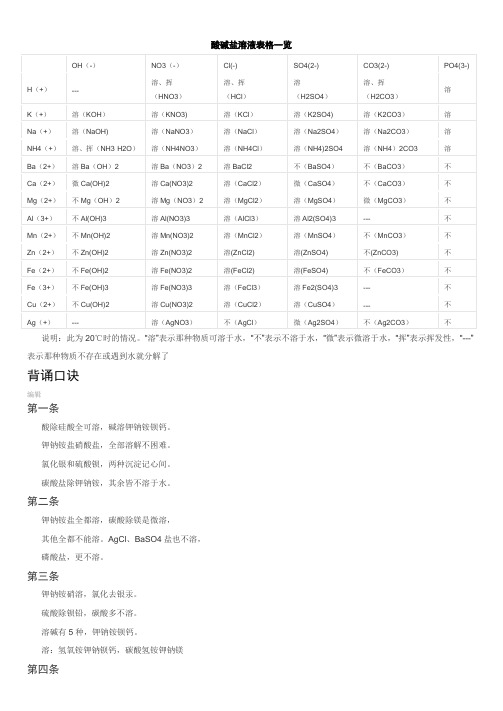
酸碱盐溶液表格一览OH(-)NO3(-)Cl(-) SO4(2-) CO3(2-) PO4(3-)H(+)--- 溶、挥(HNO3)溶、挥(HCl)溶(H2SO4)溶、挥(H2CO3)溶K(+)溶(KOH)溶(KNO3) 溶(KCl)溶(K2SO4) 溶(K2CO3)溶Na(+)溶(NaOH) 溶(NaNO3)溶(NaCl)溶(Na2SO4)溶(Na2CO3)溶NH4(+)溶、挥(NH3·H2O)溶(NH4NO3)溶(NH4Cl)溶(NH4)2SO4 溶(NH4)2CO3 溶Ba(2+)溶Ba(OH)2 溶Ba(NO3)2 溶BaCl2 不(BaSO4)不(BaCO3)不Ca(2+)微Ca(OH)2 溶Ca(NO3)2 溶(CaCl2)微(CaSO4)不(CaCO3)不Mg(2+)不Mg(OH)2 溶Mg(NO3)2 溶(MgCl2)溶(MgSO4)微(MgCO3)不Al(3+)不Al(OH)3 溶Al(NO3)3 溶(AlCl3)溶Al2(SO4)3 --- 不Mn(2+)不Mn(OH)2 溶Mn(NO3)2 溶(MnCl2)溶(MnSO4)不(MnCO3)不Zn(2+)不Zn(OH)2 溶Zn(NO3)2 溶(ZnCl2) 溶(ZnSO4) 不(ZnCO3) 不Fe(2+)不Fe(OH)2 溶Fe(NO3)2 溶(FeCl2) 溶(FeSO4) 不(FeCO3)不Fe(3+)不Fe(OH)3 溶Fe(NO3)3 溶(FeCl3)溶Fe2(SO4)3 --- 不Cu(2+)不Cu(OH)2 溶Cu(NO3)2 溶(CuCl2)溶(CuSO4)--- 不Ag(+)--- 溶(AgNO3)不(AgCl)微(Ag2SO4)不(Ag2CO3)不说明:此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了背诵口诀编辑第一条酸除硅酸全可溶,碱溶钾钠铵钡钙。
常见酸碱盐溶解表℃

21.5
+溶K
溶112
31.6
溶
11.1
溶
34.7
溶
111.5
+溶Rb
117溶
53
溶
48
溶
91
溶
450
+溶Cs
330溶
23
溶
179
溶
186
溶
﹥500
2+难Be
溶
107
溶
39
溶
﹥500
2+难Mg
0.009溶
70
溶
33
溶
54.2
微
2+微Ca
0.165溶
129
微
0.21
溶
74.5
难
2+微Sr
溶0.8
71
3+In
微
0.04
溶
500﹥
——
——
+Tl
溶
18.6
微
0.05
难
0.0006
3+Tl
——
——
溶
溶
2+Ge
微
0.24
溶
——
——
溶
4+Ge
——
——
——
——
——
——
2+Sn
难
溶
溶
微
0.98
4+Sn
溶
500﹥
——
——
——
——
2+Pb
难
微
0.064
微
0.084
微
0.063
3+As
认识酸碱盐

14
2 4 2 3 2
2012 41.通过对化学的学习,我们认识了“酸”和“碱”,请回答下列 问题: (1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在有相同 的 H+ 离子(填符号).
13
盐:Na2SO4/Na2SO3/Na2S等 氧化物:H2O/Na2O/SO2/SO3
1、预习第3节,如何识别酸碱盐。 2、写出酸碱盐的化学式(各4个,任意)。 3、本次测验最后的计算题出错的同学,把 题目整理在大演草上。
12
2009 11.将化学知识系统化,有助于对问题的认识。“物质构成的奥秘” 这一主题让我们认识了常见的化学元素、物质组成的表示等内容。 现有Na、H、O、S四种元素,请你参与下列问题的研究。 (2)在上述四种元素中,任选两种或三种元素组成合适的物质,将 其化学式填写在横线上。酸: ;碱: ;盐: ; 氧化物: 。 酸:H SO /H SO /H S,碱:NaOH
判断:是否是酸 NaHSO4=Na++H++SO427
Ca(OH)2、NaOH、KOH、Ba(OH)2
Ca(OH)2=Ca2++2OHNaOH====Na++OHKOH======K++OHBa(OH)2=Ba2++2OH定义:电离时生成的阴离子全部是OH-的化合物。
判断:是否是碱 Cu2(OH)2CO3=2Cu2++2OH-+CO328
1
2
氢H 钠 Na 磷 P 钙 Ca 碘 I
碳C 镁 Mg 硫 S 铁 Fe 金 Au
氮N 铝 Al 氯 Cl 铜 Cu 银 Ag
氧O 硅 Si 钾K 锌 Zn 钡 Ba
酸碱盐表格
一、干燥剂 1. 使用干燥剂的目的是除去气体中混有的水蒸气。
2.我们学过的干燥剂有氢氧化钠、浓硫酸、氧化钙、氯化钙等。
氢氧化钠易潮解;浓硫酸具有吸水性;而氧化钙可以与水反应:CaO+H 2O=Ca(OH)2 3.氢氧化钠氢氧化钠等碱性干燥剂不能干燥氯化氢、二氧化碳、二氧化硫等酸性气体。
4. 浓硫酸浓硫酸等酸性干燥剂不能干燥氨气等碱性气体。
二、酸的定义和分类酸:物质溶于水时,形成的阳离子全部是H +的化合物。
由于酸、碱、盐溶于水时会电离出阴、阳离子,所以酸、碱、盐的水溶液具有导电性。
酸的电离:HCl=H ++Cl -,H 2SO 4=2H ++SO 42-三、碱的定义和分类碱:物质溶于水时,形成的阳离子全部是OH -的化合物。
四、氢氧化钠和氢氧化钙部分变质 1.氢氧化钠部分变质的证明方法:① 取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:Na 2CO 3+CaCl 2=2NaCl+CaCO 3↓ 或 Na 2CO 3+Ca(NO 3)2=2NaNO 3+CaCO 3↓② 过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
2.氢氧化钙固体部分变质的证明方法:① 取样,加适量水使固体完全溶解,加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑② 另取少量固体,加氯化铵(或硫酸铵)研磨,如果闻到刺激性氨味,说明氢氧化钙存在,氢氧化钙部分变质:Ca(OH)2+2NH 4Cl=CaCl 2+2NH 3↑+2H 2O 或 Ca(OH)2+(NH 4)2SO 4=CaSO 4+2NH 3↑+2H 2O 3.在所有的复分解反应中,中和反应优先发生,并且反应可以瞬时完成。
中和反应是放热的反应。
中和反应同氧化反应、还原反应一样,是特征反应,不属于四大基本反应类型。
酸碱盐溶液表格一览

酸碱盐溶液表格一览————————————————————————————————作者:————————————————————————————————日期:2酸碱盐溶液表格一览OH(-)NO3(-)Cl(-) SO4(2-) CO3(2-) PO4(3-)H(+)--- 溶、挥(HNO3)溶、挥(HCl)溶(H2SO4)溶、挥(H2CO3)溶K(+)溶(KOH)溶(KNO3) 溶(KCl)溶(K2SO4) 溶(K2CO3)溶Na(+)溶(NaOH) 溶(NaNO3)溶(NaCl)溶(Na2SO4)溶(Na2CO3)溶NH4(+)溶、挥(NH3·H2O)溶(NH4NO3)溶(NH4Cl)溶(NH4)2SO4 溶(NH4)2CO3 溶Ba(2+)溶Ba(OH)2 溶Ba(NO3)2 溶BaCl2 不(BaSO4)不(BaCO3)不Ca(2+)微Ca(OH)2 溶Ca(NO3)2 溶(CaCl2)微(CaSO4)不(CaCO3)不Mg(2+)不Mg(OH)2 溶Mg(NO3)2 溶(MgCl2)溶(MgSO4)微(MgCO3)不Al(3+)不Al(OH)3 溶Al(NO3)3 溶(AlCl3)溶Al2(SO4)3 --- 不Mn(2+)不Mn(OH)2 溶Mn(NO3)2 溶(MnCl2)溶(MnSO4)不(MnCO3)不Zn(2+)不Zn(OH)2 溶Zn(NO3)2 溶(ZnCl2) 溶(ZnSO4) 不(ZnCO3) 不Fe(2+)不Fe(OH)2 溶Fe(NO3)2 溶(FeCl2) 溶(FeSO4) 不(FeCO3)不Fe(3+)不Fe(OH)3 溶Fe(NO3)3 溶(FeCl3)溶Fe2(SO4)3 --- 不Cu(2+)不Cu(OH)2 溶Cu(NO3)2 溶(CuCl2)溶(CuSO4)--- 不Ag(+)--- 溶(AgNO3)不(AgCl)微(Ag2SO4)不(Ag2CO3)不说明:此为20℃时的情况。
酸碱盐表格
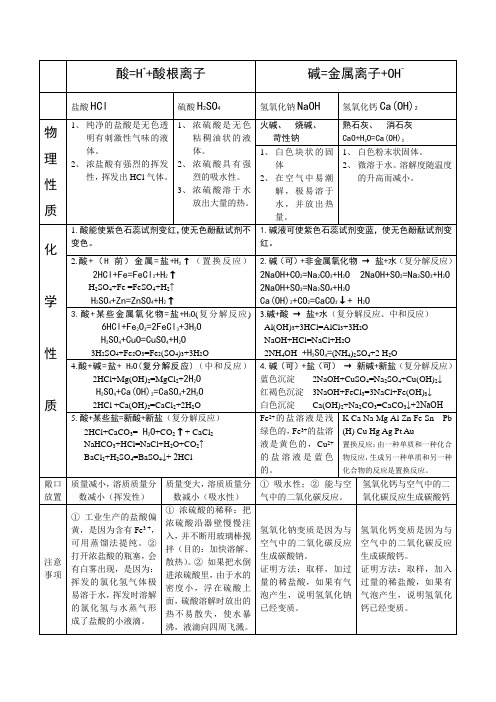
H2SO4+Zn=ZnSO4+H2↑
2.碱(可)+非金属氧化物→盐+水(复分解反应)
2NaOH+CO2=Na2CO3+H2O 2NaOH+SO2=Na2SO3+H2O
2NaOH+SO3=Na2SO4+H2O
Ca(OH)2+CO2=CaCO3↓+ H2O
3.酸+某些金属氧化物=盐+H2O(复分解反应)6HCl+Fe2O3=2FeCl3+3H2O
H2SO4+Ca(OH)2=CaSO4+2H2O
2HCl+Ca(OH)2=CaCl2+2H2O
4.碱(可)+盐(可)→新碱+新盐(复分解反应)
蓝色沉淀2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
红褐色沉淀3NaOH+FeCl3=3NaCl+Fe(OH)3↓
白色沉淀Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
注意:金属比新金属活泼,K、Ca、Na不遵循这样的置换反应,它们与盐溶液反应时,会先和水反应生成对应的碱,然后再和盐溶液反应。
氯化钠
NaCl
食盐
白色粉末,水溶液有咸味,
溶解度受温度影响不大
①作调味品,腌制咸菜;
②作防腐剂;
③消除积雪(长期过量使用融雪剂会破坏植被和道路,还会使土壤盐碱化)
④农业上用氯化钠溶液来选种
H2SO4+CuO=CuSO4+H2O3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
九年级化学酸碱盐总结

4、碱能跟某些盐发生复分解反应,生成其他碱和盐。
F eCl+3NaOH=3NaCl+Fe(OH)↓(红褐色沉淀)32↓(蓝色沉淀)酸、碱、盐一、重要的酸:1、盐酸HCl:无色液体,易挥发,有刺激性气味,酸性较弱。
2、硫酸H SO:无色油状液体,不易挥发,强腐蚀性,密度较大。
243、硝酸HNO:无色液体,易挥发,强腐蚀性,有特殊刺激性气味,酸性最强。
3二、稀酸的化学性质1、酸能使紫色石蕊溶液变红。
2、酸能跟较活泼金属发生置换反应,放出氢气,并生成盐。
Zn+H SO=ZnSO+H↑24423、酸能跟某些盐反应,生成其他酸和盐。
H Cl+AgNO=HNO+AgCl↓(白色沉淀)334、酸能跟某些金属氧化物反应,生成盐和水。
CuO+H SO=CuSO+H O24425、酸跟碱发生中和反应,生成盐和水。
H Cl+NaOH=NaCl+H O2三、基本反应1、中和反应:酸跟碱反应,生成盐和水,这种反应叫做中和反应。
2、复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
通式:AB+CD=AD+CB四、浓酸1、浓硫酸:具有强氧化性,强腐蚀性,强脱水性,可作干燥剂。
2、浓硫酸的稀释:水的密度比浓硫酸小,当水滴入浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险。
因此:稀释浓硫酸时,一点要把浓硫酸沿容器壁慢慢注入水里,并不断搅拌,切不可将水倒进浓硫酸里。
五、常见的碱1、氢氧化钙C a(OH):俗名熟石灰,消石灰,微溶于水,它的溶液俗称石灰水,具有腐蚀性。
22、氢氧化钠NaOH:俗名苛性碱,烧碱,极易溶于水,具有强腐蚀性。
3、氢氧化钾KOH:六、碱的化学性质:1、碱能使无色酚酞溶液变红,使紫色石蕊溶液变蓝。
2、碱跟酸发生中和反应,生成盐和水。
H Cl+NaOH=NaCl+H O23、碱能跟多种非金属氧化物起反应,生成盐和水。
S O+KOH=K SO+H O223232N aOH+CuSO=Na SO424七、溶液的酸碱性1、pH与溶液的酸碱性:溶液酸碱性的强弱,常以溶液的酸碱度衡量,表示为溶液的pH。
酸碱盐单元复习表格

酸碱盐单元复习表格酸、碱、盐的水溶液都能导电:溶于水时离解成能自由移动的阴、阳离子二、部分酸、碱、盐的化学式:四、物质的颜色:鉴别鉴别Cl和SO4时须知:①检验SO4:最好用Ba(NO3)2、Ba(OH)2溶液;②在未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含Ag +或SO 42-; ③鉴别Cl -和SO 42-:只能用BaCl 2溶液,不能用AgNO 3溶液;④检验SO 42-的另外方法:先加过量的HCl(排除干扰),再滴加BaCl 2溶液;⑤Cl -和SO 42-共存时检验:应先检验SO 42-[加过量Ba(NO 3)2或Ba(OH)2,不能用BaCl 2溶液],再检验Cl -(加AgNO 3溶液)。
六、酸、碱、盐的溶解性:钾钠铵硝都能溶,硫酸除钡氯除银,碳酸只溶钾钠铵,溶碱钾钠钡和铵。
微溶:Ca(OH)2:石灰水注明“澄清”的原因;CaSO 4:实验室制二氧化碳时不用稀硫酸的原因; Ag 2SO 4:鉴别SO 42-和Cl -时,不用硝酸银的原因。
常见沉淀物:氯化银、硫酸钡、(硫酸银):不溶于稀硝酸 碳酸盐:碳酸钙、碳酸钡、碳酸银碱:氢氧化镁、氢氧化铜、氢氧化铁七、两类反应:八、溶液的酸碱性与酸碱度的测定:九、生活中的酸和碱性质比较:(1)溶于硝酸、盐酸(2)十一、其他注意点:1.浓盐酸、浓硫酸、氢氧化钠、生石灰、纯碱晶体、硫酸铜粉末等露置在空气中:①质量如何变化?②质量分数如何变化?③是否变质?2.NaOH固体密封保存的原因:易吸收水蒸气而潮解,易吸收二氧化碳而变质。
检验是否变质:可用盐酸(酸)、Ba(OH)2(碱)、BaCl2(盐)检验。
3.对于反应“Ca(OH)2+CO2→CaCO3↓+H2O”可用于解释:①检验CO2;②白膜形成(思考:如何除去白膜?);③新彻的墙壁会出“汗”。
4.酸溶液≠酸性溶液;碱溶液≠碱性溶液。
如Na2CO3溶液是盐溶液,但溶液显碱性,可使酚酞试液变红。
酸碱盐表格——精选推荐
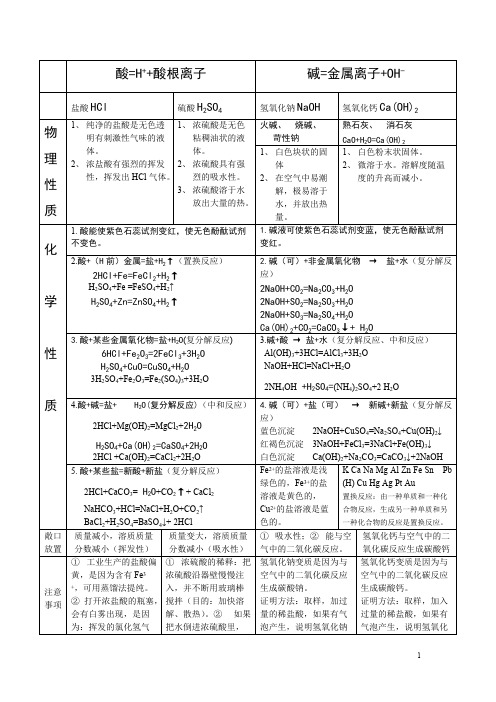
酸=H++酸根离子碱=金属离子+OH-盐酸HCl硫酸H2SO4氢氧化钠NaOH氢氧化钙Ca(OH)2火碱、烧碱、苛性钠熟石灰、消石灰CaO+H2O=Ca(OH)2物理性质1、纯净的盐酸是无色透明有刺激性气味的液体。
2、浓盐酸有强烈的挥发性,挥发出HCl气体。
1、浓硫酸是无色粘稠油状的液体。
2、浓硫酸具有强烈的吸水性。
3、浓硫酸溶于水放出大量的热。
1、白色块状的固体2、在空气中易潮解,极易溶于水,并放出热量。
1、白色粉末状固体。
2、微溶于水。
溶解度随温度的升高而减小。
1.酸能使紫色石蕊试剂变红,使无色酚酞试剂不变色。
1.碱液可使紫色石蕊试剂变蓝,使无色酚酞试剂变红。
2.酸+(H前)金属=盐+H2↑(置换反应)2HCl+Fe=FeCl2+H2↑H2SO4+Fe =FeSO4+H2↑H2SO4+Zn=ZnSO4+H2↑2.碱(可)+非金属氧化物→盐+水(复分解反应)2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(OH)2+CO2=CaCO3↓+ H2O3.酸+某些金属氧化物=盐+H2O(复分解反应)6HCl+Fe2O3=2FeCl3+3H2OH2SO4+CuO=CuSO4+H2O3H2SO4+Fe2O3=Fe2(SO4)3+3H2O3.碱+酸→盐+水(复分解反应、中和反应)Al(OH)3+3HCl=AlCl3+3H2ONaOH+HCl=NaCl+H2O2NH4OH +H2SO4=(NH4)2SO4+2 H2O4.酸+碱=盐+ H2O(复分解反应)(中和反应)2HCl+Mg(OH)2=MgCl2+2H2OH2SO4+Ca(OH)2=CaSO4+2H2O2HCl +Ca(OH)2=CaCl2+2H2O4.碱(可)+盐(可)→新碱+新盐(复分解反应)蓝色沉淀2NaOH+CuSO4=Na2SO4+Cu(OH)2↓红褐色沉淀3NaOH+FeCl3=3NaCl+Fe(OH)3↓白色沉淀Ca(OH)2+Na2CO3=CaCO3↓+2NaOH化学性质5.酸+某些盐=新酸+新盐(复分解反应)2HCl+CaCO3= H2O+CO2↑+ CaCl2NaHCO3+HCl=NaCl+H2O+CO2↑BaCl2+H2SO4=BaSO4↓+ 2HCl Fe2+的盐溶液是浅绿色的,Fe3+的盐溶液是黄色的,Cu2+的盐溶液是蓝色的。
中考化学第一轮酸碱盐

l 四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
l 在初中化学范畴内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
l 氨水的电离是NH 3·H 2O=NH 4++ OH -,所以氨水也是碱。
l 钾、钠、钙的氧化物能与水反响生成相应的碱。
如:CaO+H 2O=Ca(OH)2Ca(OH)2 CaCO 3CaO+CO 2↑, CaO+H 2O=Ca(OH)21. 碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
由于弱碱不溶于水,所以弱碱不能使指示剂变色。
2. 碱+非金属氧化物 → 盐+水(复分化反响)a) 反响产生的条件:① 碱是四大强碱;② 非金属氧化物是二氧化碳、二氧化硫、三氧化硫。
b) 根据条件我们可以写出十二个化学方程式,但必须掌握的四个化学方程式是: 2NaOH+CO 2=Na 2CO 3+H 2O (用氢氧化钠溶液吸收二氧化碳)2NaOH+SO 2=Na 2SO 3+H 2O 2NaOH+SO 3=Na 2SO 4+H 2O Ca(OH)2+CO 2=CaCO 3↓+ H 2O (查验二氧化碳;石灰墙“出汗”) 3. 碱+酸 → 盐+水(复分化反响、中和反响) 在碱的通性中,弱碱只有该性质。
4. 碱+盐 → 新碱+新盐(复分化反响)a) 反响产生的条件:①反响物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质);②新碱是氨水;③ 若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b) 铵盐一定能与四大强碱反响。
c) 新碱是沉淀:蓝色沉淀 – 2NaOH+CuSO 4=Na 2SO 4+Cu(OH)2↓红褐色沉淀 – 3NaOH+FeCl 3=3NaCl+Fe(OH)3↓白色沉淀 – 2NaOH+MgSO 4=Na 2SO 4+Mg(OH)2↓ d) 新盐是沉淀:Ba(OH)2+Na 2SO 4=BaSO 4↓+ 2NaOH Ca(OH)2+Na 2CO 3=CaCO 3↓+2NaOH e) 蓝白沉淀:Ba(OH)2+CuSO 4=BaSO 4↓+ Cu(OH)2↓ f) 红白沉淀:3Ba(OH)2+Fe 2(SO 4)3=3BaSO 4↓+ 2Fe(OH)3↓g) 波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO 4=CaSO 4+Cu(OH)2↓四、氢氧化钠和氢氧化钙变质1. 氢氧化钠变质氢氧化钠变质是因为与空气中的二氧化碳反响生成碳酸钠。
酸碱盐的分类及性质(网课)

(3)铁与盐酸的反应___F_e_+__2_H_C__l _=_F_e__C_l2__+_H__2_↑___ ;铁与稀硫酸的反应__F_e__+_H__2_S_O_4_=__F_e_S_O__4_+__H_2_↑___ 。
(4)铝与盐酸的反应__2_A_l_+__6_H_C__l _=_2_A__lC__l3_+__3_H__2_↑_ ;铝与稀硫酸的反应_2_A_l_+__3_H__2_S_O_4_=__A_l_2_(S__O_4_)_3_+__3_H。2↑
( 3 ) 氢 氧 化 钙 与 碳 酸 钠 反 应 _ _C_a_(_O_H_)_2 _+_N_ a_2_C_O_3_=_ _C_a_C_O_3_↓_ +_ _2_NaOH
(
4
)
氢
氧
化
钡
与
硫
酸
钠
反
应
_
_B_a_(_O_H_)_2 _+_N_ a_ 2_S_O_4_=_
_B_a_S_O_4_↓_+_
2NaOH
三、盐的化学性质:
1. 盐 + 金属 → 盐 `+ 金属` CuSO4+Fe=FeSO4+Cu
2. 盐 + 酸→盐`+酸` 3. 盐 + 碱→盐`+碱` 4. 盐1 + 盐2 → 盐1`+ 盐2`(反应物必须可溶;生成物有一种沉淀或气体或水)
NaCl + AgNO3 = AgCl↓+ NaNO3
三、盐的化学性质:
总结:酸+(某些)盐→新酸+新盐
? ?
小并
羊找
酸碱盐记忆

②常见沉淀:AgCl↓BaSO4↓Cu(OH)2↓Fe(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 --- 盐 + 氢气(置换反应)1. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ (最常用)(实验室制H2用的金属有Zn,Fe,Mg,Al,酸有稀H2SO4和稀HCl )(2)金属单质 + 盐(溶液) --- 另一种金属 + 另一种盐2. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu3. 铝和硝酸银溶液反应: Al+ 3AgNO3 = Al(NO3)3 + 3Ag(3)碱性氧化物(金属氧化物) +酸 --- 盐 + 水4. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O5. 氧化钙和稀盐酸反应:CaO + 2HCl = CaCl2 + H2O(4)酸性氧化物(非金属氧化物) +碱 -------- 盐 + 水6.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O7.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水 (中和反应)8.盐酸和烧碱反应:HCl + NaOH = NaCl +H2O9. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐11.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑12.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑13.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl(7)碱 + 盐 --- 另一种碱 + 另一种盐14. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH15.硫酸铜溶液与氢氧化钡:CuSO4 + Ba(OH)2 = BaSO4↓+Cu(OH)2↓(8)盐 + 盐 --- 两种新盐16.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 = AgCl↓ + NaNO317.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl中学化学常见气体性质归纳1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯化锌
ZnSO4
硫酸锌
ZnCO3
碳酸锌
Fe2+
Fe(OH)2
氢氧化亚铁
Fe(NO3)2
硝酸亚铁
FeCl2
氯化亚铁
FeSO4
硫酸亚铁
FeCO3
碳酸亚铁
Fe3+
Fe(OH)3
氢氧化铁
Fe(NO3)3
硝酸铁
FeCl3氯化铁
Fe2(SO4)3
硫酸铁
---
Cu2+
Cu(OH)2
氢氧化铜
Cu(NO3)2
硝酸铜
CuCl2
氯化铜
CuSO4
硫酸铜
---
Ag+
---
AgNO3硝酸银
AgCl氯化银
Ag2SO4硫酸银
Ag2CO3碳酸银九年级化来自常见化合物化学式OH-
NO3-
Cl-
SO42-
CO32-
H+
---
HNO3硝酸
HCl氯化氢
H2SO4硫酸
H2CO3碳酸
K+
KOH氢氧化钾
KNO3硝酸钾
KCl氯化钾
K2SO4硫酸钾
K2CO3碳酸钾
Na+
NaOH氢氧化钠
NaNO3硝酸钠
NaCl氯化钠
Na2SO4硫酸钠
Na2CO3碳酸钠
NH4+
NH4OH氢氧化铵
NH4NO3硝酸铵
硝酸镁
MgCl2氯化镁
MgSO4硫酸镁
MgCO3碳酸镁
Al3+
Al(OH)3氢氧化铝
Al(NO3)3
硝酸铝
AlCl3
氯化铝
Al2(SO4)3
硫酸铝
---
Mn2+
Mn(OH)2氢氧化锰
Mn(NO3)2
硝酸锰
MnCl2
氯化锰
MnSO4
硫酸锰
MnCO3
碳酸锰
Zn2+
Zn(OH)2氢氧化锌
Zn(NO3)2
硝酸锌
NH4Cl氯化铵
(NH4)2SO4
硫酸铵
(NH4)2CO3碳酸铵
Ba2+
Ba(OH)2氢氧化钡
Ba(NO3)2硝酸钡
BaCl2氯化钡
BaSO4硫酸钡
BaCO3碳酸钡
Ca2+
Ca(OH)2氢氧化钙
Ca(NO3)2硝酸钙
CaCl2氯化钙
CaSO4硫酸钙
CaCO3碳酸钙
Mg2+
Mg(OH)2氢氧化镁
Mg(NO3)2
