第8章氧化还原平衡
[化学]8第八章 氧化-还原反应
![[化学]8第八章 氧化-还原反应](https://img.taocdn.com/s3/m/e4ee01115a8102d276a22fae.png)
R R H H + R2C=CR2 H H C C
R R
金属催化剂表面
R R C H C
R R R H
R C H C
R R
H
多相催化加氢:
氢原子常由位阻少的方向加成
林德拉催化剂(Lindlar cat.)
第八章
氧化-还原反应
氧化反应:增加氧,减少氢的反应
还原反应:增加氢,减少氧的反应
分类:
被氧化-还原的化合物
氧化-还原试剂(O-R) 氧化反应的历程有些仍不太成熟
氧化反应:
催化氧化
(工业用) 氧化剂用空气或氧气
及催化剂
实验室氧化用试剂
烃类的氧化:
烯烃的氧化:氧化剂有KMnO4,OsO4,RCO3H, H2CrO4,O3 稀冷高锰酸钾(或碱性)氧化(顺式加成两个羟基)
臭氧氧化:双键上的H2C=变为H2C=O;
RCH=变成RCH=O,R2C=变成R2C=O
芳烃的氧化:
具有α-氢的侧链烷基易氧化为羧基
芳烃的氧化:
芳烃的氧化:
无α-氢的芳烃不反应或芳环打开
(CH3)3C KMnO4 (CH3)3C-COOH
苯胺或苯酚:
苯环上电子云密度较大易被氧化
低压氢化:催化剂为贵金属、铂、钯、镍、
Raney镍、压力1~4个大压 低温
高压氢化:催化剂为Raney镍
压力100~300
个大压 高温
碳-碳重键,碳-氮重键、硝基、醛酮的羰基均用
低压氢化
芳环、杂环、羧酸衍生物用高压氢化
第八章 氧化还原滴定法(6,7)

23
3
HCO + S ?
S?
3
微量的Cu2+、Fe3+等也能促进Na2S2O3的分解
Cr2O + 6I (过量) + 14H = 2Cr + 3I2 ? 7H2O 或 IO + 5I (过量) + 6H = 3I2 ? 3H2O
析出 I2 的反应的反应条件: 1. 酸度:0.2~0.4mol/L [ H ] 反应速度较慢 ; [ H ] I 易被空气中的氧氧化
BrO3 5Br (过量) 6H 3Br2 +3H2O
OH + 3 Br2
OH
Br
Br
Br
3HBr
KBrO
3( 一定量 )
KBr(过量)
Br2 2I I 2 2Br
用Na2 S2O3滴定析出的I 2
28
第七节
氧化还原滴定结果的计算
氧化还原滴定结果的计算关键是: 1. 准确判断滴定方式 2. 确定待测组分与滴定剂之间的计量关系
aX ~ bY ~ cZ ~ dT aX ~ dT
a cT VT M X wX d 100% ms
29
例 8-9:取废水水样100.0mL,用H2SO4酸化后,加 入0.01667mol/L K2Cr2O7溶液25.00mL,使水样中 的还原物质在一定的条件下被氧化,然后用 0.1000mol/L 的 FeSO4 滴 定 剩 余 的 Cr2O72- 用 去 15.00mL。计算废水试样的耗氧量。
2S2O3 、Sn(II )等
直接碘量法适宜在弱酸性或中性环境中进行
碱性环境中 3I 2 + 6OH - = 2IO3 + 5I + 3H2 O
第八章氧化还原电极电势(基).

->电极电位的测量
(一)标准氢电极
比与溶液中H+可达到以下平衡:
2H+ + 2e- H H2
lOOkPa^气饱和了的钳片和氢离子浓度
为lmolL>的酸溶液之间所产生的电势
差就是标准氢电极的电极电位,定为零:
SHE: Pt, H2(l««kPa) JI+(m =1)
(二)标准电极电位标准氢电极与其它各种标准状态下的电极组成原电池,标准氨电极
定在左边,用实验方法测得这
个原电池的电动势数值,就是
该电极的标准电极电位。
比较氧化剂或还原剂的强弱
标准电极电势值越大,电对中氧化型得电 子倾向越大,是强氧化剂;其共觇的还原型失 电子倾向越弱。
标准电极电势值越小,电对中 还原型失电子倾向越大,是强还原剂;其共 的氧化型得电子倾向越小。
判断氧化还原反应自发进行的方向.对角线规则
试判断标准态下反应2Fe2++ i2=2Fe3++2厂自 发进行的方向。
两电对中0°值高的氧化型物质为较强的
6
氧化剂,0值低的还原型物质为较强的还原剂。
Fe 2+ (aq) 0(Fe^/Fe^ ) = 0.77 IV
反应将逆向(由右向左)自发进行。
即:
2Feh + 21- = 2Fe2+ +
1
1 ■
强氧化剂| +强还原剂2
弱还原剂| +弱氧化剂2
bU/I )=0.5355^
【2 (s)+
2e" 广
(aq)
Fe*(aq) + e'。
氧化还原及电极电位

2.应用标准电极电位数据,解释下列现象:
(1)为使 Fe2+溶液不被氧化,常放入铁钉。
(2)H2S 溶液,久置会出现浑浊。
(3)无法在水溶液中制备 FeI3 。
( (Fe3+/Fe2+)=0.77V, (Fe2+/Fe)=-0.45V, (S/H2S)=0.14V, (O2/H2O)=1.23V,
(I2/I-)=0.54V )
解 (1) 正极反应 Cl2(g)+2e- → 2 Cl- (aq) 属于气体电极
负极反应 Ag(s)+Cl-(aq) → AgCl(s)+e- 属于金属-难溶盐-阴离子电极
电池反应 2Ag(s)+ Cl2(g) →2AgCl(s) n=2
(2) 正极反应 PbCl2(s)+2e- →Pb(s)+2Cl- (aq) 属于金属-难溶盐-阴离子电极
将 和 数据带入
= -1.136 V=1.358 V-1.136 V=0.222V,
又由
AgCl(s) + Ag Ag+ + Cl- + Ag
= =(0.222-0.799 6)V/0.059 16V=-9.76
Ksp(AgCl) = 1.74×10-10
例 8-3 在 Ag+、Cu2+离子浓度分别为 1.00×10-2mol?L-1 和 1.00mol?L-1 的溶液中加入铁
C. (-) Zn|Zn2+(c)‖Cu2+(0.1c)|Cu (+)
D. (-) Zn|Zn2+(0.1c)‖Cu2+(c)|Cu (+)
E. (-) Zn|Zn2+(2c)‖Cu2+(c)|Cu (+)
生物化学 第8章 生物氧化

天冬 氨酸
①苹果酸脱氢酶
②天冬氨酸氨基转移酶
存在部位:肝脏、心肌组织
两种穿梭系统的比较
α-磷酸甘油穿梭 穿梭 物质 进入线粒 体后转变 成的物质 进入 呼吸链 α-磷酸甘油 磷酸二羟丙酮 苹果酸-天冬氨酸穿梭 苹果酸、 谷氨酸 天冬aa、α-酮戊二酸
FADH2
琥珀酸 氧化呼吸链
NADH+ H+
NADH 氧化呼吸链
琥珀酸由琥珀酸脱氢酶催化脱下的2H经复合 体Ⅱ(FAD,Fe—S)使COQ形成COQH2, 再往下传递与NADH氧化呼吸链相同。(见 上图)
NADH氧化呼吸链和琥珀酸氧化呼 吸链总图
FADH2
NADH
FMN
CoQ
Cyt-b c1
c
aa3
O2 H2O
3、分别进入两条呼吸链的底物
苹果酸 异柠檬酸 β -羟丁酸 谷氨酸 NAD+ FMN 琥珀酸 FAD(Fe-S) CoQ b c1 c aa3 O2
10
血红素b、c1 Fe-S 血红素c 血红素a 血红素a3 Cu2+ O2
Q
Cytc
13
1
Cytc Cyta
Ⅳ
细胞色素C氧化酶
13
(一)尼克酰胺核苷酸类(NAD+)
NAD+ 和NADP+的结构
NAD+:R=H NADP+:R=PO32-
尼克酰胺核苷酸的作用原理
H
H H CONH 2
C CONH2 N R
AH2 2H(2H++2e)
吸 链
1 2 O2
H2O
氧化
A
ADP+Pi
能量 ATP 磷酸化
第八章生物氧化

27
2.黄素蛋白(flavin protein,FP)
黄素蛋白的辅基有两种:FMN和FAD, 其分 子中的异咯嗪环可以进行可逆的加氢和脱氢反应, 故黄素蛋白在呼吸链中属于递氢体,在加氢反应 时接收2个氢原子。
28
H3C H3C
N
CH 2 O H C OH H C OH H C OH
O PO O-
36
37
细胞色素c (Cytochrome C)
➢13kD球形蛋白 ➢唯一能溶于水的细胞色素 ➢流动电子载体,可在线粒 体内膜外侧移动
38
呼吸链中常见的几种蛋白质或酶
名称
特点
主要功能
黄素蛋白
以FAD或FMN为辅基 传递H和电子
铁硫蛋白
辅基为铁硫中心(Fe-S) 传递单个电子
泛醌(CoQ)
脂溶性,能在内膜中自 由扩散
ATP、热能
10ion and storage of ATP
ATP在能量代谢中的核心作用 ATP的生成
底物水平磷酸化 氧化磷酸化 ATP的储存和利用
11
一、 ATP在能量代谢中的核心作用
生物体能量代谢的特点:
1. 生物体不能承受能量大量增加、能量大量 释放的化学过程,所以代谢反应都是依序 进行,能量逐步得失的反应
⊿G′
(kcal/mol) (-14.8) (-12.3) (-11.8) (-10.3) (-7.3) (-7.5) (-6.6) (-6.6) (-5.0)
14
二、 ATP的生成 (一)底物水平磷酸化 定义:代谢物在氧化分解过程中,因脱氢或
脱水而引起分子内能量重新分布,产 生高能键,然后将高能键转移给ADP (或GDP)生成ATP(或GTP)的过 程,称为底物水平磷酸化(substrate phosphorylation)。
第八章生物氧化

2.细胞色素 Cyt 细胞色素(Cyt 细胞色素 Cyt) 细胞色素是属于色蛋白类的结合蛋白, 细胞色素是属于色蛋白类的结合蛋白,其辅基是 含铁卟啉的衍生物(血红素A,血红素B,血红素 血红素A,血红素B,血红素C) 含铁卟啉的衍生物 血红素A,血红素B,血红素C) 细胞色素共有五种,分别为Cyt 细胞色素共有五种,分别为Cyt a, Cyt b, c, Cyt c1, Cyt c, Cyt a3. 细胞色素在呼吸链中是通过铁卟啉中的铁原子氧 化还原作用而往复传递电子, 化还原作用而往复传递电子,细胞色素是单电子 传递体方程式如下 方程式如下: 传递体方程式如下: ( b, c1, c) 2Cyt·Fe 2Cyt Fe3+ + 2e2Cyt·Fe 2Cyt Fe2+
一. 生物氧化的涵义 由前述分解代谢的总方程式: 由前述分解代谢的总方程式:
有机物 + O2 能量( ATP) CO2 + H2O + 能量( ATP)
则有机物的分解是一种有氧参与的氧化反应, 则有机物的分解是一种有氧参与的氧化反应, 且反应发生在生物体内, 且反应发生在生物体内,故称为生物氧化 定义 有机物质在生物体细胞内的 氧化分解作用称为生物氧化 由于此过程消耗氧生成CO2 ,且在细 由于此过程消耗氧生成CO 胞中进行, 胞中进行,因此又称为细胞呼吸
(二)反应历程复杂 例 葡萄糖的氧化反应方程式: 葡萄糖的氧化反应方程式: C6H12O6 +6O2 6CO2 + 6H2O
在体内和体外都是一样的, 在体内和体外都是一样的,但各自的反 应历程不同,体外氧化是一次反应完全的 应历程不同 体外氧化是一次反应完全的 而生物氧化是在活细胞的水溶液中进 生物氧化是在活细胞的水溶液中进 行的,途径迂回曲折,有条不紊, 行的,途径迂回曲折,有条不紊,反 应历程复杂, 应历程复杂,都是酶促反应
有机化学课件:第8章 氧化还原反应

还原态物质的还原能力就越弱; 氧化态物质的氧化能力越弱,其对应的 还原态物质的还原能力就越强。
2 MnO4 + 10 Cl + 16 H+ = 2 Mn2+ + 5Cl2 + 8 H2O
Cl Cl2
MnO4 H Mn2 H2O
氧化值是人为的定义;
氧化值与化合价的区别
化合价:表示元素的原子结合成分子时,原子 数目的比例关系。从分子结构来看,化合价是 指形成共价化合物时所形成的共价键的数目。 只能是正整数。
CH4 、CH3Cl 、CH2Cl2 、CHCl3 CCl4 化合价均为4 氧化值分别为:-4、-2、0、+2、+4
二、氧化还原反应
氧化半反应
还原半反应
电池反应:原电池中发生的总的氧化还原反应 Zn + Cu2+ Cu + Zn2+
盐桥的作用
盐桥:饱和KCl溶液+琼胶,其中离子可自由迁移。
负极: Zn Zn2+ + 2eZn2+过剩,显正电性,阻 碍半反应继续进行,盐桥 中的Cl-中和过量的正电荷。
正极的情况与之相反。
盐桥的作用
元素的氧化值发生变化的反应
Cu2++Zn
Zn2++Cu
在氧化还原反应中, 氧化(oxidation):元素的氧化值升高的过程
还原(reduction):氧化值降低的过程 氧化剂(oxidant): 氧化值降低 的物质 还原剂(reductant):氧化值升高的物质
Cu2+ + Zn
氧化剂 还原剂
第8章氧化还原滴定知识

第8章氧化还原滴定知识1. 一、单选题1.[2]用H2C204·2H20标定KMn04溶液时,溶液的温度一般不超过(),以防止H2C2O4 • 2H20 的分解。
[单选题] *A.60°CB.75°CC.40°CD.90°C(正确答案)2. [2]把反应Zn + Cu2+→Zn2+ + Cu设计成原电池,电池符号为()。
[单选题] *A.(-)Zn|Zn2+ || Cu2+|Cu( + )(正确答案)B.(-)Zn2+|Zn || Cu2+|Cu( + )C.(-)Cu2+|Cu || Zn2+|Zn( + )D.(-)Cu|Cu2+ || Zn2+|Zn( + )3. [2]将反应Fe2+ + Ag+ → Fe3+ + Ag构成原电池,其电池符号为()。
[单选题] *A.(-)Fe2+| Fe3+ || Ag+| Ag( + )B.(-)Pt| Fe2+;Fe3+ || Ag+| Ag( + )C.(-)Pt| Fe2+,Fe3+ || Ag+| Ag(+)(正确答案)D.(-)Pt| Fe2+,Fe3+ || Ag+|Ag| Pt(+)4. [2]当增加反应酸度时,氧化剂的电极电位会增大的是()。
[单选题] *A.Fe3+B.I2C.K2Cr207(正确答案)5. [2]电极电势的大小与下列哪种因素无关()。
[单选题] *A.电极本身性质B.温度C.氧化态和还原态的浓度D.化学方程式的写法(正确答案)6. [2]下列说法正确的是()。
[单选题] *A.电对的电位越低,其氧化形的氧化能力越强B.电对的电位越高,其氧化形的氧化能力越强(正确答案)C.电对的电位越高,其还原形的还原能力越强D.氧化剂可以氧化电位比它高的还原剂7. [3]反应 2Fe3+ + Cu = 2Fe2+ + Cu2+进行的方向为()。
[] [单选题] *A.向左B.向右(正确答案)C.已达平衡D.无法判断8. [3]在 2Cu2+ + 4I- = 2CuI ↓ + I2 中,则反应方向向()。
第8章氧化还原反应与 氧化还原滴定法2
定剩余的MnO4- 。根据已知过量的KMnO4和还原剂标
准溶液的浓度和消耗的体积,即可计算出甲酸的含量
。
7
10-4 常用氧化还原滴定方法
二 、重铬酸钾法(Potassium Dichromate Method)
(一) 概述
K2Cr2O7在酸性条件下与还原剂作用: Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O (2) 应用范围比KMnO4 法窄;
18
10-4 常用氧化还原滴定方法 2. 硫酸铜中铜的测定
三、 碘 量 法
2 Cu2+ + 4 I - = 2CuI↓ + I2
I2 + 2S2O32- = S2O32- + 2 I -
n Cu 2+ / n Na 2S2O3= 1 / 1
可逆反应,应加入过量 KI。CuI 沉淀表面吸附 I2导致结果
(4) 滴定终点:高锰酸钾自身指示终点(淡粉红色30秒不退)。
4
10-4 常用氧化还原滴定方法
一、 KMnO4法
(三) 高锰酸钾法应用示例 1. 过氧化氢的测定
可用KMnO4标准溶液直接滴定,其反应为: 5H2O2 + 2MnO4- + 6H+ = 2Mn2+ + 5O2 + 8H2O 室温、在硫酸或盐酸介质。开始时反应进行较慢。
最后以Na2S2O3标准溶液滴定析出的 I2。
22
10-4 常用氧化还原滴定方法
2
10-4 常用氧化还原滴定方法
一、 KMnO4法
(二) 标准溶液的配制与标定(间接法配制)
KMnO4自行分解反应:
第八章地球化学系统中的氧化还原反应

第八章地球化学系统中的氧化还原反应缓冲剂、硅酸盐熔体氧逸度、硅酸盐熔体Fe2+- Fe3+平衡、变质岩氧逸度氧化-还原反应在水溶液、硅酸盐熔体、变质岩中都是常见的现象,这里对氧化-还原反应电化学方面暂不讨论,而以实例集中探讨氧逸度问题。
8.1氧逸度缓冲剂氧逸度是影响岩浆演化途径、岩浆不混溶作用、岩浆的物理性质、以及岩浆系统相关系的重要参数。
在岩石学和热力学研究中,常用氧逸度缓冲剂表示系统氧逸度的大小。
常见的氧逸度缓冲剂和氧逸度(IgfOQ计算式应该指出的是,如果不与温度相联系,泛泛谈氧逸度是无意义的。
例如,HM缓冲剂的lgfO2 值在800—1200K 之间要变化10 个数量级(Nordstrom and Munoz, 1986)。
铁是自然界含量最为丰富的变价元素。
不同价态的含铁矿物可以概略地指示氧逸度的相对大小。
由自然铁(Fe)-方铁矿(Fe2+)-磁铁矿(Fe2++Fe3+)-赤铁矿(Fe3+),反映了其结晶时的氧逸度依次增高。
在火山岩中,铁镁矿物和氧逸度之间的平衡主要决定于熔体和斑晶相矿物的总成分。
在相似的温度下,随氧逸度由低到高,铁镁矿物一般将依次出现橄榄石、斜方辉石、角闪石和黑云母。
为讨论问题的方便,人们常用相对于FMQ缓冲剂的氧逸度dgf ozb MQ)来表示岩浆系统氧逸度的大小,定义为△lgf°2(FMQ) = lgf o2-lgf°2(FMQ)。
某些火成岩△ lgf°2(FMQ)值如为:接近液相线的各种基性熔岩和大多数亏损型地幔尖晶石二辉橄榄石(mg# = 0.90)的△lgf o2(FMQ)= ±2.0,含铁橄榄石斑晶的流纹岩的△ lgf°2(FMQ) = 0.5—2.0,含斜方辉石和角闪石斑晶的流纹岩和英安岩的A lgf o2(FMQ) =1.0—2.0,含黑云母和/或角闪石斑晶的流纹岩的A lgf°2(FMQ) = 2.0—3.0。
分析化学教学课件 第8章 氧化还原滴定法 2

Eθ Fe3/Fe2
0.0592lgγ γ((F Fe e3 2 ))α α((F Fe e2 3 ))0.0592lgc c((F Fe e3 2 ))
在一定条件下,上式中γ和α有固定值,因 而上式中前两项之和应为一常数,令其为 Eq′
E F θ e '3 /F e2 E F θ e3 /F e2 0 .0 5 9 2 lgγ γ ( (F F e e3 2 ) )α α ( (F F e e2 3 ) )
实验方法 理论计算:可逆体系
pH
14 化学计量点
12
10 酚酞
8
甲基红 6 甲基橙
4
2
滴定突跃 (pH=4.3~9.7)
0 10
20
30 40
v(NaOH/ml)
0.1000mol/L NaOH滴定0.1000mol/LHCl的滴定曲线
滴定过程中存在着两个电对:滴定剂电对和 被滴定物电对。
随着滴定剂的加入,两个电对的电极电位 不断发生变化,并随时处于动态平衡中。可由 任意一个电对计算出溶液的电位值,对应加入 的滴定剂体积绘制出滴定曲线。
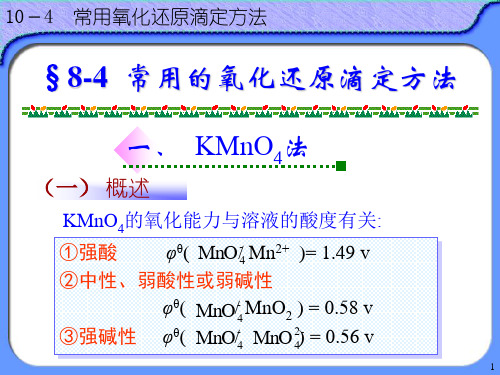
1.高锰酸钾法
KMnO4,强氧化剂
氧化能力 还原产物
与pH有关
酸性介质 MnO4- + 8 H+ + 5e = Mn2+ + 4H2O E° =1.51v
在中性或弱碱性
MnO4- + 2H2O + 3e = MnO2 + 4OH-
E° =0.59v
在碱性介质 MnO4- + e = MnO42-
E° =0.56v
c 生成络合物
氧化态形成的络合物更稳定,使电势降低,还 原性增加,反之则电势升高,氧化性增加
氧化还原反应.pptx

1.2. 离子 - 电子法配平氧化还原方程式 (半反应法) 步骤: a. 根据氧化数的变化分别写出氧化半反应和还原半反
应的骨架反应
b. 配平半反应方程式两边的原子和电荷数 c. 根据得失电子数相同,将配平的半反应组合成净的
总反应
酸性水溶液
1. 配平氧化数(氧化态)有变化的那种元素的原子数 2. 在缺m个氧原子的一侧加m个H2O分子,把O原子数 配平 3. 在缺n个氢原子的一侧加n个H+ 离子,把H原子数配 平 4. 在缺负电荷的一侧加数量合适的电子,把反应式二 侧的电荷数配平,即得配平的半反应方程式
2.1. 化学电池
锌-铜电池
原电池
正极-电子流入-阴极 负极-电子流出-阳极
正极:Cu2+ + 2e- = Cu (阴极),还原反应 负极: Zn = Zn2+ + 2e(阳极),氧化反应
电池反应: Zn + Cu2+ = Zn2+ + Cu
电解池
电子流动的方向 电流方向
导线:沟通两片金属,使电子能在两者之间传递 盐桥(KCl水溶液,琼脂):沟通两个溶液,使正负 离子能在两个溶液之间迁移
c. 气体电极:在结构上与惰性电极一样
Pt丝
H2 = 2H+ + 2e-
PtH2(a atm)H+(b mol/L)
Pt, H2(a atm)H+(b mol/L)
Pt, Cl-(b mol/L)Cl2(c atm)
将两个气体电极插在HCl溶液中组成原电池: (-) Pt, H2(a atm)HCl (b mol/L)Cl2(c atm), Pt (+)
第八章氧化还原滴定法答案

第八章氧化还原滴定法练习题参考答案1 对Ox-Red 电对, 25℃时条件电位(Eө') 等于( D)(A) Eө+ 0059.lgnaaOxRed(B) Eө+ 0059.lgnccOxRed(C) Eө+ 0059.lgnaaγγOx OxRed Red⋅⋅(D) Eө + 0059.lgnaaγγOx RedRed Ox⋅⋅2 为降低某电对的电极电位, 可加入能与( 氧化)态形成稳定络合物的络合剂; 若要增加电极电位, 可加入能与( 还原)态形成稳定络合物的络合剂。
3. MnO4-/Mn2+电对的条件电位与pH的关系是( B)(A) Eө'= Eө -0.047pH (B) Eө'= Eө -0.094pH(C) Eө'= Eө -0.12pH (D) Eө'= Eө -0.47pH4. Fe3+与Sn2+反应的平衡常数对数值(lg K)为( B)(Eө (Fe3+/Fe2+)= 0.77 V, Eө (Sn4+/Sn2+)= 0.15 V)(A) (0.77-0.15)/0.059 (B) 2×(0.77-0.15)/0.059(C) 3×(0.77-0.15)/0.059 (D) 2×(0.15-0.77)/0.0595. 当两电对的电子转移数均为2时,为使反应完全度达到99.9%,两电对的条件电位至少大于( B)(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V6 若两电对的电子转移数分别为1 和2, 为使反应完全度达到99.9%, 两电对的条件电位差至少应大于( C)(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V7. 欲以氧化剂O T滴定还原剂Rx, O T+n1e=R T Ox=Rx-n2e,设n1=n2=1,要使化学计量点时,反应的完全程度达到99.9%,两个半反应的标准电位的最小差值应为( B)(A) 0.177V (B) 0.354V (C) 0.118V (D) 0.236V8. 下列现象各是什么反应?(填A,B,C,D)(1) MnO4-滴定Fe2+时, Cl-的氧化被加快_______D_________(2) MnO4-滴定C2O42-时, 速度由慢到快_______B _________(3) Ag+存在时, Mn2+氧化成MnO4-_______ A _________(4) PbSO4沉淀随H2SO4浓度增大溶解度增加_______ C _________(A) 催化反应(B) 自动催化反应(C) 副反应(D) 诱导反应9. 用Ce4+滴定Fe2+,当体系电位为0.68V时, 滴定分数为( B)[Eө' (Ce4+/Ce3+)=1.44V,Eө' (Fe3+/Fe2+)=0.68V](A) 0 (B) 50% (C) 100% (D) 200%10. 用铈量法测定铁时, 滴定至50% 时的电位是( A)[已知Eө' (Ce4+/Ce3+)= 1.44 V, Eө' (Fe3+/Fe2+)= 0.68 V](A) 0.68 V (B) 1.44 V(C) 1.06 V (D) 0.86 V11. 用K2Cr2O7滴定Fe2+, 在化学计量点时, 有关离子浓度的关系是( C)(A) [Fe3+] = [Cr3+], [Fe2+] = [Cr2O72-](B) 3[Fe3+] = [Cr3+], [Fe2+] = 6[Cr2O72-](C) [Fe3+] = 3[Cr3+], [Fe2+] = 6[Cr2O72-](D) [Fe3+] = 3[Cr3+], 6[Fe2+] = [Cr2O72-]12. 已知在1 mol/L HCl溶液中Eө' (Fe3+/Fe2+)=0.68 V, Eө' (Sn4+/Sn2+)=0.14 V。
基础化学 第八章 氧化还原反应与电极电位

子的氧化数为-1,如Cl在BrCl中;
在含氧化合物中按氧化物决定,如ClO2中Cl的氧 化值为+4。
(6)电中性的化合物中所有原子的氧化值的和为零。
多原子离子中所有原子的氧化值的和等于离子的
电荷数。
6
例1:试计算Na2S2O3(硫代硫酸钠)和Na2S4O6 (连四硫酸钠)中硫的氧化数。
解:Na2S2O3中S的氧化数为: (+1)× 2+3×(-2)+2X=0, X=+2
4
(二)确定元素氧化值的规则
日本化学教授桐山良一(在1952年)和美国著名化学家 鲍林(1975年)等人分别发表论说,对确定元素氧化数的 方法制定了一些规则。
(1)单质中原子的氧化值为零。 (2)单原子离子中原子的氧化值等于离子的电荷 数。例如Na+离子中Na的氧化值为+1。 (3)化合物中,氧的氧化值一般为-2,
14
(2)计算氧化数升(降)总数,并按照最小公倍 数原则确定系数
+2-5=-3
+5
0 +5
+2
HNO3 + P H3PO4 + NO
+5+0=+5 5 H N O 3+ 3 P3 H 3 P O 4+ 5 N O
(3)最后配平H、O原子
= 5 H N O 3+ 3 P + 2 H 2 O 3 H 3 P O 4+ 5 N O
9
Zn + 2HCl
ZnCl2 + H2
其中,锌失去电子,氧化值升高,被氧化,称为
还原剂(reducing agent),又称电子的供体(electron
donor)。HCl中的H+得到电子,氧化值降低,被还
第八章-氧化还原反应与氧化还原滴定习题及答案

第⼋章-氧化还原反应与氧化还原滴定习题及答案第⼋章氧化还原反应与氧化还原滴定习题1.是⾮判断题1-1氧化数在数值上就是元素的化合价。
1-2 Na 2S ,Na 2S 2O 3,Na 2SO 4和NaS 4O 6中,硫离⼦的氧化数分别为-2,2,4,6和+5/2 。
1-3 NH 4+中,氮原⼦的氧化数为-3,其共价数为4。
1-4氧化数发⽣改变的物质不是还原剂就是氧化剂。
1-5任何⼀个氧化还原反应都可以组成⼀个原电池。
1-6两根银丝分别插⼊盛有 mol ·L -1和 1 mol ·L -1 AgNO 3溶液的烧杯中,且⽤盐桥将两只烧杯中的溶液连接起来,便可组成⼀个原电池。
1-7在设计原电池时,θ?值⼤的电对应是正极,⽽θ?值⼩的电对应为负极。
!1-8原电池中盐桥的作⽤是盐桥中的电解质中和两个半电池中过剩的电荷。
1-9半反应NO 3- + H + + e ?NO + H 2O 配平后,氧化态中各物质的系数依次为1,4,3。
1-10在碱性介质中进⾏的反应CrO 2-+Cl 2+OH -?CrO 42-+Cl -+H 2O 被配平后反应⽣成物CrO 42-的系数分别为8和2。
1-11对电极反应S 2O 82-+2e2SO 42- 来说,S 2O 82- 是氧化剂被还原,SO 42-是还原剂被氧化。
1-12原电池中,电⼦由负极经导线流到正极,再由正极经溶液到负极,从⽽构成了回路。
1-13⾦属铁可以置换CuSO 4溶液中的Cu 2+,因⽽FeCl 3溶液不能与⾦属铜反应。
1-14标准电极电势表中的θ值是以氢电极作参⽐电极⽽测得的电势值。
1-15电极电势表中所列的电极电势值就是相应电极双电层的电势差。
1-16某电对的标准电极电势是该电对与标准氢电极组成原电池时的原电池电动势。
1-17电极反应为Cl2+2e2Cl -的电对Cl 2/Cl -的E θ=;电极反应为12Cl 2+e Cl -时θ(Cl 2/Cl -) …=1/2×=。
四川大学近代化学基础--氧化还原反应

✓若参与电极反应的各物质均处于标准态,则为标准电极 电势,用 EOx/Red 表示。
2019/12/29
例对铜电极:
Pt| H2 ( p) | H+ ( a=1 )
Cu2+ ( a=1 ) |Cu
在25℃下,实验测得该电池的电动势 EMF = 0.337V,
即
E
Cu
2+
/
Cu
=
0.337V
2019/12/29
如: Cu2+ + 2e → Cu
ECu2+/Cu
Cl2(g) + 2e → 2Cl-(aq)
ECl2 /Cl-
Ag+ + e → Ag
EAg +/Ag
AgCl (s) + e →Ag(s) + Cl-(aq) EAgCl/Ag
用这种方法(还原半反应的形式)表示的电极电势
称为还原电势。还原电势越高,表明该电对进行还原
2019/12/29
+3
+5
①As2O3 + HNO3 + H2O →
↑ 2 ×2 ↓ 3
+5
+2
H3AsO4 + NO
3As2O3 + 4HNO3 + 7H2O → 6H3AsO4 + 4NO
+1 2 +5
+2
+6 +2
②Cu2S + HNO3 →Cu(NO3) 2 + H2SO4 + NO + H2O
2019/12/29
例:查得 ECu2+/Cu = +0.337V EZn2+/Zn = 0.763V
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:将下列反应设计成原电池并以原电池符号表示
2Fe2+ 1.0mol L-1 + Cl 2 101325Pa 2Fe3+ 0.1mol L-1 + 2Cl - 2.0mol L-1
[H+]
Ox/Red
例:求算当 (1) [H + ] = 1.0mol L-1, (2) [H + ] = 0.01mol L-1 时, ClO- /Cl- = ?
3
已知 [ClO -3 ] = [Cl - ] = 1.0 mol L-1; ClO- /Cl- = 1.45 V θ
§8.2 电极电势(Electrode Potential)
8.2.1 原电池的构造和概念 8.2.2 电极电势
8.2.1 原电池的概念和构造
实验现象: 锌片插入硫酸铜溶液中 锌片表面?: 沉积红色物
Zn
溶液颜色?: 兰色变浅
烧杯温度?: 发热
Cu2+ SO42-
Zn + Cu Zn + Cu
吉布斯自由能变与原电池电动势的关系
rGm = W非 在原电池中,非膨胀功只有电功 rGm = W电 = E Q rGm = n F E 标准态下
ΔrG = -nFE
θ m
θ
1. 电池反应的能斯特方程 (Nernst Equition)
氧化还原反应: aOx1 + bRed2 = cRed1 + dOx2 化学反应等温式: rGm = rGm + RT ln Q nFE = nFE RT ln Q 式中
[Red1 ]c [Ox 2 ]d Q= [Ox1 ]a [Red 2 ]b
能斯特方程
[Red1 ]c [Ox 2 ]d 0.0592 E=E lg n [Ox1 ]a [Red 2 ]b
2. 电极反应的能斯特方程
aOx + ne bRed
0.0592 [Red] 0.0592 [Ox]a θ = lg lg a = + b n [Ox] n [Red]
θ b
注意:式中分子分母项包括其他参与反应的物质
书写能斯特方程式时应注意!
注意电池、电极反应中的正负号及对数的分子分母 固态或纯液态不列入,气体用分压表示 H+、OH‾列入能斯特方程中 注意能斯特方程表达式中电子数 n
Fe + e Fe
27 +
3+
2+
Cr2O +14H + 6e 2Cr + 7H2O
若加入NaCl溶液
Ag+ + Cl AgCl(s)
Ag /Ag =
+
θ Ag + /Ag
+ 0.0592lg
θ K sp
[Cl ]
θ sp
-
=
θ Ag + /Ag
1 + 0.0592lgK + 0.0592lg [Cl - ]
实际电极反应可看成
AgCl(s) + e Ag + Cl
Ox/Red
=
θ Ox/Red
RT [Ox] ln nF [Red]b
a
[Ox] 或 [Red]
Ox/Red
对H+(或OH)参与的电极反应: a Ox + bH+ + ne = c Red + d H2O
Ox/Red
RT [Ox]a [H + ]b θ = Ox/Red + ln nF [Red]c
正极 : 2 + 2e- 2Cl Cl 负极: Fe - e Fe
2+ 3+
(-) Pt Fe 2+ 1.0mol L-1 , Fe 3+ 0.1mol L-1 Cl - 2.0mol L-1 Cl 2 101.325kPa , Pt (+)
写出原电池符号
θ MBn /M
与
θ Mn+ /M
之间的关系
PbI2/Pb Ag2S
PbSO4/Pb
如果 Cu2+ + e Cu+反应体系中加入KI溶液
θ Cu θ 与Cu2+ /CuI 之间的关系? 2+ /Cu+
NaClHBrຫໍສະໝຸດ H2O有关氧化数的规定
单质的氧化数为零 氧的氧化数为-2 氢的氧化数为+1 中性分子中各元素原子的氧化数之代数和为零 单原子离子的氧化数等于其电荷数 多原子离子中各元素原子的氧化数之和等于 离子的电荷数
熟悉一些物质的氧化数
Al
KCl CO2
Br2
Mg2+
S2-
NaOH
活泼金属Zn电极电势
Zn
2+
/Zn
负极
不活泼金属Cu电极电势
Cu
2+
/Cu
正极
Zn-Cu原电池电动势
E = () (-) Cu2 / Cu Zn2 / Zn
3、标准氢电极
2H (aq) + 2e H2 g
+ -
氢电极组成: H+(c) | H2(p), Pt 标准氢电极的规定: T=298K,[H+] = 1.0 molL1 , pH2 = 101.325 kPa
Cu2+ + Zn (s)
Zn + Cu(s)
2+
H2 (g) + Cl 2 (g)
2 HCl(g)
氧化还原反应: 反应物之间有电子转移(偏移)的化学反应 氧化数发生变化的化学反应 氧化数: 指分子中某元素的一个原子的表观荷电数,该荷 电数是假定把每一化学键中的电子指定给电负性
较大的原子而求得
θ H+ / H2
= 0.000 V
标准氢电极结构
4、标准电极电势
在标准态下,某一电极与标准氢电极组成原电池, 通过测定原电池的电动势求得的该电极的电极电势 氢电极与锌电极组成原电池
E = ( ) (-)
θ H / H2
θ Zn 2 / Zn
= 0.763V
θ Zn2+ /Zn
= -0.763V
氢电极
使用标准电极电势表时应注意!
用还原反应的电极电势来表示
标准电极电势没有加合性
是水溶液体系的标准电极电势 引用 时注意反应条件
8.3 影响电极电势的因素
8.3.1 能斯特方程式 8.3.2 浓度与酸度的影响 8.3.3 生成沉淀对电极电势的影响
8.3.1 能斯特方程式
M → Mn+ + ne Mn+ + ne → M Mn+ + ne M
不活泼金属:
达到平衡时:
影响反应方向的因素:
金属的活泼性
溶液中金属离子的浓度
2、电极电势
双电层之间的电势差 电极电势的表示方法:
M
n
/M
原电池电动势:
两个电极电势之差
E = ( ) (-)
Zn-Cu原电池的电极电势与电动势
a Ox1 + 氧化剂
b Red2 = c Red1 + 还原产物
氧化还原反应的配平
1. 离子— 电子配平法 配平原则: 电荷守恒: 反应物之间得失电子数相等 质量守恒: 反应前后各元素原子总数相等
配平步骤
(1) 确定反应介质 (2) 用离子式写出主要反应物和产物 (气体、纯液体、固体和弱电解质则写分子式) (3) 将反应分解为两个半反应式,并配平原子数 (4) 配平两个半反应的电荷数 (5) 使两个半反应的得失电子数相等
2+ 2+
1 、 原 电 池 的 结 构
Cu-Zn原电池工作示意图
2、原电池(Primary Cell)
借助氧化还原反应把化学能转变成电能的装置
锌极反应:负极 Zn - 2e Zn2+ 半电池反应 Half-cell Reaction
铜极反应: 正极
Cu2+ + 2e Cu 氧化还原反应
为什么电子从Zn极流向Cu极? 德国化学家W.H.Nernst在1889年提出了“双电层理论 ”
1、双电层的形成
活泼金属
Zn片
+ + + + + + + +
不活泼金属
Cu片
++ ++ ++ ++
ZnSO4溶液 溶解>沉积 沉积>溶解
CuSO4溶液
活泼金属:
原电池符号的书写方法:
原电池符号
(-)Zn | ZnSO4 (c1 ) || CuSO4 (c2 ) | Cu (+)
(1) 负极写在左边“” ,正极写在右边“+”
(2) 两相界面用“|”分开,盐桥用“‖”表示
(3) 括号内注明物质的浓度或分压
(4) 电对中无金属单质,需加惰性电极,用“ ,”分 开
(1) [H+] = 1.0molL1 时
ClO /Cl = 1.45 V
3 -
(2) [H+] = 0.001molL1 时 [H+]
ClO /Cl = 1.27 V
3 -
Ox/Red
