艾速平产品介绍
从国内外Neulasta及其Biosimilar分析F627市场课件

1.1长效G-CSF具有更好临床获益
试验用药
肿瘤类型
FN发生率
重度粒细胞缺乏发生 率
第一周期严重中性粒 细胞减少持续时间
1.6天
1.8天
均值差异
0.2 (95% CI - 0.2, 0.6)
患者数量
310
患者特征
转移性或非转移性乳腺癌患者,每21天给药阿霉素60mg/m2和多西他赛75 mg/m2,持续四个周期
用药及方法
每日皮下注射 filgrastim5mcg/kg/day,开始于每个化疗 周期的第2天
发热性中性粒细胞减少症发生率
17%
1%
P值
p <0.001
住院率
14%
1%
静脉注射抗感染药物使用率
10%
2%
1.2 Neulasta升白效果与短效G-CSF相当
目录一、粒细胞集落刺激因子(G-CSF)是最常用的升白药长效G-CSF具有更好临床获益Neulasta升白效果与短效G-CSF相当二、国外市场情况:国外市场规模近60亿美元,长效产品占主导美国市场:类似物上市后迅速抢占市场份额长效G-CSF类似物在研项目少,未来竞争格局稳定三、国内市场情况:长效产品推动整体市场快速增长国内市场渗透率低,未来空间可观四家长效G-CSF处于临床后期,未来竞争格局良好四、公司的F627介绍及市场规模预测F627属于第三代G-CSF,具有独特的作用机制F-627国内外III期临床试验结果良好F627市场规模预测:成熟期国内外合计有望达到68.7亿元
艾速平_产品知识题库完整

二阶产品知识题库一、填空题1、艾速平®适应症为:(1)当口服疗法不适用时,的替代疗法;(2)用于口服疗法不适用的。
2、艾速平®对于不能口服用药的胃食管反流病患者,用法用量为:静脉注射或静脉滴注本品mg, 每日次。
3、对于反流性食管炎患者,艾速平®用法用量为:mg,每日次;对于反流疾病的症状治疗,艾速平®用法用量为:mg,每日次。
4、对于不能口服用药的Forrest分级Ⅱc-Ⅲ的急性胃或十二指肠溃疡出血患者,推荐静脉滴注本品mg,每小时一次,用药天。
5、艾速平®注射液的制备:是通过加入mL的溶液至本品小瓶中供静脉注射使用;艾速平®滴注液的制备:是通过将本品1支溶解至溶液mL,供静脉滴注使用。
配制后的注射用或滴注用液体均是的澄清溶液,应在小时使用,保存在30℃下。
从微生物学的角度考虑最好立即使用。
6、艾速平®有种给药方法/途径,分别为和。
7、对于轻到中度肝功能损害的患者无需调整剂量。
严重肝功能损害的患者每日剂量不应超过mg。
8、艾司奥美拉唑主要经过细胞色素P450酶系统(CYP)代。
主要依靠特异性同工酶和进行代。
9、严重肝功能损害主要参考指标包括:PTA、、酶学指标、胆碱酯酶、血清白蛋白、血脂及血糖。
10、不同治疗目的所需控制的最佳胃pH值不同,其中,胃pH> 是预防应激性溃疡的关键;胃pH> 是急性上消化道出血治疗的关键。
11、艾速平®产品定位主要针对三个细分市场,即、及患者。
12、艾速平®20mg核心促销信息中,关于适应症的描述是对于的症状治疗应使用20mg;的患者使用的最大剂量不应超过20mg;与联合使用需配合密切临床监测,本品剂量不应超过20mg。
13、艾速平®2017年品牌竞争策略主要是同品,性价比高;品类竞争策略主要是方便安全,更好。
14、关于艾速平®与奥美拉唑品类竞争的产品主要有阿斯利康的、奥赛康的。
艾速平-产品知识题库

一、填空题1、艾速平®适应症为:(1)当口服疗法不适用时,的替代疗法;(2)用于口服疗法不适用的。
2、艾速平®对于不能口服用药的胃食管反流病患者,用法用量为:静脉注射或静脉滴注本品 mg, 每日次。
3、对于反流性食管炎患者,艾速平®用法用量为: mg,每日次;对于反流疾病的症状治疗,艾速平®用法用量为: mg,每日次。
4、对于不能口服用药的Forrest分级Ⅱc-Ⅲ的急性胃或十二指肠溃疡出血患者,推荐静脉滴注本品 mg,每小时一次,用药天。
5、艾速平®注射液的制备:是通过加入 mL的溶液至本品小瓶中供静脉注射使用;艾速平®滴注液的制备:是通过将本品1支溶解至溶液 mL,供静脉滴注使用。
配制后的注射用或滴注用液体均是的澄清溶液,应在小时内使用,保存在30℃下。
从微生物学的角度考虑最好立即使用。
6、艾速平®有种给药方法/途径,分别为和。
7、对于轻到中度肝功能损害的患者无需调整剂量。
严重肝功能损害的患者每日剂量不应超过 mg。
8、艾司奥美拉唑主要经过细胞色素P450酶系统(CYP)代谢。
主要依靠特异性同工酶和进行代谢。
9、严重肝功能损害主要参考指标包括:PTA、、酶学指标、胆碱酯酶、血清白蛋白、血脂及血糖。
10、不同治疗目的所需控制的最佳胃内pH值不同,其中,胃内pH> 是预防应激性溃疡的关键;胃内pH> 是急性上消化道出血治疗的关键。
11、艾速平®产品定位主要针对三个细分市场,即、及患者。
12、艾速平®20mg核心促销信息中,关于适应症的描述是对于的症状治疗应使用20mg;的患者使用的最大剂量不应超过20mg;与联合使用需配合密切临床监测,本品剂量不应超过20mg。
13、艾速平®2017年品牌竞争策略主要是同品,性价比高;品类竞争策略主要是方便安全,更好。
14、关于艾速平®与奥美拉唑品类竞争的产品主要有阿斯利康的、奥赛康的。
最新艾速平-产品知识题库-精选.pdf

A 消旋体
B 左旋
C 右旋
5、以下关于注射用艾司奥美拉唑钠质量标准描述,哪项正确()
。
A、原研耐信 ?的质量标准最高
B、艾速平 ?质量标准最高
C、奥一明 ?质量标准最高
D、《中国药典》 ( 2015 版第二部)最高
6、目前 IMS 数据显示,以下哪一类 A、艾司奥美拉唑
PPI 针剂市场份额最大() 。
B、 5%葡萄糖注射液
C、乳酸钠林格注射液
D、 10%葡萄糖氯化钠注射液
25、关于艾司奥美拉唑的代谢,以下描述正确的是() 。
A、经细胞色素 P450 酶系统代谢
B、艾司奥美拉唑钠血浆中的主要代谢产物为艾司奥美拉唑砜
C、肾脏
D、非酶代谢 26、严重肝功能损害主要有哪些参考指标() 。 A、 PTA B、 ALT、 AST酶学指标 C、胆碱酯酶
D、血清白蛋白、血脂及血糖
27、以下关于注射用艾司奥美拉唑钠的生产厂家描述,正确的是()
。
A、重庆莱美药业
B、正大天晴药业集团
C、阿斯利康制药 D、江苏奥赛康 28、以下关于 PPI制剂最大生物利用度的描述,错误的是() 。 A、艾司奥美拉唑最大 B、奥美拉唑最大
C、兰索拉唑最大 D、所有 PPI 制剂生物利用度均一样 29、以下关于艾速平 ?的描述正确的是() 。 A、采用不对称合成,有效阻止 R 异构体的生成 B、原料药、制剂内控标准高于药典和原研 C、生产过程中使用进口除菌过滤器、进口胶塞 D、采用乙醇、乙酸乙酯代替乙腈,避免有毒残留 30、以下属于艾速平 ?竞品的有() 。
,项目承办方是由(媒体
33、 2017 年艾速平 ?在助力医院开发及学术推广的策略上,力争循证医学证据的补充(
第六届“正大天晴杯”大奖赛单连锁选拔赛—“骨科+消化”线上答题

第六届“正大天晴杯”大奖赛单连锁选拔赛一“骨科+消化”线上答题本测试共计50题,时长20分钟,超时系统将自动交卷,请勿频繁切屏!所属区域及办事处:[填空题]*基本信息:[矩阵文本题]*姓名:________________________连锁:________________________门店: ________________________电话:________________________“正大天晴杯”知识与关爱技能大奖赛创建至今,今年是第几届?***[单选题]*A.第七届B.第六届(,C.第五届D.第四届本届“正大天晴杯”知识与关爱技能大奖赛的目标受众有哪些?****A.连锁内训师(B.连锁药店店员(C.连锁领导ID.集团同事(「正大天晴拥有庞大的产品集群,覆盖多个疾病领域,请问目前覆盖了以下哪些领域?****A.肿瘤(B.内分泌UC.肝消,D.呼吸I正大天晴哪个产品的上市,奠定了正大天晴在肿瘤领域的主流地位?***[单选题]*A.福可维,B.润众C.格尼可D.安显本届“正大天晴杯”知识与关爱技能大奖赛所涉及的疾病领域包含以下哪些O。
****A.肿瘤B.肝消(正确答案)C.心血管㈠D.内分泌G本届“正大天晴杯”知识与关爱技能大奖赛单连锁选拔赛环节一的名称叫做O。
***[单选题]*A.海选赛B.初赛C.晴你来比拼(D.晴你来分享本届“正大天晴杯”知识与关爱技能大奖赛单连锁选拔赛环节一中,担任讲师一职的是0。
***[单选题]*A.天晴代表B.第三方培训公司讲师C.院内医生专家D.参加“蒲公英行动”的连锁内训师I .正大天晴是一家富有社会责任感的药企,为积极响应国家抗疫号召,第五届“正大天晴杯”大奖赛全国总决赛采用的是()决策。
***[单选题]*A.线下现场参赛B.线上平台参赛(C.取消全国总决赛D.延期全国总决赛正大天晴致力于协同零售连锁构建慢病管理体系,为连锁培养具有疾病药物治疗以及患者关爱技能的专业人才,目前正大天晴为零售连锁提供了哪些学术项目?****A.阳光行动(上确答案)B.蒲公英行动C“正大天晴杯”知识与关爱技能大奖赛—)D.KS精英训练营(正大天晴秉承“健康科技,温暖更多生命”的理念,为患者提供更完善的大健康医疗生态,2023年,开创性的构建“药企一连锁■患者”三方协同的患者教育公益项目,这个项目的名称叫()。
瑞士艾酸平,助你轻松排尿酸

瑞士艾酸平,助你轻松排尿酸一、艾酸平有什么功效?Aibasit(艾酸平)来自瑞士,由瑞士Biosana(柏善)公司研发设计,具备独特的碱性离子配方,能通过调整人体的矿物质平衡来排酸,迅速恢复正常体液酸碱平衡。
Aibasit能通过人体血液和组织的正常代谢帮助人体排除尿酸,从而使细胞获得跟多的自由氧并增加维生素和矿物质的细胞级吸收。
二、艾酸平——来自瑞士的体液酸碱平衡专家1、瑞士艾酸平含有多种特有植物精华成分,造就全球独一无二的排酸组方;2、瑞士40年历史的著名品牌Biosana研制;3、预防和改善与体液酸碱平衡相关的关节炎、骨质疏松、纤维组织肌痛、癌症、抑郁、疲劳及蛀牙;4、重构人体酸碱物质平衡,为人体的关节、肝脏、肠道、肾脏、肺及皮肤等组织代谢提供适宜的环境。
三、瑞士艾酸平特有植物精华海藻提取物(含柠檬酸钾、柠檬酸钙、柠檬酸镁、柠檬酸钠、柠檬酸铁、柠檬酸锰)、菊粉、黑莓提取物、茴香果提取物、万寿菊提取物、柠檬果粉、甜橙果粉、马铃薯淀粉、微晶纤维素四、艾酸平作用机理:艾酸平特别选用天然海藻来源地碱性离子(钾、钙、镁、钠、铁、锰2),并科学配方,保证人体完美酸碱平衡下的最佳吸收,而高含量的碱性元素组合物强化人体摄取微量元素,这对因为体液酸碱失衡造成的矿物质和微量元素失衡至关重要。
艾酸平配方中加入的菊粉和其他植物精华成分(黑莓提取物、茴香果提取物、万寿菊提取物)能够促进人体的消化和代谢,并强化人体“排除尿酸”。
相比常规的膳食补充剂营养配方,艾酸平能够以更快速、更高效的方法重构人体正常所需的酸碱物质平衡。
艾酸平含有超高含量的碱性离子柠檬酸盐,这种特殊盐型和特定的配方能够最有效的帮助尿酸过高和微量元素失衡的人群。
艾酸平的特殊碱性矿物质复合配方师目前市场上最有效的排酸产品。
2024年奥氮平市场调查报告

2024年奥氮平市场调查报告1. 背景和目的本市场调查报告旨在对奥氮平(Olanzapine)市场进行调查和分析,了解奥氮平的产品特点、市场竞争态势以及未来发展趋势。
通过深入研究奥氮平市场情况,为相关企业制定合理的市场营销战略提供参考。
2. 奥氮平产品概述奥氮平是一种常用的抗精神病药物,主要用于治疗精神分裂症和双相情感障碍等相关疾病。
其主要特点包括:高效、低副作用、临床应用广泛等。
3. 奥氮平市场竞争态势3.1 主要竞争对手奥氮平市场上存在多个主要竞争对手,包括:•氯氮平(Chlorpromazine)•好吉宁(Risperidone)•奥兰宁(Aripiprazole)•立普妥(Quetiapine)等3.2 奥氮平市场份额根据市场调查数据显示,奥氮平在抗精神病药物市场中占据重要地位,其市场份额稳步增长,预计未来几年内将保持相对稳定。
4. 奥氮平市场发展趋势4.1 技术创新带来的机遇随着医疗技术的不断创新和进步,奥氮平在治疗精神疾病方面有望持续发挥重要作用。
同时,新型药物递送系统和治疗方案的研发也为奥氮平市场的发展提供了新的机遇。
4.2 市场扩大的挑战尽管奥氮平在市场上表现强劲,但随着竞争对手不断涌现,市场竞争日趋激烈。
此外,药物价格、医保政策等问题也对市场扩大造成了一定的挑战。
5. 奥氮平市场营销策略基于对奥氮平市场状况和发展趋势的分析,我们提出以下市场营销策略供相关企业参考:•提高产品质量和疗效,确保产品的安全性和有效性;•加强市场宣传和推广,扩大产品知名度和市场份额;•积极开展合作与研发,不断推陈出新,提高市场竞争力;•寻求与医药机构的合作,扩大销售渠道;•关注市场动态和竞争态势,及时调整市场策略。
6. 结论通过本次2024年奥氮平市场调查报告,我们深入了解了奥氮平产品的特点、市场竞争态势以及未来发展趋势。
同时,我们提供了相关企业制定市场营销策略的建议和参考。
展望未来,奥氮平市场将面临挑战与机遇,需要相关企业积极应对,并制定相应的市场营销策略以确保市场竞争力和持续发展。
iTRAQ

百泰派克生物科技
iTRAQ
iTRAQ(isobaric tags for relative and absolute quantitation)即同位素标记相对和绝对定量技术,是由AB SCIEX公司研发的一种基于标签的蛋白质定量技术。
iTRAQ技术通过同位素标记来实现蛋白质定量研究,其基本原理为:将水解得到的蛋白质多肽N末端或赖氨酸侧链基团用同位素试剂标签标记,再将该混合物进行高精度串联质谱分析,根据信号峰强度等质谱信息实现对样品蛋白的定量和定性分析。
iTRAQ含有8种不同的试剂标签,可同时对多达8个样品进行鉴别和定量;该技术在体外对样品蛋白进行标记,检测范围广,精确度高,理论上可用于对所有物种的胞内、胞外蛋白质进行定量分析。
百泰派克生物科技采用Thermo公司最新推出的Obitrap Fusion Lumos质谱仪结合Nano-LC,提供iTRAQ蛋白定量分析服务技术包裹,您只需要将您的实验目的告诉我们并将您的蛋白寄给我们,我们会负责项目后续所有事宜,包括蛋白酶切、肽段标价、肽段分离、质谱分析、质谱原始数据分析、生物信息学分析。
痛风怎么办,艾酸平缓解痛风病发症

痛风怎么办,艾酸平缓解痛风病发症痛风怎么办,发作时疼痛十分剧烈,令人痛苦不堪。
许多患者就诊时都是坐着轮椅或者被人搀扶进诊室,疼痛得难以行走。
古代大多是国王所得,这是因为痛风与饮食密切相关,古代只有国王或者贵族才能经常喝肉汤喝酒,所以相比贫苦的百姓,他们更容易得痛风。
随着现代人的生活水平普遍提高,酒肉不再是国王和贵族的专享,因此痛风的发病率也越来越高,而且呈年轻化的趋势。
痛风较准确的定义是:持续、显著的高尿酸血症,在多种因素影响下,过饱和状态的单水尿酸钠(MSU)微小结晶析出,沉积于关节内、关节周围、皮下、肾脏等组织,引发急、慢性炎症和组织损伤,出现相应临床症状和体征的疾病。
由此概念我们就知道尿酸盐结晶除了沉积在关节内,还会沉积在肾脏引起痛风性肾病,临床表现有血尿、蛋白尿、白细胞尿、尿比重下降、夜尿增多甚至肾衰竭;沉积在心血管引起冠心病造成心肌缺血、心绞痛甚至心肌梗死;沉积在关节周围和皮下形成痛风石等。
可见痛风的危害远远不止造成关节破坏那么简单。
艾酸平排除尿酸,缓解痛风柏善BIOSANA于2012年由北京康力基生物科技有限公司引入中国,康力基公司首先引入了BIOSANA最为经典的酸碱平衡产品-——艾酸平(免费热线:4006-270-279)艾酸平(Aibasit)是来自瑞士的酸碱平衡海藻精华复合营养片,以海藻提取物(含柠檬酸钾、钙、镁、钠、铁、锰)、菊粉、黑莓提取物、茴香果提取物等为主要成分,具有独特的碱性离子配方,能通过调整人体的矿物质平衡和人体血液、组织代谢来排酸,从而调节人体酸碱平衡、改善人体基础代谢、维持人体多种脏器正常生理功能。
为人体排除尿酸、重构人体酸碱平衡,这就是来自瑞士原装进口的艾酸平的使命。
艾酸平海藻精萃复合片是由5种天然碱性排酸植物复合而成,长期服用本品不仅可以促进机体排出尿酸,更可以扭转酸性体质,使人恢复弱碱性体质。
在弱碱性体质下,沉积在关节等处的尿酸盐结晶可以重新溶解,并通过肾脏、肠道代谢,从而起到改善缓解痛风的作用。
药物Ertugliflozin(埃格列净)合成检索总结报告
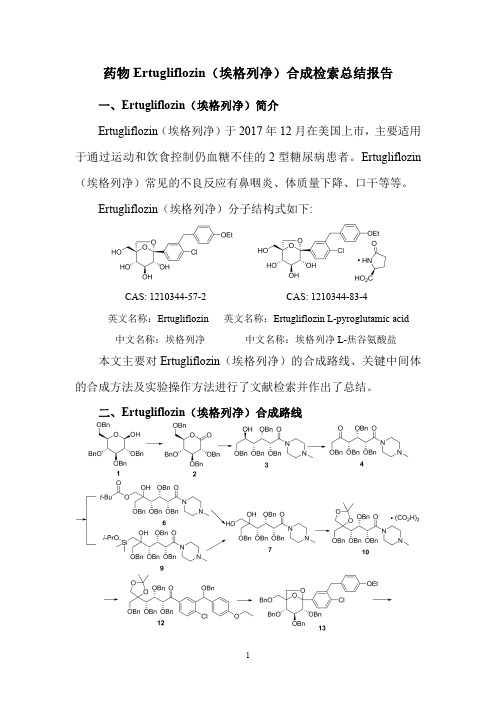
药物Ertugliflozin(埃格列净)合成检索总结报告一、Ertugliflozin(埃格列净)简介Ertugliflozin(埃格列净)于2017年12月在美国上市,主要适用于通过运动和饮食控制仍血糖不佳的2型糖尿病患者。
Ertugliflozin (埃格列净)常见的不良反应有鼻咽炎、体质量下降、口干等等。
Ertugliflozin(埃格列净)分子结构式如下:CAS:1210344-57-2CAS:1210344-83-4英文名称:Ertugliflozin英文名称:Ertugliflozin L-pyroglutamic acid中文名称:埃格列净中文名称:埃格列净L-焦谷氨酸盐本文主要对Ertugliflozin(埃格列净)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、Ertugliflozin(埃格列净)合成路线三、Ertugliflozin (埃格列净)合成检索总结报告(一)Ertugliflozin (埃格列净)中间体2的合成合成方法实验步骤参考文献操作方法一Dissolve 50g of compound (1)in 285mL of DMSO and then into it 190mL of acetic anhydride was added and allowed to react at room temperature overnight.The reaction solution was poured into cold water,extracted with ethyl acetate,and washed with saturated sodium hydrogen carbonate solution.Wash with polyester,saturated sodium chloride solution,Dry over anhydrous sodium sulfate.Evaporation on a silica gel column under reduced pressure to give a colorless oil (2)44g,yield 89%.CN105085494;(2019);(B)Chinese 操作方法二4g freshly activated molecular sieve 4Åand 3.3g N-methylmorpholine-N-oxide are added to a solution of 10.0g 2,3,4,6-tetra-O-benzyl-α-D-glucopyranose 1in 140ml dichloromethane.The solution is stirred for 20min at ambient temperature,before adding 0.3g of tetrapropylammonium perruthenate.After 2h stirring at ambient temperature the solution is diluted with dichloromethane and filtered through Celite.The filtrate is washed with aqueous sodium thiosulfate solution and water and then dried over sodium sulfate.After the solvent is removed the residue 2is chromatographed through silica gel (cyclohexane/ethyl acetate 4:1).Yield:8.2g (82%of theory)US2006/189548;(2006);(A1)English;US2006/234953;(2006);(A1)English;US2007/4648;(2007);(A1)English;US2007/27092;(2007);(A1)English 操作方法三To a solution of 2,3,4,6-tetra-O-benzyl-D-glucopyranoside 1(5g,9.25mmol)in DMSO (25mL)was added acetic acid anhydride (15mL).The mixture was stirred overnight before diluted with water (200mL),then extracted with ethyl acetate for 5times.The combined organic phase were washed with saturated NaCl solution,dried with anhydrous Na 2SO 4,filtrated,and concentrated under reduced pressure.The residue was purified by column chromatography (petroleum ether/ethyl acetate =8/1)to give compound 2Bioorganic and Medicinal Chemistry Letters ;vol.22;nb.1;(2012);p.642-644(4.63g,93%)as a colorless oil.操作方法四To a solution of oxalyl chloride (2.4mL,27.74mmol)in dichloromethane (100mL)cool to -78o C was added DMSO (2.6mL,37.00mmol)and the resulting solution stirred for 15minutes.A solution of 2,3,4,6-tetra-O-benzyl-β-D-glucopyranose 1(6g,11.10mmol)in dichloromethane (10mL)was added via syringe and the resulting mixture was stirred for 1hour at -78o C.Finally,triethylamine (6.4mL,46.24mmol)was added and the mixture was stirred for 1hour allowing to warm to room temperature.Diluted with ethyl acetate (200mL)and washed with 0.5M HCl (2×75mL),water (1×75mL)and brine (1×75mL).The organics were dried over magnesium sulfate,filtered,and concentrated.The crude product 2was used without further purification.WO2006/138163;(2006);(A2)English 操作方法五A solution of 2,3,4,6-tetra-O-benzyl-D-glucopyranose 1(25.0g)in dimethyl sulfoxide (100mL,4L/kg)was stirred at 20−25°C for 30min under a nitrogen atmosphere.Acetic anhydride (75mL,3L/kg)was added at a rate of 5mL/min (∼15min)at 15−25°C.After complete addition,the reaction mixture was stirred for 18−24h at 20−25°C.After complete reaction was confirmed by UHPLC/MS analysis,the reaction mixture was diluted with toluene (225mL,9L/kg)and a 3.3N aqueous solution of HCl (225mL,9L/kg)was slowlyadded to quench the excess acetic anhydride.The reaction mixture was stirred for 20min at 20−25°C to complete this quench.The phases were separated,the aqueous layer was discarded,and the organic layer was washed with a 2M aqueous phosphate buffer (pH 7,225mL,9L/kg).After stirring for 20min at 20−25°C,the phases were separated,and the organic layer was dried over sodium sulfate (asneeded)and filtered.Analysis of the filtrate indicated 26.9g of lactone 2was present (924mg/g potency,94.6%purity).Organic Process Research and Development ;vol.18;nb.1;(2014);p.66–81.(二)Ertugliflozin (埃格列净)中间体3的合成合成方法实验步骤参考文献A solution of tetra-O-benzyl gluconolactone 2(14.7wt/wt%,50g)in toluene (340g total solution mass)was stirred at。
胸腺素α1与拉米夫定组合或者与拉米夫定及泛昔洛韦组合治疗乙型肝

专利名称:胸腺素α1与拉米夫定组合或者与拉米夫定及泛昔洛韦组合治疗乙型肝炎感染
专利类型:发明专利
发明人:梁英杰
申请号:CN99811382.4
申请日:19990922
公开号:CN1320041A
公开日:
20011031
专利内容由知识产权出版社提供
摘要:治疗患者中乙型肝炎病毒(HBV)感染的方法,其包括向需要此等治疗的患者给药以下药物组合,该组合包括抗病毒有效量的胸腺素α1(Tα1)和抗病毒有效量的拉米夫定、以及任选的抗病毒有效量的泛昔洛韦。
申请人:希克龙制药公司
地址:美国加利福尼亚州
国籍:US
代理机构:永新专利商标代理有限公司
代理人:过晓东
更多信息请下载全文后查看。
阿托品阻断药哌仑西平M2胆碱受体阻断药课件

哌仑西平主要通过竞争性拮抗乙酰胆碱的作用而发挥药效,能够抑制腺体分泌、扩 张瞳孔、减慢心率等。
药动学
哌仑西平口服吸收较 快,约1小时达到血 药浓度峰值。
哌仑西平主要通过肝 脏代谢,代谢产物主 要经肾脏排泄。
哌仑西平在体内分布 广泛,可透过血脑屏 障进入中枢神经系统 。
药物相互作用
哌仑西平与胆碱酯酶抑制剂合用时, 可能出现相加作用,导致不良反应加 重。
阿托品阻断药哌仑 西平m2胆碱受体阻 断药课件
目 录
• 阿托品阻断药哌仑西平m2胆碱受体简介 • 阿托品阻断药哌仑西平m2胆碱受体的药理作
用 • 阿托品阻断药哌仑西平m2胆碱受体阻断药的
适应症与禁忌症
目 录
• 阿托品阻断药哌仑西平m2胆碱受体阻断药的 给药方式与剂量
• 阿托品阻断药哌仑西平m2胆碱受体阻断药的 研发与展望
慢性胃炎
哌仑西平可以缓解慢性胃 炎引起的胃痛、胃酸过多 等症状。
消化性溃疡
通过抑制胃酸分泌,减少 胃酸对胃黏膜的刺激,促 进溃疡愈合。
禁忌症
对哌仑西平过敏者
过敏体质者应慎用哌仑西平,如出现过敏反应应及时停药。
青光眼患者
哌仑西平可能会加重青光眼的症状,因此青光眼患者应禁用。
严重肝肾功能不全者
哌仑西平在体内代谢和排泄需要肝肾功能的参与,因此严重肝肾功 能不全者应禁用。
扩张血管
调节心脏功能
M2胆碱受体在心脏中主要分布在心 肌和传导系统,哌仑西平通过阻断 M2胆碱受体,可以抑制心肌收缩和 传导速度,用于治疗心律失常。
哌仑西平可以作用于血管平滑肌上的 M2胆碱受体,引起血管舒张,降低 血压。
分布与代谢
分布
M2胆碱受体在体内广泛分布,主要集中在中枢神经系统、心血管系统、消化 系统等器官和组织中。
过敏性鼻炎爱赛平常用文档

正注册的国家
计划注册的国家
*Nasal antihistamines: A Novel and Effective Approach to Treating Rhinitis Michael A. Kaliner, MD Annals of Allergy, Asthma and Immunology, Volume 99, Nimber 5, Nov.2007, pp383-391(9)
美国 爱赛平上市后疗效再评价*
n=22549
100%
84%
90%
80%
65%
60%
40%
20%
0%
≤15分钟
≤30分钟
≤60分钟
中国 爱赛平上市后疗效再评价
n=1171
100%
89%
76%
80%
60%
40%
20%
0%
15分钟
2周
* Trangsrud AJ. Pharmacotherapy 2002; 22(11):1458-1467 Day JH et al. Annals of Allergy, Asthma, & Immunology1997; 79:163-172
爱赛平鼻喷剂
长期应用具有良好的耐受性
儿童耐受性 N=352
成人耐受性 N=185
98%
98% 的儿童接受爱赛平 4周治疗后耐受性良好
96%
95.6% 的成人接受爱赛平 6个月治疗后耐受性良好
Gastpar H. Arzneim Forsch/Drug Research 1993; 43(7)Biblioteka 771-776爱赛平鼻喷剂
儿童变应性鼻炎患者疗效明显
爱赛平

爱赛平(盐酸氮卓斯汀)
[适应症] 季节性过敏性鼻炎(花粉症)和常年性过敏性鼻炎
[用法用量] 1喷/鼻孔,早晚各1次,每日2次(相当于每日0、56mg盐酸氮卓斯汀剂量)或遵医述。
喷药时保持头部直立在症状消失前应坚持使用爱赛平(盐酸氮卓斯汀),但连续使用不超过6个月。
[不良反应]少数患者喷药时会产生鼻黏膜刺激,个别患者出现鼻衄。
若给药方法不正确用药时会有苦味产生。
[禁忌症]对盐酸氮卓斯汀,洁尔灭和依地酸高度敏感的患者禁用爱赛平(盐酸氮卓斯汀),6岁以下儿童禁用。
艾素肺癌方案

艾素肺癌方案第1篇艾素肺癌方案一、背景肺癌是我国常见的恶性肿瘤,其发病率和死亡率呈逐年上升趋势。
艾素(化学名:吉非替尼)是一种多靶点抗肿瘤药物,适用于治疗非小细胞肺癌。
为确保艾素肺癌治疗方案的科学性、合理性和合法性,结合我国相关法律法规及临床实践,制定本方案。
二、目标1. 提高患者生存质量,延长生存期。
2. 降低药物不良反应,减轻患者痛苦。
3. 严格遵循我国相关法律法规,确保治疗方案的合规性。
三、治疗方案1. 病例筛选(1)病理诊断:经病理学检查确诊为非小细胞肺癌。
(2)基因检测:具有表皮生长因子受体(EGFR)敏感突变。
(3)分期:ⅢB~Ⅳ期。
2. 用药方案(1)剂量:250mg/次,口服。
(2)频率:每日1次。
(3)疗程:持续用药至病情进展或出现不可耐受的不良反应。
3. 疗效评估(1)疗效评价:根据实体瘤疗效评价标准(RECIST 1.1版)进行评价。
(2)评估时间:治疗开始后每6周进行一次评估。
4. 不良反应监测(1)监测指标:血常规、肝功能、肾功能、甲状腺功能等。
(2)监测频率:治疗开始后每2周进行一次监测,稳定后可延长至每4周一次。
5. 治疗调整(1)根据疗效评估和不良反应监测结果,及时调整治疗方案。
(2)如出现病情进展,可考虑更换其他抗肿瘤药物或联合治疗。
四、合规性保障1. 严格遵守我国相关法律法规,包括但不限于《药品管理法》、《医疗机构管理条例》等。
2. 确保治疗方案在医疗机构内实施,严禁非法行医。
3. 加强对患者教育,提高患者对药物治疗的认知度和依从性。
五、人文关怀1. 关注患者心理健康,提供心理支持。
2. 加强与患者及家属的沟通,充分尊重患者意愿。
3. 提供便捷的就医流程,减轻患者负担。
六、总结本方案旨在为艾素肺癌患者提供科学、合理、合规的治疗方案,以提高患者生存质量,延长生存期。
在实施过程中,需密切关注患者病情变化和不良反应,及时调整治疗方案,确保治疗的有效性和安全性。
同时,关注患者心理和生理需求,提供全方位的人文关怀,为患者创造一个良好的治疗环境。
艾太(奈韦拉平片)使用说明

艾太(奈韦拉平片)【用法用量】1.成人: 200mg每天1次,连用2周后改为200mg 每天2次,并同时使用至少两种以上的其它抗逆转录病毒药物。
2.2个月到8岁的儿童: 4mg/kg每天1次,连用2周后改为7mg/kg/日,分2次给药。
3.8岁或以上的儿童: 4mg/kg每天1次,连用2周后改为4mg/kg每天2次。
所有患者的总剂量不得超过400mg/天。
4.预防HIV母婴传播: (1)马上分娩的孕妇:单剂量200mg。
(2)新生儿:出生后72小时内,按2mg/kg口服1次。
【注意事项】接受奈韦拉平或其它任何抗逆转录病毒药物治疗的患者,均可能继续发生机会性的感染和HIV相关疾病,因此,这些患者仍然需要具有对HIV相关性疾病治疗有经验的内科医生进行密切的临床观察。
目前对于本药的长期疗效尚不清楚。
奈韦拉平治疗并未显示可以减少HIV-1传染给其他人的危险性。
【不良反应】皮疹、肝功能异常/肝炎、恶心、疲劳、发热、头痛、嗜睡、呕吐、腹泻、腹痛和肌痛变态反应。
最严重的药物是Seven-Johnson综合症,毒性表皮坏死溶离,重症肝炎/肝衰竭和过敏反应。
【禁忌】对维乐命的活性成分或者此产品的任何赋形剂具有临床明显过敏反应的患者,维乐命??用。
对由于严重皮疹,皮疹伴全身症状,过敏反应和奈韦拉平引起的肝炎而永久中断本药治疗的患者不能重新服用。
在服用本药期间,继往出现ASAT或ALAT超过正常值上限5倍,重新应用本药后迅速复发肝功不正常的患者应禁用。
【适应症】本品与其它抗逆转录病毒药物合用治疗HIV-1感染。
对于分娩时未使用抗逆转录病毒治疗的孕妇,应用奈韦拉平可预防HIV-1的母婴传播。
【药物相互作用】如果患者正在接受由CYP3A或CYP2B代谢的药物治疗,若开始合用本药,前者药物剂量需要调整。
酮康唑和奈韦拉平不应合用。
【类型】处方药【医保】非【国家/地区】国产【剂型】片剂【药代动力学】奈韦拉平主要在肝脏代谢,奈韦拉平代谢物主要由肾脏清除。
《艾曲泊帕乙醇胺片生物等效性研究技术指导原则(2023版)》

2023年8月一、概述 (1)二、人体生物等效性研究设计 (1)(一)研究类型 (1)(二)受试人群 (2)(三)给药剂量 (2)(四)给药方法 (2)(五)血样采集 (2)(六)检测物质 (2)(七)生物等效性评价 (2)(八)其他 (2)三、人体生物等效性研究豁免 (3)四、参考文献 (3)一、概述艾曲泊帕乙醇胺(Eltrombopag Olamine)为小分子血小板生成素(TPO)受体激动剂,艾曲泊帕乙醇胺片临床获批用于治疗既往对糖皮质激素、免疫球蛋白等治疗反应不佳的成人和12岁及以上儿童慢性免疫性(特发性)血小板减少症(ITP)患者,使血小板计数升高并减少或防止出血。
本品仅用于因血小板减少和临床条件导致出血风险增加的ITP患者。
本品应在以下产品使用前间隔至少2小时或使用后间隔至少4小时服用,包括抗酸药、富含钙(≥50mg钙)的食物(如乳制品、豆制品(不包括豆奶)、海产品、芝麻、脱水蔬菜等,具体可参考《中国食物成分表》)、或含有多价阳离子(如铝、钙、铁、镁、硒和锌)的矿物质补充剂。
艾曲泊帕乙醇胺片生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》等相关指导原则。
二、人体生物等效性研究设计(一)研究类型采用两制剂、两周期、两序列交叉设计,进行空腹和餐后条件下单次给药的人体生物等效性研究。
也可考虑采用平行试验设计。
(二)受试人群健康受试者。
(三)给药剂量建议采用申报的最高规格单片服用。
(四)给药方法口服给药。
(五)血样采集合理设计样品采集时间,使其包含吸收、分布及消除相。
(六)检测物质血浆中的艾曲泊帕。
(七)生物等效性评价以艾曲泊帕的C max、AUC0-t、AUC0-∞作为生物等效性评价指标。
生物等效性接受标准为受试制剂与参比制剂的C max、AUC0-t和AUC0-∞的几何均值比的90%置信区间在80.00%~125.00%范围内。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
艾司奥美拉唑40mgIV 每天1次 泮托拉唑40mgIV 每天1次
第5天 24小时
13.90
9.00
P < 0.0001
第5天 24小时
3.60
P < 0.001
1.80
0
6
12
18
24
胃内pH>4的时间(小时)
0
2
4
6
8 10 12
胃内pH>6的时间(小时)
一项单中心、随机、开放标签交叉研究,纳入25例幽门螺旋杆菌阴性的健康成人受试者,随机使用艾司奥美拉唑针剂或泮托拉唑针 剂每天静脉滴注40mg,给药5天,分析第1天和第5天24小时胃液PH
艾速平®制剂注册标准高于《药典》及进口标准
项目
企业标准
进口注册标准
国产
有关物质
杂质Ⅰ≤0.3% 杂质Ⅲ≤0.5% 杂质Ⅳ≤0.5% 总杂≤1.5%
H168/66(杂质Ⅰ)≤0.5% H 193/61(杂质Ⅲ)≤0.9% H215/01杂质Ⅳ≤1.3% 总杂≤2.6%
杂质Ⅰ≤0.5% 杂质Ⅲ≤0.5% 杂质Ⅳ≤0.8%
第5天
4.3
3.2
P < 0.0001
第1天
3.1
2.3
P < 0.001
第1天0-4小时
3.5
2.2
P < 0.0001
0
1
2
3
4
5
6
胃内pH平均值
一项开放标签交叉研究,纳入101例幽门螺旋杆菌阴性的健康成人受试者,随机分为两组,分别使用艾司奥美拉唑针剂(40mg)或兰 索拉唑针剂(30mg)5天,经过10-17天的洗脱期,两组受试者交叉,分析两个阶段第1天和第5天24小时胃液PH,共97例完成研究
尊敬的大会主席、各位专家 大家好!
艾速平®是抑酸治疗的一线用药 强效持久抑酸 更高标准 更值信赖
1
艾速平®简要处方信息
商标名:艾速平® 通用名:注射用艾司奥美拉唑钠 曾用名:注射用埃索美拉唑钠 注册分类:6类 申请类型:仿制(国内首批仿制) 医保:国家医保乙类 规格:40mg、20mg(国内独家) 适应症:1、作为当口服疗法不适用时,胃食管反流病的替代疗法;2、用于口服疗 法不适用的急性胃或十二指肠溃疡出血的低危患者(胃镜下Forrest分级Ⅱc-Ⅲ) 给药方法
5-甲氧基-2-[(4-甲氧基-3,5-二甲基-2-吡啶基)-甲基亚砜]-3H-苯并咪唑
• 奥美拉唑为消旋体 • 艾司奥美拉唑为优势构型,S-异构体
艾速平®通用名为艾司奥美拉唑
国家医保目录乙类,价格更合理
艾司奥美拉唑2009年批准进入国家医保目录:乙类(口服常释剂型、注射剂) 2014年6月6日药典委员会确定标准,更名为:艾司奥美拉唑 北京、江苏、海南等省市均已将医保目录平行调整
胃内24h的pH平均值可达4以上
艾速平®有效止血率高达98%
100% 95%
P<0.05
98%
总有效率(%)
90% 85%
艾速平®
88% 奥美拉唑针剂
一项研究纳入200例溃疡出血患者,随机分为艾速平®(40mg加以0.9%NaCl 静脉滴注,q12h)组和奥美 拉唑(40mg加以0.9%NaCl 静脉滴注,q12h)组,治疗5天,比较两组患者治疗后的效果
Pisegna JR,et al. Aliment Pharmacol Ther. 2008 Mar 15;27(6):483-90
艾速平®抑酸作用更持久
• 艾司奥美拉唑针剂40mg静脉滴注用药第5天24小时胃内pH>4和pH>6的时 间较泮托拉唑分别延长4.9小时和1.8小时
艾司奥美拉唑40mgIV 每天1次 泮托拉唑40mgIV 每天1次
艾速平®强效抑酸
Olbe L, et al. Nat Rev Drug Discov 2003; 2(2):132-9.
艾速平®具有代谢优势,降低对CYP2C19的依赖 性,个体差异小、抑酸效果更稳定
艾 司 奥 美 拉 唑
Lindberg. P., et al., Aliment Pharmacol Ther, 2003.17(4):p.481-8
总杂≤2.0%
R-对映 体
≤0.5%
参见:艾速平®CFDA药品质量标准
未定入
≤0.5%
1.国家药典委员会.中华人民共和国药典2015年版.第二部 2.注射用艾司美拉唑进口药品标准.标准号:JX20040055
艾速平®是奥美拉唑的S-型异构体 血浆浓度是R-奥美拉唑的3倍 抑酸效果更出色
艾速平®血浆浓度更高
Wilder-Smith CH, et al. Aliment Pharmacol Ther. 20:1099–1104
艾速平® 20mg连续给药可维持胃内平均pH>4 且胃内pH>4时间长达12h,适合每天2次给药方案
胃内pH>4时间长达12h以上
Eur J Clin Pharmacol .2009, 65:19-31.
艾速平®起效更快 用药1小时即能达到pH>4
• 艾司奥美拉唑针剂快速起效,用药后第1天,1小时即能达到pH>4
胃内pH值
pH=4
艾司奥美拉唑针剂40mg 静脉滴注,每天1次
泮托拉唑40mg静脉滴注, 每天1次 基线
给药后的时间(小时)
一项单中心、随机、开放标签交叉研究,纳入25例幽门螺旋杆菌阴性的健康成人受试者,随机使用艾司奥美拉唑针剂或泮托拉唑针剂 每天静脉滴注40mg,给药5天,分析第1天和第5天24小时胃液PH
艾速平®首批获批艾司奥美拉唑针剂 同时具有20mg,40mg两个规格
有两种包装
• 两种规格:40mg、20mg • 两种包装
– 小包装:1支/盒;中包装:10支/盒
• 件/箱:12中包装,共计120支
艾速平®一项专利 获取代亚砜化合物的合成方法专利
注射用药:配制溶液的静脉注射时间至少在3分钟以上 滴注用药:配制溶液的静脉注射时间应在30分钟内
艾速平®手性结构,优势构型
左旋异构,是奥美拉唑的S-异构体,质子泵抑制剂家族的第一个单一光学异构体
艾司奥美拉唑
奥美拉唑
5-甲氧基-2-((S)-((4-甲氧基-3,5-二甲基-2-吡啶基)甲基)亚硫酰基)-1H-苯并咪唑奥美拉唑
Wilder-Smith CH, et al. Aliment Pharmacol Ther. 20:1099–1104
艾速平®抑酸能力更强
• 艾司奥美拉唑针剂用药后第1天4小时内、第1天和第5天24小时胃内pH平均值 较泮托拉唑分别高1.3、0.8和1.1
艾司奥美拉唑40mgIV每天1次
泮托拉唑30mgIV 每天1次
