2020年高考化学冲刺选择题集训第06天含解析
2020年高考考前大冲刺卷 理综化学部分

2020年高考考前大冲刺卷理综综合(化学部分)可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl35.5 K39一、选择题(每题6分,共42分。
)7.沈括的《梦溪笔谈》中记载①......高奴县出脂.....颇似淳漆,燃之如麻,但烟甚浓,....试扫其烟以为墨,黑光如漆,松墨不及也,遂大为之。
”②“信州铅山县有苦泉,流以为涧,挹其水熬之,则成胆矾,烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜....”。
下列说法不正确的是A.①中的“脂水”指石油B.①中的“烟”指石油中含碳个数较多的烃不完全燃烧产生的现象C.②中制得胆矾的方法为蒸发结晶D.②中“久之亦化为铜”发生了置换反应8.用N A表示阿伏加德罗常数,下列叙述正确的是A.1mol H2O2完全分解产生O2时,转移的电子数为2N AB.0.lmol环氧乙烷()中含有的共价键数为0.3N AC.1mol淀粉水解后产生的葡萄糖分子数目为N AD.常温下,1L pH=l的草酸(H2C2O4)溶液中H+的数目为0.1N A9.合成药物异搏定路线中某一步骤如下:+NaH,DMF下列说法正确的是A.物质X在空气中易被氧化B.物质Z与氢气完全加成需要消耗6mol H2C.物质Y能发生取代、消去、加成反应D.等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶110.科学家经过研究发现,CO2与H2在催化剂作用下可转化成CH3OH燃料,是一种减排、环保的有效方法。
该可逆反应发生过程中的能量变化如图所示,下列说法错误的是A .CH3OH(g)+H2O(g)CO2(g)+3H2(g)为吸热反应B.使用催化剂x时,正反应的活化能=ΔH+逆反应活化能C.其他条件一定,与其他催化剂相比,使用催化剂z时,反应物转化率可能更高D.从图中可知,选用不同的催化剂,反应的ΔH也不同11.亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体,具刺鼻恶臭味,遇水分解,某学习小组用Cl2和NO制备NOCl装置如图。
2020高三冲刺押题卷(三)化学试题Word版附答案及解析

2020高三冲刺押题卷(三)化学试题满分100分。
考试时间50分钟★祝考试顺利★注意事项:1.答题前,请考生认真阅读答题卡上的注意事项。
务必将自己的姓名、考号填写在答题卡上指定位置,贴好考号条形码或将考号对应数字涂黑。
用2B铅笔将试卷类型A填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
答在试题卷、草稿纸上无效。
3.非选择答题用0.5毫米黑色墨水签字笔直接答在答题卡上每题对应的答题区域内,答在试题卷、草稿纸上无效。
4.考生必须保持答题卡的清洁。
考试结束后,监考人员将答题卡和试卷一并收回。
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 Cl-35.5 Ca-40 Ti-48 Fe-56 Cu-64第Ⅰ卷选择题(共42分)一、选择题:本卷共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.世界第一条大面积碲化镉薄膜“发电玻璃”生产线最近在成都投产,该材料是在玻璃表面镀一层碲化镉薄膜,光电转化率高。
下列说法错误的是()A. 普通玻璃含有二氧化硅B. 该发电玻璃能将光能完全转化为电能C. 碲化镉是一种无机化合物D. 应用该光电转化技术可减少温室气体排放2.下列关于有机物的说法正确的是()A. C5H10O2的同分异构体中,能与NaHCO3反应生成CO2的有4种B. 糖类、油脂、蛋白质都是电解质C. 乙烯使溴水、酸性高锰钾溶液褪色的反应类型相同D. 将碘酒滴到未成熟的苹果肉上变蓝说明苹果肉中淀粉已水解3.X、Y、Z、W为原子序数依次增大的短周期主族元素。
X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。
丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:下列说法错误的是()A. 四种元素形成的单质中W的氧化性最强B. 甲、乙、丙中沸点最高的是丙C. 甲常用作致冷剂D. 甲、乙分子均只含极性共价键4.用“银-Ferrozine”法测室内甲醛含量的原理为:已知:吸光度与溶液中有色物质的浓度成正比下列说法正确的是()A. 反应①中参与反应的HCHO为30g时转移电子2molB. 可用双氧水检验反应②后的溶液中是否存在Fe3+C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8molD. 理论上测得溶液吸光度越高,HCHO含量也越高5.25℃将浓度均为0.1 mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100 mL,且生成的BA可溶于水。
2020年高考化学终极冲刺卷试题及答案解析

2020年06月08日xx 学校高中化学试卷学校:___________姓名:___________班级:___________考号:___________一、单选题1.为防止病毒的传播与传染,可使用酒精、“84”消毒液、口罩及防护服等。
下列说法不正确的是( )A.75%医用酒精中的浓度是指质量分数B.工业上“84”消毒液可用与NaOH 溶液反应制得2Cl C.层压织物防护服中含聚四氟乙烯超级防水透湿复合面料,聚四氟乙烯属于化学纤维D.N95口罩能有效阻挡某些可吸入微生物,但不能消除接触性传染疾病的危险2.是阿伏加德罗常数的值。
下列说法正确的是( )A N A.含质子数为31mol H O +A10N B.溶于足量的稀硝酸中转移的电子数为214.4g Cu O A 0.1N C.28 g 聚乙烯分子含碳碳双键数目为AN D.麦芽糖在稀硫酸作用下完全水解的产物中含醛基的数目为-11L 1mol L A2N 3.化合物是一种药物和有机合成的中间体。
下列关于M 的说法错误的是( )A.所有碳原子不可能处于同一平面B.能发生取代反应和加聚反应C.等物质的量的M 与甲苯完全燃烧时消耗的质量相等2O D.M 的同分异构体中能与反应的结构只有1种(不含立体异构)3NaHCO 4.元素周期表中前20号元素R 、X 、Y 、Z 的原子序数依次增大。
R 和Y 位于同主族,R 原子最外层电子数和X 的原子序数之和等于Z 的原子序数。
由这四种元素组成一种化合物Q ,在Q 的溶液中滴加溶液,产生沉淀的物质的量与的物质的量的关系如图所示。
下列说法正确的是( ()2Ba OH ()2Ba OH )A.简单离子半径:Z>X>Y>RB.气态氢化物的热稳定性:R>YC.Q 的溶液中两种阳离子浓度相等D.是含一种化学键的离子化合物22Z R 5.实验室制备“引火铁”(反应活性很高的铁粉)的装置如图所示。
下列说法错误的是( )A.稀硫酸中加入少量可加快反应速率B.②和④的主要作用均为吸收水蒸气4CuSO C.实验过程中,③中固体颜色发生明显变化 D.点燃酒精灯前,应先在⑤处收集气体并验纯6.利用微生物燃料电池原理处理含硫废水,其工作原理示意图如图所示。
化学-2020年高考考前押题密卷(江苏卷)(全解全析)
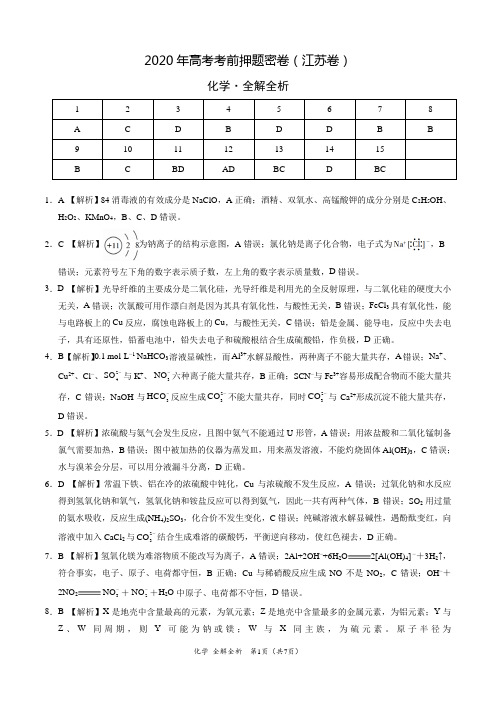
2020年高考考前押题密卷(江苏卷)化学·全解全析1 2 3 4 5 6 7 8 A C D B D D B B9 10 11 12 13 14 15BCBDADBCDBC1.A 【解析】84消毒液的有效成分是NaClO ,A 正确;酒精、双氧水、高锰酸钾的成分分别是C 2H 5OH 、H 2O 2、KMnO 4,B 、C 、D 错误。
2.C 【解析】为钠离子的结构示意图,A 错误;氯化钠是离子化合物,电子式为,B错误;元素符号左下角的数字表示质子数,左上角的数字表示质量数,D 错误。
3.D 【解析】光导纤维的主要成分是二氧化硅,光导纤维是利用光的全反射原理,与二氧化硅的硬度大小无关,A 错误;次氯酸可用作漂白剂是因为其具有氧化性,与酸性无关,B 错误;FeCl 3具有氧化性,能与电路板上的Cu 反应,腐蚀电路板上的Cu ,与酸性无关,C 错误;铅是金属、能导电,反应中失去电子,具有还原性,铅蓄电池中,铅失去电子和硫酸根结合生成硫酸铅,作负极,D 正确。
4.B 【解析】0.1 mol·L −1 NaHCO 3溶液显碱性,而Al 3+水解显酸性,两种离子不能大量共存,A 错误;Na +、Cu 2+、Cl −、24SO -与K +、3NO -六种离子能大量共存,B 正确;SCN −与Fe 3+容易形成配合物而不能大量共存,C 错误;NaOH 与3HCO -反应生成23CO -不能大量共存,同时23CO -与Ca 2+形成沉淀不能大量共存,D 错误。
5.D 【解析】浓硫酸与氨气会发生反应,且图中氨气不能通过U 形管,A 错误;用浓盐酸和二氧化锰制备氯气需要加热,B 错误;图中被加热的仪器为蒸发皿,用来蒸发溶液,不能灼烧固体Al(OH)3,C 错误;水与溴苯会分层,可以用分液漏斗分离,D 正确。
6.D 【解析】常温下铁、铝在冷的浓硫酸中钝化,Cu 与浓硫酸不发生反应,A 错误;过氧化钠和水反应得到氢氧化钠和氧气,氢氧化钠和铵盐反应可以得到氨气,因此一共有两种气体,B 错误;SO 2用过量的氨水吸收,反应生成(NH 4)2SO 3,化合价不发生变化,C 错误;纯碱溶液水解显碱性,遇酚酞变红,向溶液中加入CaCl 2与23CO -结合生成难溶的碳酸钙,平衡逆向移动,使红色褪去,D 正确。
2020高考化学模拟押题卷及答案(3套)

7.化学与人类生产、生活密切相关,下列叙述中正确的是( ) A.泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料 B.从石墨中剥离出的石墨烯薄片能导电,因此是电解质 C.中国天眼 FAST 用到的碳化硅是一种新型的无机非金属材料 D.食品工业以植物油和氢气为原料生产氢化植物油,利用了植物油的取代反应 【答案】C 【解析】银饰主要成分是 Ag,为金属材料,彩瓷主要成分是硅酸盐,为无机非金属材料,故 A 错误;石 墨烯是单质,因此不是电解质,故 B 错误;碳化硅是新型无机非金属材料,故 C 正确;植物油是不饱和脂 肪酸甘油酯,与氢气发生加成反应得到氢化植物油,故 D 错误。 8.设 NA 为阿伏加德罗常数的值,下列说法正确的是( ) A.2.8 g 铁粉与 50 mL 4 mol·L-1 盐酸反应转移电子的数目为 0.15NA B.常温下 1 L pH=13 的氢氧化钠溶液中由水电离出的 H+的数目为 0.1NA C.标准状况下,8.96 L 氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为 0.2NA D.1.2 g 金刚石与石墨的混合物中含有碳碳单键的数目为 0.4NA 【答案】C 【解析】A 项,铁与盐酸反应生成 FeCl2,n(Fe)=0.05 mol,n(HCl)=0.2 mol,盐酸过量,转移电子数 为 0.1NA,错误;B 项,c(OH-)=0.1 mol·L-1,c(H+)=c(H+)水=1×10-13 mol·L-1,错误;C 项,2H2 +O2==点=燃==2H2O、2CO+O2==点=燃==2CO2,0.4 mol H2、CO 混合气体完全燃烧,消耗 0.2 mol O2,正 确;D 项,0.1 mol 碳原子的金刚石含有碳碳键数为 0.2NA,0.1 mol 碳原子的石墨含有碳碳键数为 0.15NA, 错误。 9.以物质 a 为原料,制备物质 d(金刚烷)的合成路线如下图所示:
高考化学复习冲刺真题重组全国卷(含解析)

高考化学复习冲刺真题重组全国卷(含解析)可能用到的相对原子质量:H-1 C-12 N-14 B-11 O-16 Cl-35.5 S-32 Ba-137一、选择题:本题共7小题,每小题6分,在每小题给出的四个选项中,只有一项符合题目要求。
7.(2022·河北·高考真题)化学是材料科学的基础。
下列说法错误的是A.制造5G芯片的氮化铝晶圆属于无机非金属材料B.制造阻燃或防火线缆的橡胶不能由加聚反应合成C.制造特种防护服的芳纶纤维属于有机高分子材料D.可降解聚乳酸塑料的推广应用可减少“白色污染”【答案】B【详解】A.氮化铝是一种高温结构陶瓷,属于新型的无机非金属材料,A正确;B.天然橡胶的单体为异戊二烯,合成橡胶的单体如顺丁烯等中均含有碳碳双键,通过加聚反应合成制得橡胶,B错误;C.“涤纶”“锦纶”“腈纶”“丙纶”“维纶”“氯纶”“芳纶”等均为合成纤维,属于有机高分子材料,C正确;D.可降解聚乳酸塑料的推广应用,可以减少难以降解塑料的使用,从而减少“白色污染”,D正确;故答案为:B。
8.(2022·河北·高考真题)茯苓新酸DM是从中药茯苓中提取的一种化学物质,具有一定生理活性,其结构简式如图。
关于该化合物下列说法不正确的是A .可使酸性4KMnO 溶液褪色B .可发生取代反应和加成反应C .可与金属钠反应放出2HD .分子中含有3种官能团【答案】D【详解】A .分子中含有的碳碳双键、羟基相连的碳原子上连有氢原子的羟基,能与酸性高锰酸钾溶液发生氧化反应使溶液褪色,故A 正确;B .分子中含有的碳碳双键能发生加成反应,含有的羧基、羟基和酯基能发生取代反应,故B 正确;C .分子中含有的羧基和羟基能与金属钠反应生成氢气,故C 正确;D .分子中含有的官能团为碳碳双键、羧基、羟基和酯基,共4 种,故D 错误; 故选D 。
9.(2021·全国·统考高考真题)下列过程中的化学反应,相应的离子方程式正确的是A .用碳酸钠溶液处理水垢中的硫酸钙:223434CO CaSO CaCO SO --++B .过量铁粉加入稀硝酸中:332Fe 4H NO Fe NO 2H O +-+++=+↑+C .硫酸铝溶液中滴加少量氢氧化钾溶液:322Al 4OH AlO 2H O +--+=+D .氯化铜溶液中通入硫化氢:22Cu S CuS +-+=↓ 【答案】A【详解】A.硫酸钙微溶,用碳酸钠溶液处理水垢中的硫酸钙转化为难溶的碳酸钙,离子方程式为:223434CO CaSO CaCO SO --++,故A 正确;B .过量的铁粉与稀硝酸反应生成硝酸亚铁、一氧化氮和水,离子方程式应为:3Fe+8H ++2N3O -=3Fe 2++2NO↑+4H 2O ,故B 错误;C .硫酸铝溶液与少量氢氧化钾溶液反应生成氢氧化铝沉淀和硫酸钾,离子方程式应为:Al 3++3OH -=Al(OH)3↓,故C 错误;D .硫化氢为弱电解质,书写离子方程式时不能拆,离子方程式应为:Cu 2++H 2S=CuS↓+2H +,故D 错误; 答案选A 。
2020高三高考冲刺化学试题Word版附答案及解析

2020高三高考冲刺化学试题满分100分。
考试时间50分钟★祝考试顺利★注意事项:1.答题前,请考生认真阅读答题卡上的注意事项。
务必将自己的姓名、考号填写在答题卡上指定位置,贴好考号条形码或将考号对应数字涂黑。
用2B铅笔将试卷类型A填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
答在试题卷、草稿纸上无效。
3.非选择答题用0.5毫米黑色墨水签字笔直接答在答题卡上每题对应的答题区域内,答在试题卷、草稿纸上无效。
4.考生必须保持答题卡的清洁。
考试结束后,监考人员将答题卡和试卷一并收回。
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 Cl-35.5 Ca-40 Ti-48 Fe-56 Cu-64第Ⅰ卷选择题(共42分)一、选择题:本卷共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法正确的是()A. 糖类、油脂、蛋白质均可水解B. 服用维生素C可缓解亚硝酸盐中毒,利用了维生素C的酸性C. PM2.5是指粒径不大于2.5×10-6 m的可吸入悬浮颗粒物D. 汽车尾气中的氮氧化合物主要源自汽油中含氮化合物与氧气反应2.黄血盐[亚铁氰化钾,K4Fe(CN)6·3H2O]可用作食盐添加剂,一种制备黄血盐的工艺如下所示:下列说法错误的是()A. HCN溶液有剧毒,含CN-的废水必须处理后才能排放B. “系列操作”为蒸发结晶、过滤、洗涤、干燥C. “试剂X”可能是K2CO3D. “废水”中含量较多的溶质为CaCl23.设阿伏加德罗常数的数值为N A。
下列说法正确的是()A. 1L1 mol·L-1的NaHSO3溶液中含有的离子数为3N AB. 2.24 L CO2与足量的Na2O2反应,转移电子数为0.1N AC. 常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3N AD. 5.6 g乙烯和环丙烷的混合物中含C—H键数目为0.8N A4.下列实验操作与温度计的使用方法均正确的是(加热装置略)()A. AB. BC. CD. D5.阿司匹林的有效成分是乙酰水杨酸(COOHOCOCH3),可以用水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为原料合成。
2022届高考化学一轮复习专项集训6 原子结构与元素周期表(含解析)

专项集训6 原子结构与元素周期表一、选择题1.下列说法不正确的是( )A.人类对原子结构的认识经历了1803年道尔顿模型→1904年汤姆孙原子模型→1911年卢瑟福原子模型→1913年玻尔原子模型→1926~1935年电子云模型B.人类对原子结构的认识过程,启示了微观结构也要根据科学猜想和分析,并通过实验验证C.在原子中电子的分层排布中,M 层(第三层)容纳的电子数最多为18,最少为8D.在化学反应过程中,原子核不发生变化,但原子最外层电子可能发生变化2.(2020浙江丽水四校期中)下列叙述中,正确的是( )A .614C 中含有14个中子B .816O 、818O 是同一种核素C .11H 2和 12H 2互为同位素 D.C 60、C 70互为同素异形体3.R n +有m 个电子,它的质量数为A ,则原子核内的中子数为( )A.m+nB.A-m+nC.A-m-nD.A+m-n4.2017年,中国公布113号、115号、117号和118号四种元素的中文名称。
其中118号元素的原子符号为 118294Og,中文名称为“”。
下列说法不正确的是( )A.质子数为118B.中子数为176C.核外电子数为118D.质量数为4125.(2020浙江杭州校级期中)联合国大会将2019年指定为“化学元素周期表国际年”,来纪念元素周期表这一伟大的发现,下面有关元素周期表的内容,描述正确的是( )A.元素周期表是俄国科学家门捷列夫发现的B.元素周期表一共有7行16列C.左边的第一列的元素都是活泼的金属元素D.S 元素在元素周期表中的位置是第三周期Ⅵ族6.下列各组粒子中,核外电子总数相等的是( )A.CO 、H 2OB.H 2O 、HClC.CO 2、N 2OD.Na +、Cl -7.下列原子中,与氧元素原子的化学性质相似的是( )8.(2020~2021浙江温州高一检测)下列说法正确的是( )A.核素的种类比元素种类少B.H 2、D 2、T 2互为同位素,因为它们核内质子数相同,中子数不同C.通常人们所说的C-12原子是指质子数和中子数都是6的碳原子D .612C 与 614C 互为同位素,两者的化学性质不同9.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )A.Al 3+B.Mg 2+C.Be 2+D.H +10.在离子R O 3n -中共有x 个核外电子,R 原子的质量数为A ,则R 原子核内含中子的数目为( )A.A+n+48+xB.A-n-24-xC.A-n+24-xD.A+n+24-x11.核外电子分层排布的主要原因是( )A.电子的质量不同B.电子的能量不同C.电子的数量不同D.电子的大小不同12.(2020浙江杭州八校联盟期中联考)医学上通过研究并实现了利用含放射性元素 1532P 的“纸贴”治疗疤痕,下列有关 1532P 、1531P 的叙述正确的是( )A .1532P 、1531P 属于同一种核素B .1532P 的原子中所含的质子数为16C .1531P 的中子数为16D .1532P 的摩尔质量为32 13.已知A 为第ⅡA 族元素,B 为第ⅢA 族元素,它们的原子序数分别为m 和n ,且A 、B 为同一周期元素。
2020年全国高考化学冲刺试卷PDF版含解析

2020年全国高考化学冲刺试卷一、选择题1.化学与生产生活密切相关。
下列说法正确的是()A.阻燃剂Al(OH)3受热分解时放出能量B.蚕丝、涤纶、棉花的主要成分均为蛋白质C.油脂在长期贮存过程中与微生物、酶和空气中的氧气作用会发生酸败D.硅太阳能电池与铜锌原电池工作时均由化学能转变为电能2.设N A为阿伏加德罗常数的值。
下列说法正确的是()A.0.1mol SiO2晶体中含有Si—O键的数目为0.2N AB.56g铁粉与高温水蒸气反应,生成H2数目为1.5N AC.标准状况下,22.4L Cl2溶于水,转移电子数为N AD.18g H218O和D2O的混合物中,所含中子数为9N A3.下列有关1-甲基-1-环己烯(结构简式如图所示)的说法正确的是()A.该物质含有六元环的同分异构体有3种B.分子中所有碳原子在同一平面上C.该物质为芳香烃D.能使溴的四氯化碳溶液褪色,且反应生成的产物有2种4.下列化学用语对事实的表述不正确的是()A.电解精炼铜的阴极反应:Cu2++2e-===CuB.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218OC.由Na和Cl形成离子键的过程:D.常温时,0.1mol·L-1氨水的pH=11.1:NH 3·H2O NH4++OH-5.BHT是一种常用的食品抗氧化剂,合成方法有如下两种,下列说法正确的是()A.能与Na2CO3溶液反应生成CO2B.与BHT互为同系物C.BHT久置于空气中不会被氧化D.两种方法的反应类型都是加成反应6.用制溴苯的废催化剂(主要含FeBr3及少量溴、苯)为原料,制取无水FeCl3和溴的苯溶液,选用的方法能达到相应实验目的的是()A.用装置①及其试剂制取氯气B.用装置②氧化FeBr3溶液中的溴离子C.用装置③分离出FeCl3溶液,不能选用装置④分离D.用装置⑤将FeCl3溶液蒸发至干,可得无水FeCl3 7.常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选择题集训
第6天
7.化学与人类生产、生活密切相关,下列说法正确的是
A.铝及其合金是生活中广泛使用的材料,通常用电解氯化铝的方法制取
B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
C.偏二甲肼[NH2N(CH3)2]是一种液体燃料,它的一种同分异构体可以是氨基酸
D.邻苯二甲酸二辛酯常用作增塑剂,对人体无害,可用作食品添加剂
【答案】B
8.N A表示阿伏加德罗常数的值,下列有关叙述正确的是
A.常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3N A
B.4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8N A
C.常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同
D.1mol铁粉在1mol氯气中充分燃烧,转移的电子数为N A
【答案】A
【解析】A、46g NO2和N2O4混合气体中,由于NO2和N2O4最简式相同,只需求得最简式NO2中的原子数即可,含有的原子数=×3=3mol,选项A正确;B、乙烯和丙烯的通式为(CH2)n其中极性键为C-H 键,为2n个,则4.2g乙烯和丙烯混合气体中含有的极性键数目为,即0.6N A,
选项B错误;C、1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液中,铵根离子浓度越小水解程度越大,所以后者溶液中铵根离子水解程度大,即同一温度下1L0.5mol/LNH4Cl溶液所含NH4+的物质的量大于2L0.25mol/LNH4Cl溶液所含NH4+的物质的量,选项C错误;D、1mol铁粉在1mol氯气中充分燃烧生成氯化铁,1mol铁粉需要1.5mol氯气,所以氯气不足,根据氯气计算转移的电子数,所以反应转移的电子数为1mol×2×N A mol-1=2N A,选项D错误。
答案选A。
9.下列有关有机物的说法正确的是()
A.乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色
B.1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应
C.酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH
D.有机物分子式为C4H7ClO2,与NaHCO3溶液反应产生CO2,其结构可能有15种
【答案】D
10.下列实验装置(加热装置已略去)或操作合理的是
【答案】D
【解析】A、此装置不能防止倒吸,应把苯换成CCl4,故A错误;B、温度计应在环形玻璃搅拌棒的环形中间,故B错误;C、冷凝管应用直形冷凝管,故C错误;D、HCl的酸性强于H2SO3,因此能够达到除去HCl的目的,不引入新杂质,故D正确。
11.右图是部分短周期元素原子半径与原子序数的关系图。
则下列说法正确的是
A.Z、M的单质均不能与冷水反应
B.最高价氧化物对应水化物的酸性:R<N
C.气态氢化物的热稳定性:Y<N<R
D.简单离子半径:M<Z<Y<X
【答案】D
12.下列说法正确的是
A.某反应正、逆反应的活化能分别为E a kJ/mol、E b kJ/mol,则△H=-(E a-E b)kJ/mol
B.H2的热值为142.9kJ/g,则有2H2 (g)+O2(g)=2H2O (l)△H=-285.8kJ/mol
C.将浓度为0.1mol/LHF溶液加水不断稀释过程中,始终保持减小
D.混合前,等体积的混合后溶液中:
【答案】C
【解析】A、正反应的活化能可理解为断裂旧化学键吸收的能量,而逆反应的活化能可理解为形成新化学键放出的能量,二者的差值即为反应的热效应,不必再加负号,选项 A错误;B、热值又称卡值或发热量,是指单位质量或体积的燃料完全燃烧时所放出的热量,而不是以1mol燃料计,选项B错误;C、当无限稀释时,c(H+)为常数,而c(F-)却不断减小,故比值减小,选项C正确;D、混合前
=2,等体积的混合后为溶质为1:1的醋酸和醋酸钠溶液且溶液呈酸性,故
c(H+)>c(OH-),,c(CH3COO-)>c(CH3COOH),<1,故:
≠,选项D错误。
答案选项C。
13.如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。
(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是()
A.当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B.当A接电源的正极时,此时Li+脱离离子存储层
C.当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D.该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
【答案】D
点睛:该题看似陌生,实际就是一个电解池,只要明白了电解池的工作原理,不难解决。
明确阳极发生氧化反应,阴极发生还原反应,分析、、、各元素的化合价,不难写出电极反应式,进一步分析得出相应结论。
