化学平衡图象典型题专题
(完整word版)化学平衡图像专项练习题

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。
化学平衡图像专题完整各类型图像

or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。
化学平衡图像例题
例3:在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,在不同条件下R的百分含量R% 的变化情况如下图,下列叙述正确的是( ) A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体或液体
例4:25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量 金属锡(Sn),发生反应: Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s), 体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。 下列判断正确的是( ) A.往平衡体系中加入金属铅后,c(Pb2+)增大 B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 D.25℃时,该反应的平衡常数K=2.2
例5:如图曲线是其它条件不变时某反应物的 最大转化率(α)与 温度(T)的关系曲线 ,图中标出 的1、2、3、4,四个点, 表示V正=V逆的点是 V正>V逆的点是 。
例6.对于可逆反应: A2(g)+3B2(g) 2AB3(g) △H<0,下列图像中正确的是( )
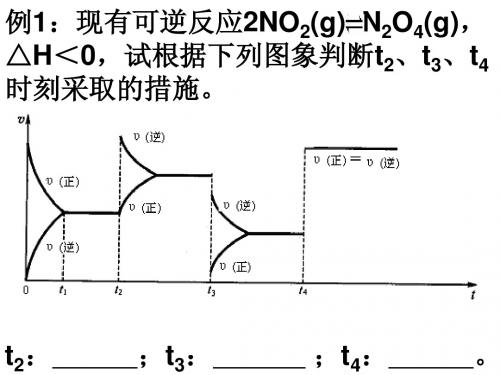
练习:(2014.1)一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1L的密闭容器 中发生反应:X(g)+3Y(g) 2Z(g),下 逆反应2NO2(g) N2O4(g), △H<0,试根据下列图象判断t2、t3、t4 时刻采取的措施。
t2 :
; t3 :
;t4:
。
例2:对于反应mA(g) + nB(g) pC(g)+qD(g) △H=QkJ/mol,分析 下列图像:
P一定,△H T一定,m+n T一定,m+n
0 p+q p+q
选修四《化学平衡图像分析》专题练习
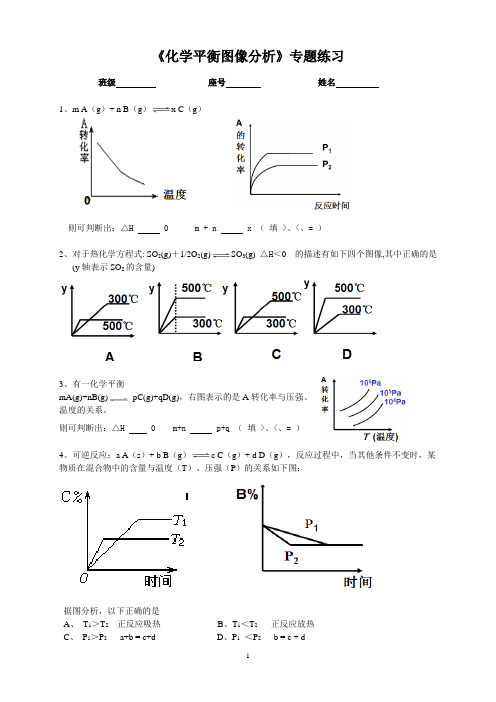
《化学平衡图像分析》专题练习班级座号姓名1、m A(g)+ n B(g)x C(g)则可判断出:△H 0 m + n x (填 >、<、= )2、对于热化学方程式: SO2(g)+1/2O2(g)SO3(g) △H<0 的描述有如下四个图像,其中正确的是(y轴表示SO2的含量)3、有一化学平衡mA(g)+nB(g)pC(g)+qD(g),右图表示的是A转化率与压强、温度的关系。
则可判断出:△H 0 m+n p+q (填 >、<、= )4、可逆反应:a A(s)+ b B(g) c C(g)+ d D(g),反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如下图:据图分析,以下正确的是A、T1>T2正反应吸热B、T1<T2正反应放热C、P1>P2a+b = c+dD、P1<P2 b = c + d5、在容积固定的密闭容器中存在如下反应:A(g) +3B(g)2C(g) △H <0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图所示,下列判断一定错误的是A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高B.图II研究的是压强对反应的影响,且甲的压强较高C.图II研究的是温度对反应的影响,且甲的温度较高D.图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高6、对于反应2A(g)+B(g)2C(g)△H<0,下列图象正确的是7、在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L 此反应符合右面图像,下列叙述是正确的是A 正反应吸热,L是气体B 正反应吸热,L是固体C 正反应放热,L是气体D 正反应放热,L是固体或液体8、对于2A(g)+B(g) 2C(g) △H <0,下列图象符合该反应的是。
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
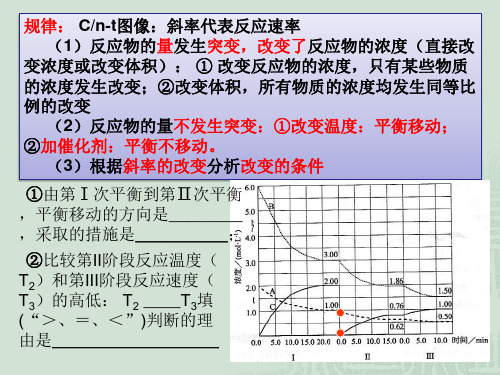
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学平衡图像专题

P·
压强
看图技巧:可逆反应的最大程度即化学平衡状态
解化学平衡图像题的技巧
(1). 看图象:
①.看面(如:纵坐标与横坐标的意义)
②.看线(如:线的走向和变化趋势、斜率)
③.看点(如:起点、拐点、交点、终点)
④.做辅助线(如:等温线、等压线、平衡线等)
(2). 想规律:
联想外界条件的改变对化学反应速率和化学平衡 的影响规律,得出图像中的隐含信息。
七、其他图像举例
[例]对于反应 xA(g)+B(s)
yC(g)+ D(s)
A的百分含量与外压强有如下图的关系, (温度不变)则: (1) P点左面曲线表示为_________ (2) X(<、=、>)_____Y,其理由是: A% (1) 达平衡前的情况 (2) <;达到平衡点P后加压, A%增加,说明平衡向左移动了 0
A、m+n<q B、n>q C、X点时的状态,V正>V逆 D、X点比Y点混和物的正 反应速率慢
2NO+O2
2NO2 ΔH=Q (Q<0)
图中的曲线是表示其他条件一 定时,反应中NO的转化率与温度 的关系曲线,图中标有a、b、c、 d四点,其中表示未达到平衡状态, 且v(正)>v(逆)的是( C ) A. a点 B. b点 C. c点 D. d点
三.百分含量(转化率或产率)—压强—温度曲线
m A(g)+nB(g)
A 转
pC(g)+qD(g) ΔH=Q
化
率
m+n > p+q ΔH <0 7Pa 1.0110
1.01106Pa 1.01105Pa
看图技巧:图象中有三 温度 个量时,“定一议二”
0
高考化学小题精练系列专题34化学平衡图像(含解析)

专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。
完整化学平衡移动图像专题

0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
