总RNA提取定量与RT-PCR 20111226
RNA抽提与RT-PCR
OD
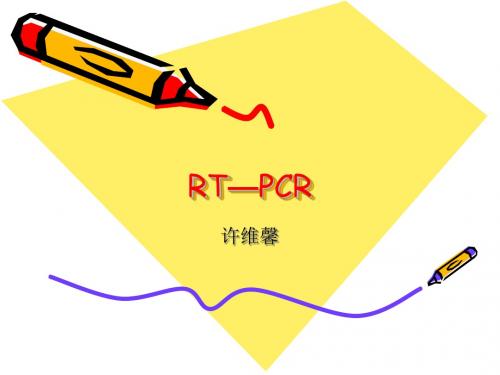
• optical density 光密度 • 定义:物质在溶液中吸收特定波长光线 强弱的参数。光密度值与光吸收物质在 溶液中的浓度成正比,是透光率对数的 倒数。
• OD260/OD280 • 纯DNA:OD260/OD280≈1.8(>1.9,表 明有RNA污染;<1.6,表明有蛋白质、 酚等污染) • 纯RNA:1.7 <OD260/OD280<2.0 (<1.7时表明有蛋白质或酚污染;> 2.0时表明可能有异硫氰酸残存)
DEPC (BIO BASIC INC.U.S.A)
DEPC即diethypyrocarbonate,中文名 为焦碳酸二乙酯。分子式为C6H10O5,分子 量为162.14。是一种强烈但不彻底的RNA酶 抑制剂。它通过和RNA酶的活性基团组氨酸 的咪唑环结合使蛋白质变性,从而抑制酶的 活性。DEPC可以抑制植物细胞上的NSCC, 即nonselective cation channel (非选择性 阳离子通道)。是常用的NSCC抑制剂.
RT— RT—PCR
许维馨
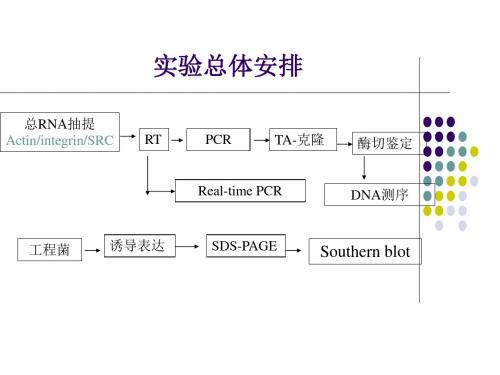
细胞总RNA 的提取 细胞总
• 1.将转染后培养48h 的细胞倒去培养液, PBS 洗3 次。 • 2.每孔加500ulTrizol,用移液器吹打混 2. 500ulTrizol 匀移入1.5mlEP 管中,每两个复孔装入 1.5mlEP 一管。 • 3.一次性研磨棒充分研磨细胞至破碎。
RT反应
反应条件为: •应 • -20℃保存样品
• U—1min内能转化1µmol底物的酶量称为 1酶单位(U) • RNase inhibitor——RNA水解酶抑制剂 inhibitor RNA • 莫洛尼鼠白血病病毒(Moloney murine leukemin virus)反转录酶(简称MMLVRTase)
植物总RNA的提取及RT-PCR

植物总RNA的提取及RT-PCR生物学实验技术植物总RNA的提取及RT-PCR一、实验目的1. 学习从植物组织中提取总RNA的方法2. 了解RT-PCR的基本原理和实验方法二、实验原理1. RNA提取的原理RNA是一类极易降解的分子,要得到完整的RNA,必须最大限度地抑制提取过程中内源性及外源性核糖核酸酶对RNA的降解。
高浓度强变性剂异硫氰酸胍可溶解蛋白质,破坏细胞结构,使核蛋白与核酸分离,失活RNA酶,所以RNA从细胞中释放出来时不被降解。
细胞裂解后,除了RNA,还有DNA、蛋白质和细胞碎片,通过酚、氯仿等有机溶剂处理得到纯化、均一的总RNA。
2. RT-PCR的原理提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)作引物利用逆转录酶反转录成cDNA。
再以cDNA 为模板进行PCR扩增,获得目的基因或检测基因表达。
RT-PCR 使RNA检测的灵敏性提高了几个数量级,使一些极为微量RNA 样品分析成为可能。
该技术主要用于分析基因的转录产物、获取目的基因和合成cDNA探针等。
三、仪器、药品与试剂配方(一) 仪器及器皿1.低温离心机;2.琼脂糖凝胶电泳系统;3.高压灭菌锅;4. PCR仪;5.研钵;6. 一次性手套等;7. 离心管;8. 培养皿;9. 烧杯及试剂瓶等。
(二) 药品1. 焦碳酸二乙酯(DEPC)2. 异硫氰酸胍(GT)3. 醋酸钠(NaAc)4. 苯酚5. 异丙醇6. 氯仿7. 乙醇8. β-巯基乙醇9. 琼脂糖10. MLV反转录试剂盒11. Taq DNA聚合酶12. 引物(三) 试剂配制1.0.1% DEPC水灭菌2. 4 mol/L异硫氰酸胍3. 2 mol/L NaAc (pH4.8)灭菌4. 3 mol/L NaAc (pH 4.8)灭菌5. 4 mol/L LiCl 灭菌6. 1×TE缓冲液:10 mM Tris-HCl(pH8.0),1 mM EDTA (pH8.0), 灭菌。
总RNA的提取与RT、Realtime-PCR

总RNA 的提取与RT、Realtime - PCR一、实验原理RNA是基因表达的中间产物,存在于细胞质与核中。
获得高纯度和完整的RNA是很多分子生物学实验所必需的,如Northern杂交、cDNA合成及体外翻译等实验的成败,在很大程度上取决于RNA的质量。
由于细胞内的大部分RNA是以核蛋白复合体的形式存在,所以在提取RNA时要利用高浓度的蛋白质变性剂,迅速破坏细胞结构,使核蛋白与RNA分离,释放出RNA。
再通过酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离,得到纯化的总RNA。
1 . RNA提取的最大影响因素-RNA酶但是由于RNA酶(RNase)广泛存在且稳定,可耐受多种处理而不被灭活,如煮沸、高压等。
RNase催化的反应一般不需要辅助因子,因而RNA制剂中只要存在少量的RNase就会引起RNA在制备与分析过程中的降解,所以RNA的制备过程中要抑制内源和外源的RNase活性,保护RNA分子不被降解。
外源性的RNase存在于操作人员的手汗、唾液等,也可存在于灰尘中。
在其它分子生物学实验中使用的RNase 也会造成污染。
这些外源性的RNase可污染器械、玻璃制品、塑料制品、电泳槽、研究人员的手及各种试齐叽而各种组织和细胞中则含有大量内源性的RNaseo2 .常用的RNA酶抑制剂*焦碳酸二乙酯(DEPQ:是一种强烈但不彻底的RNase抑制剂。
它通过和RNase的活性基团组氨酸的咪唑环结合使蛋白质变性,从而抑制酶的活性。
*异硫氰酸胍:目前被认为是最有效的RNase抑制剂,它在裂解组织的同时也使RNase失活。
它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNase有强烈的变性作用。
*氧钒核糖核苷复合物:由氧化钒离子和核苷形成的复合物,它和RNase结合形成过渡态类物质,几乎能完全抑制RNase的活性。
*RNA酶的蛋白抑制剂(RNasin):从大鼠肝或人胎盘中提取得来的酸性糖蛋白。
RNasin是RNase的一种非竞争性抑制剂,可以和多种RNase结合,使其失活。
总RNA的提取,RT-PCR实验报告

生物化学实验报告姓名:学号:专业年级:组别:第二实验室生物化学与分子生物学实验教学中心实验名称总RNA的提取与RT-PCR实验日期2019-11-22 实验地点第二实验室合作者指导老师评分XX 教师签名李某某批改日期2013-06-03 一、实验目的1. 掌握从细胞中提取总RNA的方法2. 熟悉离心机的基本操作3. 掌握RT-PCR基因扩增的原理和过程4. 熟悉电泳法鉴定所得RNA二、实验原理1. 细胞总RNA的提取及定量1)每个细胞内大概有10-5mg RNA(主要有rRNA,tRNA,mRNA三种)2)mRNA 3’端存在20-250个多聚腺苷酸(polyA)结构,可用oligo(dT)亲和层析柱分离mRNA 3)对RNA进行分离有异硫氰酸胍氯化铯超速离心法,盐酸胍-有机溶剂法,氯化锂-尿素法,蛋白酶K-细胞质RNA提取法等、异硫氰酸胍-酚-氯仿一步法等。
4)目前常用的是Trizol法,能快速地从细胞组织中分离出RNA,适用于小量样品也使用于大量样品5)在加入氯仿离心后,溶液分为水相和有机相,RNA在上层水相中。
6)取出水相用异丙醇沉淀可回收RNA ,用乙醇沉淀中间层可回收DNA;用异丙醇沉淀有机相可回收蛋白质2. 逆转录-聚合酶链反应(RT-PCR)提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)或随机引物利用逆转录酶反转录成cDNA。
再以cDNA为模板进行PCR扩增,而获得目的基因或检测基因表达三、材料与方法:以流程图示意材料总RNA的提取RT-PCR1. 微量加样枪,灭菌超薄PCR反应管, 1.基因扩增仪、微量加样枪、灭菌超2. Trizol试剂,氯仿,异丙醇,75%乙醇,无RNase的水或0.5%SDS(溶液均用DEPC 处理过的水配置)薄PCR反应管2.提取的总RNA3.第一链cDNA合成试剂盒(含有逆转录酶、RNA酶抑制剂、缓冲液)4.dNTP mix:含dATP、dCTP、dGTP、dTTP各2 mmol/L四、结果与讨论:①结果:实验数据、现象、图谱;②讨论:以结果为基础的逻辑推论,并得出结论。
总RNA的提取与RT、Realtime-PCR

总RNA的提取与RT、Realtime-PCR一、实验原理RNA是基因表达的中间产物,存在于细胞质与核中。
获得高纯度和完整的RNA是很多分子生物学实验所必需的,如Northern杂交、cDNA合成及体外翻译等实验的成败,在很大程度上取决于RNA的质量。
由于细胞内的大部分RNA是以核蛋白复合体的形式存在,所以在提取RNA时要利用高浓度的蛋白质变性剂,迅速破坏细胞结构,使核蛋白与RNA分离,释放出RNA。
再通过酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离,得到纯化的总RNA.1.RNA提取的最大影响因素—RNA酶但是由于RNA酶(RNase)广泛存在且稳定,可耐受多种处理而不被灭活,如煮沸、高压等.RNase催化的反应一般不需要辅助因子,因而RNA制剂中只要存在少量的RNase就会引起RNA在制备与分析过程中的降解,所以RNA的制备过程中要抑制内源和外源的RNase活性,保护RNA分子不被降解。
外源性的RNase存在于操作人员的手汗、唾液等,也可存在于灰尘中.在其它分子生物学实验中使用的RNase也会造成污染.这些外源性的RNase可污染器械、玻璃制品、塑料制品、电泳槽、研究人员的手及各种试剂。
而各种组织和细胞中则含有大量内源性的RNase.2.常用的RNA酶抑制剂*焦碳酸二乙酯(DEPC):是一种强烈但不彻底的RNase抑制剂。
它通过和RNase的活性基团组氨酸的咪唑环结合使蛋白质变性,从而抑制酶的活性。
*异硫氰酸胍:目前被认为是最有效的RNase抑制剂,它在裂解组织的同时也使RNase失活。
它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNase有强烈的变性作用.*氧钒核糖核苷复合物:由氧化钒离子和核苷形成的复合物,它和RNase结合形成过渡态类物质,几乎能完全抑制RNase的活性。
*RNA酶的蛋白抑制剂(RNasin):从大鼠肝或人胎盘中提取得来的酸性糖蛋白。
RNasin是RNase的一种非竞争性抑制剂,可以和多种RNase结合,使其失活.*其它:SDS、尿素、硅藻土等对RNase也有一定抑制作用。
RNA提取RTPCR
三、实验步骤:
RNase free dH2O 10µl 70℃、10min 冰上急冷、2min
Oligo(dt15) primer(50µM) 2 µl Total RNA 2 µl
5×M-MLV buffer 离心数秒
4 µl 1 µl
20 µl体系 0.5 µl
dNTP Mixture (10 mM each) RNase Inhibitor(40U/µl)
RTase M-MLV(RNase H-)(200U/µl) 0.5µl 42 ℃、60min 70 ℃、15min 冰上冷却即得到总cDNA
PCR
一、实验原理:
PCR(Polymerase Chain Reaction,聚合酶链式反 应)。聚合酶链式反应(PCR)是体外酶促合成特异 DNA片段的一种方法,由高温变性、低温退火(复 性)及适温延伸等几步反应组成一个周期,循环进 行,使目的DNA得以迅速扩增,具有特异性强、灵 敏度高、操作简便、省时等优点。 标准反应中一般采用三温度点法,双链DNA在90-95℃ 变性,再迅速冷却至40-60℃,引物退火并结合到靶 序列上,然后快速升温至70-75℃,在TaqDNA聚合酶 的作用下,使引物链沿模板延伸。
PCR反应程序
94℃ 94℃ 57.0℃ 72℃ 72℃ 4min 40s 40s 1.5mim 10min
35个循环
反应结束后,取反应液10μ l进行琼脂糖凝胶电泳, 确认μ l Eppendorf管(PCR管)中依次加入: ddH2O 15μ l 10×PCR Buffer 2.5μ l Mg2+ 2 μ l dNTP (10 mM) 1μ l primer 1 1μ l primer 2 1μ l 模板 2μ l Taq酶 0.5μ l Total 25μ l
植物总RNA的提取及RT-PCR

植物总RNA的提取及RT-PCR一、实验目的1. 学习从植物组织中提取总RNA的方法2. 了解RT-PCR的基本原理和实验方法二、实验原理1. RNA提取的原理RNA是一类极易降解的分子,要得到完整的RNA,必须最大限度地抑制提取过程中内源性及外源性核糖核酸酶对RNA的降解。
高浓度强变性剂异硫氰酸胍可溶解蛋白质,破坏细胞结构,使核蛋白与核酸分离,失活RNA酶,所以RNA从细胞中释放出来时不被降解。
细胞裂解后,除了RNA,还有DNA、蛋白质和细胞碎片,通过酚、氯仿等有机溶剂处理得到纯化、均一的总RNA。
2. RT-PCR的原理提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)作引物利用逆转录酶反转录成cDNA。
再以cDNA为模板进行PCR扩增,获得目的基因或检测基因表达。
RT-PCR使RNA检测的灵敏性提高了几个数量级,使一些极为微量RNA 样品分析成为可能。
该技术主要用于分析基因的转录产物、获取目的基因和合成cDNA 探针等。
三、仪器、药品与试剂配方(一) 仪器及器皿1.低温离心机;2.琼脂糖凝胶电泳系统;3.高压灭菌锅;4. PCR仪;5.研钵; 6. 一次性手套等;7. 离心管;8. 培养皿;9. 烧杯及试剂瓶等。
(二) 药品1. 焦碳酸二乙酯(DEPC)2. 异硫氰酸胍(GT)3. 醋酸钠(NaAc)4. 苯酚5. 异丙醇6. 氯仿7. 乙醇8. β-巯基乙醇9. 琼脂糖10. MLV反转录试剂盒11. Taq DNA聚合酶12. 引物(三) 试剂配制1. 0.1% DEPC水灭菌2. 4 mol/L异硫氰酸胍3. 2 mol/L NaAc (pH4.8)灭菌4. 3 mol/L NaAc (pH 4.8)灭菌5. 4 mol/L LiCl 灭菌6. 1×TE缓冲液:10 mM Tris-HCl(pH8.0),1 mM EDTA(pH8.0), 灭菌。
四、实验步骤(一)总RNA的提取(1)研钵冷却后,倒入2/3液氮,加入0.2 g植物材料,充分研磨后转入一个含有300 μl的4M GT的1.5 ml的聚丙烯管中,摇匀。
实验三 RNA的提取检测与定量PCR

实验三RNA的提取、检测与定量PCR实验1 总RNA提取(Trizol试剂法)完整RNA的提取和纯化,是进行RNA方面的研究工作,如Nothern杂交、mRNA分离、RT-PCR、定量PCR、cDNA合成及体外翻译等的前提。
RNA 的制备与分析对于了解基因在转录水平上的表达与调节和cDNA 的合成都是必须的,RNA的纯度和完整性对于Northern blot,RT-PCR 和cDNA 文库的构建等分子生物学实验都至关重要。
所有RNA的提取过程中都有五个关键点,即1):样品细胞或组织的有效破碎;2):有效地使核蛋白复合体变性;3):对内源RNA酶的有效抑制;4):有效地将RNA从DNA和蛋白混合物中分离;5):对于多糖含量高的样品还牵涉到多糖杂质的有效除去。
但其中最关键的是抑制RNA酶活性。
RNA的提取目前主要采用两种途径,1):提取总核酸,再用氯化锂将RNA 沉淀出来;2):直接在酸性条件下抽提,酸性下DNA与蛋白质进入有机相而RNA 留在水相。
第一种提取方法将导致小分子量RNA的丢失,目前该方法的使用频率已很低。
RNA分离的方法很多,最关键的因素是尽量减少RNA 酶的污染。
实验目的:学习RNA 的简易制备过程,通过RNA电泳带评价RNA 质量实验材料:水稻幼嫩叶片实验原理:Trizol是由酚与异硫氰酸胍组成的均相溶液。
异硫氰酸胍是目前认为最有效的RNA酶抑制剂,它在裂解组织的同时也使RNA酶失活。
它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNA酶有强烈的变性作用。
不仅可直接用于从人类、动物、植物、细菌等细胞或组织中提取总RNA,而且还可以从样品中提取DNA或蛋白质。
纯化的总RNA完整性好,不受蛋白质、DNA的污染。
可用于Northern杂交、RNA点杂交、poly(A)+ mRNA的分离、体外转录、RT-PCR、RNase封阻分析以及分子克隆。
焦磷酸二乙酯(DEPC)是一种强烈但不彻底的RNA酶抑制剂。
组织中RNA的制备与定量分析

2. 3.
4.
(二)引物的选择
1. 随机六聚体引物:用此种方法时,体系中所有RNA分子全部充当 了cDNA第一链模板,通常用此引物合成的cDNA中96%来源于 rRNA。
2. Oligo(dT):是一种对mRNA特异的方法。因绝大多数真核细胞 mRNA具有3’端Poly(A+)尾,此引物与其配对,仅mRNA可被转 录。由于Poly(A+)RNA仅占总RNA的1-4%,故此种引物合成的 cDNA比随机六聚体作为引物和得到的cDNA在数量和复杂性方面 均要小。
10ml 1ml
1ml 6ml
总体积
20ml
如配好的反应液较多沾到管壁上,可将PCR反应管置台式离心机中瞬时离心,使 反应液集中于管底,然后将反应管放到基因扩增仪(PCR仪)上 .
(注意:匀浆一定要彻底,是提取高质量RNA的前提;细胞数量与 Trizol的比例,细胞的数量不能过多。)
实验材料:HEK293人胚肾细胞
操作步骤
1. 细胞中加入1 ml Trizol(RNAisoPlus)用移液枪反复吹吸直无明显沉 淀后,室温放置5min,使其充分裂解。 (注意:此时可放入-70℃长期保持。 ) 2. 按200 ul 氯仿/ml Trizol加入氯仿,振荡混匀后室温放置2-3 min。
E.电泳时使用的甲醛pH值低于了3.5 。 DNA污染 A.样品匀浆时加的试剂量太少 B.样品中含有有机溶剂(如乙醇,DMSO等),强缓冲液或碱性溶液
第二部分 逆转录-聚合酶链反应
(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)
原 理
4.
操作步骤
5. 6. 7. 8. 9. 10. 加入等体积异丙醇后,上下颠倒混匀,4℃放置5-10 min。 4℃ 12,000g离心10 min,弃上清,离心后在管侧和管底出现胶状沉 淀。 加入1 ml 75%乙醇,(切勿触及沉淀!)温和振荡离心管,悬浮沉淀。 4℃ 12,000g离心5 min,尽量弃上清。 室温晾干或真空干燥5 min。(注:RNA样品不要过于干燥,否则很 难溶解。) 加入10 ul无RNase的水,充分震荡混匀。
(完整)总RNA的提取定量与RT-PCR

生物化学实验报告姓名:学号:专业年级: 级临床八年制组别:第二实验室生物化学与分子生物学实验教学中心【预习报告】一、实验原理1)总RNA的提取与定量在哺乳动物中,平均每个细胞内大约含有10-5μg RNA,其中rRNA占总量的80%—85%,tRNA和核内小分子RNA占10—15%,而mRNA只占1—5%。
rRNA由28S、18S、5S等几类组成,这些RNA分子根据密度和分子大小,通过密度梯度离心、凝胶电泳、离子交换层析进行分离。
mRNA分子种类繁多,分子量大小不均一,在细胞中含量少,绝大多数mRNA分子(除血红蛋白、有些组蛋白mRNA以外),在3’端存在20—250个多聚腺苷酸(polyA)。
利用此特点,用oligo(dT)亲和层析柱分离mRNA。
RNA分离的方法有:异硫氰酸胍氯化铯超速离心法,盐酸胍—有机溶剂法,氯化锂-尿素法,蛋白酶K-细胞质RNA提取法等、异硫氰酸胍-酚-氯仿一步法等。
目前常用的是Trizol法.Trizol试剂适用于从细胞和组织中快速分离RNA.TRIzol的主要成分是异硫氰酸胍和酚。
异硫氰酸胍属于解偶剂,是一类强力的蛋白质变性剂,可溶解蛋白质主要作用是裂解细胞,使细胞中的蛋白,核酸物质解聚得到释放。
酚虽可有效的变性蛋白质,但是它不能完全抑制RNA酶活性,因此Trizol中还加入了8-羟基喹啉、β-巯基乙醇等来抑制内源和外源RNase。
在加入氯仿离心后,溶液分为水相和有机相,RNA选择性地进入无DNA和蛋白质的水相中。
取出水相用异丙醇沉淀可回收RNA;用乙醇沉淀中间层可回收DNA;用异丙醇沉淀有机相可回收蛋白质。
Trizol试剂可用于小量样品(50~100mg组织、5×106细胞)也适用于大量样品(≥1g组织、〉107细胞)。
对人,动物,植物组织,细菌均适用,整个提取过程在一小时内即可完成。
分离的总RNA无蛋白质和DNA污染,可用于Northern blot,dot blot,ployA筛选,体外翻译,RNase 保护分析和分子克隆。
总RNA的提取和RT-PCR

Taq DNA聚合酶:用于PCR 扩增。
04
05
引物:用于特异性地扩增目 标基因片段。
实验步骤
总RNA提取
逆转录
使用总RNA提取试剂从细胞或组织中提取 总RNA。
将提取的RNA与逆转录酶、dNTPs混合, 合成cDNA。
PCR扩增电泳ຫໍສະໝຸດ 析将合成的cDNA与Taq DNA聚合酶、引物 混合,进行PCR扩增。
避免使用锐器,如刀 片、针头等,以防意 外伤害。
使用一次性手套和实 验服,避免交叉污染。
实验操作注意事项
使用高质量的试剂和耗材,确保 实验结果的准确性。
在实验过程中,要保持低温环境, 以防RNA降解。
严格按照试剂盒说明书进行操作, 避免操作失误导致实验失败。
实验质量控制注意事项
1
在实验前进行质量控制,确保实验设备和环境的 清洁度。
洗涤RNA
加入等体积的异丙醇,混合均 匀后离心,弃去上清液,用 75%乙醇洗涤RNA沉淀。
干燥RNA
将RNA沉淀晾干,溶解于DEPC 处理的水中。
02
RT-PCR
实验原理
逆转录
逆转录是指以RNA为模板,通过逆转录酶的作用合成cDNA的过程。在RT-PCR中, 逆转录酶将RNA转化为cDNA,以便进行后续的PCR扩增。
在疾病诊断和治疗中的应用
病原微生物检测
肿瘤诊断和预后评估
RT-PCR技术可用于检测和鉴定病原 微生物,如病毒、细菌和寄生虫等, 为疾病的诊断提供快速和准确的方法。
通过检测肿瘤组织中特定基因的表达 水平,可以辅助肿瘤的诊断和预后评 估,为制定治疗方案提供依据。
耐药性基因检测
通过RT-PCR技术可以检测病原微生 物中的耐药性基因,了解其耐药机制, 为临床治疗提供指导。
实验流程:细胞RNA提取和定量PCR

一、Total RNA的提取1)吸弃Dish中培养液,每个Dish中加入1 ml Trizol试剂,轻轻吹打,室温放臵5 min,充分裂解细胞;2)将样本转移至1.5 ml Eppendrof管中;3)每个1.5 ml Eppendrof管中加入200 ul氯仿,剧烈振荡混匀30秒。
放臵3 min使自然分相;4)12000 rpm,4℃离心15 min;5)将上清液(400-500 ul)小心的转移到无RNase的1.5 ml Eppendrof管中,加入500 ul(等体积)异丙醇,颠倒混匀,室温放臵15 min;6)12000 rpm,4℃离心10 min;7)小心弃去上清,留下白色沉淀;8)每个离心管中加入1 ml 75%乙醇(0.1% DEPC水配制),剧烈振荡使沉淀溶解。
12000 rpm,4℃离心5 min;9)弃去75%乙醇,重复步骤8。
尽可能彻底弃去上清,在吸水纸上扣干。
此步骤中沉淀容易漂起,注意避免倒弃沉淀。
10)管口打开,通风柜或37烘箱内晾干;11)沉淀用40 ul 0.1% DEPC水溶解(根据沉淀量调整加入水的量);12)取1~2 ul在Nanodrop分光光度计上测定RNA浓度。
注意吸取前尽量混匀,保证RNA溶液均一。
二、逆转录根据逆转录所需RNA量,将各RNA样品用溶剂(DEPC水)调至相同浓度,然后取相同体积进行逆转录反应,以尽量避免加样误差。
逆转录方法参照逆转录试剂盒说明书,不同试剂盒方法不一样。
以下为Taka ra逆转录试剂盒说明书:反应体系中包含逆转录酶、oligo dT引物、6聚体随机引物和5×缓冲液以及水和RNA模板。
三、荧光定量PCR定量PCR分SYBR和Taqman两种方法,一般使用SYBR即嵌合荧光检测法。
嵌合荧光检测法原理:SYBR Green I与双链DNA结合后发出荧光,实验时可以实时监测反应体系中的SYBR Green I荧光强度,达到检测PCR产物扩增量的目的。
总RNA提取定量与RT-PCR

E.RNA沉淀未完全溶解。
常见问题分析
RNA降解 A.组织取出后没有马上处理或冷冻。
B.待提取RNA的样品没有保存于-60至-70℃,而保存在了-5至-20℃。 C.细胞在用胰酶处理时过度。 D.溶液或离心管未经RNase去除处理。 E.电泳时使用的甲醛pH值低于了3.5 。 DNA污染
振荡离心管,悬浮沉淀。 8. 4℃ 12,000g离心5min,尽量弃上清。
9. 室温晾干或真空干燥RNA沉淀5-10min。(注:RNA样品不要过于干燥,否则很难 溶解。)
10. 加入10μl无RNase的水,充分震荡混匀。
操作步骤
收集适量细胞,
加500μl Trizol
用移液枪反复吹吸,直至裂解 室温静置5min
2. 有效地使核蛋白复合体变性; 3. 对内源RNA酶的有效抑制; 4. 有效地将RNA从DNA和蛋白混合物中分离; 5. 对于多糖含量高的样品还牵涉到多糖杂质的有效除去。
原理
rRNA 80-85%:28S 18S 5S
10-5μg RNA/细胞
tRNA, snRNA 10-15%
mRNA 1-5%
RNA分离的方法:异硫氰酸胍氯化铯超速离心法;盐酸胍-有机溶剂法;氯 化锂-尿素法;蛋白酶K-细胞质RNA提取法;
异硫氰酸胍-酚-氯仿一步法(Trizol法)等。
目前常用的是Trizol法。
原理
Trizol 是一种新型总 RNA 抽提试剂
其主要成分是异硫氰酸胍和酚。异硫氰酸胍属于解偶剂,是一类强力的蛋白
能的原因是污染了RNase。
常见问题分析
RNA得率低:
A.样品裂解或匀浆处理不彻底。 B.RNA沉淀未完全溶解。 A260/A280<1.65 : A.RNA应使用TE Buffer稀释后再进行吸光度值的测定。 低离子浓度和低pH值条件下A280值偏高。 B.样品匀浆时加的试剂量太少。 C.匀浆样品时未在室温放置5分钟。
RNA提取及RT-PCR

(2)随机引物引导的cDNA合成法 (randomly primed
cDNA synthesis) : 根据许多可能的序列,合成出6-10个核苷酸长的寡 核苷酸短片段(混合物),作为合成第一链cDNA 的引物。 在应用这种混合引物的情况下,cDNA的合 成可以从mRNA模板的许多位点同时发生,而不 仅仅从3’-末端的oligo(dT)引物一处开始。
RNA检测 (1)测定样品在260 nm和280 nm的吸光值 按1OD=40 μ g/ ml RNA计算RNA的产量。 OD260/OD280在1.8-2.0 。 (2)进行琼脂糖凝胶电泳,确定RNA提取的情 况。
RNA降解 1、组织取出后没有马上处理或冷冻
2、样品或提取的RNA保存与-5—-20℃, 没有在
准备工作
RNA酶(Rnase)是导致RNA降解最主要的物质。 此酶非常稳定,在一些极端的条件下只可暂时失活, 但限制因素去除后又迅速恢复活性。常规高温高压灭 菌方法和蛋白抑制剂不能使所有的Rnase完全失活。 1. 它广泛存在于人的皮肤上,因此制备RNA时必须 戴手套。 2. RNase 的又一污染源是取液器。根据取液器制造 商 的要求对取液器进行处理。一般情况下采用以 DEPC配制的70%乙醇擦洗取液器的内部和外部,可基 本达到要求。 3. 塑料制品、玻璃和金属物品的处理 (1) 塑料制品:尽量使用一次性无菌塑料制品。已标 明RNase-free的塑料制品,如没有开封使用过,通常不 必再处理。
(1) oligo(dT)引导的DNA合成法:利用真核 mRNA分子所具有的poly(A)尾巴的特性,加入 12-20个脱氧胸腺嘧啶核苷组成的oligo(dT)短片段, 由反转录酶合成cDNA的第一链。 缺陷:因为逆转录酶无法到达mRNA分子的5’ -末端,必须从3’-末端开始合成cDNA。对 于大分子量的较长的mRNA分子而言,特别麻 烦。
实验专题模块五RNA的提取及定量PCR检测技术

RNA的提取及定量PCR检测技术
总RNA的提取 反转录
实时荧光定量PCR
RNA是基因表达的中间产物,存在于细胞质与核中。对 RNA进行操作在分子生物学中占有重要地位。
获得高纯度和完整的RNA是很多分子生物学实验所必需 的,如cDNA合成、定量PCR、Northern杂交及体外翻译等 实验的成败,在很大程度上取决于RNA的质量。
2. 反应条件
第一步,37℃,15 min(反转录反应) 第二步,85℃,5 sec(反转录酶的失活反应) 第三步,4℃
注:1. 将得到的 RT 反应液加入到下一步的Real Time PCR反应体系中,其加 入量不要超过PCR 反应体积的 1/10(V/V)量。2. 合成的cDNA需要长期保存 时,请于-20℃或更低温度保存。
荧光定量检测系统由实时荧光定量PCR仪,实时荧光定 量试剂,通用电脑,自动分析软件等构成。设备由荧光定量 系统和计算机组成(见图3-2),用来监测循环过程的荧光。 与实时设备相连的计算机收集荧光数据。数据通过实时分析 软件以图表的形式显示。原始数据被绘制成荧光强度相对于 循环数的图表。实时设备的软件能使收集到的数据进行正常 化处理来弥补背景荧光的差异。正常化后可以设定域值水平, 这就是分析荧光数据的水平。样品到达域值水平所经历的循 环数称为Ct值(限制点的循环数)。域值应设定在使指数期 的扩增效率为最大,这样可以获得最准确,可重复性的数据 (见图3-3)。如果同时扩增的还有标有相应浓度的标准品, 线性回归分析将产生一条标准曲线,可以用来计算未知样品 的浓度。
之前勿需洗涤细胞。TRIzol的用量应根据培养板面积而定,不取决于细胞 数。TRIzol加量不足可能导致提取的RNA有基因组DNA污染。)
2. 每使用1ml TRIzol加入0.2ml氯仿,剧烈振荡15秒,室温放 置3分钟。 3. 4℃下,11000×g离心15分钟。样品分为三层:底层为黄色 有机相,上层为无色水相和一个中间层。RNA主要在水相中, 水相体积约为所用TRIzol试剂的60℅。 4. 把水相转移到新管中,加入0.5ml异丙醇(1ml TRIzol的用 量),充分混匀后,室温放置10分钟,以沉淀水相中的RNA。 5. 4℃下,11000×g离心10分钟,离心前看不出RNA沉淀,离 心后在管侧和管底出现胶状沉淀。弃去上清。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目前常用的是Trizol法。
/sfzx/
原理
Trizol 是一种新型总 RNA 抽提试剂 其主要成分是异硫氰酸胍和酚。异硫氰酸胍属于解偶剂,是一
类强力的蛋白质变性剂,可溶解蛋白质,其主要作用是裂解细 胞,使细胞中的蛋白/核酸物质解聚得到释放。 酚虽可有效的变性蛋白质,但是它不能完全抑制RNA酶活性, 因此Trizol中还加入了8-羟基喹啉、β-巯基乙醇等来抑制内 源和外源RNase。
掌握从细胞中提取总RNA的方法 熟悉紫外吸收法检测RNA浓度与纯度的原理及测定方法 掌握RT-PCR基因扩增的原理和过程
/sfzx/
实验流程
提取 总RNA
定量
合成cDNA 第一链
PCR
电泳
提取原理 操作步骤
计算方法 操作步骤
逆转录原理 操作步骤
原理体系 引物选择
/sfzx/
(一)反转录酶的选择
1. 鼠白血病病毒(MMLV)反转录酶:有强的聚合酶活性,RNA酶H活性相对较弱。 最适作用温度为37℃。在长时间的逆转录过程中,不会造成模板的降解,获 得cDNA的几率大,适用于较长的cDNA链的合成。
2. 禽成髓细胞瘤病毒(AMV)反转录酶:有强的聚合酶活性和RNA酶H活性。最 适作用温度为42℃。
/sfzx/
原理
10-5μg RNA/细胞
rRNA 80-85%:28S 18S 5S tRNA, snRNA 10-15% mRNA 1-5%
RNA分离的方法:异硫氰酸胍氯化铯超速离心法;盐酸胍-有机溶 剂法;氯化锂-尿素法;蛋白酶K-细胞质RNA提取法;异硫氰酸胍酚-氯仿一步法(Trizol法)等。
常见问题分析
RNA得率低: A.样品裂解或匀浆处理不彻底。 B.RNA沉淀未完全溶解。
A260/A280<1.65 : A.RNA应使用TE Buffer稀释后再进行吸光度值的测定。 低离子浓度和低pH值条件下A280值偏高。 B.样品匀浆时加的试剂量太少。 C.匀浆样品时未在室温放置5分钟。 D.吸取水相时混入了有机相。 E.RNA沉淀未完全溶解。
RNA纯品:OD260 /OD280 ≈2.0(1.8~2.0),OD260 /OD230 >2.0 若OD260/OD280小于1.8,说明样品中还可能含有蛋白质或酚,应
再用酚/氯仿抽提,以乙醇沉淀纯化RNA。 若OD260/OD280大于2.0,则提示可能有异硫氰酸残存或RNA降解。 OD260/OD230比值小于2.0时表明有小分子及盐存在。
加入500μl 75%乙醇 洗涤离心管壁(8)
4℃, 12000g 离心5min 室温干燥沉淀2-5min
小心尽量弃去乙醇
(9)
加入10μl RNase-free水 溶解沉淀备用
/sfzx/
紫外光吸收法
原 理:
1. 物质在光的照射下会产生对光的吸收效应 2. 而且物质对光的吸收是具有选择性的 3. 各种不同的物质都具有其各自的吸收光谱
RNA (mg/ml) = 40×OD260 读数×稀释倍数(n)/1000
dsDNA(双链DNA) ssDNA(单链DNA) RNA
1OD260 = 50ug/ml 1OD260 = 33ug/ml 1OD260 = 40ug/ml
/sfzx/
紫外吸收检测RNA的纯度
室温静置5min (3)
4℃, 12000g 离心15min (4)
吸取上清液200~250 μl
向上清中加入等体积 上下颠倒离心管充分混匀
至(切另忌一吸新出离白心色管中中间层)(5) 异丙醇混匀
室温静置10min (6)
4℃, 12000g 离心10min
小心弃去上清
(7)
缓慢沿离心管壁
轻轻上下颠倒
DNA污染 A.样品匀浆时加的试剂量太少 B.样品中含有有机溶剂(如乙醇,DMSO等),强缓冲液或碱性溶液
/sfzx/
第二部分 逆转录-聚合酶链反应
Reverse Transcription-Polymerase Chain Reaction
/sfzx/
1. 所有的玻璃器皿均应在使用前于180℃的高温下干烤6h或更长时间。 2. 塑料器皿可用0.1%DEPC水浸泡12h以上,高压灭菌。 3. 有机玻璃的电泳槽等,可先用去污剂洗涤,双蒸水冲洗,乙醇干燥,
再浸泡在3% H2O2室温10min,然后用0.1%DEPC水冲洗,晾干。 4. 配制的溶液应尽可能用0.1% DEPC在37℃处理12h以上。然后用高压灭
/sfzx/
操作步骤
1. 细胞或组织加Trizol(RNAisoPlus)后剧烈振荡15s,室温放置5min,使其充分 裂解。 (注意:此时可放入-70℃长期保持)
2. 按0.2ml 氯仿/1ml Trizol加入氯仿(本实验加100μl),剧烈振荡混匀后室温放 置5min。 (注意:此步振荡非常重要,建议在旋涡振荡器上进行。)
因此不同波长的单色光通过溶液时其光的能量就会 被不同程度的吸收,光能量被吸收的程度和物质的浓度 有一定的比例关系.
/sfzx/
紫外吸收检测RNA的浓度
RNA在260nm波长处有最大的吸收峰。因此,可以用260nm波长分光测定 RNA浓度,OD值为1相当于大约 40μg/ml 的单链RNA。用双蒸水稀释 RNA样品(1μlRNA+49μl水)倍并以双蒸水为空白对照,根据此时读 出的OD260 值即可计算出样品稀释前的浓度:
电泳原理 电泳步骤
/sfzx/
第一部分 细胞总RNA的提取及定量
Extraction and Quantitation of Cell Total RNA
/sfzx/
关键点
所有RNA的提取过程中都有五个关键点:
1. 样品细胞或组织的有效破碎; 2. 有效地使核蛋白复合体变性; 3. 对内源RNA酶的有效抑制; 4. 有效地将RNA从DNA和蛋白混合物中分离; 5. 对于多糖含量高的样品还牵涉到多糖杂质的有效除去。
/sfzx/
原理
在加入氯仿离心后,氯仿比重大,使溶液分为水相、中间层和 有机相。RNA在上层水相中,DNA和蛋白质位于中间层,有颜色 的下层为有机相。
取出水相用异丙醇沉淀可回收RNA;用乙醇沉淀中间层可回收 DNA。
/sfzx/
3. 4℃ 12,000g离心15min。样品分为三层:底层为黄色(红或绿)有机相,上层 为无色水相和一个中间层。RNA主要在水相中,水相体积约为所用Trizol试剂的 60%。
4. 吸取上层水相,至另一离心管中。一般400-450μl 就足够了,宁少勿多! (注:千万不要吸取中间界面)
/sfzx/
原理
提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo (dT)或随机引物利用逆转录酶反转录成cDNA。再以cDNA为模板进 行PCR扩增,而获得目的基因或检测基因表达。
RT-PCR使RNA检测的灵敏性提高了几个数量级,使一些极为微量RNA 样品分析成为可能。
该技术主要构建RNA高效转录系统。
南方医科大学 生物化学与分子生物学实验教学示范中心
Expertimental Teaching Center of Biochemistry and Molecular Biology
总RNA的提取、定量与RT-PCR
/sfzx/
目的
完整RNA的提取和纯化,是进行RNA 方面的研究工作如 Nothern杂交、mRNA分离、RT-PCR、定量PCR、cDNA合成 及体外翻译等的前提。
RNA酶污染来源
RNA酶可耐受多种处理而不被灭活,如煮沸、高压灭菌等。 严格控制外源性RNA酶的污染:外源性的RNA酶存在于操作人员
的手汗、唾液等,也可存在于灰尘中,造成器械、玻璃制品、 塑料制品、电泳槽、研究人员的手及各种试剂的污染。 最大限度地抑制内源性的RNA酶:而各种组织和细胞中则含有 大量内源性的RNA酶。
菌除去残留的DEPC。不能高压灭菌的试剂,应当用DEPC处理过的无菌 双蒸水配制,然后经滤膜过滤除菌。 5. 操作人员戴一次性口罩、帽子、手套,实验过程中手套要勤换。 6. 设置RNA操作专用实验室,所有器械等应为专用。
/sfzx/
/sfzx/
/sfzx/
常见问题分析
RNA降解 A.组织取出后没有马上处理或冷冻。 B.待提取RNA的样品没有保存于-60至-70℃,而保存在了-5至-20℃。 C.细胞在用胰酶处理时过度。 D.溶液或离心管未经RNase去除处理。 E.电泳时使用的甲醛pH值低于了3.5 。
3. RNA酶的蛋白抑制剂(RNasin) 从大鼠肝或人胎盘中提取得来的酸性 糖蛋白。RNasin是RNA酶的一种非竞争性抑制剂,可以和多种RNA酶结 合,使其失活。
4. 其他 SDS、尿素、硅藻土等对RNA酶也有一定抑制作用。
/sfzx/
防止RNA酶污染的措施
操作步骤
样品处理 提取组织RNA时,每50~100mg组织用1ml Trizol试剂对组织进行裂
解; 悬浮细胞先离心沉淀,每5-10 ×106个细胞加1ml Trizol后,反复
用枪吹打或剧烈振荡以裂解细胞。 培养贴壁细胞不须消化,可直接用Trizol进行消化、裂解,Trizol
体积按10cm2/ml比例加入。 (注意:匀浆一定要彻底,是提取高质量RNA的前提;细胞数量与 Trizol的比例,细胞的数量不能过多。) 实验材料:人胚胎肾细胞293
操作步骤
5. 加入等体积异丙醇混匀,4℃放置5-10min。 6. 4℃ 12,000g离心10min,弃上清,离心后在管侧和管底出现胶状沉
淀。 7. 按1ml 75%乙醇/ml Trizol加入75%乙醇洗涤RNA沉淀,(切勿触及沉
淀!)温和振荡离心管,悬浮沉淀。 8. 4℃ 12,000g离心5min,尽量弃上清。 9. 室温晾干或真空干燥RNA沉淀5-10min。(注:RNA样品不要过于干燥,
