乙醇-环己烷气液平衡相图的绘制实验报告
环己烷乙醇恒压气液平衡相图绘制

环己烷—乙醇恒压气液平衡相图绘制一 实验目的1. 测定常压下环己烷—乙醇二元系统的气液平衡数据,绘制101.325 kPa 下的沸点-组成的相图。
2. 掌握阿贝折射仪的原理和使用方法。
3.掌握水银温度计与大气压力计的校正与使用方法。
二 实验原理液体混合物中各组分在同一温度下具有不同的挥发能力。
因而,经过气液间相变达到平衡后,各组分在气、液两相中的浓度是不相同的。
根据这个特点,使二元混合物在精馏塔中进行反复蒸馏,就可分离得到各相应的纯组分。
为了得到预期的分离效果,设计精馏装置必须掌握准确的气液平衡数据,也就是平衡时的气、液两相的组成与温度、压力间的依赖关系。
大量工业上重要的系统的平衡数据,很难由理论计算,必须由实验直接测定,即在恒压(或恒温)下测定平衡的蒸气与液体的各组成。
其中,恒压数据应用更广,测定方法也较简便。
恒压测定方法有多种,以循环法最普遍。
循环法原理的示意图见图2-20。
在沸腾器P 中盛有一定组成的二元溶液,在恒压下加热。
液体沸腾后,逸出的蒸气经完全冷凝后流入收集器R 。
达一定数量后溢流,经回流管流回到P 。
由于气相中的组成与液相中不同,所以随着沸腾过程的进行,P 、R两容器中的组成不断改变,直至达到平衡时,气、液两相的组成不再随时间而变化,P 、R 两容器中的组成也保持恒定。
分别从R 、P 中取样进行分析,即得出平衡温度下气相和液相的组成。
图2-20 循环法原理示意图本实验测定的环己烷——乙醇二元气液恒压相图,如图2-21所示。
图中横坐标表示二元系的组成(以B 的摩尔分数表示),纵坐标为温度。
显然曲线的两个端点t 、t 即指在恒压下纯A 与纯B 的沸点。
若溶液原始的组成为x ∗A ∗B 0,当它沸腾达到气液平衡的温度为t 1时,其平衡气液相组成分别为y 1与x 1。
用不同组成的溶液进行测定,可得一系列t-x-y 数据,据此画出一张由液相线与气相线组成的完整相图。
图2-21的特点是当系统组成为x e 时,沸腾温度为t e ,平衡的气相组成与液相组成相同。
完全互溶双液系气液平衡相图的绘制。实验报告

完全互溶双液系气液平衡相图的绘制一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一在工作曲线上找出未知溶液的组成。
三.仪器与试剂沸点仪,阿贝折射仪,调压变压器,超级恒温水浴,温度测定仪,长短取样管。
环己烷物质的量分数x环己烷为0、0.2、0.4、0.6、0.8、1.0的环己烷-乙醇标准溶液,已知101.325kPa下,纯环己烷的沸点为80.1℃,乙醇的沸点为78.4℃。
25℃时,纯环己烷的折光率为1.4264,乙醇的折光率为1.3593。
四.实验步骤:1.环己烷-乙醇溶液折光率与组成工作曲线的测定调节恒温槽温度并使其稳定,阿贝折射仪上的温度稳定在某一定值,测量环己烷-乙醇标准溶液的折光率。
为了适应季节的变化,可选择若干温度测量,一般可选25℃、30℃、35℃三个温度。
2. 无水乙醇沸点的测定将干燥的沸点仪安装好。
从侧管加入约20mL无水乙醇于蒸馏瓶内,并使传感器(温度计)浸入液体内。
冷凝管接通冷凝水。
按恒流源操作使用说明,将稳流电源调至1.8-2.0A,使加热丝将液体加热至缓慢沸腾。
液体沸腾后,待测温温度计的读数稳定后应再维持3~5min以使体系达到平衡。
在这过程中,不时将小球中凝聚的液体倾入烧瓶。
记下温度计的读数,即为无水乙醇的沸点,同时记录大气压力。
3. 环己烷沸点的测定同2步操作,测定环己烷的沸点。
《物理化学实验报告》双液系的气液平衡相图

双液系的气液平衡相图2011年9月5日实验,2011年9月12日提交报告助教:柳清1 引言相图(phase diagram)是用图形表示多相系统的物理化学状态随温度、压力、组分含量等的变化的图1。
对于多相平衡系统,相律(phase rule)是其热力学基础。
本实验研究的是环己烷-乙醇(C6H12-C2H5OH)双液系的气液平衡状态。
根据相律,f+Φ = C+2其中相数Φ为2,独立自由组分数C为1,则系统自由度数f为1。
如果固定外压p不变,条件自由度数f′为0。
因此,在外压p不变时,温度T和组分含量x唯一确定了双液系气液平衡系统的状态。
用气液平衡时的温度T和组分含量x分别作为纵横坐标,同时测定气相和液相的组成,可以绘制双液系的气液平衡T-x相图。
不同组成的双液系具有不同形式的气液平衡T-x相图。
理想液体混合物或者接近理想液体混合物的双液系,混合物的沸点介于两纯物质沸点之间,如图1(a)。
各组分蒸气压对拉乌尔定律产生很大的正偏差时,混合溶液体系会具有最低恒沸点,如图1(b)。
反之,混合溶液体系会具有最高恒沸点,如图1(c)。
(a) (b) (c)图1 不同双液系的气液平衡T-x相图形式本实验选用具有最低恒沸点的环己烷-乙醇(C6H12-C2H5OH)双液系。
用沸点仪可以测定不同组成的双液系的恒压沸点T。
沸点仪是测定常量溶液沸点的工具。
沸腾时的溶液从喷嘴喷出,温度计测定的恰是该处蒸气和液相平衡的温度。
气相部分经过冷凝器冷凝后储存在小泡中,以备取样。
考虑到温度计的精度,需要对1/10℃温度计进行露茎校正。
由于温度计暴露于体系之外的部分所处温度与实测区域不同,二者膨胀系数略有差别。
为了补偿这部分损失,通过辅助温度计读出环境温度后,按下式校正:t = t0+1.57×10-4×n×(t0-t s)式中t0为温度计读数,n为温度计露茎在体系外的刻度数目,t s为辅助温度计读数。
t 为校正后的温度。
乙醇-环己烷气液平衡相图的绘制实验报告

环己烷-乙醇双液系气液平衡相图的绘制姓名: 学号: 班级: 同组: 成绩一、实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二、实验原理恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图2.7(c))所示。
图1 二组分真实液态混合物气—液平衡相图(T-x 图)本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2.8)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T -x 相图。
本实验中两相的成分分析均采用折光率法测定。
t At AtAt Bt B t Bt / o Ct / o t / o x Bx Bx BABAABB(a)(b)(c)x 'x '折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同。
因此可先配制一系列已知组成的溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的组成。
三、仪器与试剂沸点仪,阿贝折射仪,调压变压器,超级恒温水浴,温度测定仪,长短取样管。
环己烷物质的量分数x环己烷为0、0.2、0.4、0.6、0.8、1.0的环己烷-乙醇标准溶液,已知101.325kPa下,纯环己烷的沸点为80.7℃,乙醇的沸点为78.4℃。
25℃时,纯环己烷的折光率为1.4264,乙醇的折光率为1.3593。
实验二 双液系的气—液平衡相图
实验二双液系的气—液平衡相图1. 目的要求(1) 绘制在p0下环己烷-乙醇双液系的气-液平衡相图,了解相图和相律的基本概念。
(2) 掌握测定双组分液体沸点的方法。
(3) 掌握用折光率确定二元液体组成的方法。
2. 基本原理任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系;若只能在一定比例范围内溶解,称为部分互溶双液系。
环己烷-乙醇二元体系就是完全互溶双液系。
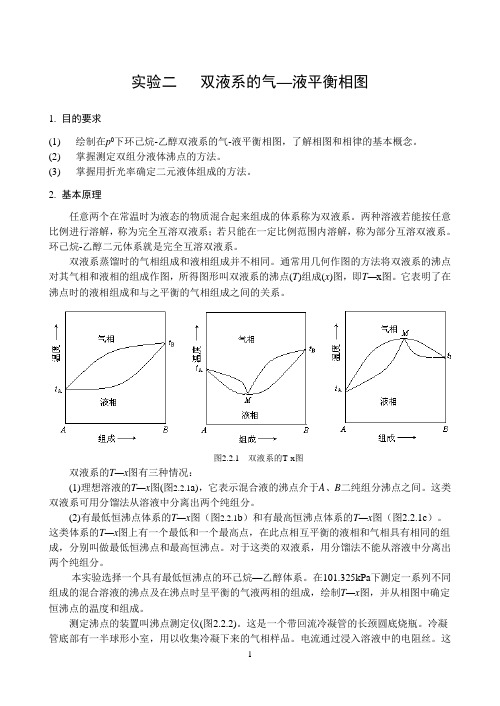
双液系蒸馏时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点(T)组成(x)图,即T—x图。
它表明了在沸点时的液相组成和与之平衡的气相组成之间的关系。
图2.2.1 双液系的T-x图双液系的T—x图有三种情况:(1)理想溶液的T—x图(图2.2.1a),它表示混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
(2)有最低恒沸点体系的T—x图(图2.2.1b)和有最高恒沸点体系的T—x图(图2.2.1c)。
这类体系的T—x图上有一个最低和一个最高点,在此点相互平衡的液相和气相具有相同的组成,分别叫做最低恒沸点和最高恒沸点。
对于这类的双液系,用分馏法不能从溶液中分离出两个纯组分。
本实验选择一个具有最低恒沸点的环己烷—乙醇体系。
在101.325kPa下测定一系列不同组成的混合溶液的沸点及在沸点时呈平衡的气液两相的组成,绘制T—x图,并从相图中确定恒沸点的温度和组成。
测定沸点的装置叫沸点测定仪(图2.2.2)。
这是一个带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电流通过浸入溶液中的电阻丝。
这样可以减少溶液沸腾时的过热现象,防止暴沸。
测定时,温度计水银球要一半在液面下,一半在气相中,以便准确测出平衡温度。
而折光率的测定又只需少量样品,溶液组成分析:由于环己烷和乙醇的折光率相差较大,4.实验步骤(1) 纯液体折光率的测定:分别测定乙醇和环己烷的折光率,重复2次~3次。
双液系的气-液平衡相图的绘制实验报告

实验四 双液系的气-液平衡相图的绘制一、目的要求1.用沸点仪测定大气压下乙醇—环己烷或异丙醇-环己烷双液系气-液平衡时气相与液相组成及平衡温度,绘制温度—组成图,确定恒沸混合物的组成及恒沸点的温度。
2.了解物化实验中光学方法的基本原理,学会阿贝折光仪的使用。
3.进一步理解分馏原理。
二、实验原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系。
两种液体若能按任意比例互相溶解,称为完全互溶的双液系;若只能在一定比例范围内互相溶解,则称部分互双液系。
双液系的气液平衡相图t x -图可分为三类。
如图4.1。
图 4.1 二元系统t x -图这些图的纵轴是温度(沸点),横轴是代表液体B 的摩尔分数B x 。
在t x -图中有两条曲线:上面的曲线是气相线,表示在不同溶液的沸点时与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
例如图4.1(a)中对应于温度t 1的气相点为y 1,液相点为1l ,这时的气相组成y 1点的横轴读数是g B x ,液相组成点1l 点的横轴读数为lB x 。
如果在恒压下将溶液蒸馏,当气液两相达平衡时,记下此时的沸点,并分别测定气相(馏出物)与液相(蒸馏液)的组成,就能绘出此t x -图。
y 1l 1t 1g Bx l Bx AB t/℃(a )气液t/℃AB B x →(b )t/ ℃气液ABB (c )图4.1(b)上有个最低点,图4.1(c)上有个最高点,这些点称为恒沸点,其相应的溶液称为恒沸混合物,在此点蒸馏所得气相与液相组成相同。
三、仪器和药品1.仪器玻璃沸点仪一套;阿贝折光仪一台;WLS 系列可调式恒流电源一台;SWJ 型精密数字温度计一台;SYC 超级恒温槽一台。
2.药品无水乙醇(AR )或异丙醇(AR );环己烷(AR )。
四、实验步骤(一)、步骤1.按图4.2连好沸点仪,数字贝克曼温度计,感温杆勿与电热丝相碰。
2.接通冷凝水,用超级恒温槽完成冷凝循环。
环己烷-乙醇气液平衡相图的绘制实验设计方案[1] 2
![环己烷-乙醇气液平衡相图的绘制实验设计方案[1] 2](https://img.taocdn.com/s3/m/ae96b4194431b90d6c85c791.png)
环己烷-乙醇气液平衡相图的绘制一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
4. 掌握用沸点仪测沸点的方法二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x),根据体系对拉乌尔定律的偏差情况,可分为三类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
(2)最大负偏差:混合物存在着最高沸点,如盐酸-水体系,如图1 (b)所示。
(3)最大正偏差:混合物存在着最低沸点,如正丙醇—水体系,如图1(c))所示。
图1 二组分真实液态混合物气-液平衡相图(T-x)对于后两种情况,为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
本实验中两相的成分分析均采用折光率法。
折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同。
因此可先配制一系列已知组成的溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的组成。
6乙醇—环己烷双液系相图

渤海大学学生实验报告课程名称: 任课教师:实验室名称: 房间号 实验时间: 年 月 日 学院 化学化工与食品安全学院 专业班级 姓名学号同组人实验项目乙醇—环己烷双液系相图 组别实验成绩一、实验目的:1.了解物理化学实验手段中常用的物理方法——光学方法的基本原理; 2.绘制乙醇—环己烷双液系的沸点—组成图,确定其恒沸组成及恒沸温度; 3.进一步理解分馏原理;4.掌握阿贝折光仪的原理及使用方法。
二、实验原理:1.在常温下,两种液态物质以任意比例相互溶解所组成的体系称之为完全互溶双液系。
在恒定压力下,表示溶液沸点与组成关系的图称之为沸点—组成图,即所谓的相图。
体系的最低或最高恒沸点即为恒沸温度,恒沸温度对应的组成为恒沸组成。
乙醇—环己烷双液系属于具有最低恒沸点一类的体系。
2.物理学方法折射率的测定是一种间接获取组成的方法。
它具有简便准确的特点。
本实验就是利用回流及分析的方法来绘制相图。
取不同组成的溶液在沸点仪中回流,测定其沸点及气、液相组成。
沸点数据可直接由温度计获得;气、液相组成可通过测其折射率,然后由组成—折射率最后确定。
3.沸点的气压校正:325.101325.10110p t t -⨯=∆ t t t b ∆+=三、实验仪器和试剂:沸点测定仪 1套; 阿贝折射计(包括恒温装置) 1套;移液管(25ml) 1个; 吸液管 2支; 调压变压器 1台; 乙醇(A ·R ) 环己烷(A ·R ) 四、实验装置图:由实验记录数据绘制乙醇-环己烷双液系相图如下:实验结果讨论:本次实验误差主要有两个方面:一是在测定乙醇-环己烷的沸点时,对沸点的记录不够准确,沸点不易判断;二是测完折光率后在坐标图上查气液相组成时由于图纸太大使得横纵坐标可能对应不够准确。
其余各过程做的较好。
八、思考题:1.操作步骤中,在加入不同数量的各组分时,如发生了微小的偏差,对相图的绘制有无影响?为什么?答:加入各组分时,如发生了微小的偏差,对相图的绘制无影响,因为最终液体的组成是通过对折光率的测定,在工作曲线上得出,所以无影响。
乙醇—环己烷双液系相图

渤海大学学生实验报告课程名称:任课教师:实验室名称:房间号实验时间:年月日一、实验目的:1.了解物理化学实验手段中常用的物理方法——光学方法的基本原理; 2.绘制乙醇—环己烷双液系的沸点—组成图,确定其恒沸组成及恒沸温度; 3.进一步理解分馏原理;4.掌握阿贝折光仪的原理及使用方法。
二、实验原理:1.在常温下,两种液态物质以任意比例相互溶解所组成的体系称之为完全互溶双液系。
在恒定压力下,表示溶液沸点与组成关系的图称之为沸点—组成图,即所谓的相图。
体系的最低或最高恒沸点即为恒沸温度,恒沸温度对应的组成为恒沸组成。
乙醇—环己烷双液系属于具有最低恒沸点一类的体系。
2.物理学方法折射率的测定是一种间接获取组成的方法。
它具有简便准确的特点。
本实验就是利用回流及分析的方法来绘制相图。
取不同组成的溶液在沸点仪中回流,测定其沸点及气、液相组成。
沸点数据可直接由温度计获得;气、液相组成可通过测其折射率,然后由组成—折射率最后确定。
3.沸点的气压校正:325.101325.10110pt t -⨯=∆ t t t b ∆+=三、实验仪器和试剂:沸点测定仪 1套; 阿贝折射计(包括恒温装置) 1套; 移液管(25ml) 1个; 吸液管 2支; 调压变压器 1台; 乙醇(A ·R ) 环己烷(A ·R ) 四、实验装置图:由实验记录数据绘制乙醇-环己烷双液系相图如下:实验结果讨论:本次实验误差主要有两个方面:一是在测定乙醇-环己烷的沸点时,对沸点的记录不够准确,沸点不易判断;二是测完折光率后在坐标图上查气液相组成时由于图纸太大使得横纵坐标可能对应不够准确。
其余各过程做的较好。
八、思考题:1.操作步骤中,在加入不同数量的各组分时,如发生了微小的偏差,对相图的绘制有无影响为什么答:加入各组分时,如发生了微小的偏差,对相图的绘制无影响,因为最终液体的组成是通过对折光率的测定,在工作曲线上得出,所以无影响。
双液系气液平衡相图的绘制

实验四双液系气液平衡相图的绘制姓名:谭成彬班级:生物工程学院生物工程07级四班学号;07041010428一、实验目的1.测定常压下环己烷—乙醇二元系统的气液平衡数据,绘制沸点—组成相图。
2.掌握双组份沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝斯折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组间分溶解度不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合成完全互溶体系时,如果该两组分的蒸汽压不同,则混合物的组成于平衡的气相的组成不同。
当压力保持一定,混合物沸点与两组分的含量有关。
恒定压力下,真实的完全互溶双液系的气—液平衡相图(T—x图),根据体系对拉乌尔的偏差情况,可分为三类:1)一般偏差:混合物的沸点介于两种纯组分之间,如果苯—苯体系,如图1(a)所示。
2)最大负偏差:混合物存在最高沸点,如盐—水体系,如图1(b)所示。
3)最大正偏差:混合物纯在最低沸点,如正丙醇—水体系,如图1(c)所示。
(a) (b)(c)图1 二组分也太混合物气——液平衡相图(T—x图)对于后两种情况,为具有沸点的双系相图。
他们爱最高或最低衡沸点时气相和液相组成相同,因而不能像第一类那样通过反复蒸馏的方法而使双液系的两个组分分离,而只能采取精馏扥那个方法分离出一种纯物质和另一种衡沸混合物。
为了测定双液系的T—x图,需要在气—液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验一环己烷—乙醇为体系,该体系属于上述第三类型,在沸点仪中蒸馏不同组成的混合物,、液二相组成,即可作出T—x 相图。
本实验气液两相的组成均采用折光率测定。
折光率是物质的一个特征数值,天宇物质的浓度计温度有关,因此在测定物质的折光率是要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同,因此可先配制一系列已知组成的溶液,在恒定温度下扯其折光率,作出折光率—组成曲线,便可通过折光率的大小在工作曲线上找出未知溶液的组成。
双液系的气液平衡相图实验报告

双液系的气液平衡相图实验报告一、实验目的1、测定常压下环己烷乙醇双液系的气液平衡相图。
2、掌握阿贝折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
本实验研究的是完全互溶双液系。
在一定温度下,溶液的气液两相达到平衡时,气相组成和液相组成之间存在一定的关系。
通过测定不同组成溶液的沸点和气、液相组成,绘制出沸点组成图(Tx 图),即可得到双液系的气液平衡相图。
通常,实验中通过测定溶液的折射率来确定其组成。
因为折射率与溶液的组成有一定的对应关系。
三、实验仪器和试剂1、仪器沸点仪阿贝折射仪超级恒温槽调压变压器温度计(50℃~100℃,分度值 01℃)移液管(1mL、2mL、5mL)洗耳球2、试剂环己烷(分析纯)无水乙醇(分析纯)四、实验步骤1、安装仪器将沸点仪洗净、烘干,安装好。
检查带有温度计的胶塞是否紧密,电热丝要靠近烧瓶底部的中心。
将阿贝折射仪与超级恒温槽连接好,调节恒温槽温度至 25℃。
2、配制溶液用移液管分别移取 05mL、10mL、15mL、20mL、25mL、30mL、35mL、40mL、45mL 乙醇于 10 个干燥的容量瓶中,再用环己烷分别稀释至刻度,摇匀,配制成一系列不同组成的环己烷乙醇溶液。
3、测定折射率用阿贝折射仪分别测定所配溶液及纯环己烷、纯乙醇的折射率。
测定时,用擦镜纸将棱镜擦净,滴加 2~3 滴待测液于棱镜上,合上棱镜并拧紧,调节反光镜使目镜内视场明亮,旋转棱镜调节旋钮,使目镜中出现明暗分界线,读取折射率。
每个样品测量三次,取平均值。
4、测定沸点向沸点仪中加入 20mL 乙醇含量较少的待测溶液,接通冷凝水。
调节调压变压器,缓慢加热溶液,当液体沸腾后,调节电压使液体沸腾稳定,待温度计读数稳定后,记录沸点温度。
停止加热,用吸管从小槽中吸取气相冷凝液,用阿贝折射仪测定其折射率。
再从侧管中吸取少量液相,测定其折射率。
双液系的气液平衡相图实验报告

双液系的气液平衡相图实验报告一、实验目的1、绘制在常压下环己烷乙醇双液系的气液平衡相图,了解相图和相律的基本概念。
2、掌握阿贝折射仪的使用方法,测定液体和蒸气的组成。
3、学会通过实验数据处理和分析,确定双液系的最低恒沸点和恒沸组成。
二、实验原理1、双液系的气液平衡双液系是指两种液体能以任意比例相互溶解所组成的体系。
在一定温度下,气液两相达到平衡时,气相组成和液相组成之间存在一定的关系。
2、相律相律表达式为:F = C P + 2,其中 F 为自由度,C 为组分数,P 为相数。
对于双液系,在压力固定的情况下,自由度 F = 2 P。
3、沸点测定通过沸点仪测定双液系的沸点。
当液体混合物沸腾时,其气相和液相的组成不同。
使用阿贝折射仪测定液相和气相的折射率,然后通过折射率组成工作曲线确定其组成。
三、实验仪器与试剂1、仪器沸点仪、阿贝折射仪、超级恒温槽、调压变压器、温度计(50 100℃,分度值 01℃)、移液管(2ml、5ml)、滴管。
2、试剂环己烷(分析纯)、无水乙醇(分析纯)。
四、实验步骤1、安装仪器将沸点仪洗净、烘干,安装好温度计、加热丝和冷凝管。
2、配制溶液用移液管分别吸取一定体积的环己烷和乙醇,配制不同组成的环己烷乙醇混合液,体积比分别为 0:10、1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1、10:0。
3、测定沸点将配制好的混合液加入沸点仪中,加热至液体沸腾。
待温度稳定后,读取沸点温度。
分别从气相冷凝液取样口和液相取样口吸取样品,用阿贝折射仪测定其折射率。
5、重复实验改变混合液的组成,重复上述步骤,测定不同组成下的沸点和折射率。
五、实验数据记录与处理1、实验数据记录|混合液体积比(环己烷:乙醇)|沸点(℃)|气相折射率|液相折射率||::|::|::|::|| 0:10 |_____ |_____ |_____ || 1:9 |_____ |_____ |_____ || 2:8 |_____ |_____ |_____ || 3:7 |_____ |_____ |_____ || 4:6 |_____ |_____ |_____ || 5:5 |_____ |_____ |_____ || 6:4 |_____ |_____ |_____ || 7:3 |_____ |_____ |_____ || 8:2 |_____ |_____ |_____ || 9:1 |_____ |_____ |_____ || 10:0 |_____ |_____ |_____ |2、折射率组成工作曲线的绘制以已知纯环己烷和纯乙醇的折射率为端点,将实验测定的不同组成下的折射率与组成数据标绘在坐标纸上,绘制折射率组成工作曲线。
环己烷-乙醇体系气液平衡相图的测定结果

因为测量环己烷沸点时,大气压为 102.41Kpa,测量乙醇沸点时大气压为 102.43KPa,所以需要用 特鲁顿规则及克劳修斯看—克拉贝隆方程进行校正,
△t(环己烷)压=(273.15+80.3)/10*(101325-102410)/101325= -3.215*10−7℃
T 沸(环己烷)=80.3-(-3.215*10−7)=80.3℃
六.思考题
1 待测溶液的浓度是否需要精确测量? 不需要,可以通过测定气液两相的折光率代入工作曲线法所得到的方程,得到环己烷的体积分 数。
2 本实验不测纯环己烷、纯乙醇的沸点,而直接用标准大气压下的数据,这样会带来什么误差? 如果当地大气压比标准大气压高,会导致实际沸点偏低,反之,则偏高。
3 如果要测纯环己烷、纯乙醇的沸点,蒸馏瓶必须洗净而且烘干,而测混合液沸点和组成时,蒸 馏瓶则不洗也不烘,为什么?
0.4 1.3609
0.5 1.3609
0.6 1.3609
0.7 1.3609
0.8 1.3609
0.9 1.3609
1.0 1.3609
图二
表三
T(沸点℃) 78.3 76.6 73.9 70.3 67.2 65.1 80.2 79.1 72.5 65.5 65.2 80.3
乙醇-环己烷相图数据
测定纯组分的沸点时,如果不进行洗涤、烘干,会污染被测的纯样品,结果就不准确;而测定混 合液的沸点和组成就不需要,因为可以通过测量折光率,间接得到组分含量。
4 在实验中,测定工作曲线时折射仪的恒温温度与测定样品时折射仪的温度是否要保持一致? 要保持一致,因为样品折射率会随温度的变化而变化。
0.3 1.3612
0.4 1.3612
物理化学实验 二元液系的气液平衡相图

• ③由于气相样品(冷凝液)挥发性大,量少, 蒸发面大,只有在停止加热后迅速取样测 定,才能保证气相组成的正确性,至于液 相,因为量多,挥发性小,很少发生不正 常情况,故可从容测定。
• ④用滴管取样,注意滴管的倾斜度,不要 让样品流入橡皮帽。 • • 1.在本实验中,气液两相是怎样达到平衡的? • 2.绘制工作曲线的目的是什么? • 3.每次加入乙醇及环已烷的量是否要求准 确? • 4.实验测得的沸点与大气压对应的沸点是 否一致?
实验注意事项
• ① • (ⅰ)明暗分界线从上和从下趋向十字交点, 其数值常不一致,取两者的平均值,或所 有测定连同校准都从一个方向趋向十字交
•
(ⅱ)丙酮或其他易挥发性液体从镜上挥发 后;棱镜温度有所降低,因此棱镜干燥后 要合上一段时间或者样品加好后过一会再 测。
• ②由于蒸馏瓶中的气相外壁处在室温下, 气相有精馏作用,即高度不同,气相成分 不同。笔者认为,近液面的气相组成比较 正确,因此冷凝管的进气管应当尽量的低, 或者下段气相加以保温。盛气相样品小槽 有0.5ml已够,不大不深,则可较快达到平 衡。但操作时,液相面不可过高,加热不 可过猛,以免液体进入气相样品中。
100% 80% 60% 40% 20% 0%
环已烷 mol%
折光率 1.4238 1.4163 (25度) 折光率 1.4218 1.4149 (30度) 1.4030 1.3915 1.3740 1.3637
1.4016 1.3896 1.3680 1.3622
3、一定组成环已烷—乙醇混合液沸 点及气液两相折射率的测定
1、加热丝一定要被测液体浸没,否则通电 加热时可能会引起有机液体燃烧。 2、加热功率不能太大,加热丝上有小气泡 逸出即可。 3、温度传感器(温度计)不要直接碰到加 热丝。
乙醇-环己烷汽液相平衡

实验三乙醇-环己烷双液系汽液平衡相图一、实验目的1.绘制环已烷一乙醇双液系的汽—液平衡相图2.掌握测定双组分液体的沸点及正常沸点的方法3.掌握用折光率确定二元液体组成的方法二、重点与难点1.t-x-y相图,相律2.汽液平衡原理3. 折光率仪的使用三、实验原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系,两种液体若能接任意比例互相溶解,称为完全互溶的双液系。
若只能在一定比例范围内互相溶解,则称部分互溶双液系。
对双液系的气液平衡相图,温度—组成图可分为三类;( l )溶液沸点介于两纯组分沸点之间(a)以理想体系为代表。
( 2 )溶液存在最高沸点(图b),极大负偏差溶液( 3 )溶液存在最低沸点(图 c ),极大正偏差溶液( b )、( c )中的最高点、最低点为垣沸点,其相应的溶液称为恒沸点混会物,恒沸点混合物蒸馏所得的汽相和液相组成相同。
如果在恒压下将溶液蒸馏,当气液两相达平衡时,记下此时的沸点,并分别测定气相(馏出物)与液相(蒸溜液)的组成,就能绘出温度-组成图。
本实验采用的是测定溶液折光率的方法来间接测定溶液的组成。
实验中乙醇和环己烷两者纯物质的折光率相差较大,它们二者形成的溶液的折光率与组成之间就存在着一定的关联,通过测定一系列已知组成的溶液的折光率可以得到标准折光率—组成曲线,实验中测定未知组成溶液的折光率,对照标准曲线,就可以查得溶液的组成。
四、仪器试剂图5.2 沸点仪示意图1. 冷凝管2. 冷凝液凹槽3.烧瓶4.支管5.温度计6.磁子7.磁力搅拌加热器五、实验步骤1 、调节超级恒温槽温度,使阿贝折光仪的温度计读数保持在25 ℃。
2 、温度计校正。
从加料口加入100% 乙醇至干燥的蒸馏器约 2/3 处,使温度计探头浸入溶液中,打开直流稳流电源的开关,加热体系,使溶液沸腾,待温度恒定后,记录所得温度和室内大气压力。
停止通电,倾出乙醇到原瓶中。
3 、用漏斗从加料口加入含有乙醇约为 5 %的环己烷溶液至蒸馏器约 1/3 处,打开冷却水,同法加热使溶液沸腾。
2021年乙醇环己烷气液平衡相图绘制实验报告

乙醇环己烷气液平衡相图绘制实验报告环己烷-乙醇双液系气液平衡相图得绘制姓名:学号:班级:同组:成绩一、实验目得1.测定常压下环己烷-乙醇二元系统得气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点得测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪得使用方法。
二、实验原理恒定压力下,真实得完全互溶双液系得气-液平衡相图( T-x ),根据体系对拉乌尔定律得偏差情况,可分为 3 类: (1)一般偏差:混合物得沸点介于两种纯组分之间,如甲苯-苯体系,如图 1(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体得蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图 2、7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体得蒸汽压都大,混合物存在着最低沸点如图 2、7(c))所示。
图 1 二组分真实液态混合物气—液平衡相图(Tx 图)本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2、8)中蒸馏不同组成得混合物,测定其沸点及相应得气、液二相得组成,即可作出 T-x 相图。
本实验中两相得成分分析均采用折光率法测定。
t At At At Bt Bt Bt / o Ct / o Ct / o Cx B x B x B A BAABB(a)(b) (c)x "x "折光率就是物质得一个特征数值,它与物质得浓度及温度有关,因此在测量物质得折光率时要求温度恒定。
溶液得浓度不同、组成不同,折光率也不同。
因此可先配制一系列已知组成得溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率得大小在工作曲线上找出溶液得组成。
三、仪器与试剂沸点仪,阿贝折射仪,调压变压器,超级恒温水浴,温度测定仪,长短取样管。
环己烷物质得量分数 x 环己烷为 0、0、2、0、4、0、6、0、8、1、0 得环己烷-乙醇标准溶液,已知 101、325kPa 下,纯环己烷得沸点为 80、7℃,乙醇得沸点为 78、4℃。
实验二 乙醇-环己烷双液相图绘制

实验二乙醇----环己烷双液系相图
一丶实验目的
1.绘制乙醇----环己烷双液系的沸点----组成图,确定其恒沸组成和恒沸温度。
2.掌握回流冷凝法测溶液沸点的方法。
3.掌握阿贝折射仪的原理及使用方法。
二丶实验原理
采用回流冷凝法测定一系列乙醇环己烷不同配比溶液的沸点和气液两相平衡时的组成,绘制溶液沸点----组成图。
三丶实验步骤
1.配制环己烷摩尔分数分别为0.10 0.20 0.30 0.40 0.50 0.60 0.70 0.80 0.90的乙醇----环己烷溶液各25ml。
2.安装沸点仪,连接阿贝折射仪和超级恒温槽,调节超级恒温槽水浴温度为25℃。
3.测无水乙醇丶系列乙醇环己烷溶液丶环己烷的沸点,以及气液两相平衡时两相的组成。
四丶数据记录及处理
1.数据记录
室温大气压
注意:表中折射率为三次测得值的平均值
2.绘制乙醇----环己烷双液系的沸点----组成图
3.利用沸点----组成图确定体系的恒沸温度和恒沸组成恒沸温度为:
恒沸组成为:
五丶误差原因分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
姓名:学号:班级:同组:成绩
一、实验目的
1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二、实验原理
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x),根据体系对拉乌尔定律的偏差情况,可分为3类:
(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图(c))所示。
图1 二组分真实液态混合物气—液平衡相图(T-x图)
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
本实验中两相的成分分析均采用折光率法测定。
?
折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同。
因此可先配制一系列已知组成的溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的组成。
三、仪器与试剂
沸点仪,阿贝折射仪,调压变压器,超级恒温水浴,温度测定仪,长短取样管。
环己烷物质的量分数x环己烷为0、、、、、的环己烷-乙醇标准溶液,已知
下,纯环己烷的沸点为℃,乙醇的沸点为℃。
25℃时,纯环己烷的折光率为,乙醇的折光率为。
四、实验步骤
1.环己烷-乙醇溶液折光率与组成工作曲线的测定(略)
2. 无水乙醇沸点的测定
将干燥的沸点仪安装好。
从侧管加入约20mL无水乙醇于蒸馏瓶内,并使温度计浸入液体内。
冷凝管接通冷凝水。
将液体加热至缓慢沸腾。
液体沸腾后,待测温温度计的读数稳定后应再维持3~5min以使体系达到平衡。
在这过程中,不时将小球中凝聚的液体倾入烧瓶。
记下温度计的读数,即为无水乙醇的沸点,同时记录大气压力。
3. 环己烷沸点的测定(略)
4. 测定系列浓度待测溶液的沸点和折光率
同2步操作,从侧管加入约20mL预先配制好的1号环己烷-乙醇溶液于蒸馏瓶内,将液体加热至缓慢沸腾。
因最初在冷凝管下端内的液体不能代表平衡气相的组成,为加速达到平衡,须连同支架一起倾斜蒸馏瓶,使槽中气相冷凝液倾回蒸馏瓶内,重复三次(注意:加热时间不宜太长,以免物质挥发),待温度稳定后,记下温度计的读数,即为溶液的沸点。
切断电源,停止加热,分别用吸管从小槽中取出气相冷凝液、从侧管处吸出少许液相混液,迅速测定各自的折光率。
剩余溶液倒入回收瓶。
按1号溶液的操作,依次测定2、3、4、5、6、7、8号溶液的沸点和气-液平衡时的气,液相折光率。
五、数据处理
阿贝折射仪温度: 25 o C 大气压: kPa
环己烷沸点:o C 无水乙醇沸点:o C
1.环己烷-乙醇混和液测定数据如下:
2.工作曲线数据来源于复旦大学《物理化学实验》(第四版)。
根据工作曲线插值求出各待测溶液的气相和液相平衡组成,填入表中。
以组成为横轴,沸点为纵轴,绘出气相与液相的沸点-组成(T-x)平衡相图。
图2. 25℃时,乙醇和环己烷双液系浓度――折光率关系工作曲线
图3. 25℃时,乙醇和环己烷双液系浓度相图
六、思考题
1、本实验过程中,如何判断气、液相是否已平衡?
2、本实验误差可能来自哪些方面?。
