物化实验双液系的气-液平衡相图实验报告
双液系的气—液平衡相图

实验五双液系的气—液平衡相图一、实验目的1、绘制在标准压力下乙醇-正丙醇体系的沸点组成图,并确定其恒沸点及恒沸组成;2、熟练掌握测定双组分液体沸点的方法及用折光率确定二组分物系组成的方法;3、掌握超级恒温槽、阿贝折射仪、气压计等仪器的使用方法。
二、实验原理1、相图任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系,如环已烷-乙醇、正丙醇-乙醇体系都是完全互溶体系。
若只能在一定比例范围内溶解,称为部分互溶双液系,例苯-水体系。
在完全互溶双液系中,有一部分能形成理想液态混合物,如苯-甲苯系统,二者的行为均符合拉乌尔定律,但大部分双液系是非理想液态混合物,其行为与拉乌尔定律有偏差。
液体的沸点是指液体的蒸气压与外界压力相等时的温度。
在一定外压下,纯液体的沸点有其确定值,但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
双液系两相平衡时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点T(或t)-组成(x)图,即T(或t)—x图。
它表明了沸点与液相组成和与之平衡的气相组成之间的关系。
在恒定压力下,二组分系统气液达到平衡时,其沸点-组成(t-x)图分三类:(1)混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
如苯-甲苯系统,此时混合物的行为符合拉乌尔定律或对拉乌尔定律的偏差不大。
如图5-1(a)所示。
(2)有最低恒沸点体系,如环已烷-乙醇体系,t—x图上有一个最低点,此点称最低恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大正偏差,如图5-1(b)所示。
对于这类的双液系,用分馏法不能从溶液中同时分离出两个纯组分。
(3)有最高恒沸点体系,如氯仿-丙酮体系,t—x图上有一个最高点,此点称最高恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大负偏差,如图5-1(c)所示。
双液系气—液平衡相图

双液系气—液平衡相图一、实验目的1.用沸点仪测定在常压下环己烷-乙醇的气液平衡相图。
2.掌握阿贝折射仪的测量原理及使用方法,掌握用折光率确定二元液体组成的方法。
3.掌握测定双组分液体沸点的方法。
二、实验原理两种液体混合而成的二组分体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系;若只能在一定比例范围内溶解,称为部分互溶双液系。
环己烷-乙醇二元体系就是完全互溶双液系。
双液系蒸馏时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点(T)组成(x)图,即T—x图。
它表明了在沸点时的液相组成和与之平衡的气相组成之间的关系。
本实验选择一个具有最低恒沸点的环己烷—乙醇体系。
在常压下测定一系列不同组成的混合溶液的沸点及在沸点时呈平衡的气液两相的组成,绘制T—X图,并从相图中确定恒沸点的温度和组成。
三、实验仪器及试剂沸点测定仪 1个 阿贝折光仪 1台 直流稳压电源 1台 水银温度计 1支玻璃温度计 1支超级恒温水浴 1台长滴管 2支环己烷-乙醇系列溶液:1、以环己烷摩尔分数计为0.05,0.15,0.30,0.45,0.55,0.65,0.80,0.95各50ml2、以环己烷摩尔分数为0.10,0.20,0.30,0.40,0.50,0.60,0.70,0.80,0.90各10ml四、实验步骤绘制标准曲线——安装沸点测定仪——测定沸点——测定平衡的气-液相组成——重复测量其余溶液相平衡1、绘制标准曲线①调节恒温水浴温度,使阿贝折光仪上的温度计读数保持在某一定值。
②分别测定环己烷摩尔分数为0.10,0.20,0.30,0.40,0.50,0.60,0.70,0.80,0.90的九个溶液以及环己烷和乙醇的折光率,每个需重复3次。
③用较大的坐标纸绘制若干条不同温度下的折光率-组成工作曲线。
2、安装沸点测定仪将干燥的沸点测定仪按照片所示安装好。
深圳大学物理化学实验报告--双液系的气----液平衡相图--赖凯涛 张志诚 史炜 汤菲菲详细版

文件编号:GD/FS-5688The Short-Term Results Report By Individuals Or Institutions At Regular Or Irregular Times, Including Analysis, Synthesis, Innovation, Etc., Will Eventually Achieve Good Planning For TheFuture.编辑:_________________单位:_________________日期:_________________(报告范本系列)深圳大学物理化学实验报告--双液系的气----液平衡相图--赖凯涛 张志诚深圳大学物理化学实验报告--双液系的气----液平衡相图--赖凯涛张志诚史炜汤菲菲详细版提示语:本报告文件适合使用于个人或机构组织在定时或不定时情况下进行的近期成果汇报,表达方式以叙述、说明为主,内容包含分析,综合,新意,重点等,最终实现对未来的良好规划。
文档所展示内容即为所得,可在下载完成后直接进行编辑。
实验者:赖凯涛张志诚史炜汤菲菲深圳大学物理化学实验报告实验者:赖凯涛实验时间:5月15日气温:23.0℃大气压:100900pa实验六:双液系的气----液平衡相图一:目的要求绘制在p下环已烷-乙醇双液系的气----液平衡图,了解相图和相率的基本概念掌握测定双组分液系的沸点的方法掌握用折光率确定二元液体组成的方法二:仪器试剂恒沸点仪精密温度计调压变压器阿贝折光仪超级恒温水浴量筒、漏斗滴管、大烧杯无水乙醇环己烷含环己烷各为10、30、50、70、90、95%(重量百分数)的乙醇溶液。
(用棕色试剂瓶盛装)含环己烷各为0%、20%、40%、60%、80%、100%的标准乙醇溶液。
(用白滴瓶盛装)三:数据分析双液系汽-液平衡相图实验者张志诚实验时间2000/15/5室温℃23.0大气压pa100900环己烷/乙醇标准溶液浓度%折光率1.3620101.3630 20 1.3635 30 1.3650 40 1.3675 50 1.3730 60 1.3655 70 1.3940 80 1.42101.42581001.4260拟合方程式参数a6.0e-07b6.0e-04c1.3601环己烷%1030709095100沸点℃77.40 73.20 67.20 64.3063.7064.90 79.40 79.80气相折光率1.3722 1.3938 1.4010 1.4030 1.4195 1.4260 1.4261液相折光率1.3616 1.3639 1.3702 1.3819 1.4018 1.4221.4262 气相浓度42053646791 100 100液相浓度2617356594101100低恒沸溶液沸点℃组成%64.167四:实验讨论。
《物理化学实验报告》双液系的气液平衡相图

双液系的气液平衡相图2011年9月5日实验,2011年9月12日提交报告助教:柳清1 引言相图(phase diagram)是用图形表示多相系统的物理化学状态随温度、压力、组分含量等的变化的图1。
对于多相平衡系统,相律(phase rule)是其热力学基础。
本实验研究的是环己烷-乙醇(C6H12-C2H5OH)双液系的气液平衡状态。
根据相律,f+Φ = C+2其中相数Φ为2,独立自由组分数C为1,则系统自由度数f为1。
如果固定外压p不变,条件自由度数f′为0。
因此,在外压p不变时,温度T和组分含量x唯一确定了双液系气液平衡系统的状态。
用气液平衡时的温度T和组分含量x分别作为纵横坐标,同时测定气相和液相的组成,可以绘制双液系的气液平衡T-x相图。
不同组成的双液系具有不同形式的气液平衡T-x相图。
理想液体混合物或者接近理想液体混合物的双液系,混合物的沸点介于两纯物质沸点之间,如图1(a)。
各组分蒸气压对拉乌尔定律产生很大的正偏差时,混合溶液体系会具有最低恒沸点,如图1(b)。
反之,混合溶液体系会具有最高恒沸点,如图1(c)。
(a) (b) (c)图1 不同双液系的气液平衡T-x相图形式本实验选用具有最低恒沸点的环己烷-乙醇(C6H12-C2H5OH)双液系。
用沸点仪可以测定不同组成的双液系的恒压沸点T。
沸点仪是测定常量溶液沸点的工具。
沸腾时的溶液从喷嘴喷出,温度计测定的恰是该处蒸气和液相平衡的温度。
气相部分经过冷凝器冷凝后储存在小泡中,以备取样。
考虑到温度计的精度,需要对1/10℃温度计进行露茎校正。
由于温度计暴露于体系之外的部分所处温度与实测区域不同,二者膨胀系数略有差别。
为了补偿这部分损失,通过辅助温度计读出环境温度后,按下式校正:t = t0+1.57×10-4×n×(t0-t s)式中t0为温度计读数,n为温度计露茎在体系外的刻度数目,t s为辅助温度计读数。
t 为校正后的温度。
物化实验双液系的气-液平衡相图实验报告

双液系的气-液平衡相图一实验目的1.绘制在pθ下环己烷-异丙醇双液系的气-液平衡相图,了解相图和相律的基本概念;2.掌握测定双组分液体的沸点及正常沸点的方法;3.掌握用折光率确定二元液体组成的方法。
二实验原理在常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例互溶,则称完全互溶双液体系,若只能部分互溶,则称部分互溶双液体系。
液体的沸点是指液体的蒸汽压与外界压力相等时的温度,在一定的外压下,纯液体的沸点有其特定值,但双液系的沸点不仅与外压有关而且还与两种液体的相对含量有关。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图中于 (a)。
而实际溶液由于A 和B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图2-4-1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验是用回流冷凝法测定环已烷—异丙醇体系的沸点—组成图。
其方法是用阿贝折射仪测定不同组成的体系,在沸点温度时气、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制沸点—组成图。
三仪器和试剂沸点仪1套;恒温槽1台;阿贝折射仪1台;量筒8个;玻璃漏斗8个;滴管2个;环己烷(分析纯);异丙醇(分析纯);实验装置如下:四实验步骤1.工作曲线的绘制配制环己烷的质量百分数0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70, 0.80和0.90的环己烷-异丙醇溶液。
计算所需环己烷和异丙醇的质量,并用分析天平准确称取。
为避免样品挥发带来的误差,称量应尽可能的迅速。
各种溶液的确切组成要按照实际称样结果精确计算。
调节超级恒温水浴的温度为35度,使阿贝折光仪上温度与其保持一致。
分别测定上述九个溶液以及异丙醇和环己烷的折光率。
根据这些数据作出折光率-组成工作曲线。
双液系的气-液平衡相图的绘制实验报告

实验四 双液系的气-液平衡相图的绘制一、目的要求1.用沸点仪测定大气压下乙醇—环己烷或异丙醇-环己烷双液系气-液平衡时气相与液相组成及平衡温度,绘制温度—组成图,确定恒沸混合物的组成及恒沸点的温度。
2.了解物化实验中光学方法的基本原理,学会阿贝折光仪的使用。
3.进一步理解分馏原理。
二、实验原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系。
两种液体若能按任意比例互相溶解,称为完全互溶的双液系;若只能在一定比例范围内互相溶解,则称部分互双液系。
双液系的气液平衡相图t x -图可分为三类。
如图4.1。
图 4.1 二元系统t x -图这些图的纵轴是温度(沸点),横轴是代表液体B 的摩尔分数B x 。
在t x -图中有两条曲线:上面的曲线是气相线,表示在不同溶液的沸点时与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
例如图4.1(a)中对应于温度t 1的气相点为y 1,液相点为1l ,这时的气相组成y 1点的横轴读数是g B x ,液相组成点1l 点的横轴读数为lB x 。
如果在恒压下将溶液蒸馏,当气液两相达平衡时,记下此时的沸点,并分别测定气相(馏出物)与液相(蒸馏液)的组成,就能绘出此t x -图。
y 1l 1t 1g Bx l Bx AB t/℃(a )气液t/℃AB B x →(b )t/ ℃气液ABB (c )图4.1(b)上有个最低点,图4.1(c)上有个最高点,这些点称为恒沸点,其相应的溶液称为恒沸混合物,在此点蒸馏所得气相与液相组成相同。
三、仪器和药品1.仪器玻璃沸点仪一套;阿贝折光仪一台;WLS 系列可调式恒流电源一台;SWJ 型精密数字温度计一台;SYC 超级恒温槽一台。
2.药品无水乙醇(AR )或异丙醇(AR );环己烷(AR )。
四、实验步骤(一)、步骤1.按图4.2连好沸点仪,数字贝克曼温度计,感温杆勿与电热丝相碰。
2.接通冷凝水,用超级恒温槽完成冷凝循环。
物化实验报告_双液系的气液平衡相图

物化实验报告_双液系的气液平衡相图实验5 双液系的气液平衡相图丛乐 2005011007 生51实验日期:2007年11月10日星期六提交报告日期:2007年11月24日星期六助教老师:贾维杰1 引言1.1实验目的1( 用沸点仪测定在常压下环已烷—乙醇的气液平衡相图。
2( 掌握阿贝折射仪的使用方法。
1.2 实验原理将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。
在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。
沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。
第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
第一类混(3)类混合物用一般精馏方法只能分离出合物可用一般精馏法分离出这两种纯物质,第(2)、一种纯物质和另一种恒沸混合物。
图1 沸点组成图为了测定二元液系的T-x图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。
本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。
方法是用沸点仪(图2)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折射仅测定其折射率。
为了求出相应的组成,必须先测定已知组成的溶液的折射率,作出折射率对组成的工作曲线,在此曲线上即可查得对应于样品折射率的组成。
沸点仪的种类很多,图2所示是一种带有电阻丝加热的沸点仪。
沸腾的溶液由喷嘴喷向温度计,因此可以测得蒸气与液相平衡的温度。
物理化学实验-双液系的气液平衡相图

广西民族大学物理化学实验报告2018年10月24日姓名:指导老师:实验步骤及装置图1.用移液管量取异丙醇25mL,倒入干燥的沸点测定仪中。
开通冷却水。
开启电源,温度开始上升,不久仪器内液体沸腾,回流至温度不再升高和气相冷凝液充满,读取沸点,关闭电源。
2.用移液管量取1mL环己烷,加入沸点测定仪中。
开启电源,温度开始上升,不久仪器内液体沸腾,回流至温度不再升高和气相冷凝液充满,读取沸点,关闭电源。
用干燥滴管吸取气相冷凝液,测其折光率。
再用另一干净滴管吸取液相样品,测其折光率。
3.用移液管量取5mL、9mL、10mL环己烷,以同样的方法,顺序测定含环己烷的各溶液的沸点及气相、液相组分的折光率。
4.用移液管量取25mL环己烷,重复步骤15.用移液管量取0.5mL、1.5mL、4mL、5mL异丙醇,以同样的方法,顺序测定含异丙醇的各溶液的沸点及气相、液相组分的折光率。
实验原理常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。
双液体系的沸点不仅与外压有关,还与双液体系的组成有关。
恒压下将完全互溶双液体系蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就能找出平衡时气、液两相的成分并绘出T-X 图。
通常,如果液体与拉乌尔定律的偏差不大,在T-X图上溶液的沸点介于A、B二纯液体的沸点之间见图1 (a) 而实际溶液由于A、B二组分的相互影响,常与拉乌尔定律有较大偏差,在T-X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图1(b), (c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验所用沸点仪如图所示。
这是一个带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电流经变压器和粗导线通过浸于溶液中的电热丝。
这样既可以减少溶液沸腾时的过热现象,还能防止暴沸。
双液系的气-液平衡相图

双液系的⽓-液平衡相图双液系的⽓-液平衡相图⼀、实验⽬的1. 掌握采⽤阿贝折光率仪确定⼆元液体组成的⽅法;2. 掌握测定双组份液体的沸点及正常沸点的⽅法;3. 绘制在恒压下环⼰烷-⼄醇双液系的⽓-液平衡相图。
⼆、实验原理两种液态的物质混合⽽成的⼆组分体系称为双液系。
它可以分为完全互溶和部分互溶的双液系。
体系的沸点不仅与外压有关,⽽且与双液系的组成有关。
在恒压下做温度T对组成x的关系图即为T-x图。
由相律可知,对于双液系在恒压下⽓-液两相共存区域中,⾃由度为1。
当温度⼀定时,⽓-液两相的相对组成也就有了确定值。
根据杠杆原理,两相的相对量也确定了。
因此实验测定⼀系列不同组成的双液系溶液的⽓-液相平衡时的沸点及此时⽓相和液相的组成,即可得T-x图。
因此双液系⽓-液平衡相图实验主体上包括⼀系列混合体系的沸点测定和⽓-液相组成分析两个主要内容。
体系的沸点可⽤沸点仪测定的,其构造如图7.2所⽰。
采⽤电热丝直接加热溶液,以防⽌过热现象,同时该沸点仪⽤平衡蒸馏法分离⽓液两相,具有可便于取样分析及避免分馏等优点。
体系的⽓液相组成的分析是相图绘制的另⼀核⼼,可以根据待测体系的理化性质寻找多种合适的分析⽅法。
以完全互溶双液系环⼰烷-⼄醇体系为例。
由于环⼰烷和⼄醇两者的折光率相差较⼤,因此本实验可采⽤测定溶液折光率⽅法来确定两组分的组成,⽤阿贝折光仪测定两组分组成的折光率,可以测出折光率对组成的⼯作曲线,根据测得液体样品的折光率,从⼯作曲线上可查得两相的组成。
三、仪器与药品FDY双液系沸点测定仪,阿贝折光仪,超级恒温槽,长滴管,烧杯(50 ml,250 ml),具塞锥形瓶(10ml),刻度移液管(5ml)丙酮(AR级);环⼰烷(AR级);⼄醇(AR级)图7-1 FDY双液系沸点测定仪前⾯板⽰意图图7-1是沸点仪加热控制器的前⾯板⽰意图,各功能键的说明如下:1、电源开关2、加热电源调节——调节所需的加热电源。
3、温度显⽰窗⼝——显⽰所测温度值。
双液系气液平衡相图实验报告

竭诚为您提供优质文档/双击可除双液系气液平衡相图实验报告篇一:双液系气—液平衡相图绘制实验报告双液系气—液平衡相图绘制实验目的:①用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。
找出恒沸点混合物的组成及恒沸点的温度。
②掌握测定双组分液体的沸点及正常沸点的测定方法。
③了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。
实验原理:液体的沸点是液体饱和蒸气压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
理想的二组分体系在全部浓度范围内符合拉乌尔定律。
结构相似,性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T-x(y)图。
大多数情况下,曲线将出现或正或负的偏差。
当这一偏差足够大时,在T-x(y)曲线上将出现极大点(负偏差)或极小点(正偏差)。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。
考虑综合因素,实验选择具有最低恒沸点的乙醇—乙酸乙酯双液系。
根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1.当温度一定时,则气液两相的组成也随之而定。
当气液两相的相对量一定,则体系的温度也随之而定。
沸点测定仪就是根据这一原理设计的,它利用回流的方法保持气液两相相对量一定,测量体系温度不发生改变时,即两相平衡后,取两相的样品,用阿贝折射计测定气液平衡气相、液相的折射率,再通过预先测定的折射率—组成工作曲线来确定平衡时气相、液相的组成(即该温度下气液两相平衡成分的坐标点。
)改变体系总成分,再如上法找出另一对坐标点。
这样得若干对坐标点后,分别按气相点和液相点连成气相线和液相线,即得T-x平衡图。
仪器与试剂:沸点仪一套调压变压器一台阿贝折射计一台超级恒温槽1/10温度计(50~100℃)一支1/10温度计(0~50℃)一支小烧杯一个小试管(5ml带软木塞)(若干)吸管2支红外线干燥箱(风筒)一台搽镜纸乙酸乙酯(AR)无水乙醇(AR)不同配比的乙醇—乙酸乙酯混合液丙酮(c、p)重蒸水实验步骤:(1)、乙醇—乙酸乙酯溶液的折射率组成工作曲线的测绘①折射率—体积分数工作曲线。
双液系的气液平衡相图实验报告

双液系的气液平衡相图实验报告一、实验目的1、测定常压下环己烷乙醇双液系的气液平衡相图。
2、掌握阿贝折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
本实验研究的是完全互溶双液系。
在一定温度下,溶液的气液两相达到平衡时,气相组成和液相组成之间存在一定的关系。
通过测定不同组成溶液的沸点和气、液相组成,绘制出沸点组成图(Tx 图),即可得到双液系的气液平衡相图。
通常,实验中通过测定溶液的折射率来确定其组成。
因为折射率与溶液的组成有一定的对应关系。
三、实验仪器和试剂1、仪器沸点仪阿贝折射仪超级恒温槽调压变压器温度计(50℃~100℃,分度值 01℃)移液管(1mL、2mL、5mL)洗耳球2、试剂环己烷(分析纯)无水乙醇(分析纯)四、实验步骤1、安装仪器将沸点仪洗净、烘干,安装好。
检查带有温度计的胶塞是否紧密,电热丝要靠近烧瓶底部的中心。
将阿贝折射仪与超级恒温槽连接好,调节恒温槽温度至 25℃。
2、配制溶液用移液管分别移取 05mL、10mL、15mL、20mL、25mL、30mL、35mL、40mL、45mL 乙醇于 10 个干燥的容量瓶中,再用环己烷分别稀释至刻度,摇匀,配制成一系列不同组成的环己烷乙醇溶液。
3、测定折射率用阿贝折射仪分别测定所配溶液及纯环己烷、纯乙醇的折射率。
测定时,用擦镜纸将棱镜擦净,滴加 2~3 滴待测液于棱镜上,合上棱镜并拧紧,调节反光镜使目镜内视场明亮,旋转棱镜调节旋钮,使目镜中出现明暗分界线,读取折射率。
每个样品测量三次,取平均值。
4、测定沸点向沸点仪中加入 20mL 乙醇含量较少的待测溶液,接通冷凝水。
调节调压变压器,缓慢加热溶液,当液体沸腾后,调节电压使液体沸腾稳定,待温度计读数稳定后,记录沸点温度。
停止加热,用吸管从小槽中吸取气相冷凝液,用阿贝折射仪测定其折射率。
再从侧管中吸取少量液相,测定其折射率。
双液系的气液平衡相图实验报告

双液系的气液平衡相图实验报告双液系的气液平衡相图实验报告一、引言在化学实验中,相图是研究物质在不同温度和压力下的相态变化规律的重要工具。
气液平衡相图是指在一定温度和压力下,气体和液体之间的平衡状态。
本实验旨在通过测定双液系的气液平衡相图,探究不同组分和温度对气液平衡的影响。
二、实验方法1. 实验仪器和试剂准备本实验所需的仪器有气相色谱仪、恒温水浴槽、压力计等。
试剂包括乙醇、水等。
2. 实验步骤(1) 准备双液系溶液:按照一定的比例将乙醇和水混合制备双液系溶液。
(2) 装填样品:将双液系溶液装填到气相色谱仪的样品瓶中。
(3) 设置温度:将恒温水浴槽的温度调至所需的实验温度。
(4) 测定平衡压力:将样品瓶放入恒温水浴槽中,等待一段时间使系统达到平衡,然后使用压力计测定平衡时的压力。
(5) 重复实验:重复以上步骤,测定不同组分和温度下的气液平衡压力。
三、实验结果根据实验数据,我们绘制了双液系的气液平衡相图。
图中横轴表示乙醇的摩尔分数,纵轴表示平衡时的压力。
我们可以观察到随着乙醇浓度的增加,平衡压力逐渐增大。
同时,随着温度的升高,平衡压力也呈现出上升的趋势。
这与理论预期相符。
四、讨论与分析通过实验结果,我们可以得出以下几点结论:1. 组分对气液平衡的影响:在双液系中,乙醇的浓度增加会导致平衡压力增加。
这是因为乙醇分子与水分子之间的相互作用力较强,使得乙醇分子更难从液相转移到气相,因而需要更高的压力才能达到平衡。
2. 温度对气液平衡的影响:随着温度的升高,气液平衡的压力也会增加。
这是由于温度升高会增加分子的热运动,使得气体分子更容易从液相转移到气相,因此需要更高的压力来保持平衡。
3. 实验误差分析:在实验过程中,由于仪器的精度限制和操作误差等因素的存在,实验结果可能存在一定的误差。
为了提高实验结果的准确性,我们可以增加重复实验次数,并进行数据的平均处理。
五、结论通过本实验,我们成功测定了双液系的气液平衡相图,并探究了组分和温度对气液平衡的影响。
实验七十五双液系的气液平衡相图实验报告

实验七十五双液系的气液平衡相图实验报告八、结果分析及问题讨论1、在该实验中,测定工作曲线时折光率的恒温温度与测定样品时折光率的恒温温度是否需要保持一致为什么答:两者的恒温温度需要保持一致,因为在不同温度时测得的折射率是不一样的。
2、在实验中,样品的加入量应十分精确吗为什么答:样品的加入量不需要十分精确。
因为每一组中气液相的浓度均是由测得的折射率在标准曲线上读得的。
3、为什么工业上常生产95%酒精只用精馏含水酒精的方法是否可能获得无水酒精答:因为蒸馏酒精时,酒精-水这个系统生成一个最低恒温混合物,蒸馏所得的产物只能是95%的酒精。
不可能只用精馏含水酒精的方法获得无水酒精,它是一个恒沸混合物,在沸点时蒸出的仍是同样比例的组分。
工业上常在此基础上加入一定的苯,再进行蒸馏。
4、试估计哪些因素是本实验的误差主要来源答:给双液系加热而产生的液相的组成并不固定,而且加热的时间长短并不固定,因此使测定的折射率产生误差;温度计的位置并不固定,测得的温度有差异;测量过程中取液后停留的时间不一样,气体的挥发程度不一样,导致的测量误差;还有不同的人观测时分辨颜色的程度不一样,同一个人在不同的环境下读的值也不一样,导致的读数误差5、试设计其它方法用以测定气、液两相组成,并讨论其优缺点。
答:组成测定。
可用相对密度或其他方法测定,但折光率的测定快速简单,特别是需要样品少,但为了减少误差,通常重复测定三次。
当样品的折光率随组分变化率较小时,此法测量误差较大。
6、讨论压力-组成相图和温度-组成相图的关系。
答:通常用几何作图的方法将双液系的沸点对其气相,液相组成作图,所的图形成为双液系温度-组成相图,而在一定温度下绘制的就为压力-组成相图。
7、为什么沸点测定仪的电流要经过变压器和粗导线通过浸于溶液中的电热丝答:这样既可以减少溶液沸腾时的过热现象,还能防止暴沸。
8、本实验选用环己烷和乙醇的原因答:因为两者折光率相差颇大,而折光率测定又只需要少量样品,所以,可以用折光—组成工作曲线来测定平衡体系的两相组成。
物化实验报告双液系气液平衡相图绘制

双液系气液平衡相图的绘制(物化实验得认真做)一、实验目的1。
用回流冷凝法测定沸点是气相和液相的组成,绘制双液系相图.2找出恒沸点混合物的组成和恒沸点的温度。
掌握测定双组分液体的沸点及正常沸点的测定方法。
3了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法.二、实验原理1液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关.2大多数情况下,T—x曲线将出现或正或负的偏差,当这个偏差足够大的时候,在曲线上将出现极大点或极小点。
这种极大点或者极小点就称为恒沸点.3考虑综合因素,实验选择具有最低恒沸点的乙醇—乙酸乙酯双液系。
4根据相平衡原理,对两组分体系,当压力恒定时,在气液平衡两相去,体系的自由度为1.若温度一定时,则气液两相的组成也随之而定。
当原溶液的组成一定时,根据杠杆原理,两相的相对量一定.反之,实验中利用回流的方法保持气液两相相对量一定,测量体系温度不发生改变时,即两相平衡后,取出两相的样品,用阿贝折射计测定气相、液相的折射率,再通过预先测定的折射率-组成工作曲线来确定平衡时气相、液相的组成(即该温度下气液两相平衡成分的坐标点).改变体系的总成分,再如上法找出另一对坐标点。
这样得若干对坐标点分别按气相点和液相点连成气相线和液相线,即得T-x平衡图。
三、实验仪器和试剂1、实验仪器沸点仪、阿贝折射仪、调压变压器、温度计两只、干燥小烧杯3只,干燥5ml小试管16只,软木塞若干,擦镜纸2、实验试剂无水乙醇(AR)乙酸乙酯(AR)丙酮(C.P)乙醇体积分数为5%、10%、15%、22%、38%、50%、70%、90%组成的乙醇-乙酸乙酯溶液。
四、实验过程1、将干燥的沸点仪安装好。
从侧管加入约20mL5%混合液于蒸馏瓶内,并使温度计浸入液体内。
冷凝管接通冷凝水。
将稳流电源电压调至13V左右,使加热丝将液体加热至缓慢沸腾。
物化实验报告 双液系的气液平衡相图

USTC 3 系 摘要:水和正丙醇的完全互溶溶液,当组成不同时其沸点和气相、液相的成分也不同。本实 验通过测量不同组成下的水和正丙醇的溶液在沸点时气相和液相的折射率, 由正丙醇-水溶 液折光率与组成工作曲线可查出对应折射率的组分。 由于温度测量存在误差, 实验中对测量 温度计进行露茎校正和压力校正。由实验结果便可作出水-正丙醇的气液平衡相图。 关键词 :沸点 折射率 温度校正 气液平衡相图。
沸点仪的设计虽各有异,但其设计思想都集中在 如何正确地测定沸点和气液相的组成,以及防止过热 和避免分馏等方面。我们所使用的沸点仪如图 5-4 所 示: 这是一只带有回流冷凝管的长颈圆底烧瓶,冷凝 管底部有一球形小室 D,用以收集冷凝下来的汽相样 品。液相样品则通过烧瓶上的支管 L 抽取,图中 E 是 一根用 300W 的电炉丝截制而成的电加热丝,直接浸 入溶液中加热,以减少溶液沸腾时的过热暴沸现象。 温度计安装时须注意使水银球一半浸在液面下,一半 露在蒸气中,并在水银球外围套一小玻璃管 C,这样, 溶液沸腾时,在气泡的带动下,使气液不断喷向水银 球而自玻璃管上端溢出;小玻璃管 C 还可减少沸点周 围环境(如空气流动或其它热源的辐射)对温度计读 数可能引起的波动,因此这样测得的温度就能较好地 代表气液两相的平衡温度。 分析平衡时气相和液相的组成,须正确取得气相 和液相样品。沸点仪中蒸气的分馏作用会影响气相的 图 5-4 沸点仪 平衡组成,使取得的气相样品的组成与气液平衡时的 A-盛液容器; B-测量温度计; 组成产生偏差,因此要减少气相的分馏作用。本实验 C-小玻管; D-小球; E-电热丝 中所用沸点仪是将平衡时的蒸气凝聚在小球 D 内,在 F-冷凝管; G-温度计; L-支管 容器 A 中的溶液不会溅入小球 D 的前提下,尽量缩短 小球 D 与大球 A 的距离,为防止分馏,尽量减少小球 D 的体积即可达此目的。为了加速达 到体系的平衡,可把 D 球中最初冷凝的液体倾回到容器 A 中。 沸点的测定 用玻璃水银温度计测量溶液的沸点,如图 5-5,固定在沸点仪上的水银温度计是全浸式 的,使用时除了要对温度计的零点和刻度误差等因素进行校正外,还应作露茎校正。这是由 于温度计未能完全置于被测体系中而引起的。 根据玻璃与水银膨胀系数的差异, 校正值的计 算式为: t 露/℃=1.610-4·n·(t 观-t 环) 校正的方法是在测量沸点的温度计 B 旁再固定一支同样精度的温度计 G, G 的水银球底 部应置于测量温度计沸点稳定值至固定温度计橡皮塞露出那一段水银柱的中部。 读沸点时同 时读取温度计 G 上的读数,得到温度 t 观和 t 环。在测量过程中,由于组成的变动,t 观也在变 动,因此温度计 G 的位置也应随着沸点稳定值而进行调整,始终让其置于温度计 B 露出水 银柱的中部。式中的 n 是露出那段水银柱的长。1.610-4 是水银对玻璃的相对膨胀系数。 沸点除了要进行露茎校正外,还需要进行压力校正。标准大气压下( P=760mmHg 或 101325Pa)测得的沸点为正常沸点。实际测量时,压力一般都不恰好为标准大气压。应用特 鲁顿规则及克劳修斯-克拉贝龙公式,可得溶液沸点随大气压变动而变动的近似值:
双液系的气液平衡相图-物化实验报告
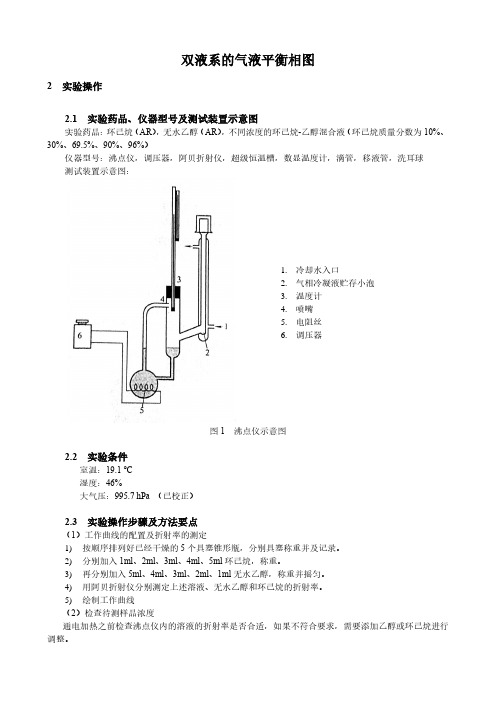
双液系的气液平衡相图2 实验操作2.1 实验药品、仪器型号及测试装置示意图实验药品:环己烷(AR),无水乙醇(AR),不同浓度的环己烷-乙醇混合液(环己烷质量分数为10%、30%、69.5%、90%、96%)仪器型号:沸点仪,调压器,阿贝折射仪,超级恒温槽,数显温度计,滴管,移液管,洗耳球测试装置示意图:1.冷却水入口2.气相冷凝液贮存小泡3.温度计4.喷嘴5.电阻丝6.调压器图1 沸点仪示意图2.2 实验条件室温:19.1 ℃湿度:46%大气压:995.7 hPa (已校正)2.3 实验操作步骤及方法要点(1)工作曲线的配置及折射率的测定1)按顺序排列好已经干燥的5个具塞锥形瓶,分别具塞称重并及记录。
2)分别加入1ml、2ml、3ml、4ml、5ml环己烷,称重。
3)再分别加入5ml、4ml、3ml、2ml、1ml无水乙醇,称重并摇匀。
4)用阿贝折射仪分别测定上述溶液、无水乙醇和环己烷的折射率。
5)绘制工作曲线(2)检查待测样品浓度通电加热之前检查沸点仪内的溶液的折射率是否合适,如果不符合要求,需要添加乙醇或环己烷进行调整。
(3)测定各溶液达到汽液平衡时的气相和液相组成打开冷却水,接通电源,慢慢调节调压器电压进行加热,直到溶液沸腾或者出现小气泡,再将电压调到33V。
待温度恒定后,记下该温度值,关电压,停止加热,同时用长滴管从冷凝管上口在小泡中取气相冷凝液,迅速测定折射率,液相溶液稍冷后,从温度计口取液相溶液测定折射率(沸腾过程已经使液相混合比较均匀了,类似“鼓泡法”;而且实际上也没有地方伸入滴管进行搅拌)。
如果沸点仪圆底烧瓶内液体快要蒸干了、电阻丝没有浸泡在液体中,就要及时补充溶液,否则体系内温度会急剧上升。
如果液面低于烧瓶侧面支管口,应及时补充液体,否则无法取液相溶液。
补充溶液时,要等到体系冷却下来。
3 结果与讨论3.1 原始实验数据表1 环己烷-乙醇混合液(标准液)的折射率序号空瓶质量/g瓶+乙醇质量/g瓶+混合液质量/g折射率129.932130.624634.4739 1.3701231.016832.487935.5774 1.3810331.169233.423335.6596 1.3926427.875530.927732.4152 1.4040528.387232.241132.9446 1.41696无水乙醇 1.36387纯环己烷 1.4284表2 环己烷-乙醇混合液(待测液)沸点及气相、液相的折射率序号环己烷质量分数温度/℃气相冷凝液折射率液相折射率1077.56 1.3638 1.3634210%75.63 1.3704 1.3654330%73.16 1.3825 1.3668469.50%64.42 1.3978 1.3817590%64.65 1.4072 1.4162696%67.26 1.4108 1.42417100%80.13 1.4278 1.4272 3.2计算的数据、结果(1)绘制折射率-组成工作曲线根据表1数据计算出各个标准溶液对应的环己烷质量分数,如表3。
双液系的气-液平衡相图

双液系的气-液平衡相图1.实验目的①掌握采取阿贝折光仪确定二元液体组成的方法;②掌握测定双组份液体的沸点及正常沸点的方法;③绘制在恒压下环己烷-乙醇双液系的气-液平衡相图。
2.实验原理①双液系:两种液态物质混合而成的二组分体系。
其沸点不仅与外压有关,还与双液系的组成有关;②本实验测定一系列不同组成的双液系溶液的气液相平衡时的沸点及此时的气、液相的组成,利用回流及分析的方法来绘制相图,即的T-x图。
主体包括一系列混合体系的沸点测定和气-液相组成分析两个主要内容。
③沸点仪:采用电热丝直接加热溶液,以防过热现象,同时FDY双液系沸点仪用平衡蒸馏法分离气液两相,具有可便于取样分析及避免分馏等优点。
构造如图:④阿贝折光仪使用步骤:将超级恒温槽调到测定所需之温度,并将此恒温水通入阿贝折光仪的两棱镜恒温夹套中,检查棱镜上的温度计读数;阿贝折光仪至于光亮处,调节反射镜,使白光进入棱镜;打开棱镜,滴1-2滴丙酮在镜面上,将棱镜轻轻合上,校正;测量时,用滴管取待测试样,滴在两棱镜间的缝隙间,旋紧锁钮,使被测液均匀覆盖于两棱镜间镜面上,不可有气泡;转棱镜使目镜中看到半明半暗现象,让明暗界线落在目镜里交叉法线的交点上,如有色散现象,调节消色补偿器使色散消失;简单表示为:安装-加样-对光-下旋钮粗调明暗面-上旋钮细调消色散-读数。
3.实验仪器与试剂FDY双液系沸点测定仪、阿贝折光仪、超级恒温槽、长滴管、烧杯、球形冷凝管、移液管,烧瓶丙酮(AR级)、环己烷(AR级)、乙醇(AR级)4.实验步骤①调节阿贝折光仪超级恒温槽温度为25℃,启动恒温水循环;②配制系列环己烷-乙醇溶液,环己烷与乙醇的体积比分别为5:95、15:85、25:75、35:65、45:55、50:50、55:45、65:35、85:15、95:5;③环己烷-乙醇溶液的组成——折光率曲线的测定:10ml具塞锥形瓶中采用称量法配制环己烷摩尔分数为0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90的环己烷-乙醇标准溶液;调节水浴温度,分别测定上述9个溶液及乙醇和环己烷的折光率,作出工作曲线图;注意:称量尽可能迅速;使用仪器时须对零点校正;测量前须用丙酮洗涤棱镜;④环己烷-乙醇二组分溶液的气液平衡数据测定:连接好实验装置,传感器勿与加热丝接触;接通冷凝水,从侧管向蒸馏瓶中二组分溶液,传感器与加热丝浸入溶液。
双液系的气液平衡相图实验报告

双液系的气液平衡相图实验报告气液平衡相图是描述气体和液体在一定温度和压力下的平衡状态的图表,通过实验测定得到的数据可以绘制出相应的相图。
本实验旨在通过实验测定的数据,绘制出双液系的气液平衡相图,并对实验结果进行分析和讨论。
实验仪器和试剂。
实验中所使用的仪器包括压力计、温度计、烧瓶、试管等。
实验所需试剂为乙醇和水。
实验步骤。
1. 首先在烧瓶中加入一定量的水,并在试管中加入一定量的乙醇。
2. 将烧瓶和试管放入恒温水浴中,使其达到所需的温度。
3. 在一定时间间隔内,记录烧瓶内乙醇蒸气的压力和温度。
4. 根据实验数据,绘制出乙醇和水的气液平衡相图。
实验结果与分析。
通过实验测定得到的数据,我们成功绘制出了乙醇和水的气液平衡相图。
从实验结果可以看出,在一定温度下,乙醇和水的气液平衡曲线呈现出一定的规律性,随着温度的升高,气液平衡曲线也相应发生变化。
在实验过程中,我们还发现了一些异常现象,如在某些温度下,乙醇的蒸气压远大于预期值,经过分析发现可能是实验条件或者实验操作上的一些误差所致。
这些异常现象也为我们提供了更多的实验数据,有助于完善气液平衡相图的绘制。
结论。
通过本次实验,我们成功绘制出了乙醇和水的气液平衡相图,并对实验结果进行了分析和讨论。
实验结果表明,在一定温度和压力下,乙醇和水的气液平衡状态呈现出一定的规律性,同时也发现了一些异常现象,这为我们提供了更多的实验数据,有助于完善气液平衡相图的绘制。
总之,本次实验为我们提供了更深入的了解气液平衡相图的机会,并通过实验数据的分析,加深了我们对气液平衡相图的认识,为今后的研究和实验提供了重要的参考依据。
以上就是本次实验的实验报告,谢谢阅读。
双液系气—液平衡相图绘制实验报告

双液系气—液平衡相图绘制实验目的:①用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。
找出恒沸点混合物的组成及恒沸点的温度。
②掌握测定双组分液体的沸点及正常沸点的测定方法。
③了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。
实验原理:液体的沸点是液体饱和蒸气压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
理想的二组分体系在全部浓度范围内符合拉乌尔定律。
结构相似,性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T-x(y)图。
大多数情况下,曲线将出现或正或负的偏差。
当这一偏差足够大时,在T-x(y)曲线上将出现极大点(负偏差)或极小点(正偏差)。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。
考虑综合因素,实验选择具有最低恒沸点的乙醇—乙酸乙酯双液系。
根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1.当温度一定时,则气液两相的组成也随之而定。
当气液两相的相对量一定,则体系的温度也随之而定。
沸点测定仪就是根据这一原理设计的,它利用回流的方法保持气液两相相对量一定,测量体系温度不发生改变时,即两相平衡后,取两相的样品,用阿贝折射计测定气液平衡气相、液相的折射率,再通过预先测定的折射率—组成工作曲线来确定平衡时气相、液相的组成(即该温度下气液两相平衡成分的坐标点。
)改变体系总成分,再如上法找出另一对坐标点。
这样得若干对坐标点后,分别按气相点和液相点连成气相线和液相线,即得T-x 平衡图。
仪器与试剂:沸点仪 一套 调压变压器 一台阿贝折射计 一台 超级恒温槽1/10温度计(50~100℃) 一支 1/10温度计(0~50℃) 一支 小烧杯 一个 小试管(5ml 带软木塞) (若干) 吸管 2支 红外线干燥箱(风筒) 一台 搽镜纸 乙酸乙酯(AR )无水乙醇(AR ) 不同配比的乙醇—乙酸乙酯混合液 丙酮(C 、P) 重蒸水实验步骤:(1)、乙醇—乙酸乙酯溶液的折射率组成工作曲线的测绘①折射率—体积分数工作曲线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双液系的气-液平衡相图
一实验目的
1.绘制在pθ下环己烷-异丙醇双液系的气-液平衡相图,了解相图和相律的基本概念;
2.掌握测定双组分液体的沸点及正常沸点的方法;
3.掌握用折光率确定二元液体组成的方法。
二实验原理
在常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例互溶,则称完全互溶双液体系,若只能部分互溶,则称部分互溶双液体系。
液体的沸点是指液体的蒸汽压与外界压力相等时的温度,在一定的外压下,纯液体的沸点有其特定值,但双液系的沸点不仅与外压有关而且还与两种液体的相对含量有关。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图中于 (a)。
而实际溶液由于A 和B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图2-4-1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验是用回流冷凝法测定环已烷—异丙醇体系的沸点—组成图。
其方法是用阿贝折射仪测定不同组成的体系,在沸点温度时气、
液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制沸点—组成图。
三仪器和试剂
沸点仪1套;恒温槽1台;阿贝折射仪1台;量筒8个;玻璃漏斗8个;滴管2个;环己烷(分析纯);异丙醇(分析纯);
实验装置如下:
四实验步骤
1.工作曲线的绘制
配制环己烷的质量百分数0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70, 0.80和0.90的环己烷-异丙醇溶液。
计算所需环己烷和异丙醇的质量,并用分析天平准确称取。
为避免样品挥发带来的误差,称量应尽可能的迅速。
各种溶液的确切组成要按照实际称样结果精确计算。
调节超级恒温水浴的温度为35度,使阿贝折光仪上温度与其保持一致。
分别测定上述九个溶液以及异丙醇和环己烷的折光率。
根据这些数据作出折光率-组成工作曲线。
2.安装沸点仪
将已洗净且干燥的沸点仪安装好,检查塞有温度计的塞子是否塞好,电热丝要靠近烧瓶底部的中心。
3.测定异丙醇的沸点
借助玻璃漏斗由支管加入异丙醇使电热丝能完全浸没于溶液中,打开冷却水,接通电源。
用调压变压器由零开始逐渐加大电压(15V 左右),使溶液缓慢加热。
液体沸腾后,再调节电压和冷却水的流量,使蒸汽再冷凝管中回流的高度保持在1.5cm左右。
待温度稳定后维持3分钟左右使体系达到平衡。
在此过程中,不时将小球中凝集的液体倾入烧瓶。
记下此时温度。
4.取样并测量
切断电源,停止加热。
用冰水使体系迅速冷却,同时恒温槽温度设置在35度。
用干燥的滴管自冷凝管口伸入小球,吸取冷凝液,滴在折光仪毛玻璃上进行测定,记下折光率。
用擦镜纸擦干毛玻璃,用另一支滴管吸取圆底烧瓶内的溶液,滴在折光仪的毛玻璃上进行测定,记下折光率。
最后将溶液倒入指定的储液瓶中。
5.系列环己烷-异丙醇溶液的测定
按上述所述步骤逐一分别测定各溶液的沸点及两相的样品的折光率,且按照环己烷的摩尔分数有小到大的测量。
五注意事项
1. 沸点仪没加液体,不得加热,防止电热丝烧断。
2.测试样品前一定要断电,用自来水冷却半分钟,然后用抹布擦干。
防止水进入试样。
取
气相液滴需要垂直,做完后试样倒回原瓶,不要倒错,重做下一个。
3.低压直流电14伏。
4.滴管一定要干燥,用吹风机吹干。
5.滴水后,调下旋钮有色彩,调上旋钮消色散。
调明暗界限恰好通
过十字线交点。
(蒸馏水n D20=1.3331)
6.读数镜筒太暗,可调旁边窗口盖成45o角。
7.在每一份样品的蒸馏过程中,由于整个体系的成分不可能保持恒定,因此平衡温度会略有变化,特别是当溶液中两种组成的量相差较
大时,变化更为明显。
为此每加入一次样品后,只要待溶液沸腾,正常回流1min~2min后,即可取样测定,不宜等待时间过长
8.每次取样量不宜过多,取样时滴管一定要干燥,不能留有上次的残液,气相取样口的残液亦要擦干净。
9.整个实验过程中,通过折射仪的水温要恒定,使用折射仪时,棱镜不能触及硬物(如滴管),擦拭棱镜用擦镜纸。
六数据处理
1.折光率-组成工作曲线的绘制
1.将实验中测得的沸点—折射率数据列表,并从已经做好的工作曲线上查得相应的组成,从而获得沸点与组成的关系。
2.依照上面的表格绘制沸点-组成图,并标明最低恒沸点及其组成
从图中可以看出:最低恒沸点为:68度.组成为环己烷约为0.609.异丙醇约为0.391.
七思考题
1.操作步骤中,在加入不同数量的各组分时,如发生了微小的偏差,对相图的绘制有无影响?为什么?
答:加入各组分时,如发生了微小的偏差,对相图的绘制无影响,因为最终液体的组成是通过对折光率的测定,在工作曲线上得出,所以无影响。
2.折射率的测定为什么要在恒定温度下进行?
答:因为折射率与温度有关,所以在测量时要在两棱镜的周围夹套内通入恒温水,保持恒温。
3.对应某一组成测定沸点及气相冷凝液和液相折射率,如因某中原因缺少其中某一个数据,应如何处理?它对相图的绘制是否有影响?答:沸点的数据不能少,其它可以少。
对于缺少的数据,可由它们的趋势找出其它点。
4.由所得相图,讨论某一组成的溶液在简单蒸馏中的分离情况?
答:若组成在0~x之间,蒸馏会得到A和C;若组成在x~1之间,蒸馏将会得到C和B。
若组成为x,则蒸馏只会得到恒沸混合物C。
5.双液系溶液的沸点有哪两个特点?
答:(1)沸点不仅与外压有关,而且与双液系的物质组成有关;
(2)在一般情况下,双液系的气相组成与液相组成并不相同。
6.恒沸点指什么?是什么因素引起来的?
答:在T-X相图上有温度互溶最高点或者最低点,并且此点的气相组成与液相组成相同,现象上表现为溶液中溶剂的蒸汽压与组成的关系偏离拉乌尔定律,内在的看,是溶液中的分子间结构和相互作用与纯物质态时同种分之间的情况不同。
