2019版高考化学一轮复习第五章物质结构元素周期律章末检测
高三第一轮复习《物质结构 元素周期律》单元测试

高三第一轮复习《物质结构元素周期律》单元测试姓名学号相对原子质量:H-1 C-12 O-16 Mg-24 K-39 Ca-40 Ba-137一、选择题(共42分)1、2012年3月修订的《环境空气质量标准》中新纳入的强制监测指标是()A.PM2.5B.NOx C.SO2D.可吸入颗粒物2、铋元素可表示为83Bi,在元素周期表中相对原子质量标示为209.0,下列说法正确的是()A.Bi元素的质量数是209B.Bi元素最高价氧化物的化学式为Bi2O3C.Bi元素位于元素周期表第六周期第ⅤA族D.Bi原子最高价氧化物的水化物酸性比硝酸的要强3、下列关于化学键的叙述,正确的一项是()A.离子化合物中一定含有离子键B.单质分子中均不存在化学键C.全部由非金属元素组成的化合物一定是共价化合物D.含有极性共价键的化合物一定是共价化合物4、下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。
向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl===2KCl+5Cl2↑+2MnCl2+8H2O522===22下列说法正确的是()A.SO2只是氧化产物B.CuFeS2仅作还原剂,硫元素被氧化C.每生成1 molCu2S,有4mol硫被氧化D.每转移1.2 mol电子,有0.2 mol硫被氧化6、已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性的强于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。
下列说法正确的是A.X、Y、Z、W的原子半径依次减小B.W与X形成的化合物中只含离子键C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W37、PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是()A.1:2混合的PbO2、Pb3O4B.1:1混合的Pb3O4、PbOC.1:4:1混合的PbO2、Pb3O4、PbOD.1:1:3混合的PbO2、Pb3O4、PbO二、非选择题(共58分)8、(共15分)2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。
(通用版)2019版高考化学一轮复习 第五章 物质结构 元素周期律学案

第五章 物质结构 元素周期律第一节原子结构__化学键教材复习——打牢基础,基稳才能楼高1.构成原子的微粒及作用原子(A ZX)⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子Z 个——决定元素的种类中子A —Z 个]在质子数确定后决定原子种类同位素核外电子Z 个——最外层电子数决定元素的化学性质2.原子(离子)中构成微粒之间的等量关系 (1)原子中:质子数(Z )=核电荷数=核外电子数; (2)原子核中:质量数(A )=质子数(Z )+中子数(N ); (3)阳离子:核外电子数=质子数-阳离子所带的电荷数; (4)阴离子:核外电子数=质子数+阴离子所带的电荷数。
3.符号中各数字的含义微点拨(1)并不是所有微粒均会有中子和电子。
有的微粒不一定有中子,如定有电子,如(2)质子数相同的微粒不一定属于同一种元素,如 (1)“三素”概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用微点拨(1)同位素的“六同三不同”同位素之间的转化,不是化学变化,是核反应。
同位素是指同一元素的不同“原子”间的关系,同素异形体是指同一元素的不同[对点练习]1.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。
下列有关48Ti和50Ti的说法正确的是( )A.48Ti和50Ti的质子数相同,互称同位素B.48Ti和50Ti的质量数不同,属于两种元素C.48Ti和50Ti的质子数相同,是同一种核素D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体解析:选A 48Ti和50Ti的质子数相同,中子数不同,是Ti元素的不同核素,互称同位素,A正确。
2.(2017·海南高考)下列分子中,其中子总数为24的是( )A .18O 3 B .2H 172O 2 C .14N 16O 2D .14C 16O 2解析:选D18O 3中含有的中子总数为(18-8)×3=30,故A 错误;2H 172O 2中含有的中子数为(2×1+2×9)=20,故B 错误;14N 16O 2中含有的中子数为7+2×8=23,故C 错误;14C 16O 2中含有的中子数为8+2×8=24,故D 正确。
化学一轮复习第五章物质结构与元素周期律微考点45“三根据”破解元素推断练习

微考点45 “三根据"破解元素推断题型一根据原子结构推断1.(2019·天津市模拟)已知a、b、c、d、e是短周期中原子序数依次增大的5种主族元素,其中a、b同主族,b、c、d、e 同周期,b的核外电子数为c的错误!,d的最外层电子数为c、e 最外层电子数之和的一半。
下列说法正确的是()A.a、b能形成离子化合物,且a离子半径小于b离子半径B.a、d能形成离子化合物da5,与水反应可产生两种气体C.c、d的简单氢化物中只有d溶于水,其水溶液呈酸性D.e形成的两种氢化物中所有化学键种类完全相同2.(2020·淮安质检)W、X、Y、Z为原子序数依次增大的短周期主族元素,W的原子核外只有6个电子,X+和Y3+的电子层结构相同,Z-的电子数比Y3+多8个,下列叙述正确的是()A.W在自然界只有一种核素B.半径大小:X+>Y3+>Z-C.Y与Z形成的化合物的水溶液呈弱酸性D.X的最高价氧化物对应的水化物为弱碱3.X、Y、Z、W、R是原子序数依次增大的五种短周期元素.X 原子的最外层电子数为最内层电子数的2倍.Y与X是同周期元素,XY2可用于灭火。
简单阳离子Z+、W2+具有相同的电子层结构.R是同周期中原子半径最小的主族元素。
下列有关说法正确的是()A.XY2中各原子都达到8电子稳定结构B.Z、W分别与Y形成的常见化合物均为碱性氧化物C.Y、Z、R三种元素形成的化合物一定能发生水解反应D.离子半径的大小顺序为Z+>W2+>Y2-题型二根据周期表“片断结构”推断4.(2019·南京三模)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法错误的是()A.单核阴离子的还原性Y强于XB.W的气态氢化物与其最高价含氧酸反应生成离子化合物C.X、Y、Z最简单氢化物中稳定性最弱的是YD.在元素周期表中118号元素与Z位于同一主族5.已知:X、Y、Z、W为短周期元素,原子半径依次为X:99pm Y:154pm Z:125pm W:117pm,X、Y、W在元素周期表中的相对位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互之间能两两反应.下列说法正确的是()A.元素Z处于周期表的阴影位置B.非金属性:X〈WC.X与W形成的化合物为离子化合物D.Y、W的最高价氧化物对应的水化物能相互反应6.(2019·济南高三模拟)W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X 比Y多一个但比Z少一个,原子的电子层数X比Y、Z少一层。
(全国通用)2019版高考化学一轮复习第5章物质结构元素周期律第3节化学键学案.doc
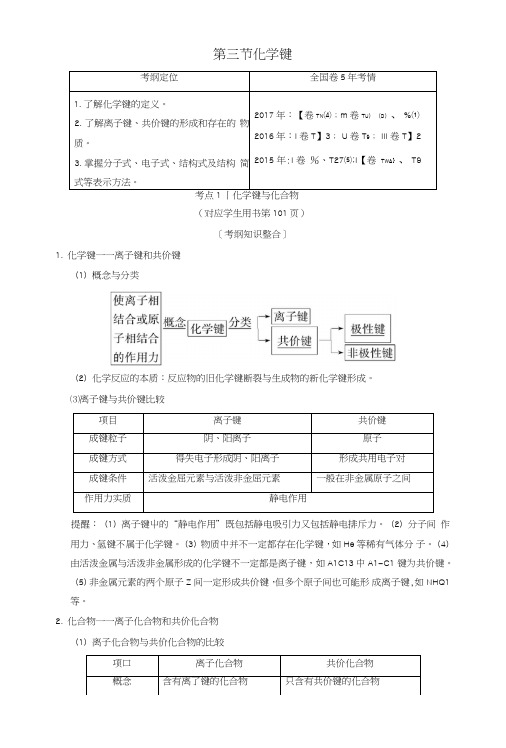
第三节化学键考纲定位全国卷5年考情1.了解化学键的定义。
2.了解离子键、共价键的形成和存在的物质。
3.掌握分子式、电子式、结构式及结构简式等表示方法。
2017年:【卷T N⑷;m卷T U)(D)、%⑴2016年:I卷T】3; U卷T9; III卷T】22015 年:I 卷%、T27⑸;I【卷T WA}、T9考点1丨化学键与化合物(对应学生用书笫101页)[考纲知识整合]1.化学键一一离子键和共价键(1)概念与分类(2)化学反应的本质:反应物的旧化学键断裂与生成物的新化学键形成。
⑶离子键与共价键比较项目离子键共价键成键粒子阴、阳离子原子成键方式得失电子形成阴、阳离子形成共用电子对成键条件活泼金屈元素与活泼非金屈元素一般在非金属原子之间作用力实质静电作用提醒:(1)离子键屮的“静电作用”既包括静电吸引力又包括静电排斥力。
(2)分子间作用力、氢键不属于化学键。
(3)物质中并不一定都存在化学键,如He等稀有气体分子。
(4)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如A1C13中A1-C1 键为共价键。
(5)非金属元素的两个原子Z间一定形成共价键,但多个原子间也可能形成离子键,如NHQ1等。
2.化合物一一离子化合物和共价化合物(1)离子化合物与共价化合物的比较项口离子化合物共价化合物概念含有离了键的化合物只含有共价键的化合物构成微粒阴、阳离子分子或原子化学键类型 一定含有离子键,可能含 有共价键只含有共价键 与物质类 别的关系① 强碱② 绝大多数盐 ③ 活泼金屈氧化物① 含氧酸② 弱碱 ③ 气态氢化物 ④ 非金属氧化物 ⑤ 极少数盐 ⑥ 绝大多数有机物(2)① 根据化学键的类型判断凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。
② 根据化合物的类型来判断大多数碱性氧化物、强碱和盐属于离子化合物;非金属氢化物、非金属氧化物、含氧酸 属于共价化合物。
③ 根据化合物的性质来判断一般熔点、沸点较低的化合物是共俭化合物。
新编高考化学一轮精选题库【第5章】物质结构、元素周期律(含答案)

新编高考化学备考资料第五章章末检测(时间:100分钟,满分:100分)第Ⅰ卷(选择题,共42分)一、单项选择题(本题包括7个小题,每小题2分,共14分)1.下列有关叙述正确的是( )A.H、D、T具有相同的质子数,是氢元素的三种同位素B.OH-与H3O+组成元素相同,所含质子数相同C.结构示意图为和两种粒子为同一种元素D.元素原子最外层电子数的多少是判断金属性和非金属性强弱的依据2.(2011·杭州调研)元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )A.同周期的主族元素中,ⅦA族元素的原子半径最小B.元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素C.室温条件下,0族元素的单质都是气体D.ⅥA元素的原子,其半径越大,越容易得到电子3.某电荷数小于18的元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。
下列有关元素X的说法中,不正确的是( )A.元素X的原子核内质子数为(2a2-1)B.元素X形成的单质既能作氧化剂又能作还原剂C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)D.由元素X形成的某些化合物,可能具有杀菌消毒的作用4.下列叙述正确的是( )A.NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1∶2B.离子化合物中一定不含共价键C.某主族元素的最高价含氧酸为H n RO m,则其气态氢化物一般是H2m-n RD.元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等5.下列有关物质结构中的说法正确的是( )A.78 g Na2O2晶体中所含阴、阳离子个数均为2N AB.1.5 g CH+3中含有的电子数为N AC.3.4 g氨气中含有0.6N A个N—H键D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构6.短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。
2019版高考化学一轮复习第五章物质结构元素周期律第一讲原子结构化学键课后达标训练

第一讲 原子结构 化学键[ 课后达标训练 ])美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献, (Pd )元素的原子序数为 46,下列叙述错误的是( )B.钯是第五周期元素 C. Pd 2+核外有48个电子 D.14?Pd 的原子核内有62个中子解析:选Co Pd 原子核外有46个电子,则Pd 2+核外有44个电子。
2.有5种单核粒子,它们分别是 :9口、18口、49口+、;0口2+、49口( “□”内元素符号未写出) ,则它们所属元素的种类有 ()个R 微粒的核外电子数为 a ,核内中子数为b ,A.b + m +n R a +ma -m +bD . a -a m +-b mR解析:选D 。
由题意可知,在化合物 AnR 中,R 的化合价为—m 其离子符号为 Rg ,已知 一个FT 的核外电子数为a ,则该同位素的核内质子数为 a — m 质量数=质子数+中子数= a —m+ b, D 正确。
、选择题1 . (2018 •宝鸡模拟 曾获得诺贝尔化学奖。
钯A.102 Pd 和1463Pd 互为同位素A . 2 种B .3种 C . 4 种D .5种 解析:选B 。
质子数决定元素的种类,质子数有 19、18、20,共 3种。
3. (2018 •豫东名校联考)化学键使得一百多种元素构成了世界的万物。
列关于化学键的叙述中正确的是(A. 离子化合物中一定含有共价键,共价化合物中不含离子键B. 共价化合物中可能含离子键,离子化合物中只含离子键C. 构成单质分子的粒子一定含有共价键D.在氧化钠子核之间的排斥作用解析:选 D 。
离子化合物必含离子键,不一定含有共价键,但共价化合物必含共价键, 定不含离子键,A 、B 错误;稀有气体分子为单原子分子,不含共价键, C 错误;离子键中既存在静电吸引,也存在静电排斥,D 正确。
4•已知R 元素的某种同位素能形成化合物A mn ,其中A 的化合价为+ n 。
2019版高考化学一轮复习第5章物质结构元素周期律第2节

2.[2017·湖北黄冈高三质检]X、Y、Z 均为短周期元素, X、Y 处于同一周期,X、Z 的最低价离子分别为 X2-和 Z-, Y+和 Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
解析 由元素的位置关系知,X 位于第 2 周期,只有氧 原子的最外层电子数等于其电子层数的 3 倍,则 X 为氧元 素,由此推知 R 为氮元素,Y 为氟元素,Z 为磷元素,A 为氯元素。A 项,热稳定性:PH3<NH3<H2O<HF,错误; B 项,原子半径:r(P)>r(Cl)>r(O)>r(F),错误;C 项,酸性: H3PO4<HNO3<HClO4,正确;D 项,PCl5 分子中磷原子最 外层有 10 个电子,错误。
解析 根据题中信息可确定 X、Y、Z 分别为 S、Na 和 F。原子最外层电子数 F>S>Na,A 错误;单质沸点 Na>S>F2,B 错误;离子半径 S2->F->Na+,C 错误;原子 序数 S>Na>F,D 正确。
3.[2017·湖南长沙长郡中学期中]美国 FDA 证实,该 国地质勘测局在内华达州法隆镇的一些奶牛场附近的井水 中发现了 84 号元素 Po(钋)的一种放射性致癌同位素。钋是 目前已知最稀有的元素之一,下列有关它的说法正确的是
6.[2017·太原重点中学联考]R、X、Y、Z、A 是短周期 主族元素,它们在周期表中的相对位置如图所示。X 原子 最外层电子数等于其电子层数的 3 倍。下列推断正确的是 ()
RXY ZA
2019届高考化学一轮复习文档:第五章 物质结构 元素周

第2讲元素周期律和元素周期表【2019·备考】最新考纲:1.掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
2.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3.以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质的递变规律。
考点一元素周期表(频数:★★☆难度:★★☆)1.原子序数:按照元素在周期表中的顺序给元素所编的序号。
原子序数=核电荷数=核外电子数=质子数。
2.元素周期表的编排原则3.元素周期表的结构(1)周期(7个横行,7个周期)。
(2)族(18个纵行,16个族)。
(3)分区①分界线:沿着元素周期表中硼、硅、砷、碲、砹与铝、锗、锑、钋的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
(4)元素周期表中的特殊位置①过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。
②镧系:元素周期表第6周期中,57号元素镧到71号元素镥共15种元素。
③锕系:元素周期表第7周期中,89号元素锕到103号元素铹共15种元素。
④超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
①ⅠA族元素不等同于碱金属元素,H元素不属于碱金属元素;②元素周期表第18列是0族,不是ⅧA族,第8、9、10三列是Ⅷ族,不是ⅧB 族;1.(RJ必修2·P112改编)下列化合物仅由主族元素组成的是()A.Cu3PB.FeSC.XeF6D.Mg3N2答案 D2.(LK必修2·P171改编)(1)填空:(2)写出丙单质分别与乙和丁单质反应的化学方程式________________________________________________________; ________________________________________________________。
高考化学一轮复习 第五章 物质结构 元素周期律-人教版高三全册化学试题

第五章物质结构元素周期律第1节原子结构[高考导航]1.了解元素、核素和同位素的含义。
2.了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布。
1.原子的构成2.原子中的等量关系(1)质量数(A)=质子数(Z)+中子数(N)(2)质子数=原子序数=核电荷数=核外电子数3.同位素核素(1)概念辨析:(2)同位素的特征:①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用核素235 92U 14 6C 21H 31H 18 8O用途核燃料用于考古断代制氢弹示踪原子问题元素、核素、同位素的辨析(1)元素、核素、同位素之间的关系(2)同位素的“六同三不同”(3)同位素、同素异形体、同分异构体、同系物同位素同素异形体同分异构体同系物概念质子数相同,中子数不同的同一种元素的不同原子之间互为同位素同种元素组成的结构不同的单质之间互为同素异形体分子式相同,结构不同的化合物互为同分异构体结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物对象原子之间单质之间一般为有机化合物之间有机化合物之间化学性质几乎完全相同相似,一定条件下可以相互转变可能相似也可能不同 相似实例11H 、21H 、 31H金刚石与石墨、C 60;红磷与白磷CH 3COOH与HCOOCH 3甲烷、乙烷、丙烷;乙烯、丙烯;甲酸、乙酸[对点练] 判断下列说法的正误(1)所有的原子中都含有质子和中子。
( ) (2)34S 原子核内中子数为16。
( ) (3)2H +核外电子数为2。
( ) (4)13C 和 15N 核内中子数相差1。
( )(5)H 3O +和OH -中具有相同的质子数和电子数。
( ) (6)1H 182O 的摩尔质量为20 g·mol -1。
( ) (7)质量数就是元素的相对原子质量。
【2019-2020】高考化学一轮复习 第5章 原子结构与元素周期律章末综合检测(五)鲁科版

教学资料参考范本【2019-2020】高考化学一轮复习第5章原子结构与元素周期律章末综合检测(五)鲁科版撰写人:__________________部门:__________________时间:__________________章末综合检测(五)(时间:60分钟;满分:100分)一、选择题(本题包括9小题,每小题5分,共45分)1.2016年是切尔诺贝利核事故30周年。
核能的和平利用对完成“节能减排”的目标有着非常重要的意义。
尤其是核聚变,因其释放能量大,成为当前研究的一个热门课题。
其反应原理为 H+H―→He+n。
下列说法中正确的是( )A.D和T是质量数不同、质子数相同的氢的两种元素B.H的核外电子数为2C.H、H、H是氢的三种核素,互为同位素D.这个反应既是核反应,也是化学反应解析:选C。
D和T是中子数不同、质子数相同的氢的两种核素,A项错误;H的核外电子数为1,B项错误;H、H、H质子数相同、中子数不同,是氢的三种核素,互为同位素,C项正确;化学反应的最小微粒是原子,反应中原子种类不会发生变化,但该反应中原子种类发生了变化,因此该反应不属于化学反应,D项错误。
2.门捷列夫对化学这一学科发展的最大贡献在于发现了元素周期律。
下列事实不能用元素周期律解释的只有( )A.碱性:KOH>Ca(OH)2>Mg(OH)2B.气态氢化物的稳定性:H2O>H2S>H2SeC.挥发性:HNO3>H3PO4>H2SO4D.原子半径:P>S>Cl解析:选C。
元素的金属性越强,其最高价氧化物对应的水化物碱性越强,金属性:K>Ca>Mg,则碱性:KOH>Ca(OH)2>Mg(OH)2,A项不符合题意;元素的非金属性越强,其简单气态氢化物越稳定,同主族元素非金属性:O>S>Se,则稳定性:H2O>H2S>H2Se,B项不符合题意;挥发性难易不能用元素周期律解释,C项符合题意;同周期主族元素从左到右原子半径逐渐减小,D项不符合题意。
近年高考化学一轮复习第5章物质结构元素周期律检测(十九)元素周期律和元素周期表鲁科版(2021年整

2019版高考化学一轮复习第5章物质结构元素周期律跟踪检测(十九)元素周期律和元素周期表鲁科版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019版高考化学一轮复习第5章物质结构元素周期律跟踪检测(十九)元素周期律和元素周期表鲁科版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019版高考化学一轮复习第5章物质结构元素周期律跟踪检测(十九)元素周期律和元素周期表鲁科版的全部内容。
跟踪检测(十九) 元素周期律和元素周期表1.2016年IUPAC命名117号元素为Ts(中文名“石田”,tián),Ts的原子核外最外层电子数是7。
下列说法不正确的是()A.Ts是第7周期第ⅦA族元素B.Ts的同位素原子具有相同的电子数C.Ts在同族元素中非金属性最弱D.中子数为176的Ts核素符号是错误!Ts解析:选D 0族元素从上往下,原子序数依次为2、10、18、36、54、86、118,则可推断117号元素位于第7周期第ⅦA族,A项正确;互为同位素的不同原子具有相同的质子数,质子数等于核外电子数,B项正确;同主族元素从上往下,非金属性逐渐减弱,C项正确;中子数为176的Ts核素符号是错误!Ts,D项错误.2。
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
下列说法错误的是()A.R的氧化物含有离子键B.最高价含氧酸的酸性:Z<YC.M的氢化物常温常压下为气体D.Y形成的化合物种类最多解析:选 B 主族元素原子的最外层电子数=主族序数,X、Y、Z、M、R 原子最外层电子数分别为1、4、5、6、1,说明元素分别位于第ⅠA、ⅣA、ⅤA、ⅥA、ⅠA族.原子半径:M>Y>Z,则M是第3周期的硫,Y、Z分别是第2周期的碳、氮;原子半径:X<Y,则X是第1周期的氢;原子半径:R>M,可知R为钠.钠的氧化物有氧化钠和过氧化钠,都含有离子键,故A正确;非金属性:Z(N)>Y(C),所以最高价含氧酸的酸性:Z>Y,故B错误;硫化氢常温常压下为气体,故C正确;有机物比无机物的种类多得多,有机物都是含碳的化合物,所以Y形成的化合物种类最多,故D正确。
2019-2020学年高考化学一轮复习第5章物质结构元素周期律5.3烃的含氧衍生物

第5章物质结构元素周期律5.3检测时间:45分钟满分:100分一、选择题(每题6分,共72分)1.[2020·兰州一中高三月考]下列关于化学键的说法正确的是( )A.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键B.不同元素的原子构成的分子不一定只含极性共价键C.含极性键的共价化合物一定是电解质D.HF的分子间作用力大于HCl,故HF比HCl更稳定答案 B解析(NH2)2CO(尿素)中只含共价键,A项错误;H2O2中含有O—O非极性键,B项正确;CO中的化学键为极性键,但CO是非电解质,C项错误;分子间作用力与分子稳定性无关,HF的键能大于HCl,所以HF比HCl更稳定,D项错误。
2.[2020·河南南阳一中月考]下列观点正确的是( )A.反应物的化学键,在化学反应中全部被破坏B.HIO中各原子都满足最外层8电子稳定结构C.某化合物熔融态能导电,该化合物中一定有离子键D.某纯净物在常温常压为气体,则组成该物质的微粒一定含共价键答案 C解析在CH3CH2OH与CH3COOH的酯化反应中,只断裂羟基中的氧氢键和羧基中的碳氧键,A错误;HIO 中的氢原子是2电子稳定结构,B错误;Ar在常温常压下为气体,但Ar中无共价键,D错误。
3.[2020·长春高三质检]下列物质的电子式书写正确的是( )答案 A解析B项,NH+4的电子式为,错误;C项,氯化氢为共价化合物,应为,错误;D项,二氧化碳分子中每个O与C之间形成两对共用电子对,应为,错误。
4.[2020·东北师大附中模拟]固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构。
则下列有关说法中错误的是( )A.1 mol NH5中含有5N A个N—H键(N A表示阿伏加德罗常数的值)B.NH5中既有共价键又有离子键C.NH5的电子式为D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑答案 A解析由“NH5”的结构知其为离子化合物(NH4H),既含有共价键,又含有离子键,1 mol NH5中含有4N A个N—H键,A错误,B、C正确;NH4H中-1价的氢离子与H2O中+1价的氢发生归中反应生成H2,D正确。
全国2019版高考化学一轮复习方案文档:第五章物质结构 元素周期律 6 章末综合检测(五)

神笛 2005
B.Cl-的结构示意图: C.14062Pd 和 14063Pd 互为同位素
意图为
,b 与 c 形成化合物的电子式为
是( )
A.原子半径:a>c>d>b
B.最高价氧化物对应水化物的酸性:c>d>a
C.原子序数:a>d>b>c
D.元素的非金属性:a>d>c
神笛 2005
,下列比较中正确的
神笛 2005
解析:选 B。根据 a 的原子结构示意图判断,x=2,所以 a 为硅,再利用 b 与 c 形成 化合物的电子式得到 b 为钠、c 为氮,由 c、d 同主族得 d 为磷。原子半径: Na>Si>P>N,A 错误;最高价氧化物对应水化物的酸性:HNO3>H3PO4>H2SiO3,B 正确; 原子序数:P>Si>Na>N,C 错误;元素的非金属性:N>P>Si,D 错误。
布相同时,核电荷数越大,微粒半径越小,半径大小顺序应为 S2->Cl->K+>Ca2+,C 错误;
同种元素的原子得电子能力相同,D 正确。
4.(2018·长春模拟)X、Y、Z、W、Q 是原子序数依次增大的五种短周期主族元素。其
中 Z 是金属,W 的单质是淡黄色固体,X、Y、W 在周期表中的相对位置关系如图所示,
M 为碳元素,N 位于第三周期,且最外层电子数是电子层数的 2 倍,则推得 N 为硫元素。
(新课标)2019版高考化学一轮复习第五单元物质结构元素周期律考点规范练14原子结构化学键

6.A A 项 ,O 和 S 在元素周期表中位于同一主族 , 故二氧化碳与羰基硫结构相似 , 但由于 O和 S 非金
属性不同 , 羰基硫为极性分子 ,A 项错误 ;B 项 , 由类推法根据 CO2 可写出羰基硫的电子式 ,B 项正确 ;C
项, 羰基硫和 CO2 同为分子晶体且组成的结构相似 , 羰基硫的相对分子质量较大 , 故羰基硫沸点比 CO2
,A 和 E 所形成的简单氢化物中 , 共价键极性
的强弱顺序为
>
( 用化学式表示 ) 。
(6) 用原子结构解释“B 与 G的单质都能与 H2 反应生成 HX型氢化物”的原
因:
。
13.(10 分 )X 、Y、 Z、 W是原子序数依次增大的短周期主族元素 ,X 、 Z 在周期表中的相对位置如图所
示;X 的单质在氧气中燃烧能生成两种无色气体 ,Y 的最简单气态氢化物的水溶液显碱性。
考点规范练 14 原子结构 化学键
( 时间 :45 分钟 满分 :100 分 ) 一、选择题 ( 本题共 10 小题 , 每小题 5 分 , 共 50 分。每小题只有一个选项符合题目要求 ) 1.(2017 湖北荆州模拟 ) 下列叙述中 , 正确的是 ( )
A. 14C中含有 14 个中子 B. 1 H、 2H、 3H 是同一种核素 C.H2O与 D2O(重水 ) 互称同位素 D.C60 、 C70、金刚石、石墨均为碳的同素异形体 2. 重水 (D2O)主要用于核反应堆中中子的减速剂和冷却剂 来研究反应机理等。下列说法正确的是 ( ) A.D 是氢的一种核素 , 原子核内有 2 个中子
( 填化学式 );ZO 2 和 YO中还原性较强的是
( 填化学式 ) 。
14.(14 分 )A 、B、 X、 Y 和 Z 是原子序数依次递增的短周期元素 , 其中 A与 Y 同主族 ,X 与 Z 同主族 ,A
2019版高考化学一轮复习 第五章 物质结构 元素周期律

K12教育课件
9
K12教育课件
7
2.【解析】选C。短周期元素W、X、Y、Z的原子序数 依次增加。m、p、r是由这些元素组成的二元化合 物,n是元素Z的单质,通常为黄绿色气体,则n是氯气,Z 是氯元素;0.01 mol·L-1 r溶液的pH为2,说明r是强酸, 因此W是H;q的水溶液具有漂白性,s通常是难溶于水的 混合物,根据转化关系图可知m是水,r是氯化氢,q是次 氯酸,p是烷烃(如甲烷),因此X是碳元素,Y是氧元素。
第五章 物质结构 元素周期律
K12教育课件
1
【考情分析】
K12教育课件
2
K12教育课件
3
【真题溯源】
K12教育课件
4
K12教育课件
5
【真题溯源解析与答案】 1.【解析】选C。根据“Y的原子半径是所有短周期主 族元素中最大的”可知Y为Na,根据“W的简单氢化物 可用作制冷剂”可知W为N,根据“由X、Y和Z三种元素 形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析 出,同时有刺激性气体产生”可知该盐为Na2S2半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径 的大小:W<Y<X,A错误;同周期自左向右非金属性逐渐增强,同主族自上而下非金属性 逐渐减弱,则元素的非金属性:Y>X,B错误; Y的氢化物是水或双氧水,常温常压下为液 态,C正确;X的最高价氧化物的水化物碳酸为弱酸,D错误。
K12教育课件
6
为O,Z为S。X的简单氢化物为H2O,W的简单氢化物为NH3,H2O的热稳定性比NH3 强,A项正确;Y的简单离子为Na+,X的简单离子为O2-,Na+与O2-电子层结构相同,B项 正确;Y与Z形成的化合物为Na2S,其水溶液为碱性,不能使蓝色石蕊试纸变红,C项错 误;S与O属于同一主族,S与Na属于同一周期,D项正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章物质结构元素周期律章末检测一、选择题(本题包括12个小题,每小题4分,共48分。
)1.下列有关元素的性质及其递变规律正确的是( )A.同主族元素形成的单质熔、沸点自上而下逐渐升高B.核外电子排布相同的微粒化学性质不一定相同C.同主族元素含氧酸的酸性随核电荷数的增加而减弱D.非金属元素的气态氢化物的稳定性越强其沸点就越高解析:第ⅠA族金属元素熔沸点自上而下是降低的,A错误;核外电子排布相同的微粒,质子数可能不相同,化学性质也不一定相同,B正确;卤族元素中HClO是弱酸,不符合题意,C错误;气态氢化物的稳定性与非金属性有关,属于化学性质,而沸点属于物理性质,二者并没有关系,D错误。
答案:B2.相同条件下,下列有关物质性质的比较,不能用元素周期律解释的是( )A.硫酸酸性大于磷酸B.钾的金属性强于钠C.氢气燃烧生成气态水放出的热量小于液态水D.氟化氢的稳定性大于氯化氢解析:非金属性越强,其最高价氧化物的水化物的酸性越强,硫酸酸性大于磷酸,可用元素周期律解释,A正确;同一主族从上到下,金属性越强,钾的金属性强于钠,可用元素周期律解释,B正确;氢气燃烧生成气态水放出的热量小于液态水,是因为水的状态不同,不能用元素周期律解释,C错误;非金属性越强,其氢化物的稳定性越强,氟化氢的稳定性大于氯化氢,可用元素周期律解释,D正确。
答案:C3.短周期主族元素X、Y、Z、W的原子序数依次增大。
X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构。
下列说法正确的是( )A.单质的沸点:Y>ZB.X、Y、Z三种元素不可能形成离子化合物C.X的最高价氧化物对应的水化物的酸性比W的强D.Y分别与Z、W形成的化合物中化学键类型不相同解析:根据题意知短周期主族元素X元素的原子最外层电子数是其内层电子数的2倍,则X为碳元素,Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,则Z为镁元素;X、Y、Z、W原子的最外层电子数之和为18,则W为硫元素。
氧气常温下为气态,镁单质常温下呈固态,单质的沸点:O2<Mg,即Y<Z,A错误;C、O、Mg三种元素可形成碳酸镁,为离子化合物,B错误;非金属性:C<S,酸性:H2CO3<H2SO4,C错误;氧化镁中的化学键为离子键,二氧化硫、三氧化硫中的化学键为共价键,化学键类型不相同,D正确。
答案:D4.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。
其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )A.B.Y与Z只能形成一种化合物C.简单阴离子还原性:Y>WD.Z与Q形成的化合物水溶液可能显酸性解析:短周期元素W的单质为淡黄色固体,则W是S元素,Y是O元素,X是C元素,因为X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,则Q是Cl元素,其中Z 的原子序数大于8又小于16的金属元素,可能是Na、Mg、Al中的一种。
在这五种元素中非金属性最强的是Cl,所以最高价氧化物对应水化物的酸性最强的是HClO4,A错误;若Z是Na元素,则可以形成Na2O、Na2O2两种氧化物,若Z是Mg、Al,则只能形成一种氧化物MgO 或Al2O3,B错误;O、S是同主族的元素,从上到下,元素的非金属性逐渐减弱,则其简单阴离子还原性逐渐增强,元素的非金属性O>S,所以还原性S2->O2-,C错误;若Z为Mg或Al,则MgCl2、AlCl3都是强酸弱碱盐,金属阳离子发生水解反应消耗水电离产生的OH-而使溶液中的H+浓度增大,溶液显酸性,D正确。
答案:D5.下列根据元素周期表和元素周期律得出的推断中正确的是( )A.金属元素原子最外层电子数越少,该金属失电子能力越强B.若存在简单阴离子R2-,则R一定位于ⅥA族C.a A2+、b B+、c C3-三种离子具有相同的电子层结构,则原子序数c>a>bD.铅位于周期表中金属和非金属的交界处,可作半导体材料解析:A选项由Na与Ca可知错误;C选项原子序数a>b>c,错误;D选项,铅属于金属,错误。
答案:B6.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Z元素的核电荷数为X与Y元素核电荷数之和。
下列说法正确的是( )A.氢化物稳定性Y比WB.XY2、XW2、ZY2熔沸点依次增大,都是由共价键形成的分子晶体C.一定条件下,X单质能与ZY2反应生成Z单质,说明X的非金属性比Z强D.根据元素周期律,可以推测T元素的单质具有半导体特性,钠能与T形成Na2T2化合物解析:设X的原子序数为a,则Z的序数为a+8,Y的序数为a+2,Z元素的核电荷数为X与Y元素核电荷数之和,则a+8=a+a+2,a=6;所以X为碳元素、Y为氧元素、Z 为硅元素、W为硫元素、T为硒元素;氢化物的稳定性与氢键无关,故A错误;二氧化硅是原子晶体,故B错误;一定条件下,碳单质能与二氧化硅反应生成硅单质,碳表现还原性,不能说明X的非金属性比Z强,故C错误;硒元素在金属与非金属的分界线附近,硒与氧元素同族,根据元素周期律,可以推测硒元素的单质具有半导体特性,钠能与硒形成Na2Se2化合物,故D正确。
答案:D7.某分子的球棍模型如图所示。
已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。
下列有关说法中错误的是( )A.X原子可能为第ⅤA族元素B.Y原子一定为第ⅠA族元素C.该分子中,只含有共价键D.从圆球的大小分析,该分子可能为N2F4解析:据球棍模型知,该分子为共价化合物,X原子可形成3条价键,则可能为N、P 等元素。
Y可能为F、Cl等元素,但Y一定不能为第ⅠA族元素,因Y若为H,只能使最外层达2个电子;若为Na等,则组成的一般为离子化合物。
答案:B8.短周期主族元素X、Y、Z、W、Q的原子序数依次增大。
X的气态氢化物极易溶于Y 的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。
下列说法正确的是( )A.元素Y的最高正化合价为+6价B.简单离子半径的大小顺序为W>Q>Z>X>YC.气态氢化物的稳定性:Q>WD.元素W的最高价氧化物对应的水化物酸性比Q的强解析:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;Q只能为氯元素。
Y为氧元素,氧元素不显+6价,故A错误;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->N3->O2->Al3+,即离子半径W>Q>X>Y>Z,故B错误;元素的非金属性越强,气态氢化物的越稳定,氯元素的非金属性强于硫,故氯化氢的稳定性比硫化氢强,故C正确;非金属性Cl>S,故Cl元素最高价氧化物对应水化物的酸性更强,故D错误。
答案:C9.X、Y、Z、W为四种短周期元素,有关这四种元素的说法中正确的是( )B.W、X、Y三种元素的最高价氧化物对应水化物的酸性依次增强C.Y的氢化物与W的单质反应的产物中可能含有共价键和离子键D.0.3 mol Cu分别与足量HYO3或H2ZO4的稀溶液反应均产生0.2 mol气体解析:根据原子半径数据及特征化合价推知,W为Cl,X为C,Y为N,Z为S。
A项,1 mol Cl2若只作氧化剂,转移电子2 mol,若和NaOH反应既作氧化剂又作还原剂,转移电子1 mol;B项,HClO4、H2CO3、HNO3中,HClO4的酸性最强;C项,NH3和Cl2反应可生成N2和NH4Cl,在NH4Cl中既有共价键又有离子键;D项,0.3 mol Cu和足量稀硝酸反应放出0.2 mol NO,Cu和稀硫酸不反应。
答案:C10.a、b、c、d是四种短周期元素。
a、b、d同周期,c、d同主族。
a的原子结构示意图为,b与c形成化合物的电子式为b+3-b+,下列比较中正确的是( )A.原子半径:a>c>d>bB.最高价氧化物对应水化物的酸性:c>d>aC.原子序数:a>d>b>cD.元素的非金属性:a>d>c解析:根据a的原子结构示意图判断,x=2,所以a为硅,再利用b与c形成化合物的电子式得到b为钠、c为氮,由c、d同主族得d为磷。
原子半径:Na>Si>P>N,A错误;最高价氧化物对应水化物的酸性:HNO3>H3PO4>H2SiO3,B正确;原子序数:P>Si>Na>N,C错误;元素的非金属性:N>P>Si,D错误。
答案:B11.短周期主族元素X、Y、Z、W原子序数依次增大,X元素的单质可在自然界形成最硬的矿石,Y原子最外层有6个电子,Z元素的氧化物可做高温耐火材料且其最高价氧化物的水化物是难溶于水的碱性物质,W与X同主族。
下列叙述正确的是( ) A.原子最外层电子数由少到多的顺序:X=W<Y<ZB.原子半径由大到小的顺序:r(W)>r(X)>r(Y)>r(Z)C.元素非金属性由强到弱的顺序:X、Y、WD.元素的简单气态氢化物的稳定性由强到弱的顺序:Y、X、W解析:短周期主族元素X、Y、Z、W原子序数依次增大,X元素的单质可在自然界中形成最硬的矿石,该矿石为金刚石,则X为C元素,Z元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质,则Z为Mg元素,Y原子最外层有6个电子,而且原子序数比Mg小,则Y为O元素,W与C同主族,则W为Si元素。
原子最外层电子数由少到多的顺序:Z<W=X<Y,故A错误;同周期自左而右原子半径减小,同主族从上到下原子半径增大,则原子半径由大到小的顺序:r(Z)>r(W)>r(X)>r(Y),故B错误;X为碳元素,Y为O元素,W为Si元素,则元素非金属性由强到弱的顺序:Y、X、W,故C错误;元素的非金属性越强,其氢化物的稳定性越强,非金属性:O>C>Si,则气态氢化物的稳定性由强到弱的顺序:Y、X、W,故D正确。
答案:D12.短周期元素X、Y、Z的原子序数依次增大,其中Y元素的原子半径最大。
已知A、B、C分别是X、Y、Z三种元素的单质,A和C常温下为气体。
在适宜的条件下,A、B、C可以发生如图所示的反应。
下列说法正确的是( )A .化合物YX 中含离子键B .Z 的含氧酸均为强酸C .非金属性:X>ZD .离子半径:Y>Z解析:根据图示,A 是H 2、B 是Na 或Mg 或Al 等活泼金属,C 是Cl 2,X 、Y 、Z 分别是H 、Na 或Mg 或Al 、Cl ;化合物NaH 中含离子键,故A 正确;HClO 是弱酸,故B 错误;非金属性:Cl>H ,故C 错误;离子半径:Cl ->Na +,故D 错误。
