SDS-PAGE原理及配方
SDSPAGE原理步骤详细介绍含图片

使半胱氨酸残基之间的二硫键断裂
▪ SDS和还原剂的作用: (1)分子被解聚或组成它们的多肽键 (2)氨基酸侧链与SDS充分结合形成带负 电荷的蛋白质-SDS胶束 (3)蛋白质-SDS胶束所带的负电荷大大 超 过了蛋白质分子原有的电荷量,消除 了不同分子之间原有的电荷差异
(二)缓冲系统的选择 一般情况下,在被分析的蛋白质稳
定的pH范围,凡不与SDS发生相互作 用的缓冲液都可以使用,但缓冲液的 选择对蛋白质的分离和电泳的速度是 非常关键的
电泳缓冲液的种类: 1、磷酸缓冲液 2、Tris-醋酸钠缓冲系统 3、咪唑缓冲液系统: 比磷酸缓冲系统的导电性低,电泳速 度要比后者快一倍 4、尿素系统: 适用分子量低于15KD的蛋白样品 5、Tris-甘氨酸系统: 使用最多的缓冲液 6、Tris-硼酸盐缓冲液: 测定糖蛋白的分子量
二、去污剂的选择 无离子去污剂:Lubro W;Brij35, Tween Triton 阳离子去污剂:cetyltrimethyl ammonium bromide (CTAB) cetylpyyridinium (CPC) 阴离子去污剂:SDS deoxycholate
三、方法 1、分类 (1)根据对样品的处理方式的不同
蛋白带迁移距离 Rf= ————————
溴酚蓝迁移距离
蛋白带迁移距离 固定前的凝胶长度 Rf= ————————— X —————————
干燥后的凝胶长度 溴酚蓝迁移距离
2、作图 以已知蛋白质分子量的常用对数值为纵坐
标,Rf为横坐标绘图
3、通过测定未知蛋白质的Rf值,便可在标 准曲线上读出他的分子量
SDS-聚丙烯酰胺凝胶电泳
SDS-PAGE
SDS-PAGE原理、方法详解

SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)一、材料准备(1)丙烯酰胺单体(Arc):在交联剂作用下形成聚丙烯酰胺(2)N,N’-甲叉双丙烯酰胺(Bis):交联剂(3)10%十二烷基硫酸钠(SDS):阴离子去污剂,可与蛋白质结合,形成SDS-蛋白质复合物。
由于SDS带有大量负电荷,当与蛋白质形成复合物后好比蛋白质穿上带负电的“外衣”,蛋白质本身带有的电荷则被掩盖,即消除了蛋白质分子之间电荷差异。
配制方法:10g SDS,用双蒸水溶解并定容至100ml,室温保存。
(4)10%过硫酸铵(Ap):引发剂。
配制方法:0.1 g过硫酸铵溶解于1ml双蒸水中。
过硫酸铵会缓慢分解,应新鲜配制。
(5)N、N、N’、N’-四甲基乙二胺(TEMED):其碱基催化AP产生氧自由基,激活单体形成自由基,发生聚合。
配制方法:原液使用。
应使用电泳级TEMED。
(6)30%丙烯酰胺凝胶贮液(Arc-Bis贮液)配制方法(50mL体系):14.55 g丙烯酰胺+0.45 g N,N-甲叉双丙烯酰胺,先用40ml双蒸水溶解,搅拌,直到溶液变成透明,再用双蒸水稀释至50 ml,0.45μm滤膜过滤。
用棕色瓶储存于4℃(丙烯酰胺单体贮液在储存过程中因光和碱催化发生脱氨反应,会缓慢转化成丙烯酸和双丙烯酸,储存液应测定pH值不超过7.0。
丙烯酰胺单体贮液应在暗色瓶中保存,每隔数月须重新配制。
丙烯酰胺具有很强的神经毒性和致癌性,并可通过皮肤吸收,其作用具有累积性。
称量时必须戴手套和面具。
)(7)分离胶缓冲液(pH8.8的Tris-HCl缓冲液):1.5M Tris-HCl,pH8.8。
配制方法:9.08 g Tris溶解在40ml 双蒸水中,用4 mol/L盐酸调节pH值8.8,再用双蒸水加至50ml。
4℃保存。
(8)浓缩胶缓冲液(pH6.7的Tris-HCl缓冲液):1.0M Tris-HCl,pH6.8。
配制方法:6.06 g Tris溶解在40 ml双蒸水中,用4 mol/L盐酸调节pH值6.8,再用双蒸水加至50 ml。
sdspage分离蛋白质原理

sdspage分离蛋白质原理
SDS-PAGE是一种常用的蛋白质分离技术,其原理基于聚丙烯酰胺凝胶电泳和SDS(十二烷基硫酸钠)的作用。
首先,将待分离的蛋白质样品加入SDS溶液中,SDS可以与
蛋白质发生非共价键结合,使蛋白质的电荷变得均匀,且带有负电荷。
这样,蛋白质在电场作用下会向阳极迁移。
接下来,将试样加载到聚丙烯酰胺凝胶孔中,聚丙烯酰胺凝胶中存在着连续的网络结构,该网络由交联的聚丙烯酰胺聚合物构成。
蛋白质在电场作用下会通过孔道中的凝胶网络逐渐迁移,迁移速度取决于其分子量,分子量较大的蛋白质迁移速度较慢,分子量较小的蛋白质迁移速度较快。
最后,当电泳进行一段时间后,蛋白质样品会在凝胶中分离成多个带状区域,每个带状区域代表了一种或多种分子量相近的蛋白质。
为了可视化蛋白质,可以通过染色或免疫检测方法进行进一步分析。
总结起来,SDS-PAGE通过使用SDS使蛋白质带有负电荷,
然后在聚丙烯酰胺凝胶电泳中根据蛋白质分子量的差异来分离蛋白质。
这种技术广泛应用于蛋白质分析和分离,用于探索蛋白质结构和功能,以及研究蛋白质相互作用。
sds-page蛋白凝胶电泳原理

sds-page蛋白凝胶电泳原理
SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离
和分析技术。
其原理基于蛋白质的电荷密度和分子质量。
1. SDS(十二烷基硫酸钠):在SDS-PAGE中,SDS被用作
溶胀剂。
SDS能够与蛋白质中的氢键和疏水作用相互作用,
使蛋白质的二级、三级结构被破坏并线性展开。
SDS与蛋白
质发生作用后,每个蛋白质分子上的SDS数量差不多是相同的,即每个氨基酸上有约2.7个SDS分子。
2. 聚丙烯酰胺凝胶:SDS处理后的蛋白质在凝胶中呈均匀线
性状。
聚丙烯酰胺是一种电泳凝胶,可形成细小的孔隙结构。
这些孔隙可以分离不同分子质量的蛋白质。
3. 电泳过程:在凝胶上形成一个电场,蛋白质带有负电荷,向阳极迁移。
溶胶中的离子也会随之迁移,以维持电中性。
由于SDS已经使蛋白质的结构线性化,其迁移速度主要取决于分
子质量。
较大分子所需的孔隙更大,迁移速度更慢,较小分子则迁移更快。
4. 可视化和测量:分离结束后,可以通过染色剂(如Coomassie Brilliant Blue)将蛋白质染色。
染色剂与蛋白质结合,形成蓝色或紫色的带状条纹,使蛋白质带的位置可见。
在染色后,可以使用图像分析软件测量带的强度和相对迁移距离,从而推断蛋白质的分子质量。
通过SDS-PAGE,可以将不同分子质量的蛋白质分离开来,
并进行定量分析。
它是一种常用的蛋白质研究技术,在生物化学、生命科学和临床诊断等领域得到广泛应用。
sds page原理

sds page原理
SDS-PAGE(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis)是一种常用的蛋白质分离和分析技术。
它的原理基于蛋白质的电荷和分子质量差异。
SDS-PAGE的原理如下:
1. 蛋白质样品:将待分析的蛋白质样品在含有SDS(十二烷基硫酸钠)的缓冲液中加热处理,使蛋白质变性为线性形式,并与SDS以1:1的比例结合。
SDS 能够给蛋白质提供一个负电荷,使蛋白质呈均一的负电荷比例。
2. 准备Gel:制备一个由聚丙烯酰胺和交联剂组成的Gel胶。
在聚丙烯酰胺中添加过氧化物,使其发生聚合反应。
这样形成了一系列大小孔隙的网状结构。
3. Gel电泳:将含有SDS的蛋白质样品通过吸附在Gel上的孔隙中。
加上直流电压,在电场作用下,蛋白质会随着电泳迁移。
负电荷较多的蛋白质迁移较快,负电荷较少的蛋白质迁移较慢,从而实现了蛋白质的分离。
4. 染色和可视化:经过电泳分离后,使用染色剂(如Coomassie蓝)对蛋白质进行染色,目的是使蛋白质能够在胶上可视化。
通过比较样品和标记的分子量标准品的黑色条带,可以测量和估算待测蛋白质的分子量。
总结:SDS-PAGE通过对蛋白质样品中的蛋白质进行处理和分离,使其呈现出
电荷和分子质量的差异性。
这一方法在蛋白质的分子量分析、鉴定和纯化过程中被广泛应用。
蛋白sds-page凝胶配方及制胶

蛋白sds-page凝胶配方及制胶
SDS-PAGE(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis)是一种常用的蛋白质电泳技术,用于分离和定量蛋白质。
以下是制作SDS-PAGE凝胶的基本配方和制胶步骤:
配方:
1. 1%丙烯酰胺(Acrylamide)溶液:将3.7g丙烯酰胺和60μl N,N'-亚甲基双丙烯酰胺溶解在0.5ml双蒸水中,搅拌均匀。
2. 2.5%BT(Bis-Tris)溶液:将0.1g BT和0.25ml TBE(三酸乙酸盐电泳缓冲液)混合均匀。
3. 10%过硫酸铵(AMS)溶液:将10μl AMS溶解在1ml双蒸水中。
4. 5xTBE电泳缓冲液。
制胶步骤:
1. 将电冰板预热至30℃。
2. 将1%丙烯酰胺溶液和2.5%BT溶液混合,100V恒压电泳10-15分钟,直至胶液凝固。
3. 将胶板取出,放入考马士亮蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
4. 将胶板再次放入考马士亮蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
5. 将胶板放入考马士固蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
6. 将胶板干燥后,即可用于蛋白质电泳。
SDSPAGE分离胶配方表及其原理

S D S P A G E分离胶配方表及其原理The Standardization Office was revised on the afternoon of December 13, 2020SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
SDSPAGE所有详细试剂配方

SDSPAGE所有详细试剂配方SDS-(聚丙烯酰胺凝胶电泳)是一种常用于蛋白质分析的实验技术。
该技术通常涉及到几种试剂,如胶溶液、缓冲液、电泳缓冲液、染色溶液等。
下面是SDS-常见的试剂配方及其详细说明。
一、胶溶液配方:1. 30%(w/v)丙烯酰胺(acrylamide)溶液- 在称量瓶中称取30g丙烯酰胺,并用蒸馏水调至100ml。
搅拌溶解直至均匀。
-这是制备聚丙烯酰胺凝胶的基础溶液。
2. 响应稀释液(Response diluent)-用于稀释聚丙烯酰胺溶液以获得不同浓度的凝胶。
-可通过将聚丙烯酰胺溶液与水按1:3体积比混合来制备响应稀释液。
二、缓冲液配方:1. 离子化追踪剂(Tris-Glycine running buffer)-用于凝胶电泳盒中电解质的运行。
-配方为:3g Tris base (pH 8.8)14.4g glycine将固体溶解于1L蒸馏水中,并调整pH至8.8三、电泳缓冲液配方:1. 离子化追踪剂(Tris-Glycine SDS running buffer)-用于在电泳过程中提供离子追踪剂。
-配方为:30g Tris base144g glycine10gSDS将固体溶解于1L蒸馏水中。
2. 加速剂(stacking gel buffer)- 用于形成凝胶中的聚集堆积层(stacking layer)。
-配方为:30g Tris base (pH 6.8)144g glycine1gSDS将固体溶解于1L蒸馏水中,并调整pH至6.8四、样品处理缓冲液配方:1. 样品加载缓冲液(sample loading buffer)-用于处理蛋白样品,以便在凝胶上获得良好的分离效果。
-配方为:0.5M Tris-HCl(pH 6.8)20%(v/v)甘油10%(w/v)SDS0.05%(w/v)溴酚蓝(bromophenol blue)旋转混合并加入蛋白样品。
五、凝胶染色溶液配方:1. 吸附性染色剂(Coomassie blue staining solution)-用于染色聚丙烯酰胺凝胶上分离的蛋白质。
简述sds—page的基本原理

简述sds—page的基本原理
SDS-PAGE是一种常见的蛋白质电泳技术,它可以将混合的蛋白质样品分离并定量分析。
SDS-PAGE技术的基本原理是利用SDS(十二烷基硫酸钠)将蛋白质中的电荷中和,使其带有负电荷,在电场作用下,蛋白质会向阳极移动,根据蛋白质的分子量大小,可以通过电泳分离得到不同的蛋白质。
SDS-PAGE的步骤分为样品制备、电泳分离、电泳转移和染色检测四个部分。
其中,样品制备是至关重要的一步,样品的制备要求样品处于还原状态,加入SDS、β-巯基乙醇和煮沸处理,以使蛋白质完全变性和解离,同时也可以破坏蛋白质的三级结构。
电泳分离是SDS-PAGE技术的核心步骤,样品经过制备后,可以通过各种尺寸的孔洞大小的聚丙烯酰胺凝胶来进行分离。
在电场作用下,蛋白质会向阳极移动。
由于SDS分子对蛋白质进行完全变性和解离,使得所有蛋白质都带有相同的负电荷,因此蛋白质迁移速率与蛋白质分子量成反比。
通常,蛋白质分子量越大,迁移速率越慢,越容易被分离。
电泳转移是将凝胶上的蛋白质转移到聚乙烯醇膜或硝酸纤维素膜上的步骤。
这一步的目的是将蛋白质从凝胶上转移到其他材料上,以便进行进一步的染色、探针反应等操作。
染色检测是SDS-PAGE技术的最后一个步骤,用染色剂将蛋白质染
色以便观察。
常用的染色剂包括银染色和伯胺蓝染色。
银染色是一种极为敏感的染色方法,但有一定的毒性和危险性,需要使用防护手套和安全设备。
伯胺蓝染色是一种简单易行的染色方法,但相对银染色来说灵敏度较低。
总的来说,SDS-PAGE技术是一种非常重要的蛋白质分析方法,可以有效地分离和定量不同分子量的蛋白质,具有广泛的应用前景。
SDS-PAGE电泳试剂配制

SDS-PAGE电泳试剂配制SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离技术,可以将蛋白质按照其分子量大小分离出来。
在这个过程中,需要使用一系列试剂来形成凝胶、还原并变性蛋白质样品、以及进行电泳。
下面我们将介绍SDS-PAGE电泳试剂的配制方法。
聚丙烯酰胺凝胶电泳胶液配制1. 蒸馏水将蒸馏水取2L,通过0.22μm的滤膜过滤3遍来除杂质,备用。
2. 均聚化溶液将40%(w/v)丙烯酰胺10mL,在干燥器中烘干2小时,然后加入蒸馏水固定容积至50mL。
将10%(w/v)N, N’-二甲基亚硫脲5mL加入均聚化溶液中,搅拌30分钟至完全溶解。
3. 凝胶制备将均聚化溶液加入10%(w/v)的三甲基丙烯酰氨基甲基纤维素,搅拌5分钟后加入0.1%TEMED等待至少1小时凝胶化。
4. 等电聚焦凝胶制备将均聚化溶液加入3.33%(w/v)等电聚焦剂,根据需要调节pH值,搅拌5分钟后加入氨基甲酸1mL,搅拌2分钟至完全溶解。
加入TEMED及APS,混合倒入制好的除尘洞中,并插入梳子。
至少1小时后移除梳子,使凝胶完全凝固。
蛋白样品处理试剂配制1. SDS缓冲液将10%SDS 1.25mL加入pH6.8的磷酸盐缓冲液(1M),加入蒸馏水固定容积至100mL,搅拌10分钟至SDS完全溶解,备用。
2. β-巯基乙醇将β-巯基乙醇400μL加入1mL磷酸盐缓冲液(1M),备用。
3. 样品缓冲液将10%SDS 100μL,β-巯基乙醇50μL加入磷酸盐缓冲液1mL中,加入蒸馏水固定容积至10mL,轻轻搅拌即可。
4. 热变性载入缓冲液将4倍浓度的样品缓冲液加入β-巯基乙醇,于100℃水浴中加热5分钟。
冷却至室温,即可使用。
电泳相关试剂配制1. 电泳缓冲液将磷酸盐缓冲液1L加入SDS 10g进行混合后,加入蒸馏水将其固定至2L,备用。
2. Anode buffer将磷酸盐缓冲液1L加入SDS 5g进行混合后,加入蒸馏水将其固定至2L,备用。
SDSPAGE原理步骤详细介绍含图片课件

一、SDS-PAGE的基本原理
(一)蛋白质分子的解聚 样品介质和聚丙烯酰胺中加入离
子去污剂和强还原剂后,蛋白质亚基 的电泳迁移率主要取决于亚基分子量 的大小,而电荷因素可以被忽略
1、SDS
阴离子去污剂 变性剂 助溶性试剂
断裂分子内和分子间的氢键 分子去折叠 破坏蛋白质分子的二级和三级结构
2、强还原剂 巯基乙醇(β-mercaptoethanal)
蛋白质-SDS胶束的特点 (1)形状像一个长椭圆棒 (2)短轴对不同的蛋白质亚基-SDS胶 束基本上是相同的 (3)长轴的长度则与亚基分子量的大 小成正比
胶束在SDS-PAGE系统中的电泳迁 移率不再受蛋白质原有电荷的影响, 而主要取决于椭圆棒的长轴长度,即 蛋白质或亚基分子量的大小。
当蛋白质的分子量在15KD—200KD 之间时,电泳迁移率与分子量的对数 呈线性关系
(3) 加样品
样品的处理 在蛋白溶液中加入过量的SDS后,可引起以
下的反应: 蛋白质本身的电荷被屏蔽 氢键断裂 疏水相互作用被取消 多肽被去折叠(二级结构破坏),并形成椭球型
①还原SDS处理 当加入还原试剂DTT或β-二巯基乙醇后,
蛋白质被完全去折叠,只根据分子量分离
②带有烷基化作用的还原SDS处理 烷基化作用可以很好地并经久牢固地保
②G-250 二甲花青亮蓝,蓝绿色。
银染色 银染的机制是将蛋白带上的硝酸
银(银离子)还原成金属银,以使银 颗粒沉积在蛋白带上
(7) 照相,凝胶干燥 (8) 定量测定
3、电泳过程中的不正常现象 (1)“微笑”现象 指示剂前沿呈现两边向上的曲线 形,说明凝胶的不均匀冷却,中间部 分冷却不好
护SH基团,而得到窄的电泳带
③非还原的SDS处理 许多样品,如生理体液、血清或尿素,
sds-page原理

sds-page原理
SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离
和纯化技术。
其原理基于蛋白质在电场中的迁移速度与其分子量成反比的特性。
首先,将待测蛋白质样品经过还原剂(如巯基乙醇)和SDS (十二烷基硫酸钠)处理,使蛋白质在溶液中全部变成带负电荷的复合物。
SDS具有两个主要功能:一是在蛋白质分子表
面均匀地吸附SDS分子,使蛋白质带有大量负电荷;二是通
过SDS分子的疏水尾部与蛋白质间的相互作用,使蛋白质变
为线性构象。
然后,将经过处理的样品加入含有聚丙烯酰胺的凝胶电泳胶质中。
聚丙烯酰胺经过电极电解质反应形成网状物质,构成凝胶。
聚丙烯酰胺凝胶可以形成一系列孔隙,这些孔隙可以按照分子量的大小分离蛋白质。
在电泳进行时,电场的作用下,带负电的蛋白质复合物会向着电极迁移,迁移的速度与蛋白质分子量成反比。
较小分子量的蛋白质移动速度相对较快,而较大分子量的蛋白质移动速度相对较慢。
因此,蛋白质在凝胶中的分离程度与其分子量有关。
在电泳完成后,可以通过染色(如银染、荧光染等)或利用特定的蛋白质探针(如抗体或荧光标记探针)来检测和可视化分离的蛋白质。
然后,可以根据蛋白质的迁移距离和已知分子量蛋白质的迁移距离之间的关系推断待测蛋白质的分子量。
总之,SDS-PAGE通过利用电场迁移速度与蛋白质分子量之间的关系,实现了对蛋白质样品的分离与纯化。
它是一种简便、快速且广泛应用的分析方法,在生物学和生物化学领域中具有重要作用。
SDS-PAGE分离胶配方表-及其原理

SDSPAGE电泳本理:之阳早格格创做散丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 战接联剂N,N’—亚甲基单丙烯酰胺(简称Bis)正在催化剂效率下,散合接联而成的具备网状坐体结构的凝胶,并以此为收援物举止电泳.散丙烯酰胺凝胶电泳可根据分歧蛋黑量分子所戴电荷的好别及分子大小的分歧所爆收的分歧迁移率将蛋黑量分散成若搞条区戴,如果分散杂化的样品中只含有共一种蛋黑量,蛋黑量样品电泳后,便应只分散出一条区戴.SDS是一种阳离子表面活性剂能挨断蛋黑量的氢键战疏火键,并按一定的比率战蛋黑量分子分散成复合物,使蛋黑量戴背电荷的量近近超出其自己本有的电荷,掩盖了百般蛋黑分子间天然的电荷好别.果此,百般蛋黑量SDS 复合物正在电泳时的迁移率,没有再受本有电荷战分子形状的效率,而不过棒少的函数.那种电泳要领称为SDS散丙烯酰胺凝胶电泳(简称SDS—PAGE).由于SDSPAGE 可设法将电泳时蛋黑量电荷好别那一果素与消大概减小到不妨略而没有计的程度,果此常常使用去审定蛋黑量分散样品的杂化程度,如果被审定的蛋黑量样品很杂,只含有一种具三级结构的蛋黑量大概含有相共分子量亚基的具四级结构的蛋黑量,那么SDS—PAGE 后,便只出现一条蛋黑量区戴. TEMED:通过催化过硫酸铵产死自由基而加速丙烯酰胺与单丙烯酰胺的散合.过硫酸铵(AP):提供启动丙烯酰胺与单丙烯酰胺所必须的自由基.SDS—PAGE 可分为圆盘状战笔曲板状、连绝系统战没有连绝系统.本真验采与笔曲板状没有连绝系统.所谓“没有连绝”是指电泳体系由二种大概二种以上的缓冲液、pH 战凝胶孔径等所组成.正在没有连绝电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分散胶缓冲液(Tris—HCl,pH8.8),二种凝胶的浓度(即孔径)也没有相共.正在那种条件下,缓冲系统中的HCl 险些局部解离成Cl-,二槽中的Gly (pI=6.0,pK a=9.7)惟有很少部领会离成Gly 的背离子,而酸性蛋黑量也可解离出背离子.那些离子正在电泳时皆背正极移动.C1—速度最快(开始离子),其次为蛋黑量,Gly 背离子最缓(尾随离子).由于C1—很快超出蛋黑离子,果此正在其后里产死一个电导较矮、电位梯度较陡的地区,该区电位梯度最下,那是正在电泳历程中产死的电位梯度的没有连绝性,引导蛋黑量战Gly 离子加快移动,截止使蛋黑量正在加进分散胶之前,快、缓离子之间浓缩成一薄层,有好处普及电泳的辨别率.蛋黑量离子加进分散胶后,条件有很大变更.由于其pH 降下(电泳举止常常超出9.0),使Gly 解离成背离子的效力减少;共时果凝胶的浓度降下,蛋黑量的泳动受到效率,迁移率慢遽下落.此二项变更,使Gly 的移动超出蛋黑量,上述的下电压梯度没有复存留,蛋黑量便正在一个较均一的pH 战电压梯度环境中,按其分子的大小移动.分散胶的孔径有一定的大小,对于分歧相对于分子品量的蛋黑量去道,通过时受到的阻滞程度分歧,纵然洁电荷相等的颗粒,也会由于那种分子筛的效力,把分歧大小的蛋黑量相互分启.SDSPAGE电泳胶配造:SDSPAGE试剂配造:。
SDS-PAGE原理及配方
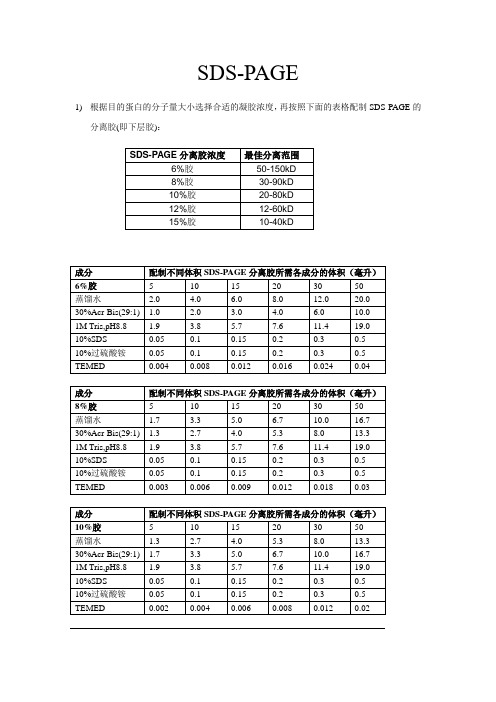
SDS-PAGE1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶(也称堆积胶、积层胶或上层胶):TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
聚丙烯酰胺的作用:丙烯酰胺与为蛋白质电泳提供载体,其凝固的好坏直接关系到电泳成功与否,与促凝剂及环境密切相关;制胶缓冲液:浓缩胶选择pH6.7,分离胶选择pH8.9,选择tris-HCL系统,具体作用后面介绍;TEMED与AP:促凝作用,加速聚丙烯酰胺的凝固;AP中含有29的丙烯酰胺和1的甲叉基聚丙烯酰胺,能产生自由氧基,使丙烯酰胺聚合。
十二烷基硫酸钠(SDS):阳离子去污剂,作用有四:去蛋白质电荷、解离蛋白质之间的氢键、取消蛋白分子内的疏水作用、去多肽折叠。
sds-page原理

sds-page原理
SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离和分析方法,其原理可以分为以下几个步骤:
1. 准备样品:将待分析的蛋白质样品溶解在含有SDS(十二烷基硫酸钠)和还原剂(如二巯基乙醇)的缓冲液中。
SDS
可以使蛋白质变为带有负电荷的线性形式,并破坏蛋白质之间的非共价相互作用;还原剂可以断裂蛋白质之间的二硫键。
2. 准备凝胶:通常使用聚丙烯酰胺(Polyacrylamide)作为凝胶材料,用于形成一个互联的三维网络结构。
通过改变凝胶的浓度和聚合物化学交联程度来调控凝胶的孔径大小。
3. 装配电泳装置:将经聚合的凝胶放置在电泳槽中,同时使凝胶与正、负极电极接触。
在前导缓冲液中加入迁移染色前蛋白样品。
4. 进行电泳:将电场通电,带电的蛋白质在电场力的作用下从凝胶上端迁移至下端。
由于SDS使蛋白质带有负电荷,所以蛋白质的迁移速率与其分子量反相关,分子量越大的蛋白质迁移速度越慢。
5. 染色和可视化:在电泳结束后,可以使用染色剂(如Coomassie蓝染剂)对蛋白质进行染色,可以直观地看到不同蛋白质的迁移情况。
还可以使用特异性的抗体进行免疫染色,以检测特定蛋白质的存在与否。
6. 分析和解释:通过测量蛋白质迁移距离和与已知分子量标准品的比较,可以确定待测蛋白质的相对分子量。
根据蛋白质在凝胶上的迁移位置,可以推测其可能的结构和功能。
总之,SDS-PAGE利用SDS破坏非共价相互作用,并使蛋白质带有负电荷,通过电场作用下的迁移速率差异,实现对蛋白质的分离和分析。
SDS-PAGE分离胶配方表-及其原理

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI =6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDS-PAGE分离胶配方表-及其原理

SDSPAGE电泳原理:之五兆芳芳创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳.聚丙烯酰胺凝胶电泳可按照不合蛋白质份子所带电荷的差别及份子大小的不合所产生的不合迁移率将蛋白质别离成若干条区带,如果别离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只别离出一条区带.SDS是一种阴离子概略活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质份子结分解复合物,使蛋白质带负电荷的量远远超出其自己原有的电荷,掩盖了各类蛋白份子间天然的电荷差别.因此,各类蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和份子形状的影响,而只是棒长的函数.这种电泳办法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE).由于SDSPAGE 可设法将电泳时蛋白质电荷差别这一因素除去或减小到可以略而不计的程度,因此经常使用来判定蛋白质别离样品的纯化程度,如果被判定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同份子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带. TEMED:通过催化过硫酸铵形成自由基而加快丙烯酰胺与双丙烯酰胺的聚合.过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基.SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统.本实验采取垂直板状不连续系统.所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成.在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、别离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同.在这种条件下,缓冲系统中的HCl 几近全部解离成Cl -,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分化离成Gly 的负离子,而酸性蛋白质也可解离出负离子.这些离子在电泳时都向正极移动.C1—速度最快(先导离子),其次为蛋白质,Gly 负离子最慢(尾随离子).由于C1—很快超出蛋白离子,因此在其前面形成一个电导较低、电位梯度较陡的区域,该区电位梯度最高,这是在电泳进程中形成的电位梯度的不连续性,导致蛋白质和Gly 离子放慢移动,结果使蛋白质在进入别离胶之前,快、慢离子之间浓缩成一薄层,有利于提高电泳的分辩率.蛋白质离子进入别离胶后,条件有很大变更.由于其pH 升高(电泳进行时常超出9.0),使Gly 解离成负离子的效应增加;同时因凝胶的浓度升高,蛋白质的泳动受到影响,迁移率急剧下降.此两项变更,使Gly 的移动超出蛋白质,上述的高电压梯度不复存在,蛋白质便在一个较均一的pH 和电压梯度情况中,按其份子的大小移动.别离胶的孔径有一定的大小,对不合相对份子质量的蛋白质来说,通过期受到的阻滞程度不合,即便净电荷相等的颗粒,也会由于这种份子筛的效应,把不合大小的蛋白质相互分隔. SDSPAGE电泳胶配制:SDSPAGE试剂配制:。
SDS-PAGE分离胶配方表-及其原理

SDSPAGE电泳原理:之迟辟智美创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳.聚丙烯酰胺凝胶电泳可根据分歧卵白质分子所带电荷的不同及分子年夜小的分歧所发生的分歧迁移率将卵白质分离成若干条区带,如果分离纯化的样品中只含有同一种卵白质,卵白质样品电泳后,就应只分离出一条区带.SDS是一种阴离子概况活性剂能打断卵白质的氢键和疏水键,并按一定的比例和卵白质分子结合成复合物,使卵白质带负电荷的量远远超越其自己原有的电荷,掩盖了各种卵白分子间天然的电荷不同.因此,各种卵白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数.这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE).由于SDSPAGE 可设法将电泳时卵白质电荷不同这一因素除去或减小到可以略而不计的水平,因此经常使用来鉴定卵白质分离样品的纯化水平,如果被鉴定的卵白质样品很纯,只含有一种具三级结构的卵白质或含有相同分子量亚基的具四级结构的卵白质,那么SDS—PAGE 后,就只呈现一条卵白质区带. TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合.过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必需的自由基.SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统.本实验采纳垂直板状不连续系统.所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成.在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同.在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl -,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部份解离成Gly 的负离子,而酸性卵白质也可解离出负离子.这些离子在电泳时都向正极移动.C1—速度最快(先导离子),其次为卵白质,Gly 负离子最慢(尾随离子).由于C1—很快超越卵白离子,因此在其后面形成一个电导较低、电位梯度较陡的区域,该区电位梯度最高,这是在电泳过程中形成的电位梯度的不连续性,招致卵白质和Gly 离子加快移动,结果使卵白质在进入分离胶之前,快、慢离子之间浓缩成一薄层,有利于提高电泳的分辨率.卵白质离子进入分离胶后,条件有很年夜变动.由于其pH 升高(电泳进行时常超越9.0),使Gly 解离成负离子的效应增加;同时因凝胶的浓度升高,卵白质的泳动受到影响,迁移率急剧下降.此两项变动,使Gly 的移动超越卵白质,上述的高电压梯度不复存在,卵白质便在一个较均一的pH 和电压梯度环境中,按其分子的年夜小移动.分离胶的孔径有一定的年夜小,对分歧相对分子质量的卵白质来说,通过时受到的阻滞水平分歧,即使净电荷相等的颗粒,也会由于这种分子筛的效应,把分歧年夜小的卵白质相互分开.SDSPAGE电泳胶配制:SDSPAGE试剂配制:。
