Real-Time_PCR实验流程
实时定量pcr步骤(详细)

半定量和实时定量PCR步骤实验原理:RT-PCR将以RNA为模板的cDNA合成同PCR结合在一起,提供了一种分析基因表达的快速灵敏的方法。
RT-PCR用于对表达信息进行检测或定量。
另外,这项技术还可以用来检测基因表达差异或不必构建cDNA 文库克隆cDNA。
RT-PCR比其他包括Northern印迹、RNase保护分析、原位杂交及S1核酸酶分析在内的RNA分析技术,更灵敏,更易于操作。
RT-PCR的模板可以为总RNA或poly(A)+选择性RNA。
逆转录反应可以使用逆转录酶,以随机引物、oligo(dT)或基因特异性的引物(GSP)起始。
RT-PCR可以一步法或两步法的形式进行。
在两步法RT-PCR 中,每一步都在最佳条件下进行。
cDNA的合成首先在逆转录缓冲液中进行,然后取出1/10的反应产物进行PCR。
在一步法RT-PCR中,逆转录和PCR在同时为逆转录和PCR优化的条件下,在一只管中顺次进行。
实验步骤:Trizol法RNA提取步骤1、提取总RNA2、逆转录反应3、PCR反应以下实验步骤仅供参考:1 样品RNA的抽提①取冻存已裂解的细胞,室温放置5分钟使其完全溶解。
②两相分离每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。
手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。
4℃下12000rpm离心15分钟。
离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。
RNA全部被分配于水相中。
水相上层的体积大约是匀浆时加入的TRIZOL 试剂的60%。
③RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。
加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。
此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。
④RNA清洗移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA沉淀。
Agilent Real-time qPCR 检测 操作手册说明书

Real-time qPCR 检测操作手册1/ 6一、实验概述Real-time Quantitative PCR Detecting System ,即实时荧光定量核酸扩增检测系统,也叫实时定量基因扩增荧光检测系统,简称qPCR 。
是一种在PCR 反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR 进程,最后通过特定数学原理对未知模板进行定量分析的方法,实现了PCR 从定性到定量的飞跃。
二、实验流程三、实验材料: 1.主要试剂试剂名称 试剂来源 Cat.No. Trizol 上海普飞 3101-100 M-MLV promega M1705 dNTPs promega U1240 oligo dT 上海生工 B0205 Bulge-LoopTM miRNA广州锐博 详见实验报告 qPCR Primer Set Rnase Inhibitor promega N2115 Primer(R&F) 上海生工 详见实验报告 SYBR Master MixtureTAKARADRR041B2/ 6样本收集Trizol 法抽取RNARNA 反转录获取cDNAReal-time qPCR2.主要器材器材名称来源Cat.NoNanodrop 分光光度计Thermo 2000/2000C稳压电泳仪上海天能EPS-600超细匀浆机FLUKO公司F6/10Real time PCR 仪器Agilent公司MX3000p反转录耗材Axygen四、实验步骤:1.总RNA 抽提(1)收取样品,Trizol 裂解。
细胞样品:收集细胞(6 孔板 80%细胞密度),2000 rpm 离心5min,去上清,细胞沉淀中加入1mL Trizol,充分混匀后室温静置 5 min,然后转移至新的 1.5 mL EP 管中;组织样品:将待研磨的组织样品从液氮或者-80℃冰箱中取出,无菌刀片于干冰上将组织样品切割成约 3 mm×3 mm×3 mm 大小,置于装有 1 mL Trizol 裂解液的 1.5mL EP 管中。
realtimePCRTaqman探针设计、实时多重PCR探针的选择、引物的设计及评价

real-time-PCRTaqman探针设计、实时多重PCR探针的选择、引物的设计及评价————————————————————————————————作者:————————————————————————————————日期:real time PCRTaqman探针设计、实时多重PCR探针的选择、引物的设计及评价一、实时荧光Taqman 探针设计总原则:探针选择要保守,引物选择要保守,因此必须找一段100-200bp相对要保守的片段来设计引物与探针。
即real-time PCR的扩增片段是50bp----150bp。
当找不到150bp的保守片段时,必须确保探针的片段是保守的。
在设计探针和引物时,要同时考虑在两条链上设计引物与探针。
但要注意的是:在那条链上设计探针时,就应靠近在同一条链上设计的引物(即上游引物)。
这样,可保证在将来扩增时,即便没有完全扩增,也有荧光信号报告出来。
两者的距离最好是探针的5’端离上游引物的3’有一个碱基,但也可以重叠。
若在原序列中找不到合适的探针与引物(1主要是探针和上游引物的距离太远,而离下游引物的距离却较近时;2突变位点要求在探针的5’ 端也能检测到荧光信号,但却是在3’端),可在互补的序列中设计引物与探针。
另real-time PCR中的探针和引物的Tm值,均要高于平常PCR的引物和杂交的探针的Tm值。
二、探针的设计探针设计的基本原则:1.保守:探针要绝对的保守,有时分型就单独依靠探针来决定。
理论上有一个碱基不配对,就可能检测不出来。
若找不到完全保守的片段,也只能选取有一个碱基不同的片段。
且这个不同的碱基最好在探针的中间,对探针与目的片段的杂交影响不大,不相同的碱基最好不要在两端,因为两端不利于探针的杂交。
且最好为A或T,而不能为G或A,因为A、T为双键,而G、A为三键。
2.探针长度Taqman探针的长度最好在25-32bp之间,且Tm值在68-72℃之间,最好为70℃,确保探针的Tm 值要比引物的Tm值高出10℃,这样可保证探针在煺火时先于引物与目的片段结合。
qPCR操作步骤

QPCR(Real-time Quantitative PCR Detecting System)即实时荧光定量核酸扩增检测系统,也叫实时定量基因扩增荧光检测系统。
标准的两步法:RNA提取→随机引物反转录→反转录产物10倍稀释→real-time PCR.注意:1 高质量的RNA获取,这里的高质量不是强调RNA降解,而是强调RNA 的纯度,不能含有基因组DNA,以及其他杂质污染。
基因组DNA的存在会导致定量偏高,给你错误的结果,所以一般用于定量PCR的RNA必须使用DNase处理,消除DNA污染。
而RNA中的杂质的污染会限制real-time PCR的反应,导致扩增失败,给你假阴性的结果。
RNA的降解不是关键,一个是因为定量PCR的引物扩增目的长度本身很短,150-250个bp,并不用于扩增目标基因的全长。
此外是因为存在内参基因,所以RNA降解会通过内参基因的测定来平衡。
毕竟一旦发生降解,所有的RNA以同样的速度降解,而相对比率不会改变。
2 减少加样误差,在使用SYBR Green MIX的时候,一定要先按照反应的量(比如8个孔)把所有的试剂一次性配成MIX然后分装,留出5微升的反应体系给模板,使用5微升是因为只有5微升以上,加样枪的误差才会比较小,如果你仅仅是吸取一微升的话,手重一点或者轻一点都会造成极大的加样误差,严重影响你的定量精确度。
3 选择合适的内参基因,一般用于定量PCR的内参基因有好几种,但却没有完全通用的内参基因。
具体到不同来源的细胞,比如不同组织来源,或者是动物等等,内参基因会有差异,最好的办法是,在你的样品上先测试内参基因,找到变化最小,最稳定的一个。
4 合适的引物设计,避免出现引物二聚体,非特异性扩增等。
Q-PCR实验流程:一、①实验前准备,每天早上到实验室后,先把超净工作台的紫外灯打开15-20分钟。
②超净台前做实验,需佩戴干净的橡胶手套/一次性薄膜手套,RNA抽提需带口罩。
实时定量PCR技术(real-time PCR)

样品重复
重复次数请遵循统计学的要求 小样本统计,n>6(n>3) 未知样品和标准品都要重复 所有复管在同样条件下完成PCR
2.2 技术方法及数据
绝对定量与相对定量
绝对定量:绝对标准曲线法
标准品拷贝数的计算 待测样本浓度(ng/ul)=OD260×40×稀释 倍数 样本分子量=碱基数×324 待测样本拷贝数(copies/ul)=待测样本浓 度/样本分子量×6×1014
扩增效率 扩增效率与标准曲线的斜率相关,计算方程为: 扩增效率(E)=10-1/斜率。理论上,在每个指 数扩增循环中,PCR产物的量加倍,即PCR产 物2倍增加,反应效率为2,扩增效率就为2, 就可得2=10-1/斜率,标准曲线得斜率就为-3.32, 斜率得绝对值与荧光曲线间距相同。 如果将扩增效率用百分率来表示,即: E%=(E-1)×100%,对于理想的PCR反应, E=2,即:扩增效率E%=(2-1)×100%=100% 如果E=1.92,带入方程(1.92-1)×100%=92%, 表示每个循环的终点,扩增产物的拷贝数增加 1.92倍,或每次循环有92%的模板被扩增。
TaqMan探针
TaqMan定量原理
荧光共振能量转移(FRET)
当某个荧光基团的发射谱与另一个荧光基团的吸 收光谱重叠,且两个基团距离足够近时,能量可 以从短波长(高能量)的荧光基团传递到长波长 (低能量)的荧光基团,这个过程称为荧光共振 能量转移(FRET),实际相当于短波长荧光基团释放 的荧光被屏蔽。
PCR效率对定量结果的影响
RealTime_RT-PCR实验流程

RealTime RT-PCR实验流程1.样本Total RNA提取- Trizol法提取组织、细胞Total RNA(1)样本处理(细菌、细胞不用研磨);在铝箔中将1cm2大小左右的组织样本敲碎,移至已加入钢珠的Eppendorf管中,使用研磨仪(30 1/s,8min)进行研磨;注:此步操作应尽可能在低温液氮环境下操作,细菌、细胞样本不用研磨。
(2)在研磨后的Eppendorf管中加入1ml Trizol,振荡混匀;(3)将混匀后溶液移至一新Eppendorf管中,加入200μl氯仿,振荡混匀;(4)离心:4℃,12000rpm,15min;(5)将离心后上清液移至一新Eppendorf管中,加入500μl异丙醇,轻轻混匀,室温静置15min;(6)离心:4℃,12000rpm,15min;(7)倒掉上清液,加入1ml 75%乙醇,振荡混匀;(8)离心:4℃,7500rpm,5min;(9)倒掉上清液,并在超净台中将乙醇挥发干净;(10)加入40~60μl DEPC H2O,65℃ 5min助溶;(11)-20℃冷冻保存。
2.Total RNA质量检测(1)NanoDrop测定Total RNA浓度(2μl Total RNA上样)(2)1.5%甲醛变性琼脂糖凝胶电泳检测RNA质量Total RNA 500ng5×Loading Buffer 2μlDEPC H2O to 7~8μl65℃变性5min,冰浴5minEB(500倍稀释)1μl总体积约为8~9μl甲醛变性琼脂糖凝胶:30ml 1×TBE Buffer中加入0.45g琼脂糖,微波炉中加热溶化,轻轻摇动使琼脂糖充分混匀(肉眼观察无颗粒状悬浮物),冷却至60℃左右时加入600μl甲醛,混匀,倒入RNA专用的制胶器中(7.5×5.5cm),室温静置30min左右即可使用。
电泳条件:120~130V,15~20min。
real-time rt-pcr的原理

real-time rt-pcr的原理
实时反转录聚合酶链式反应(real-time RT-PCR)的原理基于实时荧光定量PCR技术,结合了逆转录(RT)和聚合酶链式反应(PCR)两个技术。
首先,通过逆转录将RNA转录成cDNA。
这个过程由逆转录酶和引物完成,
引物与目标RNA序列的特异性序列互补。
当引物与目标RNA序列结合时,逆转录酶开始参与反应,通过循环变化的温度条件,使RNA序列转录成互补的DNA(cDNA)。
然后,这个cDNA作为模板进行PCR扩增。
PCR反应体系中含有荧光探针和
引物,引物与cDNA的特异性序列互补。
当引物与cDNA序列结合时,通过循环变化的温度条件,使DNA片段扩增。
在PCR扩增过程中,荧光信号发生器被激活,荧光信号开始释放。
荧光信号的释放与DNA片段的扩增相关联,通过检测荧光信号的强度,可以实时监测DNA片段的扩增情况。
通过比较荧光信号的强度与标准曲线,可以确定初始样品中目标RNA的量。
总之,实时反转录聚合酶链式反应是一种高灵敏度、高特异性的RNA检测技术,广泛应用于基因表达分析、病毒检测和基因突变研究等领域。
宏石96P Realtime PCR system 标准操作规程

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载宏石96P Realtime PCR system 标准操作规程地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容目的:建立宏石96P Realtime PCR system 标准操作规程,指导操作人员的正常使用和维护保养。
范围:适用于研发部、技术部实验全过程。
责任人:实验室负责人执行:研发部所有人员、技术部所有人员监督管理:研发部负责人、技术部负责人一、使用环境要求不要将SLAN主机安装在强电磁干扰或有高感应系数的仪器旁边,例如:电冰箱、高速离心机、振荡器等;SLAN主机通过风扇散热,主机放置位置离周围物体或墙壁至少要有15cm 距离,以便通风;仪器上不许覆盖任何东西。
仪器必须放在稳固、水平的平面上,避免阳光直射,避免靠近加热设备;仪器在环境温度10~30℃,相对湿度20~80%的室内使用;为了防止电击危害,SLAN主机必须接在符合安规标准的三芯接地插座上,电压为~220V(50Hz);SLAN系统的用户必须经过制造商或经销商的专业技术人员培训后,才能安装及使用本系统。
二、系统操作简易流程新建一文件后,选择对应的模块。
进行反应孔的模板编辑,选择每个反应孔的样品类型,完成每个孔的信息输入。
轻轻推开蓝色滑板,按模板设置的顺序将反应试管正确放置在模块中(48孔),并关上滑板。
新建或打开一个PCR程序,编辑PCR反应的升降温步骤,选择合适的探针。
确认无误后,在程序编辑页面点击“开始”进行实验。
反应结束后,实验结果自动保存在E盘“PCR结果”文件夹中。
点击工具栏中的“数据分析”图标,对结果进行分析;点击“实验结果”选项卡,用户可观察实验结果:浓度值、Ct值、曲线等。
实时荧光定量PCR注意事项及原理(Q-RT)

1)Livak法,即2-△ △ Ct法
条件:目标基因和参照基因扩增效率都接近100%,且相互间效率偏差在5%以内。 首先,用内参基因的Ct值归一目标基因的Ct值, △Ct(test)= Ct(target,test)- Ct(ref,test) △Ct(calibrator)= Ct(target,calibrator)- Ct(ref,calibrator) 其次,用校准样本的△ Ct值归一试验样本的△ Ct值, △ △Ct= △Ct(test)- △Ct(calibrator) 最后,计算表达水平比率, 2-△ △ Ct=表达量的比值
A3:如果待测样本的Ct值高于标准曲线上最低浓度的标准品的Ct值, 增加待测样本量重做实验。
例如:
5 4 3 2 1
无扩增
低表达。通常基因表达检测所需的 cDNA 量为 1 到 100 ng。但
是如果目的基因的丰量的样本中很低,可能就需要更多的样本 量。
反转录问题。检查您的反应中的各组分,通过优化各组分提高 扩增效率。
荧光报告基团:
双链 DNA (dsDNA) 结合染料:SYBR Green I,非特异性结合
在游离状态下,SYBR Green I 发出微弱的荧光,但一旦与dsDNA 结合,其荧光增加1000 倍。
工作原理:
x-轴表示PCR循环数; y-轴表示扩增反应的荧光值,与反应管中扩增产物的量有比例关系
NTC 扩增
当引物二聚体形成时,如果使用与 DNA 双链结合的染料,在
NTC 反应中也可观察到荧光信号。
另一种情况,在存在污染物的情况下,在 NTC 孔中也可看到晚 期扩增。如果由于加样错误引起是一种随机事件,并不是所有 NTC 都会出现扩增。如果在每一个 NTC 反应里都出现扩增,很 可能是其中一种或两种试剂被污染了。
real-time PCR 教程

Real-time qPCR手册---手把手教你从菜鸟到高手由于Real-time qPCR的众多优点,现在已经是生命科学领域的一项常规技术。
越来越多的研究文章中涉及RT-PCR的实验,也基本上被real-time qPCR所代替。
由于real-time aPCR 输出的数据不同于常规的PCR 电泳检测,很多没有做过real-time qPCR的研究者常常感到高深莫测,不知从何入手;甚至一些做过次实验的研究者也会对数据处理分析感到迷惑,不知所措。
本文就从real-time qPCR的发展史说起,包括real-time qPCR的原理,实验设计,实际操作,数据分析,常见问题解答五个方面,手把手教你从各个方面了解real-time qPCR,彻底的从菜鸟到高手!一、Real-time qPCR发展史Real-time qPCR就是在PCR扩增过程中,通过荧光信号,对PCR进程进行实时检测。
由于在PCR扩增的指数时期,模板的Ct 值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
由于常规的PCR的缺点,real-time qPCR由于其操作简便,灵敏度高,重复性好等优点发展非常迅速。
现在已经涉及到生命科学研究的各个领域,比如基因的差异表达分析,SNP检测,等位基因的检测,药物开发,临床诊断,转基因研究等。
在Real-time qPCR技术的发展过程中,定量PCR仪的发展起了至关重要的作用。
1995年,美国PE公司(已经并入Invitrogen公司)成功研制了Taqman技术,1996年推出了首台荧光定量PCR检测系统,通过检测每个循环的荧光强度,通过Ct值进行数据分析。
从而荧光定量PCR获得广泛应用。
现在的定量PCR仪有ABI7000、7300、7500,7700、7900HT、StepOnePlusTM、StepOneTM、PRISM@StepOneTM系列;BIO-RAD的CFX96、iCycler iQ5@、MyiQ@、MJ Research Chromo4TM Opticon 系列;Stratagene MxTM系列;Roche LightCycler@系列;Eppendorf Masercycler@;Corbett Rotor-GeneTM;Cepheid SmartCycler@和BIOER的LineGene系列。
Real-time_PCR_原理(非常经典的PCR文档)
Real-time PCR 原理介绍实时荧光定量PCR技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,它具有特异性更强、有效解决PCR污染问题、自动化程度高等特点,目前已得到广泛应用。
本文试就其定量原理、方法及参照问题作一介绍。
一.实时荧光定量PCR原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
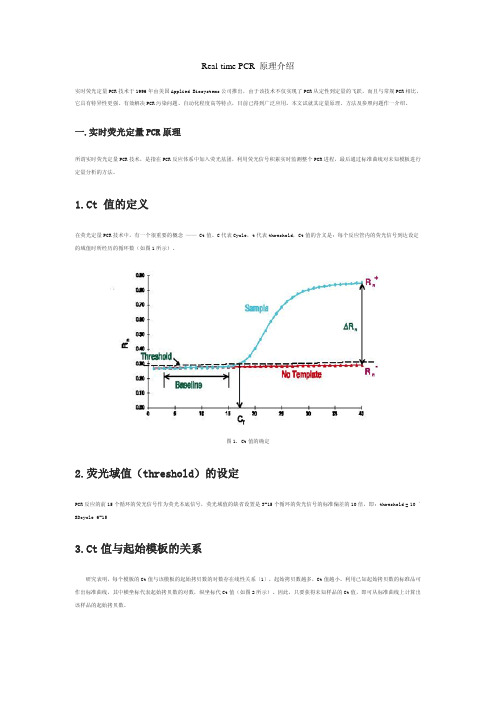
1.Ct 值的定义在荧光定量PCR技术中,有一个很重要的概念 —— Ct值。
C代表Cycle,t代表threshold,Ct值的含义是:每个反应管内的荧光信号到达设定的域值时所经历的循环数(如图1所示)。
图1. Ct值的确定2.荧光域值(threshold)的设定PCR反应的前15个循环的荧光信号作为荧光本底信号,荧光域值的缺省设置是3-15个循环的荧光信号的标准偏差的10倍,即:threshold = 10 ´ SDcycle 6-153.Ct值与起始模板的关系研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系〔1〕,起始拷贝数越多,Ct值越小。
利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代Ct值(如图2所示)。
因此,只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。
图2. 荧光定量标准曲线4.荧光化学荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料〔2〕。
现将其原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
实时荧光定量PCR(Real-Time-PCR)实验流程

实时荧光定量PCR(Real-Time PCR)实验流程一、RNA的提取(详见RNA提取及反转录)不同组织样本的RNA提取适用不同的提取方法,因为Real-Time PCR对RNA样品的质量要求较高,所以,正式实验前要选择一款适合自己样品的提取方法,在实验过程中要防止RNA 的降解,保持RNA的完整性。
在总RNA的提取过程中,注意避免mRNA的断裂;取2ug进行RNA的甲醛变性胶电泳检测,如果存在DNA污染时,要用DNase I进行消化(因为在处理过程中RNA极易降解,建议体系中加入适量RNA酶抑制剂)。
二、DNase I 消化样品RNA 中的DNA用DNase I 消化DNA组份加量模板(RNA) 10ugRNase Inhibitor 4ulDNase I buffer 10ulDNase I 10ulDEPC处理H2O 至100ul混匀,37℃90min三、RNA琼脂糖凝胶电泳1.1%的琼脂糖凝胶电泳凝胶的配制:1)称取琼脂糖0.45g放入三角瓶中,向其中加入4.5ml的10×MOPS缓冲液和39.5ml 的DEPC水,放微波炉里溶化。
2)待冷却到60摄氏度左右时,加入1ml甲醛,摇匀(避免产生气泡)。
倒入凝胶板上凝固30min。
2.取各个RNA样品4µl,加入6×RNA电泳上样缓冲液2µl混匀,加入变性胶加样孔中。
3.120V电压下电泳25min。
用凝胶紫外分析仪观察,照相保存。
4.RNA电泳结果如下图所示。
可见28S和18S两条明亮条带,无DNA条带污染。
四.RNA反转录为cDNA反转录程序(以MBI的M-MLV为例) 组份加量(20ul体系) 加量(40ul 体系)模板(RNA) 0.1~2.5ug(根据条带的亮度适当调整) 3ug(根据条带的亮度适当调整)引物T18(50uM)(或其他引物) 2.0ul 4.0ulDEPC处理H2O 至12.5ul 至25ul混匀,70℃5min,立即冰浴5*buffer 4.0ul 8.0uldNTP(10mM) 2.0ul 4.0ulRNase Inhibitor 0.5ul 1.0ul混匀,37℃5minM-MLV 1.0ul 2.0ul42℃60min ,70℃10min反转录引物的选择与Real-Time PCR引物设计的要求1)随机六聚体引物:当特定mRNA由于含有使反转录酶终止的序列而难以拷贝其全长序列时,可采用随机六聚体引物这一不特异的引物来拷贝全长mRNA。
real-time pcr原理

real-time pcr原理
实时聚合酶链反应(real-time PCR)是一种广泛应用于分子生
物学研究中的技术,用于检测和定量DNA或RNA的存在。
与传统聚合酶链反应(PCR)相比,实时PCR能够提供更快、更准确的结果。
实时PCR基于聚合酶链反应原理,通过扩增目标DNA或
RNA序列来检测其存在。
实时PCR使用一对特异性引物,即
前向引物和反向引物,与目标序列的两侧结合。
在反应过程中,DNA聚合酶会复制模板DNA,并在每个引物的结合位点依次
合成新的DNA链。
然而,与传统PCR不同的是,实时PCR在反应混合物中加入
了一种叫做探针的荧光探测剂。
这种探针通常由一个引物和一个荧光信号发生器组成。
当探针与目标序列结合时,引物会选择性地与模板DNA结合,并将荧光信号发生器离开。
在PCR
反应进行的同时,荧光信号会产生,并且可以实时监测到
PCR反应的进程。
实时PCR设备一般配备了一个光学系统,可以记录PCR反应
过程中产生的荧光信号。
光学系统能够定量检测荧光信号的强度,并将其转化为DNA或RNA的相对数量。
这使得实时
PCR能够定量目标DNA或RNA序列在样本中的存在量。
总的来说,实时PCR结合了PCR的增幅特性和荧光技术的快
速检测特性,可以在PCR反应进行的同时实时监测和定量目
标DNA或RNA序列的存在量。
这使得实时PCR成为现代分子生物学研究中的重要工具。
qRT-PCR流程

qRT-PCR流程摘要:苯酚的主要作⽤是裂解细胞,使细胞中的蛋⽩,核酸物质解聚得到释放。
苯酚虽可有效地变性蛋⽩质,但不能完全抑制RNA酶活性。
qRT-PCR,是Quantitative Real-time PCR 的简称,也叫实时荧光定量PCR,是⼀种在DNA扩增反应中,以荧光化学物质测定每次聚合酶链式反应(PCR)循环后产物的总量,通过内参或者外参法对待测样品中特定DNA序列进⾏定量分析的⽅法。
qRT-PCR⽬前已成为不同样本间进⾏基因表达⽔平差异⽐较权威的⽅法。
然⽽不适当的实验设计,没有⾜够的对照和重复,低质量的RNA样本,逆转录引物选择不理想,qRT-PCR的引物退⽕温度选择不当和数据分析⽅法不正确等都可能会成为影响qRT-PCR检测灵敏度的因素。
下⾯普健⽣物就从8个⽅⾯带你详细了解⼀下qRT-PCR的注意事项,以提⾼你的实验成功率。
1、实验设计 由于RNA易降解,对外在环境敏感,因此在实验条件或样本操作等各个环节都需要严格把控。
2、RNA抽提 RNA的抽提环境⾮常关键。
由于RNA酶⽆处不在和其难以灭活的顽固本性,在实验的每⼀步,任何偶然的疏忽或不妥当的操作都有可能造成RNA酶的污染,从⽽导致整个实验的失败。
因此,严格控制实验条件,避免任何可能的污染,是保证实验成功的关键。
RNA抽提建议⽤专⽤的操作区,离⼼机、移液枪、试剂等均应专⽤;所⽤的耗材、溶液及试剂均应是RNase-free或经过DEPC处理过的(这⼀步很费精⼒但不得不做,所以失败了会很痛苦);操作过程中应始终戴⼀次性橡胶⼿套,并经常更换,以防⼿臂上的细菌、真菌以及⼈体⾃⾝分泌的RNA酶造成污染;避免在操作中说话聊天并且要记得戴⼝罩以防RNA酶污染;提取过程应尽量保持低温环境(所以戴个⼿套是正确的选择)并减少操作时间。
关于什么是Trizol,某百科是这样说的: Trizol是⼀种新型总RNA抽提试剂,可以直接从细胞或组织中提取总RNA。
实时荧光pcr原理

实时荧光pcr原理实时荧光PCR原理。
实时荧光PCR(Real-time PCR)是一种快速、精确、灵敏的PCR技术,它可以实时监测PCR反应中的DNA合成过程。
实时荧光PCR结合了PCR技术和荧光探针技术,能够在PCR反应进行的同时,实时监测PCR产物的累积量,从而可以快速、准确地检测目标DNA的存在和数量。
实时荧光PCR的原理基于PCR技术和荧光探针技术。
在PCR反应中,每一个PCR周期都会使目标DNA序列的数量倍增,同时也会使荧光探针与目标DNA结合并释放荧光信号。
实时荧光PCR仪器可以实时检测PCR反应体系中的荧光信号强度,通过监测荧光信号的变化来确定PCR产物的累积量,从而可以定量检测目标DNA的存在和数量。
实时荧光PCR的关键步骤包括,首先,将待检测的DNA模板与引物和荧光探针一起加入PCR反应体系中;然后,通过PCR仪器进行PCR扩增反应,同时实时监测PCR反应体系中的荧光信号强度;最后,利用PCR仪器的软件分析荧光信号的变化,从而确定目标DNA的存在和数量。
实时荧光PCR的优点在于其快速、准确、灵敏。
相比传统的终点PCR,实时荧光PCR不需要等到PCR反应结束才进行检测,而是可以在PCR反应进行的同时实时监测PCR产物的累积量,从而可以大大缩短检测时间。
同时,实时荧光PCR可以通过荧光信号的实时监测来定量检测目标DNA的数量,具有更高的灵敏度和准确性。
实时荧光PCR在生物医学研究、临床诊断、食品安全等领域有着广泛的应用。
在基因表达分析中,实时荧光PCR可以用来定量检测特定基因的表达水平;在病原微生物检测中,实时荧光PCR可以用来快速、准确地检测病原微生物的存在和数量;在转基因食品检测中,实时荧光PCR可以用来检测转基因成分的含量。
总之,实时荧光PCR作为一种快速、准确、灵敏的PCR技术,具有广泛的应用前景。
随着实时荧光PCR技术的不断发展和完善,相信它将在生命科学领域发挥越来越重要的作用。
Real-time PCR

实时PCR实时PCR(real-time PCR),属于定量PCR(Q-PCR)的一种,以一定时间内DNA的增幅量为基础进行DNA的定量分析。
real time PCR 的定量使用荧光色素,目前有二种方法。
一种是在ds DNA中插入特异的荧光色素,例如SYBR Green荧光染料;另一种使用一种能与增幅DNA序列中特定寡核酸序列相结合的一种荧光探针(probe),如Taqman 探针。
、两种方法原理不同。
SYBR Green荧光染料游离时不发光,当反应体系中存在双链DNA时,SYBR Green与双链DNA结合,此时才发光。
Taqman探针带有一个荧光基团和一个淬灭基团,荧光基团连接在探针的5’末端,而淬灭基团则在3’末端。
PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,此时荧光基团发出的荧光信号可以被检测到。
real time PCR 与 reverse transcription PCR 相结合,能用微量的RNA来找出特定时间、细胞、组织内的特别表达的遗传基因。
这两种RT PCR的组合又被称之为“定量RT-PCR(quantitative RT-PCR)”反应体系oligo: 多聚体,相当于mRNA引物AMV RT:禽类成髓细胞瘤病毒逆转录酶MMLV RT:莫洛尼鼠白血病病毒逆转录酶dNTPs:脱氧核苷酸RNase:RNA酶抑制剂PCR Buffer:RT-PCR缓冲液MgCl2:2价镁离注意事项:绝对定量:几种可能:1. 你的cDNA浓度是不是通过紫外分光测定的?紫外的干扰因素很多,只能作为浓度参考,也就是可能会导致你的内参Ct有差异,正常现象。
2. 反转录的效率,如果你的内参扩增产物在靠近mRNA的3'端影响不大,如果在里面或者5'端,Ct值存在差异正常。
pcr实验流程和注意事项

PCR实验流程如下:
试剂准备阶段:在试剂贮存和准备区的超净工作台或生物安全柜进行,用确保无污染的移液器、枪头及容器等进行分装。
所有的PCR体系都应该在-20℃保存,除了ddH2O之外,其余的试剂组份需完全融化之后再加入,以免影响浓度。
配制反应体系应在快速进行,以减少非特异性扩增。
体系配制完成之后应马上进行PCR反应。
样本制备阶段:样本制备是整个PCR反应中最为关键的环节,在接收样本时一定要确保样本的密封性以及样本编号的唯一性。
严格遵守操作规程进行加样操作,操作时候尽量少说话或者不说话。
所有操作需要在生物安全柜内进行,操作前后生物安全柜需要进行紫外灯消毒,注意生物安全柜中物品的排放。
戴手套并勤于更换,要有无核酸观念。
在样本检测的同时设立对照(阳性对照、阴性对照、阴性模板、试剂对照)。
PCR实验注意事项:
引物长度通常在18-22个碱基之间。
解链温度Tm值通常要在52-58度之间。
GC含量也是一个重要的因素。
以上信息仅供参考,具体步骤和注意事项可能会因实际情况而有所不同,建议咨询专业人士获取更准确的信息。
real time rt-pcr

荧光
SYBR Green 法
延伸结束,形成双链DNA, SYBR Green结合到双螺旋小沟 中,当受到适合光源激发,发射 出荧光,反映产物浓度 优点 – 使用方便,无需复杂的设计
– 成本较低
缺点 – 与非特异性产物结合,无模板 特异性 – 试验方法较难优化 – 灵敏度低
TaqMan探针法
设计特定的探针监测相关产 物浓度 优点 特异性高,可准确定量 灵敏度高 设计不同标记的探针,可进 行多重检测 缺点 一个探针只适用于一个目标 价格较高 探针设计较繁琐
配制SYBR Green Real time PCR反应体系
例
置于Real time PCR仪上进行 PCR反应
SYBR Green Mix ddH20 Primer F Primer R 稀释20倍的cDNA
20μl体系 10 4 1 1 4
采用相对定量2 -△△CT法进 行数据分析
SDS软件
待解决问题
Real Time RT-PCR原理
基本概念
荧光
定量
基本概念
基线:扩增曲线中水平部分 阈值:在荧光扩增曲线上人为设定的一个值,一般设置
是基线荧光信号的标准偏差的10倍。
Ct值:每个反应管内的荧光信号到达设定的阈值时所经
历的循环数
定量
浓度的对数值与 循环数呈线性关 系,根据样品扩 增达到阈值的循 环数(Ct值)就 可分析样品中起 始模板量。
逆转录PCR或 者称反转录 PCR,由RNA 链逆转录成为 互补DNA,再 以此为模板通 过PCR进行 DNA扩增。
实时荧光定量 PCR,在PCR 反应体系中加 入荧光基团, 利用荧光信号 实时监测整个 PCR进程。
实时定量PCR:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Real-Time_PCR实验流程一、RNA 的提取详见 RNA 提取及反转录不同组织样本的 RNA 提取适用不同的提取方法,因为 Real-Time PCR 对 RNA 样品的质量要求较高,所以,正式实验前要选择一款适合自己样品的提取方法,在实验过程中要防止 RNA的降解,保持 RNA 的完整性。
在总 RNA 的提取过程中,注意避免 mRNA 的断裂;取 2ug 进行 RNA 的甲醛变性胶电泳检测,如果存在 DNA 污染时,要用 DNase I 进行消化(因为在处理过程中 RNA 极易降解,建议体系中加入适量 RNA 酶抑制剂)。
二、DNase I 消化样品 RNA 中的 DNA用 DNase I 消化 DNA组份加量模板RNA 10ugRNase Inhibitor 4ulDNase I buffer 10ulDNase I 10ulDEPC 处理 H2O 至 100ul混匀,37℃ 90min三、RNA 琼脂糖凝胶电泳1.1的琼脂糖凝胶电泳凝胶的配制:1)称取琼脂糖 0.45g 放入三角瓶中,向其中加入 4.5ml 的10×MOPS 缓冲液和 39.5ml 的DEPC 水,放微波炉里溶化。
2)待冷却到 60 摄氏度左右时,加入 1ml 甲醛,摇匀(避免产生气泡)。
倒入凝胶板上凝固 30min。
2.取各个 RNA 样品 4l,加入6×RNA 电泳上样缓冲液 2l 混匀,加入变性胶加样孔中。
3.120V 电压下电泳 25min。
用凝胶紫外分析仪观察,照相保存。
4.RNA 电泳结果如下图所示。
可见 28S 和 18S 两条明亮条带,无 DNA 条带污染。
四.RNA 反转录为 cDNA反转录程序以 MBI 的 M-MLV 为例组份加量20ul 体系加量40ul 体系模板RNA 0.12.5ug 3ug根据条带的亮度适当调整引物 T1850uM或其他引物 2.0ul 4.0ulDEPC 处理 H2O 至 12.5ul 至25ul混匀,70℃ 5min,立即冰浴5buffer 4.0ul 8.0uldNTP10mM 2.0ul 4.0ulRNase Inhibitor 0.5ul 1.0ul混匀,37℃ 5minM-MLV 1.0ul 2.0ul42℃ 60mi n ,70℃ 10min反转录引物的选择与 Real-Time PCR 引物设计的要求1)随机六聚体引物:当特定 mRNA 由于含有使反转录酶终止的序列而难以拷贝其全长序列时,可采用随机六聚体引物这一不特异的引物来拷贝全长 mRNA。
用此种方法时,体系中所有 RNA 分子全部充当了 cDNA 第一链模板,PCR 引物在扩增过程中赋予所需要的特异性。
通常用此引物合成的 cDNA中 96来源于 rRNA。
2)OligodT:是一种仅对 mRNA 特异的方法。
因绝大多数真核细胞 mRNA 具有 3端PolyA尾,此引物与其配对,仅 mRNA 可被转录。
由于 PolyARNA 只占总 RNA 的1-4,故此种引物合成的cDNA 比随机六聚体作为引物和得到的 cDNA 在数量和复杂性方面均要小。
特别适合检测多个基因的表达,这样可以节约反转录的试剂,cDNA 可以多次使用,可用于检测稀有基因是否表达、从极少量细胞中定量检测特定 mRNA 的表达水平。
3)特异性引物:最特异的反转录方法是用含目标 RNA 的互补序列的寡核苷酸作为引物,若PCR 反应用二种特异性引物,第一条链的合成可由与mRNA3’端最靠近的配对引物起始。
用此类引物仅产生所需要的 cDNA,导致更为特异的 PCR 扩增。
做 Real Time PCR 时,用于 SYBR Green I/Eva Green 法时的一对引物与一般 PCR 的引物,在引物设计上所要求的参数是不同的。
引物设计的要求:① Tm55-65℃② GC30-80③ PCR 扩增产物长度:引物的产物大小不要太大,一般在80-300bp 之间都可。
④ 引物的退火温度要高,一般要在60℃以上。
要特别注意避免引物二聚体和非特异性扩增的存在。
而且引物设计时应该考虑到引物要有不受基因组 DNA 污染影响的能力,即引物应该跨外显子,最好是引物能跨外显子的接头区,这样可以更有效的不受基因组 DNA 污染的影响。
至于设计软件,PRIMER3,PRIMER5,PRIMER EXPRESS 都应该可以的。
做染料法最关键的就是寻找到合适的引物和做污染的预防工作。
对于引物,你要有从一大堆引物中挑出一两个能用的引物的思想准备---寻找合适的引物非常不易。
五、cDNA 与引物质量检测取 0.2ml 薄壁 PCR 管,编号。
向各管中加入含染料2×PCR TaqMix10ul;加入正反向引物各 0.5ul(引物浓度 10uM) ,向管中加入混合的 cDNA 各 1ul。
各管补加水至 20ul。
组份加量2×PCRTaqMix 10ul10uMPrimer FW 0.5ul10uMPrimer RV 0.5ulTemplate DNA 1ulddH2O 混匀至 20ul 混匀,置于 TP600PCR 仪中。
95℃ 5min;95℃15s,60℃35s ,40cycles;72℃ 5min;4℃ pause。
取扩增产物各 8μl,DL2000 分子量标准 5μl/泳道。
1琼脂糖凝胶 120V 电压下电泳25min。
用凝胶紫外分析仪观察。
选择特异性好,扩增效率高的引物作为实时荧光使用引物。
六、利用相对定量的方法分析目的基因表达量的情况:由于 RNA 纯化后得率不同、RNA 反转录为 cDNA 的效率不同等客观因素,用于定量分析的初始样品浓度不同,因此,在进行基因表达调控研究中都会用一些看家基因来标准化,以校正因样品初始浓度不同而造成的差异。
常用的看家基因有 beta-actin,GAPDH,18SrRNA 等。
因此,在做基因表达调控分析时至少要做两个基因,目的基因和一个看家基因。
七、定量 PCR 检测:取 0.2ml 薄壁 PCR 管,分别编号。
向各管中加入2×qPCR TaqMix12.5ul,10uM 各基因正反向引物混合物 0.5ul,对应的 cDNA 各 1ul。
一管中不加模板用作阴性对照。
各管补加水至 25ul。
组份加量模板cDNA/ddH2O 1.0ul10uM 引物F/R 0.5ul2×qPCR Mix 12.5ulddH2O 11.0ul 混匀,置于 SLAN 荧光定量 PCR 仪中。
95℃5min 预变性后,95℃15s→65℃35s(荧光检测),40cycles。
荧光定量 PCR 一般把退火和扩增设成一个温度,只在扩增出现问题时才会考虑设梯度。
八、扩增曲线和溶解曲线溶解曲线全部为单峰表明为特异性扩增。
一般而言,荧光扩增曲线可以分成三个阶段:荧光背景信号阶段,荧光信号指数扩增阶段和平台期,其形状是一条平滑的 S 型曲线。
如果在荧光背景信号阶段出现很多拐点,可能的原因是体系未混匀或者存在固态杂质;如果向下探头后又很快抬头然后又向下探头,可能原因是体系中模板量太高,建议模板稀释后再用。
如果引物二聚体存在则阴性对照会出现抬头现象,这在 Real-Time PCR 中很难避免;若是阴性对照的溶解曲线出现和样品中同样的峰,说明体系配置中存在污染,则实验结果不可用。
在溶解曲线中出现双峰有三种可能:① 引物峰,引物峰通常是两峰中的前面一个,消除的办法是降低体系中的引物量或重新设计引物;②在做基因表达差异时容易出现 DNA 被扩增峰(只在引物跨内含子时存在),出现原因是提取 RNA 时存在 DNA 污染,可以通过电泳验证,这时要重新消化 RNA 样品中的 DNA;③ 扩增非特异,这时要重新摸扩增或重新设计并验证引物。
九、表达差异的计算方法绝对定量通过标准曲线计算起始模板的拷贝数;相对定量方法则是比较经过处理的样品和未经处理的样品目标转录本或是目标转录本在不同时相的表达差异之间的表达差异。
2-△△CT 方法是实时定量 PCR 实验中分析基因表达相对变化的一种简便方法。
在有些情况下,并不需要对转录本进行绝对定量,只需要给出相对基因表达差异即可。
显然,我们说 X 基因在经过某种处理后表达量增加 2.5 倍比说该基因的表达从 1000 拷贝/细胞增加到 2500 拷贝/细胞更加直观。
2-△△CT 方法的推导(详见实时定量 PCR 和 2-△△CT 法分析基因相对表达量)补充:在 DNase I 消化样品 RNA 中的 DNA 后,需要对样品重新进行氯仿抽提,具体实验流程如下:消化后总体积 10Oul,体积太少,不利于抽提,我们往往补加 200ulDEPC 水。
1. 向离心管中加入等体积氯仿(约 300ul),剧烈颠倒,充分混匀至中层出现白色片状沉淀。
4℃14000 rpm 离心 8min,取上清(约 250ul)。
2. 加入 1/10 体积的 NaAC(3M)(约 25ul)和预冷的等体积异丙醇(约 280ul),-20℃放置 20min。
3. 4℃14000 rpm 离心 15min,去上清,注意不要触到沉淀。
4. 加入 1ml 的 75乙醇,4℃14000rpm 离心 3min,去上清。
5. 瞬时离心,用 200ul(或 10ul)的头小心吸去离心管底的残存液态(勿吸到管底的沉淀)。
6. 把离心管放置于超净台晾至约 5-10 分钟(勿完全干燥,否则很难溶)。
加入 3050μl的无 RNase 的水,静止 1min 后,振荡 30sec,瞬时离心。
.m.m.m 荧光定量 PCR 完全攻略1、什么是定量 PCR以参照物为标准对 PCR 终产物进行分析或对 PCR 过程进行监测从而达到评估样本中靶基因的拷贝数称为定量 PCR.定量 PCR 的可行性定量一般是在 PCR 扩增的指数期进行的.2、定量 PCR 定量的理论依据是什么特定的待扩增基因片段起始含量越大则指数扩增过程越短当扩增速率趋于稳定后则无论原来样品中起始模板含量多少最终扩增片段的含量通常是一样的. 理想的扩增结果:YX2n其中 Y 代表扩增产物量 X 代表 PCR 反应体中的原始模板数 n 为扩增次数理论上 PCR 扩增效率为 100PCR 产物随着循环的进行成指数增长但实际上:DNA 的每一次复制都不完全即每一次扩增中模板不是呈 2 的倍增长实际应为:Y X1En其中 E 代表扩增效率:E 参与复制的模板/总模板通常E≤1E 在整个 PCR 扩增过程中不是固定不变的.通常 X 在 1105拷贝、循环次数n≤30 时E 相对稳定原始模板以相对固定的指数形式增加适合定量分析这也就是所谓的指数期随着循环次数 n 的增加30 次 E 值逐渐减少Y 呈非固定的指数形式增加最后进入平台期.3、荧光定量PCR 定量的理论模式又是什么PCR 是对原始待测模板核酸的一个扩增过程任何干扰 PCR 指数扩增的因素都会影响扩增产物的量使得 PCR 扩增终产物的数量与原始模板数量之间没有一个固定的比例关系通过检测扩增终产物很难对原始模板进行准确定量.近年来研究人员通过大量的实践研究了相对准确的定量 PCR 方法即荧光定量 PCR.PCR 扩增通式:① TnT01En② TnTn-11En注:0。
