临床试验的实验室检测正常值范围
医疗器械_体外诊断试剂临床试验基本文件目录2022版

医疗器械/体外诊断试剂临床试验基本文件目录为指导申办者和医疗器械临床试验机构开展医疗器械(含体外诊断试剂,下同)临床试验,特制定本文件目录供参考执行。
医疗器械临床试验开展顺序一般为:申办者完成临床前相关研究,选择已备案的医疗器械临床试验机构以及主要研究者,并组织临床试验方案等相关文件制定。
伦理委员会审查批准该临床试验,申办者与临床试验机构签订合同后进行医疗器械临床试验项目备案;其中,对人体具有较高风险的第三类医疗器械临床试验,还应当经国务院药品监督管理部门批准。
受试者签署知情同意书以及入组,研究者按照临床试验方案实施临床试验。
申办者在临床试验完成后向所在地省局报告。
一、临床试验准备阶段临床试验保存文件临床试验机构申办者1临床试验申请表保存原件保存2试验方案以及其修正案(已签章)保存原件保存原件3研究者手册保存保存原件4知情同意书文本以及其他任何提供给受试者保存原件保存原件的书面材料5招募受试者和向其宣传的程序性文件(若有)保存原件保存原件6病例报告表文本保存原件保存原件7基于产品技术要求的产品检验报告保存保存原件8临床前研究相关资料保存保存原件9研究者简历以及资格证明文件保存保存10试验医疗器械的研制符合适用的医疗器械质保存保存原件量管理体系相关要求的声明11受试者保险的相关文件(若有)保存保存原件12伦理委员会审查意见保存原件保存原件—1—13伦理委员会成员表(若有)保存原件保存原件14临床试验合同(已签章)保存原件保存原件15医疗器械临床试验批件(若有)保存保存原件16药品监督管理部门临床试验备案文件保存保存原件17启动会相关培训记录保存原件保存18研究者签名样张以及研究者授权表保存原件保存19临床试验有关的实验室检测正常值范围(若保存保存有)20医学或者实验室室间质控证明(若有)保存保存21试验医疗器械标签文本-保存原件22试验医疗器械与试验相关物资的交接单保存原件保存23设盲试验的破盲程序(若有)保存保存原件24总随机表(若有)-保存原件25监查计划-保存原件26试验启动监查报告-保存原件二、临床试验进行阶段临床试验保存文件临床试验机构申办者27研究者手册更新件(若有)保存保存原件28临床试验方案更新件(若有)保存原件保存原件29其他文件(病例报告表、知情同意书、书面保存原件保存原件情况通知)的更新(若有)30试验医疗器械产品检验报告的更新(若有)保存保存原件31伦理委员会对更新文件的书面审查意见(若保存原件保存原件有)32研究者简历以及资格证明文件的更新(若保存保存有)33临床试验有关的实验室检测正常值范围更保存保存新(若有)34医学或者实验室室间质控证明更新(若有)保存保存35试验医疗器械与试验相关物资的交接单(若保存保存有)36已签名的知情同意书(若有)保存原件-37原始医疗文件(若有)保存原件-—2—38已填并签字的病例报告表保存保存39研究者对严重不良事件的报告(若有)保存原件保存40申办者对试验医疗器械相关严重不良事件的报告(若有)保存保存原件41其他严重安全性风险信息的报告(若有)保存保存原件42受试者鉴认代码表保存原件-43受试者筛选表与入选表保存原件-44研究者签名样张以及研究者授权表更新文件(若有)保存原件保存45监查员监查报告-保存原件三、临床试验完成或者终止后临床试验保存文件临床试验机构申办者46试验医疗器械储存、使用、维护、保养、销毁、回收等记录(若有)保存原件(若有)保存原件(若有)47生物样本采集、处理、使用、保存、运输、销毁等各环节的完整记录(若有)保存原件-48所有检测试验结果原始记录(若有)保存原件保存49最终监查报告-保存原件50稽查证明(若有)-保存原件51治疗分配记录(若有)保存保存原件52破盲证明(若有)保存保存原件53研究者向伦理委员会提交的试验完成文件保存原件保存54分中心临床试验小结保存原件(本中心)保存原件55临床试验报告保存原件(组长单位)保存原件—3—。
临床试验启动工作指南

临床试验启动工作指南1.依临床试验中心的地域分布,在征求组长单位及参加单位意见和建议的前提下确定试验启动会议地点、时间。
2•分别与各参研单位商定临床试验启动会议参会人员和日程安排等。
3.考察启动会会议地点,根据实际情况对人员的接送、文件的准备、餐饮和娱乐的安排以及会议记录等进行相应的安排。
4.向各参研单位分发临床试验启动会议邀请函,随函下发会议日程安排。
5.临床试验启动会议的文件准备:⑴临床试验方案。
⑵格式病案(研究病历)和CRF及《CRF填写指南》。
⑶知情同意书初稿。
⑷研究者手册。
⑸临床试验标准操作规程(SOPs )。
⑹国家食品药品监督管理局临床试验批件。
⑺研究者履历表(空白)。
⑻试验用药品、对照品标签(说明书)及包装样品。
⑼《药品临床试验药品发放、回收、清点登记表》(样表)。
⑽《药品临床试验访视表》。
(11)临床试验启动会议日程安排。
(12)临床试验启动会议参加人员签到表(空白)。
(13)实验室检验与检测正常值范围表(空白)。
6.会议由申办者相关领导(或临床试验组长单位药理基地负责人)主持,参加会议人员应包括相关专业(科室)研究者、基地负责人、统计学专家、实验室人员和监查员等。
7.依据会议日程安排对提供的临床试验方案、格式病案和CRF、知情同意书等相关文件依伦理性与科学性原则进行讨论,提出修改和更正意见,最终确定试验用正式文件并签字同意(申办者、主要研究者、监察员签字并注明日期)。
8.就临床试验的标准操作程序(SOPs )、研究者手册和临床试验中实验室检测等进行讨论,同时各研究中心向会议组织者提供本研究中心该项试验所涉中心实验室、急救中心和/或药代动力学室等资质、检测和检查设备与正常值范围,并就实验检测方法、正常值和仪器性能等进行协调统一。
9.就临床试验的开始时间、进度、任务的分配,药品和文件的发放、管理,临床试验人员的培训,临床试验方案的实施,临床试验的组织管理、质量控制(QC)和质量保证(QA),中期协调会的工作安排,临床试验的监查、稽查和多中心临床试验的协调统一等进行协商。
2022药物临床试验知识竞赛真题模拟及答案(4)

2022药物临床试验知识竞赛真题模拟及答案(4)共224道题1、研究者对严重不良事件的报告的描述正确的是()(多选题)A. 完成严重不良事件CRF后,再行报告申办者等B. 手收集严重不良事件信息后,再行报告申办者等C. 立即报告不良严重事件,不因收集资料而拖延D. 应在获知消息后24小时内通过电话或传真向申办者、SFDA及伦理委员会报告试题答案:C,D2、临床试验开始前,研究者和申办者应就哪些问题达成书面协议?()(多选题)A. 试验方案B. 试验的监查C. 稽查和标准操作规程D. 实验中的职责分工达成书面协议试题答案:A,B,C,D3、双盲指哪些人不知道治疗分配?()(多选题)A. 受试者B. 研究者C. 监查员D. 数据分析者试题答案:A,B,C,D4、临床试验开始前,研究者和申办者应就什么达成书面协议?()(多选题)A. 试验方案B. 试验的监查、稽查C. 标准操作规程D. 试验中的职责分工试题答案:A,B,C,D5、伦理委员会的意见不可以是()(单选题)A. 同意B. 不同意C. 作必要修正后同意D. 作必要修正后重审试题答案:D6、下列哪一项不是对伦理委员会的组成要求?()(单选题)A. 至少有一名参试人员参加B. 至少有5人组成C. 至少有一人从事非医学专业D. 至少有一人来自其他单位试题答案:A7、以下说法正确的为()(多选题)A. 多中心临床试验应建立标准化的评价方法,试验中所采用的实验室和临床评价方法均应有质量控制,或由多中心实验室进行。
B. 多中心临床试验的数据资料应集中管理与分析,并建立数据传递与查询程序。
C. 多中心临床试验应建立管理办法以使各试验中心的研究者遵从试验方案,包括在违背方案时中止其继续参加试验的措施。
D. 在多中心临床试验中应加强监查员的职能试题答案:A,B,C,D8、在有关临床试验方案下列哪项是正确的?()(单选题)A. 研究者有权在试验中直接修改试验方案B. 临床试验开始后试验方案决不能修改C. 若确有需要,可以按规定对试验方案进行修正D. 试验中可根据受试者的要求修改试验方案试题答案:C9、下列哪项不包括在试验方案内()(单选题)A. 试验目的B. 试验设计C. 病例数D. 知情同意书试题答案:D10、()指药政管理部门对有关一项临床试验的文件、设施、记录和其他方面所进行的官方审阅,可以在试验点、申办者所在地或合同研究组织所在地进行。
临床试验实验室正常值范围

mmol/L mmol/L mmol/L U/L U/L
umol/L U/L U/L U/L U/L g/L g/L g/L
umol/L umol/L umol/L mmol/L umol/L
0.7
1.5
2
3
0.7
1.2
0
40
0
45
0
3
0
10
30
110
0
50
109
245
5
40
60
80
35
55
20
35
66
181
2.8
7.1
12
22
0.27
4.2
0
35
7 甲状腺球蛋白抗体 8 甲状腺球蛋白
IU/ml ng/ml
0
115
1.4
78
4
检查项目(Test Item)
1 CA72-4 2 CA15-3 3 CA125 4 CEA 5 CA19-9
单位 (Unit) 肿瘤标记物
正常值(Normal Value)
低限(Lower Limit)
高限(Upper Limit)
凝血功能检查
sec.
10.5
13.5
%
70
130
0.85
1.2
sec.
22.5
34
g/L
1.8
4
sec.
甲功八项 1 总T3 2 总T4 3 游离T3 4 游离T4 5 促甲状腺素 6 甲状腺过氧化物酶抗体
单位 (Unit)
正常值(Normal Value)
低限(Lower Limit)
高限(Upper Limit)
临床试验研究者告知书(11版)

临床试验研究者告知书(1.1版)尊敬的研究者:为确保整个项目顺利实施,我们将项目实施过程中的注意事项向您告知:1.为了确保项目顺利启动,建议您在项目实施过程中有任何疑问,可与机构办人员及时联系,我们将不遗余力为您协调处理。
2.项目启动前,由专业组负责人确认主要研究者人选名单并向机构办公室(1)备案,如无特殊原因,由主要研究者组建临床研究小组,确定研究成员名单。
监查员或机构办公室人员将项目相关资料(附件一)递交给您,请您审核方案等,并协助项目负责人填写《伦理申请表》(附件二),递交机构办公室相关责任人处(2或3)。
3.待伦理委员会出审查结果出具批件后,协助机构办公室(2或3)完成项目检查费报价单(以EMAIL形式确认)。
4.项目合同签署时,请务必打印“临床试验合同签署意见表”(中心章,审批时限1个月;机构章,审批时限2周,附件三),主要研究者签署确认后将合同一并递交机构办公室(2或3);同样,在签署总结报告时,也需打印“临床试验总结报告签署意见表”(附件四);相关的申请表格最新内容我们均已公布在我中心内网GCP专栏内。
5.协议签订后,由主要研究者与申办者共同确定启动会日期并向机构办公室报备(2或3),由主要研究者或机构办公室发布会议启动通知。
召开启动会时,应指定一名临床试验协调员/秘书负责记录并撰写会议纪要,方案及可行性讨论后,由主要研究者明确分工授权(参见附件五);6.临床试验协调员/秘书保存启动会相关资料(原件,签到表、PPT和会议纪要等)。
机构办公室(2或3)负责文档归档的监督,并协同主要研究者进行中心内外的协调。
7.项目实施前,药物送至金山总部或市区分部专业组试验药物存放室。
试验药物到达前必须实现与我办公室秘书(2)联系,确保药物是由三方共同签字确认(申办方、药物管理员、机构办公室);同样,在回收药物至申办方时,也请实现联系机构办公室秘书(2)到场确认签字。
8.项目实施中,请PI任命项目组质控员,项目质控员完成项目组内审(两月1次),检查问题上报PI进行项目组内部整改,PI对项目的实施质量负责;专业组质控员每半年度完成专业组内审(每半年一次,集中在4月和10月),质量检查结果进行整改并上报专业组负责人。
(整理)GCP规定临床试验保存文件.

(2)生产、储存危险化学品(包括使用长输管道输送危险化学品)的建设项目;
为了有别于传统的忽视环境价值的理论和方法,环境经济学家把环境的价值称为总经济价值(TEV),包括环境的使用价值和非使用价值两个部分。分类具体内容应编写的环境影响评价文件一、临床试验准备阶段
中期或年度报告
保存
保存
34
受试者鉴认代码表
保存原件
35
受试者筛选表与入选表
保存
保存
36
试验用药品登记表
保存
保存
37
研究者签名样张
保存
保存
三、临床试验完成后
临床试验保存文件
研究者
申办者
38
试验药物销毁证明
保存
保存
39
完成试验受试者编码目录
保存
保存
40
稽查证明件
保存原件
41
最终监查报告
保存原件
42
治疗分配与破盲证明
保存原件
10
临床前实验室资料
保存原件
11
国家食品药品监督管理局批件
保存原件
12
研究者履历及ቤተ መጻሕፍቲ ባይዱ关文件
保存
保存原件
13
临床试验有关的实验室检测正常值范围
保存
保存
14
医学或实验室操作的质控证明
保存原件
保存
15
试验用药品的标签
保存原件
16
试验用药品与试验相关物资的运货单
保存
保存
17
临床检验项目临床意义与解释

(四)同时应用的药物 1、该项目不考虑肝损伤类型 2、无同时服用其他药物,或其他药物 (甚至已知肝损药物)服用与肝损伤起 病时间不符,则不计分。 3、对未知可引起肝损伤的药物,通常 妥善的处理办法是采用5~90天作为“提 示性或相符的时间” 4、对已知可引起肝毒性的药物,则采 用已被认可的肝损伤潜伏期。
RUCAM评分法-解释
(五)非药物性肝损伤因素 1、组I:HAV、HBV、HCV(急性)、胆道梗阻、酗酒、新近 发生过低血压(休克肝) 2、组Ⅱ:CMV、EBV、疱疹病毒感染 3、组I病因较好排除,组Ⅱ病因的排除主要靠临床表现和病史。 (六)药物以往的肝损伤信息 1、该项目评分不考虑肝损伤类型 2、如说明书不可靠,本项评分将特别困难 3、专家们也有可能不认同许多药物潜在的相对肝毒性 (七)对药物再刺激的应答情况 1、阳性:再次单独应用该药物引起了ALT双倍升高(肝细胞型), 或ALP或TBIL水平双倍升高(混合型或胆汁淤积型),计3分 2、相容:在急性肝损伤期间再次应用该药,且ALT、ALP或TBIL 水平出现双倍升高,计1分
病理性:肝胆系统疾病、胆道结石引起的胆管阻塞、肝内胆汁淤积 且与血清胆红素升高相平行、溶血性贫血。
药物性肝损伤-代谢异常机制
1相反应 解毒 肝药酶: 细胞色素P450酶系(CYP) 增强毒性 当解毒酶被抑制 增强毒性的酶被诱导
肝损伤
药物性肝损伤-代谢异常机制
• 2相反应
• 药
乙酰化
甲基化
物
还原型谷胱甘肽 葡萄糖醛酸 谷氨酰胺
临床试验实验室指标的设定,异常值判 定及临床意义解释
实验室检一般项目
血常规:RBC、WBC、NE(%)、Hb等 尿常规:RBC、WBC、Pr等 便常规+OB 生化:AST\ALT\GGT\Tbil\AKP\BUN\Cr\z电解质等 凝血四项:APTT\PT\Fg\TT 血脂:TC\TG\HDL-C\LDL-C
临床试验实验室正常值范围收集流程

临床试验实验室正常值范围收集流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!临床试验实验室正常值范围的收集流程详解临床试验是医学研究的关键环节,其中实验室数据的准确性与可靠性至关重要。
cr的正常值

CR的正常值什么是CR?CR(Complete Response)是医学上用来评估一种治疗方法对肿瘤是否有效的指标。
CR表示完全的缓解或消失,即肿瘤细胞全部死亡或肿瘤全部消失。
CR通常是通过临床检查、影像学和实验室检查来确认的。
在癌症治疗领域,CR是治疗效果显著的重要指标之一。
CR的意义和应用CR作为肿瘤治疗效果的评估指标,其重要性不言而喻。
它可以帮助医生判断病人的疗效,指导治疗方案和调整治疗进程。
对于一些肿瘤类型,如淋巴瘤、白血病等,CR是达到临床治愈的标志。
而对于其他一些恶性肿瘤,CR的达到通常意味着治疗有效,病情得到了控制。
对于临床试验来说,CR也是一个重要的终点指标。
临床试验通常设定CR率作为主要终点指标之一,用于评估新药物或新治疗方案的疗效。
CR率越高,则意味着治疗的有效性越高。
CR的评估方法和标准CR的评估通常包括临床检查、影像学和实验室检查。
常用的CR评估方法包括PET-CT扫描、MRI、CT、骨髓检查等。
在临床实践中,通常使用一些标准来评估CR。
常用的标准包括:1.RECIST(Response Evaluation Criteria in Solid Tumors):该标准主要用于评估实体瘤的治疗效果,对瘤体积的变化进行评估。
2.IWCLL(International Workshop on Chronic Lymphocytic Leukemia):该标准主要用于评估慢性淋巴细胞白血病的治疗效果,对外周血淋巴细胞计数、淋巴结大小、脾脏大小等进行评估。
这些标准通常会根据不同肿瘤类型和治疗方法的不同进行调整,以获得更准确的评估结果。
CR的正常值范围CR的正常值范围是指在特定的临床试验或疗效评估中,CR被认为是治疗有效的范围。
CR的正常值范围通常不是一个具体的数值,而是一个区间。
例如,在某种肿瘤治疗中,CR的正常值范围可能是10%到30%。
也就是说,只有当治疗后的患者达到10%以上30%以下的CR率时,才能被认为是治疗有效。
临床试验通用稽查内容

生物样本测定、复测及归档应按储存条件要求分区贮存管理,并有样本转移记录。
2.4.13
超过保存期后的生物样本,在取得委托方书面同意后,按相关规定进行销毁处理并详细记录。
2.5
原始记录及CRF
2.5.1
临床试验的原始记录保存完整,可溯源。
2.5.2
CRF中的检查数据和信息与检验科、影像科、心电图室、内镜室(LIS、PACS信息系统)等检查数据一致,可溯源。
根据复审决定,向申请人发出伦理审查决定文件。
6.9
审查决定与传达符合SOP要求
6.10
伦理必备文件管理
6.10.1
伦理必备文件资料保存完整,与资料目录一致,符合GCP要求。
6.10.2
保存主要研究者履历,研究者履历内容完整。
6.10.3
伦理委员会批件、签到表、会议记录、委员表决票等保存完整。
6.10.4
6.3
有伦理委员会章程。伦理委员会组成及章程应在卫生行政部门备案,并公开其委员的姓名、职业和隶属关系。
6.4
有独立的伦理资料档案室,资料归档应分类定位、标识清楚,并符合档案管理要求。
6.5
有机构伦理审查(会议审查、快速审查等)、区域伦理审查、中心伦理审查的相关规定和管理制度。
6.6
伦理审查申请与受理符合SOP规定
1.11
有PI授权分工表、研究者签名样张,签名一致、授权分工明确、职责清楚,授权日期合理。
1.12
有研究者履历,数量应与授权分工表中一致,研究者履历内容完整。
1.13
申办者应在临床试验实施前,向机构提交备案资料,备案资料齐全,备案的方案、知情同意书与临床试验执行方案、知情同意书版本一致。
1.14
GCP规定临床试验保存资料

保存保存中期或年度报告33
受试者鉴认代码表保存原件34
保存保存受试者筛选表与入选表35
3
/ 2
保存保存实验用药品登记表36
保存保究者
实验药物销毁证明保存保存38
完成实验受试者编码目录保存保存39
稽查证明件保存原件40
保存原件最终监查报告41
保存保存实验用药品与实验相关物资的运货单25
保存原件新批号实验药物的药检证明26
保存原件监查员访视报告27
保存原件已签名的知情同意书28
保存原件原始医疗文件29
保存原件病例报告表(已填写,签名,注明日期)保存副本30
保存保存原件研究者致申办者的严重不良事件报告31
申办者致药品监督管理局、伦理委员会的严保存原件保存32
临床实验保存文件
一、临床实验准备阶段
临床实验保存文件研究者申办者
保存研究者手册保存1
实验方案及其修正案(已签名)保存保存2
病例报告表(样表)保存保存3
知情同意书保存保存原件4
财务规定保存保存5
多方协议(已签名)(研究者、申办者、合保存保存6
同研究组织)
伦理委员会批件保存原件保存7
保存伦理委员会成员表保存原件8
保存原件临床实验申请表9
保存原件临床前实验室资料10
保存原件国家食品药品监督管理局批件11
保存保存原件研究者履历及相关文件12
保存保存临床实验有关的实验室检测正常值范围13
保存原件医学或实验室操作的质控证明保存14
保存原件实验用药品的标签15
保存实验用药品与实验相关物资的运货单保存16
保存原件实验药物的药检证明17
3
/ 1
保存原件设盲实验的破盲规程18
临床试验管理规程

XXXXXXXXX有限公司一、目的:为了保证新药临床试验过程中遵循科学和伦理道德的原则,使数据的采集、录入和报告做到及时、完整、准确和一致,使受试者的权益和健康得到保护,并保障其安全,保证临床试验遵循己批准的方案、药物临床试验质量管理规范(GCP)和有关法规,使试验结论科学、可靠,根据《中华人民共和国药品管理法》、《药物临床试验质量管理规范》、《药品注册管理办法》、《赫尔辛基宣言》及ICH《人体生物医学研究国际道德指南》等相关法规文件精神,制定本规程。
二、范围:本规程适用于申办者对临床试验过程的管理。
三、责任:研发部。
四、内容:1.临床试验前的准备1.1申办者对临床试验中心的遴选1.1.1申办者在上报药物的临床前研究资料后,根据所申请药物的性质、作用特点、功能主治以及疾病的流行病学、样本量的大小和药品临床试验基地的专业特长等,初步遴选临床试验参加单位和确定参加单位的数量。
1.1.2对初选单位的专业特长、研究资质、人员组成结构、任职行医资格、相关临床试验检查和检测设备以及参研人员参加GCP培训等情况进行现场考察,确认其资质、资源、能力和承担任务量的大小。
1.1.3根据现场考查结果,首先确定临床试验组长单位,经与之协商确立临床试验参加单位,并据此草拟临床试验的《多中心临床试验协调委员会联络表》和《临床试验参加单位初选报告》。
1.1.4国家食品药品监督管理局临床试验批文下达后,申办者根据批文精神,与临床试验组长单位一道最终确定临床试验参加单位。
1.2临床试验文件的起草1.2.1申办者与研究者共同商定起草并签署试验方案、CRF和知情同意书等临床试验文件。
1.2.2申办者起草《研究者手册》,或其替代文件《供临床医师参考的临床前研究药效学、毒理学试验综述》。
1.2.3申办者成立数据和安全监查委员会/数据监查委员会和试验项目小组,根据试验方案设计要求和项目标准由项目小组成员共同制定病例报告表(CRF),监查员可参与部分设计工作。
临床试验标准操作规程

第一部分总则第一条:为了保证新药临床试验过程中遵循科学和伦理道德的原则,使数据的采集、录入和报告做到及时、完整、准确和一致,使受试者的权益和健康得到保护,并保障其安全,保证临床试验遵循己批准的方案、药物临床试验质量管理规范(GCP)和有关法规,使试验结论科学、可靠,根据《中华人民共和国药品管理法》、《药物临床试验质量管理规范》、《药品注册管理办法》、《赫尔辛基宣言》及ICH《人体生物医学研究国际道德指南》等相关法规文件精神,制定本标准操作程序.第二条:药品临床试验依其流程、内容和进程不同,将其划分为临床试验前的准备、启动临床试验、临床试验过程、中期协调会和结束临床试验等五个阶段。
第三条:本标准操作规程是根据药品Ⅱ期临床试验设计要求确立,临床进行的Ⅲ、Ⅳ期临床试验包括部分生物等效性试验均参照本程序执行.第二部分临床试验前的准备第四条:申办者对临床试验中心的遴选。
⑴申办者在上报药物的临床前研究资料后,根据所申请药物的性质、作用特点、功能主治以及疾病的流行病学、样本量的大小和药品临床试验基地的专业特长等,初步遴选临床试验参加单位和确定参加单位的数量。
⑵对初选单位的专业特长、研究资质、人员组成结构、任职行医资格、相关临床试验检查和检测设备以及参研人员参加GCP培训等情况进行现场考察,确认其资质、资源、能力和承担任务量的大小.⑶根据现场考查结果,首先确定临床试验组长单位,经与之协商确立临床试验参加单位,并据此草拟临床试验的《多中心临床试验协调委员会联络表》和《临床试验参加单位初选报告》.⑷国家食品药品监督管理局临床试验批文下达后,申办者根据批文精神,与临床试验组长单位一道最终确定临床试验参加单位。
第五条:申办者起草临床试验文件。
⑴申办者与研究者共同商定起草并签署试验方案、CRF和知情同意书等临床试验文件。
⑵申办者起草《研究者手册》,或其替代文件《供临床医师参考的临床前研究药效学、毒理学试验综述》。
⑶申办者起草《药品临床试验标准操作规程(SOPs)》、《药品临床试验监查工作标准操作规程(SOPs)》、《药品临床试验研究者履历表》、《药品临床试验筹备会议签到表》、《药品临床试验药品发放、回收、清点登记表》、《受试者用药记录卡》和《药品临床试验实验室检查参考正常值范围表》等文件。
药物临床试验质量管理规范(2003年版)

药物临床试验质量管理规范(2003年版)国家食品药品监督管理局令(第3号)二○○三年八月六日第一章总则第一条为保证药物临床试验过程规范,结果科学可靠,保护受试者的权益并保障其安全,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,参照国际公认原则,制定本规范。
第二条药物临床试验质量管理规范是临床试验全过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。
第三条凡进行各期临床试验、人体生物利用度或生物等效性试验,均须按本规范执行。
第四条所有以人为对象的研究必须符合《世界医学大会赫尔辛基宣言》(附录1),即公正、尊重人格、力求使受试者最大程度受益和尽可能避免伤害。
第二章临床试验前的准备与必要条件第五条进行药物临床试验必须有充分的科学依据。
在进行人体试验前,必须周密考虑该试验的目的及要解决的问题,应权衡对受试者和公众健康预期的受益及风险,预期的受益应超过可能出现的损害。
选择临床试验方法必须符合科学和伦理要求。
第六条临床试验用药品由申办者准备和提供。
进行临床试验前,申办者必须提供试验药物的临床前研究资料,包括处方组成、制造工艺和质量检验结果。
所提供的临床前资料必须符合进行相应各期临床试验的要求,同时还应提供试验药物已完成和其它地区正在进行与临床试验有关的有效性和安全性资料。
临床试验药物的制备,应当符合《药品生产质量管理规范》。
第七条药物临床试验机构的设施与条件应满足安全有效地进行临床试验的需要。
所有研究者都应具备承担该项临床试验的专业特长、资格和能力,并经过培训。
临床试验开始前,研究者和申办者应就试验方案、试验的监查、稽查和标准操作规程以及试验中的职责分工等达成书面协议。
第三章受试者的权益保障第八条在药物临床试验的过程中,必须对受试者的个人权益给予充分的保障,并确保试验的科学性和可靠性。
受试者的权益、安全和健康必须高于对科学和社会利益的考虑。
伦理委员会与知情同意书是保障受试者权益的主要措施。
临床试验数据分析要点(GCP)

临床试验数据分析要点5 .3 .1 分析对象的数据集5 .3 .1 .1 全样本分析(Full analysis set )计划治疗原则(intention-to-treat )是指主要分析应当包括所有进入随机化的遵循这一原则需要对所有随机受试者完成随访得到试验结果。
由于各种理由,这在实际上是难以达到的,因此,全样本分析是尽可能接近于包括所有随机受试者,在分析中保留最初的随机化对于防止偏差和提供安全的统计检验基础很重要。
在许多场合,它提供的对治疗效果的估算很可能反映了以后的实际观察结果。
从分析中剔除已随机受试者的情况不多:包括不符合重要入选标准,一次也没有用药,随机化后没有任何数据。
从分析中剔除不符合入选条件受试者必须不致引起偏差:入选标准的测定是在随机化之后;违反合格标准的检测是完全客观的;所有受试者都受到同样的合格性调查;各组实行同样的入选标准,凡违反者均被排除。
5 .3 .1 .2 遵循研究设计对象(Per Protocol Set )"Per Protocol" 对象组,有时称之为" 有效病例"、"有效样本"或"可评价受试者样本;定义为全部分析样本中较好遵循设计书的一个受试者亚组:·完成预先说明的确定治疗方案暴露。
·得到主要变量的测定数据。
·没有违反包括入选标准在内的重要试验设计。
从"有效受试者"组中剔除受试者的精确理由应当在揭盲前就充分限定并有文件记载。
为得到"有效受试者"而排除对象的原因和其他一些违反研究设计的问题,包括对象分配错误、试验中使用了试验方案规定不能用的药物、依从性差、出组和数据缺失等,应当在不同治疗组之间对其类型、发生频率和发生时间进行评价。
5 .3 .1 .3 不同的分析(受试者)组的作用在验证性试验中,通常进行全样本和"有效受试者" 两种分析。
临床试验的实验室检测正常值范围
尿比重
PH值
尿蛋白
尿糖
尿白细胞
尿红细胞
-
-80
﹤150
﹤
0-2
0-偶见
ND
ND
mg/L
mmol/L
HP
HP
大便常规
方法:手工法
(胶体金法)
大便蛔虫卵
大便鞭虫卵
大便吞噬细胞
大便钩虫卵
大便白细胞
大便红细胞
大便脓细胞
0
0
0
0
0
0
0
LPF
LPF
HPF
HPF
HPF
HPF
HPF
心电图仪 GE公司
Mac5000 12导联心电图
g/L
g/L
umol/L
umol/L
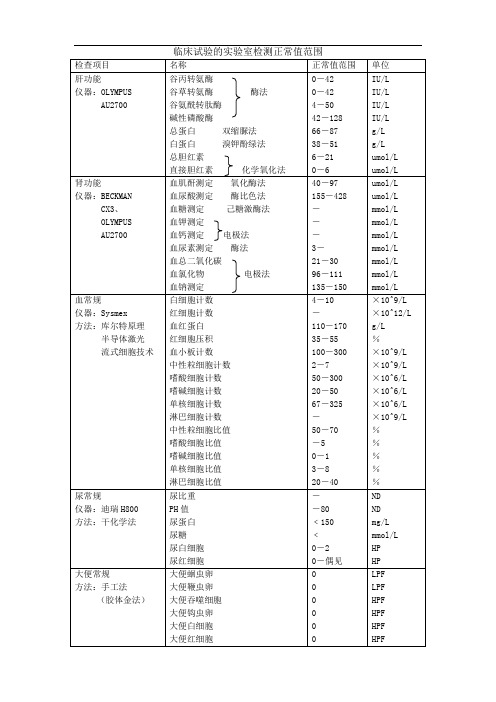
肾功能
仪器:BECKMAN
CX3、
OLYMPUS
AU2700
血肌酐测定氧化酶法
血尿酸测定酶比色法
血糖测定己糖激酶法
血钾测定
血钙测定电极法
血尿素测定酶法
血总二氧化碳
血氯化物电极法
血钠测定
40-97
155-428
-
-
-
3-
21-30
96-111
135-150
umol/L
临床试验的实验室检测正常值范围
检查项目
名称
正常值范围
单位
肝功能
仪器:OLYMPUS
AU2700
谷丙转氨酶
谷草转氨酶酶法
谷氨酰转肽酶
碱性磷酸酶
总蛋白双缩脲法
白蛋白溴钾酚绿法
总胆红素
直接胆红素化学氧化法
0-42
0-42
临床试验项目标准操作规程(SOP)

临床试验项目标准操作规程(SOP)第一部分总则第一条:为了保证新药临床试验过程中遵循科学和伦理道德的原则,使数据的采集、录入和报告做到及时、完整、准确和一致,使受试者的权益和健康得到保护,并保障其安全,保证临床试验遵循己批准的方案、药物临床试验质量管理规范(GCP)和有关法规,使试验结论科学、可靠,根据《中华人民共和国药品管理法》、《药物临床试验质量管理规范》、《药品注册管理办法》、《赫尔辛基宣言》及ICH《人体生物医学研究国际道德指南》等相关法规文件精神,制定本标准操作程序。
第二条:药品临床试验依其流程、内容和进程不同,将其划分为临床试验前的准备、启动临床试验、临床试验过程、中期协调会和结束临床试验等五个阶段。
第三条:本标准操作规程是根据药品Ⅱ期临床试验设计要求确立,临床进行的Ⅱ、Ⅱ期临床试验包括部分生物等效性试验均参照本程序执行。
第二部分临床试验前的准备第四条:申办者对临床试验中心的遴选。
Ⅱ申办者在上报药物的临床前研究资料后,根据所申请药物的性质、作用特点、功能主治以及疾病的流行病学、样本量的大小和药品临床试验基地的专业特长等,初步遴选临床试验参加单位和确定参加单位的数量。
Ⅱ对初选单位的专业特长、研究资质、人员组成结构、任职行医资格、相关临床试验检查和检测设备以及参研人员参加GCP培训等情况进行现场考察,确认其资质、资源、能力和承担任务量的大小。
Ⅱ根据现场考查结果,首先确定临床试验组长单位,经与之协商确立临床试验参加单位,并据此草拟临床试验的《多中心临床试验协调委员会联络表》和《临床试验参加单位初选报告》。
Ⅱ国家食品药品监督管理局临床试验批文下达后,申办者根据批文精神,与临床试验组长单位一道最终确定临床试验参加单位。
第五条:申办者起草临床试验文件。
Ⅱ申办者与研究者共同商定起草并签署试验方案、CRF和知情同意书等临床试验文件。
Ⅱ申办者起草《研究者手册》,或其替代文件《供临床医师参考的临床前研究药效学、毒理学试验综述》。
临床试验文件保存使用说明

临床试验文件保存说明(研究者文件夹)一、在分中心启动会后,第一例受试者入组前必须在该中心研究者处建立此文件夹,包含下述文件:1、备案文件2、中心启动会资料3、研究者相关资料5、临床试验机构说明:(1)研究者文件夹需要保留第一部分(1、备案文件),监查员文件夹不保留。
(2)第一例受试者入组前需要收集:①实验室正常值范围:可以采集检验科空白验单,或采用SOP中‘相关实验室正常值范围’,需要基地盖章,如无法获得基地盖章可以由研究指定负责人签字并注明日期,日期注意要在第一例受试者入组前,一般为启动会日期;②在基地获取‘基地资质证明’、‘医学或实验室操作的质控证明’。
若项目开展超过一年需更新‘医学或实验室操作的质控证明’,若研究基地通过老基地复核并发证书,需获得更新。
③临床研究机构情况调查表:为基地调研时使用,为评估研究中心研究团队及入组能力的考核。
④研究者声明页,主要研究者签字及日期,日期注意要在第一例受试者入组前,一般为启动会日期。
⑤启动会时需要获得启动会会议记录、启动会签到表、研究者签名样张及分工表及主要研究者授权、研究者履历及相关文件(GCP证书)。
请注意在研究者签名样张及分工表上签字的研究者一定要在启动会签到表示上有签字,如有新增加的研究者,需重新填写研究者签名样张及分工表并获得主要研究者授权,并保存对这些研究者进行的项目培训记录(重新填写启动会会议纪要及启动会签到表);被授权的研究者真正参与试验相关工作的需要获得研究者简历,若研究者有GCP证书需获得,若没有可不获得,但主要研究者必须获得GCP证书复印件。
二、在试验过程中请研究者将试验用药品与试验相关物资的运货单保存在该文件夹中;研究者应及时填写或更新试验用药品与试验相关物资的发放、回收记录表、试验用药品登记表、受试者鉴认代码表、受试者筛选入组表、完成试验受试者编码目录、严重不良事件报告表,并保存在此文件夹中;监查员应及时填写或更新监查员访视记录表及监查报告,将复印件保存在研究者文件夹中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
g/L
umol/L
umol/L
肾功能
仪器:BECKMAN
CX3、
OLYMPUS
AU2700
血肌酐测定氧化酶法
血尿酸测定酶比色法
血糖测定己糖激酶法
血钾测定
血钙测定电极法
血尿素测定酶法
血总二氧化碳
血氯化物电极法
血钠测定
40-97
155-428
-
-
-
3-
21-30
96-111
135-150
umol/L
umol/L
mmol/L
mmol/L
mmol/L
mmol/L
mmol/L
mmol/L
mmol/L
血常规
仪器:Sysmex
方法:库尔特原理
半导体激光
流式细胞技术
白细胞计数
红细胞计数
血红蛋白
红细胞压积
血小板计数
中性粒细胞计数
嗜酸细胞计数
嗜碱细胞计数
单核细胞计数
淋巴细胞计数
中性粒细胞比值
嗜酸细胞比值
嗜碱细胞比值
方法:干化学法
尿比重
PH值
尿蛋白
尿糖
尿白细胞
尿红细胞
-
-80
﹤150
﹤
0-2
0-偶见
ND
ND
mg/L
mmol/L
HP
HP
大便常规
方法:手工法
(胶体金法)
大便蛔虫卵
大便鞭虫卵
大便吞噬细胞
大便钩虫卵
大便白细胞大Βιβλιοθήκη 红细胞大便脓细胞0
0
0
0
0
0
0
LPF
LPF
HPF
HPF
HPF
HPF
HPF
心电图仪 GE公司
Mac5000 12导联心电图
临床试验的实验室检测正常值范围
检查项目
名称
正常值范围
单位
肝功能
仪器:OLYMPUS
AU2700
谷丙转氨酶
谷草转氨酶酶法
谷氨酰转肽酶
碱性磷酸酶
总蛋白双缩脲法
白蛋白溴钾酚绿法
总胆红素
直接胆红素化学氧化法
0-42
0-42
4-50
42-128
66-87
38-51
6-21
0―6
IU/L
IU/L
IU/L
IU/L
单核细胞比值
淋巴细胞比值
4-10
-
110-170
35-55
100-300
2-7
50-300
20-50
67-325
-
50-70
-5
0-1
3-8
20-40
×10^9/L
×10^12/L
g/L
%
×10^9/L
×10^9/L
×10^6/L
×10^6/L
×10^6/L
×10^9/L
%
%
%
%
%
尿常规
仪器:迪瑞H800
