江苏省海门市2016届高考化学午间练习十
(精校版)江苏化学高考试题文档版(含答案).docx

高中化学学习材料鼎尚图文收集整理绝密★启封并使用完毕前试题类型:2016年普通高等学校招生全国统一考试(江苏卷)化学注意事项:考生在答题前请认真阅读本注意事项及各题答案要求1.本试卷共8页,包含选择题(第1题~第15题,共15题)和非选择题(第16题~第21题,共6题)两部分。
本卷满分为120分,考试时间为100分钟。
考试结束后,请将本卷和答题卡一并交回。
2.答题前,考生务必将自己的姓名、准考证号用0.5毫米黑色水笔填写在试卷和答题卡规定位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号和本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再涂选其他答案。
做大非选择题,必须用0.5毫米黑色的签字笔在答题卡上的指定位置做大,在其他位置作答一律无效。
5.如需作图,需用2B铅笔绘、写清楚,线条、符号等需加黑、加粗。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5K 39 Ca 40 Mn 55 Fe 56 I 127第Ⅰ卷一、单项选择题:本题共10小题,每小题2分,共计20分,每小题只有一个选项符合题意.............。
1.大气中CO2含量的增加会加剧“温室效应”。
下列活动会导致大气中CO2含量增加的是A.燃烧煤炭供热B.利用风力发电C.增加植被面积D.节约用水用电2. 下列有关化学用语表示正确的是O B.Mg2+的结构示意图:A.中子数为10的氧原子:188C.硫化钠的电子式:D.甲酸甲酯的结构简式:C2H4O23.下列有关物质的性质与用途具有对应关系的是A.SO2具有氧化性,可用于漂白纸浆B.NH4HCO3受热易分解,可用作氮肥C.Fe2(SO4)3易溶于水,可用作净水剂D.Al2O3熔点高,可用作耐高温材料4.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。
江苏省海门市2016届高考化学午间练习十一

午间练习(十一)1.过氧化钙晶体(CaO 2·8H 2O )呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
实验室可用工业碳酸钙(含MgCO 3、FeCO 3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:(1)溶解时常进行加热,其作用是 ,采用水浴加热而不用酒精灯直接加热的原因是(用化学方程式表示)____________ ________ ________ ____________;(2)反应①中发生氧化还原反应的离子方程式为 ;操作Ⅰ中用到的玻璃仪器有;(3)洗涤的目的是除去固体表面吸附的NH 4+、CO 32—离子等。
实验室中检验NH 4+的方法是 。
(4)反应②生成CaO 2·8H 2O 的化学反应方程式为 。
反应时用冰水冷却的主要原因是 ;(5)将过氧化钙晶体在坩埚中加热逐渐升高温度。
测得样品质量随温度的变化如右图曲线所示,则350℃以后所得固 体物质的化学式为。
2.(16分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)用水分解获得氢气的能量变化如右图所示,表示使用催化剂是曲线 。
该反应为 (放热还是吸热)反应(2)1g 的氢气完全燃烧生成液态水释放出142.9k J 的热量写出其完全燃烧的热化学方程式:。
(3)利用氢气和CO 合成二甲醚的三步反应如下:① 2H 2(g) + CO(g) C H 3O H (g);ΔH = -90.8kJ·mol -1② 2CH 3OH(g) CH 3OCH 3(g) + H 2O (g);ΔH = -23.5 kJ·mol -1③ CO(g) + H 2O (g) C O 2(g) + H 2(g);ΔH = -41.3 kJ·mol -1总反应:3H 2(g) + 3CO(g) CH 3OCH 3(g) + C O 2 (g)的ΔH =50 150 250 350 T/℃(4)氢氧燃料电池能量转化率高,具有广阔的发展前景。
2016年高考江苏卷化学试题(附含答案解析)

试题类型:2016年普通高等学校招生全国统一考试(江苏卷)化学注意事项:考生在答题前请认真阅读本注意事项及各题答案要求1.本试卷共10页,包含选择题(第1题~第15题,共15题)和非选择题(第16题~第21题,共6题)两部分。
本卷满分为120分,考试时间为100分钟。
考试结束后,请将本卷和答题卡一并交回。
2.答题前,考生务必将自己的姓名、准考证号用0.5毫米黑色水笔填写在试卷和答题卡规定位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号和本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再涂选其他答案。
做大非选择题,必须用0.5毫米黑色的签字笔在答题卡上的指定位置做大,在其他位置作答一律无效。
5.如需作图,需用2B铅笔绘、写清楚,线条、符号等需加黑、加粗。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 I 127第Ⅰ卷一、单项选择题:本题共10小题,每小题2分,共计20分,每小题只有一个选........项符合题意.....。
1.大气中CO2含量的增加会加剧“温室效应”。
下列活动会导致大气中CO2含量增加的是A.燃烧煤炭供热B.利用风力发电C.增加植被面积D.节约用电用水2. 下列有关化学用语表示正确的是O B.Mg2+的结构示意图:A.中子数位10的氧原子:188C.硫化钠的电子式:D.甲酸甲酯的结构简式:C2H4O23.下列有关物质的性质与用途具有对应关系的是A.SO2具有氧化性,可用于漂白纸浆B.NH4HCO3受热易分解,可用作氮肥C.Fe2(SO4)3易溶于水,可用作净水剂D.Al2O3熔点高,可用作耐高温材料4.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。
2016江苏高考化学试题(清晰WORD版)

2016年普通高等学校招生全国统一考试(江苏卷)化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5K 39 Ca 40 Mn 55 Fe 56 I 127选择题单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个....选项符合题意。
1.大气中CO2含量的增加会加剧“温室效应”。
下列活动会导致大气中CO2含量增加的是2.下列有关化学用语表示正确的是为10的氧原子:2+的结构示意图:C.硫化钠的电子式:D.甲酸甲酯的结构简式:C2H4O23.下列有关物质的性质与用途具有对应关系的是具有氧化性,可用于漂白纸浆2HCO3受热易分解,可用作氮肥4(SO4)3易溶于水,可用作净水剂2D.Al2O3熔点高,可用作耐高温材料4.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。
下列说法正确的是A.元素X、W的简单阴离子具有相同的电子层结构B.由Y、Z两种元素组成的化合物是离子化合物D.原子半径:r(X)<r(Y)<r(Z)<r(W)5.下列指定反应的离子方程式正确的是A.将铜丝插入稀硝酸中:Cu+4H++2NO3-=== Cu2++2NO2↑+H2OB.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe === 2 Fe3+C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2 Na+6.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是7.下列说法正确的是A.氢氧燃料电池工作时,H2在负极上失去电子B.0.1mol·L -1Na 2CO 3溶液加热后,溶液的pH 减小C.常温常压下, Cl 2中含有的分子数为6.02×1023个D.室温下,稀释0.1mol·L -1CH 3COOH 溶液,溶液的导电能力增强8.通过以下反应均可获取H 2。
【全国百强校】江苏省海门中学2016届高三9月学情调研化学试题解析(解析版)

可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 P 31 S 32 Cl 35.5 K 39 Cr 52Fe 56 Cu 64 I 127选择题单项选择题:本题包括10小题,每小题只有一个选项符合题意。
1.下列有关说法正确的是A.Fe与S混合加热生成FeS2B.Fe(OH)3胶体无色、透明,能发生丁达尔现象C.H2、SO2、CO2三种气体都可用浓硫酸干燥D.SiO2既能和氢氧化钠溶液反应,也能和氢氟酸反应,所以是两性氧化物【答案】C考点:常见元素及其化合物的物质2.浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是A.酸性B.脱水性C.强氧化性D.吸水性【答案】A【解析】试题分析:浓硫酸和含有水分的蔗糖作用,被脱水后生成了黑色的炭(碳化),并会产生二氧化硫.反应过程分两步,浓硫酸吸收水,蔗糖(C12H22O11)在浓硫酸作用下脱水,生成碳和水(试验后蔗糖会变黑,黑的就是碳颗粒),这一过程表现了浓硫酸的吸水性和脱水性:第二步,脱水反应产生的大量热让浓硫酸和C发生反应生成二氧化碳和二氧化硫,这一过程表现了浓硫酸的强氧化性,答案为A。
考点:考查浓硫酸的性质,浓硫酸除了具有酸性,还具有吸水性、脱水性和强氧化性。
3.实验室抽取少量干燥的氨气涉及下列装置,其中正确的是A.①是氨气发生装置B.②是氨气吸收装置C.③是氨气发生装置D.④是氨气收集、检验装置【答案】C【考点定位】考查氨气的实验室制备【名师点晴】本题是结合实验目的对实验装置的探究,只要准确分析装置的特点并结合氨的性质与制备原理去分析,如装置①涉及制备原理、②考查氨气的物理性质及防倒吸操作、③考查常见氨气的制备方法、④氨气的收集与检验,再逐一判断存在的缺陷,通过排除确定正确选项。
4.下列叙述不正确的是A.热的浓盐酸可以除去烧瓶内残留的MnO2B.过量的铜与浓硝酸反应会有一氧化氮生成C.稀硝酸可除去试管内壁的银镜D.白磷在空气中加热到一定温度能转化成红磷【答案】D【解析】试题分析:A.MnO2和热的浓盐酸能反应生成可溶性的盐,A正确;B.过量的铜与浓硝酸反应先生成二氧化氮,随着反应进行硝酸的浓度减小,稀硝酸与Cu反应生成一氧化氮,B正确;C.试管内壁的银镜通常用稀硝酸洗涤,C正确;D.白磷与氧气反应,则应隔绝空气发生白磷与红磷的转化,D错误;答案为D。
江苏省海门实验学校2016届高三化学苏教版:午间练习2 Word版

高三化学午间练习(二)可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5K-39 Fe-56 Cu-64 Pd -106单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个....选项符合题意。
1.化学与生活生产、环境保护、资源利用、能源开发等密切相关。
下列说法不正确的是A .实施“雨污分流”工程,可提高水资源的利用率B .煤的气化、液化是使煤变成清洁能源的有效途径C .垃圾分类有利于资源回收利用,废易拉罐属不可再生废物D .合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 2A .CO 2B .S 2-的结构示意图:C .质子数为53,中子数为78的碘原子:131 53ID .过氧化氢的电子式:H +H3.设N A 表示阿伏加德罗常数的值。
下列叙述正确的是A. 标准状况下,11.2 L 乙醇中含有的碳氢键数为2.5N AB. 常温常压下,28 g C 2H 4、CO 的混合气体中含有碳原子的数目为1.5N AC. 常温下,20 L pH =12的Na 2CO 3溶液中含有的OH -离子数为0.2N AD. 标准状况下,2.24LCl 2与足量的NaOH 溶液反应,转移的电子数目为0.2 NA 4.下列各组离子在指定溶液中一定能够大量共存的是A .在含有大量HCO 3―的溶液中:Na +、NO 3-、Cl -、AlO 2- B .加铝粉放出大量H 2的溶液中:K +、NH 4+、SO 42-、Br -C .含0.1mol·L —1NO 3-的溶液:H +、Fe 2+、Mg 2+、Cl -D .能使甲基橙变红的溶液中:Na +、NH 4+、SO 42-、NO 3-5.下列有关物质的性质和该性质的应用均正确的是 A .二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气 B .氢氟酸具有强酸性,用氢氟酸蚀刻玻璃C .氨气具有氧化性,用浓氨水检验Cl 2管道是否泄漏D .钠的金属性比钾强,工业上用钠制取钾() 6.X 、Y 、Z 、W 为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。
【推荐】江苏省2016年高考化学复习试题:专题十 重要的有机化合物 导航卷 Word版含答案

专题十重要的有机化合物导航卷[本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共60分,考试时间50分钟]可能用到的相对原子质量:H—1C—12N—14O—16Na—23Mg—24Al—27S—32Mn—55Fe—56第Ⅰ卷(选择题共24分)一、不定项选择题(本题共6小题,每小题4分。
在每小题给出的四个选项中,有一个或两个选项符合题目要求)1.(2015·江苏化学,12)己烷雌酚的一种合成路线如下:下列叙述正确的是()A.在NaOH水溶液中加热,化合物X可发生消去反应B.在一定条件下,化合物Y可与HCHO发生缩聚反应C.用FeCl3溶液可鉴别化合物X和YD.化合物Y中不含有手性碳原子2.(2014·江苏化学,12)去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。
下列说法正确的是()A.每个去甲肾上腺素分子中含有3个酚羟基B.每个去甲肾上腺素分子中含有1个手性碳原子C.1 mol去甲肾上腺素最多能与2 mol Br2发生取代反应D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应3.(2013·江苏化学,12)药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是()A.贝诺酯分子中有三种含氧官能团B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应D.贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠4.(2012·江苏化学,11)普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。
下列关于普伐他汀的性质描述正确的是()A.能与FeCl3溶液发生显色反应B.能使酸性KMnO4溶液褪色C.能发生加成、取代、消去反应D.1 mol 该物质最多可与1 mol NaOH 反应5.(2011·江苏化学,11)β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。
江苏省海门市2016届高考化学午间练习三

午间练习(三)1、图表法、图象法是常用的科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:(1)以上10种元素中第一电离能最小的是________(填编号)。
比元素B原子序数大10的元素在元素周期表中的位置:________周期,________族,其基态原子的核外电子排布是____________________________________________。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是________________(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是_________________,__________________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。
其分子中共形成________个σ键,________个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第________族。
图(B)是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第________族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是________,理由是________________________________________________________________________。
2、叠氮化钠(NaN 3)是一种无色晶体,常见的两种制备方法为2NaNH 2+N 2O===NaN 3+NaOH +NH 3,3NaNH 2+NaNO 3===NaN 3+3NaOH +NH 3↑。
回答下列问题:(1)氮所在的周期中,电负性最大的元素是________,第一电离能最小的元素是________。
(2)基态氮原子的L 层电子排布图为______________。
江苏省海门市2016届高考化学午间练习五

午间练习(五)1.(2015·重庆高考·8)某汽车安全气囊的产气药剂主要含有NaN 3、Fe 2O 3、KClO 4、NaHCO 3等物质。
当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN 3是气体发生剂,受热分解产生N 2和Na ,N 2的电子式为 。
(2)Fe 2O 3是主氧化剂,与Na 反应生成的还原产物为 (已知该反应为置换反应)。
(3)KClO 4是助氧化剂,反应过程中与Na 作用生成KCl 和Na 2O,KClO 4含有化学键的类型为 ,K 的原子结构示意图为 。
(4)NaHCO 3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100 g 上述产气药剂产生的气体通过碱石灰后得到N 233.6 L(标准状况)。
①用碱石灰除去的物质为 ;②该产气药剂中NaN 3的质量分数为 。
2.(2015·浙江高考·27)Ⅰ.请回答:(1)H 2O 2的电子式 。
(2)镁燃烧不能用CO 2灭火,用化学方程式表示其理由 。
(3)在AgCl 沉淀中加入KBr 溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 。
(4)完成以下氧化还原反应的离子方程式:Mn + C 2+ Mn 2++ CO 2↑+ O -4O 2-4Ⅱ.化合物甲和NaAlH 4都是重要的还原剂。
一定条件下金属钠和H 2反应生成甲。
甲与水反应可产生H 2,甲与AlC l 3反应可得到NaAlH 4。
将4.80 g 甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H 2。
请推测并回答:(1)甲的化学式 。
(2)甲与AlCl 3反应得到NaAlH 4的化学方程式 。
(3)NaAlH 4与水发生氧化还原反应的化学方程式 。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe 2O 3),脱锈过程发生反应的化学方程式 。
江苏省海门实验学校2016届高三化学苏教版:午间练习六

高三化学午间练习(六)1.(2015·海南高考·14)单质Z是一种常见的半导体材料,可由X 通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:(1)能与X发生化学反应的酸是;由X制备Mg2Z的化学方程式为。
(2)由Mg2Z生成Y的化学方程式为,Y分子的电子式为。
(3)Z、X中共价键的类型分别是、。
2.(2015·全国卷Ⅰ·27)硼及其化合物在工业上有许多用途。
以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:回答下列问题:(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式。
为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_________________________________________________________________________(写出两条)。
(2)利用的磁性,可将其从“浸渣”中分离.“浸渣”中还剩余的物质是(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是。
然后再调节溶液的pH约为5,目的是。
(4)“粗硼酸”中的主要杂质是(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为.(6)单质硼可用于生产具有优良抗冲击性能的硼钢。
以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程.3.(2015·天津高考·9)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。
湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。
某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:回答下列问题:(1)反应Ⅰ是将Cu转化为Cu(NH3,反应中H2O2的作用是。
高考化学 午间练习1(2021年整理)

江苏省海门市2016届高考化学午间练习1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(江苏省海门市2016届高考化学午间练习1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为江苏省海门市2016届高考化学午间练习1的全部内容。
午间练习(一)可能用到的相对原子质量:H —1 C-12 N —14 O-16 Al —27 Mn-55 Ni-59 Ag —108 单项选择题:(本题包括10小题,每小题2分,共计20分。
每小题只有一个....选项符合题意。
) 1.我国科学家制得了SiO 2超分子纳米管,微观结构如图。
下列叙述正确的是 A .SiO 2与干冰的晶体结构相似 B .SiO 2耐腐蚀,不与任何酸反应 C .工业上用SiO 2制备粗硅D .光纤主要成分是SiO 2,具有导电性 2.下列关于化学用语的表示正确的是A .HClO 的电子式:B .中子数为16的硫原子:C .K +的结构示意图: D .对硝基甲苯的结构简式:3.25℃时,下列各组离子在指定溶液中一定能大量共存的是A .pH =1的溶液中:Na +、NH 4+、NO 3-、ClO -B .=10—10的溶液中:K +、Ba 2+、NO 3-、Cl - C .0。
1 mol ·L -1NaAlO 2溶液中:Na +、Al 3+、HCO 3—、SO 42-D .常温下,在c (H +)水·c (OH -)水=10—26的溶液中:K +、Fe 2+、Cl -、NO 3- 4.右图是金属镁和卤素单质(X 2)反应的能量变化示意图。
下列说法正确的是A .由MgCl 2制取Mg 是放热过程B .热稳定性:MgI 2>MgBr 2>MgCl 2>MgF 2C .常温下氧化性:F 2<Cl 2<Br 2<I 2D .由图可知此温度下MgBr 2(s )与Cl 2(g)MgBr 2(s )+Cl 2(g )=MgCl 2(s )+Br 2(g ),ΔH =-117kJ·mol -11632 S H :O :Cl : . .. . . . . . c (H +)c (OH —)– 400 0反应进程 E / k J ·m o l –1– 800– 1200– 364 MgI 2(s)– 524 MgBr 2(s) – 641 MgCl 2(s)– 1124 MgF 2(s) Mg (s )+X 2(g )5.下列物质性质与应用对应关系不.正确..的是 A .生石灰能与水反应,可用于实验室干燥氯气 B .二氧化氯具有强氧化性,可用于自来水的杀菌消毒 C .常温下,铝与浓硫酸发生钝化,可用铝槽车贮运浓硫酸 D .钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属6.下列有关实验装置进行的相应实验,不.能.达到实验目的的是A .用装置甲制取氯气B .用装置乙除去氯气中的少量氯化氢和水蒸气C .用装置丙可证明Cl 2的氧化性强于SD .用装置丁可以完成“喷泉”实验7.设N A 为阿伏伽德罗常数的值。
江苏省海门市高考化学午间练习四

午间练习(四)1、X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为1s22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N-CH2-CH2-NH2)形成配离子:回答下列问题:(1)W原子的核外电子排布式为____________________________,上述配离子中含有的化学键类型有____________(填字母)。
a。
配位键 b. 极性键 c. 离子键 d。
非极性键(2)元素X、Y、V第一电离能由大到小的顺序是_____________________ (用元素符号表示).(3)Z的氢化物的空间构型是________;该氢化物的沸点比甲烷的高,其主要原因是________________________________________________________________________。
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是_____________。
(5)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为_________分子(填“极性"或“非极性”);XeO3分子中中心原子的杂化类型为_______;XeO3分子的空间构型为___________.2、配位化合物在生产生活中有重要应用,请根据要求回答下列问题:(1)现有Ti3+的配合物[TiCl(H2O)5]Cl2·H2O。
该配合物的配体是________,配位数是________.(2)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在________。
a. 共价键b. 非极性键 c。
配位键 d。
σ键 e. π键(3)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象,则第一种配合物的结构式为________________________,第二种配合物的结构式为________________________,如果在第二种配合物溶液中滴加AgNO3溶液时,产生的现象是_____________________________________.3、X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):(1)R的基态原子的核外电子排布式是___________________________________________。
高考化学 午间练习四(2021年整理)

江苏省海门市2016届高考化学午间练习四编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(江苏省海门市2016届高考化学午间练习四)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为江苏省海门市2016届高考化学午间练习四的全部内容。
午间练习(四)1、X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为1s22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N -CH2-CH2-NH2)形成配离子:回答下列问题:(1)W原子的核外电子排布式为____________________________,上述配离子中含有的化学键类型有____________(填字母)。
a。
配位键 b. 极性键 c. 离子键 d。
非极性键(2)元素X、Y、V第一电离能由大到小的顺序是_____________________ (用元素符号表示).(3)Z的氢化物的空间构型是________;该氢化物的沸点比甲烷的高,其主要原因是________________________________________________________________________。
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是_____________。
(5)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为_________分子(填“极性"或“非极性”);XeO3分子中中心原子的杂化类型为_______;XeO3分子的空间构型为___________.2、配位化合物在生产生活中有重要应用,请根据要求回答下列问题:(1)现有Ti3+的配合物[TiCl(H2O)5]Cl2·H2O。
江苏省海门市高考化学午间练习九

午间练习(九)注:每小题有一个或两个.....选项符合题意 1.下列离子组在指定溶液中一定能大量共存的是A .c (I -)=0.1 mol·L -1的溶液中: Na +、Fe 3+、SO 42-、Cl -B .由水电离产生的c(OH -)=1×10-10 mol·L -1的溶液中:Ba 2+、K +、NO 3-、Cl -C .0.2 mol·L -1NaHC 2O 4溶液中:Ca 2+、Na +、OH -、Cl -D .加入Al 能放出H 2的溶液中:K +、NH 4+、NO 3-、Cl -2.下列各组物质中,物质之间通过一步反应就能实现右图所示转化的是 编号 a b c d① Na 2O Na 2O 2 Na NaOH ② Al 2O 3 NaAlO 2 Al Al (OH)3 ③ FeCl 2 FeC13 Fe CuCl 2 ④ NO NO 2 O 2 HNO 3A .①②③B .②③④C .②③D .③④3.有Fe 2+、NO 3-、Fe 3+、NH 4+、H +和H 2O 六种粒子,分别属于同一氧化还原反应中的 反应物和生成物,下列叙述不正确的是A .氧化剂与还原剂的物质的量之比为1︰8B .该过程说明Fe (NO 3)2溶液不宜加酸酸化C .若有l mol NO 3-发生氧化反应,则转移8mol e -D .若把该反应设计为原电池,则负极反应为Fe 2+-e -=Fe 3+ 4.设N A 为阿伏加德罗常数的值,下列叙述正确的是A .25℃,pH=1的硫酸溶液中含有的H +数目为0。
1N AB .0。
15 mol NO 2与水完全反应时转移的电子数为0。
1N AC .1 L 1 mol ·L -1的Na 2CO 3溶液中含有阴离子个数大于N AD .电解饱和食盐水,当阴极产生2。
24L H 2时,则转移的电子数为0.2N A5.下列图示与对应的叙述相符的是 a b d c3%食盐溶液 ZnFe图1 图2 图3 图4 A.图1表示表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线B.图2表示压强对可逆反应2A(g) +2B(g)3C(g)+D(s)的影响,乙的压强比甲的压强大(注:纵坐标表示反应物A的体积分数)C.图3中正极为铁,其电极反应式:2H+ + 2e- = H2↑D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA 溶液的pH小于同浓度的NaB溶液的pH6.下列离子方程式表达正确的是A.将过量S O2气体通入氨水中:SO2+2NH3·H2O=2NH4++SO32-B.硫化钠水溶液呈碱性的原因:S2-+2H 2O H2S + 2OH-C.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2OD.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-= 2FeO42-+3Cl-+5H2O7.以葡萄糖为燃料的微生物燃料电池结构示意图如下图所示。
高考一轮复习江苏省海门实验学校高三化学午间练习十一
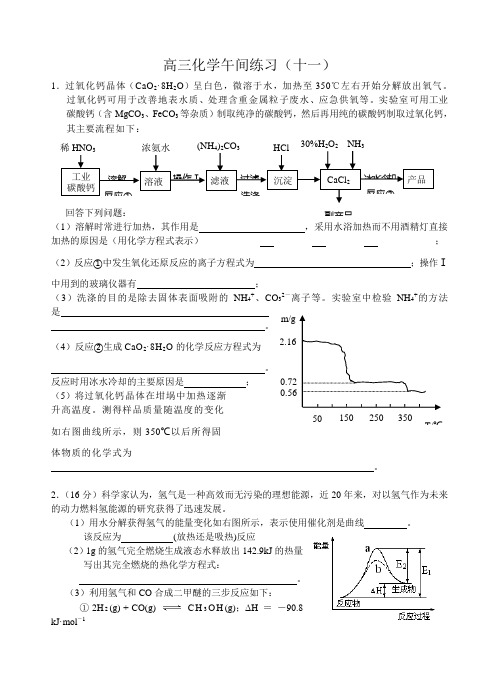
高三化学午间练习(十一)1.过氧化钙晶体(CaO 2·8H 2O )呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
实验室可用工业碳酸钙(含MgCO 3、FeCO 3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:回答下列问题:(1)溶解时常进行加热,其作用是 ,采用水浴加热而不用酒精灯直接加热的原因是(用化学方程式表示)____________ ________ ________ ____________;(2)反应①中发生氧化还原反应的离子方程式为 ;操作Ⅰ中用到的玻璃仪器有 ;(3)洗涤的目的是除去固体表面吸附的NH 4+、CO 32—离子等。
实验室中检验NH 4+的方法是 。
(4)反应②生成CaO 2·8H 2O 的化学反应方程式为 。
反应时用冰水冷却的主要原因是 ;(5)将过氧化钙晶体在坩埚中加热逐渐升高温度。
测得样品质量随温度的变化如右图曲线所示,则350℃以后所得固 体物质的化学式为。
2.(16分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)用水分解获得氢气的能量变化如右图所示,表示使用催化剂是曲线 。
该反应为 (放热还是吸热)反应(2)1g 的氢气完全燃烧生成液态水释放出142.9kJ 的热量写出其完全燃烧的热化学方程式:。
(3)利用氢气和CO 合成二甲醚的三步反应如下:① 2H 2(g) + CO(g) C H 3O H (g);ΔH = -90.8kJ·mol -1② 2CH 3OH(g) CH 3OCH 3(g) + H 2O (g);ΔH = -23.5 kJ·mol -1③ CO(g) + H 2O (g) C O 2(g) + H 2(g);ΔH = -41.3 kJ·mol -1总反应:3H 2(g) + 3CO(g) CH 3OCH 3(g) + C O 2 (g)的ΔH = 副产品 30%H 2O 2 NH 3 工业 碳酸钙 溶液 滤液 CaCl 2 产品 溶解 稀HNO 3 反应① 浓氨水 操作Ⅰ (NH 4)2CO 3过滤 洗涤沉淀 HCl 冰水冷却 反应② 50 150 250 350 2.160.72 0.56 T/℃ m/g(4)氢氧燃料电池能量转化率高,具有广阔的发展前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
午间练习(十)
1.(12分)电镀污泥主要含有Cr 2O 3、NiO 和Fe 2O 3等物质,可制备Na 2Cr 2O 7溶液和NiSO 4·6H 2O 晶体,实现有害物质的资源化利用。
已知黄钠铁矾[NaFe 3(SO 4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。
(1)焙烧时Cr 2O 3被氧化为Na 2CrO 4,该反应的化学方程式为。
(2)写出酸化时CrO 42—
转化为Cr 2O 72—
的离子方程式: 。
(3
)①加入CaCO 3的目的是中和溶液中的酸,调节溶液pH ,提高铁的去除率。
溶液pH 对除铁
效率影响如下图所示。
则除铁时应控制溶液的pH 为 (填序号)。
A .0.5~1.5 B .1.5~2.5 C .2.5~3.5 ②除铁时发生反应的离子方程式为。
③若除铁时pH 稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是 。
(4)从滤液中获取NiSO 4·6H 2O 晶体的操作为 、冷却结晶、过滤、 、
干燥。
227铁的去除率/ %
溶液pH 对除铁效率的影响
1
2
3
4
2.(12分)过氧化银(Ag 2O 2)作为活性物质,广泛应用于抗菌消毒和化学能源等领域。
(1)过氧化银抗菌消毒的可能原因是 。
(2)Al -Ag 2O 2电池可用作水下动力电源,其原理如题2图-1所示。
该电池的负极反应式
为 。
(3)用NaClO -NaOH 溶液氧化AgNO 3,制得高纯度的纳米级Ag 2O 2。
写出该反应的离子方程
式: 。
(4)用上述方法制得的Ag 2O 2会含有少量的Ag 2O 。
可用热重分析法测定Ag 2O 2的纯度。
其步骤如下:
取某样品27.12g 在N 2气氛下加热,测得不同温度下对应的剩余固体的质量与温度的关系曲线(即失重曲线)如题2图-2所示。
①CD 段发生反应的化学方程式是 。
②计算样品中Ag 2O 2的质量分数 (写出计算过程) 。
题2图-1
隔膜
电极
100
22
24
26
28
固体残留质量 /g
200
300
400
500
t /℃
600
A
B
C
D
E
25.52g
23.76g
题2图–2
3.(15分)某地煤矸石经预处理后主要含SiO 2(61%)、Al 2O 3(30%)和少量的Fe 2O 3、FeO 及钙镁
的化合物等。
某实验小组利用其提取Al(OH)3。
(1)“酸浸”过程中发生的主要反应的离子方程式为 。
为提高“酸浸”时铝浸出率,可采取的措施之一是 。
(2)“氧化”是将Fe 2+
氧化成Fe 3+
,其目的是。
检验Fe 3+
已水解完全的方法是 (3)滤渣Ⅱ的主要成分是CaCO 3、Mg(OH)2和 。
(4)①上述流程中可循环利用的物质的化学式是 。
②“转化”时主要反应的离子方程式为 。
(5)Fe 3+
开始沉淀和沉淀完全的pH 分别为2.1和3.2,Al 3+
开始沉淀和沉淀完全的pH 分别为4.1
和5.4。
为了获得产品Al(OH)3,从氧化后的溶液开始,若只用纯碱一种试剂,后续操作是 。
煤矸石
Cl 2 盐酸 纯碱 母液Ⅰ 气体 NaOH 溶液 CO 2 母液Ⅱ
滤渣Ⅰ 滤渣Ⅱ
4.(14分)催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V 2O 5作催化剂:
4FeS 2(s)+11O 2(g)=2Fe 2O 3(s) +8SO 2(g) △H =―3412 kJ·mol -1
2SO 2(g)+O 2
(g) 错误!未找到引用源。
2SO 3(g) △H =―196.6
kJ·mol -1
SO 3(g)+H 2O(l)=H 2SO 4(l) △H =―130.3 kJ·mol -1
以FeS 2为原料,理论上生产2mol H 2SO 4(l)所释放出的热量为 kJ 。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH 3OH(g)HCOOCH 3(g)+2H 2(g) △H >0
第二步:HCOOCH 3(g)CH 3OH(g)+CO(g) △H >0
①第一步反应的机理可以用题4图-1所示。
图中中间产物X 的结构简式为 。
②在工业生产中,为提高CO 的产率,可采取的合理措施有 。
(3)采用一种新型的催化剂(主要成分是Cu -Mn 合金),利用CO 和H 2制备二甲醚(DME )。
主反应:2CO(g)+4H 2(g)CH 3OCH 3(g)+H 2O(g) 副反应:CO(g)+H 2O(g)CO 2(g)+H 2(g)
CO(g)+2H 2(g)CH 3OH(g)
测得反应体系中各物质的产率或转化率与催化剂的关系如题4图-2所示。
则催化剂中(4(5 。
②用阴离子交换膜控制电解液中OH -
的浓度制备纳米Cu 2O ,
V 2O 5
∆ 题4图-2
产率、转化率/ %
n (Mn)/n (Cu)
20 40 60
80
1.0 2.0 3.0 4.0 DME 产率
CO 转化率
CO 2转化率 CH 3OH 转化率
题4图-1
题4 图-3
反应为2Cu +H 2O Cu 2O +H 2↑,如题4图-3所示。
该电解池的阳极反应式为 。
高三化学午间练习(十)答案
1.(12分)
(1)2Cr 2O 3+4Na 2CO 3+3O 2 4Na 2CrO 4+4CO 2 (2分)
(2)2CrO 42—+2H +=Cr 2O 72—
+H 2O (2分)
(3)① B (2分)
②3Fe 3++3CaCO 3+Na ++5SO 42—
+3H 2O =NaFe 3(SO 4)2(OH)6↓+3CaSO 4↓+3CO 2↑(2分) ③生成Fe(OH)3胶体的颗粒小、沉淀速率慢、不容易过滤等(合理答案均可)(2分) (4)蒸发浓缩、洗涤(各1分,共2分)
2(12分)
(1)具有强氧化性或Ag 为重金属元素,有消毒杀菌功能 (2分)
(2)Al ―3e —+4OH —=AlO 2—
+2H 2O (2分)
(3)2Ag ++ClO —+2OH —=Ag 2O 2↓+Cl —
+H 2O (2分)
(4)①2Ag 2O 4Ag +O 2↑ (2分)
②AB 段发生的反应为:2Ag 2O 2 2Ag 2O +O 2↑ (1分)
n (O 2)=1
27.12g 25.52g
0.0500mol 32g mol --= (1分) n (Ag 2O 2)=2n (O 2)=2×0.0500mol=0.1000mol (1分)
w (Ag 2O 2)=1
1
0.1000mol 248g mol 91.45%27.12g mol --⨯≈ (1分)
3(15分)
(1)Al 2O 3+6H +=2Al 3+
+3H 2O (2分)
提高酸的浓度(或适当提高反应温度或搅拌下进行反应) (2分)
(2)将Fe 2+氧化成Fe 3+
,有利于其水解除去铁元素 (2分)
取少量母液Ⅰ,滴加KSCN 溶液,无血红色,则Fe 3+
已水解完全 (2分) (3)Fe(OH)3(1分) (4)①CO 2(或Na 2CO 3)(2分)
②AlO 2—+CO 2+2H 2O =Al(OH)3↓+HCO 3
—
(或2AlO 2—+CO 2+3H 2O =2Al(OH)3↓+CO 32—)(2分)
(5)加入纯碱调节pH 到3.2,过滤除去Fe(OH)3等固体后,再加入纯碱调节pH 到5.4,过滤
得到Al(OH)3(2分)
4(14分)
(1)1310.2 (2分)
(2)①HCHO (2分) ②升高温度或降低压强 (2分) (3)2.0 (2分) (4)1:4 (2分)
(5)①4Cu(OH)2+N 2H 4 2Cu 2O +N 2↑+6H 2O (2分)
②2Cu ―2e -+2OH -
=Cu 2O +H 2O (2分)
∆
∆
焙烧
∆
·
·。
