物化作业
物化题练习题

物化题练习题1. 下列关于物质的说法中,正确的是:A. 物质是由分子或原子构成的;B. 物质可以被分解成更小的物体;C. 物质可以存在于固态、液态和气态;D. 物质可以通过化学反应转变成其他物质。
2. 水的化学式是H2O,其中2是表示:A. 氧元素的个数;B. 氢元素的个数;C. 氧气分子的个数;D. 氢气分子的个数。
3. 下列物质中,是化合物的是:A. 纯净水;B. 氧气;C. 氯气;D. 金属铝。
4. 气体的特点不包括:A. 分子间距离大,分子运动自由;B. 气体可以被压缩;C. 气体分子之间有强烈的相互作用力;D. 气体可以扩散和弥散。
5. 下列物质中,属于物理变化的是:A. 将水煮沸;B. 冰块融化成水;C. 铁生锈;D. 木材燃烧成灰。
6. 下列物质中,属于化学变化的是:A. 电池产生电能;B. 冰融化成水;C. 水蒸气变成水;D. 液化石油。
7. 下列物质中,属于原子的是:A. 水分子;B. 氧气分子;C. 铁分子;D. 氯气分子。
8. 下列元素中,是金属的是:A. 氧气;B. 氯气;C. 铁;D. 氮气。
9. 化学方程式中反应物和生成物分别位于方程式的左边和右边,这是遵守了什么定律?A. 质量守恒定律;B. 能量守恒定律;C. 波动守恒定律;D. 力学守恒定律。
10. 在化学方程式中,用于表示反应条件的符号是:A. ♦;B. ∆;C. ⊕;D. ↾。
以上是物化题练习题,请根据题目自行选择答案,并进行检查。
祝你好运!。
水处理作业

水的物化处理作业项文力090430第一章超纯水及其制备20℃时测得纯水电阻率(MΩ·cm)为16,换算成25℃时的电阻率解:20℃时测得纯水电导率为:L20℃=1/16 μΩ-1·cm-1=μΩ-1·cm-1;L t=L e(t)+L p(t);L e(25℃)=k t* L e(t)= k t*( L t-L p(t))= k20℃*( L20℃-L p(20℃));∴L25℃=L e(25℃)+L p(25℃) = k20℃*( L20℃-L p(20℃)) +L p(25℃);∴ρ25℃=1/ L25℃=1/[ k20℃*( L20℃-L p(20℃)) +L p(25℃)];查表得:k20℃=;L p(20℃)=μΩ-1·cm-1;L p(25℃)=μΩ-1·cm-1;∴ρ25℃=1/[ k20℃*( L20℃-L p(20℃)) +L p(25℃)]= 11.111*(0.06250.0380)0.0548-+= MΩ·cm第二章传质与物料平衡原理多相反应模型:如图为淹没式生物活性炭滤池,试建立数学模型,假定生物反应为一级反应dsksdt=-,其他参数自行假定。
e,Q图 淹没式生物活性炭滤池解:如图,在滤柱上取一段ΔL,在AΔL 这一体积微元内,建立污染物的物料衡算方程。
主体溶液中污染物的变化量等于活性炭表面生物膜反应的量。
假定微元内单位体积生物膜表面积为F ,污染物进入生物膜表面的通量为N Δ,则:-QΔS=AΔL·F·N Δ∴S AFN L Q ∆∆=-∆,微元趋于无限小时,AFN QdS dL ∆=- 假定活性炭的空隙率为ε,比表面积为e ,则:F=(1-ε) e ;∵污染物到达生物膜后才发生反应,反应速率为一级反应dsks dt=-,而N Δ为污染物的通量,进入生物膜表面由于反应而消失,消失速率即反应速率,∴-N Δ=dsks dt-=; ∴AFN (1)Q dS A ekS dL Qε∆-=-=- ∴0(1)ln()e S A ekL S Qε-=- ∴0(1)exp[]e A ekLS S Qε-=⋅-第三章 离子交换理论用离子交换法从CuSO 4废液中回收Cu ,废液含Cu 2+为20mgN/L ,处理水量3.78m 3/h 。
物化变化和性质判断作业题

一、化学变化和物理变化的判断
1、以下变化中:
①冰雪融化,②玻璃破碎,③食品腐烂变质,④木材制成桌椅,⑤二氧化碳被液化,
⑥氧气变成液氧,⑦铁生锈,⑧饼干变软,⑨食物的消化,⑩食盐溶解,
○11气球和车胎发生爆炸,○12火药爆炸,○13锅炉气压大而爆炸,○14铜变成铜绿(铜生锈),
○15铁变成铁水,○16保险丝熔断,○17蜡烛的燃烧,○18光合作用,○19铁铸成铁锅,
○20呼吸作用,○21澄清石灰水遇二氧化碳变浑浊,○22食盐吸水回潮,○23电灯通电发光发热
属于物理变化的是:(填序号)
属于化学变化的是:(填序号)
二、物理性质和化学性质的判断
2、以下性质中:
①温度在100度以上时,水(会)变成水蒸汽,②酒精(容易)着火,
②红磷(是)暗红色的固体,④氧气(能)支持燃烧,⑤汽油(容易)挥发,
⑥氧气(能)微溶于水,⑦蜡烛熔点低,受热(会)熔化,⑧白磷(能)自燃,
⑨稀有气体(有)惰性,⑩二氧化硫(有)刺激性气味,○11大米(可以)酿成酒,
○12牛奶(会)变酸,○13氧气液化后(会)变成淡蓝色,○14金刚石硬度很大
○15保险丝(容易)熔断,○16汽油(有)挥发性○17二氧化碳(可以)用来灭火
属于物理性质的是:(填序号)
属于化学性质的是:(填序号)
化学变化和物理变化的本质区别是:
如何判断是变化还是性质?答:在描述文字中包含有“可以”“能够”“会”“容易”“是”“有”等字眼的通常是指物质的性质。
物化作业课后答案

第一章 化学热力学基础1-1 气体体积功的计算式 dV P W e ⎰-= 中,为什么要用环境的压力e P ?在什么情况下可用体系的压力体P ? 答:在体系发生定压变化过程时,气体体积功的计算式 dV P W e ⎰-= 中,可用体系的压力体P 代替e P 。
1-2 298K 时,5mol 的理想气体,在(1)定温可逆膨胀为原体积的 2 倍; ( 2 )定压下加热到373K ;(3)定容下加热到373K 。
已知 C v,m = 28.28J·mol -1·K -1。
计算三过程的Q 、W 、△U 、△H 和△S 。
解 (1) △U = △H = 0 kJ V V nRT W Q 587.82ln 298314.85ln12=⨯⨯==-= 11282.282ln 314.85ln-⋅=⨯==∆K J V V nR S (2) kJ nC Q H m P P 72.13)298373(,=-==∆ kJ nC U m V 61.10)298373(,=-=∆ W = △U – Q P = - 3.12 kJ112,07.41298373ln )314.828.28(5ln-⋅=+⨯==∆K J T T nC S m P (3) kJ nC Q U m V V 61.10)298373(,=-==∆ kJ nC H m P 72.13)298373(,=-=∆ W = 0112,74.31298373ln 28.285ln-⋅=⨯==∆K J T T nC S m V 1-3 容器内有理想气体,n=2mol , P=10P θ,T=300K 。
求 (1) 在空气中膨胀了1dm 3,做功多少? (2) 膨胀到容器内压力为 lP θ,做了多少功?(3)膨胀时外压总比气体的压力小 dP , 问容器内气体压力降到 lP θ时,气体做多少功?dVp dl A p dl f W ⋅=⋅⋅=⋅=外外外δ解:(1)此变化过程为恒外压的膨胀过程,且Pa P e 510=J V P W e 1001011035-=⨯⨯-=∆-=- (2)此变化过程为恒外压的膨胀过程,且Pa P e 510=n R T P n R T P n R T P V V P V P W e 109)10()(12-=--=--=∆-=θθθθ J 6.4489300314.82109-=⨯⨯⨯-= (3) Vn R TP dP P P e =≈-=1221ln ln 12121P P nRT V V nRT dV V nRT dV P W V V V V e ==-=-=⎰⎰ kJ PP 486.11101ln 300314.82-=⨯⨯⨯=θθ1-4 1mol 理想气体在300K 下,1dm 3定温可逆地膨胀至10dm 3,求此过程的 Q 、W 、△U 及△H 。
物化练习题及答案

物化练习题及答案一、选择题(每题4分,共40分)1. 锌可以和下列哪种物质发生反应?A. 铜B. 铝C. 钢铁D. 铂答案:A2. 以下哪个元素是地球上最常见的金属元素?A. 铁B. 铝C. 铜D. 锌答案:B3. 哪种燃料的能量密度最高?A. 木材B. 天然气D. 汽油答案:D4. 以下哪种物质在常温下为液体?A. 铁B. 铝C. 汞D. 铂答案:C5. 温度为摄氏零下273.15度时,气体的体积为零,这一温度点被称为:A. 绝对零度B. 熔点C. 沸点D. 环境温度答案:A6. 水在常温下的存在形态是:A. 液体C. 固体D. 上述都是答案:D7. 以下哪个元素是地球上最常见的非金属元素?A. 氧B. 氮C. 碳D. 硅答案:A8. 化学式H2O表示的物质是:A. 水B. 氧气C. 化学反应D. 碳酸答案:A9. 哪种金属在常温下属于液体?B. 铝C. 汞D. 铜答案:C10. 化学名称Fe表示的元素是:A. 铝B. 铁C. 铅D. 锡答案:B二、填空题(每题5分,共20分)1. 短程有色金属成本较低,适合制造耐腐蚀、散热等需要。
答案:铝2. 电子元器件中常使用的金属材料是导体。
答案:铜3. 在自然界中,最多的元素是氢。
答案:氢4. 所有物质由不可再分割的最小粒子组成,称为原子。
答案:原子三、简答题(每题10分,共40分)1. 解释物质的三态是什么?并举例说明。
答案:物质的三态分别是固态、液态和气态。
在固态下,物质的分子密集排列,不易流动,例如冰。
在液态下,物质的分子较为稀疏,可以流动,例如水。
在气态下,物质的分子排列较为松散,具有较高的热运动能量,例如水蒸气。
2. 什么是化学反应?举例说明。
答案:化学反应是指物质在化学变化过程中,原有的物质经过分子之间的构建、断裂和重新组合,形成新的物质的过程。
例如,当铁与氧气反应形成铁锈时,化学反应发生。
3. 解释燃烧现象的化学原理。
答案:燃烧是一种快速氧化反应,它需要燃料、氧气和可燃物质达到着火点的温度。
物化作业答案

2-8 某理想气体, 1.5V m C R =。
今有该气体 5 mol 在恒容下温度升高50℃,求过程的W ,Q ,△H 和△U 。
解:恒容:W=0;kJJ K nC T K T nC dT nC U m V m V K T Tm V 118.33118503145.823550 )50(,,50,==⨯⨯⨯=⨯=-+==∆⎰+kJJ KR C n T K T nC dT nC H m V m p KT Tm p 196.55196503145.8255 50)()50(,,50,==⨯⨯⨯=⨯+==-+==∆⎰+根据热力学第一定律,:W=0,故有Q=△U=3.118kJ2-10 2mol 某理想气体,R C m P 27,=。
由始态100 kPa ,50 dm 3,先恒容加热使压力升高至200 kPa ,再恒压泠却使体积缩小至25 dm 3。
求整个过程的W ,Q ,△H 和△U 。
解:整个过程示意如下:333203125200250200250100221dm kPa T moldm kPa T moldm kPa T molW W −→−−−→−=KnR V p T 70.3003145.8210501010033111=⨯⨯⨯⨯==-K nR V p T 4.6013145.8210501020033222=⨯⨯⨯⨯==-K nR V p T 70.3003145.8210251020033333=⨯⨯⨯⨯==-kJ J V V p W 00.5500010)5025(10200)(331322==⨯-⨯⨯-=-⨯-=- kJ W kJ W W 00.5W W ;00.5 ;02121=+=== 0H 0,U ;70.300 31=∆=∆∴==K T T-5.00kJ -W Q 0,U ===∆2-17 单原子理想气体A 与双原子理想气体B 的混合物共5mol ,摩尔分数y B =0.4,始态温度T 1=400 K ,压力p 1=200 kPa 。
物化 (2)

练习与作业一、是非题下列各题中的叙述是否正确?正确的选“√”,错误的选“×”。
√× 1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
√× 2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
√× 3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
√× 4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
√× 5. 稳定态单质的∆f H m (800 K) = 0。
二、选择题选择正确答案的编号,填在各题后的括号内:理想气体定温自由膨胀过程为:(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0;(E)以上答案均不正确对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 );(E)以上答案均不正确pV g = 常数(g = C p,m/C V,m)适用的条件是:(A)绝热过程;(B)理想气体绝热过程;(C)理想气体绝热可逆过程;(D)绝热可逆过程;(E)以上答案均不正确在隔离系统内:( A ) 热力学能守恒,焓守恒;(B) 热力学能不一定守恒,焓守恒;(C) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒;(E)以上答案均不正确从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( A )可以到达同一终态;(B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响;(E)以上答案均不正确当理想气体反抗一定的压力作绝热膨胀时,则:( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少;(E)以上答案均不正确已知反应H2(g) +1/2 O2(g) =H2O(g)的标准摩尔反应焓为∆r H m (T),下列说法中不正确的是:(A)∆r H m (T)是H2O(g)的标准摩尔生成焓;(B)∆r H m (T)是H2O(g)的标准摩尔燃烧焓;(C)∆r H m (T)是负值;(D)∆r H m (T)与反应的∆r U m 数值不等(E)以上答案均不正确三、填空题在以下各小题填上答案。
物化综合作业题2010

1. 求下列各过程的体积功:(视H 2为理想气体)。
( 1 )5 mol H 2由300 K ,100 kPa 定压下加热到800 K ; ( 2 )5 mol H 2由300 K ,100 kPa 定容下加热到800 K ; ( 3 )5 mol H 2由300 K ,1.0 MPa 定温可逆膨胀到1.0 kPa ;( 4 )5 mol H 2由300 K ,1.0 MPa 自由膨胀到1.0 kPa 。
解:( 1 )由式 ,对定压过程,则W = -p su ( V 2-V 1 ) = -p su nR因为:p 1 = p 2 = p su所以:W = -nR ( T 2-T 1 )= -20.78 kJ ( 2 )定容过程,即d V = 0,所以,W = 0。
( 3 )对理想气体,定温可逆过程:W 1 = -nRT ln( p 1 / p 2 ) = -86.15 kJ ( 4 )理想气体自由膨胀,W = 02. 60℃时甲醇(A)的饱和蒸气压是83.4 kPa , 乙醇(B)的饱和蒸气压是47.0 kPa , 二者可形成理想液态混合物, 若液态混合物的组成为质量分数w B = 0.5 , 求60℃时与此液态混合物平衡的蒸气组成(以摩尔分数表示)。
(已知甲醇及乙醇的M r 分别为32.04及46.07。
)解:该液态混合物的摩尔分数系统的总压力p = p A *x A + p B *x B = 68.47 kPa 平衡蒸气组成: y B = 0.2823.计算2 mol 理想气体在以下过程中所作的功:( 1 )25℃时,从10.0 dm 3定温可逆膨胀到30.0 dm 3;( 2 )使外压力保持为101.3 kPa ,从10.0 dm 3定温膨胀到30.0 dm 3;( 3 )在气体压力与外压力保持恒定并相等的条件下,将气体加热,温度从T 1 = 298 K 升到T 2,体积从10.0 dm 3膨胀到30.0 dm 3。
物化作业下一

1、0.001 mol ·kg -1 K 3[Fe(CN) 6]水溶液的离子强度为:( A )(A) 6.0×10-3 mol·kg -1 (B) 5.0×10-3 mol·kg -1(C) 4.5×10-3 mol·kg -1 (D) 3.0×10-3 mol·kg -12、298K ,当H 2SO 4溶液的质量摩尔浓度从0.01mol·kg –1增加到0. 1mol·kg –1时,其电导率κ和摩尔电导率m Λ的变化将( C )(A) κ减小,m Λ增加 (B) κ增加,m Λ增加(C) κ减小,m Λ减小 (D) κ增加,m Λ减小3、质量摩尔浓度为m 的K 3PO 4溶液,平均活度系数为γ±,则K 3PO 4的活度a 为( D ) (A) 444m m θγ±⎛⎫ ⎪⎝⎭ (B) 4m m θγ±⎛⎫ ⎪⎝⎭ (C)4m m θγ±⎛⎫ ⎪⎝⎭ (D) 4427m m θγ±⎛⎫ ⎪⎝⎭4、已知25℃时,φθ(Fe 3+| Fe 2+) = 0.77 V ,φθ(Sn 4+| Sn 2+) =0.15 V 。
今有一电池,其电池反应为2 Fe 3++ Sn 2+=== Sn 4++2 Fe 2+,则该电池的标准电动势E θ(298 K) 为( B )(A) 1.39 V (B) 0.62 V (C) 0.92 V (D) 1.07 V5、某电池在298K, P θ压力下,可逆放电的热效应为Q R = -100J, 则该电池反应的△r H m 值应为( D )(A) =100J (B) = -100J (C) >100J (D) <-100J6、已知Λ()K O H m 291,2∞=4.89×10-2-12mol m S ⋅⋅,此时(291K)纯水中的m (H +) =m (OH -)=7.8×10-8 mol·kg -1,则该温度下纯水的电导率为( B )(A)3.81×10-9 S·m -1 (B )3.81×10-6 S·m -1(C)7.63×10-9 S·m -1 (D )7.63×10-6 S·m -1二、问答题1、奥斯特瓦尔德(Ostwald )稀释定律能否适用于强电解质溶液?为什么?2、为什么不能用普通电压表直接测量可逆电池的电动势?一般电压表,尽管内阻较高,也要消耗一定的电流,而此电流,在原电池的内阻上也要产生电压降,使原电池的输出电压小于原电池的电动势,所以不能用电压表直接测量原电池电动势另一方面,一般原电池是做为计量电压的标准,为了保持其精度,也不允许让它消耗电流,只能配合电位差计使用。
生化作业

简述氨基酸和蛋白质的物化性质答:氨基酸的物化性质:1.氨基酸是两性电解质。
所有氨基酸都是含有碱性的氨基,又含有酸性的羧基;可在酸性溶液中与质子结合成带正电荷的阳离子,也可在碱性溶液中与OH—结合,失去质子变成带负电荷的阴离子,因此氨基酸是一种两性电解质,具有两性解离的特性。
氨基酸的解离方式取决于其所处溶液的酸碱度。
在某一PH的溶液中,氨基酸解离呈阳离子和阴离子的趋势及程度相等,称为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
酸性氨基酸等电点pI<4.0,碱性氨基酸的等电点pI》7.5,中性氨基酸等电点pI 为5.0~6.5。
由于不同氨基酸所带的可解离基团不同,所以等电点不同。
2.氨基酸的紫外吸收性质根据氨基酸的吸收光谱,含有共轭双键的色氨酸、酪氨酸在280nm波长附近具有最大吸收峰。
大多数蛋白质含有酪氨酸和色氨酸残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速而简便的方法。
3.茚三酮反应(除脯氨酸外,所有的α-氨基酸都能与茚三酮发生颜色反应,生成蓝紫色化合物,脯氨酸与茚三酮生成黄色化合物。
) 氨基酸与水合茚三酮共加热时,氨基酸被氧化分解,生成醛、氨及二氧化碳;水合茚三酮则被还原。
在弱酸性溶液中,茚三酮的还原产物还可与氨及另一分子茚三酮缩合成蓝紫色化合物,蓝紫色化合物颜色的深浅与氨基酸释放出的氨量成正比,可用作氨基酸的定性或定量测定。
蛋白质的物化性质:一.蛋白质的两性解离和等电点蛋白质是由氨基酸组成的,分子中除多肽链两端的游离α-氨基和α-羧基外,侧链R上还有些可解离的基团。
由于蛋白质分子中既含有能解离出H+的酸性基团,又含有能结合H+的碱性基团,因此蛋白质分子为两性电解质。
当溶液处于某一PH值,蛋白质分子不解离,或解离成阳离子和阴离子的趋势相等,即净电荷为零,呈兼性离子状态,此时溶液的PH值称为该蛋白质的等电点(pI)。
蛋白质的pI由构成蛋白质的酸性氨基酸和碱性氨基酸的比例决定。
物化考试题及答案

物化考试题及答案一、选择题1. 下列物质中,属于化合物的是:A. 氧气B. 铜C. 干冰D. 汞答案:C2. 下列关于元素周期表的说法中,错误的是:A. 元素周期表是由原子序数(或核电荷数)按递增顺序排列的B. 元素周期表每个元素的周期数对应着它的核电荷数C. 元素周期表上方的元素都是非金属元素D. 元素周期表中,同一周期上的元素具有相似的化学性质答案:C3. 以下哪种情况不属于物质发生化学反应的证据:A. 出现明显的气体产生B. 出现颜色变化C. 发生吸热或放热反应D. 出现物质的形态改变答案:D4. 酸性溶液的pH值范围是:A. 0-7B. 7-14C. 0-14D. 取决于具体溶液答案:A5. 下列元素中,属于卤素的是:A. 氯B. 铝C. 锌D. 钠答案:A二、填空题1. 标准状况下,1摩尔理想气体的体积为________升。
答案:22.42. 一个物质的化学式为H2O,其摩尔质量为________克。
答案:183. 反应物A和B按化学方程式C2H5OH + 3O2 → 2CO2 + 3H2O进行反应,若有10g的A反应,且理论产量达到100%,则生成的C2H5OH的物质的质量为________克。
答案:324. 电子分子式H•,表示该分子中含有________个原子。
答案:15. 开尔文温度与摄氏温度之间的转换关系是:K = ________ + 273.15答案:摄氏温度三、解答题1. 请简要解释物理变化和化学变化的区别,并举出两个例子。
答案:物理变化指的是物质在外观、形态或其他物理性质上发生的变化,其化学性质并未改变。
例如,水的沸腾是一个物理变化,水在沸腾过程中,由液态变为气态,但其化学组成没有发生改变。
化学变化指的是物质在化学性质上发生的变化,导致物质的组成和性质发生显著变化。
例如,铁生锈是一个化学变化,铁在与氧气接触后会发生氧化反应,形成铁锈,其化学组成发生了变化。
2. 简述酸和碱的性质,并举出两个例子。
物化作业

第一张1.4 一抽成真空的球形容器,质量为25.0000g。
充以4℃水之后,总质量为125.0000g。
若改充以25℃,13.33kPa的某碳氢化合物气体,则总质量为25.0163g。
试估算该气体的摩尔质量。
水的密度按1 g.cm-3计算。
解:球形容器的体积为V=(125-25)g/1 g.cm-3=100 cm3将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M wM w= mRT/ PV=(25.0163-25.0000)⨯8.314⨯300.15/(13330⨯100⨯10-6) M w =30.51(g/mol)1.7 今有20℃的乙烷~丁烷混合气体,充入一抽成真空的200cm3容器中,直到压力达到101.325kPa,测得容器中混合气体的质量为0.3897g。
试求该混合气体中两种组分的摩尔分数及分压力。
解:将乙烷(M w=30g/mol,y1),丁烷(M w=58g/mol,y2)看成是理想气体:PV=nRT n=PV/RT=8.3147⨯10-3mol(y1⨯30+(1-y1) ⨯58)⨯8.3147⨯10-3=0.3897y1=0.401 P1=40.63kPay2=0.599 P2=60.69kPa1.9 氯乙烯、氯化氢及乙烯构成的混合气体中,各组分的摩尔分数分别为0.89,0.09及0.02。
于恒定压力101.325kPa下,用水吸收其中的氯化氢,所得混合气体中增加了分压力为 2.670kPa 的水蒸汽。
试求洗涤后的混合气体中C2H3Cl及C2H4的分压力。
解:根据道尔顿定律分压力吸收后1.13 一密闭刚性容器中充满了空气,并有少量的水。
当容器于300K条件下达平衡时,容器内压力为101.325kPa。
若把该容器移至373.15K的沸水中,试求容器中达到新平衡时应有的压力。
设容器中始终有水存在,且可忽略水的任何体积变化。
300K时水的饱和蒸气压为3.567kPa。
物化习题

第二章:作业题1. 问题:能否选取真空空间作为热力学体系?解答:一个课题的研究对象,就是该课题的体系。
一般来说,体系是物质世界中一个有限的宏观部分。
单独选取真空空间作为体系没有实际意义。
但是,在处理某些问题时,体系内可以包括一部分真空空间。
2. 例:将两种不同气体分装在同一汽缸的两个气室内,二气室之间有隔板隔开。
左气室中气体的状态为V=20ml,T=273K,P=1.01⨯102KPa;右气室中气体的状态为V=30ml,T=303K,P=3.03 ⨯102KPa。
现将二气室之间的隔板抽掉使两种气体混合。
若以整个汽缸中的气体为体系的话,则此过程中做功为多少?传热为多少?Q=0, W=03. 下述体系中,哪一个是错误的?如果体系在变化中与环境没有功的交换,则A.体系放出的热量一定等于环境吸收的热量B.体系的温度降低值一定等于环境温度的升高值C.最终达到平衡时,体系的温度与环境的温度相等D.若体系1与体系2分别与环境达成热平衡,则二体系的温度相同。
B4.2、绝热箱中装有水,水中绕有电阻丝,由蓄电池供给电流。
设电池在放电时无热效应,通电后电阻丝和水的温度皆有升高。
若以电池为体系,以水和电阻丝为环境,则下述答案中,哪一组是正确的?A.Q=0,W>0,∆U<0B.Q<0, W>0,∆U>0C.Q>0,W=0,∆U<0D.Q=0,W<0, ∆U>0 答案:D若以电阻丝为体系,以水和电池为环境,则上述答案中,哪一组是正确的?答案:B5. 下述说法中,哪一种正确?A、完成同一过程,经任意可逆途径所做的功一定比经任意不可逆途径所做的功多B、完成同一过程,经不同的可逆途径所做的功都一样多C、完成同一过程,经不同的不可逆途径所做的功都一样多D、完成同一过程,经任意可逆途径所做的功不一定比经任意不可逆途径所做的功多答案:D6. 3、下述说法中,哪一种正确?A、完成同一过程,只可能有一条不可逆途径B、不可逆途径是指经该途径所产生的体系变化及环境变化均不能复原。
物化作业课后习题

辽宁科技大学辽宁科技大学物理化学课后习题答案学院:矿业工程学院专业:矿物加工辽宁科技大学第一章 化学热力学基础P 82(1-1) 10 mol 理想气体由25℃,1.00MPa 。
设过程为:(i )向真空膨胀;(ii )对抗恒外压0.100MPa 膨胀。
分别计算以上各过程的(i) 外(ii)(ii )P 1V 11=24.777m 3;因为是恒温过程,故 V 2=21P P V 1=66101.0101777.24⨯⨯⨯=247.77m 3W=-⎰21v v Pdv =-P(V 2-V 1)=-22.2995J小结:此题考查真空膨胀的特点及恒外压做功的求法,所用公式有:PV=nRT;TPV=常数;W=-⎰21v v Pdv 等公式。
P 82(1-3) 473k, 0.2MPa ,1dm 3的双原子分子理想气体,连续经过下列变化:(I )定温膨胀到3 dm 3;(II )定容升温使压力升到0.2MPa ;(III )保持0.2MPa 降温到初始温度473K 。
(i )在p-v 图上表示出该循环全过程;(ii )计算各步及整个循环过程的Wv 、Q ,ΔU ,及Δ辽宁科技大学H 。
已知双原子分子理想气体C p,m =27R 。
解:P 1V 1=nRT 1 n=111RT V P =4733145.8101102.036⨯⨯⨯⨯-mol=0.0509mol,P 1V 1=P 2V 2 ∴P 2=21V VP 1=31×0.2×106=0.067MPa,T 2=21P P T 1=6316102.0102.0⨯⨯⨯×473K=1419K.(i) 恒温膨胀A B △U i =0,△H i =0. W i =-⎰21v v Pdv =-nRTln 12v v =-0.0509×8.3145×473×ln3=-219.92J.辽宁科技大学Q i=-W=219.92J.(ii)等体过程 B C 因为是等体积过程所以W ii=0, Q ii=△U ii=nC V,m△T=n(C p,m-R)(T2-T1)=0.0509×(7-1)×8.3145×2(1419-473)=1000.89J;△H ii=nC p,m△T=0.0509×3.5×8.3145×(1419-473)=1401.2J.(iii)等压过程 C AW iii=-P△V=-P(V1-V2)=-0.2×106×(1-3)×10-3=400J;△H iii=nC p,m△T=0.0509×3.5×8.3145×(473-1419)=-1401.2J △U iii=nC V,m△T=0.0509× 2.5×8.3145×(473-1419)=-1000.89JQ=△U-W=-1000.89-400=-1400.89J在整个过程中由于温度不变所以△U=0, △H=0;Q=-W=-180.08J.小结:此题考查了恒温过程、等体过程以及等压过程的公式应用,内能和焓只是过于温度的函数。
物化第一章习题
M RT / p 8.315J K 1mol 1 273.15K 22.237 10 6 kg m 3 Pa 1 50.5 10 3 kg mol 1 50.5g mol 1
22.8 22.7
1.7 今有 20℃的乙烷-丁烷混合气体,充入一 抽成真空的 200cm3 容器中,直至压力达 101.325kPa, 测得容器中混合气体的质量为 0.3897g。试求该混合气 体中两种组分的摩尔分数及分压力。 解:已知 T=293.15K V=0.2dm3=2.0×10-4m3 p=101.325kPa m=0.3897g=3.897×10-4kg
《物理化学》
第一章 气体的 pVT 关系
第 4 页
因为 pV=(m/Mg)RT 所以 Mg =mRT/pV=8.315Pam3mol-1K-1×298.15K×0.0163g/13330Pa×0.0001m3 =30.31 gmol-1 1.5 两个容积均为 V 的玻璃球泡之间用细管连接, 泡内密封着标准状况下的空气。 若将其中一个球加热到 100℃,另一个球则维持 0℃,忽略连接细管中气体体积,试求该 容器内空气的压力。
25.331 0.56660
2.3074 1.5263 1.1401 /g.dm 解:当气体符合理想气体的行为时 p mRT /(VM ) 所以 M RT / p
对于实际气体,只有当压力 p 趋近于零时上述关系才成立,即 由题所给数据计算出在不同压力下的/p 值。列表如下: p/kPa
n
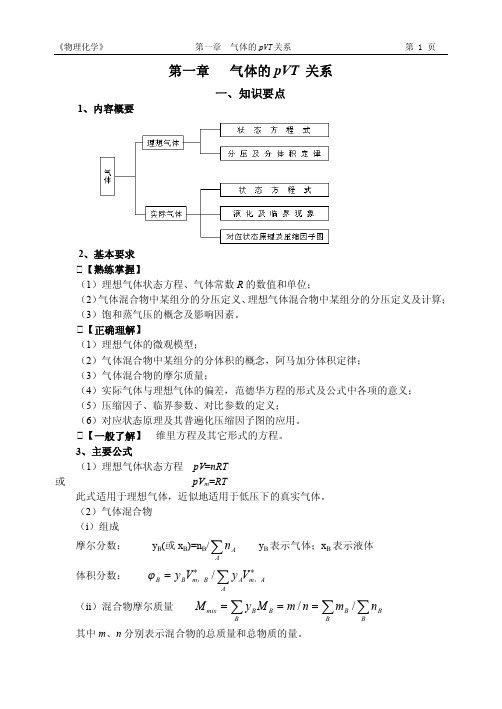
A A
A
yB 表示气体;xB 表示液体
B y BVm ,B / y AVm,A
(ii)混合物摩尔质量
M mix y B M B m / n m B / n B
小猿口算能否检查初中与高中语数外物化作业

小猿口算能否检查初中与高中语数外物化作业
摘要:
1.引言:介绍小猿口算及其功能
2.主体:分析小猿口算能否检查初中与高中语数外物化作业
a.初中语数外物化作业的检查
b.高中语数外物化作业的检查
3.结论:总结小猿口算在语数外物化作业检查方面的应用和局限性
正文:
小猿口算是一款非常实用的在线教育工具,旨在帮助学生提高数学计算能力,同时提供作业答案检查功能。
那么,对于初中与高中的语数外物化作业,小猿口算是否能够进行检查呢?
首先,我们来看初中语数外物化作业的检查。
小猿口算在数学方面有着非常强大的计算能力,可以轻松应对初中阶段的各种数学题目。
同时,对于语文和英语的作业,小猿口算也能提供一定的检查功能。
例如,用户可以输入语文和英语的作文题目,小猿口算会根据文本内容进行语句通顺度和语法正确性的检查。
然而,对于物理和化学等科学科目的作业,小猿口算的检查能力就有所局限了。
因为这些科目涉及到复杂的公式和化学方程式,小猿口算暂时无法准确识别和计算。
接下来,我们再看高中语数外物化作业的检查。
在数学方面,小猿口算同样可以应对高中阶段的各种数学题目。
对于语文和英语的作业,小猿口算也能提供类似的检查功能。
然而,在物理和化学等科学科目方面,小猿口算仍然面
临着无法准确识别和计算复杂公式和化学方程式的问题。
综上所述,小猿口算在初中与高中语数外物化作业的检查方面具有一定的应用价值,尤其在数学和语文、英语等科目的作业检查中表现较好。
然而,由于复杂公式和化学方程式的识别和计算能力有限,小猿口算在物理和化学等科学科目的作业检查方面存在一定的局限性。
物化

1.在298K电解槽中放有A2B3电解质溶液。
已知A3+离子运动速度v+是B2-离子运动速度v-的1.5倍,则溶液中A3+的迁移数t+应等于(B ) :(A)0.8;(B)0.6;(C)0.4;(D)0.22.下列说法不正确的是(B ):(A)同一种离子在不同电解质溶液中其离子迁移数不相同;(B)电解质溶液其它条件不变,电位梯度的改变影响电解质溶液中的离子迁移数;(C)离子迁移数与电解质溶液中正、负离子的运动速度有关;(D)溶液的温度改变,离子的迁移数也改变。
3.298K时,在0.01mol·dm-3的LiCl溶液中Cl-离子的迁移数是0.671,则相同浓度的NaCl溶液中Cl-离子的迁移数为(D ):(A)0.671;(B)0.329;(C)0.0671;(D)无法确定。
4. 在0.01mol·dm-3的CaCl2溶液中,Ca2+离子的迁移数为0.426,该溶液中Cl-的迁移数为:(A )(A)0.574;(B)0.218;(C)0.426;(D)0.852。
作业:221页4题, 225页7题例题:P225 例题2例题:P226 例题3作业:P227 8 、10、12 、141、质量摩尔浓度为m的Na3PO4 溶液, 平均活度系数为γ±,则电解质的活度为(C)(A) aB = 4(m/m⊖)4(γ±)4 (B) aB = 4(m/m⊖)(γ±)4(C) aB = 27(m/m⊖)4(γ±)4 (D) aB = 27(m/m⊖)(γ±)42、1mol.kg-1 k4Fe(CN)6 溶液的离子强度为(A )(A) 10 mol.kg-1 (B) 7 mol.kg-1 (C) 4 mol.kg-1 (D) 15 mol.kg-13、下列电解质溶液中,离子平均活度系数最大的是(A )(A) 0.01 mol.kg-1 NaCl (B) 0.01 mol.kg-1 CaCl2(C) 0.01 mol.kg-1 LaCl3 (D) 0.01 mol.kg-1 CuSO44、某一强电解质Mv+ Xv-,则其平均活度a±与活度aB 之间的关系是(D)(A) a±= a B (B) a±= (aB)2 (C) a±=aBγ(D) a±= (aB)1/γ5、用同一电导池分别测定浓度为0.01mol.dm-3 和0.1mol.dm-3 的不同电解质溶液,其电阻分别为1000Ω和500Ω,则它们的摩尔电导率比为∧m ,1/∧m ,2 = R2C2/(R1C1)= 5。
物化相图练习及答案

判断题:1.在一个给定的系统中,物种数可以因分析问题的角度的不同而不同,√但独立组分数是一个确定的数。
2.自由度就是可以独立变化的变量。
⨯3.相图中的点都是代表系统状态的点。
⨯4.恒定压力下,根据相律得出某一系统的f = l,则该系统的温度就有一个唯一确定的值。
⨯5.根据二元液系的p~x图可以准确地判断该系统的液相是否是理想液体混合物。
√7.对于二元互溶液系,通过精馏方法总可以得到两个纯组分。
⨯9.恒沸物的组成不变。
⨯10.若A、B两液体完全不互溶,那么当有B存在时,A的蒸气压与系统中A的摩尔分数成正比。
⨯11.在简单低共熔物的相图中,三相线上的任何一个系统点的液相组成都相同。
√12.三组分系统最多同时存在5个相。
√二、单选题:1.H2O、K+、Na+、Cl- 、I- 体系的组分数是:C(A) K = 3 ;(B) K = 5 ;(C) K = 4 ;(D) K = 2 。
2.单组分固-液两相平衡的p~T曲线如图所示,则:(克拉贝龙方程式)C(A) Vm(l) = Vm(s) ;(B) Vm(l)>Vm(s) ;(C) Vm(l)<Vm(s) ;(D) 无法确定。
3.压力升高时,单组分体系的熔点将如何变化:D(A) 升高;(B) 降低;(C) 不变;(D) 不一定。
4.硫酸与水可组成三种化合物:H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s),在p•下,能与硫酸水溶液共存的化合物最多有几种:B(A) 1 种;(B) 2 种;(C) 3 种;(D) 0 种。
5.在101325Pa的压力下,I2在液态水与CCl4中的溶解已达到平衡(无固体I2存在),此体系的自由度为:B(A) 1 ;(B) 2 ;(C) 3 ;(D) 0 。
6.NaCl水溶液和纯水,经半透膜达到渗透平衡,该体系的自由度数是:C(A) f = 1 ;(B) f = 2 ;(C) f = 3 ;(D) f = 4 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 在373 K 恒温条件下,计算1 mol 理想气体在下列四个过程中所做的膨胀功。
已知始、终态体积分别为25 dm 3和100 dm 3 。
(1)向真空膨胀; (2)等温可逆膨胀;(3)在外压恒定为气体终态压力下膨胀;(4)先外压恒定为体积等于50 dm 3 时气体的平衡压力下膨胀,当膨胀到50 dm 3以后,再在外压等于100 dm 3 时气体的平衡压力下膨胀。
试比较四个过程的功,这说明了什么问题? 解:(1)向真空膨胀,外压为零,所以20W =(2)等温可逆膨胀1111225ln1 mol 8.314 J mol K 373 K ln 4299 J 100V W nRT V --==⨯⋅⋅⨯⨯=- (3)恒外压膨胀3e 21221212()()()nRTW p V V p V V V V V =--=--=--11331 mol 8.314 J mol K 373 K (0.10.025)m 2326 J 0.1 m--⨯⋅⋅⨯=-⨯-=- (4)分两步恒外压膨胀4e,121e,232213223()()()()nRT nRTW p V V p V V V V V V V V =----=----12232550(11)(2)50100V V nRT nRT nRT V V =-+-=+-=-111 mol 8.314 J mol K 373 K 3101 J --=-⨯⋅⋅⨯=-说明作功与过程有关,系统与环境压差越小,膨胀次数越多,做的功也越大。
7. 判断以下各过程中Q ,W ,ΔU ,ΔH 是否为零?若不为零,能否判断是大于零还是小于零? (1)理想气体恒温可逆膨胀(2)理想气体节流(绝热等压)膨胀 (3)理想气体绝热、反抗恒外压膨胀(4)1mol 实际气体恒容升温 (5)在绝热恒容容器中,H 2(g )与 Cl 2(g )生成 HCl (g )[理想气体反应] 解:(1)理想气体恒温可逆膨胀,0, 0, <0, >0U H W Q ∆=∆=(2)理想气体节流膨胀, 0H ∆=,因为温度不变, 所以 0U ∆=。
节流过程是绝热过程,0Q = ,故0W= 。
(3)绝热、恒外压膨胀,0Q=,U W ∆=,系统对外作功 <0, <0W p V U =-∆∆,0H U p V ∆=∆+∆=(4)恒容升温,0W=,温度升高,热力学能也增加,0U ∆>,故>0Q 。
温度升高,压力也升高,0H U V p ∆=∆+∆> 。
(5)绝热恒容的容器,0, 0, 0Q WU ==∆=。
这是个气体分子数不变的反应,()()0H U pV U nRT U nR T ∆=∆+∆=∆+∆=∆+∆>,放热反应,温度升高。
300 K 时,4 g Ar (g )(可视为理想气体,其摩尔质量M Ar =39.95 g·mol -1),压力为506.6 kPa 。
今在等温下分别按如下两过程:反抗202.6 kPa 的恒定外压进行膨胀。
(1)等温为可逆过程;(2)等温、等外压膨胀,膨胀至终态9. 在压力为202.6 kPa 。
试分别计算两种过程的Q ,W ,ΔU 和ΔH 。
解:(1)理想气体的可逆过程,0U H ∆=∆= ,4 g Ar 的物质的量为:14 g0.10 mol 39.95g moln -==⋅ 1112506.6 ln0.10 mol 8.314 J mol K 300 K ln 228.6 J 202.6R R p Q W nRT p --=-==⨯⋅⋅⨯⨯= (2)虽为不可逆过程,但状态函数的变化应与(1)相同,即0U H ∆=∆=22212211()()(1)R R nRT nRT pQ W p V V p nRT p p p =-=-=-=- 11202.60.10 mol 8.314 J mol K 300 K (1)149.7 J 506.6--=⨯⋅⋅⨯⨯-=10. 在573 K 时,将1 mol Ne (可视为理想气体)从1000 KPa 经绝热可逆膨胀到100 kPa 。
求Q 、W 、ΔU 和ΔH 。
解法1: 因该过程为绝热可逆过程,故Q =0。
∵R C m V 23=,,R C m p 25=,,则35==mV m p C C ,,γ 又 ∵ γγγγ221111T p T p --=,则11212T p p T γγ-⎪⎪⎭⎫⎝⎛=∴11212T p p T γγ-⎪⎪⎭⎫ ⎝⎛==573100100035351⨯⎪⎭⎫ ⎝⎛-// = 228K11,m 21() 1 mol 1.58.314 J mol K (228573) K 4.30 kJ V W U nC T T --=∆=-=⨯⨯⋅⋅⨯-=- 11,m 21() 1 mol 2.58.314 J mol K (228573) K 7.17 kJ p H nC T T --∆=-=⨯⨯⋅⋅⨯-=-11. 有1 m 3的单原子分子的理想气体,始态为273 K ,1000kPa 。
现分别经(1)等温可逆膨胀;(2)绝热可逆膨胀;(3)绝热等外压膨胀,到达相同的终态压力100 kPa 。
请分别计算终态温度T 2、终态体积V 2和所做的功。
解:(1)理想气体的等温可逆膨胀过程,pV =常数,则有:T 2=T 1=273K32112m 01010011000..p V p V =⨯==mol 584402733148011010003111...RT V p n =⨯⨯⨯==W = -12lnV V nRT = -21ln p p nRT ∴ W = -440.58×8.314×273×1001000ln= -2302.6kJ (2)绝热可逆膨胀, Q =0,则有ΔU = W 。
R C mV 23=,,R C m p 25=,,则35==m V m p C C ,,γ 又 ∵ γγγγ221111T p T p --=,则11212T p p T γγ-⎪⎪⎭⎫⎝⎛=∴11212T p p T γγ-⎪⎪⎭⎫ ⎝⎛==273100100035351⨯⎪⎭⎫ ⎝⎛-// = 108.6KW =ΔU = nC V ,m ( T 2 -T 1) = 440.58×23×8.314×( 108.6 -273) = -903.3 kJ (3)绝热恒外压膨胀, Q =0,则有ΔU = W 。
即 -p e (V 2-V 1) = nC V ,m ( T 2 -T 1)-2p (22p nRT -11p nRT ) = nC V ,m ( T 2 -T 1) 则有:- (2T -112p T p ) = 23×( T 2 -T 1) - (2T -1000273100⨯) = 23×( T 2 -273) T 2 =174.7K33222m 46101007174314858440....p nRT V =⨯⨯⨯==W =ΔU = nC V ,m ( T 2 -T 1) = 440.58×23×8.314×( 174.7 -273) = -540.1 kJ11. 1mol 理想气体在 273 K 等温地从 1000 kPa 膨胀到100 kPa ,如果膨胀是可逆的,试计算此过程的Q ,W 以及气体的ΔU ,ΔH ,ΔS ,ΔG ,ΔA 。
解:理想气体等温可逆膨胀,ΔT = 0 ,ΔU = 0 ,ΔH =0W =1000100ln27331481ln ln1212⨯⨯⨯==-.p p nRT V V nRT = -5.23 kJ Q = -W = 5.23 kJΔS = 273102353R ⨯=.T Q = 19.16 J·K -1W S T A G =∆-=∆=∆= -5.23 kJ16. 1mol 理想气体在122K 等温的情况下反抗恒定的外压,从10dm 3膨胀到终态。
已知在该过程中,系统的熵变为19.14J·K-1,求该膨胀过程系统反抗外压pe 和终态的体积V2,并计算ΔU 、ΔH 、ΔG 、ΔA 、环境熵变ΔS sur 和孤立系统的熵变ΔS iso 。
解:理想气体等温可逆膨胀:ΔT = 0 ,ΔU = 0 ,ΔH =0Q R =-W R =12lnV V nRT 即:ΔS sys =10ln 31481ln 212R V.V V nR T Q ⨯⨯===19.14J·K -1 V 2=100dm 3p e =p 2=321010012231481-⨯⨯⨯=.V nRT =10.14kPaΔG =Δ A = - T ΔS =-122×19.14= -2.34 kJ理想气体等温恒外压膨胀:Q =-W = p e ΔV= p e (V 2-V 1)=10.14×(100-10)=912.6J ΔS sur =T Q -=1226912.-= -7.48J·K -1 ΔS iso = ΔS sys + ΔS sur = 19.14 -7.48 = 11.66J·K -120. 在温度为 298 K 的恒温浴中,某2mol 理想气体发生不可逆膨胀过程。
过程中环境对系统做功为 3.5 kJ ,到达终态时体积为始态的10倍。
求此过程的Q ,W 及气体的ΔU ,ΔH ,ΔS ,ΔG ,ΔA 。
解:因为在恒温浴中进行,理想气体的 ΔU = ΔH = 0 Q = - W = -3.5 kJ设计一个始、终态相同的可逆过程,ΔS = Q R /T = nR ln10 = 38.3 J·K -1 ΔG = ΔA = -T ΔS = -11.41 kJ13.乙酸(A )与苯(B )的相图如下图所示。
已知其低共熔温度为265 K ,低共熔混合物中含苯的质量分数B 0.64w =。
(1)指出各相区所存在的相和自由度。
(2)说明CE ,DE ,FEG 三条线的含义和自由度。
(3)当B 0.25()w a =点和B 0.75()w b =点的熔液,自298 K 冷却至250 K ,指出冷却过程中的相变化,并画出相应的步冷曲线。
解: (1)CED 线以上,是熔液单相区,根据相律,条件自由度为*12112f C P =+-=+-= CFE 线之内,乙酸固体与熔液两相共存,条件自由度*1f =。
EDG 线之内,苯固体与熔液两相共存,条件自由度*1f =。
在FEG 线以下,苯的固体与乙酸固体两相共存,条件自由度*1f =。
(2)CE 线,是乙酸固体的饱和溶解度曲线,条件自由度*1f =; DE 线,是苯固体的饱和溶解度曲线,条件自由度*1f =;在FEG 线上,苯固体、乙酸固体与组成为E 的熔液三相共存,条件自由度*0f =。
