高中复习化学有机化学反应类型全总结
高中化学有机化学总复习

注意点
银氨溶液的配制:AgNO3溶液中滴加氨水至沉淀恰好溶解; 实验成功的条件:试管洁净;热水浴;加热时不可振 荡试管;碱性环境 ,氨水不能过量.(防止生成易爆物) 银镜的处理:用硝酸溶解;
银镜反应
6、乙醛与新制Cu(OH)2
化学药品:NaOH溶液、CuSO4溶液、乙醛
化学方程式:
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+H2O
思考与交流 1.生成的气体通入高锰酸钾溶液前要先通入盛水的试管 2.还可以用什么方法鉴别乙烯,这一方法还需要将生成的气体先通入盛水的试管中吗
10、 科 学 探 究
P60
乙酸溶液
苯 酚 钠 溶 液
碳酸钠固体 Na2CO3+2CH3COOH
2CH3COONa+CO2↑+H2O
酸性:
乙酸>碳酸>苯酚
分离、提纯
O
或
[ CH2-CH-CH2-CH2] n
催化剂
O
加聚反应的特点:
1、单体含不饱和键: 2、产物中仅有如高烯聚烃物、,二无烯其烃它、小炔分烃子、,醛等。 3、链节和单体的化学组成相同;但结构不同
单体和高分子化合物互推:
CH2= CH
[ CH2— CH ]n
[ CH2— CH ]n Cl
CH2=CH Cl
H[
OH ]—CH2
nOH
酚醛树脂
制取 酚醛树脂
OH + HCHO
OH
n
CH2OH
OH
H+
CH2OH
OH
H+
H[
]—CH2
nOH +(n-1)H2O
制备酚醛树脂的注意事项
高三化学有机化学反应类型整理

二、能使溴水褪色 的有机物包括: 烯烃、炔烃—加成反应。 酚类—取代反应—羟基的邻、对位。 醛(基)类—氧化反应。 三、能使酸性KMnO4褪色 的有机物包括: 烯烃、炔烃、苯的同系物、醇类、苯 酚、醛(基)类—氧化反应。
有机反应及其反应类型整理:
四、与浓硫酸 反应的有机物包括: 苯的磺化—作反应物—取代反应。 苯的硝化—催化、脱水—取代反应。 醇的脱水—催化、脱水—消去或取代。 醇和酸的酯化—催化、脱水—取代反应。 五、能与H2加成 的有机物包括: 烯烃、炔烃、含苯环、醛(基)类—也是 还原反应。
有机化学反应类型整理
HOCH2CH2OH
2
有机物转化网络图一 [CH2-CHCl]n
3
BrCH2CH2Br
1
CH3CH3
5 6
4 7
CH2=CH2
8 9
CH CH
11
23
24
CH2=CHCl
10
12 CH3CH2Br 13
14 CH3CH2OH 15 18 19
CH3CHO
20
16
CH3COOH
22
有机反应及其反应类型整理:
六、能与NaOH溶液 反应的有机物包括: 卤代烃、酯类—水解—取代反应。
(卤代烃的消去用NaOH醇溶液)
酚类、羧酸类—中和反应。 七、能与Na2CO3 反应的有机物包括: 甲酸、乙(二)酸、苯甲酸、苯酚等; 能与NaHCO3 反应的有机物包括: 甲酸、乙(二)酸、苯甲酸等。 —强酸制弱酸。
17
21
CH3CH2ONa
C2H5OC2H5
CH3COOC2H5
CH3 -NO2 -Br -SO3H O2N- -NO2 NO2 CH2Cl
高中有机化学反应类型小结

中学有机化学反应类型小结有机化学反应始终是教学的重点也是高考的热点,对化学反应进行科学的分类是探讨化学首先要解决的问题,高考考查的重要有机反应有:取代反应、加成反应、消去反应、氧化反应、还原反应、聚合反应、水解反应、酯化反应等,考查的方式有:对生疏的有机反应类型的推断;依据各类有机反应的机理书写有机化学反应方程式。
本文对常见的有机化学反应类型列举如下:一、取代反应定义:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。
典例:(1)卤代反应:如甲烷、苯的卤代反应。
(2)硝化反应:如苯、甲苯硝化反应。
(3)水解反应:卤代烃的水解、酯的水解、油脂的水解(包括皂化反应)、二糖和多糖的水解、蛋白质的水解。
(4)酯化反应:酸和醇作用生成酯和水的反应。
留意点:①取代与置换不同,置换中肯定有单质参与反应,并生成一种新的单质,而取代则不肯定有单质参与反应或生成。
②被取代的肯定是有机物分子中的原子或原子团,而用来取代的原子或原子团可以是有机物分子中的原子或原子团,也可以是无机物分子中的原子或原子团。
二、加成反应定义:有机物分子中不饱和碳原子跟其它原子和原子团结合生成新物质的反应。
通常不饱和碳原子主要指C=C、C=O(一般不含羧酸或酯中的C=O)、碳碳叁键以及具有肯定不饱和性的苯环。
典例:(1)在催化剂的作用下,烯烃、炔烃、苯和苯的同系物、醛、酮及油脂及氢气发生的加成反应。
(2)常温下含有不饱和碳原子的有机物与卤素单质、卤代氢的加成反应:如烯、炔、油脂等有机物。
如乙烯→氯乙烷。
(3)与水的加成反应:烯、炔等含有不饱和碳原子有机物在催化剂作用下,可以跟水发生加成反应。
如乙烯水化生成乙醇。
留意点:①发生加成反应的主体都是含有不饱和键的有机物,加成的物质往往是非金属单质(H2、Cl2等)或小分子化合物(H2O、HX等)。
②不饱和键是发生加成反应的前提条件下,不饱和键含碳碳之间的双键、三键,还有碳氧之间的双键、碳氮之间的三键。
高中化学—有机化学10种反应类型

一、取代反应定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。
在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。
分例如下:1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。
例如:2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。
如:(3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。
在铂或钯催化下,350℃以上发生脱氢反应生成苯。
环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。
与三氯化铝在温和条件下则异构化为甲基环戊烷。
低碳硝基烷的工业应用日益广泛。
在使用原料上,以丙烷硝化来制取是合理的途径。
在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。
有代表性的反应器则是多室斯登该尔反应器。
国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。
3、与硫酸的磺化反应(苯、苯的衍生物, 几乎均可磺化)。
如:4、羧酸和醇的酯化反应5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。
如:6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。
如:7、醇与卤化氢(HX)的反应。
如:8、羧酸或醇的分子间脱水。
如:二、加成反应定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。
在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。
如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。
通常参与加成反应的无机试剂包括H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子(对称或不对称试剂)起加成反应。
说明:i.羧基和酯基中的碳氧双键不能发生加成反应。
重要有机化学反应类型总结

② 能够水解的有机化合物:卤代烃、酯、油脂、二糖、多糖(淀粉、纤维素)、蛋白
质等。 ③ 典型反应
O
O
CH3 C O C2H5+H2O 稀H2SO4 CH3 C OH +CH3CH2OH
O
CH3 C O C2H5+NaOH
CH3 COONa+CH3CH2OH
C17 H 35COOCH 2 |
C17 H 35COOCH |
[
[O C
C OCH2CH2 +2nH2O
(的确良)
5. 消去反应 ① 定义:从一个有机分子中脱去一个小分子(如水、卤化氢等分子),而生成不饱和
(双键或叁键)化合物的反应。
② 能发生消去反应的物质:某些醇和卤代烃。
③ 典型反应
CH 3
CH 2OH
浓H2SO4 170C
CH
2
CH 2
H 2O
CH 3
1)能被酸性
KMnO
4
(紫色)氧化,使其褪色的物质有:烯烃、炔烃、二烯烃、油脂 CH3COONa
浓H2SO4 (含加C 成 C )、硝化 (23) CH3 、(24)
C2取H5代、
OH 、 C碱H石3C灰H(O34、) 葡萄糖等。
CH3
CH2CH3
COOH
NO2
SO3H
酸性 KMnO4 Cl
CH4 取代 Cl2,光(35)
2. 加成反应
① 定义:有机分子里不饱和的碳原子跟其它原子或原子团直接结合生成别的物质。加
成反应是不饱和键(主要为 C C , C C )重要性质。
② 能发生加成反应的物质有:烯烃、炔烃、苯环、醛、酮、油脂等。
③ 典型反应
有机化学反应类型总结

有机化学反应类型总结是有机化学领域中最为重要的研究内容之一。
通过,化学家们可以合成新的有机化合物,改变化合物的结构和性质,深入研究有机化合物的各种特性。
本文将对常见的类型进行总结和介绍。
一、取代反应取代反应是有机化学中最基本的反应类型之一。
它发生在有机分子中的一个原子或基团被另一个原子或基团所代替的过程中。
常见的取代反应包括烷基取代、芳香族取代和酰基取代等。
在取代反应中,官能团的性质通常会发生变化,从而使得有机分子的性质也发生相应的改变。
二、加成反应加成反应是指两个或多个分子结合形成一个较大的分子的反应类型。
它通常涉及到有机分子中的双键、三键或其他高度不饱和键的断裂和形成。
加成反应的例子包括烯烃的加成、炔烃的加成和羰基化合物的加成等。
通过加成反应,化学家可以合成出各种各样的有机分子,从而为有机合成提供了广阔的空间。
三、消除反应消除反应是指有机化合物中的一个原子或基团被消除出去,形成新的双键或三键的反应类型。
它通常发生在分子中的邻位或对位上,由于消除反应的进行,有机分子的结构和性质会发生改变。
消除反应的例子包括醇的脱水、脱卤代反应和羟基的消除等。
消除反应在有机合成中也起到了重要的作用,能够合成一些具有特殊结构和性质的有机分子。
四、重排反应重排反应是指有机化合物中化学键的重新排列,形成新的键或断裂原有键的反应类型。
重排反应通常发生在有机分子中的官能团或取代基团周围的各个位置上,由于重排反应的进行,有机分子的结构和性质发生了显著的改变。
常见的重排反应包括烷基重排、芳香族重排和脱氢重排等。
通过重排反应,化学家们可以探索有机分子的结构和反应机理,为有机合成提供了新的思路和方法。
五、环化反应环化反应是指有机分子中的合成反应中形成环状结构的反应类型。
通过环化反应,化学家们可以合成出各种各样的环状有机分子,从而研究和探索有机分子的不同结构和性质。
常见的环化反应包括碳碳键的环化反应、羰基的环化反应和杂环的环化反应等。
高中化学知识点总结:有机化学反应类型归纳

高中化学知识点总结:有机化学反应类型归纳1.取代反应(1)定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
(2)能发生取代反应的物质:烷烃、芳香烃、醇、酚、酯、羧酸、卤代烃。
(3)典型反应:CH4 + Cl2 CH3Cl + HCl2.加成反应(1)定义:有机物分子里不饱和碳原子跟其他原子或原子团直接结合生成别的物质的反应。
(2)能发生加成反应的物质:烯烃、炔烃、苯及其同系物。
醛、酮、单糖等等。
(3)典型反应:CH2=CH2 + Br2 → CH2Br-CH2Br3.加聚反应(1)定义:通过加成聚合反应形成高分子化合物。
(2)特征:生成物只有高分子化合物,其组成与单体相同。
(3)典型反应:4.缩聚反应(1)定义:通过缩合反应生成高分子化合物,同时还生成小分子。
(如H2O、NH3等)的反应。
(2)特征:除生成高分子化合物还有小分子生成。
(3)典型反应:5.消去反应:(1)定义:从一个有机物分子中脱去小分子(如H2O、HX等)而生成不饱和化合物(含双键或叁键)的反应。
(2)能发生消去反应的物质:醇、卤代烃。
(3)典型反应:6.氧化反应(1)定义:有机物加O或去H的反应。
(2)类型:①在空气中或氧气中燃烧②催化氧化如:2C2H5OH + O2 2 CH3CHO + 2H2O③某些有机物被非O2氧化剂氧化如:烯、炔、苯的同系物被酸性,KMnO4氧化;醛类,甲酸及甲酸酯葡萄糖被银氢溶液,新制Cu(OH)2氧化:CH3CHO+2Cu(OH)2 → CH3COOH+Cu2O↓+2H2O7.还原反应(1)定义:有机物加H或去O的反应(2)典型反应:CH3CHO+H2→ CH3CH2OH(也是加成反应)8.酯化反应:(也属于取代反应)(1)定义:酸与醇起作用、生成酯和水的反应(2)典型反应:C2H5OH + CH3COOH CH3COOC2H5 + H2O9.水解反应(属于取代反应)(1)反应特征:有水参加,有机物分解成较小分子。
高三化学有机化学反应类型整理

二、能使溴水褪色 的有机物包括: 烯烃、炔烃—加成反应。 酚类—取代反应—羟基的邻、对位。 醛(基)类—氧化反应。
三、能使酸性KMnO4褪色 的有机物包括: 烯烃、炔烃、苯的同系物、醇类、苯
酚、醛(基)类—氧化反应。
有机反应及其反应类型整理:
21 22
CH3CH2ONa C2H5OC2H5
CH3COOC2H5
-NO2 -Br
12 3 4
-SO3H
CH3 O2N- -NO2
CH2Cl
NO2
10
11
-CH3
12
--CCHl 3
-Cl 5
13
OH
-OH 6 Br- -Br
-COOH
有机物转化 网络图二
78 9
Br
-ONa 显色反应
有机反应及其反应类型整理:
(卤代烃的消去用NaOH醇溶液)
酚类、羧酸类—中和反应。
七、能与Na2CO3 反应的有机物包括: 甲酸、乙(二)酸、苯甲酸、苯酚等; 能与NaHCO3 反应的有机物包括: 甲酸、乙(二)酸、苯甲酸等。 —强酸制弱酸。
有机反应及其反应类型整理:
八、能与金属Na 反应的有机物包括: 含-OH的物质:醇、酚、羧酸。
四、与浓硫酸 反应的有机物包括: 苯的磺化—作反应物—取代反应。 苯的硝化—催化、脱水—取代反应。 醇的脱水—催化、脱水—消去或取代。 醇和酸的酯化—催化、脱水—取代反应。
五、能与H2加成 的有机物包括: 烯烃、炔烃、含苯环、醛(基)类—也是
还原反应。
有机反应及其反应类型整理:
六、能与NaOH溶液 反应的有机物包括: 卤代烃、酯类—水解—取代反应。
高考化学有机反应类型总结

高考化学有机反应类型总结
高考化学中的有机反应类型是化学考试中的重要考点,也是学生需要掌握的重要知识点。
以下是对高考化学有机反应类型的总结:
一、取代反应
取代反应是有机化学中最常见的反应类型之一,它涉及到有机物分子中的原子或基团被其他原子或基团所取代。
例如,甲烷与氯气在光照条件下发生取代反应,生成氯代甲烷和氯化氢。
二、加成反应
加成反应是烯烃和炔烃与氢气、卤素或卤化氢等发生反应,生成饱和烃或卤代烃的反应。
例如,乙烯与氢气发生加成反应,生成乙烷。
三、消去反应
消去反应是有机化学中另一种常见的反应类型,它涉及到有机物分子中的羟基或卤素原子与相邻的碳原子上的氢原子结合,生成不饱和键的反应。
例如,乙醇发生消去反应,生成乙烯。
四、酯化反应
酯化反应是有机酸和醇发生反应,生成酯和水的反应。
例如,乙酸和乙醇发生酯化反应,生成乙酸乙酯和水。
五、水解反应
水解反应是有机酸或酯等在水中发生分解的反应。
例如,乙酸乙酯在酸性条件下发生水解反应,生成乙酸和乙醇。
六、氧化还原反应
氧化还原反应是有机化学中涉及电子转移的反应,包括氧化和还原两个过程。
例如,烯烃与臭氧发生氧化还原反应,生成醛或酮。
以上是对高考化学有机反应类型的总结,学生需要掌握每种反应类型的概念、原理和实例,以便能够正确理解和应用这些知识。
同时,学生还需要注意不同反应类型之间的联系和区别,以便能够更好地掌握有机化学的知识体系。
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
高考化学复习常见有机反应类型归纳

基本类型
有机物类别
消去反应
卤代烃、醇等
氧化 反应
ቤተ መጻሕፍቲ ባይዱ
燃烧 酸性 KMnO4 溶液 直接(或催化)氧化
绝大多数有机物 烯烃、炔烃、苯的同系物等
酚、醇、醛、葡萄糖等
还原反应
醛、葡萄糖等
聚合
加聚反应
烯烃、炔烃等
反应
缩聚反应
苯酚与甲醛、多元醇与多元羧酸等
与浓硝酸的颜色反应
蛋白质(含苯环的)
与 FeCl3 溶液的显色反应
(1)A 的名称(系统命名)为________,H 的官能团是________、 ________(填名称)。 (2)写出下列反应的反应类型:反应①是________;反应④是 ________。 (3)反应②发生的条件是_____________________________。
(4)已知:—SH(巯基)的性质与—OH 相似,则
(2)E 可以发生的反应有________(填序号)。
①加成反应
②消去反应
③氧化反应
④取代反应
(3)由 B 转化成 D 的化学方程式是_________________________
_____________________________________________________。
(4)G 在一定条件下发生反应,生成分子式为 C4H4O4 的有机物 (该有机物可使溴的四氯化碳溶液褪色),G 发生此反应的化学 方程式是_____________________________________________。 (5)已知在 X 分子结构中,R1 里含有能与 FeCl3 溶液发生显色反 应的官能团,且 E 分子中苯环上的一氯代物只有一种,则 X 的 结构简式是__________________________________________。
有机化学基本反应类型较全

有机反应类型——知识归纳
书写有机化学反应的注意事项
写有机物的结构简式及反应条件
不漏写除了有机物外的其它无机小分子
如酯化反应、硝化反应、醇催化氧化、缩聚反 应生成的H2O;卤代反应生成的HX等 配平:如醇、醛的催化氧化、银镜反应
专用名词不能出错
如,苯写“笨”、“酯”和“脂”混用、“硝化” 写“消化”, “水浴”写成“水狱”,“褪色” 写成“腿色”
有机反应类型——加聚反应
类型(联系书上提到的高分子材料):
乙烯型加聚 聚丙烯、聚苯乙烯、聚氯乙烯、 聚丙烯腈、聚甲基丙烯酸甲酯(有机玻璃) 1,3-丁二烯型加聚(破两头,移中间) 天然橡胶(聚异戊二烯) 氯丁橡胶(聚一氯丁二烯) 含有双键的不同单体间的共聚
乙丙树脂(乙烯和丙烯共聚), 丁苯橡胶(丁二烯和苯乙烯共聚)
5、水解反应
(1)H2NCH2CONHCH2COOH+H2O→ (2)C12H22O11(蔗糖)+H2O→ (3) C12H22O11(麦芽糖)+H2O → (4)(C6H10O5)n(淀粉)+H2O → (5)(C6H10O5)n(纤维素)+H2O →
(条件、现象、应用)
6、皂化反应
C 17 H35 C O O C H2 C 17 H35 C O O C H + C 17 H35 C O O C H2
条件下
不对称烯烃或炔烃和H2O、HX加成时可能产生两 种产物
醛基的C=O只能和H2加成,不能和X2加成,而羧 基和酯的C=O不能发生加成反应
若一种物质中同时存在C=C、醛基等多个官能团 时,和氢气的加成反应可同时进行,也可以有选 择地进行,看信息而定
有机反应类型——消去反应
原理:“无进有出”
高中有机化学方程式依据反应类型汇总

高中有机化学教材方程式依据反应类型汇总一、取代反应(6)1.甲烷氯气光照:CH4 + Cl2CH3Cl + HCl2.苯与液溴的反应: (催化剂为溴化铁)苯与浓硝酸的反应: (硝化反应)甲苯与浓硝酸反应: (制炸药)3.氯代烃水解反应: (水解反应属于取代反应)4.乙醇与浓氢溴酸:CH3CH2OH + HBr CH3CH2Br + H2O5.苯酚与浓溴水的取代反应:(现象:白色浑浊)6.酯化反应:(酯化反应属于取代反应)二、加成反应(5)1.乙烯的加成(碳碳双键加成)乙烯与溴水的反应:(加成反应)乙烯与水的反应:(加成反应)乙烯与溴化氢反应:(加成反应)乙烯与氢气反应:(加成反应)2.乙炔的加成(碳碳三键加成):3.苯环加成: (环己烷)4.醛基加成:(也属于还原反应)5.羰基加成:CH3COCH3 + H2 CH3CHOHCH36.一般认为羧基、酯基不加成三、消去反应(2)1.卤代烃的消去反应: (条件为NaOH的醇溶液)2.醇的消去反应: (条件为H2SO4加热)四、聚合反应(加聚和缩聚)1.乙烯的加聚反应: (加聚反应)1,3丁二烯的1,4加聚:1,3丁二烯的1,2加聚:nCH2=CH-CH=CH2 [ CH2-CH ]n22.乙二酸和乙二醇:nHOCH2CH2OH + nHOOCCOOH H [ OCH2CH2OOCCO ] OH + (2n-1)H2O乳酸的缩聚: nHOCH(CH3)COOH H[ OCHCO ]n OH + (n-1)H2O3五、氧化反应1.氧气/铜催化(1):乙醇的催化氧化:2CH3CH2OH + O2 2CH3CHO + 2H2O (氧化反应)2.银氨溶液/加热(1):银镜反应:CH3CHO +2Ag(NH3)2OH CH3COONH4 + 3NH3↑ + 2Ag↓+ H2O3.醛与新制氢氧化铜的反应(1):4.高锰酸钾褪色(6)(烯、炔、部分芳香烃、部分醇、酚、醛等)。
高中化学反应类型归纳
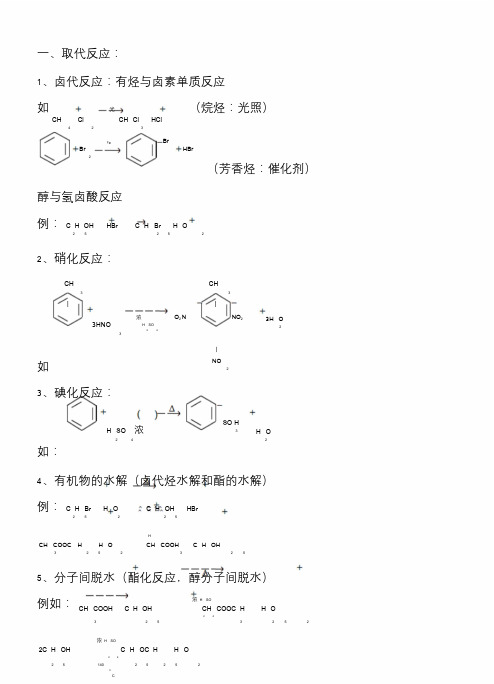
1、卤代反应:有烃与卤素单质反应如光(烷烃:光照)CH Cl CH Cl HCl423Br2FeBrHBr(芳香烃:催化剂)醇与氢卤酸反应例:C H OH HBr C H Br H O252522、硝化反应:CH CH33 ||3HNO3浓O2N NO2H SO243H O2|如NO2 3、碘化反应:H SO浓24SO H3H O2如:4、有机物的水解(卤代烃水解和酯的水解)例:C H Br H O C H OH HBr25225HCH COOC H H O CH COOH C H OH32523255、分子间脱水(酯化反应,醇分子间脱水)例如:浓H SOCH COOH C H OH CH COOC H H O243253252浓H SO2C H OH C H OC H H O242514025252C1、不饱和烃与H2、X2、HX、H2O等加成如NiCH CH2H CH CH233CH CH Br CH CH22222||Br Br2、芳香烃与X2、H2加成Ni3H2例:3、O||C与H2加成(包括醛、酮单糖与H2加成)如NiCH CHO H CH CH OH3232三、消去反应:1、卤代烃消去:X所连碳原子上连有H原子的卤代烃才能消去(NaOH醇溶液)。
如:醇CH CH CH X NaOH CH CH CH NaX H O3223222、醇消去:羟基所连碳原子上的相邻碳原子上必须连有H原子的醇才能消去(浓H2SO4,加热)。
如:浓H SOCH CH CH CH C CH H O2432322170C|||CH OH CH33四、聚合反应:1、加聚反应:不饱和有机物彼此加成而生成高分子化合物的反应。
n C H CH CH2 CH2|n如:(C=C变C—C)nCH2 CH CH CH2 [ CH2 CH CH CH 2 ] n2 个C=C变成1 个C=C2、缩聚反应:单体间相互反应生成高分子化合物同时,有小分子生成。
高中有机化学的基本反应类型整理汇总.doc

0.186,假定A的相对分子质量为90,则N(O)=90x^J86 = l0463^lo所以氧的原子个数为1,则A的相对分子质量为:S|=86*由商余法得箜評=5… 10,即A得分子式为C5H i0O.(2)由于B与NaHCO3溶液完全反应,其物质的就之比为1:2,所以B中含有2个—COOH,结合c +c2h5oh->c2h4o2 +h2o可知,C为CH,COOH,即B中含有3个C原子,现已知B中含有2个一COOH,即B中还含有一个CH?,所以B的结构简式为HOOC~CH2—COOH, B 与足量的C2H5OH 反应的化学方程式为:HOOC-CH? — COOH +2C2H5OH -= = C2H5OOC—ch2—COOC2H5 + 2H2O,反应类型为酯化反应.(3)A可以与金展钠作用放岀氢气,说明A 中含有的官能团为一OH,能使溟的四氯化碳溶液褪色,说明A中含有C = 且A为直链化合物,结合题上的提示可得A 的结构简式为: HO~CH 2—CH2—CH = CH—CH3.(4)能与NaHCO,溶液反应放出CO?,说明为竣酸,其结构简式为:CH3CH2CH2COOH. CH3CH(CH3)COOH ・答案:(1)C5H io O(2)HOOC—CH2—COOH + 2C2H5OH ^=c2h5ooc—ch2—COOC2H5+2H2O 酯化反应(或取代反应;(3)H0—CH2—CH2—CH = CH—CH3(4) 2 CH3CH2CH2COOH.CH3CH(CH3)COOH点评:在大题中,对组成分子式、结构简式、同分异构体、反应类型、化学方程式等等的考査更全面.吉林省梅河□市翰林高中(135000 )•师殿峰有机化学的十大基本反应类型一、取代反应1.概念:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应.2.特点:有“上”有“下”.3.常见类型:(1)烷绘的卤代反应.如:CH4 +C12 -^CH?C1 + HC1(2)苯及其同系物和酚的卤代(硝化、磺化)反应.如:1 +3HBr(3)醇与氢卤酸(HX)的反应.如:C2H5OH + HBr -^->C2H5Br + H20(4)醇分子间脱水生成醛的反应.如: 浓H2SO3C2H5OH + HOC2H5——-~>c2h5oc2h5 +h2o浓h2so4CH3COOH + HOC2H5——―ch3cooc2h5 +h2o( _ ■如:C2H5—Br + H20 ― C2H5—OH + HBrCH3COOC2H5 + h2o - >ch3ooh + C2H5OH二、加成反应1•概念:有机物分子中双键(或三键)两端的碳原子(或其他原子)与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应.2.特点:只“上”不“下二3・常见类型:(1)烯炷、二烯婭、块疑.芳香烧、醛、酮及含有碳碳不饱和键的婭的衍生物与h2的加成反应.如:CH2 = CH2 + H2 =S^=CH3CH3催化剂CH2 = CHCH = 2H2 + 2H2— CH3CH2CH2CH3CH = CH +2H2 >CH3CH30+琨工0CH3CHO + H2—— >CH3CH2OHCH3COCH3 + h2>CH3CHOHCH3创化剂CH2 = CHCOOH + H2 -- >CH3CH2COOH(2)烯炷、二烯婭、烘婭及含有碳碳不饱和键的婭的衍生物与卤素(X2)的加成反应.如:CH2 =CH2 +Br2->Br€H2CH2BrCH2 = CHCH = CH2 + Br2->BT€H2CHBi€HBi£H2BrCH = CH 4 2Br2->Br2CHCHBr2CH2 = CHCOOH + Br2->BrCH2CHBi€OOH(3)烯婭、二烯炷、烘婭及含有碳碳不饱和键的炷的衍生物与卤化氢(HX)的加成反应. 如:CH2 = CH2 + HC1 一連化叭 CH3CH2CICH = CHCH = CH2 + HBr -肇化泄CH3CH = CHCH2Br(4)烯坯、块矩与水的加成反应•如:CH2 = CH2 + H20 進化叫CH3CH2OHCH 三CH + H20 上竺厶CH3CHO三、消去反应1 •概念:有机化合物在一定条件下,从一个分子中脱去一个小分子(如水、卤化氢等)而生成不饱和(含双键或三键)化合物的反应,叫做消去反应.2.特点:只“下”不“上”.'3•常见类型:(1)卤代绘与强域的醇溶液共热的反应•如:CH3CH2CH2Br + NaOH -^>CH3CH = CH2 f + NaBr +H2O舗化汞(2)醇分子内的脱水反应.如:CH3CH2OH -^CH2=CH2t +H204.知识规律:(1)只有一个碳原子的卤代婭或醇(如CH3X.CH3OH)和与卤索原子或轻基所连碳原子的邻位碳原子上没有氢原子的卤代婭或醇[如(CH3)3CCH2X. (CHj) 3CCH2OH ] 不能发生消去反应.(2)—卤代烧或一元醇发生消去反应生成烯炷,二卤代炷或二元醇发生消去反应可生成烘烧或二烯婭•如:浓H2SO4 CH3CH2OH + HO—N02(浓)----------- ►CH3CH2ONO2 +h2oCH2—OHI j 浓h2S04CH2—OH +2HO—NO2(浓)------------CH?—OHCH—OHICH?—OHch2—ono2CH—0N02+3H2Och2—ono2CH2=C—C=CH: +2NaBr+2H2OCH3CH3Br2CH2CH2Br4- +2NaOH(浓)CH = CII +2NaBr+2II2O(3)有两个(或士个)邻位碳原子,且两个(或三个)邻位碳原子上均有氢原子的卤代坯或醇发生消去反应时可能有两种(或三种)消去方式•当卤代炷或醇有两种(或三种)消去方式时,主要从含氢较少的邻位碳原子上脱氢.如:CH3CH2CHCH3 + KOHIBrCH3 CH = CHCH3(CH3CH2 CH = CHJ + KBr + H2O 81% 19%四、酯化反应1.概念:酸和醇起作用,生成酯和水的反应叫做酯化反应.其中,酸指有机酸(竣酸)或无机含氧酸(如H2SO4. HNO3等);醇不仅指醇类,而且包括含醇羟基的有机物(如葡萄糖、纤维素等).2.特点:有“上”有“下”.3.常见类型:(1)无机含氧酸与一元醇、二元醇和多元醇的酯化反应.如:(2)无机酸与糖的酯化反应.in:OH(C6H7O2)-OHOH3n H20(3)—元竣酸与一元酸、二元醇和多元醇的黯化反应•如:浓h2so4 ch3cooh +HOC2H5 ----------------------------------- ►CH3COOC2H$ +h2o浓H2SO42CH3COOH + HO—CH2——-~►HO—CH2CH3COOCH2 +2H.0CH3COOCH2浓h2so43C17 H35 COOH + CH2—OH —-_CH—OHch2—ono2ch2—ono2+ 2H2O+ 3H0—NO?(浓)浓HqSO,+ 2NaOH乙醇+ 3a HO—N02(浓)浓h2so4-----0—NO2(C6H7O2)^-O-NO20—NO2I・• •CH2—OH •C17H35COOCH2 +3H2Oc17h35coochc,7h35cooch2(4)一元敖酸与糖的酯化反应.如:CHOI H*(CHOH). + 5CH3COOH―►CH2OHCHOI(CHOOCCH3)4 +5H2OCH2OOCCH3(5)二元竣酸与一元醇、二元醇的酯化反应•如:浓h2so4・ COOH +2CH3CH2OH——-一►COOHCOOC2H< *2H2OICOOC2H5浓h2so4 HOOC—COOH + HOCH2CH2OH —-~►HOOC—COOCH2CH2OH + h2o浓h2so4COOH + CH2OH ——-_►I I △COOH CH.OH0 = C CH2\ /aH00C^^2/^C00H + hHOCH2CH2OH0 0f -tc—OCH2CH2O3- + 2nH2O(6)起基竣酸分子内的酯化反应•如:亠亠亠•浓HqSO,HO—CHjCHjCHjCOOH ----------------- ►CH2—€ch2 ch2-o +h2o(刀轻基按酸分子间的酯化反应•如:HOCH2CH2COOH + HOCH2CH2COOH 浓h2so4—-~► hoch2 ch2 cooch2 ch2 COOH + h2o浓h2so4raHOCH2CH2COOH —-_►-fOCH2CH2Ci +nH2O浓h2so4CH3CHCOOH + CH3CHCOOH ——-__►OH OH\I/CH—CH3五、氧化反应1.概念:有机物分子中加氧或夫氧的反应叫做氧化反应.• 2.特点:得“氣”或失“氢3.常见类型:(1)有机物的燃烧反应,如:C” + (% + 于)。
高三专题复习:有机化学的反应类型

高三专题复习:有机化学的反应类型重要有机反应类型取代反应、加成反应、消去反应、聚合反应(含加聚反尖和缩聚反应)、氧化反应、还原反应 一、取代反应1.概念:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。
2.常见能发生取代反应的官能团有:醇羟基(-OH )、卤原子(-X )、羧基(-COOH )、酯基(-COO -)、肽键(-CONH -)等。
3.常见能发生取代反应的有机物如下图所示:(1)卤代反应:烃分子的氢原子被—X 所取代的反应。
(2)硝化反应:苯分子里的氢原子被—NO 2所取代的反应。
(3)磺化反应:苯分子里的氢原子被硫酸分子里的磺酸基(—SO 3H )所取代的反应。
(4)酯化反应:酸和醇起作用生成酯和水的反应。
羧酸和醇的酯化反应的脱水方式是“酸脱羟基醇脱氢”。
这种反应的机理可通过同位素原子示踪法进行测定。
(5)水解反应:一般指有机化合物在一定条件下跟水作用生成两种或多种物质的化学反应。
水解反应包括卤代烃水解、酯水解、糖水解、蛋白质水解。
其中皂化反应也属于水解反应。
皂化反应是指油脂在有碱存在的条件下水解,生成高级脂肪酸钠和甘油的反应。
取代反应 烃的卤代苯的磺化醇与氢卤酸的反应 酯化反应水解反应 醇、氨基酸等分子间的脱水苯的硝化塑料注意水解反应发生时有机物的断键部位,如乙酸乙酯水解时是与羰基相连的C -O 键断裂。
(蛋白质水解,则是肽键断裂) 二、加成反应1.能发生加成反应的官能团:碳碳双键、碳碳三键、苯环、羰基(醛、酮)等(包括:加水、加卤素、加氢、加卤化氢等) 2.加成反应有两个特点:(1)反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
(2)加成反应后生成物只有一种(不同于取代反应)。
说明:(1)羧基和酯基中的碳氧双键不能发生加成反应。
(2)醛、酮的羰基与H 2发生加成反应,与其它物质一般难于加成。
三、加聚反应1.本质:通过自身加成反应形成高分子化合物。
高三化学有机化学反应类型整理

有机反应及其反应类型整理:
二、能使溴水褪色 的有机物包括: 烯烃、炔烃—加成反应。 酚类—取代反应—羟基的邻、对位。 醛(基)类—氧化反应。 三、能使酸性KMnO4褪色 的有机物包括: 烯烃、炔烃、苯的同系物、醇类、苯 酚、醛(基)类—氧化反应。
有机反应及其反应类型整理:
四、与浓硫酸 反应的有机物包括: 苯的磺化—作反应物—取代反应。 苯的硝化—催化、脱水—取代反应。 醇的脱水—催化、脱水—消去或取代。 醇和酸的酯化—催化、脱水—取代反应。 五、能与H2加成 的有机物包括: 烯烃、炔烃、含苯环、醛(基)类—也是 还原反应。
17
21
CH3CH2ONa
C2H5OC2H5
CH3COOC2H5
CH3 -NO2 -Br -SO3H O2N- -NO2 NO2 CH2Cl
1 2 4
3
10
11
-CH3
12
-CH3 -Cl -COOH
OH
-Cl 5 -OH 6 Br-
13
-Br
7 8
9
Br
显色反应
有机物转化 网络图二
-ONa
一、与Br2反应须用液溴 的有机物包括: 烷烃、苯、苯的同系物—取代反应。
有机化学反应类型整理
HOCH2CH2OH
2
有机物转化网络图一 [CH2-CHCl]n
3
BrCH2CH2Br
1
CH3CH3
5 6
4 7
CH2=CH2
8 9
CH CH
11
23
24
CH2=CHCl
10
12 CH3CH2Br 13
14 CH3CH2OH 15 18 19
CH3CHO
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学反应类型全总结一、取代反应
定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应.
取代反应的类型很多, 中学化学中主要有下面几类:
1.卤代反应烷烃、芳香烃、苯酚等均能发生卤代反应如:
2.硝化反应苯及其同系物、苯酚、烷烃等均能发生硝化反应如:
3.磺化反应苯、苯的衍生物, 几乎均可磺化.如:
(邻、对位产物为主) 4. 酯化反应
(1)羧酸和醇的反应.如:
(2)无机含氧酸和醇的反应.如:
5.水解反应:
卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应.如:
6. 与活泼金属的反应:
醇、酚、羧酸等均能与活泼金属如钠反应生成氢气.如:
7.醇与卤化氢(HX)的反应.如:
8.羧酸或醇的分子间脱水.如:
二、加成反应
定义有机物分子里不饱和的碳原子跟其它原子或原子团直接结合, 生成别的物
质的反应, 叫加成反应分子结构中含有双键或叁键的化合物, 一般能与H
2、X
2
(X为
Cl、Br、I)、HX、H
2
O、HCN等小分子物质起加成反应.
如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等.
说明:
1.羧基和酯基中的碳氧双键不能发生加成反应。
2.醛、酮的羰基只能与H
2
发生加成反应。
3.共轭二烯有两种不同的加成形式。
1.和氢气加成.
2.和卤素加成
3.和卤化氢加成
4.和水加成
三、消去反应
定义:有机化合物在适当条件下, 从一个分子相邻两个碳原子上脱去一个小分子(如O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除反应H
2
发生消去反应的化合物需具备以下两个条件:
(1)是连有一OH(或一X)的碳原子有相邻的碳原子;
(2)是该相邻的碳原子上还必须连有H原子.
1.醇的消去反应.如:
2.卤代烃的消去反应.如:
四、聚合反应
定义:由许多单个分子互相结合生成高分子化合物的反应叫聚合反应.
聚合反应有两个基本类型:加聚反应和缩聚反应.
1.加聚反应.
由许多单个分子互相加成, 又不缩掉其它小分子的聚合反应称为加成聚合反应简称加聚反应.
烯烃、二烯烃及含的物质均能发生加聚反应.如:
2.缩聚反应
单体间相互结合生成高分子化合物的同时, 还生成小分子物质的聚合反应, 称
为缩合聚合反应, 简称缩聚反应.
酚和醛、氨基酸(形成多肽)、葡萄糖(形成多糖)、二元醇与二元酸、羟基羧酸等均能发生缩聚反应.如:
五、有机氧化反应
1.燃烧(绝大多数有机物容易燃烧)如:
3.催化氧化(或去氢)
(1)乙烯催化氧化制乙醛(催化剂PdCl
2和CuCl
2
)
(2)乙醇催化氧化制乙醛(催化剂:Cu或Ag)
(3)乙醛催化氧化制乙酸(催化剂:醋酸锰)
(4)丁烷氧化法制乙酸(催化剂:羧酸的钴盐等)
4.与强氧化剂:KMnO
4
(H+)的反应:
(1)烯烃、二烯烃、炔烃,含有的油脂都能使KMnO
4
(H+)的紫色褪色.如:
(2)苯的同系物也能使KMnO
(H+)的紫色褪色.如:
4
(2)醛、甲酸及其酯、甲酸盐、葡萄糖等含有醛基的物质也能使KMnO
(H+)的紫色
4褪色.如:
5.醛基(-CHO)与弱氧化剂:银氨溶液、新制Cu(OH)2的氧化反应. (-CHO均被氧
化成-COOH),醛类、甲酸及其酯、甲酸盐、葡萄糖等均能发生上述反应.如:
六、有机还原反应
1.催化加氢(或去氢)的还原反应
含有或的不饱和化合物及含有的醛、酮、单糖、羧酸等物质与H2的加成反应,都属于还原反应(其它反应见前面加成反应1.)如:
3.硝基苯制苯胺
七、分解反应
1.热分解反应.如:
2.裂化、裂解反应.如:
八、酸碱反应
九、显色反应
1.苯酚溶液跟FeCl
3溶液作用能显紫色.因苯酚和FeCl
3
在水溶液里反应,生成络离
子而显紫色.
2.可溶性淀粉溶液遇碘变蓝色
因直链淀粉的结构能容纳碘钻入并吸附成包含物质而显蓝色.
4.蛋白质(分子结构中含有苯环), 跟浓硝酸作用呈黄色因氨基酸中的苯环发生硝
化反应, 生成黄色的硝基化合物.
十、与Na反应
醇、酚、酸分别与Na、NaOH、Na2CO3、NaHCO3的反应
仰望天空时,什么都比你高,你会自卑;
俯视大地时,什么都比你低,你会自负;
只有放宽视野,把天空和大地尽收眼底,
才能在苍穹泛土之间找准你真正的位置。
无须自卑,不要自负,坚持自信。
用心工作,快乐生活!(工作好,才有好的生活!)
此文档可编辑,欢迎使用!
~~~专业文档,VIP专享。
更多精彩文档,尽在Baidu文库~~~。
