硫酸生产方法
硫酸的工业制法

1 .什么是环境?
大气、土地、水、矿产、森林、生物以 及风景游览区、自然保护区、生活居住 区等构成了人类生存的环境
2 .环境污染包括哪些?
环境污染主要包括大气污染、水污染、土壤 污染、食品污染等,此外还包括固体废弃物, 放射性噪声等污染。
返回
3.SO2排放到大气中有哪些危害?
• ①人吸入SO2会发生呼吸道疾病,浓度高达一定程 度时,会使人死亡。 • ②如果SO2与空气中的飘尘接触,或跟氮的氧化物 接触,会部分被氧化为SO3,危害跟严重,这些硫 的氧化物能直接伤害植物叶片,浓度高时,会使 植物枯死。 • ③降水时,硫的氧化物以及所形成的硫酸和硫酸 盐随雨雪降到地面,即所谓的“酸雨”。酸雨可 使湖泊水质酸化,毒害鱼类和其它水生生物;使 土壤酸化、破坏农田、损害农作物、森林;酸雨 还会腐蚀建筑物、金属制品、名胜古迹等。
返回
6.什么是热交换过程? 6. 什么是热交换过程?
通过热交换器把反应时生 成的热,传递给进入接触 室的需要预热的混合气体, 并冷却反应后生成的气体, 像这样传递热量的过程就 是化学工业上常用的热交 换过程。
返回
7.吸收SO3为什么不直接用水或 稀硫酸,而是用98.3%的浓硫酸?
因为用水或稀硫酸作吸收 剂时,容易形成酸雾,吸 收速度慢且吸收不充分, 而 用 98.3% 的 浓 硫 酸 作 吸 收剂,则在吸收过程中不 形成酸雾,吸收速度快且 吸收充分,有利于SO3的吸 收。
关于多步反应变一步的计算
步骤: 1.写出多步反应的化学方程式; 2.找出主要原料和最终产物之间的物质的 量的对应关系。即找出主要原料和最终产 物中所含关键原子个数关系。 3.列出关系式,解出答案。
守恒原则
•计算中可以按照守恒、累积、转化的三原则处 理有关过程及数据以化难为易。 •1.守恒原则:如黄铁矿制硫酸中 S 原子守恒,具 体表现形式为 •FeS2——2H2SO4 或 S——H2SO4
硫酸的性质、生产方法和主要设备

2.中国硫酸工业的发展
1874年,天津机械局三分厂建成中国最早的铅室法装置, 1876年投产,日产硫酸约2t,用于制造无烟火药。
1934年,中国第一座接触法装置在河南巩县兵工厂分厂投产。 1949年以前,中国硫酸最高年产量为 180kt(1942)。1983年硫
酸产量达8.7Mt(不包括台湾省),仅次于美国、苏联,居 世界第三位。1998 年产量为20.495Mt,居第二位。 1951年,研制成功并大量生产钒催化剂,此后还陆续开发了 几种新品种。 1956年,成功地开发了硫铁矿沸腾焙烧技术,并将文氏管洗 涤器用于净化作业。 1966年,建成了两次转化的工业装置,成为较早应用这项新技 术的国家。在热能利用、环境保护、自动控制和装备技术等 方面,也取得了丰硕成果。
硝化法的兴衰 1746年,英国人J.罗巴克在伯明翰建成一座 6ft(lft=0.3048m)见方的铅室,这是世界上第一座铅室法生 产硫酸的工厂。1805年前后,首次出现在铅室之外设置燃烧 炉焚燃硫磺和硝石,使铅室法实现了连续作业。1827年,著 名的法国科学家盖.吕萨克建议在铅室之后设置吸硝塔,用铅 室产品(65%H2SO4)吸收废气中的氮氧化物。1859年,英国 人J.格洛弗又在铅室之前增设脱硝塔,成功地从含硝硫酸中 充分脱除氮氧化物,并使出塔的产品浓度达76%H2SO4。这 两项发明的结合,实现了氮氧化物的循环利用,使铅室法工 艺得以基本完善。
铅室法产品的浓度为 65%H2SO4,塔式法则为76%H2SO4。 在以硫铁矿和冶炼烟气为原料时,产品中还含有多种杂质。
40年代起,染料、化纤、有机合成和石油化工等行业对浓硫 酸和发烟硫酸的需要量迅速增加,许多工业部门对浓硫酸产 品的纯度也提出了更高的要求,因而使接触法逐渐在硫酸工 业中居于主导地位。
硫酸的工业制法
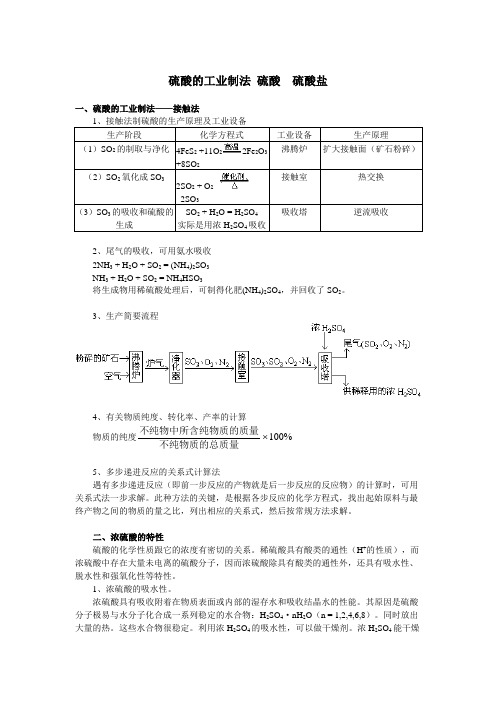
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
硫酸的制备方程式

硫酸的制备方程式全文共四篇示例,供读者参考第一篇示例:硫酸,化学式为H2SO4,是一种广泛应用的强酸,常用于各种工业生产、实验室研究以及农业生产中。
硫酸是一种无色、无臭、具有强烈腐蚀性的液体,能与许多物质发生化学反应。
制备硫酸的方法有多种,其中最常见的方法是通过硫磺氧化反应制备。
硫酸的制备方程式为:S(s) + O2(g) + H2O(l) -> H2SO4(aq)这个方程式表明,硫磺(S)在氧气(O2)的存在下与水(H2O)发生反应,生成硫酸(H2SO4)溶液。
制备硫酸的过程包括几个步骤:第一步:将硫磺加热至熔化状态,使其成为液态硫磺。
接着将液态硫磺缓慢地滴入浓硝酸(HNO3)中,在这个过程中,硫磺逐渐溶解到硝酸中。
第二步:将所得的硫酸溶液置于冷却装置中,让其冷却至室温。
在这一过程中,硝酸的浓度逐渐下降,硫酸的浓度逐渐增加。
第三步:将所得的硫酸溶液进行浓缩和精炼,直至得到所需的硫酸产品。
值得注意的是,制备硫酸的过程中需要特别注意安全措施,因为硫酸具有腐蚀性强的特点,对皮肤和眼睛都有较强的刺激性。
在操作过程中,需要戴上防护眼镜、手套等防护用具,并注意避免硫酸溶液飞溅或溅在皮肤上。
除了硫磺氧化法,制备硫酸的方法还包括氧化二氧化硫和过氧化氢等方法。
氧化二氧化硫制备硫酸的方程式为:SO2(g) + H2O2(l) -> H2SO4(aq)硫酸的制备方法多种多样,选择适合自己需要的制备方法进行生产。
在操作过程中,一定要遵守安全规范,做好防护工作,以确保生产过程的安全和顺利进行。
希望通过本文的介绍,能更好地了解硫酸的制备方法和安全注意事项。
【字数不足,可以自行补充相关内容】。
第二篇示例:硫酸(化学式:H2SO4)是一种无机酸,它是一种无色、无臭的油状液体,非常强酸,能与大部分金属反应生成相应的硫酸盐。
硫酸在工业生产中有着非常重要的应用,在化工、金属加工、药品制造等领域都有着广泛的用途。
硫酸的制备是化工生产中的一个重要环节,下面我们将介绍硫酸的制备方程式。
硫酸 工艺流程

硫酸工艺流程
《硫酸工艺流程》
硫酸是一种重要的化工原料,广泛应用于冶金、化工、电子、农业等行业。
其生产工艺流程包括硫磺制酸和硫酸水解两种方式。
硫磺制酸是主要的工艺流程之一。
首先硫磺经燃烧生成二氧化硫气体,然后与空气中的氧气进行催化氧化反应,生成二氧化硫。
接着将二氧化硫气体送入吸收塔中,通过与大量稀释的硫酸溶液(浓度约为98%)进行吸收而生成硫酸。
硫酸溶液再
进行蒸馏和浓缩,得到高纯度的硫酸产品。
另一种硫酸的生产方式是硫酸水解法。
通过使用金属硫化物或氧气和水反应来生产硫酸。
其中最常见的方式是用硫铁矿和水进行反应,产生硫酸和硫化氢气体。
硫酸再通过蒸馏和浓缩等工序得到高纯度的硫酸产品。
无论是硫磺制酸还是硫酸水解,都涉及了一系列的催化、吸收、分离和浓缩步骤。
因此,在硫酸的生产过程中,需要严格控制反应条件和操作参数。
同时,还需要处理废气和废水以及生产过程中产生的其他废物,防止对环境造成负面影响。
总的来说,硫酸的生产工艺流程复杂,并且需要严格的操作和控制,以确保产品质量和生产安全。
同时,环保意识也越来越受到重视,硫酸生产企业需要不断改进工艺流程,减少对环境的影响。
硫酸生产工艺流程

硫酸生产工艺流程硫酸(H2SO4)是一种重要的化工原料,广泛用于电池制造、冶金、石油化工等领域。
下面将介绍硫酸的生产工艺流程。
硫酸生产一般采用硫磺为原料,经过燃烧生成二氧化硫(SO2),然后在催化剂的作用下氧化为三氧化硫(SO3),最后与水反应生成硫酸。
硫磺燃烧:硫磺首先进入燃烧炉,在高温下与空气发生燃烧反应,生成二氧化硫、二氧化硫、一氧化硫等气体。
硫磺的燃烧需要控制温度和氧气的供给,以确保产物中二氧化硫的浓度足够高。
净化:燃烧后的烟气中含有颗粒物、氯化氢、氮氧化物等有害物质,需要通过净化来除去。
通常采用除尘装置、洗涤器、脱硫装置等对烟气进行处理,以保护环境和催化剂的效果。
氧化:经过净化后的烟气进入氧化器,其中包含着催化剂,通常是以二氧化硅为载体的铂触媒。
在催化剂的作用下,二氧化硫会与空气中的氧气发生氧化反应,生成三氧化硫。
氧化反应需要控制反应温度和氧气的供应量,以获得高的转化率。
吸收:氧化后的烟气中含有大量的三氧化硫,需要通过吸收来将其转化为硫酸。
烟气通过吸收器,其中装有反应器和吸收剂。
通常使用浓硫酸作为吸收剂,烟气中的三氧化硫会与浓硫酸发生反应生成硫酸,同时放出大量的热。
吸收反应需要控制反应温度和吸收剂的浓度,以提高反应速率和转化率。
蒸发:吸收后生成的稀硫酸需要经过蒸发浓缩,以增加其浓度。
稀硫酸首先进入换热器,在与加热的浓硫酸进行热交换的同时,稀硫酸的温度也会升高。
然后进入蒸发器,在真空下进行蒸发,水分从稀硫酸中蒸发出来,从而使硫酸的浓度逐渐升高。
冷却:经过蒸发后的浓硫酸进入冷却器,通过与冷却水进行热交换来降低其温度。
冷却后的硫酸进一步脱水,并通过进一步蒸发的方式提高其浓度。
质量控制:在硫酸生产过程中,需要对原料、产品和中间产物进行质量控制。
通过对原料进行分析和检验,确保其符合要求,并对每个生产步骤进行监测和调整,以确保产品质量和生产效率。
以上就是硫酸生产的工艺流程。
在实际生产中,可能会根据不同厂家和工艺的要求有所差异,但总体流程是相似的。
硫酸,硫酸工业制法

原料准备与处理
硫磺
01
硫磺是硫酸生产的主要原料,需经过筛选、破碎、研磨等工序,
将其细化为适合反应的颗粒大小。
燃料和氧化剂
02
生产硫酸需要燃料提供热量,同时需要氧化剂如空气或氧气参
与燃烧反应。
水
03
硫酸生产过程中需要大量的水,主要用于吸收反应生成的尾气,
同时用于设备的冷却和洗涤。
燃烧反应
燃烧室
硫磺、燃料和氧化剂在燃烧室中进行高温燃烧,生成二氧化硫气 体。
硫酸生产过程中产生的废水含有酸性物质和重金属离子,需要进行 处理后达标排放。
废渣处理
硫酸生产过程中产生的废渣含有硫铁矿和重金属离子,需要进行妥善 处理和利用。
05 硫酸工业的发展趋势与展 望
提高硫酸生产效率
优化工艺流程
通过改进工艺流程,提高设备运行效率,降低生 产过程中的能耗和物耗。
强化技术创新
产品质量
通过控制吸收反应的条件, 可以生产不同浓度的硫酸, 满足市场需求。
三废处理与环境保护
废气处理
硫酸生产过程中产生的废气需 经过除尘、脱硫等处理,以减
少对环境的污染。
废水处理
产生的废水需经过处理,去除 其中的有害物质,达到排放标 准后才能排放。
废渣处理
产生的废渣需进行妥善处理或 再利用,以减少对环境的影响 。
接触法制硫酸
接触法制硫酸的基本原理是利用硫或硫化物与空气中 的氧气反应,生成二氧化硫气体,再经过催化氧化生
成三氧化硫,最后与水反应生成硫酸。
接触法制硫酸的优点在于可以利用硫或硫化物作为原 料,同时可以利用工业尾气中的二氧化硫气体进行回
收利用。
接触法制硫酸的缺点在于需要高温高压的反应条件, 同时尾气处理难度较大。
硫酸生产工艺

的起始含量(摩尔分数),p 为反应前混合气体的总压, 若以 a,b 分别表示 SO2 和 O2 的起始含量(摩尔分数),p 为反应前混合气体的总压,以 摩尔混合气为计算基准,通过物料衡算可得到氧的平衡分压为: 1 摩尔混合气为计算基准,通过物料衡算可得到氧的平衡分压为:
将式(3- 05)代入式(3- 04)得到: 将式(3-1-05)代入式(3-1-04)得到: (3 代入式(3 得到
(3- 06)式中等式两边都有 Xe,故要用试差法来计算 Xe。 (3-1-06)式中等式两边都有 Xe,故要用试差法来计算 Xe。 压力和气体的起始度。 当炉 由(3-1-06)式知,影响平衡转化率的因素有:温度、 (3- 06)式知,影响平衡转化率的因素有:温度、 式知 压力和气体的起始度。 82%时 (3- 06)式可计算出不同压 气的起始组成 SO2 为 7.5%,O2 为 10.5%,N2 为 82%时,用(3-1-06)式可计算出不同压 Xe,结果示于表 03。 力,温度下的平衡转化率 Xe,结果示于表 3-1-03。 表 3-1-03 平衡转化率与温度和压力的关系
2. 二氧化硫催化氧化的反应机理
二氧化硫的氧化属气-固相催化氧化反应,当无催化剂时,反应活化能是 209 二氧化硫的氧化属气-固相催化氧化反应,当无催化剂时, kJ/mol,反应不易进行 在钒催化剂上反应时, 反应不易进行, 92~ kJ/mol。 kJ/mol,反应不易进行,在钒催化剂上反应时,反应活化能降至 92~96 kJ/mol。催 化氧化机理由四个步骤构成。 化氧化机理由四个步骤构成。 ①钒催化剂上存在着活性中心,氧分子吸附在它上面后,〖JG(〗O〖ZJLX,Y〗O 钒催化剂上存在着活性中心,氧分子吸附在它上面后, JG(〗 ZJLX,Y〗 ,Y 〖JG)〗键遭到破坏甚至断裂,使氧分子变为活泼的氧原子(或称原子氧),它比氧分 JG)〗键遭到破坏甚至断裂,使氧分子变为活泼的氧原子(或称原子氧),它比氧分 ), 反应。 子更易与 SO2 反应。 吸附在钒催化剂的活性中心,SO 原子受活性中心的影响被极化。 ②SO2 吸附在钒催化剂的活性中心,SO2 中的 S 原子受活性中心的影响被极化。 因此很容易与原子氧结合在一起,在催化剂表面形成络合状态的中间物种。 因此很容易与原子氧结合在一起,在催化剂表面形成络合状态的中间物种。 ③这一络合状态的中间物种,性质相当不稳定,经过内部的电子重排,生成了性 这一络合状态的中间物种,性质相当不稳定,经过内部的电子重排, 质相对稳定的吸附态物种。 质相对稳定的吸附态物种。 催化剂 催化剂 催化剂SO2O→催化剂SO3 吸附态物种) (络合状态中间物种) (吸附态物种) 络合状态中间物种) (吸附态物种
硫酸的生产工艺流程

硫酸的生产工艺流程
硫酸是一种重要的化工原料,广泛应用于冶金、化工、制药等领域。
以下是硫酸的生产工艺流程。
硫酸的生产主要有两种方法:传统的铁法和现代的湿法。
1. 铁法生产硫酸:
铁法生产硫酸的原料主要是硫矿石。
首先将硫矿石破碎成适当大小的颗粒,然后放入烧结机进行烧结,得到硫化铁矿。
硫化铁矿与空气或氧气反应生成二氧化硫。
得到的二氧化硫通过浸入浓硝酸的吸收塔中,与硝酸发生反应生成亚硝酸。
然后亚硝酸再经过氧化反应转化为硝酸。
最后,硝酸与水进行反应生成硫酸。
铁法生产硫酸的优点是反应过程简单,设备投资较低,但有一些缺点,如低效能、废气处理困难等。
2. 湿法生产硫酸:
湿法生产硫酸的原料主要是硫矿石或石膏。
首先将硫矿石或石膏破碎成适当大小的颗粒,然后与水混合,形成硫酸浆液。
硫酸浆液进入吸收塔,通过气液反应与二氧化硫接触,生成含有硫酸的颗粒。
然后,硫酸颗粒通过离心或过滤分离出来,得到纯净的硫酸液。
最后,硫酸液经过蒸馏、冷却等工艺步骤得到纯度较高的硫酸。
湿法生产硫酸的优点是硫酸纯度高,能耗较低,废气处理相对容易。
然而,湿法生产过程中也存在废水处理的问题。
无论是铁法还是湿法,硫酸生产过程中都会产生大量的废气和废水,对环境造成污染。
因此,在硫酸生产过程中,必须对废气和废水进行有效的处理,以减少对环境的影响。
总之,硫酸的生产工艺流程主要有铁法和湿法,通过硫矿石或石膏与空气、氧气或硝酸的反应,最终得到硫酸。
随着环保意识的提高,对废气、废水等污染物的处理越来越重要,将对硫酸生产工艺产生影响。
硫酸生产工艺流程

硫酸生产工艺流程
硫酸是一种重要的化工原料,广泛应用于冶金、化工、电镀、
纺织等行业。
硫酸的生产工艺流程主要包括硫磺燃烧、吸收转化和
结晶析出三个步骤。
首先,硫磺燃烧是硫酸生产的第一步。
硫磺经过破碎、熔化后,进入燃烧炉内燃烧,生成二氧化硫气体。
在燃烧过程中,需要控制
燃烧温度和通风量,以确保硫磺完全燃烧生成二氧化硫气体。
其次,吸收转化是硫酸生产的关键步骤。
二氧化硫气体通过吸
收塔,与稀硫酸或水接触,发生氧化反应生成浓硫酸。
在吸收转化
过程中,需要控制反应温度、压力和反应时间,以提高硫酸的产率
和纯度。
最后,结晶析出是硫酸生产的最后一步。
通过结晶器,浓硫酸
冷却结晶,生成硫酸结晶体。
结晶析出过程中,需要控制冷却速度
和搅拌强度,以获得均匀细小的硫酸结晶体。
总的来说,硫酸生产工艺流程是一个复杂的化学过程,需要严
格控制各个步骤的操作参数,保证硫酸的生产质量和产量。
同时,
还需要关注环保要求,合理处理废气和废水,减少对环境的影响。
除了传统的硫磺燃烧法,还有其他硫酸生产工艺,如氧气法、
氯气法等。
这些新型工艺在提高硫酸产率和减少能耗方面具有一定
优势,但也面临着技术难度和成本等挑战。
综上所述,硫酸生产工艺流程是一个综合性的工程系统,需要
从原料选取、工艺设计、设备运行等多个方面进行综合考虑和优化,以实现安全高效的硫酸生产。
希望通过不断的技术创新和工艺改进,能够提高硫酸生产的质量和效率,为相关行业的发展做出贡献。
硫酸怎么制作出来的

硫酸怎么制作出来的硫酸,在70~90年代,被称为工业之母,大多化工企业都用它来做原料,制造产品,用途广泛。
在当时的国民经济中,占有很大比重。
随着社会的快速发展,它以逐步淡出人们的视线。
仅以此文,算是对那个时代的一段回忆,及对硫酸感兴趣朋友的一点认知吧!一,硫酸生产的工艺及基本原理:原料粉碎→焙烧→净化→转化→干燥→吸收→成品。
二、工艺的主要任务和目标是:(1)将硫铁矿破碎成颗粒,作为沸腾炉的烧结原料;(2)点火焙烧,形成含硫气体;(3)去除二氧化硫气体中的杂质,称为净化;(4)二氧化硫与三氧化二铝通过转化器反应生成三氧化硫,称为转化。
(5)将气体放入干燥炉中干燥;(6)加水吸收,判定产品合格。
三,主要工序指标:烧出率≥98.5%,净化收率≥97%,转化率≥96%,吸收率≥99.95%,产酸率≥91.5%,硫利用率≥91.5%,灰渣残硫≤0.5%。
四,产品规格和标准:(1)产品规格:特种硫酸、浓硫酸、烟酸。
这是传统的浓硫酸。
(2),产品标准:硫酸含量92.5%或98%,残渣含量≤0.02%,铁含量≤0.005%,砷含量≤0.001%,透明度≥160mm,色度≤1.0毫升。
五,硫酸生产管理:硫酸作为三大酸之一,腐蚀性强,工艺复杂,化学反应裂解严重。
所以他有国家通用的和硬性的生产操作规程,生产分析规程,安全保证规程,等等。
人员必须经过培训,持证上岗,没有任何马贴的余地。
六,硫酸的主要用途:主要用作复合肥的原料,广泛应用于化工企业、特钢洗涤、皮革制造、医药工业等。
硫酸作为我国改革开放之初的重要生产资料,为国民经济做出了巨大贡献。
回忆回忆,重新认识,是我们义不容辞的责任和情怀。
他的发展、存在、衰落,必将在历史的长河中留下不可或缺的印记!如何制作硫酸硫酸,在70~90年代,被称为工业之母,大多化工企业都用它来做原料,制造产品,用途广泛。
在当时的国民经济中,占有很大比重。
随着社会的快速发展,它以逐步淡出人们的视线。
工业制硫酸

SO2
2
二 氧 化 硫 转 化 成 三 氧 化 硫
SO3
3
三 氧 化 硫 的 吸 收 和 硫 酸 的 生 成
H2SO4
1. 二氧化硫的制取和净化 高温 4FeS2(固)+11O2(气===2Fe2O3(固)+8SO2(气)+Q
原 料 粉 碎
炉气 SO2、O2、N2、水蒸气以及 一些杂质,如As、Se等的
一、接触法制造硫酸的反应原理
S
硫化物 如 FeS2
SO2
SO3
H2SO4
SO3 + H2O===H2SO4
2SO2+O2===2SO3 △ S+O2===SO2 4FeS2+11O2===2Fe2O3+8SO2
高温
点燃 催化剂
二、接触法制造硫酸的生产过程
S
硫化物 如 FeS2
1 二 氧 化 硫 的 制 取 和 净 化
工业制硫酸
引
言
硫酸是化学工业中的重要产品之一。首先硫酸大 量用于化肥和农药的生产,如每生产1吨的过磷酸钙 要消耗360公斤硫酸,化肥生产消耗占硫酸产量的50% 以上;在有机合成工业中,硫酸用于各种磺化反应和 硝化反应,生产醚、酯、有机酸、也要消耗硫酸;在 无机化学工业中,HF、H3PO4等的生产及K、Fe、Cu、 Zn、Al的硫酸盐的生产等,都要消耗硫酸;在冶金工 业中;国防工业中,如生产炸药;石油工业、染料、 人造纤维、食品、电池、搪瓷、医药、机械加工工业 等许多部门,都要用到硫酸。既然需要这么多硫酸, 那么怎样制取呢?
返回
3.三氧化硫的吸收和硫酸的生成 145 C SO3 + H2O===H2SO4+79.5kJ
硫酸制备方法

硫酸制备方法
硫酸的制备方法主要有以下几种:
1. 硫磺燃烧法:将硫磺与空气在一定的温度和压力下燃烧,生成二氧化硫,再与水反应生成硫酸。
2. 矿石燃烧法:将黄铁矿(FeS2)与空气在高温下燃烧,生成二氧化硫,
再与水反应生成硫酸。
3. 接触氧化法:将二氧化硫气体与氧气在接触氧化反应器中反应,生成三氧化硫气体,再与水反应生成硫酸。
4. 硫酸钠焙烧法:将硫酸钠(Na2SO4)与硅酸盐或铝硅酸盐在高温下焙烧,生成三氧化硫气体,再与水反应生成硫酸。
5. 浓硫酸稀释法:将浓硫酸稀释,通过稀释过程释放出热量,使稀硫酸进一步浓缩。
以上是硫酸的制备方法,不同方法所需原料和设备不同,生产成本也有所差异。
在实际生产中,根据原料供应、市场需求和生产规模等因素选择合适的方法。
总结硫酸生产工艺

总结硫酸生产工艺硫酸的重要性硫酸是一种广泛应用于工业生产和日常生活的化学品。
它是许多制造过程中不可或缺的原料,也是许多产品的主要成分。
硫酸主要用于制造化肥、冶金、石化和制药工业等领域。
因此,了解硫酸的生产工艺是非常重要的。
硫酸的生产工艺硫酸的生产工艺可以分为两种主要方法:传统浓硫酸生产工艺和湿法磷矿生产工艺。
传统浓硫酸生产工艺传统浓硫酸生产工艺是使用硫矿石(如黄铁矿)作为原料,通过燃烧生产硫化气体,再通过氧化和吸收过程,将硫化气体转化为浓硫酸。
以下是传统浓硫酸生产工艺的步骤:1.燃烧硫矿石:将硫矿石与空气或氧气混合,进行燃烧产生二氧化硫(SO2)气体和二氧化硫气体。
2.氧化过程:将产生的二氧化硫气体送入氧化器中,加入催化剂,经过一系列的反应,将二氧化硫气体转化为三氧化硫(SO3)气体。
3.吸收过程:将三氧化硫气体送入吸收器中,与浓硫酸接触,发生一系列的化学反应,逐渐生成浓硫酸。
4.脱水过程:将浓硫酸进行脱水处理,降低水分含量,制得相对纯度较高的浓硫酸。
传统浓硫酸生产工艺的优点是原料来源广泛,生产成本相对较低,但存在一些问题。
其中主要问题是二氧化硫的氧化过程需要大量催化剂的参与,催化剂的选择和使用对工艺的效率和环境影响具有重要意义;另外,与其他工艺相比,传统浓硫酸生产工艺对环境的污染比较严重。
湿法磷矿生产工艺湿法磷矿生产工艺是另一种较为常见的硫酸生产工艺。
该工艺主要用于生产磷肥,其中硫酸是重要的中间产物。
以下是该工艺的步骤:1.处理磷矿石:将磷矿石进行粉碎和浸泡处理,使其中的磷酸转化为可溶性的磷酸盐溶液。
2.磷酸盐溶液的处理:将磷酸盐溶液与硫酸反应,生成硫酸盐和磷酸盐的混合物。
其中硫酸起到催化剂的作用。
3.盐湖析出:通过蒸发磷酸盐溶液,使其饱和度增加,然后冷却沉淀析出硫酸盐和磷酸盐的结晶。
4.硫酸的分离和脱水:通过过滤和脱水处理,从硫酸盐和磷酸盐的混合物中分离出纯净的硫酸。
湿法磷矿生产工艺的优点是可以从含磷矿石中直接生产硫酸,且可以同时生产磷肥,提高资源利用率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
以硫铁矿为原料的接触法硫酸生产工艺
董子玉
1.概述
(1)硫酸的用途和产品规格
硫酸是重要的化工产品,用途十分广泛。
工业硫酸是指SQ与H20以一定比例混合而成的化
合物,分为稀硫酸(H2SQ含量65%和75%)浓硫酸(H2SO含量92.5 %和98%和发烟硫酸(游离S03 含量20%)。
(2)硫酸生产的原料
生产硫酸的原料主要有硫磺、硫铁矿、硫酸盐及含硫工业废物。
硫磺是理想原料(含硫99.5%),原料纯,流程简单、投资少、成本低。
硫铁矿是世界上大多数国家生产硫酸的主要原料。
分有普通硫铁矿、浮选硫铁矿和含
煤硫铁矿。
硫酸盐有石膏(CaSQ)芒硝(N82SQ)和明矶石[KA13(QH)6(SQ4)2]等,这些原料生产硫酸,还可生产其它产品。
含硫废物指冶金厂、石油炼制副产气及低品位燃料燃烧废气中的SQ,炼焦的焦炉气和
合成氨厂半水煤气中的HS,及金属加工的酸洗液、炼厂的废酸与废渣。
(3)硫酸生产的方法
接触法制硫酸基本反应
(1)S0 2的制取将硫铁矿焙烧,制取S02
2.二氧化硫炉气的制造
(1) 硫铁矿的预处理
块状硫铁矿和含煤硫铁矿需破碎和筛分。
大矿石破碎至35-45m m以下,再细碎,使碎粒小于3-6mm送入料仓或焙烧炉。
(2) 硫铁矿的焙烧
焙烧操作条件
a .温度焙烧温度控制在850—950r0
b .矿粒度
c .氧浓度氧浓度过高,生成的SO2在Fe2O3的催化作用下变为SO3生成的酸雾多,加重净化负荷。
焙烧设备焙烧是在焙烧炉中进行。
焙烧炉有块矿炉、机械炉、沸腾炉等几种型式,我国广泛使用沸腾炉。
(3) 炉气净化
①净化的目的和指标
工艺流程不同,净化指标有所差别,我国规定的标准(mg?m-3)如下:
水分V 100;尘V 2;砷V 5;氟V 10;酸雾:一级降雾v 35, 二级电降雾v 5。
②净化原理及设备
根据炉气中杂质的种类和特点,可用U形管除尘、旋风降尘、水洗(或酸洗)、电除尘、
干燥等净化方法逐级进行分离。
③净化流程净化流程分为湿法和干法两大类
湿法流程中,将炉气冷却,洗涤除杂,再升温(420〜440C)转化,造成了“干湿病”。
生产1吨酸排出10〜15m3的酸性污水,污染严重,国外该流程已淘汰。
此流程投资少,上马快,除砷氟效率高,我国90%的硫酸厂采用水洗流程。
干法流程短,在高温下进行,热利用率高。
无污酸、污水排出,污染少。
缺点是除As, Se, F 等杂质差,不适于含As, Se, F 多的矿料。
3.二氧化硫的催化氧化
(1) 催化氧化工艺条件
1. 最适宜温度从热力学角度SO2的氧化的平衡转化率随温度升高而降低,氧化反应宜在低温下进行。
适宜的炉气组成提高炉气中02的浓度都有利的。
02的浓度越大,SO2的转化率越大,反应速率也越快;SO2的浓度越小,生产强度降低。
SO2浓度还与催化剂用量、生产能力及总费用有关。
2. 压力SO2氧化是体积缩小的可逆的反应。
增加压力有利于SO2的转化。
常压下,转化率已达96%〜98%。
(2) 二氧化硫催化氧化的设备和流程
①转化器按换热方式不同,转化器分间接换热式和直接换热式两类。
②工艺流程
a .中间换热式四段转化流程
b .四段转化空气冷激流程
C .二转二吸流程
4.三氧化硫的吸收
将S03用硫酸吸收成产品酸;或从转化工序出来的转化气中S03含量不超过10%。
使之与水蒸气结合成硫酸蒸气,再冷凝为酸。
前者为吸收成酸,后者是冷凝成酸。
(1)吸收成酸
吸收成酸是用硫酸水溶液吸收S03 S03溶解在溶液中,与所含的水化合生成硫酸:nS03 + H28 H2S0牛(n-l)S03 + Q
当n> 1时,生成发烟硫酸;n—1时,生成无水硫酸;n v 1时生成含水硫酸。
生产中用浓度为98.3%的酸来吸收,效果最好,过低过高都会使操作恶化。
(2)冷凝成酸
冷凝成酸适用于转化气中含有水分的场合,S03与水蒸气结合成硫酸蒸气:
S03(气)+ H20气)= H2S04气)+ 125 kJ (2 —20)
温度降低,平衡常数增大,平衡向右移动,生成大量H2S04蒸气。
当H2S04勺蒸气的分压超过其饱和蒸气压,即凝成硫酸溶液:
H2S04(气)=H2S04液)+ 50.13 kJ(2 —21)
上述两个可逆反应构成一个平衡体系:
S03(气)+ H20气)===H2SO4 气)===H2SO4 液
冷凝成酸流程与吸收成酸流程相似,但两者存在不同之处。
吸收成酸为化学吸收过程,吸收剂为98.3 %浓硫酸,操作温度较低,进塔气体温度在120〜200C。
冷凝成酸是物理
过程,使用硫酸的浓度较低,操作温度较高,一般转化气体进口温度保持在220〜400C以上。
5.接触法生产硫酸的全流程
接触法流程的生产方法有多种,把不同方法的几个工序结合起来,构成不同的接触法生产硫酸全流程。
通常有水洗、酸洗和干洗三种流程。
小结
从工业原料到合格产品的工业生产涉及诸多实际问题,一方面,矿石的加工处理、炉气的净化分离等物理过程,是硫酸生产必不可少的单元操作,焙烧和转化工序的化学反应的要求决定着矿石处理和炉气净化等物理过程进行的程度;另一方面,焙烧和转化本身又都是非均相化学反应过程,其速率是由表面反应,还是由扩散来决定,需通过宏观动力学研究确定。
单元操作和宏现化学反应过程都是工业生产有别于化学实验研究而引入的新概念、新知识,要实施这些过程,选择适宜的设备、确定最佳的工艺条件、匹配合理的工艺流程则是化学工艺学研究的基本内容。
前者在后续章节要陆续深入展开,后者在本节讨论中已几次涉及。
