2021届全国新高考化学精品复习———“位—构—性”综合推断题的解题方法
5 突破全国卷热点题型5 元素“位—构—性”综合推断题的解题策略

上一页
返回导航
下一页
第5章 物质结构 元素周期律
11
4.短周期主族元素 X、Y、Z、W、N 的原子序数依次增大,X 的原子在元素周期表
中原子半径最小,Y 的次外层电子数是其电子总数的 1/4,离子化合物 ZX2 是一种储氢
材料,W 与 Y 属于同一主族,NY2 是医学上常用的水消毒剂、漂白剂。下列叙述正确
上一页
返回导航
下一页
第5章 物质结构 元素周期律
15
6.短周期主族元素 X、Y、Z、W 的原子序数依次增大。在如图所示 的物质转化关系中,p、q、m、n 分别是元素 W、X、Y、Z 的气体 单质,p 和 s 均为有色气体,v 的水溶液呈碱性。常温下, 0.1 mol·L-1t 溶液与 0.1 mol·L-1u 溶液的 pH 均为 1。下列说法不正确的是( ) A.Y、W 的最高价氧化物对应的水化物均为强酸 B.元素的非金属性:Z>Y>X,原子半径:X<Z<Y C.s 溶于水的反应中,氧化剂与还原剂的物质的量之比为 1∶2
()
上一页
返回导航
下一页
第5章 物质结构 元素周期律
8
解析:选 C。若 Y 的最简单氢化物的沸点比 M 的低,则 Y 为 C,从而推知 X 为 Al, Al 能与强碱溶液反应,A 项正确;M、Z 的简单阴离子电子层结构相同,则核电荷数 越小,半径越大,所以简单阴离子半径:M>Z;M、Z 的简单阴离子比 Y 的简单阴离 子多一个电子层,故简单阴离子半径:M>Z>Y,B 项正确;若 Y 的氢化物的水溶液呈 碱性,则 Y 为 N,从而推知 X 为 Si,SiO2 能与氢氟酸反应,C 项错误;非金属性:Z>M, 故最高价氧化物对应水化物的酸性:Z>M,D 项正确。
“位—构—性”综合推断题的解题方法
“位—构—性”综合推断题的解题方法一、依据元素原子结构推断元素利用原子结构、核外电子排布特征为元素推断的突破口,是元素推断题的重要类型之一,题目通常以文字叙述的形式给出元素原子的核外电子排布、位置关系等关键信息。
解题时可结合短周期元素的原子结构及元素的特殊性质,对元素进行合理的推断。
1.根据核外电子的排布三大规律推断元素(1)最外层电子规律(2)“阴三、阳四”规律某元素阴离子最外层电子数与次外层电子数相等,该元素位于第三周期;若为阳离子,则位于第四周期。
如S2-、K+最外层电子数与次外层电子数相等,则S位于第三周期,K位于第四周期。
(3)“阴上、阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
如O2-、F-、Na+、Mg2+、Al3+电子层结构相同,则Na、Mg、Al位于O、F的下一周期。
2.根据元素在周期表中位置,确定其化合物的化学式知道元素在周期表中的主族序数后,根据化合价规律就可以写出它的化合物的化学式,例如(用R代表元素):残缺元素周期表型推断题一般给出两种信息:一是给出局部的元素周期表,展示出几种不同元素的相对位置;二是给出某种元素的位置特征、原子结构特征或由该元素形成的单质或化合物的特殊性质。
解答此类题目时,要先根据给出的某种元素的特殊结构或性质,确定该元素在周期表中的位置,然后以此为“坐标原点”,根据其他元素与该元素的位置关系,进而确定其他未知的元素。
1.元素周期表中短周期特殊结构的应用(1)元素周期表中第一周期只有两种元素H和He,H元素所在的第ⅠA族为元素周期表的左侧边界,第ⅠA族左侧无元素分布。
(2)He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有元素分布。
利用这个关系可以确定元素所在的周期和族。
2.熟悉主族元素在周期表中的特殊位置三、依据元素及其化合物性质推断元素利用元素及其化合物特殊组成与特殊性质的元素推断题,是近几年高考的热点题型,题目一般通过文字叙述提供某些元素及其化合物的相关性质(如能腐蚀玻璃、黄绿色气体等),解题时抓住这些关键特性,首先确定其为何种元素,然后以此为突破口,推知其他未知元素。
“位、构、性”综合推断题的解法

解题篇经典题高一使用 2020年6月“ !、"、##$%& 断()* +■广东省深圳市第二高级中学 王 燕元素周期表与元素周期律是学习化学的 一种重要工具,是近年全国卷选择题必考问题之一。
一般以元素推断的形式呈现,重点考查元素周期表、元素周期律、原子结构、原 子半径大小的比较、元素的性质等相关知识!整体来看,考点比较集中,需要考生能够从提 供的信息中准确提取相关内容,并与已有元素化合物知识整合,解决相关问题,是知识融合的经典题型。
四、分类解析1.依据元素周期表的“片段结构”推断兀^素。
! !下表是元素周期表的一部分,w、X 、Y 、Z 为短周期主族元素,W 与X 的最高化合价之和为8。
下列说法错误的是( )WX Y Z、‘'位、构、性’的关系核电荷数 电子 :结构结构决定位置位置反映结构丨位置氐最外层电子数互相+断性质反映结构结构决定性得失电子能力(氧化性,还原性) 金属性、非金属性最高价氧化物对应水化物的酸、碱性K 化物的LMQ 性二、周期表中主族元素性质递变规律(1)周期表右上角,即同一周期从左到右,同一主族从下到上,有5种关系逐渐增加。
(2)周期表左下角,即同一周期从右到A. 原子半径:W V XB. 常温常压下,Y 单质为固态C. 气态氢化物热稳定性:Z V WD. X 的最高价氧化物的水化物是强碱 解析:第一步:挖掘题干信息。
厂-H 信息1]—W 、X 、Y 、Z 为短周期主族元素挖掘题干信息一元素相对位置 I I x| Y I Z H信息3]w 与X 的最高化合价之和为8第二步:确定元素。
左,同一主族从上到下,有4种关系逐渐增加。
其关系大致如下所示:W(N )X(A1)Y(Si)Z(P )元素非金属性、单质氣化性、得电子能力、氢化物的稳定性、最髙价氧 物对应水化物的;酸性元素金属性、单履还原性、夷电子能力、最高价氧化物对应水化物的碱性三、解题思路图表觀,讎元飆期表戕躺元素文字能,舲巌及其胎躺齟 推断元素翳启羸臨肝翳特讎航素判瑯頑懈,龊各元素在元隸 期耕的超騎同腳、同主航黜鮫规亀分祈黜髒第三步:分析判断,结合元素性质以及元素周期表、周期律,分析选项,得出答案。
“位—构—性”关系的综合推断

“位—构—性”关系的综合推断利用“位—构—性”关系综合考查元素周期律是高考的热点题型,通常以原子核外电子排布、元素周期表的片段、短周期元素的结构特点、元素化合物的性质进行元素推断,然后考查粒子半径大小比较、元素金属性和非金属性强弱、化学键类型的判断、物质性质判断等。
解答元素推断题,不仅要求学生掌握必要的知识,还要求学生有一定的逻辑推理能力,其解题流程如右。
一、解题必备智能1.元素“位—构—性”三者之间的关系2.推断元素的基本思路3.高考考查的角度及判断分析依据4.元素及其化合物的性质在推断中的作用(1)性质与位置互推是解题的关键熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:①元素的金属性、非金属性;②气态氢化物的稳定性;③最高价氧化物对应水化物的酸碱性;④金属与水或酸反应置换H2的难易程度。
(2)性质和结构的互推是解题的要素①电子层数和最外层电子数决定元素原子的金属性和非金属性;②同主族元素最外层电子数相同,化学性质相似;③正确推断原子半径和离子半径的大小及结构特点;④判断元素金属性和非金属性的强弱。
二、突破常考题型类型一依据原子结构特点推断元素[典例1](2019·全国卷Ⅲ)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。
X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。
下列叙述正确的是()A.熔点:X的氧化物比Y的氧化物高B.热稳定性:X的氢化物大于Z的氢化物C.X与Z可形成离子化合物ZXD.Y的单质与Z的单质均能溶于浓硝酸[思维建模]第一步:挖掘题干信息,确定元素名称与位置第二步:根据元素周期表、周期律判断递变规律[解题方略]1.核外电子排布三大规律(1)最外层电子规律某元素阴离子最外层电子数与次外层相同,该元素位于第三周期;若为阳离子,则位于第四周期。
(3)“阴上、阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
高考化学推断题解题思路整理

高考化学推断题解题思路整理2021年高考化学推断题包括实验推断题、无机物推断题和无机物推断题,它对考生的思想才干和知识网络结构提出了较高的要求,即要求考生有较深沉的化学功底,知识网络明晰,对化学的一切知识点(如元素、化合物的性质)了如指掌。
明天查字典化学网的小编给大家整理了高中化学推断题解题思绪,希望对考生有所协助。
想了解其他最新的资讯,小编会在第一时间通知大家,请大家继续关注查字典化学网。
【高考化学】推断题解题思绪1.猜想出题者的意图。
化学这一门的知识点比拟多,而高考试卷又不能够把一切的内容都涵盖,所以出题者要考察的也就是那些重点的内容,即一些经常碰面的元素,比如氮、硫、碳,重要的基本的化合物二氧化硫、氧化铁、硫铁矿等,以及和我们的生活比拟相关的,比如氧气、氯气、铁之类等。
因此在做推断题时大体的思索范围就要有个界限,不能漫无目的乱想。
2.找打破口。
题干越长,给的分支越多,往往标题就越复杂。
由于题干越长,分支越多,也就是给的信息越多,越容易找到打破口。
普通的打破口就是一些元素的特性,比如能腐蚀玻璃的单质,自然就知道是氟了;恢复性最强的离子,就是硫离子了等等。
找到一两个打破口,所要解的结也就很容易解开了。
3.假设真实找不到打破口,在大致范围确定的状况下,大可猜上一把。
由于大致的范围确定了,就可以依据标题给的条件猜出几个能够的、罕见的、常用的元素或是化合物,再用扫除法找到答案。
4.找到打破口停止联想:推断题首先要抓住打破口,表现物质特征处大都是打破口所在,所以考生在掌握化学知识概念点上,要留意总结它的特征。
在推断题的题干中及推断表示图中,都明示或隐含着种种信息。
每种物质都有其共同的化学性质,如物质属单质还是化合物,物质的颜色如何,是固体、液体还是气体,有怎样的反响条件,反响进程中有何现象,在生活中有何运用等,同时还要留意表述物质的限制词,如最大(小)、仅有的等。
考生看到这些信息时,应积极联想教材中的相关知识,停止假定重演,一旦在某一环节出错,便可停止另一种想象。
高中化学专题讲座 “位-构-性”综合推断题的解题方法(精练)-2022年一轮复习讲练测(原卷版)
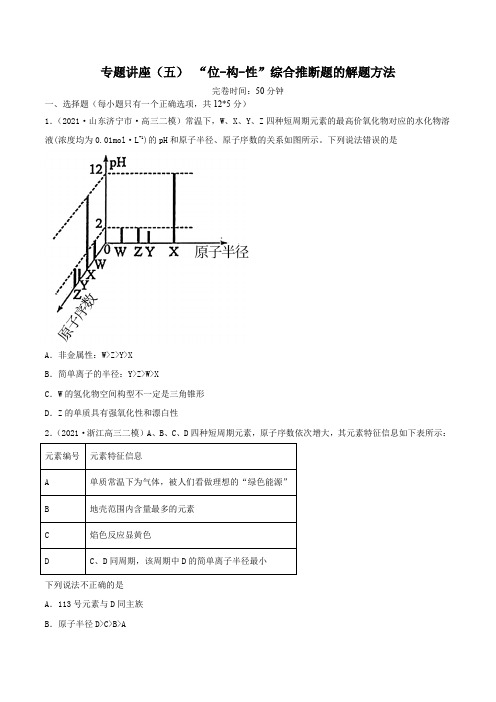
专题讲座(五)“位-构-性”综合推断题的解题方法完卷时间:50分钟一、选择题(每小题只有一个正确选项,共12*5分)1.(2021·山东济宁市·高三二模)常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol·L-1)的pH和原子半径、原子序数的关系如图所示。
下列说法错误的是A.非金属性:W>Z>Y>XB.简单离子的半径:Y>Z>W>XC.W的氢化物空间构型不一定是三角锥形D.Z的单质具有强氧化性和漂白性2.(2021·浙江高三二模)A、B、C、D四种短周期元素,原子序数依次增大,其元素特征信息如下表所示:下列说法不正确的是A.113号元素与D同主族B.原子半径D>C>B>AC .C 单质与水反应所得的强碱性溶液中含有两种电子数相同的阴、阳离子D .C 、D 的最高价氧化物水化物之间能发生反应,生成一种正四面体构型的离子3.(2021·浙江高三三模)如图,X 、Y 、Z 、W 四种短周期元素的原子最外层电子数之和为21。
下列说法正确的是A .原子半径(r ):r(Z)r(Y)r(X)>>B .X 的氢化物一定比Y 的氢化物的沸点要低C .2WY 、4WZ 、WX 均有熔点高、硬度大的特性D .某病毒DNA 链中有T 元素,可能是T 取代了普通DNA 链中的P 元素4.(2021·吉林松原市·高三其他模拟)短周期主族元素W 、X 、Y 、Z 的原子序数逐渐增大,四种元素形成的化合物结构如图所示。
在元素周期表中元素W 是原子半径最小的元素,Z 原子的最外层电子数是周期数的3倍,且W 与X 、Y 、Z 均可形成电子数相等的分子。
下列说法正确的是A .简单气态氢化物稳定性:Z <XB .由W 、Y 、Z 三种元素组成的化合物均是共价化合物C .YF 3分子中的原子均是稳定的8电子结构D .X 元素的最高价氧化物对应的水化物为强酸5.(2021·浙江金华市·高三二模)X 、Y 、Z 、M 、Q 五种短周期主族元素,原子序数依次增大。
2021届高三化学一轮复习 “位——构——型”综合推断题的解题方法(知识梳理与训练)

2021届高三化学一轮复习“位——构——型”综合推断题的解题方法(知识梳理与训练)知识梳理1.结构与位置互推是解题的核心(1)掌握四个关系式:①电子层数=周期数;②质子数=原子序数;③最外层电子数=主族序数;④主族元素的最高正价=主族序数(O、F除外),最低负价=主族序数-8。
(2)熟练掌握周期表的结构及周期表中的一些特殊规律:①“凹”型结构的“三短四长,七主七副八零完”;②各周期元素种类;③稀有气体的原子序数及在周期表中的位置;④同主族上下相邻元素原子序数的关系。
2.性质与位置互推是解题的关键熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:(1)元素的金属性、非金属性;(2)气态氢化物的稳定性;(3)最高价氧化物对应水化物的酸碱性;(4)金属与水或酸反应置换H2的难易程度。
3.结构和性质的互推是解题的要素(1)电子层数和最外层电子数决定元素原子的金属性和非金属性;(2)同主族元素最外层电子数相同,化学性质相似;(3)正确推断原子半径和离子半径的大小及结构特点;(4)判断元素金属性和非金属性的强弱。
4.熟记常见题眼,是解题的“突破口”(1)微粒的电子层结构特征稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同:①与He原子电子层结构相同的离子有H-、Li+、Be2+;②与Ne原子电子层结构相同的离子有F-、O2-、Na+、Mg2+、Al3+等;③与Ar 原子电子层结构相同的离子有Cl-、S2-、K+、Ca2+等。
(2)周期表中特殊位置的常见元素①族序数等于周期数的元素:H、Be、Al、Ge等。
②族序数等于周期数2倍的元素:C、S。
③族序数等于周期数3倍的元素:O。
④周期数是族序数2倍的元素:Li、Ca等。
⑤周期数是族序数3倍的元素:Na、Ba。
⑥最高正价与最低负价代数和为零的短周期元素:C等。
⑦最高正价是最低负价绝对值3倍的短周期元素:S。
5 突破全国卷热点题型5 元素“位—构—性”综合推断题的解题策略

突破全国卷热点题型5元素“位—构—性”综合推断题的解题策略[热点精讲]1.建立“位—构—性”关系模型2.结构与位置互推是解题的核心(1)掌握四个关系式:①电子层数=周期序数;②质子数=原子序数;③最外层电子数=主族序数;④主族元素的最高正价=主族序数(O、F除外),最低负价=主族序数-8。
(2)熟练掌握周期表的结构及周期表中的一些特殊规律:①“凹”型结构的“三短四长七刚满,七主七副八零完”;②各周期元素种数;③稀有气体的原子序数及在周期表中的位置;④同主族上下相邻元素原子序数的关系。
3.性质与位置互推是解题的关键熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:(1)元素的金属性、非金属性;(2)气态氢化物的稳定性;(3)最高价氧化物对应水化物的酸碱性;(4)金属与水或酸反应置换H2的难易程度。
4.结构和性质的互推是解题的要素(1)电子层数和最外层电子数决定元素原子的金属性和非金属性;(2)同主族元素最外层电子数相同,化学性质相似;(3)正确推断原子半径和离子半径的大小及结构特点;(4)判断元素金属性和非金属性的强弱。
5.元素推断题中常用到的推断依据(1)气态氢化物的水溶液呈碱性或气态氢化物能与其最高价氧化物对应的水化物发生化合反应的元素:N。
(2)最活泼的非金属元素或无正化合价的主族元素或无氧酸可腐蚀玻璃的元素或简单气态氢化物最稳定的元素或简单阴离子的还原性最弱的元素:F。
(3)焰色反应呈黄色的元素:Na;焰色反应呈紫色(透过蓝色钴玻璃观察)的元素:K。
(4)地壳中含量最多的金属元素:Al。
(5)元素的简单氢化物和其最高价氧化物对应的水化物能发生氧化还原反应,或元素的简单氢化物能和其氧化物在常温下反应生成该元素对应的单质,该元素是S。
(6)单质为黄绿色气体的元素:Cl。
(7)可组成红棕色有刺激性气味气体的两种元素:O、N。
[热点精练]精练一依据结构特点或在元素周期表中的位置推断1.(2020·武汉调研)W、X、Y和Z为原子序数依次增大的四种短周期主族元素。
专题讲座 “位-构-性”综合推断题的解题方法(练)高考化学一轮复习讲练测(全国通用)(解析版)

专题讲座(五)“位-构-性”综合推断题的解题方法第一部分:高考真题感悟1.(2022·海南·高考真题)短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y 是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是XW是非极性分子A.3B.简单氢化物沸点:X>YC.Y与Z形成的化合物是离子化合物D.X、Y、Z三种元素组成的化合物水溶液呈酸性【答案】C【解析】X、Y、Z、W为原子序数依次增大的短周期主族元素,X、Y同周期并相邻,且Y是组成水的元素之一,则Y为O元素,X为N元素,Z在同周期主族元素中金属性最强,则Z为Na元素,W原子在同周期主族元素中原子半径最小,则W为Cl元素。
A.由分析,X为N元素,W为Cl元素,NCl3分子的空间构型为三角锥形,其正负电荷的中心不重合,属于极性分子,A错误;B.H2O和NH3均含有氢键,但H2O分子形成的氢键更多,故沸点H2O>NH3,B错误;C.Y为O元素,Z为Na元素,两者形成的化合物为Na2O、Na2O2均为离子化合物,C正确;D.N、O、Na三种元素组成的化合物NaNO3呈中性、NaNO2呈碱性,D错误;答案选C。
2.(2022·浙江·高考真题)X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。
X的核外电子数YX分子呈三角锥形,Z的核外电子数等于X、Y核外电子数之和。
M与X同主族,Q是等于其周期数,3同周期中非金属性最强的元素。
下列说法正确的是A.X与Z形成的10电子微粒有2种B.Z与Q形成的一种化合物可用于饮用水的消毒M Z与MQ的晶体类型不同C.2D.由X、Y、Z三种元素组成的化合物的水溶液均显酸性【答案】B【解析】X的核外电子数等于其周期数,X为H,YX3分子呈三角锥形,Y为N,Z的核外电子数等于X、Y核外电子数之和,则Z为O,M与X同主族,则M为Na,Q是同周期中非金属性最强的元素,则Q为Cl,综合分析,X为H,Y为N,Z为O,M为Na,Q为Cl。
2021届高考化学素养提升全突破08 “位—构—性”之间的关系及推断(原卷版)

专题08 “位—构—性”之间的关系及推断——以宏观与微观相结合的视角解决问题元素推断题是高考的热点题型,命题的落点是借助元素周期表的片段,(某一部分)推断元素,然后利用“位—构—性”关系综合考查元素及化合物性质和化学反应原理相关内容。
能力要求是能从不同层次认识物质的多样性,并对物质进行分类;能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念;能从宏观和微观相结合的视角分析和解决实际问题。
1.【2019新课标Ⅰ卷】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。
下列叙述正确的是A.WZ的水溶液呈碱性B.元素非金属性的顺序为X>Y>ZC.Y的最高价氧化物的水化物是中强酸D.该新化合物中Y不满足8电子稳定结构2.【2019新课标Ⅲ卷】X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和我10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。
下列叙述正确的是A.熔点:X的氧化物比Y的氧化物高B.热稳定性:X的氢化物大于Z的氢化物C.X与Z可形成离子化合物ZXD.Y的单质与Z的单质均能溶于浓硫酸1、同一元素“位—构—性”之间的关系2、元素推断类题目的基本特点实际考查中只呈现元素周期表的某一片段,根据呈现的片段结构中提供的信息推断元素,推出元素在周期表中的位置,就可以快速确定元素的名称、原子结构及相关性质。
3、解题基本思路4、命题角度(1)与元素周期表的具体结构相结合考查考查的角度通常有:由位置推断结构性质;由结构确定位置,推断性质;由性质、用途推断位置和结构。
这类题型属于高考高频考点,体现了对“宏观辨识与微观探析”的化学学科核心素养的考查。
【典例1】【2019新课标Ⅱ卷】今年是门捷列夫发现元素周期律150周年。
下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。
元素“位—构—性”的综合推断(解析版)

元素“位-构-性”的综合推断一、元素综合推断的具体方法这类题目往往将元素化合物知识、物质结构理论、化学基本理论等知识串联起来,综合性较强,解题的关键是正确推断元素。
具体方法:阅读题目(建立印象)→根据题设特点(短周期元素原子结构特征,元素主要化合价的特征关系,元素及化合物的特殊性质,元素在周期表中的特殊位置等)→找出突破口→假设→验证。
如:已知X、Y、Z、W 四种短周期元素的位置关系如图:则可以推出X为He,再依次推知Y为F、Z为O、W为P。
二、主要考点1.原子或离子半径大小,第一电离能、电负性大小比较2.元素在周期表中的位置3.气态氢化物的稳定性4.元素金属性或非金属性5.元素最高价氧化物对应水化物的酸碱性6.元素间组成化合物的种类及性质7.化学键三、元素金属性、非金属性强弱的比较方法1.元素金属性强弱的实验比较法。
(1)单质与水或非氧化性酸反应越剧烈,金属性越强。
(2)单质还原性越强或离子氧化性越弱,金属性越强。
(3)最高价氧化物对应水化物的碱性越强,金属性越强。
(4)若X n++Y-→X+Y m+,则Y金属性比X强。
2.元素非金属性强弱的实验比较法。
(1)与H2化合越容易,气态氢化物越稳定,非金属性越强。
(2)单质氧化性越强,阴离子还原性越弱,非金属性越强。
(3)最高价氧化物对应水化物的酸性越强,非金属性越强。
(4)A n-+B-→B m-+A,则B非金属性比A强。
3.元素性质递变规律(1)同周期,从左到右,主族元素的金属性减弱,非金属性增强。
(2)同主族,从上到下,元素的金属性增强,非金属性减弱。
四、“四看”突破粒子半径大小比较1.“一看”电子层数:当最外层电子数相同,电子层数不同时,电子层数越多,半径越大。
4.“二看”原子序数:当核外电子数相同时,原子序数越大,离子半径越小。
2.“三看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。
3.“四看”核外电子数:对于同元素,当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
【化学】巧思妙解“位—构—性”综合推断题

【化学】巧思妙解“位—构—性”综合推断题元素推断题主要考查元素周期表中“位—构—性”三者之间的关系及利用物质结构和性质进行综合推断的能力,题目综合性较强,难度较大,所占分值较高。
而掌握短周期元素的结构特点、在元素周期表中的位置及其重要化合物的性质,是解决元素综合推断题的有效方法。
一、元素综合推断题求解的一般思路解答元素推断题的一般思路:图中,左侧为题目直接或间接给出的信息,中间为推断出的信息,右侧为推断结果。
二、有关综合推断的必备知识与题型分析题型1 由主族元素在周期表中的位置推断【破题策略】1.牢记元素周期表的结构(能区分长短周期、主副族、每周期的元素数目等)是求解的基础,一定要做到“心中有表”。
2.熟悉主族元素在元素周期表中的特殊位置和数据特征,具体请参照重点全解专题一和专题二的内容。
【调研1】短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,A与C在周期表中的位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是A.A与C可形成共价化合物B.A的氢化物的稳定性大于C的氢化物的稳定性C.原子半径A<B<CD.B的氧化物的熔点比A的最高价氧化物的熔点高【解析】A与C在元素周期表中的位置上下相邻,则A、C同主族,且A在第2周期,B原子最外层电子数等于A原子次外层电子数,所以B为镁;据A、B、C三原子的最外层电子数之和为1 0,推出A 为碳,C为硅,A与C可形成共价化合物Si C,CH4的稳定性大于SiH4的,MgO为离子晶体,A(碳)的最高价氧化物CO2为分子晶体,原子半径B>C>A。
答案:C题型2 由元素及其化合物的性质推断【破题策略】掌握常见元素及其化合物的特性是关键,解决这一关键在于平时的积累,要熟记《考试大纲》要求的元素及其化合物性质方面的典型特征。
比如(1)形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C。
高三化学一轮复习【“位—构—性”综合推断题的解题方法】

(2)性质与位置互推是解题的关键 熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:① 元素的金属性、非金属性;②气态氢化物的稳定性;③最高价氧化物对 应水化物的酸碱性;④金属与水或酸反应置换H2的难易程度。 (3)结构和性质互推是解题的要素 ①电子层数和最外层电子数决定元素的金属性和非金属性;②同主族元 素最外层电子数相同,化学性质相似;③正确推断原子半径和离子半径 的大小及结构特点;④判断元素金属性和非金属性的强弱。
B.元素的非金属性:Z>Y>X
√C.化合物XZ2中所有原子均满足8电子稳定结构
D.X、Z的单质分别直接与Y的单质反应,都能生成两种氧化物
1234 5678
解析 0.05 mol·L-1丙溶液的pH为1,可知丙为二元强酸,应为H2SO4, K是无色气体,是主要的大气污染物之一,且可生成H2SO4,则应为SO2, 可知乙为O2,L为H2O,甲是常见的固体,可知甲为C,M为CO2,则W 为H元素,X为C元素,Y为O元素,Z为S元素,以此解答该题。同周期
1234 5678
Y是O元素,Z是Na元素,O2-、Na+核外电子排 布都是2、8,电子排布相同,核电荷数越大,离 子半径就越小,所以离子半径:Z<Y,B错误; O、Na两种元素可形成两种离子化合物:Na2O、 Na2O2,C正确; 元素的非金属性越强,其简单氢化物的稳定性就越强,X是C元素,Y是 O元素,由于元素的非金属性:C<O,所以氢化物的热稳定性:CH4< H2O,D正确。
1.同一元素的“位—构—性”关系
2.元素推断类题目的基本特点
3.推断题要点总结 (1)结构与位置互推是解题的核心 ①掌握四个关系式:a.电子层数=周期数;b.质子数=原子序数;c.最外 层电子数=主族序数;d.主族元素的最高正价=主族序数(O、F除外), 负价=主族序数-8。 ②熟练掌握周期表的结构及周期表中的一些特殊规律 a.“凹”型结构的“三短四长,七主七副八零完”;b.各周期元素种类; c.稀有气体的原子序数及在周期表中的位置;d.同主族上下相邻元素原 子序数的关系。
高考化学复习——“位、构、性”关系的考查

高考化学复习——“位、构、性”关系的考查这类题目往往将元素化合物知识、物质结构理论、化学基本理论等知识串联起来,综合性较强,难度较大,解题的关键是正确推断元素,常用的主要方法有:1.原子或离子结构示意图。
2.元素主要化合价的特征关系。
3.原子半径的递变规律。
4.元素周期表中短周期的特殊结构。
如:①元素周期表中第一周期只有两种元素H和He,H元素所在的第ⅠA族左侧无元素分布;②He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有元素分布。
利用这个关系可以确定元素所在的周期和族。
如:已知X、Y、Z、W四种短周期元素的位置关系如图:5.部分元素及其化合物的特性(1)形成化合物种类最多的元素或对应单质是自然界中硬度最大的物质的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素或简单氢化物在通常情况下呈液态的元素:O。
(4)地壳中含量最多的金属元素:Al。
(5)最活泼的非金属元素或无正化合价的元素或无含氧酸的非金属元素或无氧酸可腐蚀玻璃的元素或气态氢化物最稳定的元素或阴离子的还原性最弱的元素:F。
(6)最活泼的金属元素或最高价氧化物对应水化物的碱性最强的元素或阳离子的氧化性最弱的元素:Cs。
(7)焰色反应呈黄色的元素:Na。
焰色反应呈紫色(透过蓝色钴玻璃观察)的元素:K。
(8)单质密度最小的元素:H。
单质密度最小的金属元素:Li。
(9)常温下单质呈液态的非金属元素:Br。
常温下单质呈液态的金属元素:Hg。
(10)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(11)元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素:N。
元素的气态氢化物和它的最高价氧化物对应的水化物能发生氧化还原反应的元素:S。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.根据核外电子的排布三大规律推断元素 (1)最外层电子规律
3.根据元素在周期表中位置,确定其化合物的化学式 知道元素在周期表中的主族序数后,根据化合价规律就可以写出它的化合物 的化学式,例如(用R代表元素):
氢化物 最高价氧化物 最高价含氧酸
ⅣA RH4 RO2 H4RO4或H2RO3
ⅤA RH3 R2O5 H3RO4或HRO3
ⅥA ⅦA
H2R RO3 H2RO4
HR R2O7 HRO4
二、依据元素周期表结构推断元素 残缺元素周期表型推断题一般给出两种信息:一是给出局部的元素周期表, 展示出几种不同元素的相对位置;二是给出某种元素的位置特征、原子结 构特征或由该元素形成的单质或化合物的特殊性质。解答此类题目时,要 先根据给出的某种元素的特殊结构或性质,确定该元素在周期表中的位置, 然后以此为“坐标原点”,根据其他元素与该元素的位置关系,进而确定 其他未知的元素。
解析 在短周期元素中,W原子的质子数是其最外层电子数的三倍,则W是15 号的P元素,根据元素在周期表中的相对位置关系可确定:X是N元素,Y是O 元素;Z是Si元素。
1234 56789
2.短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子 的最外层电子数之和为21。下列关系正确的是
1.元素周期表中短周期特殊结构的应用 (1)元素周期表中第1周期只有两种元素H和He,H元素所在的第ⅠA族为 元素周期表的左侧边界,第ⅠA族左侧无元素分布。 (2)He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有 元素分布。 利用这个关系可以确定元素所在的周期和族。
2.熟悉主族元素在周期表中的特殊位置
WX
Y
Z
A.氢化物沸点:W<Z
B.氧化物对应水化物的酸性:Y>W
C.化合物熔点:Y2X3<YZ3
√D.简单离子的半径:Y<X
1234 56789
解析 设W原子的最外层电子数为x,由图表可知,四种元素原子的最外层电 子数之和=x+x+1+x-2+x+2=21,解得x=5,则W为N元素、X为O元素、 Y为Al元素、Z为Cl元素。NH3分子间有氢键,其沸点比HCl高,故A错误; Al(OH)3显两性,N元素的氧化物对应的水化物HNO3、HNO2均显酸性,故B 错误; Al2O3是离子晶体,熔点高,而AlCl3是分子晶体,熔点低,故C错误; Al3+和O2-结构相同,核电荷数大,离子半径小,故D正确。
题组一 结构特点与元素在周期表中的位置相结合推断
1.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原 子的质子数是其最外层电子数的三倍,下列说法不正确的是
√A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z C.最简单气态氢化物的热稳定性:Y>X>W>Z D.元素X、Z、W的最高化合价分别与其主族序数相等
族序数等于周期数的元素 族序数等于周期数2倍的元素 族序数等于周期数3倍的元素 周期数是族序数2倍的元素 周期数是族序数3倍的元素 最高正价与最低负价代数和为零的短周期元素 最高正价是最低负价绝对值3倍的短周期元素 除H外,原子半径最小的元素
H、Be、Al C、S O Li、Ca
Na、Ba H、C、Si
K
单质密度最小的元素
H
单质密度最小的金属元素
Li
常温下单质呈液态的非金属元素
Br
常温下单质呈液态的金属元素
Hg
最高价氧化物及其水化物既能与强酸反应,又能与强碱反应 Al
的元素
元素的气态氢化物和它的最高价氧化物对应水化物发生氧化 S
还原反应的元素
常见的一种元素存在几种单质的元素
C、P、O、S
专题精练
2.依据“等电子”微粒 (1)寻找“10电子”微粒和“18电子”微粒的方法 ①“10电子”微粒
②“18电子”微粒
CH3—CH3、H2N—NH2、HO—OH、F—F、F—CH3、CH3—OH……
(2)记忆其他等电子微粒 ①“14电子”微粒:Si、N2、CO、C2H2、C22- 。 ②“16电子”微粒:S、O2、C2H4、HCHO。 (3)质子数和核外电子数分别相等的两种微粒关系 ①可以是两种原子,如同位素原子。 ②可以是两种分子,如CH4、NH3等。 ③可以是两种带电荷数相同的阳离子,如 NH+ 4 、H3O+。 ④可以是两种带电荷数相同的阴离子,如OH-、F-。
S F
三、依据元素及其化合物性质推断元素 利用元素及其化合物特殊组成与特殊性质推断题,是近几年高考的热点题型, 题目一般通过文字叙述提供某些元素及其化合物的相关性质(如能腐蚀玻璃、 黄绿色气体等),解题时抓住这些关键特性,首先确定其为何种元素,然后以 此为突破口,推知其他未知元素。
物质特性 形成化合物种类最多的元素或单质是自然界中硬度最大的物质 的元素或气态氢化物中氢的质量分数最大的元素
最外层电子数(N) 3≤N<8
N=1或2
N>次外层电子数
元素在周期表中 的位置
Байду номын сангаас
ⅢA族~ ⅦA族
第ⅠA族、第ⅡA族、 第2周期(Li、Be)
第Ⅷ族、副族、0族 除外
元素氦
(2)“阴三、阳四”规律 某元素阴离子最外层电子数与次外层电子数相等,该元素位于第3周期; 若为阳离子,则位于第4周期。如S2-、K+最外层电子数与次外层电子数相 等,则S位于第3周期,K位于第4周期。 (3)“阴上、阳下”规律 电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳 离子位于阴离子的下一周期。如O2-、F-、Na+、Mg2+、Al3+电子层结构 相同,则Na、Mg、Al位于O、F的下一周期。
空气中含量最多的元素或氢化物的水溶液呈碱性的元素 地壳中含量最多的元素或氢化物的沸点最高的元素或氢化物在 通常情况下呈液态的元素
推断元素 C N O
最活泼的金属元素或最高价氧化物对应水化物碱性最强的元素或 Cs
阳离子的氧化性最弱的元素
单质最易着火的非金属元素
P
焰色反应呈黄色的元素
Na
焰色反应呈紫色(透过蓝色钴玻璃观察)的元素
