重金属钋化物分子MPo( 2Ⅱ),(M=Cu,Ag,Au)的结构和势能函数
高一化学金属化合物知识点

高一化学金属化合物知识点金属化合物是由金属元素和非金属元素通过化学键相互结合而成的化合物。
在高一化学学习中,金属化合物是一个重要的知识点。
本文将从金属离子、非金属离子和金属化合物的命名与计算公式等方面进行论述。
一、金属离子金属元素的原子能够通过失去一个或多个电子形成阳离子,这些阳离子即为金属离子。
金属离子由于失去了电子,具有正电荷。
金属离子一般以元素符号加电荷形式表示,例如Fe2+表示二价亚铁离子,Cu2+表示二价铜离子。
二、非金属离子非金属元素的原子具有较强的电子亲和力,能够通过获得一个或多个电子形成阴离子,这些阴离子即为非金属离子。
非金属离子由于获得了电子,具有负电荷。
非金属离子一般以元素符号减电荷形式表示,例如Cl-表示氯离子,O2-表示氧离子。
三、金属化合物的名称根据金属离子和非金属离子的数量以及它们之间的化学键情况,可以确定金属化合物的名称。
1. 二元金属化合物当一个金属离子和一个非金属离子结合时,称为二元金属化合物。
命名二元金属化合物时,一般先写金属离子的名称,再写非金属离子的名称,并在非金属离子的名称后面加上-化或-化物。
例如:NaCl - 氯化钠MgO - 氧化镁2. 多元金属化合物当一个金属离子和两个或多个非金属离子结合时,称为多元金属化合物。
命名多元金属化合物时,一般先写金属离子的名称,再写第一个非金属离子的名称,接着写第二个非金属离子的名称,并在最后一个非金属离子的名称后面加上-化或-化物。
例如:Fe(NO3)3 - 硝酸铁(III)CuSO4 - 硫酸铜(II)四、金属化合物的计算公式给定金属离子和非金属离子的名称,我们可以根据化合物的电中性来确定金属化合物的计算公式。
1. 电中性原则金属离子的电荷数乘以金属离子的个数应等于非金属离子的电荷数乘以非金属离子的个数。
根据这个原则,我们可以通过化学式的交换和平衡来写出金属化合物的计算公式。
例如:氯化钠的化学式为NaCl,其中钠离子的电荷数为+1,氯离子的电荷数为-1,符合电中性原则。
高二化学选修二知识点笔记

高二化学选修二知识点笔记1.分子键和晶体结构:-原子价电子:元素在化合物中只能使用最外层的电子进行化学键的形成,这些外层电子称为原子的价电子。
-分子键:共用电子对的形成使原子之间的核吸引力相互重叠,从而形成一种相对稳定的数种以原子核为中心的化合物,这种化合物称为分子化合物。
原子间通过共用电子对连接的力称为分子键。
-价电子对斥力:当两个原子间的原子间距减小时,由于两个原子价电子对间的排斥作用增大,进而产生一种能量最低的原子间距。
-偏离度:分子共有原子间距可计作偏离度,记作`D(m)`,`m`为数值,但属似`10^(−10)~10^(−11)m`。
-簇(原子团)/分子/离子晶体:离子晶体是由阳离子或阴离子通过离子键而成的晶体;簇(原子团)是由原子间的化学键而形成的团簇;分子晶体是由分子间为主要组成的晶体;金属晶体是由金属原子间的金属键而成的晶体。
-结构化模型:结构化模型是将晶体中的质子模型化为相邻原子核连接在一起的图形模型。
-原子核直径:通常假设原子核直径为原子中心距离的`1/10`或`1/3.3`。
-材料的韧性:大分子吸声材料多为粘性固体。
高温粘附分子分子的数目减少,分解进一步进行,挥发分子从内部水分子分子沿溶液表面排出,后形成分子的韧性或形成的团簇。
2.分子的立体结构和立体化学-光学异构体:分子中进行1构异析出的引力力计作相应的发弱力,即增加了空间角负荷-配位数、轨道和烯的立体构象:轨道同样也会引发分子构造的改变。
-立体结构的描述、回旋址进程-推导出带有向能性的几何图形-从立体构造沿着声成摇摆转化为从单光子到多光子,饱和振动子为平面介质林区波传递的弯曲能量迁移。
3.晶体的物理性质-晶体分子键的显著特征:用固体急液体。
在固体中,晶体的分子键具有规律和亲和性。
分子键固定在立体晶格中,具有正常结构。
-晶体的热启动性:晶体具有特定的热启动性,当温度达到其中一阈值时,分子键能量低于分子间的位移能量,使晶体分子摆脱平衡位置而变为固过。
高一化学必修一第三章知识点总结归纳

高一化学必修一第三章学问点总结归纳其实,不是化学太难,而是你的(学习(方法))出现了严峻的问题。
只要方法得当,你完全可以很快告辞“差生”!今日在这给大家整理了(高一化学)必修一第三章,接下来随着一起来看看吧!高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻挡内部金属接着被氧化。
镁在空气中燃烧,产生刺眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳(总结)金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
1.推断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子实力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
人教版高中化学必修一第三章金属及其化合物知识点总结(K12教育文档)

人教版高中化学必修一第三章金属及其化合物知识点总结(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(人教版高中化学必修一第三章金属及其化合物知识点总结(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为人教版高中化学必修一第三章金属及其化合物知识点总结(word版可编辑修改)的全部内容。
高一化学金属及其化合物知识点总结1.元素的存在形式有两种:游离态和化合态.(1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
(2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:(1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
(2)镁条燃烧发出耀眼的白光,用来做照明弹.(3)利用铝的良好导电性,做导线。
利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。
3.金属化合物的用途:(1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。
(2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
(3)明矾做净水剂。
4.金属的分类:(1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。
(2)根据密度分类:密度大于4。
大学化学复习纲要

18. 缓冲溶液,形成的缓冲溶液的条件及其PH值计算,各
配比变化后,PH值的计算。
19. 电极电势,表达式,能斯特方程,难溶物的电极电势,
13. 配合物的电极电势,PH值对平衡的影响。
20. 根据电极电势大小判断氧化性大小
上一内容 下一内容 回主目录
返回
第五章 化学与环境保护
1. 环保污染气体 2. 酸雨 3. 脱硫途径 4. 空气污染物,室内空气污染物
上一内容 下一内容 回主目录
返回
第八章
有机高分子材料
1. 聚合物单体。 2. 聚合物2个温度的定义与材料3相的关系。 3. 高聚物变质的原因
上一内容 下一内容 回主目录
返回
第一章 原子结构与元素周期表
1. 原子轨道,量子数,原子序数与量子数的关系 2. 能量最低原理,洪特(Hund)规则,鲍林(Pauli)不相容原理 3. 电离能,电负性与金属性的关系
上一内容 下一内容 回主目录
返回
第二章 分子结构
1. 杂化态,分子杂化态与分子空间构型的关系,氢键。 2. 范德华力,极性键与非极性键,极性分子与非极性分子
上一内容 下一内容 回主目录
返回
第四章 化学平衡
8. 化学平衡的定义,动态的平衡。 9. 平衡常数,平衡常数的表达式,平衡与产率的关系。 10. 比值与平衡常数比对判断反应方向。 11. 影响平衡的因素,影响平衡常数的因素,与温度的关系 多重平衡的表达式。
上一内容 下一内容 回主目录
返回
第四章 化学平衡
12. 气相平衡, 溶液平衡 13. 弱酸弱碱的PH数值计算 14. Ksp的定义,根据Ksp判断沉淀形成的先后, 15. 浓度幂乘积与Ksp比对,判断沉淀与否。 16. Ksp计算溶解度
2024年金属有机化学课件

金属有机化学课件一、引言金属有机化学是研究金属与有机物之间的化学键、反应和应用的学科。
它是现代化学的一个重要分支,涉及有机化学、无机化学和物理化学等多个领域。
金属有机化学的研究不仅可以丰富化学的理论体系,还可以为材料科学、催化科学、生命科学等领域提供重要的理论支持和实践应用。
本课件旨在介绍金属有机化学的基本概念、重要反应和应用领域,以帮助学生更好地理解和掌握这一学科。
二、金属有机化学的基本概念1.金属有机化合物金属有机化合物是由金属原子与有机基团通过共价键连接而成的化合物。
金属原子通常与碳、氮、氧、硫等非金属原子形成配位键,形成金属有机配合物。
金属有机化合物具有独特的化学性质和广泛的应用领域。
2.配位键配位键是指金属原子与有机基团之间的共价键。
在金属有机化合物中,金属原子通常提供一个或多个空轨道,而有机基团提供一个或多个孤对电子,它们之间通过共价键相连。
配位键的形成使金属原子能够与多种有机基团形成稳定的化合物。
3.配合物配合物是由中心金属原子和周围的配体通过配位键连接而成的化合物。
配合物通常具有确定的结构和独特的性质,如催化活性、光学活性等。
配合物在材料科学、催化科学和生命科学等领域具有重要应用。
三、金属有机化学的重要反应1.均相催化反应均相催化反应是指在金属有机化合物催化下,反应物和催化剂处于同一相(液相或气相)的催化反应。
均相催化反应具有高效、选择性好和反应条件温和等优点,广泛应用于有机合成、石油化工和环境保护等领域。
2.配位聚合反应配位聚合反应是指在金属有机化合物催化下,通过配位键的形成将单体连接成高分子聚合物的反应。
配位聚合反应具有活性高、选择性可控和产物性能优异等特点,是合成高性能高分子材料的重要方法。
3.金属有机化合物的合成反应金属有机化合物的合成反应包括有机配体的合成、金属有机化合物的合成和金属有机配合物的合成等。
这些合成反应通常涉及有机合成、无机合成和物理方法等多种技术手段,需要根据目标产物的结构和性质进行合理设计。
第十九章金属通论精选课件

硅铝酸盐
(3)氧化物及硫化物:过渡金属
问题:金属元素在自然界中有哪几种主要存 在形式?
❖ 少数贵金属以单质或硫化物。(如Au、Ag、 Hg、铂系)
❖ 轻金属:氧化物和含氧酸盐。(如以CO32- 、 PO43- 、 SO42-)
钾钙 钪钛 钒 铬锰铁钴镍 铜 锌镓锗砷硒 溴氪
5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc44 Ru 45 Rh 46 Pd 47Ag 48Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe
铷锶 钇 锆铌 钼 锝 钌 铑钯银 镉 铟 锡 锑 碲 碘 氙
通常随着温度的增高而增大
通常随温度的增高而减小
5.大多具有展性和延性
大多不具有展性和延性
6.固体金属大多属金属晶体 固体大多属分子型晶体
7.蒸气分子大多是单原子的
蒸气(或气体)分子大多是双原 子或多原子的
物理性质 金属光泽:
❖ 重- 金属:氧化物、硫化物、SiO32-、CO32
绿柱石 闪锌矿
辉锑 矿
软锰矿 黑钨矿
19-2 金属提炼
19-2-1 金属还原过程的热力学 以氧化物为基础,ΔfG越负,
氧化物越稳定,T.P下同一类型氧 化物的ΔfG越负,越难得到金属。
埃林汉姆
图(氧化
金
物自由
属
能—温度
还
图):
原
作用:
的
1)找出氧
(2)Mg可还原 Al2O3生成Al,能否发生Al 还原MgO生成Mg的反应?上述两个还原 过程的温度范围是多少?
1超分子化学简介

一、立体异构
1 几何异构 在配合物中, 配体可以占据中心原子周围的
不同位置。所研究的配体如果处于相邻的位置, 称之为顺式结构; 如果配体处于相对的位置, 称之 为反式结构。这种异构现象称为顺-反异构。
十二羰基合―三角-三锇
[Nb6( 2- C1)12]2+ 十二( 2-氯)合―八面 ―
六铌(2+)离子
[Mo6( 3-Cl)8]4+ 八( 3-氯)合―八面―
有效原子序数规那么(EAN规那么)
EAN规那么 金属的 d 电子数加上配体所提供的σ电子数之 和等于18,或中心金属的总电子数等于下一个 稀有气体原子的有效原子序数
命名
-complex
-配合物的命名原那么与经典配合物相似,但为 了说明键合情况,还需标明配位原子的键合方式
假设配体中的键或环上的所有原子都是键合
于一个中心原子,那么配体名称前加上词头
( (hapto)表示 键合形式,上标配位原子数 n
) [PtC12(NH3)(C2H4)] 二氯·一氨·( -乙烯)合
➢ 福井谦一〔K. Fukui) 和 R. Hoffman,前沿 分子轨道理论,1981
➢ H. Taube,金属配合物的电子转移反响机 理,1983 ➢ R. A. Marcus,溶液中电子传递理论,1992
➢ 21世纪,纳米科学与技术的应用,分子器 件的研究
二、配合物的分类、命名 及异构现象
分类
简单配合物
配
体
螯合物
carbonyl
种
complex
类
特殊配合物
【最新】安徽化学竞赛 无机 19第19章 金属通论(共44页PPT)(共44张PPT)

贵金属:这类金属包括金、银和铂族元素,由于它 们稳定、含量少、开采和提取困难、价格贵;
—— 贱金属
准金属:半导体,一般指硅、硒、碲、砷、硼;
稀有金属:自然界中含量很少,分布稀散、发现较 晚,难以从原料中提取的或在工业上制备和应用较 晚的金属;如:锂、铷、铯、钨、锗、稀土元素和 人造超铀元素等。
3
19-1 概述
1、金属元素:指价电子数较少,在化学反应中容 易失去电子的元素,处于周期表的左方及左下方。 自然界存在和人工合成的金属已达90多种,按不同 的标准分类;
金属
黑色金属 (Fe、Cr、Mn及其合金) (钢铁:铁碳合金)
有色金属
密度:轻有色金属和重有色金属 价格:贵金属和贱金属 性质:准金属和普通金属
Mg 可还原 Al2O3生成Al的温度范围 273 ~1673 K Al 还原MgO 生成 Mg的温度在1673 K 以上。 (3) 为什么用C作还原剂还原金属氧化物时,产物是CO? CO生成线向下倾斜,即温度越高,越易生成CO
14
19-2-2 工业上冶炼金属的一般方法 工业上提炼金属一般有下列几种方法: 热分解法、热还原法、电解法。
除rG来判断外还要注意下几方面情况;(1)还原力
强;(2)容易处理;(3)不和产品金属生成合金;(4)可 以得到高纯度的金属;(5)其它产物容易和生成金属分 离;(6)成本尽可能低
18
3、电解熔盐法:
电解熔盐 (活泼金属制备如Al、Mg、Ca、Na、Li等) Al以后的制备用电解盐溶液法(如Zn等)
艾林汉在1944年首先用消耗1molO2生成氧化物过程 的自由能变化对温度作图。根据:
北师大版无机化学课件 p区金属

p区金属
主要内容
§21.1 p区金属概述
§21.2 铝 镓分族 §21.3 锗分族
§21.4 锑和铋
本章教学重点
1.掌握Al、Sn、Pb单质及其化合物的 性质及锗分族性质变化规律;
2.掌握锑和铋单质及其化合物的性质;
IIIA
p区金属元素
在周期表中的位置
共10种金属
21.1 p区金属概述
红宝石 Cr2O3
蓝宝石 黄玉/黄晶 Fe2O3和TiO2 Fe2O3
氢氧化铝:Al(OH)3 两性: Al(OH)3+ 3H+ === Al3+ + 3H2O Al(OH)3+ OH-=== [Al(OH)4]- 在碱性溶液中存在[Al(OH)4]-或[Al(OH)6]3- 3- 经光谱实验证实: 简便书写为: AlO2 或AlO3 溶液中不存在AlO 或AlO
铝的性质
(1)物理性质: 银白色,延展性、导电性、导热性较好。 用途: 电讯器材、建筑设备、电器设备的制造 以及特殊材料的制备。
(2)化学性质:
①与非金属单质反应 2Al(s)+3X2=2AlX3(s) 4Al(s)+3O2(g)=2Al2O3(s) 2Al(s)+3S(l)=2Al2S3(s) 铝的亲氧性: 铝与氧反应的自发性程度很大,铝一接触空 气表面立即氧化,生成一层牢固的氧化膜而耐 腐蚀。铝能夺取化合物中的氧且放出大量的热, 致使反应时不必向体系供热。故铝是冶金上常 用的还原剂,在冶金学上称为铝热法。
IIIA Al, Ga, In, Tl IVA Ge, Sn, Pb VA Sb, Bi VIA Po 与S区金属相比 ns2np1 ns2np2 ns2np3 +III(+I) +II, +IV +III, +V
第八章--金属-金属多重键化学PPT课件

nb和na分别代表成键和反键轨道上的电子数.
* 上式所表示的键级仅仅是以成键轨道上净的电子对数为出发点,它 并不代表键强的直接量度.因为σ πδ组分对总的键强的贡献有很大
的差别.
**两金属原子间存在四对成键电子,是造成这类化合物M—M距离很
短的根本原因.
-
8
金属-金属四重键
• Pauling描述---价键/杂化轨道理论
-
32
金属-金属四重键
• 大多数这类化合物中的Cr—Cr距离此羧基化合物的短得多
• 例: Cr—Cr距离
– Cr2(DMP)4(图) – Cr2(TMP)4 – Cr2(MMP)4 – Cr2(map)4
184.7pm 184.9pm 182.8pm 187.0pm
*“超短键”---M—M距离小于190pm
-
18
金属-金属四重键
• 双齿配体最主 要的是羧基和 类羧基阴离子, 羧基中的氧原 子也可被一个 或两个RN基团 所取代.
-
19
金属-金属四重键
• 例:Mo2(O2CCH3)4
– 测定结果:Mo---Mo四重键
– 醋酸根阴离子CH3COO-中的两个氧 原子分别和两个钼(II)配位,构成了 双齿桥基.
* Mo2间形成四重键的倾向比Cr2大.
-
25
金属-金属四重键
• CCrr22((OO22CCCRH)4L3)24(型H2化O)合2是物中最 重要的一种.
– 单核铬(II)的化合物一般呈蓝色 或紫色,具有强烈的顺磁性.
– Cr2(O2CCH3)4(H2O)2 呈深红色, 具反磁性。
– 从发现(1844)到认识(1970)经历 了约120年.
排斥也最强.图(a)
金属有机化学总结要点

见到。
精选课件
9
缺电子型化合物中的多中心键
Li,Be,Mg,A1等几种元素的烷基化合物和氢化物, 其单分子体不稳定,多数情况下以多聚体存在。
二硼烷B2H6能稳定存在,而其单分子体BH3却只有极 少量能以游离的分子存在,其原因是长期未得到解 决的问题。
用Ziegler催化剂的烯烃聚合机理
精选课件
23
Ziegler催化剂是由TiCl4或TiCl3与A1Et3或A1Et2Cl 等有机铝化合物混合来制备,烷基铝化合物是作为过 渡金属化合物的烷基化试剂而起作用的,钛上所带卤 素原子与铝上所带的烷基发生交换即生成乙基钛化合 物:
精选课件
24
认为确实是生成了某种乙基钛化合物,并成为活性物 种。这样生成的催化剂与乙烯反应后,乙烯П配位于 钛,发生Et—Ti 键间的插入反应,反应机理可最简单 地表示如下:
精选课件
6
IUPAC命名规则:
n-Bu3GeEt MeBeH
三丁基乙基锗 氢甲基铍
精选课件
7
-配合物命名
含-键配位的金属有机化合物,命名时要指出配位的配位体中有多少碳原子与金属原子成键,用 n表示。
Mn
CO
CO
CO
5-CpMn(CO)3 三羰基 - 5 - 环戊二烯基合锰
精选课件
8
金属与碳之间存在共价键时,成键形式可以有三种情 况:
氢原子进入桥的位置,它的1S轨道与SP3轨道重叠后, 就形成了1个扩展到整个B—H—B原子组的一个轨道 [图2.6(c)]。由各硼原子和桥联的H原子分别提供1个 电子,所以用4个电子形成了2组B—H—B键,1对电 子用于3个原子组,这样的键叫三中心二电子键(3— center,2—electronbond);简称3c - 2e键。
高中化学竞赛中过渡元素的讲解

过渡元素(一)要求(1)从电子层结构的特点理解d区元素的通性。
(2)了解钛、钒、铬重要化合物的化学性质。
了解钼、钨的重要化合物。
(3)掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的化学性质以及各氧化态锰之间相互转化关系。
(4)掌握铁、钴、镍的化合物在反应性上的差异。
熟悉铁、钴、镍的重要配合物。
(5)了解铂及其重要化合物的性质。
(一) 过渡元素通性过渡元素一般是指原子的电子层结构中d轨道或f轨道仅部分填充的元素。
因此过渡元素实际上包括d区元素和f区元素。
本章主要讨论d区元素。
d区元素价电子构型为(n-1)d1~8ns1~2(Pd 4d10和Pt 5d96s1例外), 最外两层电子均未填满。
由此构成了d区元素如下通性:(1)单质相似性最外层电子一般不超过2个,较易失去,所以它们都是金属。
又因为d区元素有较大的有效核电荷,d电子有一定的成键能力,所以它们一般有较小的原子半径、较大的密度、较高的熔点和良好的导电导热性。
例如Os的密度(22.488 g∙cm−3),W的熔点(3380 o C,Cr的硬度都是金属中最大的。
d区元素化学活泼性也较接近。
(2)有可变氧化态因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,所以除ⅢB族只有+3氧化态外,其他各族都有可变的氧化态。
氧化态变化趋势是同一周期从左到右逐渐升高,然后降低;同一族从上到下高氧化态趋于稳定。
例如MnO4−有强氧化性,而ReO4−无氧化性。
例1对同一族元素来说,随周期数增加,为什么主族元素低氧化态趋于稳定而过渡元素高氧化态趋于稳定?主族元素(主要表现在ⅢA,ⅣA,ⅤA族)随周期数增加,低氧化态趋于稳定的原因一般归因于“惰性电子对效应”。
为什么过渡元素随周期数增加高氧化态趋于稳定呢? 仔细研究一下过渡元素的电离能可发现:I1和I2往往是第二、第三过渡系列比第一过渡系列的大,但从I3开始,往往第二、第三过渡系列比第一过渡系列的小。
超分子化学三.pptx

1:1 百草枯 2:1
第20页/共34页
3.12 碱金属阴离子和电子化物
[Cs([18]冠-6)2]+ •e穴醚]+ •e-
电子化盐
限定在直径0.24 nm球状格子内 电子间距0.87 nm 200K电导率10-10
固态不是电子导体
第21页/共34页
3.13 杯芳烃
对位取代的苯酚和甲醛缩合得到 calixarene
对不同尺度的金属离子的络合
第27页/共34页
3.14 碳原子给体与-酸配体
混合碳-杂原子主体
与金属有机的交叉点
K+ PF6-
金属离子Ag+ 阳离子-络合
第28页/共34页
[RuCl2(dmso)4]
碳氢化合物主体
少见
多见
第29页/共34页
Cr
对环番
第30页/共34页
3.15 含铁细胞
天然含铁细胞
第33页/共34页
感谢您的观看。
第34页/共34页
电荷,氢键,空间。。。
第12页/共34页
氢键强度和空间识别
第13页/共34页
三维主体分子对铵离子的络合
第14页/共34页
双络合功能基主体
含有两个客体结合位置的主体
Lehn的设计
第15页/共34页
超分子化合物的NMR谱 芳香环流效应 核nuclear overhauser effect (NOE)
第16页/共34页
偶合
第17页/共34页
手性识别
有机阳离子识别的应用例子
第18页/共34页
两性受体
两性受体是两种或两种以上的客体识别方式产生协同络合促进作用的分子 主体对两性受体的适应性
高中化学选择性必修二教案讲义:超分子(教师版)

超分子1.了解超分子的概念、结构、性质。
2.了解超过分子的存在与应用,能举例说明物质在超分子等不同尺度上的结构特点对物质性质的影响。
一、超分子1.定义由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
2.存在形式超分子定义中的分子是广义的,包括离子。
3.微粒间作用力—非共价键:超分子内部分子之间通过非共价键结合,主要是静电作用、范德华力和氢键、疏水作用以及一些分子与金属离子之间形成的弱配位键。
4.分子聚集体的大小:超分子这种分子聚集体,有的是有限的,有的是无限伸展的。
二、超分子特征1、分子识别:通过尺寸匹配实现分子识别。
2、自组装:超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
三、超分子的应用1、应用(1)在分子识别与人工酶、酶的功能、短肽和环核酸的组装体及其功能等领域有着广阔的应用前景。
(2)超分子化学的发展不仅与大环化学(冠醚、穴醚、环糊精、杯芳烃、C60等)的发展密切相连,而且与分子自组装(双分子膜、胶束、DNA双螺旋等)、分子器件和新兴有机材料的研究息息相关。
2、应用实例(1) “杯酚”分离C60和C70:杯酚与C60通过范德华力相结合,通过尺寸匹配实现分子识别。
向C60和C70的混合物中加入一种空腔大小适配C60的“杯酚”,再加入甲苯溶剂,溶解未装入“杯酚”的C70,过滤后分离C70;再向不溶物中加入氯仿,溶解“杯酚”而将不溶解的C60释放出来并沉淀。
(2)冠醚识别碱金属离子:冠醚是皇冠状的分子,有不同大小的空穴,能与正离子,尤其是碱金属离子络合,并随环的大小不同而与不同的金属离子络合,利用此性质可以识别碱金属离子。
冠醚环的大小与金属离子匹配,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
(3)细胞和细胞器的双分子膜:细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
【单元练】高中物理选修3第一章【分子动理论】知识点总结(1)
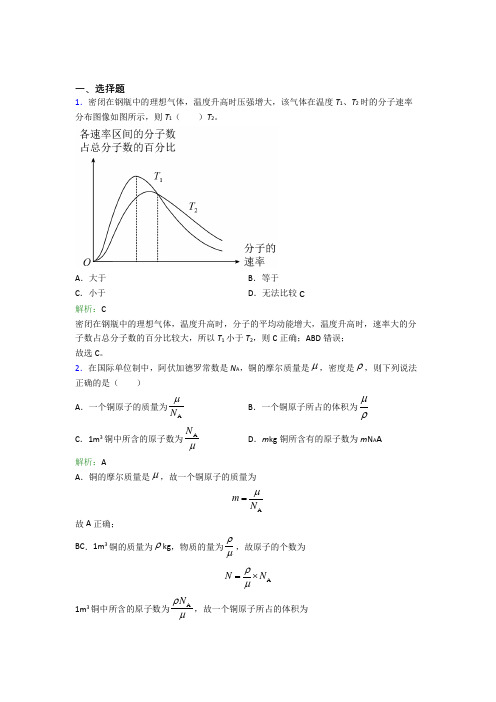
一、选择题1.密闭在钢瓶中的理想气体,温度升高时压强增大,该气体在温度T 1、T 2时的分子速率分布图像如图所示,则T 1( )T 2。
A .大于B .等于C .小于D .无法比较C解析:C密闭在钢瓶中的理想气体,温度升高时,分子的平均动能增大,温度升高时,速率大的分子数占总分子数的百分比较大,所以T 1小于T 2,则C 正确;ABD 错误; 故选C 。
2.在国际单位制中,阿伏加德罗常数是N A ,铜的摩尔质量是μ,密度是ρ,则下列说法正确的是( ) A .一个铜原子的质量为AN μ B .一个铜原子所占的体积为μρC .1m 3铜中所含的原子数为AN μD .m kg 铜所含有的原子数为m N A A解析:AA .铜的摩尔质量是μ,故一个铜原子的质量为Am N μ=故A 正确;BC .1m 3铜的质量为ρkg ,物质的量为ρμ,故原子的个数为 A N N ρμ=⨯ 1m 3铜中所含的原子数为AN ρμ,故一个铜原子所占的体积为A A 1N N μρρμ=故BC 错误;D .m kg 铜的物质的量为mμ,故含有的原子数目为AA mN mN μμ⨯=故D 错误。
故选A 。
3.若以M 表示水的摩尔质量,V 表示在标准状态下水蒸气的摩尔体积,ρ为在标准状况下水蒸气的质量密度,N A 为阿伏加德罗常数,m 、V 0分别表示每个水分子的质量和体积,下面是四个关系式:其中( )①A V N mρ= ②A N M ρ= ③A M m N = ④ 0A V V N = A .①和②都是正确的 B .①和③都是正确的 C .③和④都是正确的 D .①和④都是正确的B 解析:B摩尔质量等于分子质量乘以阿伏伽德罗常数,也等于等于摩尔体积乘以密度,即A mN V ρ=变形后可得A V N mρ=故①正确;气体的摩尔质量等于摩尔体积乘以密度,所以V M ρ=所以M Vρ=故②错误;摩尔质量=分子质量⨯阿伏伽德罗常数,即AM m N =故③正确;④由于气体分子间距远大于分子直径,因此0AV V N <故④错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ivsiai n tue h i t h rt l td f o ( =C , g A )sse . n et t nc si t tef s te ei u yo g o o ts r o a c s MP ,M u A , u ytms
K yw rs e od :
o ( =C ,g A )ptni nt nsait, l t ncr l i ,M uA , u , et f co ,t ly ee r e t n o l a u i bi co o ao
o rlt t o s c reain m eh d .Th oa p c ay ia o e t l u cin rs e isaec n tu tdb tig t ea . o ettl a ea lt l tn i n t sf p ce sr ce yf t n s n c p af o o r o i n h eg U V SM u el o bef n t n,a d s etoc pc d t df rec n tn sae d rv d fo i.Ths r y C r e a r lS r i u c o n p r so i aaa o c sa t eie r m t s — i c n o r i
L U egmi , . uS o g -, HA Yo gf g , I i g n I F n - n Qi uR n Z O n . n  ̄ JNG X a o g M 一 a o
( .S ho f ai o r , eigIfr t nSi c n 1 co l B s o cC us B l e j n nomai c n e dTeh ooyUnv ri , i g10 8 。 hn ; o e a cn l g iest  ̄ j y i 0 0 5 C Ja n 2 etrfrC n esdMatrSineadTeh ooy ab ntue f cn l y abn10 1 C ia .C ne o o d ne t c c n e e cn l ,H ri si t Teh oo ,H ri 5 0 。 hap l ie l ue oX Ⅱ ) M =C , g btat Th ng tl o d e l MP ( o n mo c s o ,( u A ,Au aebe tde s g )hv ensui ui d n
sa d r mal o e r lt it s u o tn il.Th ru d ee to i tt d c rep n ig ra o a l tn a d s l c r eai si p e d p e t s — v c o a e g o n lcr nc sae a r o dn e s n b e s n o s
摘
要 : 用相对论 小核赝 势研 究了重金属钋化物 分子 MP ( 利 o X Ⅱ ) ( =C , g Au . ,M u A , ) 用群论 方法 结合
原子 分子反应静 力学原理导 出了分 子的基 电子状 态和相应 的 离解极 限 , 并在各 种 电子相 关理论 水平上 计
算 了它们 的平衡 几何和振动频率 . 在此基础上用 Mu e—o i函数 形式拟和势能 曲线 , 到 了总的解析 势 r lSre rl b 得 能 函数 , 并计算 出了光谱数据 和力常数 . 关键词 : o ( =C , g Au ; MP ,M uA , )势能 函数 ; 稳定性 ; 电子相 关
中图分类 号 : 5 9 1 0 3.9 文献标 识码 : A
’
Stu t r sa tnta u to fc i g e a lni e r c u e nd po e i lf nc inso o na em t lpo o d
moeue MP ( 2 ) M =C , gA ) l l o X c s Ⅱ ,( u A , u
Th q ib im e mere dvb ain e u n i ecluae tt esv rl h rt a v l o lcr n ee ul r i u g o ti a irt a f q e ce a c ltda h e e a e ei le es fee to sn ol r sr a to c l
维普资讯
第2 4卷
第 3期
原
子
与 分
子
物
理
学
报
V0. 4 No 3 12 .
20 0 7年 6月
J OURNAL OFATOMI AND MOL C ECULAR PHYS C IS
J n。2 0 u 07
文章编 号 : 0 00 6 (0 7 0 —5 70 1 0 —34 2 0 )30 4 —7
重 金 属 钋 化 物分 子 MP {Ⅱ ) ( =C , , ) o 2 ,M u Ag Au 的 结构 和 势 能 函数
刘凤敏 其木 苏荣 一赵永 芳2 井孝功2 , , , ,
(. 1北京信 息科技 大学基 础部 , 北京 108 ;2哈尔滨工业大学凝聚态科学与技术中心 , 005 . 哈尔滨 10 1 50 )
