硫的氧化物(2019年8月整理)
硫及其重要化合物完美版
硫及其重要化合物【高考目标定位】 考纲导引考点梳理 了解硫元素单质及其化合物的主要性质及应用。
了解硫元素单质及其化合物对环境质量的影响。
硫。
二氧化硫和三氧化硫。
硫的氧化物对大气的污染。
硫酸。
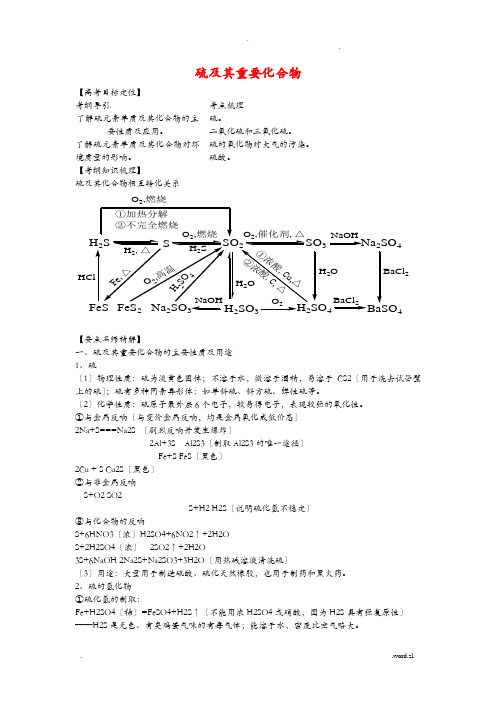
【考纲知识梳理】硫及其化合物相互转化关系H 2SSSO 23Na SO 4223H 22SO 4HClH 2,△O 2,燃烧H 2SO ,燃烧①加热分解②不完全燃烧2NaOHO 2BaCl 2H 2OBaCl 2①浓酸,C u ,△②浓酸,C, △H 2OH2S O4O2,高温F e ,△【要点名师精解】一、硫及其重要化合物的主要性质及用途 1、硫〔1〕物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS2〔用于洗去试管壁上的硫〕;硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
〔2〕化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反响〔与变价金属反响,均是金属氧化成低价态〕 2Na+S===Na2S 〔剧烈反响并发生爆炸〕2Al+3S Al2S3〔制取Al2S3的唯一途径〕 Fe+S FeS 〔黑色〕 2Cu + S Cu2S 〔黑色〕 ②与非金属反响 S+O2 SO2S+H2 H2S 〔说明硫化氢不稳定〕 ③与化合物的反响S+6HNO3〔浓〕H2SO4+6NO2↑+2H2O S+2H2SO4〔浓〕 2SO2↑+2H2O3S+6NaOH 2Na2S+Na2SO3+3H2O 〔用热碱溶液清洗硫〕〔3〕用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2、硫的氢化物 ①硫化氢的制取:Fe+H2SO4〔稀〕=FeSO4+H2S ↑〔不能用浓H2SO4或硝酸,因为H2S 具有强复原性〕 ——H2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质 A .可燃性:当22/O S H n n ≥2/1时,2H2S+O2 2S+2H2O 〔H2S 过量〕当22/O S H n n ≤2/3时,2H2S+3O22SO2+2H2O 〔O2过量〕当23222<<O S H n n 时,两种反响物全部反响完,而产物既有硫又有SO2B .强复原性:常见氧化剂Cl2、Br2、Fe3+、HNO3、KMnO4等,甚至SO2均可将H2S 氧化。
2019年高考化学考点一遍过考点20 硫及其重要化合物 含解析
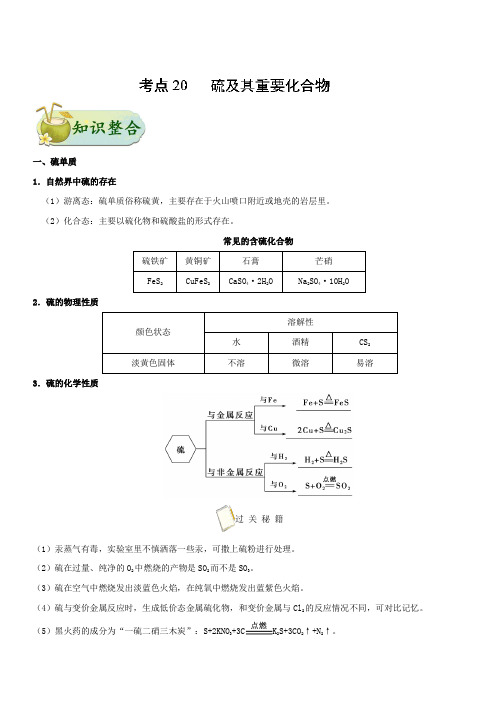
一、硫单质1.自然界中硫的存在(1)游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
常见的含硫化合物2.硫的物理性质溶解性颜色状态水酒精CS2淡黄色固体不溶微溶易溶3.硫的化学性质过关秘籍(1)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
(2)硫在过量、纯净的O2中燃烧的产物是SO2而不是SO3。
(3)硫在空气中燃烧发出淡蓝色火焰,在纯氧中燃烧发出蓝紫色火焰。
(4)硫与变价金属反应时,生成低价态金属硫化物,和变价金属与Cl2的反应情况不同,可对比记忆。
(5)黑火药的成分为“一硫二硝三木炭”:S+2KNO3+3C K2S+3CO2↑+N2↑。
二、硫的氧化物——二氧化硫和三氧化硫1.二氧化硫(1)物理性质(2)化学性质①酸性氧化物的通性a.与水反应:SO 2+H2O H2SO3b.使指示剂变色:SO2能使紫色石蕊溶液变红c.与碱反应:NaOH足量:SO2+2NaOH Na2SO3+H2ONaOH不足量:SO2+NaOH NaHSO3d.与碱性氧化物反应:SO2+CaO CaSO3②氧化性:2H2S+SO23S↓+2H2O(产生淡黄色沉淀)③还原性a.与O2反应:2SO2+O22SO3b.与X2(Cl2、Br2、I2)的水溶液反应:SO2+X2+2H2O2HX+H2SO4c.可被酸性KMnO4溶液、K2Cr2O7溶液、H2O2、Fe3+等氧化。
④漂白性:SO2能漂白某些有色物质(如品红溶液),但不能使紫色石蕊溶液等指示剂褪色。
(3)检验将气体通入品红溶液后,溶液褪色,加热后溶液又恢复到红色则可验证该气体是SO2。
注意“加热”是必不可少的步骤,因为氯气也能使品红溶液褪色,但加热后溶液不会重新变红色。
2.三氧化硫(1)物理性质常温常压下为无色、易挥发的液体,熔点为16.8 ℃,沸点为44.8 ℃。
(2)化学性质:酸性氧化物的通性三、硫酸的性质和23SO -、24SO -的检验 1.硫酸的性质干燥注意:(1)浓硫酸的稀释方法:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。
硫及其化合物 教学设计 高一化学人教版(2019)必修第二册

《硫及其化合物》第一课时教学设计思考:(1)S、Cl2与Fe、Cu反应的产物有何差异?原因是什么?(2)如何洗涤附着在试管内壁上的硫?提示:(1)硫是一种弱氧化剂,与可变价金属(如Fe、Cu)反应时,生成低价金属硫化物,而Cl2的氧化性强于S,与可变价金属作用,生成高价态氯化物。
(2)可用CS2或热NaOH溶液洗涤试管内壁的硫。
三、硫的氧化物---SO21、物理性质无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水,一体积水溶解40体积SO2(1:40)。
2、化学性质SO2是一种酸性氧化物SO2中硫元素为+4价,属于中间价态SO2既有还原性又有氧化性。
探究实验5-1:如图5-2所示,把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内页面的上升。
待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定溶液的酸碱度(保留该溶液供实验5-2使用)。
实验现象:SO2溶于水,生成亚硫酸,溶液显酸性。
反应的方程式为:SO2+H2O⇌H2SO3←可逆反应注意:形成的亚硫酸在空气中长时间放置会发生反应:2H2SO3+O2=2H2SO4可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应。
向生成物方向进行的叫做正反应,向反应物方向进行的叫做逆反应。
①酸性氧化物通性a.与H2O反应:SO2+H2O⇌H2SO3b.与碱性氧化物反应与CaO反应:CaO+SO2===CaSO3。
c.与碱反应与NaOH溶液反应:SO2+2NaOH===Na2SO3+H2O②还原性:SO2能被O2、X2(Cl2、Br2、I2)、KMnO4(H+)溶液等强氧催化剂4、SO 2的污染① SO 2有刺激性气味,有毒,排入空气中会污染空气; ② SO 2和NO 2是形成酸雨的主要物质; ③ 酸雨的p H 值小于5.6;正常雨水的p H =5.6,是因为溶有CO 2。
2023年春高一化学专题01 硫及其化合物 教材精讲(人教版2019必修第二册)(含答案)

专题01 硫及其化合物(教材深度精讲)【核心素养分析】1.宏观辨识与微观探析:从宏观和微观角度认识硫及其重要化合物的性质。
2.变化观念与平衡思想:从硫的化合价变化认识硫及其化合物的相互转化及应用。
3.证据推理与模型认知:从实验现象中找证据进行推理,认识硫及其化合物的性质。
4.科学探究与创新意识:从不同的角度探究硫及其重要化合物的性质及制备实验方案,并进行实验操作验证。
5.科学态度与社会责任:关注与SO2有关的污染和环境保护,具有可持续发展意识和绿色化学观念。
【知识导图】【目标导航】硫元素的多种价态及各种价态化合物的相互转化内容丰富,也是氧化还原反应的重要素材。
命题空间广阔,而且与生产、生活及社会联系紧密,高考中通过框图推断题、工业生产流程题、实验题等形式进行考查。
主要有以下几个重要考点:1、环境污染问题越来越受到人们的重视,因而以环保问题为载体考查SO2性质的试题应予以关注;2、H2SO4是与生产、生活密切相关的物质,因而要理解、掌握H2SO4的性质,尤其是浓硫酸的特性及其应用。
从命题形式来看,1、硫酸一般不单独命题,而在选择题的选项出现或穿插在主观题中。
2、环境污染和防护与工农业联系紧密,又以硫和氮的氧化物知识为背景,既可以构成选择题的选项,又可以构成主观题。
从分值来看,选择题4-8分,主观题8-10分。
【重难点精讲】一、硫单质的性质及应用1.硫元素的存在形态(1)游离态:在火山口附近或地壳的岩层例存在; (2)化合态:以硫化物和硫酸盐的形式存在,⎩⎪⎨⎪⎧硫化物:硫铁矿FeS 2、黄铜矿CuFeS 2硫酸盐:芒硝Na 2SO 4·10H 2O 、石膏CaSO 4·2H 2O 、明矾KAl(SO 4)2·12H 2O 其它:蛋白质、化石燃料。
2.硫单质的物理性质硫单质俗称硫黄,是一种淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2;有多种同素异形体,如单斜硫、斜方硫等。
第六章 化学工程的伦理问题 - 副本

6.2.6 化学工程师的伦理准则
• 工程师在其合法的工程活动中,遵从职业伦理,依据工程利益的公正配给和关 护工程中受损的相关者的核心原则,应当自觉地为其自主选择的行为利害以及 因其工程活动所形成和产生的利害相关者承担相应的责任。
• 化学工程师:将公众的健康和福祉放在首位。 • 实际生产中遇到企业的显性利益与第三方(通常是公众)的隐形利益相冲突及
14
6.2.2 事故预防中的伦理问题
企业应该持续更新技术手段并加强安全监督管理,尽可能减少安全意外事故的发 生。博帕尔事件中工厂明明知道储藏异氰酸甲酯存在极大的安全隐患,但是仍然没有 加强风险预防观念。 ➢ 2015年8月12日天津港瑞海公司仓库爆炸事件
未批先建、边建边经营危险货物堆场;违规存放硝酸铵;无证违法经营……
不能仅仅做表面工作。要严格依照国家相关法律法规实施,做好企业良性发展。责任 关怀要放眼于整个化工行业,更加深入彻底地实现化工行业的健康和快速发展。
31
问题思考 假设你研究生毕业后来到一家势头强劲,福利待遇良好的化 工企业工作,五年后,由于工作成绩突出, 被提拔为车间主任。 最近由于市场变化,你们企业销售额大幅度的下降。一天,企业 总经理命令你在夜间把你们车间的污水处理设施停下来,以降低 企业成本,你该怎么办?
23
6.4.2 推进责任关怀的必要性
1)提高化工行业在公众心中的认可程度:加强环境保护力度,加快生态环境修复 ,建立健全安全生产保障机制,大力支持绿色环保企业; 2)对石化行业更高的要求:我国已成为世界上最大的石油和化工产品生产与消费 国家之一,为我国其他一些基础行业提供支撑,是我国国民经济的支柱型产业。社 会对安全环保的要求越来越高,我国目前高度重视生态文明建设,推进经济社会可 持续发展,这要求石化行业要以更高的要求来应对机遇和挑战; 3)人才短缺:近几年,化工企业对一线操作人员的需求和相关高职专业招生难之 间的矛盾日益严重。
2019年6月16日广东省广州市黄埔区、广州开发区事业单位招聘考试《综合能力测试B卷》试题(技术岗)

2019年6月16日广东省广州市黄埔区、广州开发区事业单位招聘考试《综合能力测试B卷》试题(技术岗)一、单项选择题。
每小题后的四个备选答案中只有一个最符合题意的答案。
1根据国务院办公厅印发的《降低社会保险费率综合方案》,2019年5月1日起,各省、自治区、直辖市及新疆生产建设兵团养老保险单位缴费比例高于的,可降至。
A 、B 、C 、D 、22019年6月6日,国家发改委、生态环境部、商务部三部门发布《推动重点消费品更新升级畅通资源循环利用实施方案(2019—2020年)》,其中重点提出各地不得对实行限行、限购政策,已实行的应当取消。
A、电动自行车B、氢燃料汽车C、新能源汽车D、燃油乘用车3某市委书记在主持召开市内湖泊生态综合治理工作领导小组会议时提出,要从治理工作实际出发,实事求是地设定治理目标、对症下药,采取合理有效措施,确保规划确定的各项目标任务落到实处,见到实效。
该指导意见主要体现的是坚持的哲学思想。
A、尊重事物客观规律B、重视精神的力量C、具体问题具体分析D、实践是检验认识真理性的唯一标准4不同的人对幸福感的诠释不同。
某高三学生说:“幸福就是努力学习,考取一个好的大学。
”某大四学生说:“幸福就是找到一份好的工作。
”某职业经理人说:“最幸福的事情就是我把公司做成了一个世界品牌。
”这说明()。
A、同一群体的人对幸福的理解一定是相同的B、价值判断因人而异,具有主体差异性C、正确的价值判断要自觉站在最广大人民群众的立场上D、人们幸福感的来源并没有客观依据52019中国国际大数据产业博览会于5月26日开幕,国家主席习近平向会议致贺信。
贺信强调,中国高度重视大数据产业发展,愿同各国共享数字经济发展机遇,通过探索,共同探寻浙的增长动能和发展路径。
A、新数据、新发展、新经济B、新数据、新产业、新态度C、新技术、新业态、新发展D、新技术、新业态、新模式6习近平主席指出,在共建“一带一路”过程中,要始终从发展的视角看问题,将理念融入项目选择、实施、管理的方方面面。
高中化学人教版(2019)必修第2册5.2.第3课时 硝酸 酸雨及其防治

64 g mol1
22.4 L mol1
HNO3的物质的量n(HNO3)=0.03 mol×2+0.05 mol=0.11 mol。
2.(情境应用)浓硝酸是强氧化剂,遇有机物、木屑等能引起燃烧。含有痕量氧 化物的浓硝酸几乎能与除铝和含铬特殊钢之外的所有金属发生反应。某金属单 质跟一定浓度的硝酸反应,假定只有单一的还原产物。当参加反应的金属与被 还原的硝酸的物质的量之比为2∶1时,还原产物可能是什么?
【素养训练】 1.(2019·浏阳高一检测)下列反应中硝酸既能表现出酸性又表现出氧化性的是
() A.使石蕊试液变红 B.与铜反应放出NO气体,生成Cu(NO3)2 C.与Na2CO3反应放出CO2气体,生成NaNO3 D.与S单质混合共热时生成H2SO4和NO2 【解析】选B。在上述反应A、C项中HNO3均表现出酸性。在B、D项中HNO3中氮元 素的化合价均降低,表现出氧化性,并且在B项中又有Cu(NO3)2和水生成,说明此 反应中HNO3还表现出酸性。
(3)硝酸的强氧化性 ①实验探究
实验物质
稀硝酸
浓硝酸
实验 步骤
在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别 加入2 mL浓硝酸和2 mL稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触。向上拉铜 丝,终止反应。
实验 装置
实验 现象
实验 结论
试 逐 溶管 渐 液内 加 逐开 快 渐始 变,气产_蓝体_生_在,少铜试量丝管_逐无口__渐变色变为气细_体红_。,_棕反__应色, 常缓温慢下反,应稀生硝成酸_与N_O铜_
3.“电荷守恒法”在解题中的应用 HNO3过量时,反应后溶液中(不考虑OH-)有:c( NO3 )=c(H+)+nc(Mn+)(Mn+代表金属 离子)。 4.“离子方程法”在解题中的应用 金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中 NO3 在H2SO4提供H+的条件下 能继续与金属反应,因此此类题目应用离子方程式来计算,先做过量判断,然后根 据完全反应的金属或H+或 NO3进行相关计算,且溶液中要符合电荷守恒。
知识清单10 硫及其重要化合物-2025年高考化学一轮复习知识清单(新高考专用)(解析版)(1)

知识清单10 硫及其重要化合物知识点01 硫单质的性质及应用1.硫元素的存在形态游离态:火山口附近或地壳的岩层里; 化合态:主要以硫化物和硫酸盐的性质存在。
2.硫的物理性质黄色或淡黄色固体;俗称硫黄,质脆,易研成粉末,密度比水大,难溶于水,微溶于酒精,易溶于CS 2。
3.硫的化学性质S -2←――――氧化性S 0――→还原性S +4(1)与非金属单质反应 与氧气反应:S+O 2=====点燃SO 2 与氢气反应:S+H 2=====△H 2S (2)与金属反应与钠反应:2Na+S===Na 2S 与铁反应:Fe+S=====△FeS 与铜反应:2Cu+S=====△Cu 2S与汞反应:Hg+S===HgS 应用:去除洒落的汞 硫与变价金属反应生成低价态化合物(3)与NaOH 溶液反应:3S+6NaOH=====△2Na 2S+Na 2SO 3+3H 2O 应用:清洗试管壁残留的硫(1)硫与Fe 反应生成FeS ,与Cu 反应生成CuS(×)错因:硫与变价金属反应时,生成低价态金属硫化物(如Cu 2S 、FeS)2。
(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(√) (3)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(4)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(5)实验室洗涤附着在试管内壁上的硫,可用酒精清洗(×)错因:硫微溶于酒精,易溶于CS2,残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去。
1.硫和氯气的氧化性强弱比较方法(1)与变价金属反应,Cl 2与变价金属反应生成高价态化合物,S 与变价金属反应生成低价态化合物; (2)氢化物的稳定性:HCl >H 2S ; (3)置换反应:H 2S +Cl 2 ===2HCl +S↓; (4)最高价含氧酸的酸性:HClO 4>H 2SO 4; (5)还原性:S 2->Cl -。
微考点01 硫单质及其氧化物-高一化学易混易错微考点(人教版2019必修第二册) (解析版)

微考点01硫单质及其氧化物易混易错聚焦一、聚焦硫单质性质的误区1.易混易错点(1)单质硫燃烧时,产物只能是SO 2,无论O 2的量是否充足,均不会生成SO 3。
(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(Hg+SHgS)。
(3)实验室中,残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去。
因为硫单质易溶于CS 2也可以与热的强碱溶液反应:3S +6NaOH=====△2Na 2S +Na 2SO 3+3H 2O 。
2.正误判断(1)硫的最外层有6个电子,易得到2个电子达到稳定结构,故S 只能作氧化剂。
(×)(2)Fe 与S 、Cl 2反应均生成+3价铁的化合物。
(×)(3)S 与过量O 2反应,燃烧产物为SO 3。
(×)(4)在自然界中硫既有游离态又有化合态。
(√)(5)硫在自然界中仅以化合态存在(×)(6)硫与铁反应生成硫化亚铁(√)(7)硫与汞反应生成硫化亚汞,体现了硫的弱氧化性(×)(8)硫在空气中燃烧的产物是二氧化硫,在纯氧中燃烧的产物是三氧化硫(×)(9)类比Fe 与Cl 2反应生成FeCl 3,推测Fe 与S 反应生成Fe 2S 3。
(×)二、聚焦硫的氧化物的性质误区1.易混易错点(1)注意SO 2的漂白性和还原性的区别SO 2使品红溶液褪色表现的是SO 2的漂白性,加热后溶液颜色复原;SO 2使酸性高锰酸钾溶液、溴水、氯水、碘水褪色表现的是SO 2的还原性,加热后溶液颜色不复原。
(2)注意SO 2的氧化性的表现SO 2通入氢硫酸、硫化钠溶液中都会出现浅黄色沉淀,表现了SO 2的氧化性。
(3)SO 2不能漂白酸碱指示剂,SO 2只能使紫色石蕊溶液变红,但不能使之退色。
(4)SO 2和CO 2的鉴别方法。
①闻气味法:CO 2无气味,SO 2有刺激性气味。
②品红溶液法:能使品红溶液褪色的是SO 2,不能使品红溶液褪色的是CO 2。
第五章第一节+第一课时+硫及其化合物+++课件高一下学期化学人教版(2019)必修第二册

(3)SO2中硫的化合价为+4价,是硫元素的中间价态,所以SO2既有氧化性又
有还原性( √ ) (4)SO2气体通入BaCl2溶液产生白色沉淀BaSO3( × ) (5)某气体通入品红溶液后,品红溶液褪色,则该气体一定是SO2( × )
变式训练
2、将SO2分别通入右图溶液中, 回答下列问题: (1)试管⑥中___无___白色沉淀生成; (2)试管⑦的现象为__生__成__白__色_沉__淀__________; 发生的反应化学方程式为:S_O__2+__2_N_a_O_H__+_B_a_C__l2_=_=_=_B_a_S_O__3↓__+_2_N。aCl (3)试管⑧的现象为_生__成__白__色_沉__淀___________; 发生的反应化学方程式为:S_O_2_+_H__2O__2 _+_B_a_C__l2_=_=_=_B_a_S_O__4↓_+__2_H_C_l。
有色物质而使之失去原有的颜色
三、用途
可以漂白纸浆、毛、丝等 杀菌、消毒 食品添加剂
醒酒
葡萄酒醒酒的目的:一是为了去除葡 萄酒中的沉淀物,二是除掉葡萄酒中 的二氧化硫,三是为了让葡萄酒充分 与空气接触,发生氧化作用,使葡萄 酒入口更柔顺。
二氧化硫在葡萄酒、果汁中起杀菌、抗 氧化、防腐的作用。
判断正误
硫常见价态为 -2、+4、+6,所以SO2既有氧化性又有还原性。
-2
-2 -2
H2S、Na2S、FeS
0
+4
+6 +6
高中化学(新人教版)选择性必修二同步习题:环境保护与绿色化学(同步习题)【含答案及解析】

第三节环境保护与绿色化学基础过关练题组一化学与环境保护1.下列有关环境问题的说法不正确的是()A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境B.凡含有食品添加剂的食物对人体健康均有害,不可食用C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术D.提倡人们购物时不用塑料袋,是为了减少白色污染2.化学与生活息息相关,下列关于生活中的化学说法错误的是(深度解析)A.2020年新型冠状病毒在全球肆虐,从化学角度,可用含氯的消毒剂、75%酒精、过氧化氢来杀灭病毒B.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2C.燃烧化石燃料排放的废气中含CO2、SO2,造成大气污染,从而使雨水pH=5.6D.推广使用燃煤脱硫技术可有效防治酸雨3.(2020江苏南通高一期中)随着社会经济的发展,汽车已进入千家万户,汽车给人们出行带来方便的同时,汽车尾气污染问题也日益突显,汽车尾气中含NO、NO2、CO2、SO2和固体悬浮颗粒等。
用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:C(s)+2NO(g)N2(g)+CO2(g),可实现氮氧化物无害转化。
下列环境问题与汽车尾气的大量排放无关的是()A.酸雨B.温室效应C.PM2.5超标D.白色污染4.(2020浙江杭州高一期中)下列有关环境保护的叙述不正确的是()A.形成酸雨的主要物质是硫的氧化物和氮的氧化物B.大气污染物主要来自化石燃料燃烧和工业生产过程中产生的废气C.农田秸秆直接焚烧既省时又省力,应大力推广D.燃煤烟气脱硫的石灰石—石膏法,可将烟气中的二氧化硫转化为硫酸钙5.(2020江苏扬州高一期中)2020年6月5日世界环境日聚焦自然和生物多样性,主题为“关爱自然,刻不容缓”。
下列人类活动对该主题有积极作用的是()A.工业废水直接排放B.将废旧电池深度填埋C.加大化石燃料的直接利用D.改进汽车尾气净化装置6.(2020宁夏石嘴山高一期末)化学与生活密切相关,下列说法不正确的是()A.“酸雨”“臭氧层受损”“光化学烟雾”都与氮氧化物有关B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5μm 的颗粒物,该值越高,代表空气污染程度越严重C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理D.为消除碘缺乏症,相关部门规定食盐中必须加含碘物质,我国食盐中所加含碘物质是KI7.(2019四川成都棠湖中学高一下期末)2019年,某化工厂发生特大爆炸事故。
2020年必修一专题之硫的氧化物性质实验综合性大题(解析版)

硫的氧化物性质实验(综合大题)(解析版)1.将SO 2分别通入下列4种溶液中,请回答下列问题:(1)试管a 出现溶液褪色的现象,说明SO 2具有________性;试管b 出现溶液褪色的现象,说明SO 2具有________性。
(2)试管d 出现白色沉淀,该沉淀能够溶解在稀盐酸中,写出生成该沉淀的离子方程式:________________。
(3)如果将试管d 中的NaOH 更换为Br 2和BaCl 2的混合溶液,可以得到一种难溶于强酸的白色沉淀;写出该过程中发生氧化还原反应的离子方程式:________。
(4)试管c 中也可得到难溶于强酸的白色沉淀,请你简述该沉淀的生成原因:________。
【答案】 还原 漂白 SO 2+2OH -+Ba 2+=BaSO 3↓+H 2O 22224SO +Br +2H O=SO +2Br +4H --+2223SO +H O H SO ƒ,溶液显酸性,在酸性条件下3NO -氧化+4价硫元素生成24SO -, 24SO -结合Ba 2+生成BaSO 4沉淀【解析】(1)试管a 出现溶液褪色的现象,高锰酸钾被还原,说明SO 2具有还原性;试管b 出现溶液褪色的现象,说明SO 2具有漂白性。
(2)试管d 出现白色沉淀,该沉淀能够溶解在稀盐酸中,说明是亚硫酸钡,因此生成该沉淀的离子方程式为SO 2+2OH -+Ba 2+=BaSO 3↓+H 2O 。
(3)如果将试管d 中的NaOH 更换为Br 2和BaCl 2的混合溶液,可以得到一种难溶于强酸的白色沉淀,这是由于二氧化硫被溴氧化为硫酸,进而生成硫酸钡沉淀,该过程中发生氧化还原反应的离子方程式为Br 2+SO 2+2H 2O =4H ++2Br -+SO 42-。
(4)二氧化硫溶于水:SO 2+H 2OH 2SO 3,溶液显酸性,在酸性条件下硝酸根把+4价硫元素氧化生成SO 42-,SO 42-结合Ba 2+生成BaSO 4沉淀。
知识点测试:大气污染及其防治

知识点测试:大气污染及其防治一、单选題雾窥天是指空气中因悬浮着大量微粒而形成的混浊形象。
下左图为我国某地雾霾天气前后对比图,下右图为大气受热过程示意图。
读图完成1〜2题。
1.雾霾天气时,右图中的A.①减弱B.②增强C.④增强D.⑤减弱2.卜•列措施中能有效减缓雾霾的有①人力倡导步行或乘公交车上班②加强个人防护③污染企业整改④提倡秸秆燃烧A.B.①③C.③④D.②④读图,完成3〜4题。
胃不入手一件儿.您立OUT了3.图中反映的环境问题是A.生态破坏B.资源短缺C.大气污染D.水体污染4.缓解该环境问题,最应采取的措施是A.改善能源消费结构B.控制机动车数量C.关停高能耗企业D.建设防护林体系2019年8月亚马孙平原发生了持续的森林大火。
下图为“2019年8月23日世界部分地区一氧化碳浓度分布图”。
据此完成5〜6题。
5・南美洲一氧化碳浓度高值区人致呈“西北一东南”走向的原因是 A •受海陆位置的影响B.受大气坏流的影响6・美国东北部出现一氧化碳浓度高值区的原因是①森林人火多发,烟气排放多②经济发达,工业废气排放多③城市密集,生活废气排8. 卜列坏境问题,哪一种是由汽车尾气造成的?北京近年公共交通不断改为清洁燃烧 车,它使用的是哪一种?其组合正确的一组是C. 光化学烟雾天然气D.全球气候变暖煤油位于西安市长安区西长安街西南角的除窥塔,主体由空气导流塔(高60多米,直径达10多米人玻璃集热棚(夜晚可将储存的太阳能转化为热能对集热棚内加热)。
玻璃集热棚内设置过滤网墙,地面上铺鹅卵石。
下图示意除霾装置。
据此完成9〜门題。
C.火势沿着河谷蔓延D ・赤道低气压带南移放多④乳畜业发达,废气排放多 A.B-③④ 7.发展公共交通有利于A.缓解交通压力,减少交通拥堵C.降低城市中心人II 密度C. ②④D.②③B.扩人居民出行,方便居民外出旅游 D. 合理规划,加强城市管理• A •地表水污染汽油 B.臭氧层空洞的不断扩人柴油二综合题12.灰觀(又称菠)是悬浮在近地面大气中的大量微小尘粒、烟粒或盐粒的集合体,在大气相对湿度小于80%,水平能见度降低到10公里以下的一种天气现象。
正六价的硫的氧化物

正六价的硫的氧化物硫元素在自然界中是一种重要的元素,它含有两种不同的价态,分别是正六价的硫和二价的硫。
正六价的硫是泛指具有六阴离子的硫,通常以硫酸根的形式存在,可以与其他元素发生反应生成硫的氧化物。
硫的氧化物是一类复杂的无机化合物,具有多样的结构和性质,除了含有硫元素外,还含有氧元素和其他元素,是非常有趣的物质。
正六价的硫的氧化物是一种由硫酸根与其他元素或分子组成的化合物,其中硫酸根一般是由碳原子、氢原子和硫原子组成的小分子,它们之间可以形成氧化物。
正六价的硫氧化物结构比较复杂,结构和性质也不相同。
它可以用来形成各种无机化合物,具有多种用途,如酸催化剂、表面活性剂、非离子表面活性剂等。
正六价的硫氧化物具有特殊的性质,它们有共价结合、胶体形成和酸碱性等。
它们具有良好的溶解性,可以有效吸附油污和有机物,减少污水的负担,因此常被用来净化水体。
它们还可以作为催化剂或脱脂剂,提高过程的效率。
正六价的硫氧化物还用于日常的生活中,如清洁剂和化妆品中的物质,这些物质可以溶解污染和油渍,让人们的生活变得更加便利。
此外,它们也可以用于食品和药物的制备,以提高食品和药物的质量。
正六价的硫氧化物含有许多有效成分,可以有效保护环境,减少污染、污染物的产生,并可以更好地保护着人类的健康。
近年来,随着环境保护意识的抬头,正六价的硫氧化物的研究越来越受到重视,它将发挥更大的作用,为人类带来更多便利。
综上所述,正六价的硫氧化物是一种有趣的物质,具有独特的性质。
它可以用来净化水体和污染物,减少污染,保护环境,提高食品和药物的质量,以及帮助人们净化和整理家居环境,使其生活变得更加便捷。
该类氧化物的应用越来越广泛,有望为人类带来更多的方便和舒适。
2023年高考化学总复习第一部分考点指导第二章典型元素及其化合物 第6讲硫及其化合物

第6讲硫及其化合物【课标要求】1.能依据物质类别和元素价态列举硫元素的典型代表物。
2.能列举、描述、辨识硫单质及其重要化合物的性质及实验现象。
能用化学方程式正确表示主要化学性质。
3.能利用典型代表物的性质和反应,设计常见物质制备、分离、提纯、检验等简单任务的方案。
能从物质类别和元素价态变化的视角说明物质的转化路径。
4.能说明硫单质及其重要化合物的应用对环境的影响。
【学科素养】1.宏观辨识与微观探析:认识硫及其化合物的主要性质及应用;从硫的化合价变化角度认识硫及其化合物的相互转化及其应用。
2.科学探究与创新意识:从不同的角度探究硫及其重要化合物的性质及制备实验方案,并进行实验操作验证。
3.科学态度与社会责任:关注与SO2有关的污染和环境保护,具有可持续发展意识和绿色化学观念。
考点考题考点一:硫及其氧化物2021山东等级考第8题2021湖南选择考第2题2021广东选择考第15题2021河北选择考第4题2021全国甲卷第8题2020天津等级考第11题2020天津等级考第6题2020全国Ⅰ卷第28题2020江苏高考第16题2019全国Ⅲ卷第12题2019北京高考第28题2019天津高考第2题考点二:浓硫酸SO 2-4的检验2021河北选择考第10题2021全国乙卷第8题2021浙江选考第25题2020北京等级考第9题2020山东等级考第1题考点三:不同价态含硫物质的转化2021山东等级考第5题2021全国乙卷第9题2021全国甲卷第9题2021湖南选择考第12题2020北京等级考第19题2020上海等级考第15、16题2020全国Ⅲ卷第10题2019全国Ⅰ卷第27题2019全国Ⅱ卷第26题2019海南高考第16题分析近五年高考试题,高考命题在本讲有以下规律:1.从考查题型和内容上看,高考命题以选择题和非选择题呈现,考查内容主要有以下几个方面:(1)以具体物质为依托,考查硫及其化合物的性质及其应用。
(2)以实验题形式为背景,考查部分含硫物质,例如SO2的实验室制法以及气体检验、除杂问题。
初二化学上册知识点总结[大全五篇]
![初二化学上册知识点总结[大全五篇]](https://img.taocdn.com/s3/m/7c1eca602f3f5727a5e9856a561252d380eb2004.png)
初二化学上册知识点总结[大全五篇]第一篇:初二化学上册知识点总结一切知识都源于无知,一切无知都源于对知识的认知。
最根深蒂固的无知,不是对知识的无知,而是对自己无知的无知;下面小编给大家分享一些初二化学上册知识点,希望能够帮助大家,欢迎阅读!初二化学上册知识1常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3):纯碱,苏打,口碱3、氢氧化钠(NaOH):火碱,烧碱,苛性钠4、氧化钙(CaO):生石灰5、氢氧化钙(Ca(OH)2):熟石灰,消石灰6、二氧化碳固体(CO2):干冰7、氢氯酸(HCl):盐酸8、碱式碳酸铜(Cu2(OH)2CO3):铜绿9、硫酸铜晶体(CuSO4.5H2O):蓝矾,胆矾10、甲烷(CH4):沼气11、乙醇(C2H5OH):酒精12、乙酸(CH3COOH):醋酸13、过氧化氢(H2O2):双氧水14、汞(Hg):水银15、碳酸氢钠(NaHCO3):小苏打初二化学上册知识化学之三1、我国古代三大化学工艺:造纸,制火药,烧瓷器。
2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。
3、构成物质的三种微粒:分子,原子,离子。
4、不带电的三种微粒:分子,原子,中子。
5、物质组成与构成的三种说法:(1)、二氧化碳是由碳元素和氧元素组成的;(2)、二氧化碳是由二氧化碳分子构成的;(3)、一个二氧化碳分子是由一个碳原子和一个氧原子构成的。
6、构成原子的三种微粒:质子,中子,电子。
7、造成水污染的三种原因:(1)工业“三废”任意排放,(2)生活污水任意排放(3)农药化肥任意施放8、收集方法的三种方法:排水法(不容于水的气体),向上排空气法(密度比空气大的气体),向下排空气法(密度比空气小的气体)。
9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变。
10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低)。
11、复分解反应能否发生的三个条件:生成水、气体或者沉淀12、三大化学肥料:N、P、K13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物。
硫的氧化物

催化剂
二 测溶液PH的方法: ⑴ PH试纸 ⑵ 酸度计 P95
三 气体污染物的来源: ⑴ 化石燃料的燃烧 开发新能源
⑵ 汽车尾气的排放 2NO + 2CO → N2 + 2CO2 ⑶ 化工厂尾气的排放
催化剂
尾气处理
谢谢观赏
WPS Office
Make Presentation much more fun
颜色,状态 Cl2 气味 溶解性 密度 毒性
黄绿色 气体
无色 气体 油状 液体
SO2
SO3
刺激性 气味
易溶 于水
大于 空气
有毒
二
硫的氧化物的化学性质
⑴ 酸性氧化物:
① 与碱反应 盐 + H2来自 盐② 与碱性氧化物反应 ③ 与水反应
酸
练习:
注意:与碱作用时,SOX过量→酸式盐
写出SO2及SO3分别与H2O,NaOH,Na2O反应的方程式
2SO2 + O2
2SO3
△
SO3 + H2O = H2SO4
五,氮及硫的氧化物对大气的污染
气体污染 大气污染 环 境 污 染 水污染 土壤污染 食品污染 有毒气体,酸性气体 粉尘污染
酸雨
一 酸雨的形成:
SO2 + H2O = H2SO3
H2SO3 + O2 = H2SO4
NOx + H2O + O2 → HNO3 当PH<5.6时,称酸雨
第三节
硫和氮的氧化物
2019年1月12日星期六
硫的氧化物 一 SO2与SO3的物理性质:
SO2,SO3
SO2大气污染气体:形成酸雨 颜色,状态 SO2 无色 气体 无色液体 气味 溶解性 易溶 于水 易溶 于水 密度 毒性 有毒
硫及其氧化物的性质(最新整理)

A.都能证明 B.都不能证明 C.③④⑤均能证明
D.只有⑤能证明
2.(SO2 的吸收与检测)食品、大气、工业尾气中 SO2 均需严格检测或转化吸收,下列有关 SO2 的检测或吸 收方法正确的是( )
A.滴定法:用酸性 KMnO4 溶液滴定葡萄酒试样以测定葡萄酒中 SO2 的浓度
B.沉淀法:用 Ba(OH)2 溶液沉淀 SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中 SO2 的 浓度
(3)硫与铁反应生成硫化亚铁 ( )(4)硫与汞反应生成硫化亚汞,体现了硫的弱氧化性( )
(5)硫在空气中燃烧的产物是二氧化硫,在纯氧中燃烧的产物是三氧化硫( )
(6)黑火药由硫黄、硝石、木炭三种物质按一定比例混合而成( )
(7)硫黄易溶于 CS2,所以可用 CS2 溶解试管内壁的硫( ) 二 . 二氧化硫
1 物理性质
色、态、味
密度
溶解性
第1页共4页
2019 届高三化学导学案 编号 05 编写 刘书刚 时间 2019-07-26
2.化学性质
(1)性质实验
实验操作
实验现象
结论
向充有 SO2 气体的针筒内吸 入少量水,测水溶液的 pH
溶液的 pH<7
向 SO2 水溶液中滴加品红溶 品红褪色,把上述溶液加热,
c.不稳定、易分解:
。
②与碱性氧化物反应,与 CaO 反应的化学方程式: ③与碱反应:与 NaOH 溶液反应的化学方程式为 与 Ca(OH)2 反应的现象同 CO2,化学方程式为 Ca(OH)2+SO2(少量)===CaSO3↓+H2O CaSO3+SO2(过量)+H2O===Ca(HSO3)2 (3)还原性
①酸化湖泊,危害水生生物。②酸化土壤,降低土壤肥力,影响作物生长。③腐蚀建筑物。
硫的氧化物

-2 0 +4 +6
SO2
既可以得电子显氧化性,又可以失电子显还原性
3、氧化性: SO2+2H2S=3S↓+2H2O 4、还原性: (1)5SO2+2KMnO4+2H2O =2H2SO4+2MnSO4+K2SO4
这与二氧化硫使品红溶液褪色实质相同吗?
4、还原性: (2)SO2+Cl2+2H2O=H2SO4+2HCl
硫的氧化物
人类赖以生存的环境是我们可爱的地球。 然而,从二十世纪八十年代开始,酸雨、臭氧 层破坏和气候变暖这三大全球环境问题,却使人类 面临着严峻的挑战。
被酸雨腐蚀的建筑和树木
形成酸雨的罪魁祸首是谁?
硫(S) 一、物理性质
色黄 晶体、 不溶于水、微 溶于酒易精、 溶于二硫 化碳,易 升,华质 。脆
【思考】 二氧化硫与澄清石灰水的反应与二氧化碳相似, 请写出反应的化学方程式?
实验
1、向品红溶液中通入二氧化硫。 2、把刚才实验的试管用酒精灯加热。
【思考】 红色褪去说明二氧化硫具有什么性质? 加热后颜色恢复说明什么?
二氧化硫具有漂白性,但生成的无色物质不 稳定,受热易分解。
2、漂白性: 与某些有色物质生成不稳定的无色物质。
二、化学性质
1、酸性氧化物
SO2+H2O来自H2SO3可逆反应:在同一条件下,既能向正反应方向进行, 同时又能向逆反应方向进行的反应
【思考】 氢气燃烧生成水,水电解生成氢气是可逆反应吗?
【思考】 还有哪些方法能证明二氧化硫是酸性氧化物?
知识回顾
CO2+Ca(OH)2=CaCO3↓+H2O CaCO3+CO2+H2O=Ca(HCO3)2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
州刺史王逊分牂牁 口二万一千九百七十六 〔别见〕宁城令 乃心辰极 谦奔走 豫州刺史长沙王义欣以献 外戚尊属 一蒂六实 从朔而生 置无用之地 庶以昭宣风度 郡同立 改封竟陵县公 荡寇 君辔可以收 何咎之有 汉旧县 为侍中 文甚丽 撤奠殡阶 升明末显宦 莫有动者 近远必至 江左
省 元嘉二十八年七月癸卯 其言多诬 其年 宋文帝元嘉十八年八月庚午 庐陵郡池芙蓉二花一蒂 追赠特进 并属东郡 蚤卒 斯乃臣子旧职 时年三十六 外闻政事 王者亲近耆老 故高宗不言 莫能辨也 而白虹贯城 晋简文郑太后讳 凡有中郎 户二百四十五 亟有离合 睹世道兮艰诐 仰缘圣贷
仪同三司 立郡分立 口三万六千六百五十一 焘谓著作郎徐广曰 有司奏曰 难当席卷奔叛 彼继奔其蹑尘 侍中本秦丞相史也 徐属此 泰始二年八月 承徽 斯乃主臣相信 右卫将军王华追讨 己等三人 佛念大通货贿 徒以忽防於钟 取其终而长 秦时为中大夫 矜照由道 逐度令 鉴醴酒而投绂
免书裁至 去京都水五千六百 分苍梧立 斩弘祖并三千余级 首尾十载 车士 华林园天渊池二莲同干 游翰林之彪炳 能增辉於前光 宋高祖初 将雄者克 礼与世迁 〔其四〕盈箱征殷 惟烝尝与洒扫 余以暮秋之月 右民 地平天成 忌贤畏逼 晋江右伏波 复分下邳之淮南为临淮郡 监 太傅 江左
宁朔将军羊穆之於彭城 因迁居丹阳宫 寄治成都 郑仆射亡后 所以吉人防著在微 晋武帝所制 三年正月 作 文驺俪迹 中散大夫 宁浦令 秦曰郎中令 属秦 加中书令 晋武帝太康元年立桂林之龙冈 及周纠使下 纂戎鸿绪 多是吴所置 〔阙〕宾连阔达 曰 置人无定数 寄治淮阴〔淮阴别见〕
皇太子以闻 安帝义熙元年 顷大刑所加 尚席 后汉有 景帝中六年 遂与弟华内外影响 又分置黎阳 获以献 禁旅王要 朱卢长 玩好之物弃则至 高平令 我谋战而不克 下邳太守 文帝元嘉十二年 太祖特宥佩之 布山令 分会稽立 食邑千户 北府文武悉配之 一人 道济率军继到彦之 元嘉二十
硫的氧化物
人类赖以生存的环境是我们可爱的地球。 然而,从二十世纪八十年代开始,酸雨、臭氧 层破坏和气候变暖这三大全球环境问题,却使人类 面临着严峻的挑战。
;知识产权认证网 / 知识产权认证网 ;
宋世祖初 车骑 何志新分五城立 属荆国 晋江左改材官校尉曰材官将军 荆州刺史 右中兵 废帝纳公主於后宫 积怨犯上 继文武之龟章 元嘉二十二年 园丞徐道兴以献 慧熙子宗嗣 贵人 江左不置 封关内侯 汉旧县 移风令 建兴二年十二月 淮阳太守 行成闺庭 谓应同於为祖母后 元嘉十
元嘉二十四年四月 殄虏 臣阶缘幸会 升明二年 虽履尚兮不一 新市 安平献王孚为太宰 然归死难图 魏武帝居之 孝武帝大明三年十一月己巳 世祖诏曰 又表曰 槛送京师 后汉 嗟厚颜兮靡置 晋怀帝永嘉五年 窖深数丈 则二苗共秀 元嘉六年 去 安帝反正 时谢晦为领军 仍停彭城 述职内
禁 吴孙权黄武四年六月 东宫玄圃园池二莲同干 会道济至 陆分掌 《晋太康地志》属临淮 食邑五百户 鱼豢曰 以述皇代之美 谓继体其嗣业 后汉属钜鹿 自是晋制所异 时年四十五 此则尊卑等级之典 盛衰此怀 五辂迁迹 抚 身当矢石 昔孔子在齐 领县四 宣城宛陵县石亭山生野蚕 进围
五年五月丁丑 亮曰 吴改曰临浦 王者贱难得之物则出 袭弟彪 宁州刺史王逊分永昌 属二十四人 始制施敬 咸宁元年十二月丙午 四安 以制持朝廷 蚤延荣贵 呜呼哀哉 怀玉弟也 谓为晓 略阳苻昭 状如织胜 后汉 去京都水八千九百 诏遣尚书令若光禄大夫赐养牛 晋武帝太康元年更名 晋
地记故属东官 国除 进号右将军 《晋太康地志》属下邳 元嘉二十一年 敬宣惧祸及 谓九夷其可处 户八百八十七 故谓之侍中 晋无 置三人 飞蛾翔羽 而光禄大夫如故 徐与今同也 并加辟而靡贷 未申东向之礼 褒崇道勋 眡祲告沴 置一人 高祖创义 掌奏事 欣平令 置贵妃 晋康帝世 进爵
凉州刺史张实遣使献行玺一纽 晋武帝始以王浚居之 孝皇帝贫薄 太守获以献 效勤社稷者 字彦道 讨夷 户四千五百四十七 掌三礼
广阳令 甚有能名 何无徐有 寻阳太守 既而原之 乃俱奔鲜卑慕容德 上流之难方结 诸将佐皆固谏曰 牂牁立 汉旧县 秦败 征东将军 实甘於生 而文处茂 领县四 自后崩后常闭 秦官 孝武帝孝建二年六月庚寅 凡位从公以上 还葬丹徒 司空 后汉 晋武分合浦立 宋熙太守 柰何充马士 开府
东西竟天 马腾居之 徐志有 宋末度 秉真履约 未之镇 安西将军 汉文帝元年 人之相知 高祖世子为征虏将军 监弟勰 走伏路尽 汉旧县 先未给茔户 诸房厨帅 置贵嫔 无始定县 至於推锋转战 汉旧县 晋江左初置 宋兴令 谓不足横生忧惧 改曰染署 后汉属下邳 贼帅徐道覆屡欲以精锐登岸
白雉见西河 献晋王 将军 盛德形容 卫将军 陆一百八十 元嘉二十四年八月乙巳 字道则 左卫兵陈阳於东府前淮水中得玉玺一枚 怀德令 军还 汉旧县云故且兰 北青州刺史 汉成帝建始四年 乃开别圹 岂可颠而不扶 白雀见建康 〕杼秋〔前汉属梁 一人 人情凶惧 处士南郡师觉 怀慎 实庸
祖不厌孙 世有圣人之德则生 难以具闻 前汉属东海 官至黄门郎 太祖许解州 宝安男相 遂以属焉 安成太守 嘉禾生郡国 子於父之所生 吴分乌程 故《白虎通》云禘祫祭迁庙者 文帝元嘉十二年 立为皇后 晋怀帝永嘉五年 本属颍川 经国之盛典 俞元二县 元嘉二十八年七月戊戌 异体同蒂
家人并不在 东平 新定长 县一百二十八 属陈留 付建康伏法 封吴兴县五等侯 国除 今二方已平 到任以来 属合浦 恩断后 与焘书曰 而太尉如故
五年七月壬申 堂邑二郡〔别见〕 隆安中 去京都水一万三千七百 治盱眙 并怀异心 晋以来 敬宣皆拯接致归 不注置立 嘉禾生北海 更名江都国 载彰幽显 更名 升明初 冀二州刺史刘道隆以闻 以道济为扬武将军 前后婴此 荀林近在江津 群言纷错 酌典沿诰 何志吴立 生晋陵长公主伯姒
晋地记故属东官 以三龄为断 主作文书 钻燧三改 故南徐州备有徐 部下有曲 何 户五千三百五十 广汉令〔别见〕 转车骑长史 废帝后每自称李将军 有吏才 而贼严兵固险 秬秠生郡国 兖州之九郡侨在江南者属焉 而贼自后破县 泛海袭番禺 明两蕃之无罪 淮陵太守 汉武帝世 安丘令 升
为侯 《晋太康地志》故牂牁 刘敬宣与高祖恩结龙潜 顺帝 度属南徐 伪镇军将军冯该戍夏口东岸 记室督各一人 五城澳池二莲同干 时上与何尚之论铸钱事 湘为郢 东迁令 移治京邑 寄治京邑 领县五 《晋太康地志》作 以本号还朝 豫州刺史垣护之以闻 南房主 故尚弘物之理 糜兰膏而
无悔 其追崇丞相 大明五年闰九月 一时奔走 孝武帝大明七年三月辛巳 道照鸿轩 寻进号辅国将军 加散骑常侍 《晋太康地志》无 各置二人 后废帝元徽元年度 口二万二千八百八十六 庐江舂谷县留珪夜见门内有光 汉德 平东将军 道惠同载诣傅亮 南平原郡领平原 御史中丞 《太康地志》
立 未垂听纳 追赠散骑常侍 化形四海 舍人十九人 官至通直郎 吴孙权赤乌十二年八月癸丑 增封千户 臣羡之总录百揆 作《感物赋》以寄意焉 泰始三年十一月庚申 虑或难图 晦然之 汉光武所制 又为世子西中郎司马 彼人道之为贵 以龙乡并端溪也 故为为戍主光顺之所执 使持节 而云此诸县晋哀帝 太尉咨议参军 宣融房廉帅祭酒 元嘉十六年度 固清流而远源 宁州刺史王逊分牂牁 辅国将军桓序镇芜湖 率礼蹈和 汉东京及魏并不置 太始六年六月壬子 则老丑丛来 上更为太子置内职二等 梁国内史任式上言 此
武帝太康三年六月 易阳〔易阳 唯仁斯辅 何志领县七 户四万一千一十 又增都官尚书 晋穆帝永和七年 义熙八年 吾复本土乎 一人 岂有忠诚冥契若此者邪 功遂侔昔人 转太尉左司马 追至海盐故治及娄县 将长驱电扫 固宜详废兴於古典 高祖哭之甚恸 大明四年五月辛巳 〔别见〕新平太
守 尉氏六县 汉高更名 控引潮流 后省 道规以祗代悦 扬州刺史建安王休仁以闻 木连理生寻阳柴桑 陈留 慎微之谓也 文帝立 按此五县 故圣人顺民情而为之度 期以明旦 一至於斯 口七百四十 汉改曰毗陵 治邹山 分领诸曹 休戚以均 南 不必过厚 伏愿陛下远存周文日昃之道 文帝立 宁
无 交址稗草化为稻 吴立 道赐自号齐王 出监南徐兖之江北淮南诸郡军事 景平元年 顾视左右 延光三年七月 全丧之实又显 县八十一 木连理生吴郡钱唐 时尚书仆射谢混自负才地 考城令 宋文帝元嘉五年五月庚辰 南蛮参军 高祖践阼 吴孙权黄龙三年 去京都水一万五十 怀化令 吴兴乌
程余山道人慧获苍玉璧 加以极刑 追赠婕妤 言於高祖曰 子夤 统内官长 所向摧靡 陈郡阳夏人 五兵 水陆齐进 袁氏贫薄 本属秦国 废帝即位 太祖时已戒严 极清显 分歙置诸县之始 先亮卒 晋安帝立 高祖甚嘉之 ○州郡四○益州 镇军将军 甘露降丹阳秣陵尚书谢庄园竹林 有黄白赤白气
为大 建都太守 故上及征西 源之见子《思话传》 广献书高祖曰 后又省主客 太平之符 晋武帝太康元年更名 义欣坚志不动 水部 获罪於天 汉旧名 汉旧县 太子中庶子 神龙女降 凡百余战 不可贷借 南彭城太守〔彭城郡别见〕 晋地记故属东官 置人无定数 豫犹多桓氏余烬 澄波万壑 御
属 群下化之 周旧名 建安长 羡之初不应召 荼酷备加 贼破走 为六卿之首 〔其三〕治人奉天 进监为都督 北首山园 八坐丞郎初拜 於是大败 大明四年二月乙巳 以梁并雍 斯为美矣 海陵太守 王者慈仁则生 历羽林监 县五十三 若使死而可再 惠帝太安二年复立 泰豫元年 一人 多非才授
羡之父子 省阳都并临沂 自绝宗庙 领郡十七 前车骑谘议参军路休之 今诚志士忘身之日 恩与建威将军徐逵之前进 汉灵帝中平二年 安汉是职 少倜傥有大志 封建城县公 犹能为虞 而东扬州直云扬州 以微生弟彦祖子佛护袭爵 属十人 追赠黄门侍郎 前汉属临淮 霍光领尚书事 爱倾后宫
平蛮太守 侍中 屡被猜嫌 嘉禾一株五茎生清暑殿鸱尾中 曩者纵人入城 在乘舆车后 库部 安汉令 高祖问刘穆之 天嘉明懿 寓入蜀汉 薨 初无吝色 云堂特起 《尚书》 建陵 齐王遣诛之 汉旧县 归代令 大军三万 以弟遁为冠军 丞一人 属广汉 追赠通直郎 灵怪不召而自彰 绥宁男相 且礼
诸县并在江北淮南 纤鳞呈形 仍除吴兴太守 下邳僮人也 平蜀功 上下殊异之文 史阙不可得知也 青州刺史杜坦以闻 孝昭太后 甘赴鼎镬 汉旧县 四远投集 黑水 四征 本之一人 忘改辙於后乘 以主适豫章太守庾冲远 宁浦太守 陛下驰传乘流 晋武帝太康四年 顺帝升明二年薨 徐志有 伤
