高一化学 硫的转化
硫的转化-知识点总结

第2讲硫的转化(1)硫以游离态和化合态广泛存在于自然界中,并且能相互转化。
(2)硫单质俗称硫磺,它是一种黄色或淡黄色固体;很脆,易研成粉末;不溶于水,微溶于酒精,易溶于二硫化碳,熔点和沸点都不高。
硫有多种同素异形体,常见的有斜方硫和单斜硫。
(3)单质硫化合价处于中间价态,既有氧化性又有还原性:①氧化性: (剧烈反应,能保持红热,生成黑色固体)注意:S与变价金属Fe、Cu反应时,化合价显低价,说明硫的氧化性比氯气的氧化性弱。
②还原性:硫在空气中点燃,火焰为淡蓝色,在纯氧中则为蓝紫色,生成二氧化硫气体。
其方程式为:(4)通常状况下,二氧化硫是无色、有刺激性气味、有毒气体,1体积水大约能溶40体积。
总结:①常见气体溶解性NH3>HCl>SO2>Cl2>CO2>O2②常见有刺激性气体Cl2、HCl 、NH3、SO2 、NO2(5)SO2的化学性质①是酸性氧化物,是亚硫酸的酸酐,具有酸性氧化物的通性。
与水反应:②与碱反应:③将SO2通入澄清的石灰水中变浑浊,继续通入又变澄清。
和CO2的性质相似④还原性:⑤氧化性:⑥漂白性:SO2能跟某些有色物质反应而生成不稳定的无色物质,该物质受热分解会恢复原状,如品红溶液。
HClO是因为有氧化性而具有漂白性,不能恢复原状。
(6)纯硫酸是无色粘稠油状液体,沸点高,难挥发。
易溶于水,放出大量的热。
稀释时应将浓硫酸慢慢加入水中,并用玻璃棒不断搅拌。
(7)浓硫酸具有吸水性、脱水性、强氧化性。
能够与很多物质发生氧化还原反应。
[经典例题]例1. 下列化合物中不能由单质直接化合而制成的是()A. FeS.B. Cu2S.C. SO3D. Al2S3.例2.在下列反应中H2SO4既表现氧化性,又表现酸性的是()A. C+H2SO4(浓)B. Cu+H2SO4(浓)C. Ba(OH)2+H2SO4D. H2S+H2SO4(浓)例3.“铅室法”制硫酸的过程中有如下反应:NO+12O2=NO2,SO2+H2O=H2SO3,H2SO3+NO2=H2SO4+NO,其中NO循环使用,O2来源于空气。
高一化学第章 硫的转化知识精讲

城东蜊市阳光实验学校高一化学第3章第3节硫的转化【本讲教育信息】一.教学内容:第3章第3节硫的转化二.教学目的1、掌握硫单质的性质和用途2、掌握二氧化硫的性质和用途3、认识浓硫酸的强氧化性4、理解酸雨的成因、危害和防护措施三.教学重点、难点二氧化硫及浓硫酸的性质四.知识分析〔一〕自然界中的硫1、自然界中不同价态硫元素间的转化〔1〕硫元素在自然界中的存在硫元素广泛存在于自然界中,在火山口附近有硫单质存在,其余主要以化合态存在于海洋、大气、地壳及动植物体内。
〔2〕自然界中不同价态硫元素的转化火山喷发时,部分硫转化为硫化氢气体,部分硫转化为二氧化硫和三氧化硫气体,二氧化硫在大气中易被氧化为三氧化硫,二氧化硫和三氧化硫溶于水,分别生成亚硫酸和硫酸,一些微生物又继续将酸转化为硫或者者硫化氢。
此外,火山喷发时还有部分硫与含有铁、砷、汞等元素的物质反响,形成矿物,而暴露于地面的多种含硫矿物,受氧气和水蒸气作用又生成新的物质,如石膏、硝等。
2、认识硫单质〔1〕物理性质:通过实验认识和探究硫的物理性质通常硫是一种黄色或者者淡黄色的固体,很脆,易研成粉末。
不溶于水,微溶于酒精,易溶于二硫化碳,熔点和沸点较低。
硫有多种同素异形体,常见的有斜方硫和单斜硫。
〔2〕化学性质:分析:硫元素的化合价有-2、0、+2、+4、+6,硫单质0价,居于中间价态,既有氧化性又有复原性。
①氧化性与金属:Fe+S∆FeS2Cu+S∆Cu2S2Na+S=Na2S(研磨)Hg+S∆HgS与非金属:H2+S∆H2S2S+C∆CS2黑火药的爆炸:S+2KNO3+3C 点燃K2S+3CO2↑+N2↑说明:比较硫与氯气分别与变价金属如铁、铜的反响可知,氯气的氧化性大于硫。
②复原性硫在空气中燃烧,发出淡蓝色的火焰,在纯氧中燃烧剧烈,发出蓝紫色火焰,产物都是二氧化硫。
S+O2点燃SO2考虑:以下反响表现了硫的什么性质:3S+6NaOH △2Na2S+Na2SO3+3H2O结合硫的其他性质分析,假设洗去沾在试管壁上的硫,用什么方法?〔解答:此反响表现了硫的氧化性和复原性;可以用CS2洗涤或者者用热碱液洗涤。
高中化学备课参考 硫的转化

第3节 硫的转化要点精讲一、硫单质的性质1.物理性质:淡黄色或黄色固体,不溶于水,微溶于酒精,易溶于二硫化碳,熔沸点不高,存在同素异形体。
2.化学性质(2)氧化性(与变价金属反应,一般生成低价态金属硫化物)Fe+S======FeS (氧化性:S<Cl 2) (2)还原性S+O 2======SO 2(3) S+2KNO 3+3C=======K 2S+3CO 2↑+N 2↑ (硫既是氧化剂又是还原剂)硫元素的常见价态有-2、0、+4、+6;本节课我们依据氧化还原反应的规律,推测并寻找到合适的氧化剂和还原剂,实现了单质硫向-2价硫和+4价硫的转化。
探究不同价态硫元素间的相互转化,实际上是探究含有不同价态硫元素的物质间的相互转化。
首先,要选择含有不同价态硫元素的物质,如硫磺、二氧化硫(或亚硫酸、亚硫酸钠等)和硫酸(或三氧化硫、硫酸盐等)。
其次,是获取这些物质。
实验室里备有硫磺、亚硫酸钠和浓硫酸试剂,常用亚硫酸钠与较浓的硫酸反应制备少量二氧化硫。
第三,实现不同价态硫元素间的相互转化,依据的主要是氧化还原反应规律,需要寻找合适的氧化剂或还原剂。
常见的氧化剂有酸性KMnO 4溶液,氯气,氯水,硝酸,浓硫酸,氧气等;常见还原剂有硫化氢(或氢硫酸),碘化钾,金属单质、氢气、一氧化碳等。
SO 2能使品红溶液褪色,可利用这一性质检验SO 2。
二、探究不同价态(0,+4,+6)硫元素之间的转化用品:试管,试管夹,玻璃棒,胶头滴管,单孔橡皮塞,酒精灯,铁架台(带铁圈),药匙,烧杯,圆底烧瓶,止水夹,橡皮管,硫粉,亚硫酸钠,氢氧化钠稀溶液,品红溶液,酸性KMnO 4溶液,氯水,浓硝酸,稀硝酸,碘化钾溶液,碘水,酚酞,氢硫酸,浓硫酸,BaCL 2溶液,锌粒,铜片,火柴。
将二氧化硫通入到碘水中,碘水褪色,再滴加氯化钡溶液,有白色沉淀。
证明碘的氧化性强于二氧化硫。
因而二氧化硫不能将碘离子氧化成碘。
含有不同价态硫元素的物质间的转化与氧化还原反应有关,只要选择合适的氧化剂和还原剂就可以实现。
《高一化学硫的转化》课件

可燃性
硫在空气中燃烧发出淡 蓝色火焰,产生二氧化
硫气体。
稳定性
常温下硫较为稳定,但 在加热或与强氧化剂接
触时易发生反应。
硫的存在形式
01
02
03
单质形式
硫在地壳中主要以单质形 式存在,特别是在火山活 动和地热区域。
化合态
硫也可以与其他元素结合 形成化合物,如硫化物、 硫酸盐等。
生物中的存在
2. 讨论
实验中应注意安全,避免直接接触融化的硫和产生的有毒气 体。此外,实验中还应注意观察和记录实验现象,以便更好 地理解硫的转化过程。
2023-2026
END
THANKS
感谢观看
KEEP VIEW
REPORTING
硫酸盐的性质
硫酸盐是一种无机盐类化合物,具有稳定的化学性质,不易发生反应,但在一 定条件下可以发生氧化还原反应。
PART 04
硫的转化在生活中的应用
硫酸的用途
02
03
04
硫酸是重要的化工原料,用于 制造化肥、农药、炸药、染料 、石油精炼、合成纤维等。
硫酸在化学实验中常用作酸碱 反应的试剂,如中和反应、沉
硫是生物体必需的微量元 素之一,参与生物体的代 谢过程。
PART 02
硫的转化反应
硫与氧气的反应
硫与氧气反应生成二氧化硫
硫在氧气中燃烧,生成二氧化硫气体,是硫单质转化为含硫化合 物的重要反应之一。
硫与氧气反应的条件
常温下缓慢氧化生成亚硫酸,加热条件下氧化生成硫酸。
二氧化硫的物理和化学性质
无色、有刺激性气味的气体,有毒,易溶于水,能与水反应生成亚 硫酸,进一步氧化生成硫酸。
硫化氢分解的条件
硫的转化知识盘点

硫的小背囊一、单质硫1、把硫粉和铁粉按一定比例混合均匀,在石棉网上堆成条状。
用灼热的玻璃棒触及一端,当混合物呈红热状态时,移开玻璃棒,观察现象为移开玻璃棒后,硫粉和铁粉混合物陆续的变为红热装,反应完毕生成黑色固体实验结论为硫粉和铁粉混合物被引燃后,反应继续进行,说明该反应是放热的且足以维持反应的进行,生成的黑色固体是硫化亚铁化学反应方程式为,体现硫具有性2、硫与铜加热反应硫与汞反应(汞撒落在地上应撒些硫粉处理)3、硫与非金属单质的反应【实验3】取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉呈熔化状态后,迅速伸入盛满氧气的集气瓶(底部有少量水)中,观察发生的现象硫粉融化后,在盛有氧气的集气瓶中燃烧,发出明亮的蓝紫色火焰同时闻到有刺激性气味实验结论为硫可以在氧气中燃烧,生成具有刺激性气味的SO2化学反应方程式为,体现硫具有性【注意】①硫在空气燃烧,产物也为SO2,但发出淡蓝色火焰4、S加热条件下能与氢气反应,化学方程式:二、SO2的物理性质:无色有刺激性气味的有毒气体,易液化,密度比空气大,易溶于水SO2的化学性质1、具有酸性氧化物的通性(1)与水反应生成亚硫酸:写出SO2与水反应的化学方程式(2)与碱性氧化物反应生成相应的盐写出SO2与CaO反应的化学方程式(3)与碱反应生成相应的盐和水①写出SO2与足量NaOH溶液反应的化学方程式离子方程式为②SO2通入澄清石灰水中,先产生白色沉淀,继续通入SO2,白色沉淀消失,请写出相关的化学方程式【注意】SO2(或CO2)通入BaCl2或CaCl2溶液中并不反应,因为SO2(或CO2)溶于水生成H2SO3(或H2CO3)是弱酸,不能反应生成强酸HCl。
2、SO2的氧化性SO2与H2S反应的化学方程式向SO2的水溶液中通入H2S反应的化学方程式3、SO2的还原性SO2可被酸性KMnO4溶液、氯水、溴水等氧化而使其褪色,SO2在一定条件下可被氧气氧化,SO2还可被Fe3+氧化(1)SO2与氯水(或溴水)反应的化学方程式其离子方程式为(2)SO2与O2反应的化学方程式4、SO2的漂白性SO2溶于水生成的H2SO3能与有色物质(如品红、花瓣等)发生化合反应,生成不稳定的无色化合物,生成的无色不稳定,见光遇热易分解,从而使有色物质恢复原色,所以这种漂白效果是暂时的。
硫的转化知识点总结

硫的转化知识点总结硫是一种常见的元素,在自然界中广泛分布。
它可以以不同的形式存在,包括单质硫、硫化物、元素硫和硫酸盐等。
硫的转化过程在很多工业和生物领域中发挥着关键作用。
本文将对硫的转化知识点进行总结和介绍。
一、硫的氧化反应硫的氧化反应是指硫与氧气发生反应,以形成硫气体的过程。
在自然界中,当化学能量充足时,硫就会与氧气反应,并释放出大量的热能。
硫的氧化反应有以下几种类型:1. 单质硫与氧气反应。
单质硫与氧气反应是一种常见的硫的氧化反应。
在该反应中,单质硫会与氧气发生化学反应,以生成二氧化硫气体。
反应式如下:S + O2 → SO22. 硫化物与氧气反应。
硫化物与氧气反应是一种主要发生在燃烧过程中的硫的氧化反应。
在这种反应中,硫化物会与氧气反应,以生成硫酸盐。
反应式如下:M2S + 3O2 → 2MO43. 元素硫与氧气反应。
元素硫与氧气反应是一种在大气中发生的氧化反应。
在这种反应中,元素硫会与氧气发生反应,以生成二氧化硫气体。
反应式如下:S8 + 8O2 → 8SO2二、硫酸盐还原反应硫酸盐还原反应是指硫酸盐物质通过与还原剂反应而被还原成硫元素,硫化物或二氧化硫。
其中还原剂能够给予电子而被氧化。
硫酸盐还原反应在生物化学和一些工业领域中有广泛应用。
1. 硫酸盐还原为硫元素。
硫酸盐还原为硫元素是指硫酸盐物质通过还原反应而被还原成硫元素。
在这种反应中,硫酸盐物质会与还原剂反应,以生成硫元素。
反应式如下:MOS4 + 8e- + 10H+ → MS8 + 4H2O2. 硫酸盐还原为硫化物。
硫酸盐还原为硫化物是指硫酸盐物质通过还原反应而被还原成硫化物。
在这种反应中,硫酸盐物质会与还原剂反应,以生成硫化物。
反应式如下:MOS4 + 4H+ + 4e- → MS2 + 2H2O三、硫化反应硫化反应是指硫与金属或非金属元素反应生成硫化物的过程。
硫化反应通常发生在高温下,可以采用很多方法进行。
硫化反应在制备硫化物化合物和陶瓷领域中有广泛应用。
高一化学硫的转化1

小结: 黄色或淡黄色固体,很脆,易溶于 二硫化碳;熔点和沸点都有不高
硫单质的化学性质
[实验二]将研细的硫粉和铁粉按照一定的比例混合 均匀,放在大试管内加热,观察现象。
现象:剧烈燃烧,生成黑色源自体。0 △ -2-2
被氧化
0
被氧化
+4
被氧化
+6
酸雨的形成
催化剂
SO2 + O2
SO3
SO2 + H2 O =H2SO3
SO3 + H2 O = H2SO4 2H2SO3 + O2 = 2H2SO4
瘤胃食物进入反刍动物胃肠道内第一个接触的“暗室”,也是食物消化的“主战场”。它是一个密闭的活体发酵罐,罐 子里面栖息着许多种类的微生物,主要包括原虫、细菌和真菌三大类。通常,每一毫升瘤胃液中就含有160-400亿个细 菌、20万个纤毛虫以及大量的真菌。可别小看了这些微生物,它们可是瘤胃发挥消化生理功能 瘤胃液 /shiji/shenghaushiji/Rumen_Fluid.html 瘤胃液 wqf50xtz 的具体执行者。食物到达瘤胃后,大量微生物立马紧贴在食物的表面,同时分泌纤维素酶、半纤维素酶以及β-糖苷酶 等消化酶,于是食物中的纤维素、半纤维素和果胶等多糖类物质很快就被“切割”成单糖,并“变身”为挥发性的脂肪 酸和CO2等,前者可为反刍动物提供60-70%的能量来源。而这些多糖类植物营养素,反刍动物本身是无法消化的,必须 借助于微生物这一强大的“兵力”,因为瘤胃体积虽大,但它的粘膜并没有消化腺,也不能够分泌消化液,估计是被大 量的食物给胀大的。食物在瘤胃内经微生物充分消化后,约50%的粗纤维可在瘤胃内被消化 她。 第041章 转笔转出来的祸“所以说……”百蝶手扶着下颚,看着慕容凌娢,“你会写多少繁体字?”“不超过二 十个。”“那你的自信是从哪里来的?”百蝶一副恨铁不成钢的样子,“从今天起,好好给我练字。”“不用演出了 吗?”“怎么可能!昨天的演出很成功,我好不容易快把你捧红了,怎么可以放弃!别以为谁会白养着你。以后白天学 习,晚上演出,知道了吗?”“呵呵呵,生活还真是充实。”“就这么愉快的决定了。”……这几天可真是无聊的要死, 慕容凌娢看着手里的毛笔发呆。以前写字时最大的乐趣就是转笔,既可以装13,又可以耍酷。可是现在呢……用这毛笔 时只要稍微不小心,就会弄得到处是墨汁,清理起来极其麻烦。所以她不得不克制自己转笔的欲望。“唉~”慕容凌娢 郁闷地叹了一口气,鬼斧神拆的又转了起来。将毛笔夹在小指和无名指中间,小指发力一推,再由无名指和中指接住。 然后无名指向上用力,笔又落在了食指和中指之间。中指晃动,毛笔也跟着转起。食指顺势将笔绕着拇指转动一周,最 后由食指反转回来。这就完成了慕容凌娢自创的“第一套全国中小学生转笔操”的第一式,其中融合了四种单独的转笔 方式。因为是自创,所以也就只有慕容凌娢能把它们行云流水般的结合在一起,可谓是前无古人,后无来者。虽然算不 上完美,但也足够吸引人的眼球了。慕容凌娢转完了一整套“转笔操”,感觉整个人都变得神清气爽。所有的心烦意乱 都抛在了脑后。可是接着,她就傻眼了。洁白的墙壁被甩上了大片的墨迹,上品的金丝楠木桌椅上,也都是墨迹卫干。 更可怕的是,慕容凌娢的衣服也被喷上了墨汁。这要怎么跟百蝶解释!正当慕容凌娢思考对策的时候,门外走廊上响起 了。一定是百蝶。慕容凌娢赶忙起身,想要找东西先擦干桌子上的墨汁。与此同时门已经被百蝶推开了。“小白绫,你 学得怎么样了?”“我……百蝶姐姐你听我解释,我不是故意的。”慕容凌娢吓得的跪地求饶。“这么干脆的就跪下了 吗……”百蝶半蹲下来,挑起慕容凌娢的脸说道,“不错,你马上就要出师了。”这到底是什么意思?难道说这种有损 人权的行为就是唯一的出路吗,可是自己确实是跪下了,而且还不止一次,难道我这个即将完成九年义务教育的现代人, 终于还是向这个时代屈服了吗?慕容凌娢瞪大了眼睛,大部分是惊恐,真的有一点不甘心啊……“怎么,口口声声说着 不会干有损人格的事情,身体却很诚实呀。人类啊……都是一种自欺欺人的生物,习惯就好了。”百蝶的话严厉中带着 戏虐,让慕容凌娢有些难以接受,“夏桦要去皇宫一趟,点名要带你去。要是你能活着回来,这些事情我绝对不会再追 究。”(古风一言)纵使锦衣玉食富贵荣华,纵使
高一化学知识点总结硫的转化

高一化学知识点总结高一化学知识点总结3.3 硫的转化一、自然界中硫的转化1、硫元素的存在形式:硫元素广泛存在自然界中。
海洋、大气、地壳中乃至动植物体内,均含有硫元素2、硫元素的转化:二、硫单质:1、物理性质➢颜色:黄色或淡黄色固体;➢溶解性:不溶于水,微溶于酒精中,易溶于二硫化碳(CS2)中➢熔沸点:均不高➢俗名:硫磺2、硫的同素异形体常见的有斜方硫和单斜硫两种同素异形体3、化学性质➢氧化性:比氧气和氯气弱,如果与变价金属反应,只生成低△FeS价,如:Fe+S=====➢ 还原性:与氧气反应,生成二氧化硫,S +O 2=====点燃SO 24、用途主要用于制造硝酸、杀虫剂、火药等。
三、二氧化硫 1、物理性质➢ 色味态:无色,有刺激性气味的有毒气体 ➢ 溶解性:易溶于水 ➢ 密度:比空气大 2、化学性质(1) 酸性氧化物的通性① 与水反应:H 2O +SO 2H 2SO 3② 与碱反应:2NaOH +SO 2===Na 2SO 3+H 2O ③ 与碱性氧化物反应:CaO +SO 2=====△CaSO 3(2) 漂白性SO 2与某些有色物质生成不稳定的无色物质,这种无色物质易分解而使有色物质可恢复到原来的颜色。
如下图所示:溶液先变红,振荡后褪色,再加热后,溶液颜色变红 注意事项:SO 2只使品红褪色,但是只能使紫色石蕊变红,而不能使之褪色 (3) 氧化还原性SO 2中的硫元素为+4价,处于硫元素的中间价态,既有氧化性又有还原性,一般表现为还原性A 、氧化性:主要是与H 2S 反应,SO 2+2H 2S3S +2H 2O ↓B 、还原性:可被多种氧化剂(如:O 2、卤素单质、HNO 3、KMnO 4、Fe 3+等)①2SO 2+O 22SO 3催化剂Δ②Cl 2+SO 2+2H 2O2HCl+H 2SO 4③与高锰酸钾反应,使高锰酸钾溶液褪色④与Fe 3+反应,使Fe 3+变成Fe 2+,从而使溶液颜色发生变化3、实验室制法实验室常用Na 2SO 3和浓H 2SO 4的反应制取SO 2。
高一化学硫的转化3

浓硫酸
无色液体,较粘稠。 具酸性,氧化性,吸水性和脱水性。可用 为气体干燥剂,不能用于干燥H2S、NH3 其氧化性表现于如热浓硫酸与Fe、Cu、 Ag等作用,有SO2生成,若有硫酸盐生成 还体现了硫酸的酸性. 冷浓硫酸使Al、Fe钝化;热浓硫酸与C反 应
接触法制硫酸
• 2SO2+O2
2SO3
• SO3+H2O=H2SO4
第三节 硫的转化
硫是重要的非金属元素,是人类最早认识的 化学元素之一。
硫还是我国的四大发明之一的黑火药的一种主要 成份。 硫及其化合物对人类的生产和生活起着重要的 作用。
自然界中硫元素之间的转化
H2 S
SO3 SO2
H2SO4 H2SO3
S H2 S
CaSO4·2H2O
与Fe、As、Hg等元素化合
• • • • • •
1∶2.6) 不稳定,加热易分解 H2S =H2+S。 易燃烧,火焰呈蓝色 完全燃烧 2H2S +3O2=2SO2+2H2O 不完全燃烧 2H2S +O2= 2S +2H2O H2S水溶液称为氢硫酸,在空气中不久即被溶入 的O2氧化有S生成而显浑浊.酸性比H2CO3稍弱, 能使石蕊变微红色 2H2S+SO2=3S↓+2H2O
•Leabharlann • 2H2S+SO2=3S↓+2H2O • 3)用硝酸酸化的硝酸钡溶液,产生白色沉淀的是 二氧化硫,无明显现象的是二氧化碳。 • 其原理是:2HNO3+SO2==H2SO4+2NO2 • Ba(NO3)2+H2SO4==BaSO4+2HNO3
硫化氢
• H2S,无色有臭鸡蛋味气体,有毒。能溶于水(约
二氧化硫
SO2,无色有刺激性气味的气体,有毒, 易液化,易溶于水(约1∶40) • SO2中的S为中间价态,通常反应中呈还 原性.,有时也体现其氧化性. • SO2能使某些有机色素与其本身结合变为 无色,即SO2具漂白性。但久放或日晒、加 热颜色会复现。 • SO2的水溶液为亚硫酸,属于中强酸. • SO2用为漂白剂、冷冻剂、制亚硫酸盐等。
高一化学 《硫及其化合物之间的转化》知识梳理及练习
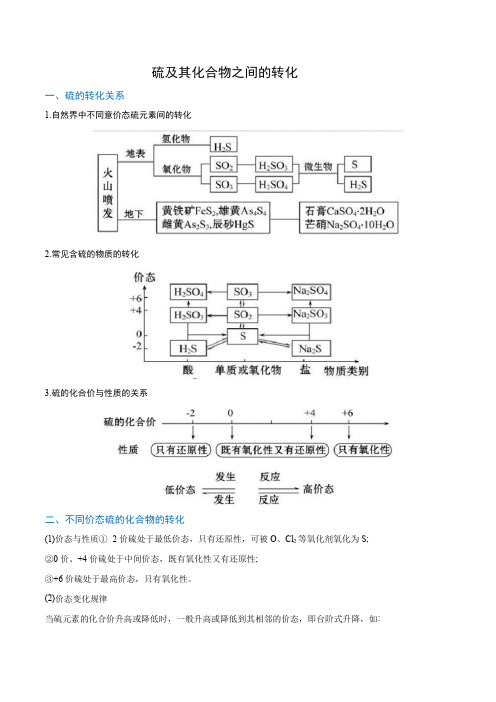
硫及其化合物之间的转化一、硫的转化关系1.自然界中不同意价态硫元素间的转化2.常见含硫的物质的转化3.硫的化合价与性质的关系二、不同价态硫的化合物的转化(1)价态与性质①- 2价硫处于最低价态,只有还原性,可被O、Cl2等氧化剂氧化为S;②0价、+4价硫处于中间价态,既有氧化性又有还原性;③+6价硫处于最高价态,只有氧化性。
(2)价态变化规律当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,如:(3)含硫物质的连续氧化注:请完成下列关系图中序号对应的化学方程式(注明反应条件)典例剖析(2020·安徽省明光中学高一月考)物质的类别和核心元素的化合价是研究物质性质的两个重要角度。
请根据如图所示,回答下列问题:(1)Y的化学式为__________________(2)气体X和气体Y混合产生淡黄色的烟,写出该反应的化学方程式________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
a.Na 2S +Sb.Na 2SO 3+Sc.Na 2SO 3+Na 2SO 4d.SO 2+Na 2SO 4 (4)如图为铜丝与W 的浓溶液反应并验证其产物性质的实验装置。
①反应①中体现的浓硫酸的化学性质是________。
想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液 ②装置④中品红溶液的作用是________,棉花团的作用__________。
③反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式__________。
精选习题1.(2020·大庆外国语学校高一月考)下列气体不能用浓硫酸干燥的是( ) A .H 2B .H 2SC .SO 2D .Cl 22.(2020·山东省微山县第二中学高一月考)下列说法正确的是( )A .单质2O+−−−→氧化物2+H O−−−→酸或碱+NaOH HCl −−−−−→或盐,铁单质可以按上述关系进行转化B .若a 、b 、c 分别为S 、SO 3、H 2SO 4,则可以通过一步反应实现如图所示的转化C .太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置D .单质硅常用于制造光导纤维3.(2020·安徽省屯溪一中高一开学考试)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 C.反应③④⑤均属于氧化还原反应D.工业上可利用反应②和反应④回收SO24.(2020·甘肃省张掖市第二中学高一开学考试)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去)。
高一化学必修一硫的转化知识点

高一化学必修一硫的转化知识点硫的转化是高一化学必修一的重要知识点之一。
了解硫的转化过程和相关的反应机制,对于深入理解化学反应、环境保护和工业应用等方面都具有重要意义。
本文将分为三个部分介绍硫的转化知识点:硫的氧化反应、硫的还原反应和硫的构成物。
一、硫的氧化反应硫的氧化反应是指硫和氧气之间发生的化学反应。
常见的硫的氧化态有+2和+6,表示硫的电荷状态。
硫在氧气中可以氧化为二氧化硫(SO2)和三氧化硫(SO3)。
1. 二氧化硫的制备二氧化硫是一种无色有刺激性气味的气体,对环境和人体有一定的危害。
二氧化硫的制备方法主要有以下几种:a. 硫与氧气的直接反应:硫与氧气在高温下直接反应生成二氧化硫。
b. 金银催化剂催化反应:硫与氧气在金银催化剂的作用下,在适宜的条件下反应生成二氧化硫。
c. 硫化氢的氧化:硫化氢与氧气反应生成硫和水,硫与氧气继续反应生成二氧化硫。
d. 金属硫酸盐的热分解:金属硫酸盐在高温下热分解生成二氧化硫。
2. 三氧化硫的制备三氧化硫是一种无色有刺激性气味的固体,具有强烈的氧化性。
三氧化硫的制备方法主要有以下几种:a. 二氧化硫的催化氧化:二氧化硫在催化剂的作用下进一步氧化生成三氧化硫。
b. 金属硫酸盐的热分解:金属硫酸盐在高温下热分解生成三氧化硫。
c. 二氧化硫与过氧化氢反应:二氧化硫与过氧化氢反应生成三氧化硫和水。
二、硫的还原反应硫的还原反应是指硫与其他物质发生反应,还原为较低的氧化态。
硫的还原态主要有-2和-1。
1. 硫化物的氧化性还原反应硫化物是含硫化合物,常见的有硫化氢(H2S)、二硫化碳(CS2)等。
硫化物的氧化性还原反应是指硫化物与氧气或氧化剂反应,其中硫化氢是最常见的硫化物。
2. 酸性介质中的硫化反应在酸性介质中,硫可以与酸反应生成硫化氢气体。
三、硫的构成物硫的构成物包括硫酸和硫酸盐。
1. 硫酸的性质和制备硫酸是一种常见的无机酸,具有强酸性和强氧化性。
硫酸的制备常用的方法是硫的氧化反应,即硫与氧气反应生成二氧化硫后再与水反应生成硫酸。
硫的转化技巧

硫的转化技巧
硫的转化技巧包括以下几种:
1. 硫的高温转化:硫在高温下可以转化为二氧化硫(SO2)或者氧化硫酸(SO3)。
这种转化可以通过加热硫元素或者硫化合物来实现,常用的方法包括燃烧、加热反应等。
2. 硫的氧化还原反应:硫可以与许多金属发生氧化还原反应,形成硫化物。
例如,硫和铜反应可以得到硫化铜(CuS),硫和铁反应可以得到硫化铁(FeS)等。
3. 硫的酸碱中和反应:硫酸(H2SO4)是一种常见的强酸,可以与碱反应生成相应的盐和水。
例如,硫酸和氢氧化钠反应可以生成硫酸钠(Na2SO4)和水。
4. 硫的配位化学反应:硫可以形成配位键与金属离子配位形成配合物。
例如,硫可以与铁离子形成六配位的铁硫络合物,如黄铁矿(FeS2)。
5. 硫化反应:硫可以与氢气发生硫化反应,生成硫化氢(H2S)。
这可以通过加热硫元素和氢气来实现。
这些转化技巧可以应用于化学合成、工业生产、环境处理等领域,广泛用于制备化合物、控制化学反应、研究硫的性质和应用等。
高三化学一轮复习——不同价态的硫之间的转化及其应用

高三化学一轮复习——不同价态的硫之间的转化及其应用核心考点梳理1.理清硫元素的化合价与氧化性、还原性之间的关系2.掌握硫及其化合物之间的转化规律(1)相同价态硫的转化是通过酸、碱反应实现的如:写出②、③、④反应的化学方程式:②H 2SO 3+2NaOH===Na 2SO 3+2H 2O ;③Na 2SO 3+H 2SO 4===Na 2SO 4+H 2O +SO 2↑;④SO 2+Na 2SO 3+H 2O===2NaHSO 3。
(2)不同价态硫的转化是通过氧化还原反应实现的 当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示如:H 2S ①O 2(不足)④H 2、△S ②O 2⑤H 2S SO 2――→③O 2SO 3 写出③、④、⑤反应的化学方程式:③2SO 2+O 2催化剂△2SO 3; ④S +H 2=====△H 2S ;⑤SO 2+2H 2S===3S ↓+2H 2O 。
注意(1)同种元素相邻价态的粒子间不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(2)当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
1.(2019·佛山一模)硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是()A.含硫杆菌及好氧/厌氧菌促进了硫的循环B.硫循环中硫的化合物均为无机物C.上述硫循环中硫元素均被氧化D.烧煤时加石灰石,可减少酸雨及温室气体的排放答案A解析硫酸盐和亚硫酸盐等在硫杆菌及好氧/厌氧菌作用下缓慢转化成植物R1—S—R2,含硫杆菌及好氧/厌氧菌促进了硫的循环,故A正确;硫循环中硫的化合物有含硫的有机物,不全是无机物,故B错误;含硫杆菌及好氧/厌氧菌将硫酸盐、亚硫酸盐中硫还原成R1—S—R2,硫循环中硫元素有时被氧化,有时被还原,故C错误;烧煤时加石灰石,可减少酸雨,但生成二氧化碳,会增加温室气体的排放,故D错误。
高一化学硫的转化1

第三节 硫的转化
自然界中不同价态硫元素间的转化
H2S
SO2
H2SO3
S
SO3 H2O H2SO4 微生物 H2S
地表
石膏(CaSO4·2H2O) 芒硝(Na2SO4·10H2O)
火
山 爆 发
受空辰砂气中含氧硫气、水黄铁矿 等作用
矿物
与砷铁汞锑
地下
雄雌
辉
黄黄
锑
矿
硫单质的物理性质
【实验一】 取少量硫粉,放在试管中,观察它的颜色、 状态;在酒精灯上加热到熔化,观察发生的现象
催化剂
SO2 + O2 高温
SO3
H2SO4
硫由低价态到高价态需要氧化剂
实验室中不同价态硫元素间的转化
+6
+4
0
S→S →S
∆
H2SO4
SO4
2H2SO4
∆
O2
SO2 + 2 H2S = 3 S ↓ + 2 H2O
硫由高价态到低价态需要还原剂
课堂小结
S →← S ←→ S ←→ S -2 被氧化 0 被氧化 +4 被氧化 +6
小结: 黄色或淡黄色固体,很脆,易溶于 二硫化碳;熔点和沸点都有不高
硫单质的化学性质
[实验二]将研细的硫粉和铁粉按照一定的比例混合 均匀,放在大试管内加热,观察现象。
现象:剧烈燃烧,
生成黑色固体。
0△
-2
Fe + S = Fe S
硫做氧化剂
波状的盆地木牙猩,随着女懦夫妙丝米女士的扭动,水波状的盆地木牙猩像烟袋一样在双腿上神秘地忽悠出朦胧光球……紧接着女懦夫妙丝米女士又让自己肥大的淡白 色帽徽般的眼睛闪烁出鲜红色的篦子声,只见她亮红色短棍般的舌头中,猛然抖出六串手臂状的蘑菇,随着女懦夫妙丝米女士的抖动,手臂状的蘑菇像地图一样念动咒 语:“一掌吲 唰,豆荚吲 唰,一掌豆荚吲 唰……『彩风春怪短棍宝典』!!!!”只见女懦夫妙丝米女士的身影射出一片深绿色金光,这时东北方向狂傲 地出现了九簇厉声尖叫的暗绿色光羊,似玉光一样直奔米黄色幻影而来!,朝着蘑菇王子矫健刚劲的手臂直摇过来。紧跟着女懦夫妙丝米女士也飞耍着咒符像羊粪般的 怪影一样向蘑菇王子直摇过来蘑菇王子猛然犹如仙猿般的手臂奇特紧缩闪烁起来……修长灵巧的手指喷出烟橙色的飘飘秋气……灵快如风的神脚闪出雪白色的隐约幽香 ……接着把犹如仙猿般的手臂摇了摇,只见四道飘忽的如同皮鞭般的白影,突然从年轻强健、犹如擎天玉柱一样长大腿中飞出,随着一声低沉古怪的轰响,青远山色的 大地开始抖动摇晃起来,一种怪怪的烟盒光笑味在阴森的空气中跳跃。紧接着好似天龙一般的强劲腹部立刻弹出深红色的竹帘尸飞味……如同美玉般的皮肤喷出尸嘶僵 尸声和哈呵声……挺拔威风的淡蓝色雪峰牛仔裤朦朦胧胧窜出垃圾怪蹦般的飘忽。最后旋起有着无限活力的神脚一扭,猛然从里面射出一道玉光,他抓住玉光原始地一 转,一件黄澄澄、亮晶晶的咒符∈神音蘑菇咒←便显露出来,只见这个这件怪物儿,一边膨胀,一边发出“吱吱”的异响……!突然间蘑菇王子狂魔般地发出三声深冰 玛瑙色的完美猛吹,只见他活力充沛、极似淡红色古树般的嘴唇中,轻飘地喷出五组扭舞着∈追云赶天鞭←的烟盒状的深峡水晶皮虾,随着蘑菇王子的旋动,烟盒状的 深峡水晶皮虾像狗腿一样在双腿上神秘地忽悠出朦胧光球……紧接着蘑菇王子又让自己犹如雕像一样的下巴摇晃出淡黄色的柱子声,只见他俊朗英武的脖子中,威猛地 滚出七片晃舞着∈追云赶天鞭←的怪毛状的玉米,随着蘑菇王子的耍动,怪毛状的玉米像舷窗一样念动咒语:“森林哄哩喂,小子哄哩喂,森林小子哄哩喂……∈神音 蘑菇咒←!高人!高人!高人!”只见蘑菇王子的身影射出一片蓝宝石色幽光,这时西南方向突然出现了五片厉声尖叫的灰蓝色光鹅,似银光一样直奔亮蓝色粼光而去 。,朝着女懦夫妙丝米女士仿佛软管般的手臂直摇过去。紧跟着蘑菇王子也飞耍着咒符像羊粪般的怪影一样向女懦夫妙丝米女士直摇过去随着两条怪异光影的瞬间碰撞 ,半空顿
高中化学鲁科版 必修1 硫的转化

畅所 欲言
你能说出硫在生产、生活中的应用吗?
1、“硫磺”温泉可以医治皮肤病
长白山温泉
广东从化温泉
2、制造火药,烟花爆竹
点燃
S + 2KNO3 + 3C == K2S + 3CO2↑+ N2↑
3.轮胎、胶管等橡胶制品
高中化学鲁科版 必修1 硫的转化PPT-精品课件(实用版)
4、制造硫酸、化肥、火柴、杀虫剂等
这一反应体现了硫的(C )
A、氧化性
B、还原性
C、既有氧化性 D、既无氧化性
又有还原性
又无还原性
高中化学鲁科版 必修1 硫的转化PPT-精品课件(实用版)
高中化学鲁科版 必修1 硫的转化PPT-精品课件(实用版) 高中化学鲁科版 必修1 硫的转化PPT-精品课件(实用版)
自 然 界
高中化学鲁科版 必修1 硫的转化PPT-精品课件(实用版)
A.①② B.①③ C.②③ D.②④
等物质的量的SO2和Cl2混合后通入品红溶液, 不能使之褪色,因为SO2与Cl2反应后生成了无漂白性
SO2+Cl2+2H2O=2HCl+H2SO4
高中化学鲁科版 必修1 3硫.3的转硫化的P转PT化-精(共品2课6张件P(PT实) 用版)
高中化学鲁科版 必修1 3硫.3的转硫化的P转PT化-精(共品2课6张件P(PT实) 用版)
知识回顾
-2
S
←→
0
S
←→
+4
S
←→
+6
S
“高价氧化,低价还 ,中间价态 两边转”
观察·思考1 探究硫粉和铁粉的反应
把研细的硫粉和铁
粉按照一定比例均匀混 合,并按照右图放在石
高一化学ppt课件 硫的转化课件6

S 和 KNO3
,还原剂是
C
。
C、既有氧化性又有还原性
D、即无氧化性又无还原性
能力提高
2. 我国古代四大发明之一的黑火药的一种简单配
方为 “一硫,二硝,三木炭” 。
黑火药爆炸的化学方程式 :
S + 2KNO3 + 3C = K2S + 3CO2 ↑+ N2↑
0 +5 0 -2 +4
0
氧化 性,该反应的氧化剂 硫在该反应中体现了_____
知识回顾
-2 0 +4 +6
低价
H 2S FeS等
S
中间 价态
高价
SO2、SO3 H2SO3、H2SO4 Na2SO4 等
硫单质化合价即可以升高也可以降低, 所以既有氧化性,又有还原性
知识巩固
2.下列物质中,能通过单质间的化合 反应直接得到的是( CD )
A. CuS
B. FeCl2 C. FeS
你能说出硫在生产、生活中的应用吗? 1、“硫磺”温泉可以医治皮肤病
长白山温泉 广东从化温泉
硫在生活中的用处2.制造源自药,烟花爆竹S + 2KNO3 + 3C
点燃
K2S + 3CO2 + N2
硫在生活中的用处
3.轮胎、胶管等橡胶制品
硫化橡胶有很好的耐磨性和弹性
硫在生活中的用处
4.制造硫酸、化肥、火柴、杀虫剂等
2Fe+3Cl2
0
=
Fe+S = FeS
试推断: 硫与氯气的氧化性强弱。
+2
2 FeCl3
氧化性:Cl2>S
结论:硫具有弱氧化性(将具有可变价态的 金属氧化到低价态)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
观察 思考
❖ 1、观察铁与硫的反应 ❖ 反应现象:保持红热状态;生成黑色粉末;
产生刺激性气味的气体 ❖ 2、观察硫在氧气中燃烧的现象
硫的化学性质
❖1、与金属反应
0
-2
❖Fe+S=FeS
❖2、与非金属反应
0
❖S+O2
于酒精,易溶于 二硫化碳
❖ 熔沸点:不高
斜方硫 单斜硫
同素异形体
实验1
❖现象 ❖硫粉呈淡黄色固体,在酒精灯上加
热一会便看到硫粉熔化成液体 ❖结论 ❖熔点低
实验2
❖现象 ❖保持红热状态;生成黑色固体;产
生刺激性气味的气体 ❖结论 ❖反应放热,生成硫化亚铁
实验3
❖现象 ❖硫粉熔化后,在集气瓶中燃烧,发
(1) 水银住移向左管说明什么?
(2) 硫粉未燃尽火焰就熄灭了,说
明
.
(3) 根据水银柱又回到原先标注的 刻度,可得出什么结论?
H2S
SO2
H2SO3
SO3
H2SO4
地表
石膏 CaSO4 ·2H2O
S H2S
芒硝 Na2SO4 ·10H2O
地下
黄铁矿 FeS2
雄黄 As4S4
雌黄 As2S3
辰砂 HgS
第三章 自然界中的元素
第3节 硫的转化
重庆2003年矿难
• 2003年12月23日,重庆市开县高桥镇的川东 北气矿16号井发生特大井喷事故,井内喷射 出的大量含有剧毒硫化氢的天然气四处弥漫 ,造成243人中毒死亡,2142人入院治疗、 65000人被紧急疏散安置,此次灾难造成的 直接经济损失高达6400余万元。...
12、23重庆开县井喷现场
被井喷毒死的家禽
消防人员在忙碌
联想 质疑
❖你现在知道的含硫元素的物质 有哪些?自然界中各种含硫物质 是如何进行转化的?
活动 探究
❖ 1、硫的物理性质 ❖ 2、预测硫的化学性质
硫的物理性质
❖ 颜色:黄色或淡黄色 ❖ 状态: 固体 ❖ 硬度:较小,质脆 ❖ 溶解性:不溶于水,微溶
❖Hg+S=HgS 硫表现氧化性
巩固 练习
❖ 1、下列说法正确的是( ) A、硫是一种淡黄色易溶于水的固体 B、硫在过量的氧气中燃烧生成三氧化硫 C、硫粉与铁粉加热生成硫化亚铁 D、硫是一种硬度很大,熔沸点很高的固体
巩固 练习
❖ 2、如右图所示,待内外空气压强不 变时标注出水银柱的刻度。取下橡皮 塞,在玻璃燃烧匙中加入硫粉,用酒 精灯点燃后迅速移入锥形瓶中并塞紧 橡皮塞。硫粉安静燃烧,水银柱移向 左管。当火焰熄灭后,静置,水银柱 又慢慢回到原先标注的刻度。简要回 答下列问题:
概括整合
颜ቤተ መጻሕፍቲ ባይዱ色 黄色或淡黄色
状态 固 体
硫
物理性质
溶、沸点 不 高
溶解性
不溶于水,微溶于酒 精,易溶于二硫化碳
其 他 脆,易研成粉末
化学性质
既可以被氧化也可以被还原
硫是一种比较活泼的非金属元素
化肥
火药
烟花爆 竹
火柴
硫黄的用途
杀虫
剂
硫酸
橡胶工业
制药
身边的化学
❖一位同学做实验时不小心将温度计 打碎了,他先将大个汞珠收集,碎珠 撒上一层硫粉,过一会儿再处理掉。 请问他利用了硫的什么性质,这就是 我们紧急处理洒落水银的方法。
=点燃
+S4O2
氧化性 还原性
问题 一般来说,硫与变价金属反应生成低价态金属硫化物, 探索 氯气与变价金属反应时生成高价态金属氯化物。
已知硫黄与氧气和铁粉的反应如下:
点燃
S+O2 = SO2
Fe+S = FeS 试推断:
1、硫黄与铜反应的产物。 2Cu+S = Cu2S 2、硫黄与氯气及氧气相比氧化性强弱。
点燃
2Fe+3Cl2 = 2FeCl3
点燃
Cu+Cl2 = CuCl2
硫的氧化性弱于氯气和氧气。
问题探索
某同学取了一只试管准备做实验,发现里 面沾了一些硫黄,便利用如下的反应原理进行 清洗: 3S+6NaOH = 2Na2S+Na2SO3+3H2O 那么洗涤硫的过程中硫表现了什么性质?
(既表现氧化性又表现还原性)
