高中教材图解(思维导图+微试题)人教版化学选修4 3-3盐类的水解
(人教版)化学选修四思维导图:3-3盐类的水解(含答案)
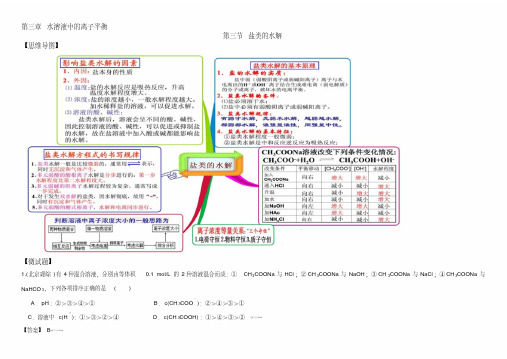
第三章水溶液中的离子平衡第三节盐类的水解【思维导图】【微试题】1.(北京理综)有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是()A.pH:②>③>④>①B.c(CH3COO-):②>④>③>①C.溶液中c(H+):①>③>②>④D.c(CH3COOH):①>④>③>②[来源学科网Z.X.X.K]【答案】B[来源:学.科.网Z.X.X.K]2.(全国卷理综)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 m ol/L的NaA和NaB混合溶液中,下列排序正确的是( )[来源:学,科,网] A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)[来源:学科网]C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)【答案】A3.(2015山东卷)室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。
下列说法正确的是()[来源:学科网]A、a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)B、a、b两点所示溶液中水的电离程度相同C、pH=7时,c(Na+)= c(A—)+ c(HA)D、b点所示溶液中c(A—)> c(HA)【答案】 D4.(2014山东卷节选29.(3))实验室可用NaOH溶液吸收NO2,反应为2NO2+2Na OH=NaNO3+NaNO2+H2O。
含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L ̄1的CH3COONa溶液,则两溶液中c(NO3 ̄)、c(NO2-)和c(CH3COO ̄)由大到小的顺序为。
人教版选修四第三章第三节 盐类的水解(完整)

A.盐的电离平衡被破坏 B.水的电离程度逐渐增大 C.溶液的PH发生了较大改变 D.Kw将变小
巩固练习
2.下列物质在常温下发生水解时,
对应的离子方程式不正确的是( A )
A.(NH4)2SO4:NH4++H2O = NH3·H2O + H+
B.NH4Cl:NH4+ + H2O
(酸性F)e(NO3)2
(中性) (中性) (酸性) (酸性)
哪种离子水解? 写出它们的水解方程式和离子方程式
微观模拟 CH3COONa+H2O反应的微观模拟
盐类的水解
? 强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐 ——有弱才水解
❖不同类型的盐水解后的酸碱性分别是什么? 强酸强碱盐、强酸弱碱盐、强碱弱酸盐
NH3·H2O + H+
C.CuSO4:Cu2+ + 2H2O
Cu(OH)2 + 2H+
D.NaF:F- + H2O
HF + OH-
巩固练习
3.判断下列盐溶液呈什么性?
CuSO4 (酸性) K2SO4
(NH4)2SO4 (酸性) NaNO3
(CH3COO)2C(a碱性) Mg(NO3)2
AlCl3
CH3溶CO液ONa
CH3COOH
碱性 :C(H+) < C(OH-)
CH3COONa + H2O CH3COOH + NaOH
类比分析(以NH4Cl溶液为例):
H2O
OH- + H+
+
NH4Cl = NH4+ + Cl-
人教选修四第三章第三节盐类的水解

一、盐的组成与盐溶液酸碱性的关系
1.强碱弱酸盐的水溶液——显碱性 2.强酸弱碱盐的水溶液——显酸性 3.强酸强碱盐的水溶液——显中性
谁强显谁性,同强显中性
学以致用
请同学们试着判断下列盐的类别及酸碱性:
Na2SO4 Na2CO3 NaF NaClO
NH4NO3 CuSO4
AlCl3 Fe2(SO4)3
生成弱电解质,导致溶液
CH3CO
中c(OH-)>c(H+)而使溶液呈 碱性。
OH
总反应:CH3COONa+H2O ⇌CH3COOH + NaOH
离子方程式:CH3COO- + H2O ⇌ CH3COOH + OH-
盐溶液 酸碱性
NaCl
中性
NH4Cl
酸性
CH3COONa
碱性
c(H+)c(OH)相对大小
达到新的平衡时,
c(H+) > c(OH-)
NH3·H 2O
溶液显酸性
NH4Cl溶液为什么显酸性?
结论:强酸弱碱盐溶
NH4Cl H2O
===+NH4+ + OH- + H+
液Cl呈- 酸性原因是由于盐电
离产生的弱碱阳离子与水 电离产生的阴离子(OH-)
结合生成弱电解质,导致
NH3·H
溶液中c(H+)>c(OH-)而使 溶液呈酸性。
第三节 盐类的水解
第1课时
2020/11/17
科学探究:盐溶液的酸碱性
分别测定下列盐溶液的酸碱性,记录在表格。 将pH试纸放在表面皿上,用干燥洁净的玻璃棒蘸取 少量溶液滴在试纸上,对比标准比色卡。
人教版高中化学选修四3.3 盐类的水解(共16张PPT)

KCl AlCl3 SO4
K2SO4 Cu
强酸强碱盐不水解,显中性 强碱弱酸盐水解显碱性 强酸弱碱盐水解显酸性
CH3COOK Na2S
盐类水解方程式的书写规律
1、盐类水解(单水解、一般双水解)一般是比较微 弱的,通常用“ ”表示,同时无沉淀和气体产生。 2、多元弱酸的酸根离子水解是分步进行的,第一步 水解程度比第二步水解程度大得多(与电离类似), (相同物质的量浓度的正盐比对应酸式盐的水解程度 大得多,故Na2CO3溶液碱性比NaHCO3强。) 3、多元弱碱的阳离子水解过程较为复杂,通常写成 一步完成。(与多元弱碱的电离类似)
(1)盐类水解的定义:在溶液中盐电离出来的
离子与水所电离出来的H+或OH-结合生成弱电 解质的反应,叫盐类的水解。 (2)实质: (3)条件:
中和反应的逆反应
强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐
3 水解规律: 有弱则水解 无弱不水解
越弱越水解
谁强显谁性
注意:水解程 度都是微弱的。
练习:判断下列盐类是否能够水解,若能水解,则水解后的 酸碱性是怎样的?
第一课时
+ 0.11mol/L盐酸溶液中,由水电离出的C ( H )、
C ( O H ) 是多少?
—
0.11mol/L氢氧化钠溶液中,由水电离出的
+ C ( H )、C ( O H
—
) 是多少?
学生实验:p53科学探究
(学生边实验边观察记录现象边探讨原因)
盐溶液 CH3COONa Na2CO3
酸碱性 盐类型
为什么 NH Cl 的水溶液显酸性 ? 4 • 第三级
– 第二级
– 第四级 » 第五级
氯化铵在溶液中的变化:
高中化学 3-3 盐类的水解 新人教版选修4

随堂练习
1、在溶液中,不能发生水解的离子是( D)
A、ClO - B、CO32- C、Fe3+ D、SO42-
2、下列盐的水溶液中,哪些呈酸性(① ③ ④ ) 哪些呈碱性( ② ⑤ )
①FeCl3
②NaClO ③ (NH4)2SO4
④ AgNO3 ⑤Na2S ⑥K2SO4
3、 下列溶液PH小于7的是( B )
一、实验探究
选择合适的方法测出实验台上 盐溶液的酸碱性。
盐溶液 NaCl
酸碱性 中性
Na2CO3
碱性
NaHCO3
碱性
NH4Cl
酸性
盐类型
强酸强 碱盐
强碱弱酸盐
强碱弱酸盐
强பைடு நூலகம்弱 碱盐
盐溶液 Na2SO4 CH3COONa (NH4)2SO4
酸碱性 中性 碱性
酸性
AlCl3
酸性
盐类型
强酸强 碱盐 强碱弱酸盐
出来的H+或OH-结合生成 弱电解质的反应,叫
做盐类的水解。
弱酸或弱碱
Ø水解实质:弱电解质的生成破坏了水的电离平 衡,增大了水的电离程度并且常常使溶液呈酸性 或碱性。
Ø水解条件:有弱酸根离子或弱碱离子存在; 盐必须可溶于水。即:有弱才水解,无弱不水解
整理ppt
酸 碱 盐的类型 是否水解
强酸 强碱
强酸强碱盐 (NaCl)
~7
Ø水解程度:越弱越整理水ppt 解,都弱都水解。
实验设计:请应用水解原理,设计一个
• 新闻链接:被蜂蛰伤莫大意 -采草药的老伯差点送了命!
某日上午10点左右,家住市区的李阿伯与 邻居到附近的山上采草药时,不慎被黄蜂蛰伤 ,当时他并未在意。回家后李阿伯感到伤处疼 痛加重、呼吸困难、意识不清,家人急忙拨打 急救电话,经医生对症处理——在被黄蜂叮咬 在患处涂抹食醋后,李阿伯脱离了危险。
人教版高中化学选修4 第三章 第三节 盐类的水解(一)(共33张PPT)

H2O
OH- + H+
对水的电离平衡有何影响?
NH3·H2O
促进水电离 2020/7/13
CH+ ﹥ COH-
溶液显酸性
9
一、盐类的水解
• 盐溶液酸碱性的理论分析 • (2) NH4Cl溶液 盐溶液中存在的粒子: H2O 、 NH4+ 、Cl- 、H+ 、OH- 、
NH3·H2O 水解方程式:
NH4Cl + H2O
2020/7/13
17
一、盐类的水解
!!! ❖弱酸强碱或强酸弱酸混合——定性判断
A:已知溶液浓度
① 0.01mol/LNaOH溶液和0.01mol/L的醋酸溶液
等体积混合,则溶液呈__碱___性;
② 将VamL0.01mol/LNaOH溶液和
VbmL0.01mol/L的醋酸溶液混合后溶液呈中性,
则Va ___小__于___ Vb。
溶液的酸碱性
碱性
酸性
中性
• 思考:强碱弱酸盐溶液为什么呈碱性? 强酸弱碱盐溶液为什么呈酸性? 强酸强碱盐溶液为什么呈中性?
2020/7/13
5
一、盐类的水解
• 盐溶液酸碱性的理论分析
• (1) CH3COONa溶液
(1)相关的电离方程式?
(2)哪些粒子间可能结合(生成弱电解质)?
(3)对水的电离平衡有何影响?
3、水解的实质:破坏了水的电离平衡(促进水的 电离)
4、水解的特点:水解
(1)可逆 盐 + 水
(2)吸热
中和
酸+碱
(3)微弱
(4)动态平衡
2020/7/13
13
Na2CO3呈碱性的理论分析
人教版选修4 化学:3.3 盐类的水解 课件(共28张PPT)

如:NaHCO3、Na2HPO4、KHS.
一、盐类的水解
❖ (5)盐类的双水解 ❖ 定义:当弱酸的酸根离子与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根
离子水解生成的OH-与弱碱的阳离子水解生成的H+反应生成水而使两种离子的 水解平衡向水解方向移动而互相促进的水解。 ❖ ①普通双水解: NH4+与CO32- 、 HCO3-、 S2-、 HS-、 CH3COO-的水解虽然相互促进,但仍然 是部分水解,离子之间能在溶液中大量共存,用可逆符号连接。
一、盐类的水解
❖ (3) Al3+与SO32❖ 先写单个离子的水解:
Al3+ + 3H2O ⇌ Al(OH)3+ 3H+ SO32- + H2O ⇌ HSO3- + OHHSO3- + H2O ⇌ H2SO3 + OH❖ 把②和③合并得:
① ② 主要 ③ 次要
SO32- + 2H2O ⇌ H2SO3 + 2OH-
该溶液可能是( )
A
①二氧化硫
②氯化铵水溶液
③硝酸钠水溶液
④氢氧化钠水溶液
A.①④ C.②③
B.①② D.③④
❖ 2、下列各离子组中,能大量共存的是( ) D
A. Ag+ 、NO3-、Cl-、K+ B. Al3+、Cl-、HCO3-、Na+ C. Fe2+、NO3-、SO42-、H+ D. NH4+、 Na+ 、 Cl-、HCO3-
②.弱酸酸式盐的酸式根既电离又水解.
如: NaHCO3 = Na++HCO3-
HCO3- + H2O
H3O+ + CO32-
全套高中化学思维导图word清晰打印版

思维导图高中化学
一目了然,快乐学习
全套高中化学思维导图(清晰打印版)
•
•
•
•
•
•
变化
•第二节燃烧热能源•第三节化学反应热的计算•第二章化学反应速率和
化学平衡
•第一节化学反应速率•第二节影响化学反应速率
的因素
•第三节化学平衡•第四节化学反应进行的方
向
•第三章水溶液中的离子
平衡
•第一节弱电解质的电离•第二节水的电离和溶液的
酸碱性
•第三节盐类的水解•第四节难溶电解质的溶解
平衡
•第四章电化学基础
•第一节原电池
•第二节化学电源
•第三节电解池
•第四节金属的电化学腐蚀
与防护• 2 有机化合物的结构特点• 3 有机化合物的命名• 4 研究有机化合物的一般
步骤和方法
•第二章烃和卤代烃
• 1 脂肪烃
• 2 芳香烃
• 3 卤代烃
•第三章烃的含氧衍生物
• 1 醇酚
• 2 醛
• 3 羧酸酯
• 4 有机合成
•第四章生命中的基础有
机化学物质
• 1 油脂
• 2 糖类
• 3 蛋白质和核酸•第五章进入合成有机高
分子化合物的时代
• 1 合成高分子化合物的基
本方法
• 2 应用广泛的高分子材料• 3 功能高分子材料。
高中化学选修四第三节盐类水解ppt课件

酸性
C(H+)>C(OH-)
碱性
C(H+)<C(OH-)
选修四第三章第三节盐类的水解
探究盐溶液的酸碱性原因
3、根据下表,对三类不同盐溶液中存在的各种粒子及粒子间的相互作用 进行比较、分析,从中找出不同类盐溶液呈现不同酸碱性的原因。
C(H+)=C(OH-) C(H+)>C(OH-)
C(H+)<C(OH-)
(2)电荷守恒 C(Na+) + C(H+)= C(CH3COO-)+C(OH-)
(3)质子守恒
C(H+)+ C(CH3COOH)= C(OH-)
原因:盐酸抑制铁离子的水解。
2、Fe(OH)3胶体的制备 方法:向沸水中逐滴加入5~6滴FeCl3,继续煮沸 至溶液呈红褐色,停止加热。
原因:煮沸、饱和FeCl3溶液、逐滴加都促进Fe3+ 的水解。
选修四第三章第三节盐类的水解
7、盐类水解的应用
3、将FeCl3溶液加热蒸干、灼烧、得到的产物是 Fe2O3 。原因: 加热促进Fe3+的水解,使得生成Fe(OH)3, 灼烧后得到 Fe2O3 。
盐溶液的酸碱性
选修四第三章第三节盐类的水解
生活中常用的盐除了NaCl外,还有Na2CO3和 NaHCO3等,Na2CO3和NaHCO3被视为“碱”用 于油污清洗和面食制作,特别是俗称纯碱。明明
是盐,为什么叫碱呢?
那些盐显中性,那些盐显酸性,哪些盐显碱性?
选修四第三章第三节盐类的水解
探究盐溶液的酸碱性
(1)溶液的酸碱性:通过溶液的酸碱性,可以促进 或者抑制盐的水解。
例如,NaCO3溶液中加碱可以抑制水解,加酸可以促进水解。
人教化学选修4第三章 第三节 盐类的水解(共15张PPT)

化钠溶液
钠溶液
酸钠混合溶液
pH
实验 盐类水解是微弱的, 结论 但比水的电离要大。
CH3COOH的电离大于 CH3COO-的水解
一、溶液中微粒浓度大小关系的探究
【问题探究1】 (1)写出醋酸溶液中存在的电离方程式:
CH3COOH ⇋ CH3COO- + H+ H2O⇋ H+ + OH(2)依据实验①的结论:找出醋酸溶液中,大量存在和 微量存在的微粒:
【合作学习2】 比较氯化铵溶液中溶质微粒浓度的大小关系:
二、比较混合溶液中微粒浓度的大小 【合作学习3】
依据实验③的结论:比较0.1mol/L醋酸和 0.1mol/L醋酸钠混合溶液(呈酸性)中溶质微 粒浓度的大小关系:
c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
2、0.01 mol/LNH4Cl溶液中,粒子浓度大小 关系不正确的是( C ) A.c(NH4+)<cCl B. c(H+) >cOH- C. c(NH3·H2O) >c(H+) D. c(NH4+) > c(NH3·H2O)
3、MOH强碱溶液和等体积、等浓度的HA弱 酸溶液混合后,溶液中有关离子的浓度应满足 的关系是( C ) A . c(M+)>c(OH-)>c(A-)>c(H+) B . c(M+)>c(A-)>c(H+)>c(OH-) C . c(M+)>c(A-)>c(OH-)>c(H+) D . c(M+)>c(H+)>c(A-)>c(OH-)
【引入新课】
同学们想一想,霍金凭借什么取得如此伟大的成 就呢? 他凭借坚忍不拔的意志和追求终极真理的精神。 今天我们学习的内容是高中化学学习中比较难的 一部分内容,也需要大家发扬这种精神。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章水溶液中的离子平衡
第三节盐类的水解
【思维导图】
【微试题】
1.(北京理综)有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是()
A.pH:②>③>④>①B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④D.c(CH3COOH):①>④>③>②
【答案】B
2.(全国卷理综)已知乙酸 (HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是( ) A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
【答案】A
3.(2015山东卷)室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。
下列说法正确的是()
A、a点所示溶液中c(Na+)>c(A—)> c(H+)>c(HA)
B、a、b两点所示溶液中水的电离程度相同
C、pH=7时,c(Na+)= c(A—)+ c(HA)
D、b点所示溶液中c(A—)> c(HA)
【答案】D
4.(2014山东卷节选29.(3))实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。
含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为。
(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
【答案】c (NO3‾) > c(NO2-) > c(CH3COO‾);b、c
【解析】根据盐类水解规律,越弱越水解,所以CH3COO‾的水解程度大于NO2-,故离子浓度大小是c(NO3‾)>c(NO2-)>c(CH3COO‾);因为CH3COO‾的水解程度大于NO2-,所以溶液A的PH小于溶液B的PH。
a.向溶液A中加适量水(使A的PH减小),b.向溶液A中加适量NaOH(使A的PH增大),c.向溶液B中加适量水(使B的PH减小),d.向溶液B中加适量NaOH (使B的PH增大),只有bc满足题意。
