新型医用无镍不锈钢(BIOSSN4)的细胞毒性评价
纳米科技材料毒性评价方法与标准介绍

纳米科技材料毒性评价方法与标准介绍纳米科技作为当今科技领域的热门研究方向之一,正在广泛应用于医疗、能源、材料、电子等领域。
然而,纳米科技材料的毒性问题引起了广泛的关注。
毒性评价是确保纳米材料的安全应用的重要环节,本文将介绍纳米科技材料的毒性评价方法与相关标准。
一、纳米材料的毒性评价方法:1. 体外研究方法体外研究方法是通过对纳米材料与细胞或体外模拟系统相互作用来评估其毒性。
常用的体外研究方法包括细胞毒性实验、核酸损伤实验、蛋白质损伤实验等。
这些实验可以通过测定细胞存活率、细胞膜通透性、氧化应激等指标来评估纳米材料对细胞的影响。
2. 动物实验方法动物实验是评价纳米材料毒性的重要手段。
常用的动物实验方法包括小鼠、大鼠、兔子等动物模型。
通过给小鼠等动物灌胃、注射或吸入纳米材料,观察动物的生物学参数、病理学改变等指标,评估纳米材料的毒性。
3. 体内成像技术体内成像技术是一种非侵入性的评价纳米材料毒性的方法。
通过使用光学成像、磁共振成像等技术,观察纳米材料在体内的分布、代谢等情况,评估其对器官和组织的影响。
二、纳米材料毒性评价的相关标准:1. ISO/TS 80004-4:关于纳米材料名词和定义的标准该标准规定了纳米材料的定义和术语,为纳米材料毒性评价提供了准确的术语和定义,以便于有效地进行毒性评估。
2. ISO/TR 13014:纳米材料毒性评价方法的指南该指南提供了纳米材料毒性评价的基本原则、方法和技术。
它介绍了纳米材料毒性评价的关键步骤,包括样品制备、实验设计、生物学指标测量等内容,为研究人员提供了实施毒性评价的指导。
3. REACH法规REACH是欧盟的一项法规,旨在保护人类和环境免受化学物质的危害。
它要求制造商或进口商对市场上的化学物质进行注册和评估。
对于纳米材料,REACH法规要求制造商或进口商提供纳米材料的物理化学特性、毒性数据等信息,以便评估其对人类和环境的潜在风险。
4. 美国食品药品监督管理局(FDA)指南FDA发布了一系列指南,用于指导纳米材料在医疗产品中的研究和开发。
304Cu抗菌不锈钢材料的细胞毒性评价

the
cytotoxicity
of the three
groups.The morphological
observation,CCK-8 test
and FCM
test were chosen to
evaluate cell toxicity of materials.Growth of L-929 cells was
in vivo.
This study is in vitro.Materials were stainless steel
divided
into
common stainless steel,antibiotic
line Was
and
pure
titanium.L-929
cell
chosen
to
assess
3
observed under inverted microscope.Optical density(OD)and relative growth
rate
(RGR)of cells cultured for
scatter
24 48
and
72 hours was
detected
using CCK-8 test.The
结果
倒置相差显微镜观察结果:培养24 h,普通不锈钢组,抗菌不锈钢组,纯钛 组,空白对照组细胞贴壁生长状态良好;阳性对照组细胞生长状态异常。培养48 h,普通不锈钢组,抗菌不锈钢组,纯钛组,空白对照组细胞生长旺盛,排列密集 规则;阳性对照组细胞固缩。培养72 h,普通不锈钢组,抗菌不锈钢组,纯钛组, 空白对照组细胞布满视野,未见异型性;阳性对照组均为死亡细胞和碎片。 CCK-8实验结果:随着培养时间的延长,普通不锈钢组,抗菌不锈钢组,纯 钛组,空白对照组的光密度值均相应的增加。各时点普通不锈钢组,抗菌不锈钢 组的光密度值均低于纯钛组和空白对照组(P<O.05),但普通不锈钢组,抗菌不锈 钢组间比较无统计学差异(P>0.05)。空白对照组各时间点细胞毒性均为0级,纯 钛组,普通不锈钢组,抗菌不锈钢组各时间点细胞毒性均为1级。 流式细胞术实验结果:各组细胞均以正常细胞和凋亡细胞为主,坏死细胞较 少。凋亡细胞在各组间分布不均,普通不锈钢和抗菌不锈钢组的凋亡细胞多于空 白对照组。细胞凋亡率在普通不锈钢、抗菌不锈钢组之间无统计学差异俨>0.05), 但这两组的细胞凋亡率均高于空白对照组,差异有统计学意义泸<O.05)。
医用纳米材料检测与评价标准

医用纳米材料检测与评价标准主要包括以下几个方面:
1.安全性评价:包括对纳米材料可能产生的毒性、生物相容性、
生物安全性等方面的评价。
这些评价通常涉及动物模型实验和体外细胞实验,以评估纳米材料对生物系统的潜在影响。
2.物理化学性质分析:包括对纳米材料的尺寸、形貌、表面性质、
稳定性等方面的分析。
这些分析通常使用现代分析技术,如透射电子显微镜、原子力显微镜、动态光散射等。
3.体外实验评价:用于评估纳米材料在体外环境中的生物效应,
如细胞毒性、细胞吞噬、细胞功能影响等。
这些实验通常使用各种细胞系或原代细胞进行。
4.体内实验评价:通过动物模型实验,评估纳米材料在体内的行
为和效果,包括药物传递、成像、治疗等方面的应用。
5.生物相容性和降解性评估:研究纳米材料与生物系统的相互作
用,以及其在体内外的降解性能。
这涉及到对纳米材料在体内的分布、代谢、排泄等方面的研究。
6.生产质量控制:确保医用纳米材料的质量和安全性,需要对其
生产过程进行严格的质量控制和管理。
这包括原材料的选取、生产工艺的优化、产品质量检测等方面的内容。
7.临床前和临床研究:在将医用纳米材料应用于临床之前,需要
进行充分的临床前和临床研究,以评估其安全性和有效性。
这些研究通常需要遵循相应的伦理和法规要求。
医疗器械生物学评价要点

医疗器械生物学评价要点1、生物安全性原则:安全、科学、有效。
目的在于消除生物材料对人体器官的破坏性,比如细胞毒性和致癌性。
另外,生物材料对于宿主是异物,在体内必定会产生某种应答或出现排异现象。
生物材料如果要成功,至少要使发生的反应被宿主接受,不产生有害作用。
2、生物功能性原则:相容、安全、有效生物功能性是指其在特殊应用中“能够激发宿主恰当地应答”的能力。
随着对生物材料生物相容性的深入研究,人们发现不仅要对生物材料的毒副作用要进行评价,还要进一步评价生物材料对生物功能的影响。
生物学反应1、血液反应:血小板血栓、凝血系统激活、纤溶系统激活、溶血反应、白细胞反应、细胞因子反应、蛋白黏附。
2、免疫反应:补体系统激活、体液免疫反应、细胞免疫反应。
3、组织反应:炎症反应、细胞黏附、细胞增殖、形成囊膜、细胞质的转变。
4、材料反应(1)物理性质变化引起生物医用材料变化的因素:1)生理活动中骨骼、关节、肌肉的力学性动态运动;2)细胞黏附吞噬作用。
(2)化学性质变化引起生物体反应的因素:1)材料中残留有毒性的低分子物质;2)材料聚合过程残留有毒性、刺激性的单体;3)材料及制品在灭菌过程中吸附了化学毒剂和高温引发的裂解产物;4)材料和制品的形状、大小、表面光滑程度;5)材料的酸碱度。
生物相容性的分类1、血液相容性:材料用于心血管系统与血液直接接触,主要考察与血液的相互作用。
血液相容性要求:抗血小板血栓形成、抗凝血性、抗溶血性、抗白细胞减少性、抗补体系统抗进性、抗血浆蛋白吸附性、抗细胞因子吸附性。
2、组织相容性(一般生物相容性):材料与心血管系统外的组织和器官接触,主要考察与组织的相互作用。
组织相容性要求:细胞黏附性、无抑制细胞生长性、细胞激活性、抗细胞原生质变化性、抗炎症性、无抗原性、无诱变性、无致癌性、无致畸性。
1、ISO中生物学评价标准的特点(1)明确了医疗装置的分类,将接触部位分为表面接触、体外与体内接触、体内植入三大类;(2)在接触时间上将小于24h的接触列为一时接触,短、中期接触时间大于24h至30天,30天以上为长期接触;嘉峪检测网编辑整理(3)生物学评价试验分为基本评价试验和补充评价试验两大类。
高氮无镍不锈钢的生物安全性

医用高氮无镍奥氏体不锈钢(BIONFSSN4)的生物安全性任伊宾,杨柯中国科学院金属研究所针对含镍医用不锈钢(如316L不锈钢)在临床使用过程中存在的镍危害及氮在钢中的有益作用,中国科学院金属研究所研究开发出新型的医用高氮无镍奥氏体不锈钢(授权专利:ZL 03110896.2),该不锈钢新材料是在现有医用奥氏体不锈钢Fe-18Cr-14Ni-3Mo(参见标准GB4234和ISO5832-1以及ASTM F138,139)的化学成分基础上,采用氮元素(0.6%以上)和锰元素(从小于2%提高到15%)共同替代具有潜在毒副作用的镍元素(从14%降到小于0.1%,属原材料带入)的成分设计思想,开发出的Fe-17Cr-15Mn-3Mo-N型医用高氮无镍奥氏体不锈钢(BIONFSSN4)。
目前国内还没有形成医用高氮无镍奥氏体不锈钢的相应产品和标准,国外只有美国CARPENTER公司开发生产的108合金是一种商品化的外科植入用高氮无镍不锈钢(参见美国ASTM F2229),其也是一种Fe-Cr-Mn-Mo-N型高氮无镍奥氏体不锈钢,目前已在骨科等医疗器械中得到应用。
从金属所开发的BIONFSSN4不锈钢化学成分设计的生物安全性角度考虑,可通过与美国的108合金及国标规定的医用奥氏体不锈钢的化学成分进行对比来进行评估,见表1。
BIONFSSN4不锈钢与108合金相比,其中的主要合金元素铬含量(17-19%)和锰含量(14-16%)均低于108合金中的铬含量(19-23%)和锰含量(21-24%),钼含量(2-4%)与现有国标规定的含镍医用不锈钢中的钼含量相同,但略高于108合金中的钼含量(1-1.5%),碳含量(不大于0.03%)和氮含量(0.6-0.8%)均低于108合金中的碳含量(不大于0.08%)和氮含量(0.85-1.1%),较低的碳含量和氮含量更有利于高氮无镍不锈钢的冷热加工和成型。
由此可见,金属所开发的高氮无镍奥氏体不锈钢中的合金元素含量均在现已临床应用的医用不锈钢(合金)的生物安全成分范围之内。
溶血试验评价奥氏体无镍不锈钢生物相容性

溶血试验评价奥氏体无镍不锈钢生物相容性(作者:___________单位: ___________邮编: ___________)【摘要】目的:通过溶血试验初步评价奥氏体无镍不锈钢的生物相容性。
方法:首先制备半径5 mm、厚1 mm奥氏体无镍不锈钢金属片。
将金属试件放入试管中,试管中加入10 ml生理盐水,另取2个试管做对照组,阴性对照组:10 ml生理盐水,阳性对照组:10 ml蒸馏水。
每个试管中加入人稀释抗凝血0.2 ml,水浴后测定各管吸光度。
按下式计算溶血率:溶血率=(样品吸光度-阴性吸光度)/(阳性吸光度-阴性吸光度)。
结果:奥氏体无镍不锈钢试件的溶血率为3.831%,小于5%。
结论:奥氏体无镍不锈钢不会引起人的急性溶血。
【关键词】奥氏体无镍不锈钢;生物相容性;溶血试验;溶血AbstractObjective:To preliminarily evaluate the biocompatibility of austenitic nickel free stainless steel with in haemolysis test.Methods:First austenitic nickel free stainless steel was made into wafers of5mmdiameter and 1mm thickness.Then the material was put separately in the cuvette with10ml physiological saline solution as the test group,while those in the cuvette with10ml distilled water or10ml physiological solution were taken as the positive control group and the negative control group.The human blood(0.2ml)was added into each cuvette.Haemolysis rate was measured according to the formula of (the absorbance value of austenitic nickel free stainless steel the absorbance value of negative control group)/(the absorbance value of positive control group the absorbance value of austenitic nickel free stainless steel).Results:haemolysis rate of the austenitic nickel free stainless steel was 3(831%,which was lower than5%.Conclusion:the austenitic nickel free stainless steel will not induce acute haemolysis.Key wordsaustenitic nickel free stainless steel;biocompatibiliby haemolysis口腔临床的修复治疗与材料学密不可分。
MTT法评价4种医用材料的细胞毒性

消化液 : 酶( y s ) 自 Amrso公 司 , 胰 T pi 购 n ec 用前 称 取 15m 2 g胰 蛋 白酶 加 5 0 mL三 蒸 水 溶 解 , 成 2 5 配 . g・ 的溶液 , 0 2 m 的微 孔 滤器 除 菌 。二 甲 L 用 .2
用 MTT 比 色法 评 价 4种 医 用材 料 的 细 胞 毒 性 。结 果
4种 医 用材 料 均 表 现 出较 高 的 细 胞 相 对 增 殖 率 , 细 胞 毒 性 为 1级 。结 其 论 4种 医 用材 料 对 细 胞 形 态 、 长 和 增 殖 不 构 成 损 害 , 明 显 细 胞 毒 性 , 有 良好 的 细胞 相 容性 。 生 无 具 关 键 词 : 胞 毒 性 实验 ; T 比 色 法 ; 提 液 细 MT 浸
I O1 9 3 5 1 9 。MTT t o s u e O a a y e t e c t t xc t ft e f u d c l t ras S 0 9— :9 9 me h d wa s d t n l z h y o o iiy o h o rme ia ma e i l.Re u t ef u d c l — s l Th o rme ia s ma t r l ip a e i h r ltv r l e a in r t n h i y o o ii sg a e 1 Co cu i nTh o rme ia t r l h v o e i s d s l y d a h g ea i e p o i r t a i a d t e rc t t x ct wa r d . n l so ef u d c l a f o o y ma e i s a en a o vo s c t t x ct . b i u y o o ii y
Ni的危害---中国科学院金属研究所

-2
-3
316L
Co62Cr28Mo6
-4
00Cr18Mn15Mo2N0.62
-5
-6
-7
37℃ Hank's solution
-8
Scan Rate (V/s) = 3e-4
-9
-0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4
Potential,E/V
0.20 0.18 0.16 0.14 0.12 0.10 0.08 0.06 0.04 0.02 0.00
0
45min 56 min 40min
316L 00Cr18Mn15Mo2N0.62 Co62Cr28Mo6
10
20
30
40
50
60
70
80
Time, t / min
316L, 0.5h
Co-Cr-Mo, 0.5h
4
8
12
时间(周)
高氮无镍不锈钢实验钢板和螺钉
高氮无镍不锈钢冠脉支架 HNS coronary stents
高氮无镍不锈钢精密钢管
壁厚:0.13+/-0.005mm, Diameter:1.9+/-0.01mm
谢 谢!
每天摄入可溶性镍250mg会引起中毒。有些人比较敏感, 摄入600μg即可引起中毒。依据动物实验,慢性超量摄取或 超量暴露,可导致心肌、脑、肺、肝和肾退行性变。有资料 显示:每天喝含镍高的水会增加癌症发病率。
欧盟于1994年通过了94/27/EC 指令(Nickel Release Directive), 该指示是用以管制镍(Ni)在与皮肤有直接及长期接触的产品 上的使用量。
医用高氮无镍不锈钢的研究及应用现状

医用高氮无镍不锈钢的研究及应用现状作者:任伊宾来源:《新材料产业》 2015年第7期文/任伊宾中国科学院金属研究所医用不锈钢是最早开发应用的医用金属材料之一,其加工性能优异、制造技术成熟、价格低廉,因而在临床上被广泛应用于加工各种器件或植入件。
医用不锈钢的发展一直和工业不锈钢的发展同步,不锈钢在1913年发明后,304不锈钢在1926年就开始用作人体骨科植入材料,同时随着耐蚀性更好的316不锈钢的发明,临床上从20世纪50年代开始用316不锈钢逐渐取代了304不锈钢。
在20世纪60年代,冶金技术的进步使316不锈钢中的碳(C)含量降低到0.03%以内,不仅解决了不锈钢的晶间腐蚀问题,而且具有优异的生物相容性,从此超低碳的316L不锈钢在医学领域被广泛应用[1]。
近几十年由于氮(N)能显著提高不锈钢的力学性能和耐蚀性,氮强化的医用不锈钢以及无镍(Ni)的高氮不锈钢也开始应用于临床。
目前用于临床的医用不锈钢按其组织主要包括医用马氏体不锈钢、医用奥氏体不锈钢和少量医用沉淀硬化型不锈钢3种类型,其中医用马氏体不锈钢和沉淀硬化型不锈钢具有高硬度和高强度,多用于制作外科手术器械,而医用奥氏体不锈钢具有良好的力学性能、耐腐蚀性能和优良的生物相容性,已经广泛应用于医疗领域,316L不锈钢为其典型代表。
目前,以316L或317L为代表的医用奥氏体不锈钢被广泛用来制作各种人工关节、骨折内固定器械和心血管支架等高端医疗器械产品。
但是医用不锈钢植入人体以后,由于不可避免的微量腐蚀或磨损,必然使其中含有的金属离子溶出,可能引起水肿、过敏、感染、组织坏死等不良组织学反应[2]。
其中316L不锈钢中含镍10%以上,临床研究已经证明,医用金属材料中镍离子的溶出,除引起致敏和发炎反应外,还可能会诱发肿瘤或血栓的形成[3]。
因此近年来,除了继续优化冶金制备技术和表面改性技术来改善和解决现有医用不锈钢临床应用问题外,研究开发新型医用无镍不锈钢已经成为医用不锈钢主要的发展趋势。
医用无镍奥氏体不锈钢的生物相容性caspase-3表达强度评价

m t s a r sda n i ei poe et fh esy P<0 0 ) aps一 at i u tlf m s alol g re ee ea sa e l g t t rvm n e ni ( lw i o w hh m ot d t .5 .C sae cvt o f r a o lt a eodr r 3 i y fo me s r m r w
Au al y B OS N4, — ral y a d 3 7L, n n i i d b l , I S o Co C o n l 1 a d ih b t y AC— EVD— e D f .Co cu in BI S 4 me tt e rq i me t o l ia mk n l so s OS N e e u r h e n rci c l f n a p iai n,S h i c mp t i t fB OS N s p e i n r y s f o e tla p i ain pl t c o O t e b o o a i l y o I S 4 wa r l bi mi a i a e frd na p l t . l c o
Ke y wor s: nc lfe ti ls c s a e3; p p o i ; o o d ike—r e sa n e s; a p s 一 a o t ss bic mpai iiy tblt
医疗器械生物学评价标准目录
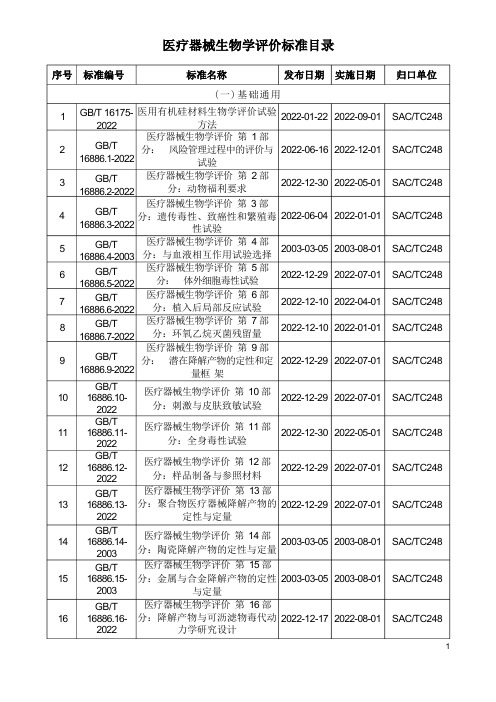
(一)基础通用1 2 3 4 5 6 7 8 910111213141516 GB/T 16175-2022GB/T16886.1-2022GB/T16886.2-2022GB/T16886.3-2022GB/T16886.4-2003GB/T16886.5-2022GB/T16886.6-2022GB/T16886.7-2022GB/T16886.9-2022GB/T16886.10-2022GB/T16886.11-2022GB/T16886.12-2022GB/T16886.13-2022GB/T16886.14-2003GB/T16886.15-2003GB/T16886.16-2022医用有机硅材料生物学评价试验方法医疗器械生物学评价第1 部分:风险管理过程中的评价与试验医疗器械生物学评价第2 部分:动物福利要求医疗器械生物学评价第3 部分:遗传毒性、致癌性和繁殖毒性试验医疗器械生物学评价第4 部分:与血液相互作用试验选择医疗器械生物学评价第5 部分:体外细胞毒性试验医疗器械生物学评价第6 部分:植入后局部反应试验医疗器械生物学评价第7 部分:环氧乙烷灭菌残留量医疗器械生物学评价第9 部分:潜在降解产物的定性和定量框架医疗器械生物学评价第10 部分:刺激与皮肤致敏试验医疗器械生物学评价第11 部分:全身毒性试验医疗器械生物学评价第12 部分:样品制备与参照材料医疗器械生物学评价第13 部分:聚合物医疗器械降解产物的定性与定量医疗器械生物学评价第14 部分:陶瓷降解产物的定性与定量医疗器械生物学评价第15 部分:金属与合金降解产物的定性与定量医疗器械生物学评价第16 部分:降解产物与可沥滤物毒代动力学研究设计2022-01-222022-06-162022-12-302022-06-042003-03-052022-12-292022-12-102022-12-102022-12-292022-12-292022-12-302022-12-292022-12-292003-03-052003-03-052022-12-172022-09-012022-12-012022-05-012022-01-012003-08-012022-07-012022-04-012022-01-012022-07-012022-07-012022-05-012022-07-012022-07-012003-08-012003-08-012022-08-01SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC2481718192021GB/T16886.17- 2005 GB/T16886.18- 2022 GB/T16886.19- 2022 GB/T16886.20- 2022 YY/T 1512-2022医疗器械生物学评价 第 17 部分:可沥滤物允许限量的建立 医疗器械生物学评价 第 18 部分:材料化学表征 医疗器械生物学评价 第 19 部 分:材料物理化学、形态学和表 面特性表征 医疗器械生物学评价 第 20 部 分:医疗器械免疫毒理学试验原 则和方法 医疗器械生物学评价风险管理过 程中生物学评价的实施指南2005-11-042022-12-302022-12-302022-12-102022-07-17 2022-04-01 2022-05-01 2022-05-01 2022-01-012022-07-01 SAC/TC248 SAC/TC248SAC/TC248SAC/TC248SAC/TC248YY/T 0870.1-医疗器械遗传毒性试验 第 1 部 2022 分:细菌回复突变试验 医疗器械遗传毒性试验 第 2 部YY/T 0870.2-变试验 医疗器械遗传毒性试验 第 3 部 24 分:用小鼠淋巴瘤细胞进行的 2022-07-24 TK 基因突变试验医疗器械遗传毒性试验 第 4 部25 分:哺乳动物骨髓红细胞微核试 2022-06-17 验医疗器械遗传毒性试验 第 5 部26 分:哺乳动物骨髓染色体畸变试 2022-06-17 验 YY/T 0870.6- 医疗器械遗传毒性试验 第 6 部27 2022-07-24 2022 分:体外哺乳动物细胞微核试验2022-10-012022-06-01 2022-08-012022-07-01 2022-07-01 2022-08-01SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248(三)繁殖和发育毒性28293031YY/T 1292.1- 医疗器械繁殖和发育毒性试验第2022 1 部份:筛选试验 YY/T 1292.2- 医疗器械繁殖和发育毒性试验第2022 2 部份:胚胎发育毒性试验 YY/T 1292.3- 医疗器械繁殖和发育毒性试验第2022 3 部份:一代繁殖毒性试验 YY/T 1292.4- 医疗器械繁殖和发育毒性试验第2022 4 部份:两代繁殖毒性试验 2022-03-02 2022-01-012022-03-02 2022-01-012022-01-26 2022-01-012022-02-28 2022-01-01SAC/TC248SAC/TC248SAC/TC248SAC/TC248(四)补体激活YY/T 0878. 1- 医疗器械补体激活试验 第 1 部32 2022- 10-21 2022- 10-01 SAC/TC2482022 分:血清全补体激活23 分:体外哺乳动物细胞染色体畸 2022-05-31 YY/T 0870.5-YY/T 0870.4-YY/T 0870.3-2022-10-21 2022 22 2022 2022 202233 34 3536 YY/T 0878.2- 2022YY/T 0878.3- 2022YY/T 0879.1- 2022YY/T 0879.2- 2022 医疗器械补体激活试验 第 2 部 分:血清旁路途径补体激活 医疗器械补体激活试验 第 3 部 分:补体激活产物(C3a 和 SC5b-9)的测定 (五)致敏医疗器械致敏反应试验 第 1 部分:小鼠局部淋巴结试验 (LLNA )放射性同位素掺入法 医疗器械致敏反应试验 第 2 部 分:小鼠局部淋巴结试验 (LLNA ) BrdU-ELISA 法2022-03-022022-07-24 2022-10-21 2022-03-022022-01-01 2022-08-01 2022-10-01 2022-01-01SAC/TC248SAC/TC248SAC/TC248SAC/TC248(六)免疫原性评价37 3839404142434445 YY/T 1465.1- 医疗器械免疫原性评价方法 第1 2022 部份:体外 T 淋巴细胞转化试验 医疗器械免疫原性评价方法 第2 部份:血清免疫球蛋白和补体成 分测定 ELISA 法 医疗器械免疫原性评价方法 第3 部份:空斑形成细胞测定 琼脂 固相法 医疗器械免疫原性评价方法 第4 部份:小鼠腹腔巨噬细胞吞噬鸡 红细胞试验半体内法 医疗器械免疫原性评价方法 第5 部份:用 M86 抗体测定动物源 性医疗器械中α-Gal 抗原清除率 医疗器械免疫原性评价方法 第6 部份:用流式细胞术测定动物脾 脏淋巴细胞亚群 医疗器械免疫原性评价方法 第7 部份:流式液相多重蛋白定量技 术 (七)降解YY/T 0511- 多孔生物陶瓷体内降解和成骨性 2022 能评价试验方法 YY/T 1775.1- 可吸收医疗器械生物学评价 第1 2022 部份:可吸收植入物指南 2022-01-262022-01-262022-07-292022-03-282022-07-292022-07-242022-03-092022-12-302022-03-09 2022-01-01 2022-01-01 2022-06-01 2022-04-01 2022-06-01 2022-08-01 2022-04-012022-06-01 2022-04-01SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248(八)临床前动物研究和临床研究YY/T 1754. 1- 医疗器械临床前动物研究 第 1部46 2022-09-27 2022-09-01 SAC/TC2482022 分:总则YY/T 1465.2-2022 YY/T 1465.3-2022 YY/T 1465.4-2022 YY/T 1465.5-2022 YY/T 1465.6-2022 YY/T 1465.7-2022医疗器械临床前动物研究 第 2部YY/T 1754.2-型48 医疗器械临床调查 1997-08-27 1998-01-01 SAC/TC248(九)微生物控制标示“无菌”医疗器械的要求49 第1 部份:最终灭菌医疗器械的 2022-07-02 2022-03-01要求标示“无菌”医疗器械的要求50 第2 部份:无菌加工医疗器械的 2022-07-02 2022-03-01要求YY/T 0618- 医疗器械细菌内毒素试验方法常51 2022-02-28 2022-01-012022 规监控与跳批检验山东中心山东中心SAC/TC248(十)动物源性医疗器械52 53 54 55 565758 596061 YY/T 0771.1- 动物源医疗器械 第 1 部份:风 2022 险管理应用YY/T 0771.2- 动物源医疗器械 第 2 部份:来 2022 源、采集与处置的控制 动物源医疗器械 第 3 部份:病YY/T 0771.3-2022YY 0970-2022 (十一)其他 YY/T 1500- 医疗器械热原试验 单核细胞激2022 活试验 人全血 ELISA 法 YY/T 1649.1- 医疗器械与血小板相互作用试验 2022 第 1 部份:体外血小板计数法 医疗器械与血小板相互作用试验 第 2 部份:体外血小板激活产物 (β -TG 、PF4 和 TxB2)的测定 YY/T 1651.1- 医疗器械溶血试验 第 1 部份:2022 材料介导的溶血试验 YY/T 1670.1- 医疗器械神经毒性评价 第 1 部 2022 分:评价潜在神经毒性的试验选 2022-03-31 2022-03-31 2022-12-302022-03-02 2022-10-212022-07-292022-05-312022-10-232022-05-31 2022-07-24 2022-04-01 2022-04-01 2022-06-01 2022-01-01 2022-10-012022-06-012022-06-012022-10-012022-06-012022-08-01SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248SAC/TC248毒和传播性海绵状脑病(TSE ) 因子去除与灭活的确认 动物源医疗器械 第 4 部份:传 YY/T 0771.4- 播性海绵状脑病(TSE )因子的 2022 去除和/或者灭活及其过程确认分 析的原则 含动物源材料的一次性使用医疗 器械的灭菌液体灭菌剂灭菌的确 认与常规控制 47 分:诱导糖尿病大鼠皮肤损伤模 2022-09-27 2022-09-01 SAC/TC248YY/T 1649.2-2022 YY/T 0615.2-YY/T 0615.1-YY/T 0297-2022202220221997择指南YY/T 1770.1- 医疗器械血栓形成试验第1 部2022 分:犬体内血栓形成试验2022-03-09 2022-04-01 SAC/TC24862。
Ni的危害 - 中国科学院金属研究所

Ni ↓,(N,Mn)↑→更加稳定的奥氏体 Cr ↑,Mo ↑ →更为优异的耐蚀性能
美国ASTM标准中的外科植入用不锈钢的化学成分,wt.%
不锈钢 F138, 139 F745 F1314 F1586 F2229 C ≤0.03 ≤0.06 ≤0.03 ≤0.08 ≤0.08 Cr 17~ 19 16.5~ 19.0 20.5~ 23.5 19.5~ 22.0 19.0~ 23.0 Ni 13.0~ 15.0 11.0~ 14.5 11.5~ 13.5 9.0~ 11.0 ≤0.05 Mn ≤2.0 ≤2.0 4.0~ 6.0 2.0~ 4.25 21.0~ 24.0 Mo 2.25 ~3.0 2.0~ 3.0 2.0~ 3.0 2.0~ 3.0 0.5~ 1.5 Cu ≤0.5 ≤0.5 ≤0.5 ≤0.25 ≤0.25 Si ≤0.75 ≤1.0 ≤0.75 ≤0.75 ≤0.75 N ≤0.1 ≤0.2 0.2~ 0.4 V, Nb: 0.1~0.3 其它
欧盟于1994年通过了94/27/EC 指令(Nickel Release Directive), 该指示是用以管制镍(Ni)在与皮肤有直接及长期接触的产品 上的使用量。 “镍的释放一直受到EC的限制。对长期接触皮肤的镀金或 非镀金产品,其每周排放的数量不超过0.5ug/CM 2。而穿环 用的金属底部组件如耳环杆,其每周排放量不能超过 0.2ug/cm2。
对于外科植入物材料来说,奥氏体不锈钢具有优良的综合性能,而且没有磁性。目前 应用最为广泛的是316L及317L不锈钢(ASTM-F138,F139)。
外科植入用奥氏体不锈钢的发展方向
新型医用奥氏体不锈钢
植入不锈 钢 不添加镍元素 优良的生物相容性 无磁性 优异的耐蚀性和耐磨性能 优良的力学性能 (强度、韧性、疲劳等) 良好的加工性能
纳米药物非临床安全性评价研究技术指导原则解读

纳米药物非临床安全性评价研究技术指导原则解读摘要随着纳米技术的迅速发展,纳米药物的研发已成为目前药物创新的发展方向之一。
纳米药物由于具有特殊的纳米尺度效应和纳米结构效应等理化特性,从而具有特殊的生物学特性,使其吸收和组织分布等药代动力学特征可能发生变化,并进而影响其安全性和有效性。
同时,由于纳米药物的特殊性,纳米药物的非临床安全性评价在普通药物非临床安全性评价的基础上,有许多特别需要关注之处。
中国于2 021年8月25日发布了《纳米药物非临床安全性评价研究技术指导原则》,本文对该指导原则进行全面解读,着重介绍纳米药物非临床安全性评价的关注要点,并结合案例进行阐述,旨在为纳米药物的研发者提供参考。
关键词纳米药物;非临床安全性评价;指导原则;药物纳米粒;载体类纳米药物随着纳米技术的迅速发展,纳米药物的研发已成为目前药物创新的发展方向之一。
纳米药物由于具有特殊的纳米尺度效应和纳米结构效应等理化特性,从而具有特殊的生物学特性,使得纳米药物与普通药物相比药代动力学特征可能发生变化,并进而影响其安全性和有效性。
国家药品监督管理局药品审评中心组织起草并于2021年8月25日发布了纳米药物相关指导原则,针对纳米药物的特点建立了纳米药物的监管标准。
本文对《纳米药物非临床安全性评价研究技术指导原则(试行) 》(下文简称《指导原则》) 进行全面解读,着重介绍纳米药物非临床安全性评价的关注要点,并结合案例进行阐述,旨在为纳米药物的研发者提供参考。
1指导原则起草背景近年来,国内外纳米技术在疾病诊断、治疗、监测等方面应用日益广泛,纳米药物相关产业进展迅猛,新技术、新应用、新成果不断涌现。
与普通药物制剂相比,纳米药物具有基于特殊的纳米尺寸、纳米结构和表面性质等,可能通过提高难溶性药物的溶解度、提高药物的生物利用度、增加药物的体内外稳定性或改善药物的溶出或释放行为、改善药物对组织器官或细胞的选择性、制成特殊制剂后实现新的给药途径等[1],从而达到满足治疗需求的目的,在多种疾病领域尤其是恶性肿瘤适应症中显示出巨大的应用潜力。
304不锈钢钢医疗器械安全评价报告

304不锈钢钢医疗器械安全评价报告本文将就304不锈钢钢医疗器械的安全性进行评价,并详细描述其用途、特点和市场前景。
1. 304不锈钢钢医疗器械的用途304不锈钢钢医疗器械广泛应用于医疗、实验室、制药、化工等领域。
这种钢材的特点是韧性好、耐腐蚀、易清洗消毒。
它非常适合制作一些医疗器械,如手术器械、注射器、针管、扩张器等,以及实验室的罐、桶、管道等容器。
2. 304不锈钢钢医疗器械的特点(1) 良好的耐腐蚀性304不锈钢钢具有极强的耐腐蚀性能,能够在不同的酸、碱、盐等介质中具有较好的稳定性。
在医疗器械中应用广泛。
(2) 高温性能稳定304不锈钢钢的高温性能相对稳定,热处理温度范围850℃~1100℃可以有效控制晶间腐蚀的发生,同时对其强度也有良好的保持作用。
(3) 优良的加工性能304不锈钢钢可轻易地加工成各种形状,其中最常见的是板材和管材。
结构设计师可以使用这种材料,通过激光切割或焊接等方式直接制作器械的原型,从而节省成本和时间。
(4) 良好的清洁性304不锈钢钢非常容易清洁和消毒,因此它在医疗行业中非常受欢迎。
其表面光滑且具有良好的防锈性,有很高的成本效益,同时也很容易维护。
3. 304不锈钢钢医疗器械的市场前景现在,医疗行业的需求越来越多样化,对医疗器械的体积和形状要求也越来越高。
304不锈钢钢医疗器械因其良好的耐腐蚀性、高温性能稳定、优良的加工性能和良好的清洁性,逐渐成为医疗器械制造商的首选材料。
据预测,未来几年内,全球医疗器械市场将呈现快速增长的趋势,特别是高端医疗器械要求材料的精细化和高品质化,对304不锈钢钢医疗器械的需求也呈现增长趋势。
304不锈钢钢医疗器械在未来的市场前景广阔,具有很大的发展潜力。
随着医疗行业对高品质、精细的医疗器械需求的增加,将进一步推动304不锈钢钢医疗器械的发展和应用。
新型医用无镍不锈钢的生物相容性评价

新型医用无镍不锈钢的生物相容性评价刘莹;张文君;韩雪松;战德松【期刊名称】《中国组织工程研究》【年(卷),期】2015(000)047【摘要】BACKGROUND:BIOSSN4 nickel-free stainless steel is an austenitic medical stainless steel material, which has passed the standard hemolysis test, cytotoxicity assays and sensitization test of the National Institute for the Control of Pharmaceutical and Biological Products. OBJECTIVE:To evaluate theinvitro cytotoxicity and corrosion resistance of a new medical BIOSSN4 nickel-free stainless steel. METHODS:The L929 mouse fibroblasts suspension was seeded in 96-wel plates at a concentration of 1×108 /L, and were divided into five groups. BIOSSN4 nickel-free stainless steel extract, 316L stainless steel extract, gold aloy extract, lead material extract (positive control) and RPMI1640 medium (negative control) were added respectively. After 1, 2 and 3 days of culture, cel morphology was observed. The absorbance value in each group was determined using MTT assay. The relative cel proliferation rate was calculated. Toxicity grading was evaluated. In the simulated oral environment, the eletric potential of corrosion, current density of corrosion and polarization resistance of BIOSSN4 no-nickel stainless steel, 316L stainless steel and gold aloy were determined. RESULTS AND CONCLUSION:Within 3 days of culture, in lead material extract group, cels shrunk; the number of cels significantlyreduced; the relative growth rate was lower than that in the other four groups (P < 0.05). In the other four groups, the cel morphology was good, and the relative growth rate was over 75%. The toxicity of BIOSSN4 nickel-free stainless steel extract, 316L stainless steel extract and gold aloy extract was grade 1. The toxicity of lead material extract was grades 2-3. These results demonstrate that BIOSSN4 nickel-free stainless steel has good biocompatibility. The corrosion resistance of BIOSSN4 nickel-free stainless steel is higher than that of the 316L stainless steel but lower than that of the gold aloys.%背景:BIOSSN4无镍不锈钢是一种奥氏体医用不锈钢材料,在中国药品生物制品检定所通过了标准的溶血实验、细胞毒性实验和致敏实验。
九种金属离子的细胞毒性评价

九种金属离子的细胞毒性评价
陈德敏
【期刊名称】《口腔材料器械杂志》
【年(卷),期】1993(0)2
【摘要】无
【总页数】1页(P12)
【作者】陈德敏
【作者单位】无
【正文语种】中文
【相关文献】
1.三维细胞支架的制备及在卷烟烟气细胞毒性评价中的应用 [J], 李茹洋;尚平平;王宜鹏;贾云祯;孙培建;孙学辉;聂聪;杨松
2.免疫毒性评价中不同淋巴细胞激活剂致大鼠外周全血产生细胞因子作用的评价[J], 艾文超;李海山;刘伟;宋乃宁;程艳;崔媛;李蕾;谢文平;陈会明
3.猪脱细胞软骨基质生物相容性及细胞毒性评价系统的建立 [J], 王效;徐宏光;肖良;刘晨;金中行;沈阳
4.猪脱细胞软骨基质生物相容性及细胞毒性评价系统的建立 [J], 王效;徐宏光;肖良;刘晨;金中行;沈阳;
5.AlCoCrCuFeTix高熵合金细胞毒性评价及对L929细胞凋亡与Ⅰ型胶原合成的影响 [J], 肖睿;孙宇;喻望清;焦二龙;汪伟佳;张兆钰;张雪
因版权原因,仅展示原文概要,查看原文内容请购买。
不锈钢微粒对人成骨样细胞毒性及护骨素及其配体基因表达的影响

不锈钢微粒对人成骨样细胞毒性及护骨素及其配体基因表达的影响林毅;林有籁;张韬【期刊名称】《福建医科大学学报》【年(卷),期】2010(44)6【摘要】目的评价两种不锈钢微粒(镍铬和钴铬合金)对人成骨样细胞MG-63的细胞毒性及对人成骨样细胞分泌护骨素(OPG)、核因子kB配体受体激活子(RANKL)的影响.方法选择人成骨样细胞系MG-63作为细胞毒性的实验对象,干预材料选用镍铬、钴铬合金微粒,使二者均以0.005%、0.01%和0.05%三个终浓度作用于细胞48 h;并设立对照组.MMT法检测细胞活力,评价不锈钢种植体的细胞毒性;用半定量RT-PCR检测人成骨样细胞内OPG/RANKL mRNA的表达量,分析微粒对破骨细胞重要信号传导通路OPG/RANKL/RANK系统的影响.结果 (1)与对照组比较,当镍铬粒子浓度>0.01%时,对细胞生长产生一定的抑制作用;而钴铬对人成骨样细胞的生长无明显的抑制作用.(2)与对照组比较,镍铬粒子浓度<0.01%时,对造骨细胞OPG的表达无明显影响,但可以诱导入成骨样细胞中RANKL的表达;钴铬粒子对细胞OPG表达无明显的影响,只有当粒子浓度达到0.05%的时候,才对人成骨样细胞中RANKL有一定的诱导效果.结论不锈钢微粒对人成骨样细胞无细胞毒性;低浓度不会促进人成骨样细胞的增殖、分化及抑制破骨细胞的形成.【总页数】4页(P436-439)【作者】林毅;林有籁;张韬【作者单位】福建医科大学,省立临床医学院、福建省立医院,口腔科,福州,350001;福建医科大学,省立临床医学院、福建省立医院,口腔科,福州,350001;福建省医学科学研究院,福州,350001【正文语种】中文【中图分类】R783.1;R329.24;R318.08【相关文献】1.RNA干扰抑制雌激素受体α亚基对雌激素诱导人成骨样细胞护骨素表达的影响[J], 武兆忠;刘敏;冯鉴强2.人胚胎间充质干细胞的生长特性及骨髓瘤细胞对其表达核因子κB受体激活剂配体/护骨素的影响 [J], 张建华;杨林花3.不同微种植体支抗材料对护骨素与护骨素配体基因表达的影响 [J], 林有籁;林毅;张韬4.阿仑磷酸钠对人成骨细胞增殖和护骨素/核因子κB受体活化因子配体mRNA表达的影响 [J], 朱芸;陈世荣;曾俊;彭李华5.不同浓度钛微粒对护骨素/护骨素配体基因表达影响的体外研究 [J], 蔡贤华;陈安民;石晓兵因版权原因,仅展示原文概要,查看原文内容请购买。
冠状动脉支架技术发展现状及建议

冠状动脉支架技术发展现状及建议史冬梅;李丹【期刊名称】《科技中国》【年(卷),期】2019(000)005【总页数】4页(P9-12)【作者】史冬梅;李丹【作者单位】科技部高技术研究发展中心;科技部高技术研究发展中心【正文语种】中文冠心病是一种严重威胁人们健康的心血管类疾病,冠状动脉支架则是一种由金属或高分子材料制成的血管内支撑器,植入能够起到恢复病变部位血流的作用,减少冠心病对病人生命的危害。
本文主要介绍冠状动脉支架技术的国内外发展现状与趋势,并提出我国进一步发展重点和对策建议。
一、关于冠状动脉支架冠心病是冠状动脉粥样硬化性心脏病的简称,该病通常由冠状动脉粥样硬化导致血管腔狭窄或阻塞,或因冠状动脉功能性改变(痉挛)导致心肌缺血缺氧或坏死而引起。
冠状动脉支架则是一种由金属或高分子材料制成的血管内支撑器,可在闭合状态下经导管送至冠脉病变部位,再通过球囊扩张使之展开,从而起到支撑血管壁,恢复病变部位血流的作用。
2017年我国冠脉支架植入量超过110万枚,并且以每年10%左右的速度增长。
然而冠脉支架技术目前仍面临两大挑战,即支架植入后由于血管平滑肌过度增生而导致的支架内再狭窄以及载药支架植入存在的支架晚期血栓。
目前国内外科学家和医疗器械企业的研究重点均集中在相关新材料的研发,希望从材料的角度,为解决临床存在的支架内再狭窄和晚期血栓等问题提供新的解决方案。
二、世界发展现状与趋势经过30余年的发展,目前临床上应用的冠脉支架主要分为三类,即金属裸支架、药物洗脱金属支架和全降解支架。
(一)金属裸支架和药物洗脱金属支架1993年美国食品药品监督管理局(FDA)批准了由一根医用不锈钢丝缠绕的冠脉支架(Gianturco-Roubin Flex-stent)治疗冠心病。
使用金属裸支架治疗冠心病后,血管的狭窄率明显降低,然而仍存在20%~30%的支架内再狭窄发生。
载药支架则可明显降低支架内再狭窄率,2003年FDA批准了首个药物洗脱支架Cypher上市。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新型医用无镍不锈钢(BIOSSN4)的细胞毒性评价(作者:___________单位: ___________邮编: ___________)作者:刘莹,韩雪松,战德松,贾红梅【摘要】目的:评价新型医用无镍不锈钢(BIOSSN4)的细胞毒性。
方法:将BIOSSN4的浸提液与体外培养的小鼠成纤维细胞L929接触后,进行MTT实验来评定材料的细胞毒性,并与传统的医用316L不锈钢的生物学性能相比较。
结果:BIOSSN4对细胞增殖的抑制作用小于316L不锈钢组,统计学分析结果显示:两种金属材料与阴性对照组的吸光度值之间的差异无统计学意义(P0.05),与阳性对照组之间的吸光度值之间的差异有统计学意义(P0.05)。
结论:BIOSSN4无镍不锈钢具有微弱的细胞毒性,符合临床应用要求,为其应用提供了一定的生物学依据。
【关键词】无镍奥氏体不锈钢;细胞毒性;MTT试验AbstractObjective:To test the cytotoxicity of a new nickel free stainless steel(BIOSSN4)and to evaluate its biocompatibility by comparing its cytotoxicity with the traditional316L medicalstainless steel,Au alloy in vitro.Mthod:after mixing the maceration extraction of the materials and the cultures of L929 cells,we evaluated cytotoxicity by using tetrazolium based colorimetric assay.Results:the cytotoxicity of BIOSSN4was weaker than that of 316Lstainless steel.There was no significant difference among the 2 kinds of metal material and the negative control(P0.05)Conclution:the biological safety of BIOSS4 is considerly good.Key wordsnew nickel free stainless steel(BIOSSN4);cytotoxicity;MTT assy医用金属材料在诸多生物材料中,由于具有较高的强度和韧性,适用于修复和置换人体硬组织[1]。
已经应用于临床的医用金属材料主要有不锈钢、钴基合金和钛合金几大类,此外还有形状记忆合金,以及纯金属金、银、钽、铌、镐为代表的贵金属等[2] 。
用作生物医用材料的不锈钢,具有良好的腐蚀性能和综合力学性能,且加工工艺简便,是生物医用材料中应用最多、最广的材料。
人们很早就使用铁丝、镍钢、镀金的铁钉及钒钢等材料进行临床治疗的尝试,目前医用不锈钢在医学领域得到了广泛应用,如AISI304,AISI316不锈钢等。
主要应用于骨骼系统的置换和修复方面,此外在齿科、心脏外科、心血管植入支架等方面也得到应用,且一直作为医疗仪器和手术器械材料而广泛使用[3]。
医用不锈钢的生物相容性及相关问题,主要涉及到不锈钢植入生物体后,由于腐蚀或磨损造成金属离子溶出引起的组织反应等,特别是不锈钢中的镍离子析出诱发的严重病变[4,5]。
镍(Ni)离子是众所周知的有害元素,除了对人体产生过敏反应外,还存在致畸、致癌的危害性[6-9] 。
镍还是大多数医用金属材料中的合金化元素,医用奥氏体不锈钢(含镍约13%左右),医用钴基合金(含镍2%~30%不等),镍钛形状记忆合金(含镍约50%)。
对于镍的危害,许多国家对日用品和医用金属材料的镍含量限制越来越严格,标准文件所允许的最高镍含量也越来越少。
所以低镍和无镍Cr Mn N型医用不锈钢的研究又引起人们的兴趣,一些研究者提出把高氮含量的Cr Mn N奥氏体不锈钢应用于生物医学[10-12]。
BIOSSN4无镍不锈钢是中科院金属研究所发展的一种奥氏体医用不锈钢材料[13],这种不锈钢完全抛弃了镍元素,采用了氮元素来强化奥氏体基体,合适的热处理使不锈钢保证了单一稳定的奥氏体结构,即便在发生严重塑性变形后仍保持稳定的奥氏体结构。
本研究是对其细胞毒性作出评价,为临床应用提供理论依据。
1 材料与方法1.1 材料1.1.1 试样分组及其来源实验组包括A、B。
A组:无镍不锈钢(BIOSSN4)(中国科学院金属研究所);B组:316L不锈钢(中国科学院金属研究所);阳性对照组为C组:铅(中国科学院金属研究所);阴性对照组为D组:RPMI 1640培养液。
1.1.2 试样制备将A,B组材料分别制成半径5 mm、厚l mm的圆形蜡片,根据不同合金的要求铸造形成圆形金属片,打磨抛光后超声清洗15min;去离子水冲洗数遍后置于玻璃小瓶中,将金属片于121 ℃高压灭菌后待用。
C组也制备成同样大小试样,清洗烘干后置于紫外线下照射,试样各个面均照射24 h备用。
1.2 实验用细胞选用传代的对数生长期L929细胞(小鼠成纤维细胞),由本院实验技术中心提供。
1.3 培养液及主要试剂 RPMI1640培养基(含10%胎牛血清,青霉素100U/ml,pH 7.2);MTT(Sine American,Biotec),全称为二甲基噻唑二苯基四唑溴盐,使用前新鲜配制,过滤除菌,浓度为5mg/ml;二甲基亚砜(DMSO,E.Merck.Darmstudt)。
1.4 主要仪器及设备 96孔和24孔培养液,25cm细胞培养液(NuNcTM,Denmark),CO2培养箱(D63450,Heraeus,Germany),倒置相差显微镜(CK10,Olympus,Japan),自动酶标测试仪(Elx800,American,bio Tek instruments,Inc),SW CJ2FD 型超净工作台(苏州安泰空气技术有限公司)。
1.5 实验方法1.5.1 试样浸提液制备将A~C组试样分别放在超净工作台中,按浸液与试样表面积之比为0.55 ml/cm的比例加入RPMI1640培养液,置于37 ℃、95%湿度、5%CO2培养箱中72 h,即得到材料浸提液。
1.5.2 细胞的传代培养与细胞悬液的制备取复苏后的L929细胞,放入37 ℃、95%相对湿度、5%CO2培养箱中静置培养,选取快速生长期的细胞,用0.25%胰蛋白酶消化后,制备成细胞密度约为1.0×105个/ml的细胞悬液,备用。
1.5.3 材料浸提液与细胞接种培养取96孔培养板。
每板均选出4组孔,每组重复6个孔,每孔中均加入细胞悬液100 μl。
在1~3组孔中分别加入A~C组的材料浸提液100 μl,使材料浸提液浓度最终为50%,在第4组孔内加入RPMI1640培养液100 μl后,继续放入培养箱中培养。
1.5.4 MTT甲臜的形成与检测分别于培养后1、2、3d 各取1块培养液,在每板的培养孔中加入5 mg/ml的MTT液,每孔20 μl,置于培养箱中继续培养4 h后取出。
吸出孔内培养液,在每孔中再加入DMSO 150 μl,微震荡20 min后,用自动酶标仪检测吸光度值,实验波长选为490 mm。
1.6 实验数据分析计算各实验组的细胞相对增殖率(RGR)并参照5级毒性评级标准作毒性级评定RGR=实验组的OD平均值/阴性对照组的OD平均值×100%,见表1。
表1 五级毒性评级标准结果评价标准:实验结果为0-1级反应的为合格;实验结果为2级反应的,应结合细胞形态分析,综合评价;实验结果为3-5级反应的为不合格。
1.7 统计学分析用Excel 2003软件将同一时期内各组的吸光度值(OD值)作方差分析和均数间两两比较的统计学分析。
以P0.05为差异有显著性。
2 结果2.1 各实验组的吸光度值材料C组(阳性对照组)在每次检测中的吸光度值均明显高于其他材料组(P0.05或P0.01),而D组(阴性对照组)的吸光度值与除C组外的其他材料组均无明显差异(P0.05),见表2。
表2 各实验组的吸光度值(x±s)419C0.265875±0.0352900.291625±0.5197000.292 857±0.040716D0.447000±0.0232620.561125±0.039 2700.669 857±0.018 425 注:C组与D组比较P0.052.2 各实验组的RGR及材料的细胞毒性级评定 A、B两组材料的毒性为1级,C组在培养48 h后毒性级由2级增长到3级,见表3。
表3 各实验组的细胞相对增殖率3 讨论不锈钢是一类应用最早的金属植入材料,虽然已经有半个多世纪的历史,但是其用作生物材料却经历了漫长的过程。
随着矫形外科手术的出现,人们就开始了医用金属材料的研究开发。
目前,医用不锈钢主要用作矫形外科植入材料,如骨科的人工关节骨棒(柄)、骨折固定用骨钉、骨板;牙科的义齿种植体及矫形丝等;管腔内植入物如心脏外科介入治疗用心血管支架等[12],此外还可用于制作医疗仪器和手术器械。
不同形式的为牙科保健所提供的含镍不锈钢,其使用一直是成功的。
许多这些不锈钢合金运用于现存的临床修复体的制作,已经有很多年了,这些修复体包括冠、固定桥、可摘局部义齿、磁性附着体的外包裹材料等。
另外,在正畸领域也被广泛的运用,如金属托槽、弓丝、带环、弹簧、结扎丝等。
还有许多器械和装置,如牙体牙髓的器械等。
医用金属材料通常具有良好的耐蚀性能和生物相容性,镍是大多数医用金属材料中的合金化元素。
但是人体环境是一个复杂的生理介质,医用金属材料在人体内不可避免存在着腐蚀或磨蚀现象,磨损、腐蚀造成的金属离子溶出对人体组织有毒害作用,可能影响到人体组织的新陈代谢。
鉴于含镍医用金属材料可能对人体健康造成的危害,专家建议最好的办法就是严格禁止或限制各种直接接触人体的金属材料(如医疗植入物、牙科材料、首饰等)中的镍含量。
目前欧共体内使用的一欧元和二欧元硬币中镍元素的释放能使有镍过敏倾向患者的皮肤引起强烈的过敏反应[15] 。
本实验采用的MTT比色法是一种能快速评定细胞增殖和细胞毒性的比色分析法。
其测得的吸光度值取决于活细胞的数量及其新陈代谢的强度,故可以灵敏地反映出被测试材料对细胞造成的毒性损害程度[16]。
同时,该方法使用自动酶标仪检测吸光度值,能定量准确地评价出材料的细胞毒性。
因此,本实验结果证实了实验中的BIOSSN4不锈钢的细胞毒性弱于316L不锈钢,这种极微弱的细胞毒性临床应用中是可以接受的。
