无机化学试卷及答案B
无机化学期末考试试卷(B卷)答案

湖南大学无机化学期末卷B 湖南大学课程考试试卷C、Ag>Cu>AuD、Au>Ag>Cu8、元素原子的最外层仅有一个电子,该电子的量子数是n=4,l=0,m=0,下列那一元素不符合此条件()A、KB、CuC、CaD、Cr9、下列各对离子不能在同一溶液中共存的是()A、Sn2+和Fe2+B、Pb2+ 和Fe2+C、[PbCl4]2-和[SnCl6]2-D、Sn2+和Fe3+10、将IIA族与IIB族元素比较时,下列叙述中正确的是:()A、化学活泼性(还原性)都随原子序数增大而增强B、在水溶液中,从上到下,φ⊙M2+/M的数值都减小。
C、IIB族金属的熔、沸点都比IIA族的低D、自上而下,第一电离能都减小。
11、汞(II)盐如Hg(NO3)2溶液与强碱反应时,得到的产物是()A、Hg(OH)2 ↓B、HgO ↓C、[Hg(OH)4] 2-D、Hg(OH)NO3 ↓12、下列离子中心原子不属于杂化轨道类型的是()A、IO65-B、ClO4-C、ClO3-D、NH313、根据软硬酸碱理论,下列配合物稳定性最好的是()A、[CdCl4]2-B、[Cd(NH3)4]2-C、[CdI4]2-D、[CdBr4]2-14、下列配体的场强强弱顺序符合光谱化学序列的是()A、I-< F- < OH-< CN-B、F-<I-< OH-< CN-C、OH-< I- < F- < CN-D、CN-< OH- < F- < I-15、下列元素中,哪一个元素原子的外围电子构型为3d全充满,4s半充满。
()A、HgB、AgC、CuD、Ni二、填空题(每题1分,共10分)1、二氧化铅与浓硫酸反应的化学方程式2、BF3, SbF5, H2O, CH3COOH, C6H6, 在液态HF中, 作为酸物质是作为碱的物质是因为(3分)3、Al3+、Cr3+与(NH4)2S反应时生成;在以(NH4)2S为组试剂沉淀第三组阳离子时,第四组阳离子试液必须提前加处理。
无机化学本科试卷B及答案

石家庄学院2013—2014学年第 一 学期《无机化学》 期末考试试卷(闭卷)(注:允许使用计算器)题号一 二 三 四 五 六 七 八 九 十 总分 得分一、单项选择题(本大题共30小题,每题1分,共30分) 1.能使任何反应达平衡时,产物增加的措施是( D )。
A. 升温 B. 加压 C. 加催化剂 D.增大反应物起始浓度2.一瓶盛有N 2和H 2的混合气体,当选择H 2作为体系时,则环境为( A )。
A. N 2、瓶子及瓶外其他物质B. 瓶子及瓶外其他物质C. N 2和瓶子D. N 23.体系不做非体积功的等压过程,吸收的热Q p 与体系焓变关系为( C )。
A. Q p >ΔHB. Q p <ΔHC. Q p = ΔHD. Q p = ΔU 4.相变H 2O(s) H 2O(g)的ΔH 和ΔS 为( C )。
A. ΔH 为正,ΔS 为负B. ΔH 为负,ΔS 为正C.均为正值D.均为负值5.已知H 2O(l)的mf G ∆Θ= -237.19 kJ·mol -1,水的分解反应2H 2O(l) = 2H 2(g) + O 2(g),在标准状态下,该反应的吉布斯函数变是( D )kJ·mol -1。
A. -237.19 B. 237.19 C. -474.38 D. 474.386.某一反应方程式中,若反应物的计量数刚好是速率方程中各物质浓度的指数,则该反应是否为基元反应?(C )。
A.一定是B.一定不是C.不一定是D.上述都不对 7.配制澄清的氯化亚锡溶液的方法是( C )。
A. 用水溶解B. 用水溶解并加热C. 用盐酸溶解后加水D. 用水溶解后加酸 8.温度一定时,在纯水中加入酸后溶液的( C )。
A. +H c ·-OH c 变大B. +H c ·-OH c 变小C. +H c ·-OH c 不变D.+H c =-OH c 9.下列物质中,两性离子是( C )。
无机化学试卷AB答案

无机化学试卷A一、单项选择题,(共24分,每题一分)1.下列物质中可以认为具有最大摩尔熵的是A.Li(g)B.Li(s)C.LiCl·H 2O(s)D.LiCO 3(s)2.下列说法正确的是( )A.放热反应均为自发反应B.∆S m 为正的反应均为自发反应 C.∆∆r S m 为正、∆r H m 为负的反应均为自发反应 D.∆r S m 为负、∆r H m 为正的反应均为自发反应3. 一个气相反应mA (g) + nB (g)qC (g) ,达到平衡时,下列说法正确的是( )A. 0=∆θmr G B. J =1 C. θK J = D. 反应物分压和等于产物分压和 4. 向平衡体系 2SO 2 (g) + O 2 (g)2SO 3 (g) 中加入惰性气体,若体系体积保持不变,则平衡() A.不移动 B. 向右移动 C. 向左移动 D.无法判断5.下列各组量子数(n,l,m ),不合理的是( )A.(3,2,0)B.(3,3,2)C.(3,1,0)D.(3,1,-1)6.下列离子的原子序数分别是25、26、27、28,其电子构型可以用[Ar]3d 6表示的是( )A.Mn 2+B.Fe 2+C.Co 3+D.Ni 2+7.下列元素原子半径排列顺序正确的是( )A.Mg>B>Si>ArB.Ar>Mg>Si>BC.Si>Mg>B>ArD.B>Mg>Ar>Si8.下列物质熔化时需要克服离子键的是( )A. H 2OB. SiO 2C. MgCl 2D.Na9.下列分子中极性最小的是( )A .H 2OB .NH 3C .H 2SD .CO 210.卤化银的溶解度依Cl—Br—I 的次序减小,能解释这种现象的理论是( )A .杂化理论B .分子间力C .共价键D .离子极化11. 0.1 mol·L –1的一元弱碱(8100.1-⨯=θbK )溶液与等体积水混合后,溶液的pH 值为( )A.8.7B.8.85C.9.0D.10.512.下列溶液中,其pH 值最小的是( )A. 0.010mol·L –1NaOHB. 0.010mol·L –1H 2SO 4C. 0.010mol·L –1HClD. 0.010mol·L –1H 2C 2O 413. 某一弱酸强碱盐MA (5100.1)(-⨯=HA K a θ),则MA 的水解常数θh K 为( )A. 1.0×10-9B. 1.0×10-2C. 1.0×10-19D. 1.0×10-514.在饱和H 2S 水溶液中,c (S 2–)近似为( )mol·L –1A. θ1a KB. θ2a KC. θ1a K ×θ2a KD. 0.115.Ag 2CrO 4的12100.9-⨯=θsp K ,则其饱和溶液中Ag +离子浓度为( )mol·L –1A. 1.3×10-4B. 2.1×10-4C. 2.6×10-4D. 4.2×10-416.在Mg(OH)2(11108.1-⨯=θsp K )饱和溶液中加入MgCl 2,使Mg 2+浓度为0.010mol·L –1,则该溶液的pH 值为( )A. 5.26B. 8.75C. 9.63D. 4.3717. 溴的元素电势图,-V 07.12V 45.0-V 54.0-3Br Br BrO BrO −−→←−−→←−−→←+++,则可求得)(--θBr /BrO E 为( )A. 1.52VB. 0.62VC.0.76VD. 0.35V18.向原电池 (-)Zn∣Zn 2+(1mol·L -1)‖Cu 2+(1mol·L -1)∣Cu(+)的正极中通入HS 气体,则电池的电动势将( )A. 增大B. 减小C. 不变D. 无法判断19.已知)(++24θ/E Sn Sn =+0.14V ,)(++23θF /F E e e =+0.77V ,则不能共存于同一溶液中的离子( )A. Sn 4+,Fe 2+B. Sn 4+,Sn 2+C. Fe 3+,Fe 2+D. Fe 3+,Sn 2+20.根据碱性溶液中溴的元素电势图,能自发歧化的物质是( )-V 07.12V 45.0-V 54.0-3Br Br BrO BrO −−→←−−→←−−→←+++A. BrO 3-B. BrO -C. Br 2D. Br -21. 在热碱溶液中,Cl 2的歧化产物是( )A. Cl -和ClO -B. Cl -和ClO 2-C. Cl -和ClO 3-D. Cl -和ClO 4-22.在Al 2(SO 4)3溶液中加入Na 2CO 3,其主要产物是( )。
无机化学试题及答案

无机化学试题及答案一、选择题(每题2分,共20分)1. 下列哪种元素属于碱土金属?A. 锂B. 钠C. 钙D. 钾2. 以下化合物中,哪一个是共价化合物?A. NaClB. HClC. CaOD. FeCl33. 元素周期表中,第IA族元素的原子最外层电子数是多少?A. 1B. 2C. 3D. 44. 以下哪个反应是氧化还原反应?A. 2H2O → 2H2 + O2B. 2H2 + O2 → 2H2OC. 2CO + O2 → 2CO2D. 2H2O + CO2 → H2CO35. 以下哪种物质的化学式是正确的?A. 氧化铜:CuOB. 硫酸:H2SO4C. 氯化钠:NaClD. 所有选项都正确6. 根据路易斯酸碱理论,以下哪种物质是酸?A. H2OB. NH3C. HClD. NaOH7. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 氢氧化钠8. 以下哪种物质是强碱?A. 氢氧化钠B. 氢氧化钾C. 氨水D. 所有选项都是强碱9. 以下哪种物质是两性氧化物?A. Al2O3B. MgOC. SiO2D. Fe2O310. 以下哪种物质是强电解质?A. 醋酸B. 乙醇C. 氯化钠D. 蔗糖二、填空题(每题2分,共20分)1. 元素周期表中,第VIIA族元素的原子最外层电子数是________。
2. 常见的碱金属元素有锂、钠、钾、铷、铯和________。
3. 金属铝的化学符号是________。
4. 元素周期表中,第IIIB族元素的原子最外层电子数是________。
5. 元素周期表中,第VIII族元素的原子最外层电子数是________。
6. 氢氧化钠的化学式是________。
7. 氧化铁的化学式是________。
8. 硫酸铜的化学式是________。
9. 碳酸钙的化学式是________。
10. 氯化铵的化学式是________。
三、简答题(每题10分,共30分)1. 描述什么是路易斯酸碱理论,并给出一个例子。
《无机化学》期末考试试卷(B)

《无机化学》期末考试试卷(B)适用专业:注意:请将答案写在答题纸上。
一、单项选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题1分,共40分)1.下列物质不属于弱电解质的是()A.HAc B.NH3·H2O C.AgCl D.H2O2.下列元素中,非金属性最强的是()A.F B.Cl C.S D.O3.下列选项中导电性最好的金属是()A.Fe B.Cu C.Na D.Ag4.地壳中含量最多的元素是()A.O B.S C.Fe D.Si5.下列符号通常代表弱酸的解离常数的是()A.K a B.K b C.K w D.K sp6.0.1 mol·L 1氢氧化钠溶液的pH值为()A.1 B.12 C.2 D.137.原子核外电子层第一层最多容纳的电子数是多少个()A.2 B.6 C.8 D.10 8.配制FeCl3溶液时,常加入少量盐酸,其目的是()A.防止Fe2+被氧化B.防止Fe2+水解C.防止Fe3+被氧化D.防止Fe3+水解9.下列物质中,属于共价化合物的是()A.NaCl B.HCl C.Na2CO3D.Na 10.可逆反应达到平衡后()A.V正>V逆B.V正=V逆C.V正<V逆D.无法确定11.将pH=3.5的盐酸溶液与pH=10.5的NaOH溶液等体积混合后,溶液的pH是()A.7 B.<7C.>7 D 无法判断12.离子键最可能存在于()A.金属原子之间B.非金属原子之间C.金属原子与非金属原子之间D.任意两种元素的原子之间13.用0.1000 mol/L NaOH溶液滴定等体积、等pH值的HCl溶液和HAc 溶液时,所消耗NaOH溶液的体积()A.相同B.V NaOH(HCl溶液消耗)> V NaOH(HAc溶液消耗)C.V NaOH(HCl溶液消耗)< V NaOH(HAc溶液消耗)D.无法确定14.34.2 g/L蔗糖溶液的物质的量浓度为(蔗糖的摩尔质量为342 g/mol)()A.0.01 mol/L B.0.1 mol/LC.0.001 mol/L D.1 mol/L15.摩尔是表示()A.物质的量的单位B.摩尔质量的单位C.物质浓度的单位D.物质微粒的单位16.目前对人类环境造成危害的酸雨主要是由下列哪种气体污染造成的()A.CO2B.H2S C.SO2D.CO17.配制医疗上用的生理盐水是采用固体()A.NaCl B.KCl C.CaCl2 D.MgCl2 18.下列不能与氯气直接化合的物质是()A.H2B.Na C.Fe D.N219.没有强烈刺激性气味的气体是()A.O2 B.NH3C.SO2D.Cl220.原子序号11~17号的元素,随核电核数的递增而逐渐变小的是()A.电子层数B.最外层电子数C.原子半径D.元素最高化合价21.金属Na长时间放置在空气中,最终的产物是()A.Na2CO3B.NaOHC.Na2O D.Na2O222.已知某溶液,可使石蕊试液变红,使甲基橙变黄色,则该溶液的pH 值范围为( ) A.8~10 B.5~8C.4.4~5.0 D.3.1~4.423.一定温度下,加水稀释弱酸,下列数值将减少的是()A.[H+] B.pH C.Ka D.不确定24.可逆反应C(s)+H2+H2(g)-Q (表示正反应为吸热反应)达平衡状态时,若降低温度,则化学平衡向哪移动()A.正反应方向B.逆反应方向C.没有D.无法判断25.下列指示剂中,不属于酸碱指示剂的是()A.酚酞B.甲基橙C.石蕊D.淀粉26.下列关于催化剂作用的叙述中错误的为()A.可以加速某些反应的进行B.可以抑制某些反应的进行C.可以使正逆反应速度以相等的速度加快D.可以改变反应进行的方向27.醋酸与NaOH溶液等浓度等体积混合后,溶液的pH是()A.等于7 B.小于7 C.大于7 D.无法判断28.某同学选择HAc~NaAc作缓冲对,配制pH=5.0的缓冲溶液,经酸度计测定所配溶液的pH为4.78,则应向此缓冲溶液中滴加少量什么溶液来调节。
无机化学B

一、单项选择题(每题1分,共计20分)1、AlF 3、AlCl 3、AlBr 3、AlI 3熔沸点变化规律是( )。
(A) AlF 3>AlCl 3<AlBr 3<AlI 3 (B) AlF 3>AlCl 3>AlBr 3>AlI 3 (C) AlF 3<AlCl 3<AlBr 3<AlI 3 (D) AlF 3>AlCl 3>AlBr 3<AlI 32、可准确解释AlF3、AlCl 3、AlBr 3、AlI 3熔沸点变化规律的理论是( ) (A) 共价键理论 (B) 离子键理论 (C) 金属键理论 (D) 极化理论3、可解释SiF4、SiCl 4、SiBr 4、SiI 4熔沸点变化规律的理论是( )。
(A) 分子间作用力理论 (B) 杂化轨道理论 (C) 分子轨道理论 (D) 共价键理论4、ClF 3具有近似T 型结构,你会采取( )理论加以解释。
(A) 价键理论 (B) 杂化轨道理论 (C) 分子轨道理论 (D) 价层电子对互斥理论5、核外电子出现的几率可用( )描述。
(A) 波函数 (B) 轨道 (C) 电子云 (D) 电子排布 6、HgCl 2分子构型为直线型,则Hg 原子采取( )杂化方式。
(A) sp (B) sp 2 (C) sp 3 (D) sp 47、下列物质能被空气中的氧所氧化的是( )。
(A) Cu(OH)2 (B) Mn(OH)2 (C) Fe(OH)3 (D) Ni(OH)2 8、可溶于水的化合物是( )(A) BaS (B) MnS (C) ZnS (D) HgS 9、下列两性氧化物( )的酸性最弱。
(A) SnO (B) SnO 2 (C) PbO (D) PbO 2 10、水溶液中不存在四价钛,而是以钛铣离子( )方式存在。
(A) 2+TiO (B) 22TiO + (C) 2TiO + (D) +TiO11、下列物质热稳定性最大的是( )。
无机化学b习题答案

无机化学b习题答案
无机化学B习题答案
在无机化学B课程中,学生们经常会遇到各种各样的习题。
这些习题涉及到化学键的形成、离子化合物的性质、配位化合物的结构等等。
为了帮助学生更好地理解课程内容,我们为大家整理了一些常见的习题答案,希望能对大家的学习有所帮助。
1. 问题:氯化钠是一种离子化合物,它的晶体结构是什么样的?
答案:氯化钠的晶体结构是面心立方结构,其中钠离子和氯离子呈现六方最密堆积。
2. 问题:铁的氧化态有哪些?
答案:铁的氧化态有+2和+3两种,分别对应于亚铁离子和三价铁离子。
3. 问题:铜离子在水溶液中的颜色是什么?
答案:铜离子在水溶液中呈现蓝色。
4. 问题:氯气和氢气发生反应会得到什么产物?
答案:氯气和氢气反应会得到盐酸。
5. 问题:硫酸铜和氢氧化钠反应会得到什么产物?
答案:硫酸铜和氢氧化钠反应会得到氢氧化铜和硝酸钠。
通过这些习题的解答,我们可以更好地理解无机化学B课程中的一些基本概念和原理。
希望大家在学习过程中能够多加练习,加深对无机化学B的理解,取得更好的成绩。
无机化学试卷及答案

☆☆ 密 封 线 内不要 答题 ☆ ☆《无机化学》试题(B 卷)(答案)本套试卷共 3 页一、判断是非题(每小题2分,共20分)1、同一温度下,溶液的蒸气压大于水的蒸气压。
( × )2、配位化合物在水中的溶解度很低。
( × )3、原子通过化学键结合成分子,所以化学键是分子中相邻原子间较强烈的结合力。
( √ )4、 光子的运动具有波粒二象性,同样原子核外电子的运动具有波粒二象性。
( √ )5、电负性越大的元素氧化性越强。
( √ )6、在同一温度下,某一化学反应的焓变等于其等容反应热。
( × )7、最稳定相态单质的焓值等于零( √ )8、催化剂可以增加活化能,提高反应速率。
( × )9、甲物体的温度比乙物体高,表明甲物体的热力学能比乙物体大。
( × ) 10、同一温度下,平衡常数随反应物浓度的不同而不同。
( × )二、选择题(每小题2分,共计20分)1、 在0oC 时,烧杯中盛有水,上面浮着冰块,保持温度不变,加入少量NaCl 并使其全部溶解,再加入AgNO 3 溶液,此时烧杯中共有( B )相。
A. 1; B 2; C 3; D 4;2、 一定温度下,已知某反应ΔG θ>0,则该反应的平衡常数K θ( C )A.> 0B.< 0C.< 1D.> 13、已知E◎(I2/I-) =;E◎(Br2/Br-) =;在标准状态下,比较I2和Br2氧化性强弱。
( B ) A. I2比Br2强;B. Br2比I2强;C. 一样强;D. 不能确定;4、下列含氢化合物中,不含有氢键的(C)A. CH4;2;C. H3BO3; D. HF ;5、第二十五号元素Mn(25)属于第(C)副族元素。
A. 2 ;B. 5 ;C. 7 ;D. 3 ;6、常温33-溶液中加入一些NaAC晶体并使之溶解,则发生的变化是(D)A. HAC的Kaθ增大;B. HAC的Kaθ减小;C. HAC解离度增大;D. HAC解离度减小;7、在盛有稀盐酸的开口玻璃烧杯中,加入锌粒进行反应生成氢气,问此化学反应系统是:( C )A. 封闭系统;B. 孤立系统;C. 敞开系统;D. 氧化还原系统;8、量子力学中,原子轨道的同义词是(B)A. 电子运动的轨迹;B.波函数;C.原子运动轨道;D.电子云;☆☆密封线内不要答题☆☆9、在下列电池反应中,Ni(s)+Cu+2(aq)=Ni+2·dm3-)+Cu(s);当该原电池的电动势为零时,Cu2+的浓度为(B)A.×1027- mol·dm3-; B.×1021-mol·dm3-;C.×1014- mol·dm3-; D.×1011-mol·dm3-;10、已知下列各电对的标准电极电势:E(Fe3+/Fe2+)=+ ;E(Cu2+/Cu)=+;E(Mg2+/Mg)= ;E(Cl2/Cl-)=+;则在标准条件下,最强的还原剂是( C )+ -三、完成下表:(每个元素2分,共10 分)四、简要回答下列问题(每小题4分,共20 分)1、简述CH4的分子结构:答:CH4中的C原子进行sp3杂化,形成4个等性sp3杂化轨道,每个sp3轨道中的单电子与4个氢原子中的1s电子形成4个等长共价键,故CH4空间构型是四面体。
无机化学专科试卷B及答案

⽆机化学专科试卷B及答案⽯家庄学院2013—2014学年第⼀学期《⽆机化学》期末考试试卷(闭卷)(注:允许使⽤计算器)⼀、填空题(本⼤题共10个空,每空1分,共10分) 1,含两个或两个以上相的系统称为⾮均相系统。
2.系统与环境之间既有能量交换,⼜有物质交换,该系统为敞开系统3.在热⼒学中,把⽤于确定系统状态的物理量(性质)称为状态函数。
4.热⼒学第⼀定律的数学表达式ΔU=Q+W,它只适⽤于封闭系统。
5.表⽰化学反应及其热效应关系的化学⽅程式叫热化学⽅程式。
6.升⾼温度使化学反应速率加快的主要原因是增加了活化分⼦的百分数。
7.为了使缓冲溶液具有较⼤的缓冲能⼒,配置HA (pKa0=4.74)-NaAc 缓冲溶液时,应将缓冲溶液的pH 值控制在3.74~5.74范围内。
8.元素的电负性是指元素的原⼦在分⼦中吸引成键电⼦的能⼒。
9.H 2O 的沸点⽐H 2S 的⾼是因为H 2O 分⼦之间形成了氢键。
10.波函数的⾓度分布图中的正负号,在原⼦轨道重叠成键时起重要作⽤。
⼆、单项选择题(本⼤题共30⼩题,每题1分,共30分) 11.H 2和O 2在绝热钢瓶中⽣成⽔,则( B )。
A. ΔH = 0B. ΔU = 0C. ΔS = 0D. ΔG =12.孤⽴体系中,下列说法正确的是( D )。
A. ΔU = W 体系>0B. ΔU = W 环境>0C. ΔU = W 体系D. ΔU = 0 13.⼀瓶盛有N 2和H 2的混合⽓体,当选择H 2作为体系时,则环境为( A )。
A. N 2、瓶⼦及瓶外其他物质B. 瓶⼦及瓶外其他物质C. N 2和瓶⼦D. N 214.体系不做⾮体积功的等压过程,吸收的热Q p 与体系焓变关系为( C )。
A. Q p >ΔHD. Q p = ΔU 15.已知H 2O(l)的m f G ?Θ= -237.19 kJ·mol -1,⽔的分解反应2H 2O(l) = 2H 2(g) + O 2(g),在标准状态下,该反应的吉布斯函数变是( D )kJ·mol -1。
湖南理工学院2021年化学化工系无机化学(下)课程考试试题及答案(B卷)

湖南理工学院2021年化学化工系无机化学(下)课程考试试题及答案(B卷)化工系《无机化学》课程考试试题(B卷)2021-2021学年第二学期_07级制药、应化、化学班级时量:120分钟总分100分,考试形式:闭卷一、选择题 ( 共 20题 40分 )1 在下列化合物中,属杂多酸盐的是……………………………() (A)Na3[P(W12O40)] (B) KCr(SO4)2・12H2O (C) Na4Mo7O23 (D) Fe2(CO)92 某金属离子在八面体弱场中的磁矩是4.90 B.M.,而在八面体强场中的磁矩为0,该中心金属离子可能是……………()(A) Cr(III) (B) Mn(II) (C) Mn(III) (D) Fe(II)3 在[Co(en)(C2O4)2]配离子中,中心离子的配位数为…………………………………()(A) 3 (B) 4 (C) 5 (D) 64 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋或低自旋的电子构型是…()(A) d2 (B) d3 (C) d4 (D) d85 不属于强氧化剂的是()。
A PbO2B NaBiO3C HClD (NH4)2S2O86 下列化合物,不属于多元酸的是()A H3AsO4B H3PO4C H3BO3D H4 SiO47 下列新制备出的氢氧化物沉淀在空气中放置,颜色不发生变化的是()A Fe(OH)2B Mn(OH)2C Co(OH)2D Ni(OH)2 8 过渡金属与许多非金属的共同点是:()A 有高的电负性B 许多化合物有颜色C 多种氧化态D 许多顺磁性化合物 9 Fe2+具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能p所要满足的条件是:()A △和P越大越好B △〉PC △〈PD △=P 10 下列配离子属于反磁性的是:()A [Mn(CN)6]4-B [Cu(en)2]2+C [Fe(CN)6]3-D [Co(CN)6]3- 11 在氯的含氧酸中,氧化能力最强的是:()A HClOB HClO2C HClO3D HClO4 12 下列物质中酸性最强的是:()A H3PO4B H3PO3C H3AsO3D H3AsO4 13 下列物质中不属于缺电子化合物的是:()A BCl3B H[BF4]C B2H6D H3BO3 14 下列物质在水中溶解度最小的是:()第 1 页共3页A NaHCO3B Na2CO3C KHCO3D K2CO3 15 下列物质碱性最强的是:()A Be(OH)2B Mg(OH)2C Ca(OH)2D LiOH16 导致水的沸点在同族元素氢化物中反常高的主要原因是:()A 色散力B 诱导力C 取向力D 氢键 17 下列物质中晶格能大小顺序中正确的是:()A MgO��CaO �� NaFB CaO��MgO �� NaFC NaF ��MgO��Ca OD NaF ��Ca O��MgO 18 下列分子中偶极矩等于0的是:()A CS2B NH3C H2SD SO319 下列分子中,含有极性键的非极性分子是:()A P4B BF3C IClD PCl320 下列分子或离子中没有孤对电子的是:()A H2OB H2SC NH4+D PCl3二、填空题 ( 共 5题 15分 )1、K2Cr207溶液分别与BaCl2、KOH和浓HCl(加热)作用,将分别转变为______1_________,_______2_______,____3_________ 。
《无机化学B》答案

《无机化学B 》辅导资料一、选择题:A型题:1. 已知HAc 的θa K =10—4.75 ,将0.2 mol ·L —1 HAc 和0.2 mol ·L —1NaAc 溶液等体积混合,所得溶液pH 为:A .9.25B .4.75C .6.37D .2.35E .2.872. 下列混合溶液为缓冲溶液的是A .NaCl —NH 4ClB .NaOH —NaAcC .NaAc —HAcD .HCl —HAcE .HCl —NH 4Cl3. 有一难溶电解质A 2B ,在水溶液中达到溶解平衡,设平衡时:[A] = x mol ·L —1,[B] = ymol ·L —1,则θSP K 可表达为A .θSP K = x 2·yB .θSP K = x ·yC .θSP K =(2x)2·yD .θSP K = x ·(2y)2E .θSP K = x ·y 2 4. 已知:电极反应Pb 2+ + 2e Pb ,ϕθ Pb 2+/ Pb = -0.126v ,如果 2Pb 2+ + 4e 2Pb,则ϕθ Pb 2+/ Pb 为 A .+0.063v B .+0.252 v C .-0.126 vD .+0.126 vE .-0.252 v5. [Ni(CN)4] 2—的空间构型为平面正方形,则其中心离子采用下列哪种杂化轨道成键:A .sp 3B .dsp 2C .sp 3dD .sp 3d 2 E. d 2sp 36.氨溶于水,氨分子与水分子间产生的作用是哪一种A. 取向力+氢键B. 取向力+诱导力C. 色散力+诱导力D. 色散力+氢键E. 取向力+色散力+诱导力+氢键7.主量子数n =3,•则该电子层最多可容纳的电子数为A. 8电子B. 18电子C. 26电子D. 28电子E. 32电子8.在 HAc 溶液中加入 NaCl ,将发生何种现象A. 溶液的 pH 值升高B. 溶液的 pH 值降低C. 同离子效应D. 溶液的离子强度减少E. 产生沉淀9.铁的原子序数是26,Fe(Ⅲ)离子的电子层结构在基态时是下列哪种构型3d 4sA. [Ar] ↑↑↑↑↑ ↑↓B. [Ar] ↑↑↑↑↑ ↑C. [Ar] ↑ ↓↑ ↓↑ ↓D. [Ar] ↑↑↑↑↑E. [Ar] ↓↑ ↓↑ ↑10.下列哪一种物质中,氧的氧化值与水的氧的氧化值不同A. OH -B. H 3O +C. O 2-D. H 2O 2E. SO 211.在饱和H 2S (θ1a K =9.1×10-8,θ2a K =1.1×10-12)水溶液中,浓度最小的是 A. H 2S B. HS - C. S 2- D. H + E. OH -12.难溶物 Mg(OH)2 的溶解度为 s (mol ·L —1),其 θSP K 的表示式为A. s 3B. 4s 3C. 1/2s 3D. 4s 2E. 2s 213.下列配体中,何种配体是螯合剂 A. NH 3 B. Cl - C. H 2N -NH 2D. NH 2CH 2CH 2NH 2E. SO 42- 14.实际浓度为0.1 mol ·L —1的NaCl 溶液,其有效浓度为0.078 mol ·L —1, 对此现象最恰当的解释是:A .NaCl 部分电离B .NaCl 与水发生了反应C .离子间的相互牵制D .因为H 2O 电离出H +和OH —E .以上说法都不对15.原电池中正极发生的是A .氧化反应B .还原反应C .氧化还原反应D .水解反应E .H +传递反应16.在NaAc 溶液中[OH -]等于A .[(θw K /θ2a K )·c 盐]1/2 B .(θ2a K ·c 盐)1/2 C .(a K θ·c 盐)1/2 D .(θb K ·c 盐)1/2 E .[(θw K /θ1a K )·c 盐]1/217. 下列混合液能够组成缓冲溶液的是A. HCl —NaClB. Na 2HPO 4-—Na 3PO 4C. HAc —NaClD. H 2CO 3—Na 2CO 3E. NaOH —NH 4Cl18. CaC 2O 4的θSP K 为2.6×10-9,若使1升0.02 mol ·L -1Ca 2+溶液生成沉淀,所需最低C 2O 42-浓度为A. 1.0×10-9B. 1.3×10-7C. 2.2×10-5D. 5.2×10-11E. 5.2×10-1019. 液态水中,水分子之间存在A .取向力和诱导力B .诱导力和色散力C .取向力和氢键D .色散力和氢键 E. 取向力、诱导力、色散力和氢键20. 形成外轨型配合物时,中心原子不可能采取的杂化方式是A .dsp 2B .sp 3C .spD .sp 3d 2 E. sp 3d 21. 电极反应: Cu 2++2e = Cu ϕθ=0.34V 当Cu 2+浓度为0.1 mol ·L -1时,ϕ (V)为A. 0.62B. 1.23C. 0.31D. -0.41E. 0.0022. 实验室中配制FeSO 4溶液必须A. 加稀H 2SO 4与铁屑B. 加铁屑C. 加浓H 2SO 4D. 加浓H 2SO 4与铁屑E. 加稀H 2SO 423. 下列有关分步沉淀叙述中正确的是A.J θ先达到溶度积的先沉淀出来。
无机化学试卷B

四、计算题(共20分)
1、按照质子理论,下列各物种中哪一个没有共轭碱?
H3SO4+,H2SO4,HSO4-,SO42-
2、设在洁净的空气中N2、O2和Ar的质量分数分别为0.755,0.232和0.0130,若气的压力是101.325kPa,试计算各气体的分压。
3、已知市售分析纯盐酸的密度为1.18 g/ml,ω(HCl) =37%,(1)求每升中的n(HCl);(2)将此溶液稀释一倍,其浓度c(HCl)为多少?(3)若制备1L0.1mol/L HCl溶液,需浓盐酸若干毫升;(4)欲知(3)中所制备溶液的准确浓度,需进行标定,称取基准物质Na2CO30.1582g,用该盐酸溶液滴定,需29.38 ml,试求出该盐酸溶液的准确浓度c(HCl)为多少?
2010---2011学年度第二学期《无机化学》考试试卷(B)
化生系20级化生()班学号:姓名:
注意:考生答题不能超过装订线(含背面),否则该题无效!
题号
一
二
三
四
五
六
七
八
总分
得分
可能用到的相对原子质量C:C:12 H:1 O:16 N:14 Ca:40 Zn:65 S:32
一、填空题(共40分)
1、一种物质(或几种物质)分散在另一种物质之中所组成的系统就称为系统,被分散的物质称为,也称为分散相,与共存的另一种物质可看作介质,因此称为。
按照分散相被分散的程度即粒子大小,可把分散系统大致分为以下三种:系统;系统;系统。
2、为了研究问题的方便,把一部分物体和周围其他物体划分开来作为研究对象,这部分被划分出来的物体就称为。与密切相关的部分(或与系统相互影响所可及的部分)称为。
3、等温等压表示正方向不能自动进行,而反而是可能进行的了。
无机化学试卷B(6)

− − −
[Cd(CN)]+ [Cd(CN)2] [Cd(CN)3][Cd(CN)4]2-
K1 = 105.48 K2 = 105.12 K3 = 104.63 K 稳= 1018.80
)
[Cd(CN)]+ + CN Cd2++ 4CN
− − −
[Cd(CN)2] + CN
则 [Cd(CN)3] + CN [Cd(CN)4]2- 的 K4…………………………………………… ( (A) K4 = 103.57 (B) K4 = 1015.23 13.32 (C) K4 = 10 (D) K4 = 1013.68
________,________; 能溶于 HNO3 的有_________________________________________; 能溶于氨水的有______________________________________________。 22. 5 分 (4652) 4652 工业上从钛铁矿制备钛白粉,大致可分为四步: 1. 酸解 2. 冷却结晶 3. 加热水解 4. 焙烧 写出 A、B、C、D、E 的化学式。 → C 1 2 A ─────→ TiOSO4 + B ────→ 3 4 Fe 粉 浓 H2SO4 → D ─→ E ─→ TiO2 23. 2 分 (1641) 1641 氢氧化铁的浓强碱性溶液中加入次氯酸钠,并加热,反应的化学方程式是 (标明主要产 物的颜色) ___________________________________________。 三、计算题 ( 共 2 题 15 分 ) 24. 10 分 (4138) 4138 通过计算说明下列氧化还原反应能否发生?若能发生,写出化学反应方程式。 (假设有关物质的浓度为 1.0 mol·dm-3, 已知 ϕ � (Fe3+/Fe2+) = +0.771 V,
无机化学试卷(附答案)
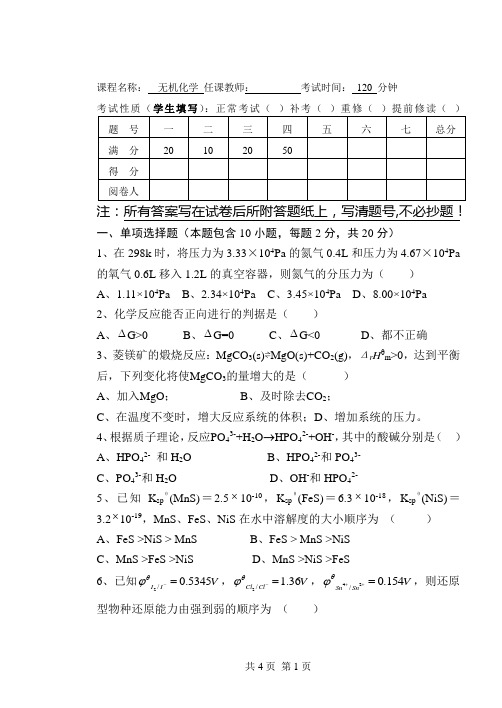
课程名称:无机化学任课教师:考试时间:120 分钟考试性质(学生填写):正常考试()补考()重修()提前修读()注:所有答案写在试卷后所附答题纸上,写清题号,不必抄题!一、单项选择题(本题包含10小题,每题2分,共20分)1、在298k时,将压力为3.33×104Pa的氮气0.4L和压力为4.67×104Pa 的氧气0.6L移入1.2L的真空容器,则氮气的分压力为()A、1.11×104PaB、2.34×104PaC、3.45×104PaD、8.00×104Pa2、化学反应能否正向进行的判据是()A、∆G>0B、∆G=0C、∆G<0D、都不正确3、菱镁矿的煅烧反应:MgCO3(s)⇌MgO(s)+CO2(g),Δr Hθm>0,达到平衡后,下列变化将使MgCO3的量增大的是()A、加入MgO;B、及时除去CO2;C、在温度不变时,增大反应系统的体积;D、增加系统的压力。
4、根据质子理论,反应PO43-+H2O→HPO42-+OH-,其中的酸碱分别是()A、HPO42-和H2OB、HPO42-和PO43-C、PO43-和H2OD、OH-和HPO42-5、已知K spθ(MnS)=2.5⨯10-10,K spθ(FeS)=6.3⨯10-18,K spθ(NiS)=3.2⨯10-19,MnS、FeS、NiS在水中溶解度的大小顺序为()A、FeS >NiS > MnSB、FeS > MnS >NiSC、MnS >FeS >NiSD、MnS >NiS >FeS6、已知2/0.5345I I Vθϕ-=,2/1.36Cl Cl Vθϕ-=,42/0.154Sn SnVθϕ++=,则还原型物种还原能力由强到弱的顺序为()A、Sn2+> I-> Cl-B、I-> Cl-> Sn2+C、Cl-> Sn2+> I-D、I- >Sn2+> Cl-7、配位化合物[Co(NH3)3Cl3]的名称为( )A、三氯化三氨合钴(III)B、三氯·三氨合钴(III)C、三氨化三氯合钴(III)D、三氨·三氯合钴(III)8、a,b,c三个电子具有的量子数(n,l,m)为a:4,2,0;b:4,1,0;c:4,1,-1。
无机化学期末试题题库(130道)

无机化学期末试题1、无机化学研究内容不包括的是()——[单选题]A 物质组成B 结构C 性质D 合成正确答案:D2、某元素处在周期表中的第三周期,该元素原子的电子层数为——[单选题]A 1B 3C 2D 4正确答案:B3、据报道,1995年我国科研人员在兰州首次合成了新核素镤-239,其原子核内有148个中子,则该元素的原子序数为——[单选题]A 148B 239C 91D 108正确答案:C4、不是共轭酸碱对的一组物质是——[单选题]A NH3, NH4+B NaOH, Na+C HS-, S2-D H2O, OH-正确答案:B5、生理盐水的质量浓度为——[单选题]A 4g/LB 9g/LC 15g/LD 50g/L正确答案:B6、2mol MgCl2 和1mol AlCl3中,Cl-的物质的量之比为——[单选题]A 3:2B 2:3C 4:3D 3:4正确答案:C7、物质的量浓度的单位是——[单选题]A mol/LB g/LC 1D g/mol正确答案:A8、下列溶液中渗透压最大的是——[单选题]A 0.1mol·L-1AlCl3B 0.1mol·L-1CaCl2C 0.1mol·L-1葡萄糖(C6H12O6)D 0.1mol·L-1NaCl正确答案:A9、下列说法正确的是——[单选题]A NaCl的质量浓度是0.1mol/LB 水的摩尔质量是18C 1mol H2的质量是2gD 1mol O的质量是32g正确答案:C10、正常人血浆(37˚C时)渗透浓度范围是——[单选题]A 210~280mmol/LB 280~320mmol/LC 280~320mol/LD 380~410mmol/L正确答案:B11、一个电对中,氧化态的氧化能力越强,则其共轭还原态的还原能力——[单选题]A 无法确定B 越强C 越弱D 影响不大正确答案:C12、将12.5g葡萄糖溶于水,配成250mL溶液,该溶液的质量浓度为——[单选题]A 25 g/LB 5.0 g/LC 50 g/LD 0.025 g/L正确答案:C13、决定多电子原子轨道能量的量子数是——[单选题]A n,lB nC lD n,l,m正确答案:A14、正常人血浆(37˚C时)渗透压范围是——[单选题]A 210~280kPaB 720~800kPaC 440~600kPaD 500~1000kPa /L正确答案:B15、下列说法正确的是——[单选题]A p轨道之间以“肩并肩”方式重叠形成σ键B p轨道之间以“头碰头”方式重叠形成π键C p轨道之间以“头碰头”方式重叠形成σ键D s轨道之间以“头碰头”方式重叠形成π键正确答案:C16、基态的电子组态是——[单选题]A [Ar]4s23d4B [Kr]4s23d4C [Ar] 3d54s1D [Xe] 3d54s1正确答案:C17、在氧化还原反应中失去电子的物质是——[单选题]A 氧化剂B 还原剂C 氧化产物D 还原产物正确答案:B18、如果将氮原子的价层电子的运动状态写成为:2,1,0,+1/2; 2, 1,0,-1/2; 2,1,1,+1/2。
无机化学b习题答案

无机化学b习题答案无机化学B习题答案无机化学是研究无机物质及其性质、结构和反应规律的科学。
在学习无机化学的过程中,我们经常会遇到各种各样的习题,通过解答这些习题可以帮助我们巩固知识、提高分析问题和解决问题的能力。
本文将为大家提供一些无机化学B习题的答案,希望能对大家的学习有所帮助。
1. 铝是一种常见的金属元素,其原子序数为13。
请问铝的电子排布是什么样的?答案:铝的电子排布为1s²2s²2p⁶3s²3p¹。
其中,1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁶表示2p轨道上有六个电子,3s²表示3s轨道上有两个电子,3p¹表示3p轨道上有一个电子。
2. 铁是一种重要的金属元素,其原子序数为26。
请问铁的电子排布是什么样的?答案:铁的电子排布为1s²2s²2p⁶3s²3p⁶4s²3d⁶。
其中,1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁶表示2p轨道上有六个电子,3s²表示3s轨道上有两个电子,3p⁶表示3p轨道上有六个电子,4s²表示4s轨道上有两个电子,3d⁶表示3d轨道上有六个电子。
3. 氯是一种常见的非金属元素,其原子序数为17。
请问氯的电子排布是什么样的?答案:氯的电子排布为1s²2s²2p⁶3s²3p⁵。
其中,1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁶表示2p轨道上有六个电子,3s²表示3s轨道上有两个电子,3p⁵表示3p轨道上有五个电子。
4. 请问氯离子的电子排布是什么样的?答案:氯离子是氯原子失去一个电子形成的,因此氯离子的电子排布为1s²2s²2p⁶3s²3p⁶。
无机化学b1考试题型及答案

无机化学b1考试题型及答案一、选择题(每题2分,共20分)1. 下列哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 钾答案:A2. 以下化合物中,属于共价化合物的是?A. NaClB. HClC. NaOHD. MgO答案:B3. 哪种元素的电子排布式为1s²2s²2p⁶3s²3p⁶?A. 氧B. 硫C. 氯D. 氩答案:D4. 下列化合物中,属于离子化合物的是?A. H₂OB. CO₂C. NaClD. CH₄5. 根据元素周期表,下列元素中属于第ⅢA族的是?A. 硼B. 铝C. 镓D. 铟答案:C6. 哪种元素的原子半径在所有元素中最大?A. 氢B. 氦C. 铯D. 钫答案:C7. 以下化合物中,属于金属氧化物的是?A. Fe₂O₃B. H₂OC. COD. SO₃答案:A8. 哪种元素的电负性最高?A. 氟B. 氧C. 氮D. 氯答案:A9. 下列化合物中,属于共价键的是?B. HClC. NaOHD. MgO答案:B10. 根据元素周期表,下列元素中属于第ⅤA族的是?A. 氮B. 磷C. 砷D. 锑答案:B二、填空题(每题3分,共30分)1. 元素周期表中,第______周期的元素数量最多。
答案:六2. 原子的电子排布遵循______原理。
答案:泡利不相容3. 元素的金属性越强,其最高价氧化物对应的水化物的______性越强。
答案:碱性4. 元素的非金属性越强,其最高价氧化物对应的水化物的______性越强。
答案:酸性5. 元素周期表中,第______族的元素都是非金属元素。
答案:ⅦA6. 元素周期表中,第______族的元素都是金属元素。
7. 元素周期表中,第______周期的元素都是过渡金属元素。
答案:四至七8. 元素的电负性越大,其______性越强。
答案:非金属9. 元素的电离能越大,其______性越强。
答案:金属10. 元素的原子半径越大,其______性越强。
东华大学2010~ 2011学年无机化学试题B答案

试卷号:B (答案)一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画)(本大题分8小题, 每小题1分, 共8分)1、错2、错3、对4、对5、错6、错7、错8、错二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(本大题分20小题, 每小题2分, 共40分)1、C2、C3、A4、B5、B6、C7、B8、D9、C10、B11、C12、B13、B14、D15、B16、D17、D18、D19、B20、B三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值)(本大题分7小题, 每小题2分, 共14分)1、a2 / (1 - a)2;不变;不移动;不移动。
2、小;小。
+ K2CrO4PbCrO4 + 2 KI ; 2.5 ×10 4。
3、PbI4、H2S < CCl4 < BCl3 < CS2;H2S。
5、1s 22s 22p 63s 23p 63d 104s 1, Cu6、Co 3+, Cl -、NH 3、H 2O, 6, 氯化二氯·三氨·水合钴(III )。
7、<, <四、配 平 题 (配 平 下 列 各 反 应 方 程 式 )(本大题分2小题, 每小题2分, 共4分)1、 5 H 5IO 6 + 2 Mn 2+ = 2 MnO 4- + 5 IO 3- + 7 H 2O + 11H +2、 10 Fe ( 粉 ) + 6 KNO 3 (s) = 5 Fe 2O 3 + 3 N 2 + 3 K 2O五、根 据 题 目 要 求 , 解 答 下 列 各 题(本大题共5小题,总计34分)1、(本小题5分)解:SiO 2 (s) + 4HF (g) → SiF 4 (g) + 2H 2O (g)△r G = {[-1512.7 + 2 ×(-228.6) - 4 ×(-273.0) - (-856.7)]}kJ ·mol -1= -21.2 kJ ·mol -1△r G < 0 kJ ·mol -1 反 应 自 发 向 右 进 行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
☆
☆
密
封
姓 名
学 号 班 级
线内不要
《无机化学》试题(B卷)(答案)
本套试卷共 3 页
一、判断是非题(每小题2分,共20分)
1、同一温度下,溶液的蒸气压大于水的蒸气压。
(×)
2、配位化合物在水中的溶解度很低。
(×)
3、原子通过化学键结合成分子,所以化学键是分子中相邻
原子间较强烈的结合力。
(√)
4、光子的运动具有波粒二象性,同样原子核外电子的运动
具有波粒二象性。
(√)
5、电负性越大的元素氧化性越强。
(√)
6、在同一温度下,某一化学反应的焓变等于其等容反应热。
(×)
7、最稳定相态单质的焓值等于零(√)
8、催化剂可以增加活化能,提高反应速率。
(×)
9、甲物体的温度比乙物体高,表明甲物体的热力学能比乙
物体大。
(×)
10、同一温度下,平衡常数随反应物浓度的不同而不同。
(×)
二、选择题(每小题2分,共计20分)
1、
在0o C时,烧杯中盛有水,上面浮着冰块,保持温度不变,加入少量NaCl
并使其全部溶解,再加入AgNO3溶液,此时烧杯中共有( B )相。
A. 1; B 2; C 3; D 4;
2、一定温度下,已知某反应ΔGθ>0,则该反应的平衡常数
Kθ(C)
A.> 0
B.< 0
C.< 1
D.> 1
3、已知E◎(I2/I-) =;E◎(Br2/Br-) =;在标准状态下,比较I2
和Br2氧化性强弱。
( B )
A. I2比Br2强;
B. Br2比I2
强;
C. 一样强;
D. 不能确
定;
4、下列含氢化合物中,不含有氢键的
(C)
A. CH
4
;
2
;
C. H
3
BO
3
; D. HF ;
5、第二十五号元素Mn(25)属于第(C)副族元素。
A. 2 ;
B. 5 ;
C. 7 ;
D. 3 ;
6、常温33-溶液中加入一些NaAC晶体并使之溶解,则发生
的变化是
(D)
A. HAC的Kaθ增大;
B. HAC的Kaθ减小;
C.HAC解离度增大;
D.HAC解离度减小;
7、在盛有稀盐酸的开口玻璃烧杯中,加入锌粒进行反应生
成氢气,问此化学反应系统是:( C )
A. 封闭系统;
B. 孤立系
统;
C. 敞开系统;
D. 氧化还
原系统;
8、量子力学中,原子轨道的同义词是(B)
A. 电子运动的轨迹;
B.波函数;
C.原子运动轨道;
D.电子云;
☆
☆
密
封
姓 名
学 号 班 级
线内不要9、在下列电池反应中,Ni(s)+Cu+2(aq)=Ni+2·dm3-)+Cu(s);
当该原电池的电动势为零时,Cu2+的浓度为
(B)
A.×1027- mol·dm3-;
B.×1021-mol·dm3-;
C.×1014- mol·dm3-;
D.×1011-mol·dm3-;
10、已知下列各电对的标准电极电势:
E(Fe3+/Fe2+)=+ ;E(Cu2+/Cu)=+;
E(Mg2+/Mg)= ;E(Cl2/Cl-)=+;
则在标准条件下,最强的还原剂是
( C )
+ -
三、完成下表:(每个元素2分,共10 分)
原
子
电子排布
价电子
构型
周
期
族区
序
数
141s22s22p63s23p23s23p23IVA p
161s22s22p63s23p43s23p43VIA p
221s22s22p63s23p63d24s23d24s24IVB d
29
1s22s22p63s23p63d104s
1
3d104s14IB ds
261s22s22p63s23p63d64s23d64s24
VII
IB
d
四、简要回答下列问题(每小题4分,共20 分)
1、简述CH4的分子结构:
答:CH4中的C原子进行sp3杂化,形成4个等性sp3
杂化轨道,每个sp3轨道中的单电子与4个氢原子中的1s
电子
形成
4个
等长
共价
键,
故
CH4
空间
构型
是四
面
体。
2、比较浓度均为0. 1 mol·L―1的(A)C6H1
2O6;
(B)NaCl; (C)Na2SO4水溶液的凝固点高低。
答:凝固点从高到低 (A) C6H12O6 > (B) NaCl >
(C) Na2SO4
3、比较下述晶体的熔点高低
(a)CaO(s); (b)C(金刚石,s); (c)CO2(s);
(d)H2O(s);
答:(b)C(金刚石,s)> (a)CaO(s)> (d)H2O(s)> (c)CO2(s)
4、已知反应Cu+2FeCl3 = 2FeCl2+CuCl2和反应CuCl2+Fe=
FeCl2+Cu均向正向进行,请比较下述各氧化还原电对电极电
势E的大小。
(a)Cu2+/ Cu; (b)Fe2+/ Fe; (c)Fe3+
/ Fe2+;
答:(c) E( Fe3+/Fe2+) > (a) E( Cu2+/Cu) > (b)
E( Fe2+/Fe)
5、容量性质状态函数和强度性质状态函数有什么区别
答:容量性质的状态函数具有加和性,而强度性质状态
函数不能加和。
☆
☆
姓
名
密
号
学
级
班
封
线内不要五、计算与应用题(每题10分共30分)
1、计算下列溶液的pH。
(氨水的K b=×10-5.)
(1) mol/L 氨水和 mol/L HCl等体积混合;
(2) mol/L氨水和 mol/L HCl等体积混合;
(3) mol/L NH4Cl和 mol/L NaOH等体积混合;
解:(1) pH=14-p K b-lg(C a/C b)= p K b=×10-5=; (3分)
(2) pH=-lg(K a C NH4+)1/2=-lg(10-14/××10-5)1/2=; (4分)
(3) pH=14-p K b-lg(C a/C b)= p K b=×10-5=; (3分)
2、在标准状态下,已知反应的热力学数据如下:
CaCO3(s) = CaO(s)
+ CO2(g)
θ
m
f
H
∆(298K)/(KJ·mol-1)
θ
m
S(298K)/(J·K-1·mol-1)
θ
m
f
G
∆(298K)/(KJ·mol-1)
通过计算说明:(1) 298K时,反应能否自发进行(2)反应
能够自发进行的最低温度是多少
解:(1) CaCO3(s) = CaO(s) + CO2(g)
△f H◎m KJ/mol -
S◎m J/
△r H◎m={+-}= KJ/mol(2分)
△r S◎m=+= J/ (2分)
△r G◎m = r H◎m- T △r S◎m = = KJ/mol > 0 该反应
在时,不能自发进行。
(2分)
(2)△r G◎m<
0 时,可以自发进行。
△r G◎m = 0时,达到平衡。
△
r G ◎
m =
△ r H◎m -T △r S◎m = 0
T = △r H◎m /△ r S◎m = ×10-3)= (K) (4分)
当温度大于()时,反应可以自发进行。
共10
分
3、 mol/l的HAc与 mol/l NaAc混合溶液100ml,计算该
溶液的PH值。
若再加入1 ml, 1 mol/l 的NaOH溶液,计
算溶液的PH值。
K◎a =×10-5 p K◎a =
解:(1)HAc与NaAc组成缓冲溶液,
PH=Pka -lg (Ca/Cb) = Pka =
(4分)
(2) HAc + OH- = Ac- +
H2O
起始浓度:(mol/l)
平衡浓度:(mol/l)- +
PH=Pka -lg (Ca/Cb)=-lg[-/+]
=-lg=+= (6分)
答:(1)缓冲溶液PH=,(2)加入NaOH后 PH= 共
10分。
