血红蛋白H包涵体染色
第九章 血红蛋白病和免疫性溶血性贫血检查
返回
实验室检查
小细胞低色素性轻度贫血 血片可见25-75%靶型红细胞
异丙醇沉淀试验和热变性试验阳性
变性珠蛋白小体检测阳性
红细胞渗透脆性减低
血红蛋白电泳HbE占75-92%
血 红 蛋 白 病 M 病 (遗传性高铁血红蛋白病)
形成原因: 肽链中与血红素铁原子连接的组氨酸发生 替代,导致部分铁原子呈稳定的高铁状态,影响 Hb正常带氧功能 临床表现: 紫绀和继发性红细胞增多 遗传方式:非显性遗传 (AD)
2
Hb发育遗传控制
基因
2
1
转录 翻译
2
1
G
A
1
珠蛋白链
22
22
Hb
22
22 22 22
F A2 A 成人Hb
GowerⅠ GowerⅡ Portland
Hb类型
胚胎Hb
胎儿Hb
(五)影响血红蛋白结构和功能的因素
珠蛋白基因缺失或缺陷 酶缺陷 化学药物中毒
第四节 血红蛋白病的 ---检查及应用
一 、 概
(一)血红蛋白病定义
述
一组遗传性或基因突变导致生成Hb的珠蛋白 肽链的结构或合成速率改变,从而引起功能异常 所致的一种溶血性贫血。
(二)血红蛋白的组成
正常Hb的组成:
是一种结合蛋白: 血红素 + 珠蛋白
每个Hb单体是由一条珠蛋白肽链和一个血红素组成的 4个Hb单体 → 一个球形四聚体
二 、血红蛋白病
人类珠蛋白基因的组织特异性强,仅在RBC及前 体中才有大量表达。
由珠蛋白基因突变引起珠蛋白 质量畸变(异常Hb病)和 数量畸变(地中海贫血) 所致的疾病统称血红蛋白病
HE染色概念及定义

He染色介绍苏木精—伊红染色法( hematoxylin-eosin staining ) ,简称HE染色法,石蜡切片技术里常用的染色法之一。
苏木精染液为碱性,主要使细胞核内的染色质与胞质内的核糖体着紫蓝色;伊红为酸性染料,主要使细胞质与细胞外基质中的成分着红色。
染色分类易于被碱性或酸性染料着色的性质称为嗜碱性( basophilia )与嗜酸性( acidophilia ) 。
组织内的蛋白质构成蛋白质的氨基酸的种类很多,它们有不同的等电点。
在普通染色法中,染色液的酸碱度为pH6左右,细胞内的酸性物质如细胞核的染色质、腺细胞与神经细胞内的粗面内质网及透明软骨基质等均被碱性染料染色,这些物质称为嗜碱性。
而细胞质中的其它蛋白质如红细胞中的血红蛋白、嗜酸粒细胞的颗粒及胶原纤维与肌纤维等被酸性染料染色,这些物质称为嗜酸型。
如果改变染色液的酸碱度,pH值升高时,则原来被酸性染料染色的物质可变为嗜碱性;pH值降低时,原来被碱性染料染色的物质则可变为嗜酸性。
所以说染色液的pH值可以影响染色的反应。
去氧核糖核酸(DNA)两条链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏木精碱性染料以离子键结合而被染色。
苏木精在碱性溶液中称蓝色,所以细胞核被染成蓝色。
伊红Y是一种化学合成的酸性染料,在水中离解成带负电荷的阴离子,与蛋白质的氨基正电荷的阳离子结合使胞浆染色,细胞浆、红细胞、肌肉、结缔组织、嗜伊红颗粒等被染成不同程度的红色或粉红色,与蓝色的细胞核形成鲜明对比。
伊红是细胞浆的良好染料。
由于组织或细胞的不同成分对苏木精的亲与力不同及染色性质不一样。
经苏木精染色后,细胞核及钙盐粘液等呈蓝色,可用盐酸酒精分化与弱碱性溶液显蓝,如处理适宜,可使细胞核着清楚的深蓝色,胞浆等其它成分脱色。
再利用胞浆染料伊红染胞浆,使胞浆的各种不同成分又呈现出深浅不同的粉红色。
故各种组织或细胞成分与病变的一般形态结构特点均可显示出来。
染色结果细胞核被苏木精染成鲜明的蓝色,软骨基质、钙盐颗粒呈深蓝色,粘液呈灰蓝色。
血红蛋白电泳检查(电泳法)

血红蛋白电泳检查(电泳法)1. 原理血红蛋白是由两对多肽链组成的复杂分子。
每一条链含有血红素和络合铁原子的卜啉。
所有血红蛋白的血红素部分都是相同的。
所测定的血红蛋白的蛋白部分称之为珠蛋白。
正常人血红蛋白多肽链包括α、β、δ和γ。
血红蛋白的结构、分子特性取决于形成其肽链的氨基酸顺序和性状。
氨基酸不同可形成不同的血红蛋白,其表面电荷不同,在电场中的泳动率不同。
本实验在碱性(PH=8.60)条件下,以琼脂糖凝胶电泳的方法进行,对红细胞洗涤后造成溶血,电泳分离血红蛋白后以氨基黑染色。
多余的染色液用酸性液体洗去。
待琼脂糖凝胶板干燥后,肉眼可直接判别有无电泳条带异常。
运用光密度扫描仪检测准确定量分析电泳条带异常情况。
血红蛋白异常有二种类型:血红蛋白性质或结构的异常称之为血红蛋白病。
血红蛋白中的一条链合成减少引起血红蛋白性质异常,称之为地中海贫血。
2. 标本采集2.1 标本采集前病人准备:受检者应空腹。
2.2 标本种类:抗凝血2.3 标本要求:抗凝剂选用EDTA,柠檬酸或肝素均可,避免碘乙酸。
常规静脉采血1.8ml,加入含有109mmol/L枸橼酸钠溶液0.2ml的干燥。
清洁试管中,充分混匀。
3. 标本储存:储存于2-8℃冰箱中,5天。
4. 标本运输:储存于2-8℃状态下的冰壶或泡沫箱密封运输。
5. 标本拒收标准:细菌污染、溶血或脂血标本不能作测定。
6. 试剂6.1 试剂名称:血红蛋白电泳检查试剂6.2 试剂生产厂家:法国Sebia公司6.3 包装规格:150tests6.4 试剂盒组成琼脂糖凝胶 10块溶血素 1瓶缓冲液条带 10包×2条薄滤纸1×10张氨基黑(浓缩液)1瓶×100ml点样模具滤纸 10条×1盒6.5 试剂储存条件及有效期:贮存于室温(15~30℃)或冰箱(2~8℃),不能冷冻。
有效期两年。
7. 仪器设备7.1 仪器名称:SEBIA电泳仪7.2 仪器厂家:法国Sebia公司7.3 仪器型号:HYDRASYS8. 操作步骤8.1 血红蛋白液制作:抗凝血离心,5000rpm,5分钟,去掉血浆,用10倍体积的生理盐水洗涤红细胞3次,若红细胞体积小于10ul,需特别小心。
血红蛋白病

血红蛋白病遗传性血红蛋白异常包括珠蛋白结构异常即异常血红蛋白病(hemoglobinopathy)和珠蛋白肽链合成障碍两大类。
异常血红蛋白病血红蛋白由珠蛋白和血红素结合而成。
异常血红蛋白病是因为珠蛋白链氨基酸序列发生改变,导致其功能和理化性质异常的一组结构性血红蛋白病。
目前已发现近700 种变异型血红蛋白,其中绝大部分为单个氨基酸替代,很少一部分为双氨基酸替代、缺失、插入、融合及链延伸所致。
我国异常血红蛋白病的发病率约为0.29%,已发现70 余种变异型血红蛋白,分布于几十个民族。
大多数变异型血红蛋白不伴有功能异常,临床上也无症状。
异常血红蛋白病可根据功能特点或结构变化加以分类。
异常血红蛋白理化性质改变,可表现为溶解性降低形成聚集体(如血红蛋白S)、氧亲和力变化、形成不稳定血红蛋白或高铁血红蛋白等。
一、镰状细胞贫血(sickle cell anemia)本病主要见于非洲和非裔黑人。
血红蛋白S(HbS)的变异是β 链第6 位谷氨酸被缬氨酸替代,其遗传学基础是β 基因第6 编码子的胸腺嘧啶替换为腺嘌呤(即GTG→GAG)。
纯合子状态的患者红细胞内HbS 浓度高,HbS 的氧亲和力降低,脱氧HbS易于形成螺旋状多聚体,使红细胞变形为镰状,称为镰变(sickling)。
镰状细胞膜僵硬,变形性降低,造成以下病理现象或临床表现:①溶血:因镰变及切变力诱发红细胞在循环中破坏,造成血管内溶血。
镰状细胞被单核-巨噬细胞系统识别和捕获,造成血管外溶血。
患者在刚出生时,因血红蛋白F 比例高,镰变现象不明显,3~4 个月后才出现贫血及黄疸,6 个月后可见脾大。
②血管阻塞:镰状细胞变形性降低,粘度增加,在微循环内淤滞,造成血管阻塞及受累组织器官的功能障碍。
临床上血管阻塞有急性发作和慢性进展两种形式。
前者表现为急性发生的骨痛、胸痛和(或)腹痛,称为血管阻塞“危象”,常在病程中反复出现。
其他急性血管阻塞表现还有手足综合征和脑卒中等。
血液内科血红蛋白病患者诊治规范

血液内科血红蛋白病患者诊治规范血红蛋白病是一组珠蛋白生成障碍性贫血,包括珠蛋白肽链分子结构异常(异常血红蛋白病)或珠蛋白肽链量的不正常(海洋性贫血)所引起的一组遗传性疾病。
(一)异常血红蛋白病1.镰状细胞贫血镰状细胞贫血是β珠蛋白链第6位谷氨酸被缬氨酸替代所致的血红蛋白S病。
红细胞内血红蛋白S浓度较高时(纯合子状态),对氧亲和力显著降低,加速氧的释放。
患者虽能耐受严重缺氧,但在脱氧情况下血红蛋白S分子间相互作用,成为溶解度很低的螺旋形多聚体,使红细胞扭曲成镰状细胞。
患者出生后3~4个月即有黄疸、贫血及肝脾大,发育较差。
由镰状细胞阻塞微循环而引起的脏器功能障碍可表现为腹痛、气急、肾区痛和尿血。
患者常因再生障碍性危象、贫血加重、并发感染而死亡。
体外重亚硫酸钠镰变试验可见大量镰状红细胞,有助诊断。
临床无症状或偶有尿血、脾梗死等表现。
本病无特殊治疗,宜预防感染和防止缺氧。
溶血发作时可予供氧、补液和输血等支持疗法。
2.不稳定血红蛋白由α或β珠蛋白肽链与血红素紧密结合的氨基酸发生替代或缺失,损害肽链结构并影响其与血红素的结合力。
不稳定血红蛋白易受氧化作用而丢失血红素,珠蛋白链在细胞内发生沉淀,形成海因小体,附着于细胞膜,使红细胞僵硬而易遭脾破坏。
本症患者贫血轻重不一,也可无贫血及其他临床症状。
实验室检查血红蛋白电泳的检出率不高,仅少数患者可与血红蛋白A分开而被检出。
海因小体生成试验阳性,异丙醇试验及热变试验阳性,是必要的诊断条件。
本证应与G-6-PD缺乏及其他血红蛋白病鉴别。
对患者应强调防治感染和避免服用磺胺类及其他氧化药物。
脾切除可使红细胞寿命延长,溶血减轻,但对重型患者可能无效。
3.血红蛋白MHbM共发现5种,其中4种的α或β肽链中的近端或远端组氨酸由酪氨酸替代,酪氨酸的酚侧链与血红素铁相结合,铁被氧化为三价铁。
患者可有发绀,但高铁血红蛋白一般不超过30%。
溶血多不明显,红细胞内也不形成海因小体。
有异常血红蛋白吸收光谱,高铁血红蛋白增高。
血红蛋白异常所致的贫血及其实验诊断考点总结
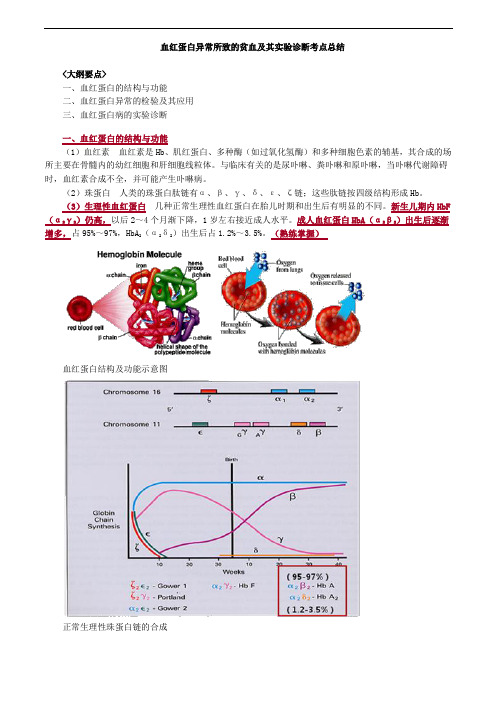
血红蛋白异常所致的贫血及其实验诊断考点总结<大纲要点>一、血红蛋白的结构与功能二、血红蛋白异常的检验及其应用三、血红蛋白病的实验诊断一、血红蛋白的结构与功能(1)血红素血红素是Hb、肌红蛋白、多种酶(如过氧化氢酶)和多种细胞色素的辅基,其合成的场所主要在骨髓内的幼红细胞和肝细胞线粒体。
与临床有关的是尿卟啉、粪卟啉和原卟啉,当卟啉代谢障碍时,血红素合成不全,并可能产生卟啉病。
(2)珠蛋白人类的珠蛋白肽链有α、β、γ、δ、ε、ζ链;这些肽链按四级结构形成Hb。
(3)生理性血红蛋白几种正常生理性血红蛋白在胎儿时期和出生后有明显的不同。
新生儿期内HbF (α2γ2)仍高,以后2~4个月渐下降,1岁左右接近成人水平。
成人血红蛋白HbA(α2β2)出生后逐渐增多,占95%~97%,HbA2(α2δ2)出生后占1.2%~3.5%。
(熟练掌握)血红蛋白结构及功能示意图正常生理性珠蛋白链的合成二、血红蛋白异常的检验及其应用1.血红蛋白电泳(原理了解,其余掌握)2.抗碱血红蛋白测定(熟练掌握)3.异丙醇沉淀试验(掌握)4.红细胞包涵体试验(掌握)5.HbA2测定(熟练掌握)6.珠蛋白肽链分析(掌握)7.红细胞镰变试验(掌握)1.血红蛋白电泳原理:根据不同的血红蛋白带有不同的电荷,等电点不同,在一定的pH缓冲液中,缓冲液的pH大于Hb的等电点时其带负电荷,电泳时在电场中向阳极泳动,反之,Hb带正电荷向阴极泳动。
经一定电压和时间的电泳,不同的血红蛋白所带电荷不同、相对分子质量不同,其泳动方向和速度不同,可分离出各自的区带,同时对电泳出的各区带进行电泳扫描,可进行各种血红蛋白的定量分析。
参考值:pH8.6TEB缓冲液醋酸纤维膜电泳,正常血红蛋白电泳区带:HbA>95%、HbF<2%、HbA2为1.0%~3.1%。
pH8.6TEB缓冲液适合于检出HbA、HbA2、HbS、HbC,但HbF不易与HbA分开,HbH与HbBarts不能分开和显示,应再选择其他缓冲液进行电泳分离。
血液学检验3.5.4 血红蛋白异常的检查

二、珠蛋白生成障碍性贫血常用的 检验方法
• (一)血红蛋白电泳 [原理]
PH缓冲液
血红蛋白分子结构差异
电荷性质数量差异
电压
不同区带
结果
• 正常人HbA>95%; • HbA2为2.5%-3.5% • HbF<2% • β-珠蛋白生成障碍性贫血的HbA2量测定 • 发现异常血红蛋白:如HbH、HbE、 HbS、
根据基因突变和临床特征可分为
1 、轻型 为β地贫基因的杂合子,多数患者无 症状,或轻度的症状。少数患者常感乏力,可有 轻度贫血,脾肿大。贫血为小细胞低色素性贫血。 血片中可见到靶形红细胞。
• (3)靶形红细胞 (target cell)。常 见于各种低色素性 贫血时尤易见到。
靶形红细胞(target cell)
结果:
正常成年人小于1%,新生儿高达80%以上。
临床意义: 1、 β珠蛋白生成障碍性贫血患者阳性细胞
明显增多。 2、遗传性胎儿血红蛋白持续综合症患者阳性
细胞高达100%。 3、孕妇和新生儿阳性细胞生理性增多
异常血红蛋白病
• 异常血红蛋白病是一组遗传性珠蛋白链分 子结构异常疾病, 是由控制多肽链合成的 基因发生突变,氨基酸组成改变,产生结 构异常的肽链。
HbBarts、HbD和HbC等
• pH8.6醋纤电泳:适合于检出 HbA、HbA2、HbS、HbC, 但 HbF不易与HbA分开,HbH与Hb Barts不能分开和显 示。
• pH 6.5 醋纤电泳:主要用于HbH和HbBarts的检出。HbH 等电点为5.6,在PH 6.5 TEB缓冲液中电泳时泳向阳极, HbBarts则在点样点不动,而其余的血红蛋白都向阴极移 动
检验
• 1、血象:贫血、网织红细胞增高。 • 2、骨髓象:增生性骨髓象。 • 3、特殊检查:变性珠蛋白小体、热变性试验、异
血红蛋白异常所致的贫血及其实验诊断

血红蛋白异常所致的贫血及其实验诊断一、血红蛋白的结构与功能1.血红素:血红素是Hb、肌红蛋白、多种酶(如过氧化氢酶)和多种细胞色素的辅基,其合成的场所主要在骨髓内的幼红细胞和肝细胞线粒体。
与临床有关的是尿卟啉、粪卟啉和原卟啉,当卟啉代谢障碍时,血红素合成不全,并可能产生卟啉病。
2.珠蛋白:人类的珠蛋白肽链有α、β、γ、δ、ε、ζ链;这些肽链按四级结构形成Hb。
3.生理性血红蛋白:几种正常生理性血红蛋白在胎儿时期和出生后有明显的不同。
新生儿期内HbF(α2γ2)仍高,以后2~4月渐下降,1岁左右接近成人水平。
成人血红蛋白HbA(α2β2)出生后逐渐增多,占95%~97%,HbA2(α2δ2)出生后占1.2%~3.5%。
4.血红蛋白的功能:运输02和CO2。
二、血红蛋白异常的检验及其应用1.血红蛋白电泳(1)原理:根据不同的血红蛋白带有不同的电荷,等电点不同,在一定的pH缓冲液中,缓冲液的pH 大于Hb的等电点时其带负电荷,电泳时在电场中向阳极泳动,反之,Hb带正电荷向阴极泳动。
经一定电压和时间的电泳,不同的血红蛋白所带电荷不同、相对分子质量不同,其泳动方向和速度不同,可分离出各自的区带,同时对电泳出的各区带进行电泳扫描,可进行各种血红蛋白的定量分析。
2)参考值1)pH8.6TEB缓冲液醋酸纤维膜电泳:正常血红蛋白电泳区带:HbA>95%、HbF<2%、HbA2为1.0%~3.1%。
pH8.6TEB缓冲液适合于检出HbA、HbA2、HbS、HbC,但HbF不易与HbA分开,HbH与HbBarts不能分开和显示,应再选择其他缓冲液进行电泳分离。
2)pH6.5TEB缓冲液醋酸纤维膜电泳:主要用于HbH和HbBarts的检出。
HbH等电点为5.6,在pH6.5TEB缓冲液中电泳时泳向阳极,HbBarts 则在点样点不动,而其余的血红蛋白都向阴极移动。
3)临床意义1)通过与正常人的血红蛋白电泳图谱进行比较,可发现异常血红蛋白区带。
血红蛋白病

Hb Bart’s 胎 儿 水 肿 综 合 征 (hydrops fetalis syndrome),患儿为常染色体显性纯合子,父母均为 地1单倍型杂合子。胎儿无珠蛋白链合成,80% 以 上 血 红 蛋 白 为 Hb Bart`s(A4 、 G4) 、 其 余 为 Hb H(4)和Hb Portland (2A2、2G2)。Hb Bart`s有很 高的氧亲和力,致使组织严重缺氧,导致自发性流 产或出生后不久死于严重水肿。
临床类型
③地中海贫血状态
患者有2个基因丧失功能,在东方人通常为地1 杂合子(- -/),而在黑人中通常为地2纯合子( -/-)。本症为轻度地中海贫血,患者有轻度 小细胞性贫血。
④地中海贫血静止型携带者
受累者仅有1个基因丧失功能(/-),有正常 血象,可无临床症状。
地中海贫血
分子病
(molecular disease)
由于基因突变导致蛋白质分子质和量 的异常,从而引起机体功能障碍的一类疾病
称为分子病可分为:运输性蛋白病,凝血及 抗凝血因子缺乏症,免疫蛋白缺陷病,膜蛋 白病,受体蛋白病等。
血红蛋白病
(Hemaglobinopathy)
血红蛋白病是由于珠蛋白分子结构 和合成异常所引起的疾病,是运输性 蛋白病的代表。
全世界异常血红蛋白携带者有1亿多人
血红蛋白的分子结构及其遗传控制
血红蛋白分子 由四个亚单位组 成,每个亚单位 包括一条珠蛋白 (globin)肽链 和一个血红素 (heme)辅基
珠蛋白分类
类链:、ζ、链 类链:、、Gγ、Aγ、链
组合
Hb Gowerl (ζ2 2)、Hb Gower2(2 2)、 Hb Portland(ζ2 γ2)、HbF(2 γ2)、 HbA(2 2)、HbA2(2 2) 成人血红蛋白有三种:HbA,占95%以上, HbA2,占2~3.5%,HbF,少于1.5%。
医学检验·检查项目:变性球蛋白(Heinz)小体生成试验_课件模板

医学检验·各论:变性球蛋白(Heinz)小体生成试验 >>>
相关检查:
尿血红蛋白定性、尿血红蛋白(uHB)、 血红蛋白C晶体包涵体试验、叠氮高铁血 红蛋白、红细胞葡萄糖-6-磷酸脱氢酶活 性、葡萄糖-6-磷酸脱氢酶。
医学检验·各论:变性球蛋白(Heinz)小体生成试验 >>>
相关症状: 溶血性黄疸、溶血性贫血、免疫性溶血、 溶血现象。
医学检验·各论:变性球蛋白(Heinz)小体生成试验 >>>
相关疾病: 白细胞葡萄糖-6-磷酸脱氢酶缺乏症、糖 原贮积病Ⅰ型、小儿葡萄糖-6-磷酸脱氢 酶缺乏症、葡萄糖-6-磷酸脱氢酶缺乏症。试验 内容课件模板
医学检验·各论:变性球蛋白(Heinz)小体生成试验 >>>
别名: 血红蛋白H。
医学检验·各论:变性球蛋白(Heinz)小体生成试验 >>>
简介:
血液中加入氧化还原染料煌焦油蓝, 经37℃孵育后,HbH因氧化变性而发生沉 淀,呈颗粒状,被染色深蓝色,均匀而弥 温地分散在红细胞内。
医学检验·各论:变性球蛋白(Heinz)小体生成试验 >>>
临床意义:
葡萄糖-6-磷酸葡萄糖脱氢酶(G-6-PD) 缺乏可致红细胞内还原型谷胱甘肽含量减 少随之出现高铁血红蛋白增高最后形成变 性珠蛋白小体这是附在细胞膜上的一种变 性血红蛋白颗粒又称血红蛋白包涵体能被 某些碱性染料染成染色或蓝黑色小点 增 高见于G-6-PD缺乏所致的蚕豆病伯氨基酸 喹啉类药物
医学检验·各论:变性球蛋白(Heinz)小体生成试验 >>>
临床意义: 所致的溶血性贫血不稳定血红蛋白(Hb)病 等平均可达67.8%(45%~92%)。
红细胞和血红蛋白讲稿

红细胞和血红蛋白讲稿各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢一、红细胞和血红蛋白的检验红细胞的生成起源于从造血干细胞分化来的红系祖细胞(BFU-E和CFU-E),在红细胞生成素(erythropoietin,EPO)的作用下,继续增殖和分化为形态学上可辨认的骨髓原红细胞,并启动红细胞内血红蛋白和血型抗原的合成。
红细胞的主要生理功能是作为呼吸载体从肺部携带氧输送至全身各组织,并将组织中的二氧化碳运送到肺而呼出体外。
红细胞的平均生存时间约为120天,因此成人体内每天约有1/120的红细胞因衰老而被破坏,同时又有相应数量的红细胞和血红蛋白生成以维持动态平衡,使循环血液中的红细胞和血红蛋白数量能保持相对恒定。
参考值红细胞数血红蛋白成年男性(~)×1012/ L 120~160g/L成年女性(~)× 1012/L 110~150g/L新生儿(~)× 1012/L 170~200g/L临床意义(-)红细胞及血红蛋白增多是指单位容积血液中红细胞数及血红蛋白量高于参考值高限。
一般经多次检查成年男性红细胞>×1012/L,血红蛋白>170g/L;成年女性红细胞>×1012/L,血红蛋白>160g/L时即认为增多。
可分为相对性增多和绝对性增多两类:1.相对性增多是因血浆容量减少,血浆中水分丢失,血液浓缩,使红细胞容量相对增加。
见于严重呕吐、腹泻、大量出汗、大面积烧伤、慢性肾上腺皮质功能减退等。
2.绝对性增多临床上称为红细胞增多症(polycythemia,erythrocytosis),可由多种原因所引起。
按发病原因可分为继发性和原发性两类,后者即真性红细胞增多症。
(1)继发性红细胞增多症:是非造血系统疾病,发病的主要环节是血中红细胞生成素增多。
l)红细胞生成素代偿性增加:因血氧饱和度减低,组织缺氧所引起。
红细胞增多的程度与缺氧程度成正比。
电泳

2.1 标本采集前病人准备:受检者应空腹。
2.2 标本种类:抗凝血
2.3 标本要求:抗凝剂选用EDTA,柠檬酸或肝素均可,避免碘乙酸。常规静脉采血1.8ml,加入含有109mmol/L枸橼酸钠溶液0.2ml的干燥。清洁试管中,充分混匀。
4. 标本储存:储存于2-8℃冰箱中,5天。
9.7 降低支架,使缓冲条不接触到凝胶板。
9.8 从保温盒里取出加样器。取时拿保护框。折断加样器齿端保护框。将加样器放在4号位置。
9.9 关上电泳仪盖子,按下键盘左侧的绿色箭头“START”键,电泳开始。
9.10 凝胶染色扫描
9.10.1 打开盖子
9.10.2 取出并丢弃加样器
9.10.3 升高两个支架,握住塑料端取出并丢弃缓冲条。
1个月:HbA 12-40﹪,HbF 60-93%,HbA2 0.1-1.0%
6个月:HbA 86-98﹪,HbF 0.84-10.7%,HbA2 0.87-2.9%
脐带血:HbA 4-40﹪,HbF 30-96%,HbA2﹤1.0%
11. 质量控制
建议测定每一批样本时都附有一控制品或含有血红蛋白A,F,C和S的血样本。
-3倍, α1巨球蛋白为正常人的3.5倍, β脂蛋白为3
倍,IgM为3倍,这时血清白蛋白的半衰期也明显延
长, 可为正常人的3-4倍, 对维持血浆胶体渗透压
均有一定作用。
蛋白合成功能遗传性缺陷或明显低下所致。该病患
者的白蛋白含量尽管只有正常人的0.05%, 而其血
浆胶渗透压仍为正常人水平的 1/2左右, 是由于
球蛋白代偿性增加所致,如传铁蛋白为正常人的 2
1. 原理
常用染色方法

常用染色方法过氧化酶染色法(POX) (2)铁染色法 (2)碱性磷酸酶染色法(NAP) (3)糖原染色法(PAS) (4)非特异性酯酶染色法 (5)酸性磷酸酶染色法(ACP) (5)苏丹黑B染色法 (6)阿利新染色法 (6)中性粒细胞中毒颗粒染色法 (7)嗜碱性粒细胞染色法 (7)嗜酸性粒细胞染色法 (7)血红蛋白H包涵体染色法 (7)T和B淋巴细胞酯酶标记鉴别法 (7)抗酒石酸酸性磷酸酶染色法(偶氮法) (7)碘化钾过氧化酶染色法(pereira氏法) (7)5-核苷酸酶染色法 (7)过氧化酶染色法(POX)一、溶液配制第一液 联苯胺 0.3g 待溶解后加入36%亚硝基铁氰化钠1ml (3.6g+6.4ml ) 碱性复红 0.3g 95%酒精 100ml 第二液3%H 2O 2 0.3ml (7滴) 用时新鲜配制蒸馏水25ml二、操作步骤1、新鲜涂片加第一液 1分钟2、再加等量第二液 4分钟3、用蒸馏水冲洗后,再用95%酒精褪色,至红色褪掉为止4、水洗后待干,再用瑞氏染液复染,时间为40-50分钟5、水洗后待干,镜检三、结果判定若细胞具有POX ,用此染色即有黑色颗粒出现在细胞内,为阳性,无黑色颗粒为阴性。
1、 粒细胞除早期原粒均为阴性2、 单核细胞为弱阳性反应,部分网状细胞呈弱阳性反应3、 淋巴细胞、巨核细胞、浆细胞为阴性反应铁染色法一、原理:幼红细胞胞浆内的铁,网状细胞及造血岛内铁粒在酸性条件下,可与亚铁氰化钾起反应,产生蓝色普鲁士蓝沉积。
二、试剂配制1、20%亚铁氰化钾溶液2、36%浓盐酸3、甲醇4、0.2%核固红(配制:硫酸铝10g 溶于蒸馏水100ml 中,待溶解后加入核固红0.2g 混匀,并放在37℃水浴箱内1小时,时时振荡使其充分溶解后过滤使用) 三、操作步骤1、新鲜涂片甲醇固定10分钟,蒸馏水洗后晾干2、(5份20%亚铁氰化钾,1份36%浓盐酸混合成清亮液)染色30分钟,蒸馏水洗后晾干3、0.2%核固红复染20-30分钟,流水冲洗,晾干。
临床检验技术中级《专业实践能力》试题及答案解析四

临床检验技术中级《专业实践能力》试题及答案解析四[单选题]1.在速率法中,自动生化仪具有线性检(江南博哥)测,最少的测定间隔点为()。
A.4个点B.7个点C.3个点D.6个点E.5个点参考答案:A参考解析:速率法:是指连续测定(每15秒~1分钟监测一次)酶反应过程中某一反应产物或底物的浓度随时间的变化来求出酶反应的初速度的方法,即连续监测法。
连续监测时间在延迟时间之后即开始,一般为60~120s,不少于4个吸光度检测点(3个吸光度变化值)。
[单选题]2.孕妇,29岁Rh(-),第一胎分娩Rh(+)胎儿,为了防止再次妊娠的胎儿产生溶血症,产后72h内应考虑给母亲注射()。
A.免疫增强剂B.抗Rh抗体C.免疫抑制剂D.RH抗原E.不需要注射参考答案:B参考解析:Rh溶血病是由于Rh阴性的妇女,怀孕了Rh阳性的胎儿接受胎儿Rh 阳性红细胞的刺激,产生了抗D lgG,此抗体通过胎盘进入胎儿体内,发生同族免疫反应,即抗D抗体.与Rh阳性(具有D抗原)红细胞发生反应,从而发生溶血。
为防止再次妊娠的胎儿产生溶血症,产后72小时内应考虑给母亲注射抗Rh抗体。
[单选题]3.荧光抗体染色技术中,特异性最高,非特异性染色最低的方法是()。
A.补体结合法B.多标记法C.间接法D.双标记法E.直接法参考答案:E参考解析:荧光抗体染色技术直接法:用将特异荧光抗体直接滴加于标本上,使之与抗原发生特异性结合,本法优点是操作简便,特异性高,非特异性荧光染色因素最少,缺点是敏感度偏低,每检查一种抗原需制备相应的特异荧光抗体。
[单选题]4.对菌群失调的描述,正确的是()。
A.细菌总数和组成发生改变B.杆菌引起的菌群失调以革兰阳性杆菌为主C.菌群失调不会引起腹泻D.长期的抗菌药物治疗不会引起菌群失调E.只有条件致病菌才会引起菌群失调参考答案:A参考解析:由于宿主,外界环境的影响,导致机体某一部位的正常菌群中各种细菌出现数量和质量的变化,原来在数量和毒力上处于劣势的细菌或耐药菌株居于优势地位,在临床上发生菌群失调症或称菌群交替症。
血红蛋白电泳及临床意义

血红蛋白电泳及临床意义血红蛋白电泳可以将血红蛋白中各正常成分或异常成分分离,以便进一步鉴定或定量测定。
用等电聚焦毛细管电泳(CIEF)和区带电泳(CZE)可分离出十几种Hb变异链,有作者采用CZE法对正常人和地中海贫血患者血液样品在pH 11.8碱性磷酸盐缓冲液(PBs)中进行分离,分离的速度很快(<8分钟),两者的电泳图谱明显不同[1]。
对胎儿红细胞处理后,分离其血红蛋白,可分离出α、β和γ几种球蛋白链,如采用低pH 3.2的缓冲液,虽然分析时间延长,但变异体的分辨效果更佳。
显然CE技术对鉴别诊断血红蛋白病起重要作用。
1 材料与方法1.1 检测对象收集2011年1月~2012年12月受检300例均为门诊进行婚前检查或前前检查人员。
其中男60例,女240例,年龄22~35岁,平均为29岁。
1.2 方法电泳槽中的阳极注入 pH9.1的Tris缓冲溶液,阴极注入 pH8.6的巴比妥缓冲溶液,要求两极液面尽量成同一水平。
把醋酸纤维素薄膜裁成4cm×12cm大小,浸入薄膜浸泡液中10min左右,取出,用滤纸吸去多余浸泡液,把薄膜粗面朝上,贴在电泳槽支架上,用两层纱布搭桥,不接通电源,自由平衡5min。
用血红蛋白吸管吸取2~3μ浓度为1 80~100g/L的血红蛋白溶液,放在盖玻片边缘(盖玻片长约1cm),把血红蛋白液用盖玻片印在醋酸纤维素薄膜靠阴极一端约1.5cm处(薄膜下衬一片干燥滤纸,吸去多余的血红蛋白液),同时用正常人血红蛋白液作对照。
接通电源,平衡5min,电压调至150V,电流量约为0.2mA/cm簿膜宽,电泳15~20min。
电泳完毕后,取下薄膜条,置于氨基黑10B染色液里染色10min,取出,用漂洗液漂洗,换液数次,直至薄膜条洁白为止。
2 结果在pH 8.6或pH 8.8电泳时,正常人的血红蛋白A及血红蛋白A2都向正极方向泳动,血红蛋白A在前,血红蛋白A2在后。
但血红蛋白F与血红蛋白A的位置很靠近,难以准确地分离和定量,可作1min碱变性试验,来测定血红蛋白F。
血红蛋白电泳检查(电泳法)

血红蛋白电泳检查(电泳法)1. 原理血红蛋白是由两对多肽链组成的复杂分子。
每一条链含有血红素和络合铁原子的卜啉。
所有血红蛋白的血红素部分都是相同的。
所测定的血红蛋白的蛋白部分称之为珠蛋白。
正常人血红蛋白多肽链包括α、β、δ和γ。
血红蛋白的结构、分子特性取决于形成其肽链的氨基酸顺序和性状。
氨基酸不同可形成不同的血红蛋白,其表面电荷不同,在电场中的泳动率不同。
本实验在碱性(PH=8.60)条件下,以琼脂糖凝胶电泳的方法进行,对红细胞洗涤后造成溶血,电泳分离血红蛋白后以氨基黑染色。
多余的染色液用酸性液体洗去。
待琼脂糖凝胶板干燥后,肉眼可直接判别有无电泳条带异常。
运用光密度扫描仪检测准确定量分析电泳条带异常情况。
血红蛋白异常有二种类型:血红蛋白性质或结构的异常称之为血红蛋白病。
血红蛋白中的一条链合成减少引起血红蛋白性质异常,称之为地中海贫血。
2. 标本采集2.1 标本采集前病人准备:受检者应空腹。
2.2 标本种类:抗凝血2.3 标本要求:抗凝剂选用ED TA,柠檬酸或肝素均可,避免碘乙酸。
常规静脉采血1.8ml,加入含有109mmol/L枸橼酸钠溶液0.2ml的干燥。
清洁试管中,充分混匀。
3. 标本储存:储存于2-8℃冰箱中,5天。
4. 标本运输:储存于2-8℃状态下的冰壶或泡沫箱密封运输。
5. 标本拒收标准:细菌污染、溶血或脂血标本不能作测定。
6. 试剂6.1 试剂名称:血红蛋白电泳检查试剂6.2 试剂生产厂家:法国Sebia公司6.3 包装规格:150test s6.4 试剂盒组成琼脂糖凝胶 10块溶血素 1瓶缓冲液条带 10包×2条薄滤纸1×10张氨基黑(浓缩液)1瓶×100ml点样模具滤纸 10条×1盒6.5 试剂储存条件及有效期:贮存于室温(15~30℃)或冰箱(2~8℃),不能冷冻。
HE染色步骤[推荐]
![HE染色步骤[推荐]](https://img.taocdn.com/s3/m/645e26c84793daef5ef7ba0d4a7302768f996f61.png)
HE染色步骤[推荐]
染色是加入染料将细胞或组织着色的过程。
HE染色是指使用
血红蛋白染成红色,细胞核染成蓝色的染色方法。
HE染色步骤如下:
1. 取制好的玻片(细胞或组织已固定在玻片上),用甲醇或乙醇进行脱水,使细胞或组织变得透明。
2. 将玻片放入染料盒中,加入苏丹三液(血红蛋白染料)浸泡。
时间通常为5-10分钟。
洗净玻片以去除多余的染料。
3. 将玻片放入氧化性酸液中(酸性洗涤液或稍微含有酒精的酸性水溶液),将苏丹三液中的铁离子还原成溶于水的亚铁离子。
时间通常为1-2分钟。
4. 接下来,将玻片放入碱性染色液中(含有甲苯重组溶液和酸性洗涤液的甲苯重组溶液),染色液中的亚铁离子被氧化成沉淀(血红蛋白)。
5. 最后,将玻片漂洗并脱水,然后用透明介质将玻片封闭,使其防止氧化。
通过HE染色,可以使细胞核染成蓝色,血红蛋白染成红色,
从而在显微镜下清晰地观察细胞或组织的结构和特征。
这是一种常用的组织学染色方法。
血红蛋白病

血红蛋白病血红蛋白病(hemoglobinopathy)是指由于珠蛋白分子结构或合成量异常所引起的疾病。
它是人类孟德尔或遗传病中研究得最深入、最透彻的分子病,是运输性蛋白病的代表,是研究人类遗传机理的最好模型。
据估计,全世界有一亿多人携带血红蛋白病的基因,我国南方发病率较高,因此,血红蛋白病是最常见的遗传之一。
(一)正常血红蛋白的组成,结构及遗传控制1.人类血红蛋白的组成和发育变化每个红细胞内含有约28000万个血红蛋白分子,每个分子由四个亚单位构成,每一个单位由一条珠蛋白肽链和一个血红素辅基组成,即血红蛋白分子是由二对珠蛋白链构成的球形四聚体(图4-10)。
其中一对是类α链(α链和ξ链),由1 41个氨基酸组成;另一对是类β链(ε、β、γ和δ链),由146个氨基酸组成。
由这6种不同的珠蛋白链组合成人类的6种不同的血红蛋白,即Hb Gower1(ξ2ε2)、HbGower2、(α2ε2)、Hb Po rtland(ξ2γ2)、HbF(α2γ2)、HbA(α2β2)和HbA2(α2δ2)。
其中γ链有两种亚型,即Gγ2和Aγ2,因此HbF有两类:α2Gγ2和α2Aγ2,前者的第136位氨酸为甘氨酸,后者为丙氨酸。
上述各种血蛋白在发育的不同阶段先后交替出现(图4-11)。
在胚胎发育早期,合成胚胎血红蛋白HbGowerl、HbGower2和HbPortland。
胎儿期(从8周至出生为止)主要是HbF。
成人有3种血红蛋白:HbA,占95%以上;HbA2,占2%-3.5%;HbF,少于1.5%。
2.人类珠蛋白基因人类珠蛋白基因分为两类:一类是类α珠蛋白基因簇(α-like globin ge ne cluster),包括ξ和α基因;另一类是β珠蛋白基因簇(β-like globin gene cluster),包括ε、γ(Gγ和Aγ)、δ和β基因。
(1)类α珠蛋白基因:人类α珠蛋白基因簇位于16p13,每条染色体上均有两个α珠蛋白基因,因此,二倍体细胞中共有4个α基因,每个α基因几乎产生等量的α珠蛋白链。
