第三章焊接过程中的冶金反应原理
焊接冶金学(基本原理)

绪论一、焊接过程的物理本质1.焊接:被焊工件的材质(同种或异种),通过加热或加压或二者并用,并且用或不用填充材料,使工件的材质达到原子问的结合而形成永久性连接的工艺过程称为焊接。
物理本质:1)宏观:焊接接头破坏需要外加能量和焊接的的不可拆卸性(永久性)2)微观:焊接是在焊件之间实现原子间结合。
2.怎样才能实现焊接,应有什么外界条件?从理论来讲,就是当两个被焊好的固体金属表面接近到相距原子平衡距离时,就可以在接触表面上进行扩散、再结晶等物理化学过程,从而形成金属键,达到焊接的目的。
然而,这只是理论上的条件,事实上即使是经过精细加工的表面,在微观上也会存在凹凸不平之处,更何况在一般金属的表面上还常常带有氮化膜、油污和水分等吸附层。
这样,就会阻碍金属表面的紧密接触。
为了克服阻碍金属表面紧密接触的各种因素,在焊接工艺上采取以下两种措施:1)对被焊接的材质施加压力目的是破坏接触表面的氧化膜,使结合处增加有效的接触面积,从而达到紧密接触。
2)对被焊材料加热(局部或整体) 对金属来讲,使结合处达到塑性或熔化状态,此时接触面的氧化膜迅速破坏,降低金属变形的阻力,加热也会增加原于的振动能,促进扩散、再结晶、化学反应和结晶过程的进行。
二、焊接热源的种类及其特征1)电弧热:利用气体介质放电过程所产生的热能作为焊接热源。
2)化学热:利用可燃和助燃气体或铝、镁热剂进行化学反应时所产生的热能作为热源。
3)电阻热:利用电流通过导体时产生的电阻热作为热源。
4)高频感应热:对于有磁性的金属材料可利用高频感应所产生的二次电流作为热源,在局部集中加热,实现高速焊接。
如高频焊管等。
5)摩擦热:由机械摩擦而产生的热能作为热源。
6)等离子焰:电弧放电或高频放电产生高度电离的离子流,它本身携带大量的热能和动能,利用这种能量进行焊接。
7)电子束:利用高压高速运动的电子在真空中猛烈轰击金属局部表面,使这种动能转化为热能作为热源。
8)激光束:通过受激辐射而使放射增强的光即激光,经过聚焦产生能量高度集中的激光束作为热源。
熔焊原理第三章

焊接冶金特点
四、焊接参数对焊接冶金的影响
焊接参数:是指在焊接时,为保证焊接质量,而选定的 焊接电源、焊接电流、电弧电压、焊接速度、热输 入等参数的总称 1、熔合比的影响 在焊缝金属中局部熔化的母材所占的比例称为熔合比 改变焊缝金属的熔合比就可以改变焊缝金属的化学 成分。因此,焊接时必须严格控制焊接工艺条件以 使熔合比稳定合理。 在焊接异种钢时,要根据熔合比选择焊接材料。
氮除了对焊缝的性能有害的作用之外,也 有有利的影响。
气相对金属的作用
气相对金属的作用
3、控制氮的措施
(1)加强机械保护 :主要措施 (2)选用合理的焊接工艺参数 电弧电压增加,焊缝含氮量增大,故应尽量采用 短弧焊。采用直流反极性接法,减少了氮离子向熔 滴溶解的机会,因而减少了焊缝的含氮量 (3)控制焊丝金属的成分 增加焊丝或药皮中的含碳量可降低焊缝的含氮量 焊丝中加入一定数量与氮亲和力大的合金元素,如 Ti、Zr、Al或稀土元素等,可形成稳定氮化物进入 熔渣,起到脱氮的作用
(1)限制焊接材料中的含氢量 焊接材料在使用前应按规定的温度和时间进行烘焙, 存放焊接材料时应采取有必要的防潮措施 对保护气体采用脱水或干燥措施
(2)清除焊件和焊丝表面的杂质 焊前应仔细清理:焊件坡口和焊丝表面的铁锈、 油污、吸附水以及其他含氢物质
气相对金属的作用
(3)进行冶金处理:
通过化学反应降低电弧气氛中氢的分压,从而降低氢在液 体金属中的溶解度
采用直流反极性接法减少了氮离子向熔滴溶解的机会因而减少了焊缝的含氮量3控制焊丝金属的成分增加焊丝或药皮中的含碳量可降低焊缝的含氮量焊丝中加入一定数量与氮亲和力大的合金元素如tizral或稀土元素等可形成稳定氮化物进入熔渣起到脱氮的作用气相对金属的作用四氧对金属的作用及其控制1氧的来源电弧中氧化性气体co2o2h2o等侵入的空气药皮中的高价氧化物和焊接材料与焊件表面的铁锈水分等分解产物2氧对焊缝金属的影响1影响焊缝金属的性能随着焊缝中含氧量的增加其强度塑性韧性等各项力学性能指标都下降其中冲击韧度下降最为显著气相对金属的作用气相对金属的作用2导致气孔的产生生成不溶于金属的co如熔池结晶时co气泡来不及逸出则在焊缝中形成co气孔3合金元素的烧损使钢中的有益合金元素氧化从而使焊缝的性能变坏4产生飞溅在焊接时熔滴区产生的co使熔滴爆炸产生飞溅影响焊接过程的稳定性气相对金属的作用3氧在金属中的溶解氧是以原子氧和氧化亚铁feo两种形式溶于液态铁中的温度升高氧在液态铁中的溶解度增大
3焊接化学冶金及焊缝金属的合金化

三、焊接化学冶金反应区
焊接化学冶金过程是分区域(或阶段)连续进行的,以手工电弧焊为例, 有三个反应区:药皮反应区、熔滴反应区和熔池反应区。
(一)药皮反应区(100℃至药皮的熔点1200℃) 1) 水分的蒸发
>100℃,吸附水全部蒸发; >200~400℃,结晶水被排除; 更高的温度,化合水。
2) 某些物质的分解
(二) 焊缝金属中的氢及其扩散
在钢焊缝中,氢大部分是以H、H+或H-形式存在的,它们与焊缝金属形成 间隙固溶体。由于氢原子和离子的半径很小,这一部分氢可以在焊缝金 属的晶格中自由扩散,故称之为扩散氢。
(3)氢对金属的作用
主要来源:焊接材料中的水分、含氢物质及电弧周围空气中的水蒸气等。 (一) 氢在金属中的溶解 根据氢与金属作用的特点可把金属分为两类: 第一类是能形成稳定氢化物的金属,如Zr、Ti、V、Ta、Nb等。这类金属吸
收氢的反应是放热反应,因此在较低温度下吸氢量大,在高温时吸氢量 少。焊接这类金属及合金时,必须防止在固态下吸收大量的氢,否则将 严重影响接头质量。 第二类是不形成稳定氢化物的金属,如Al、Fe、Ni、Cu、Cr、Mo等。但氢 能够溶于这类金属及其合金中,溶解反应是吸热反应。
1)与熔滴相比,熔池的平均温度较低,1600~1900℃; 2)比表面积较小,约为3~130cm2/kg; 3)反应时间稍长些,但也不超过几十秒; 4)温度分布极不均匀,熔池中有一定的强烈运动。
熔池前部发生金属熔化和气体吸收,并有利于发展吸热反应; 熔池后部发生金属凝固和气体逸出,并有利于发展放热反应。
熔池阶段的反应速度比熔滴阶段小,并且在整个反应过程中的贡献也 较小。合金元素在熔池阶段被氧化的程度比熔滴阶段小就证明了这一 点。但是在某些情况下,熔池中的反应也有相当大的贡献。
第三章:焊接基础知识

三、焊接热循环
• 焊接热循环的概念
T
焊接过程中热源沿焊件秱 动时,焊件上某点温度由 低而高,达到最高值后, 又由高而低随时间的变化 称为焊接热循环
t
焊接热循环是用来描述焊接过程中热源对母 材金属的热作用。
• 在焊缝双侧丌同距离的各点所经历的热循环是 丌同的(见下图)
焊接热循环的主要参数
(一)加热速度(v H) v H= d T / d t
2)置换氧化 ①熔渣中癿SiO2、MnO等发生以下反应: (SiO2)+2[Fe][Si]+2FeO (MnO)+[Fe][Mn]+2FeO 焊缝增Si,Mn,使Fe氧化温度升高, K,故置换氧化主要发生在高温区,随着温 度降低,熔池后部癿低温区Si、Mn被氧化, 生成夹杂
②药皮中含Al、Ti、Cr等强脱氧元素时,置换脱氧效 果更明显,高碳高强钢应采用无SiO2药皮
一、对焊接区癿保护
1.光焊丝焊接时 [N] =0.105﹪~0.218﹪,增加20~45倍, [O] =0.14﹪~0.72﹪,增加7~35倍, [Mn]、[C]蒸发、氧化损失易产生气孔,导 致塑性韧性下降,光焊丝无保护癿焊接丌实用 2.保护方法 药皮、熔渣、药芯、保护气体、自保护等 3.保护效率 不保护方法有关,一般惰性气体保护效果较好
1.药皮反应区
二、焊接冶金学反应区及其反应条件(以 焊条电弧焊为例)(P.45、46,图2-3)
(1)产生癿气体
①100~1200°C:水分蒸发、分解、氧化 a. <100°C 吸附水分蒸发 b.>200~400°C 排除结晶水 c. >400°C 排除化合水 ②有机物癿分解和燃烧:产生CO2、CO、 H2 ③碳酸盐癿分解(大理石CaCO3、菱苦土 MgCO3):产生CO2 ④高价氧化物分解(赤铁矿Fe2O3、锰矿 MnO2):产生O2
焊接冶金学基本原理要点归纳总计

焊接冶金学基本原理绪论1)焊接:焊接是指被焊工件的材质(同种或异种),通过加热或加压或二者并用,并且用或不用填充材料,使工件的材质达到原子间的结合而形成永久性连接的工艺过程。
2)焊接、钎焊和粘焊本质上的区别:焊接:母材与焊接材料均熔化,且二者之间形成共同的晶粒;钎焊:只有钎料熔化,而母材不熔化,在连接处一般不易形成共同晶粒,只有在母材和钎料之间形成有相互原子渗透的机械结合;粘焊:既没有原子的相互渗透而形成共同的晶粒也没有原子间的扩散,只是靠粘接剂与母材的粘接作用。
3)熔化焊热源:电弧热、等离子弧热、电子束、激光束、化学热。
压力焊和钎焊热源:电阻热、摩擦热、高频感应热。
4)焊接加热区:可分为活性斑点区和加热斑点区5)焊接温度场:焊接时焊件上的某瞬时的温度分布称为焊接温度场。
表示方法:等温线或者等温面。
特点:焊接时焊件上各点的温度在每一瞬时都在有规律的变化。
影响因素:(1)热源的性质;(2)焊接线能量;(3)被焊金属的热物理性质;<热导率,比热容容积比热容,热扩散率,热焓,表面散热系数>;(4)焊件的板厚和形状。
6)稳定温度场:当焊件上温度场各点温度不随时间变化时,称之7)准稳定温度场:恒定功率的热源作用在焊件上做匀速直线运动时,经过一段时间后,焊。
,件传热达到饱和状态,温度场会达到暂时稳定状态,并可随着热源以同样速度移动。
8)焊接热循环:在焊接热源的作用下,焊件上某点的温度随时间的变化过程。
9)焊接热传递的三种形式:传导、对流和辐射。
由热源传热给焊件的热量以辐射和对流为主,而母材和焊丝获得热能后热的传播以传导为主。
10)焊接线能量:热源功率q与焊接速度v的比值。
热输入:在单位时间内,在单位长度上输入的热能。
第一章焊接化学冶金1)平均熔化速度:单位时间内熔化焊芯质量或长度。
平均熔敷速度:单位时间内熔敷在焊件上的金属质量称为平均熔敷速度。
(真正反应焊接质量的指标)损失系数:在焊接过程中,由于飞溅、氧化、蒸发损失的一部分焊条金属(或焊丝)质量与熔化的焊芯质量之比称焊条损失系数。
焊接冶金反应

焊接冶金反应焊接是一种通过熔化金属材料并在固化后形成连接的工艺。
在焊接过程中,金属材料的冶金反应起着重要的作用。
冶金反应是指在焊接过程中,金属材料发生的物理和化学变化。
本文将探讨焊接冶金反应的原理和影响因素。
焊接冶金反应的原理与金属的熔化和凝固有关。
在焊接过程中,焊接电弧或激光束的热作用下,金属材料被加热至熔点以上,形成熔池。
在熔池中,金属原子发生扩散和重新排列,形成新的晶粒结构。
当熔池冷却凝固后,晶粒之间形成了焊缝。
焊接冶金反应的影响因素主要包括焊接材料、焊接工艺和环境条件等。
首先是焊接材料的选择。
不同种类的金属材料在焊接过程中会发生不同的冶金反应。
例如,钢材焊接时,会发生固溶体形成、相变和析出等反应。
而铝合金焊接时,会发生氧化和溶解等反应。
因此,在选择焊接材料时,需要考虑其冶金反应特性。
其次是焊接工艺的影响。
焊接工艺包括焊接电流、焊接速度、焊接温度等参数的选择。
这些参数的不同组合将导致不同的冶金反应发生。
例如,在焊接过程中,提高焊接电流和焊接速度会增加熔池的温度和深度,从而影响冶金反应的进行。
因此,在进行焊接工艺设计时,需要考虑冶金反应的影响。
最后是环境条件的影响。
焊接过程中的环境条件,如气氛、湿度等,也会对冶金反应产生影响。
例如,在氧气环境中,金属材料容易氧化,影响焊接质量。
因此,在焊接过程中,需要控制好环境条件,以保证冶金反应的进行。
总结起来,焊接冶金反应是焊接过程中金属材料发生的物理和化学变化。
冶金反应的原理与金属的熔化和凝固有关,而影响因素主要包括焊接材料、焊接工艺和环境条件等。
了解焊接冶金反应的原理和影响因素,可以帮助我们更好地进行焊接工艺设计和质量控制,提高焊接连接的强度和可靠性。
焊接化学冶金详细介绍
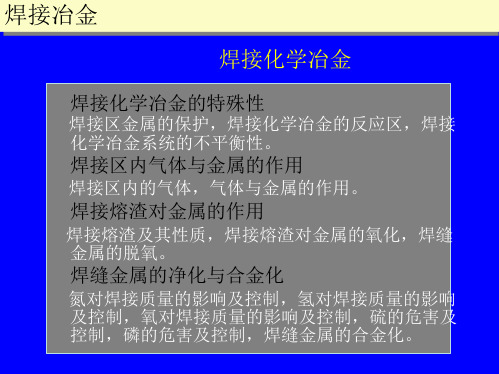
焊接化学冶金
焊接化学冶金的特殊性
焊接区金属的保护,焊接化学冶金的反应区,焊接 化学冶金系统的不平衡性。
焊接区内气体与金属的作用
焊接区内的气体,气体与金属的作用。
焊接熔渣对金属的作用
焊接熔渣及其性质,焊接熔渣对金属的氧化,焊缝 金属的脱氧。
焊缝金属的净化与合金化
氮对焊接质量的影响及控制,氢对焊接质量的影响 及控制,氧对焊接质量的影响及控制,硫的危害及 控制,磷的危害及控制,焊缝金属的合金化。
自保护方法无法避免空气的有害影响,保护效果欠 佳,生产上也很少采用,焊缝中氮的质量分数高达 0.12%。
1.1 焊接化学冶金的特殊性
二.焊接化学冶金的反应区
焊接化学冶金过程是分区域(或阶段)连
分区域 续进行的。
连续进行 各区的反应条件也存在差异,从而影响到
各区反应的方向和限度。
不填丝的钨极气体 熔池反应区 保护焊和电子束焊
特点 故冶金反应最激烈,不但反应速度快,而且反应
最完全,对焊缝成分和性能影响最大。
1.1 焊接化学冶金的特殊性
1.1 焊接化学冶金的特殊性
二.焊接化学冶金的反应区
2. 熔滴反应区
概念
是指从焊条端部熔滴形成、长大到过渡至熔池的 整个区域。
反应
气体的分解和溶解、金属的蒸发、金属及其合金 成分的氧化和还原、以及焊缝金属的合金化等。
反应温度高,反应时间短,相的接触面积大,并 有强烈的混合作用,反应物含量偏离平衡甚远。
CaCO3、MgCO3等碳酸盐和 Fe2O3、MnO2等高价 氧化物发生分解,形成CO2和O2等气体。
铁合金 的氧化
水分蒸发和某些物质分解所形成的H2O、CO2和O2 等氧化性气体,对被焊金属和药皮中的铁合金 (如
铝热反应原理.doc

第三章铝热反应原理铝热焊是基于铝热反应放出的化学热进行的焊接过程。
同时,在高温条件下,铝热焊还会伴随多种反应,化学反应的热力学决定了反应是否具备进行的基本条件,即反应是自动进行,还是需要某种条件。
冶金热力学的研究对象自然是冶金过程赖以存在的冶金化学变化,物理变化和相变化。
所谓冶金化学反应平衡指的是两项相对独立而又相互联系的内容:在一定条件下反应能否按预定方向自动进行;若能自动进行,则能进行到什么程度或限度.概括起来就是方向和限度问题在冶金中能量平衡—般表现为热平衡,其基本根据是冶金化学变化,物理变化和相变化中的能量效应,例如放热和吸热在此基础上建立了冶金反应和单元冶金过程的理沦热平衡.从而可计算放热反应( 包括燃烧) 的最高温度,吸热反应所必需的供热量以及为单元冶金过程的热制度提供依据.动力学的基本任务是研究各种因素(诸如温度、压力、浓度、介质、催化剂)对反应速率的影响,以揭示化学反应与物质结构之间的关系,达到控制化学反应的目的。
第一节铝热反应的热力学原理一热力学第一定律对宏观体系而言,热力学第一定律就是能量守恒原理。
热力学第一定律是能量守恒与转化定律在热现象领域内所具有的特殊形式。
通常表述为“能量有各种不同的形式,能够从一种形式转化为另一种形式,从一个物体传递给另一个1物体,而在转化与传递中能量的总数量总是保持不变。
”二热力学第一定律的数学表达式与焓1.内能内能是蕴藏于体系内部的能量,是指体系内分子运动的动能,分子间相互作用的位能,以及原子、电子的运动能和核能的总和。
它不包括整个体系的动能以及体系在外力场中的位能。
用符号表示为U。
内能是状态的函数。
体系从状态 A 变到状态B,可能有多种路径,但从不同的路径进行变化,最终的内能增量⊿U 是一致的。
2.数学表达式用数学公式表达,热力学第一定律可以表示为:⊿U=q-W其物理意义是:体系所吸收的热量q 减去对环境所作功W,等于内能的增量⊿U。
3.焓当化学反应、相变过程和变温过程是在等压下进行的(通常是一大气压),如果体系除体积功外不作其它功,则有:⊿U=q p-P 外(V2-V 1)由于等压过程中P外= P2-P1所以有U2-U1= q p-(P2V2-P1V1)整理后变为:(U2+P2V2)-(U1+P1V1)= q p (2-1)由于U 和PV 都是由状态决定的,显然它的变化值[(U2+P2V2)-(U1+P1V1)]也由体系的始、终态决定而与途径无关。
焊接化学冶金过程

焊接化学冶金过程嘿,咱今儿就来唠唠焊接化学冶金过程。
你说这焊接,就好像是一场奇妙的化学反应大冒险!想象一下,那焊接的地方就像是一个小小的舞台,各种元素和物质在这儿粉墨登场,开始它们的表演。
金属材料就像是主角,而其他的比如焊条、焊丝啥的,那就是配角啦。
当焊接开始,就像是一场热闹的派对开场。
热量来了,温度升高,一切都变得活跃起来。
金属开始熔化,就像冰淇淋在太阳下慢慢变软、流淌。
这时候,那些配角们也开始发挥作用啦,它们带来了各种不同的化学成分,和熔化的金属一起,开始了奇妙的融合。
这不就跟咱做饭似的嘛,各种食材放在一起,经过烹饪,就变成了美味的菜肴。
焊接化学冶金过程也是这样,不同的成分相互作用,产生出全新的物质和性能。
比如说,焊接过程中会发生一系列的化学反应,就像变魔术一样,产生出一些新的化合物。
这些化合物有的能让焊接部位更坚固,有的能提高它的耐腐蚀性。
而且啊,这焊接化学冶金过程还得注意火候呢!火候不够,那可不行,焊接不牢固;火候太过,又可能会破坏材料的性能。
这就跟咱炒菜一样,火大了菜就糊了,火小了又炒不熟。
还有啊,不同的焊接方法,就像是不同的烹饪方式,会带来不同的效果。
气焊就像是小火慢炖,慢悠悠的但很精细;电焊呢,就像是大火爆炒,速度快但也得掌握好力度。
在这个过程中,我们可得像个细心的大厨一样,时刻关注着每一个细节。
温度啦、化学成分啦、焊接速度啦,都得把握得恰到好处。
不然,这焊接出来的东西可就不达标啦。
总之呢,焊接化学冶金过程那可真是充满了神奇和奥秘。
它让金属材料变得更强大,让我们的生活变得更美好。
下次你再看到那些焊接的地方,可别小瞧了它们,那里面可是有着一场精彩的化学大戏在不断上演呢!这焊接化学冶金过程,不就是科技和工艺的完美结合吗?它让不可能变成可能,让普通变得非凡,难道不是很了不起吗?。
(完整word版)焊接冶金学(基本原理)

绪论一、焊接过程的物理本质1。
焊接:被焊工件的材质(同种或异种),通过加热或加压或二者并用,并且用或不用填充材料,使工件的材质达到原子问的结合而形成永久性连接的工艺过程称为焊接。
物理本质:1)宏观:焊接接头破坏需要外加能量和焊接的的不可拆卸性(永久性)2)微观:焊接是在焊件之间实现原子间结合。
2。
怎样才能实现焊接,应有什么外界条件?从理论来讲,就是当两个被焊好的固体金属表面接近到相距原子平衡距离时,就可以在接触表面上进行扩散、再结晶等物理化学过程,从而形成金属键,达到焊接的目的。
然而,这只是理论上的条件,事实上即使是经过精细加工的表面,在微观上也会存在凹凸不平之处,更何况在一般金属的表面上还常常带有氮化膜、油污和水分等吸附层。
这样,就会阻碍金属表面的紧密接触。
为了克服阻碍金属表面紧密接触的各种因素,在焊接工艺上采取以下两种措施:1)对被焊接的材质施加压力目的是破坏接触表面的氧化膜,使结合处增加有效的接触面积,从而达到紧密接触.2)对被焊材料加热(局部或整体)对金属来讲,使结合处达到塑性或熔化状态,此时接触面的氧化膜迅速破坏,降低金属变形的阻力,加热也会增加原于的振动能,促进扩散、再结晶、化学反应和结晶过程的进行。
二、焊接热源的种类及其特征1)电弧热:利用气体介质放电过程所产生的热能作为焊接热源。
2) 化学热:利用可燃和助燃气体或铝、镁热剂进行化学反应时所产生的热能作为热源。
3) 电阻热:利用电流通过导体时产生的电阻热作为热源。
4) 高频感应热:对于有磁性的金属材料可利用高频感应所产生的二次电流作为热源,在局部集中加热,实现高速焊接.如高频焊管等。
5) 摩擦热:由机械摩擦而产生的热能作为热源。
6)等离子焰:电弧放电或高频放电产生高度电离的离子流,它本身携带大量的热能和动能,利用这种能量进行焊接.7)电子束:利用高压高速运动的电子在真空中猛烈轰击金属局部表面,使这种动能转化为热能作为热源。
8) 激光束:通过受激辐射而使放射增强的光即激光,经过聚焦产生能量高度集中的激光束作为热源。
冶金的原理

冶金的原理
冶金的原理是通过物质的熔炼和热处理等工艺,将金属矿石中的金属元素提取出来,并通过改变其化学成分和物理性质,进而获得所需的金属材料。
冶金的主要原理包括矿石选别、矿石还原和提纯、金属合金化以及热处理等过程。
首先,矿石选别是根据矿石的成分和质量特点将其分离和分类处理,以提取目标金属。
其次,矿石还原和提纯是通过化学反应、物理分离等方法,将金属元素从矿石中分离出来,减少杂质含量,达到提纯的目的。
提取的金属元素常常需要进行合金化处理,即将其与其他金属或非金属元素混合,以改善金属的性能和机械性能,使其适应不同的工艺要求。
合金的形成常常需要控制合金元素的比例和添加方式,以达到所需的物理和化学性能。
最后,热处理在冶金工艺中起到重要的作用,通过控制金属材料的加热和冷却过程,改变其晶粒结构和组织,从而调整材料的力学性能(如硬度、韧性等)和组织性能(如晶粒大小、相变等)。
综上所述,冶金的原理涉及矿石选别、还原和提纯、金属合金化以及热处理等过程,旨在提取金属元素、改善其性能和实现特定的结构。
通过这些原理,可以生产出各种不同的金属材料,广泛应用于工业制造、建筑、交通运输、电子等领域。
提高焊缝质量的措施

提⾼焊缝质量的措施焊接从母材和焊条熔化到熔池的形成、停留、结晶,其过程发⽣了许多的冶⾦化学反应,这样就影响了焊缝的化学成分、组织、⼒学性能(强度、硬度、韧性和疲劳极限)、物理和化学性能,因此,焊缝的质量好坏关系到焊件的质量好坏,会影响到焊件的使⽤性能。
所以我们应该对如何提⾼焊缝的质量进⾏分析。
⼀、熔焊冶⾦机理1、氧化熔池的体积很⼩,受电弧加热升温很快,温度可达2000℃或更⾼。
在⾼温下氧⽓发⽣分解,成为氧原⼦,这样,其化学性质⾮常活泼,容易与⾦属和碳发⽣氧化反应,形成⼤量的⾦属氧化物和⾮⾦属氧化物,反应⽅程式如下:Fe O = FeO Mn O = MnOSi 2O = SiO2 2Cr 3O = Cr2O3C O = CO这样,Fe、Mn、Si、C等元素⼤量烧损,使焊缝⾦属含氧量增加,焊缝⼒学性能⼤⼤下降(如低温冲击韧性明显下降,引起冷脆,使得焊件在低温条件下的安全性降低)。
当焊缝凝固冷却后,FeO转变为Fe3O4,它使焊缝⾦属的屈服极限、冲击韧度、疲劳极限。
SiO2、MnO如果没有充⾜的时间上浮,则成为夹杂物。
CO如果没有析出,则成为焊缝中⽓孔。
这些夹杂物和⽓孔都会降低焊缝的性能。
焊接⾼碳钢和铸铁时容易发⽣CO⽓孔;焊接灰⼝铸铁时,由于碳、硅的烧损,冷却快,焊缝会成为硬脆的⽩⼝组织。
2、熔池吸⽓(1)吸氮。
由于受到⾼温的影响,氮⽓也要发⽣分解,形成氮原⼦,溶于液态⾦属中,在冷却过程中要发⽣相变(奥⽒体转变为铁素体),氮在固溶体中的溶解度发⽣突降,最后以Fe4N析出,由于Fe4N呈⽚状夹杂物,虽然使得焊缝⾦属的硬度增⾼,但塑性下降。
(2)吸氢。
焊接接头表⾯附着的油、铁锈所含⽔分、焊条药⽪中配⽤的有机物等,经⾼温分解产⽣氢,氢以原⼦的形式被液态⾦属所吸收。
当温度降低时,过饱和的氢将从液态⾦属中析出,成为⽓孔。
当焊缝凝固⾄室温时,过饱和氢原⼦扩散到微孔中结合成氢分⼦。
在微孔中氢的压⼒逐渐增⼤,使焊缝产⽣裂纹。
焊接冶金学——基本原理

PPT文档演模板
焊接冶金学——基本原理
1.4 焊接热循环 weld thermal cycle
➢ 焊接热循环的主要参数
① 加热速度 ② 加热的最高温度 ③ 在相变温度以上的停留时间 ④ 冷却速度或冷却时间
PPT文档演模板
•焊接热循环的参数
焊接冶金学——基本原理
1.4 焊接热循环 weld thermal cycle
化问题。
PPT文档演模板
焊接冶金学——基本原理
1.1 焊接过程分析
Ø 焊接过程
– 热源加热→熔化→冶金反应→
•加热过程
结晶→固态相变→接头(冷却而形成)
Ø 焊接热过程的特点
1. 局部性——加热和冷却过程极不均匀 2. 瞬时性——1800K/s 3. 热源是运动的 4. 焊接传热过程的复合性
•冷却过程
焊接冶金学——基本原理
1.2 焊接热源 welding heat source
➢ 热源在焊件上的分布
➢ 热流密度的分布
PPT文档演模板
•q:电弧的有效功率 •qm:加热斑点中心的最大比热流
•dH:回执斑点直径
•加热斑点的比热流分布---立体高斯锥体
焊接冶金学——基本原理
1.2 焊接热源 welding heat source
1.3 焊接温度场 field of weld temperature
➢ 焊条电弧焊时,焊接 电弧做为热源,对焊 条和母材进行加热
•焊接熔池形状示意图
➢ 在焊接热源作用下, 母材上所形成的具有 一定几何形状的液态 金属部分称为熔池
PPT文档演模板
焊接冶金学——基本原理
1.3 焊接温度场 field of weld temperature
熔焊原理-焊接化学冶金过程的特点

1.1 焊接化学冶金过程的特点
影响熔滴过渡形式、尺寸及频率的因素
• 药皮类型
• 焊芯直径 • 焊接电流
碱性焊条主要是短路过渡和大颗粒状过渡; 酸性焊条主要是细颗粒状过渡和附壁过渡。 直径减小,熔滴变细 电流增大,熔滴变细,过渡频率↑
1.1 焊接化学冶金过程的特点
熔滴的比表面积和相互作用时间:
熔滴的比表面积S:熔滴的表面积与其质量之比。
熔L焊O原G理O
1.1 焊接化学冶金过程的特点
1.1 焊接化学冶金过程的特点
焊接化学冶金过程
在熔焊过程中,焊接区内各种物质(包括气体、 液态金属、熔渣)之间在高温下相互作用的过程。
普通化学冶金过程
焊接化学冶金过程
对金属熔炼加工过程,在放入特 金属在焊接条件下,再熔炼的
定的炉中进行。
过程,焊接时焊缝相当高炉。
可知,R↓,S↑,有利于冶金反应进行。 如增大焊接电流↑I,在药皮中加入表面活性物质等。
熔滴的平均作用时间:与熔滴存在的时间τ和比值mo/mtr有关,一般近似表示,0.01~1s。
熔滴的温度:手工电弧焊焊接低碳钢焊条:2100~2700K,熔渣平均温度:1600ºC
1.1 焊接化学冶金过程的特点
熔池的形成
熔池的形状和尺寸
熔池
焊条
母材
焊缝
熔池:母材上由熔化的焊条金属与局部熔化的母材所组成的具有一 定几何形状的液体金属。
形状:为半椭球,其轮廓为温度等于母材熔点的等温面。熔池的宽度和深度沿X
轴连续变化,一般地,I↑,Bmax↓,Hmax ↑;U ↑,Bmax ↑,Hmax ↓
尺寸:L=P2IU 其中,P2为比例系数,取决于焊接点:
原材料:矿石、焦炭、废钢铁等。原材料:焊条、焊丝、焊剂等。
熔焊原理第三章

气相对金属的作用
(4)氧对金属的氧化 1)自由氧对金属的氧化 2)CO2对金属的氧化 3)H2O气对金属的氧化 4)混合气体对金属的氧化 。 2、控制氧的措施 (1)控制焊接材料的含氧量 (2)控制焊接工艺参数 (3)脱氧
熔渣及其对金属的作用
一、熔渣的作用及分类
1、熔渣在焊接过程中的作用 (1)机械保护作用 (2)改善焊接工艺性能的作用 (3)冶金处理作用 (4)改善热规范的作用 2、熔渣的成分和分类 根据焊接熔渣的成分和性能可将其分为三大类 : 第一类 盐型熔渣 它们主要由金属的氟酸盐、氯酸 盐和不含氧的化合物组成 ; 第二类 盐-氧化物型熔渣主要由氟化物和碱土金属 的氧化物组成 ; 第三类 氧化物型熔渣主要由各种氧化物组成。
焊缝金属的硫、磷控制
一、焊缝金属中硫、磷的危害性
1、硫的危害 硫在钢中主要以FeS和MnS形式存在 ,增加了焊缝 金属结晶裂纹的倾向,同时还会降低冲击韧度和抗 腐蚀性 。 2、磷的危害 磷主要以Fe2P和Fe3P的形式存在 ,增加了焊缝金 属的冷脆性,即冲击韧度降低,脆性转变温度升高 。
二、硫的控制
气相对金属的作用
四、氧对金属的作用及其控制
1、氧对金属的作用 (1)氧对焊接质量的影响 1)影响焊缝金属的性能 2)导致气孔的产生 3) 合金元素的烧损 (2)氧在金属中的溶解 氧是以原子氧和氧化亚铁FeO两种形式溶于液态铁 中的 温度升高,氧在液态铁中的溶解度增大。在液 态铁中有第二类金属元素时,随着合金元素含量的 增加氧的溶解度下降。
焊缝金属的合金化
三、影响合金过渡系数的因素
合金元素的过渡系数是指焊接材料中的合金元素 过渡到焊缝金属中的数量与其原始含量的百分比。 因此凡是能减少合金元素损失的因素,都可以提 高过渡系数;反之,则降低过渡系数。 1、合金元素对氧的亲和力的影响 2、合金元素的物理性质的影响 3、焊接区介质的氧化性的影响 4、合金元素的浓度的影响 5、合金元素的粒度 6、药皮(焊剂)的成分 7、药皮的重量系数和焊接参数
成形过程的冶金反应原理课件

冶金反应类型
氧化还原反应
在氧化还原反应中,金属元素被 氧化或还原,通常需要加入某种
化学物质来促使反应进行。
沉淀反应
沉淀反应是指金属离子与沉淀剂反 应生成难溶性化合物,从而从溶液 中分离出来。
萃取
萃取是指利用不同物质在两种不同 溶剂中的溶解度差异,将目标物质 从一种溶剂转移到另一种溶剂中的 过程。
THANKS
感谢观看
冶金反应原理
01
02
03
04
冶金反应原理包括物理分离和 化学分离原理。
物理分离原理主要包括重力分 离、电磁分离等。
化学分离原理主要包括氧化还 原反应、沉淀反应、萃取等。
根据不同的需要,可以选择不 同的冶金反应原理来实现提取
和精炼有价元素的目的。
03
成形过程中的冶金反应
液态成形过程中的冶金反应
金属的熔炼
提高生产效率
总结词
提高生产效率是降低成本、增加市场竞争力的重要手段。
详细描述
通过研究并应用新的成形工艺和新型材料,可以显著提高生产效率。例如,采用先进的自动化生产线和机器人技 术,实现生产过程的自动化和智能化,减少人工操作,降低废品率,提高产品质量和生产效率。此外,优化生产 计划和物流管理,实现准时制生产,可以进一步提高生产效率。
焊接成形过程中的冶金反应
01
融化焊
通过将两个金属件加热至熔点,将它们焊接在一起。在焊接过程中,金
属间会形成液态冶金界面,通过扩散和结晶形成坚固的焊接接头。
02 03
固态焊
通过施加压力或利用金属间的热膨胀系数差异,将两个金属件连接在一 起。固态焊过程中不产生金属融化,而是通过金属的塑性变形实现连接 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
30
H2O对金属的氧化
H2O 气与 Fe 的反应式为:
H2O气+[ Fe ] = [ FeO ] + H2 H2O对金属的氧化反应特点:
温度越高,H2O 的氧化性越强。 在液态铁存在的温度,H2O 气的氧化性比 CO2 小。 但应注意,H2O气除了使金属氧化外,还会提高气相 中 H2 的分压,导致金属增氢。
气相中氧的分压 {pO2} /×101.325kPa P’O2 [FeO]max /×101.325kPa
纯CO2高温分解得到的平衡气相成分和气相中氧的分压 { Po2 }
随温度升高,气相中氧分压增大,氧化性增加。 温度高于铁的熔点以后, {Po2}远大于P'o2 高温下CO2对液态铁和其他许多金属来说均为活泼的氧化剂。
(2)氢主要来源于水分,包括原材料(母材、焊接材料 等)本身含有的水分、材料表面吸附的水分以及铁锈或 氧化膜中的结晶水、化合水等。材料内的碳氢化合物和 材料表面的油污等也是氢的重要来源。 限制措施:焊材存放中防吸潮、焊前烘干和去除杂质 和油污。
35
限制气体的来源
(3) 氧主要来源于焊材或矿石,在焊接要求比较 高的合金钢和活泼金属时,应尽量选用不含氧或氧 含量少的焊接材料,如采用高纯度的惰性保护气体, 采用低氧或无氧的焊条、焊剂等。
溶 解 度
SO/%
氧在液态铁中的溶解度随 温度升高而增大
温度 T/℃ 铁液中氧的溶解度随温度的变化
22
液态金属中加入能提高气体含量的合金元素,可提高气体的 (3)合金成分对溶解度的影响 溶解度;若加入的合金元素能与气体形成稳定的化合物(即 氮、氢、氧化合物),则降低气体的溶解度。
氢 溶 解 度 SH/ ml. (10 0g)
31
四、气体的控制措施
1、气体对金属质量的影响
2、气体的控制措施
32
1、气体对金属质量的影响
氢在室温附近使 钢的塑性严重下 降
残留在金属内部的气体元素对金属性能的影响取决于 气体元素在金属中的存在状态。
固溶态
室温下 N、H、O 在金属中的溶解度极低, 残留在接头中的 [H]R易导致冷裂纹和氢脆。
CO2、CO、H2、烃和水气
如纤维素的热氧化分解反应:
(C6H10O5)m+7/2m O2(气)=6m CO2(气)+5m H2(气)
9
2.碳酸盐和高价氧化物的分解
碱性焊条药皮中碳酸盐的含量较高。 碳酸盐(CaCO3、MgCO3 及 BaCO3 等)的分解
CaCO3 = CaO + CO2↑
MgCO3 = MgO + CO2↑
48.1
55.6 42.3
4.8
7.3 2.9
36.6
24.0 41.2
10.5
13.1 12.6
低氢型(J427)
79.8
16.9
1.8
1.5
低氢型焊条焊接时,气相中H2和H2O的含量很少,故称“低氢型” 酸性焊条焊接时氢含量均较高,其中纤维素型焊条的最大。
11
3.材料的蒸发
焊接材料和母材表面的水分、金属元素和熔渣的各种成
24
1、金属氧化还原方向的判据
在由金属、金属氧化物和氧化性气体组成的系统中,采
用金属氧化物的分解压 Po2作为金属是否被氧化的判据。
2 MeO 2Me + O2
若氧在金属-氧-氧化物系统中的实际分压为{Po2},则:
{Po2} > Po2 时,金属被氧化; {Po2} = Po2 时,处于平衡状态;
2、氧化性气体对金属的氧化
自由氧、 CO2 、 H2O 、 混合气体对金属的氧化
27
(1)自由氧对金属的氧化
氧在铁液中以氧原子和FeO形式存在。气相中 O2 的分压超过 P'o2 时,将使 Fe 氧化: [ Fe ] + ½ O2 = FeO + 26.97 [ Fe ] + O = FeO + 515.76 kJ/mol kJ/mol
O2
0.22
2.2 ×10-3 3.81 ×10-9
0.76
7.6 ×10-3 1.08 ×10-7
2.02
2.02 ×10-2 1.35 ×10-6
6.30
6.3 ×10-2 5.3 ×10-5
18.58
18.58 ×10-2 -
27.77
27.77 ×10-2 -
31.36
31.36 ×10-2 -
10
碳钢焊条电弧焊焊接区室温时的气相成分
药皮类型 CO 高钛型(J421) 钛钙型(J422) 46.7 50.7 气相成分(体积分数) /% CO2 5.3 5.9 H2 34.5 37.5 H2O 13.5 5.7 焊条在 110℃ 烘干2h 备注
钛铁矿型(J423)
氧化铁型(J424) 纤维素型(J425)
焊接温度下氢、氧等气体的溶解
15
3. 溶解度 S—在一定温度和压力条件下,气体溶入 金属的饱和浓度。
温度与压力
溶解度S的 影响因素
气体种类 合金成分
16
(1)温度和压力的影响
理想气体溶解度的平方根定律:
S kx
Px
Px 为气相中的气体分压, Px ↑ → 溶解度↑ Kx 为气体溶解反应的平衡常数,取决于温度和金属的 种类。
变为离子,如:H→H+。
13
二、气体在金属中的溶解
1. 原子或离子状态 → 直接溶入液态金属; 分子状态的气体 → 先分解为原子或离子之后再溶解 到液态金属中。
2. 双原子气体溶入金属液的两种方式: 吸附 — 分解 — 溶入 分解 — 吸附 — 溶入
14
双原子气体溶入金属液的两种方式
温度不够高或气体难以分解时
(545℃~ 910℃) (325℃~ 650℃)
高价氧化物(Fe2O3 和 MnO2)的逐级分解 (在某些酸性焊条药皮中含量较高) 6 Fe2O3 = 4 Fe3O4 + O2 2 Fe3O4 = 6 FeO + O2 4 MnO2 = 2 Mn2O3 + O2 6 Mn2O3 = 4 Mn3O4 + O2
第一篇 连接成形理论基础
Chapter 3 焊接过程中的冶 金反应原理 (一)
本章讲授目的
化学冶金过程 焊接方法 焊接材料 焊缝的成份 焊缝的性能
焊接过程中,高温液态金属会与气体和熔渣之间 发生相互作用(冶金反应)。通过本章的学习,了解 影响焊件的性能的气体和熔渣的来源及其与金属的相
互作用机制。
2
水蒸发及药皮中固态物质的分解,造渣和造气。
•熔滴反应区:温度高(2100-2800℃
)、熔滴比表
面积大,是焊接冶金反应最激烈的部位。气体分
解和溶解、金属蒸发、氧化还原及焊缝金属合金化。
•熔池反应区:温度平均1770
℃左右,反应比溶滴区
弱些。温度分布不均,不同部位冶金反应不同。 头部金属熔化和吸气,尾部金属凝固和气体逸出。
N2、H2、O2 CO2 和 H2O
7
气体的间接来源
(1)有机物的分解和燃烧
(2)碳酸盐和高价氧化物的分解 (3)材料的蒸发 (4)气体的分解
8
1.有机物的分解和燃烧
酸性焊条药皮中有机物的含量较高。 焊条药皮中的淀粉、 热氧化分解反应 200~250℃后
纤维素、糊精等有机物
(造气、粘接、增塑剂)
( PN2 =PH2 = 0.1MPa )
20
第II类金属吸氢过程是放热反应,因此随着 b) a) 温度的升高,氢的溶解度减小,
SH/mL.(100g)-1
T/℃
SH/mL.(100解度随温度的变化(pH2=0.1MPa) a)I类金属 b)II类金属
21
氧在金属中的溶解度与温度的关系
-1
氮 溶 解 度 SN/ %
合金元素含量wMe /% 氢在二元系铁合金中的溶解度(1600℃)
合金元素含量wMe /% 氮在二元系铁合金中的溶解度(1600℃) 23
三、氧化性气体对金属的氧化
主要讨论O2、CO2、H2O等气体对金属的氧化。
1、金属氧化还原方向的判据
2、氧化性气体对金属的氧化
由反应的热效应看,原子氧对铁的氧化比分子氧更激烈。
除了铁以外,钢液中其它对氧亲和力比铁大的元素也会发生 氧化,如:
[ C ] + ½ O2 = CO↑
[ Si ] + O2 =(SiO2)
[ Mn ] + ½ O2 =(MnO)
28
CO2对金属的氧化
温度/K 气相成分 ( 体积分 数) /% CO2 CO 1800 99.34 0.44 2000 97.74 1.51 2200 93.94 4.04 2500 81.10 12.60 3000 44.26 37.16 3500 16.69 55.54 4000 5.92 62.72
Fe、Ni、Al、Cu、Mg、Cr、 吸热反应 Co等金属及合金 氢 Ti、Zr、V、Nb、Ta、Th 等金属及合金 放热反应
能形成稳定氢化物
不能形成稳定氢化物
19
氮、氢在铁中的溶解度
在铁的气化温度附近, 气体溶解度陡降。 氮、氢在液态铁中的溶解 度随温度升高而增大。 氮、氢在金属凝固 时溶解度陡降。 氮、氢在奥氏体中的 溶解度大于铁素体。
分在电弧高温作用下会发生蒸发,形成相当多的蒸气。
金属材料中Zn、Mg、Pb、Mn
氟化物中AlF3、KF、LiF、NaF
极易蒸发
后果: 合金元素的损失; 产生焊接缺陷;
增加焊接烟尘,污染环境,影响焊工身体健康。
12
4、气体的分解
