基础化学习题答案chap12
2020年智慧树知道网课《基础化学》课后章节测试满分答案

第一章测试1【单选题】(1分)在使用物质的量单位(mol)时,要注意基本单元的表示。
若n(H2O)=1.0mol,则n(1/2H2 O)的数值为()A.0.5molB.1.0molC.3.0molD.2.0mol第二章测试1【判断题】(1分)对于非电解质稀溶液,其渗透浓度在数值上等于其质量摩尔浓度。
A.对B.错2【判断题】(1分)临床上将葡萄糖溶液与溶液作为等渗溶液使用。
如将此两溶液以任意比例混合,则所得混合液也必然是等渗溶液。
A.对B.错3【判断题】(1分)渗透浓度为的NaCl溶液和的葡萄糖溶液,它们的渗透压相等,则它们的物质的量浓度也相等。
A.对B.错4【判断题】(1分)由于0℃的冰与0℃的NaCl溶液温度相同,所以该两相可以共存。
A.错B.对5【判断题】(1分)难挥发非电解质稀溶液的沸点升高、凝固点降低均由溶液的蒸气压下降引起。
A.对B.错6【判断题】(1分)无论溶质是电解质还是非电解质,凝固点降低值较小的溶液的渗透压一定低于凝固点降低值较大的溶液。
A.错B.对7【判断题】(1分)由于苯比水易挥发,故在相同温度下,苯的蒸气压比水大。
A.对B.错8【判断题】(1分)将相同质量的葡萄糖和甘油分别溶于1L水中,则两溶液的△p1=△p2,△T b1=△T b2,π1=π(T一定)。
2A.对B.错9【判断题】(1分)纯溶剂通过半透膜向溶液渗透的压力称为渗透压。
A.对B.错10【判断题】(1分)渗透浓度均为的NaCl溶液和葡萄糖溶液,NaCl溶液的渗透压大。
A.错B.对11【判断题】(1分)渗透压较高的溶液其物质的量浓度一定较大。
A.对B.错12【单选题】(1分)下列方法最适用于测定蛋白质相对分子质量的是()A.沸点升高法B.蒸气压下降法C.渗透压法D.凝固点降低法13【单选题】(1分)已知水的,测得某人血清的凝固点为-0.56℃,则该血清的渗透浓度为()A.506mmol·L-1B.560mmol·L-1C.408mmol·L-1D.301mmol·L-114【单选题】(1分)已知苯的凝固点为5.35℃,。
《基础化学》试卷及答案12

基础化学试卷(12)一、是非题:(10分)以“√”表示正确,“×”表示错误填入括号1.某反应A+2B→C,其速率方程式为υ=kc A c B2,可知此反应为元反应()2.在氢电极中加入NaAc,其电极电位会降低()3.称取一级标准物质Na2CO3时,吸收水分,故标定HCl溶液所得的浓度比实际高()4.电子在原子轨道内的运动轨迹可由波函数ψ来描述()5.高分子溶液的分散相粒子的大小与溶胶相近,因此高分子溶液也有明显的Tyndall效应()6.将氢原子的1s电子激发到2s轨道和激发到2p轨道所需能量相同()7.有一浓度为c的溶液,吸收了波长为λ的入射光的16.69%,在同样条件下,浓度为2c的溶液的透光率为69.40% ()8.热力学标准态的含义是“25o C,溶质的质量摩尔浓度为1mol⋅kg-1,气体分压为100kPa”()9.当缓冲溶液总浓度一定时,缓冲容量将随缓冲溶液的pH值而改变()10.若原电池处于平衡状态,则该原电池的标准电动势E 等于零()二、选择题(30分)1.标准状态下,若欲使Cu++Cu+→Cu2++Cu(即2 Cu+ →Cu2++Cu)必须()A. ϕ (Cu + /Cu )>ϕ (Cu 2+ /Cu + )B. ϕ ( Cu 2+ /Cu +)>ϕ (Cu + /Cu )C. ϕ (Cu + /Cu )>ϕ ( Cu 2+ /Cu )D. ϕ ( Cu 2+ /Cu )>ϕ (Cu + /Cu )2. 相同温度下,渗透浓度为0.2mol ·L -1Na 2CO 3与渗透浓度0.2mol ·L -1葡萄糖溶液,其渗透压 Π( Na 2CO 3)与Π(葡萄糖)之比最恰当的说法是 ( ) A.1:1 B. 3:1 C. 接近于1:1 D. 接近于3:13. 摩尔吸光系数κ的值与下列哪个因素无关 ( ) A. 溶液的性质 B. 入射光的波长λ C. 溶液的浓度 D. 溶液的温度4. 下列计算缓冲溶液pH 公式正确的是 ( )A. pH= p (b wK K )+ lg 碱酸n nB. pH= p (b wK K )+ lg 酸碱n n C. pH= p K a + lg碱酸n n D. pH= p (a wK K )+ lg 酸碱n n 5. 从下列四物质在25℃时的溶度积常数中判断其在水中溶解度最大的是( ) K sp (PbI 2) = 7.1×10-9,K sp (AgIO 3) = 3.0×10-8,K sp [Pb(OH)2] = 1.2×10-15, K sp (BaSO 4) = 1.1×10-10,A. PbI 2B. AgIO 3C. Pb(OH)2D. BaSO 46. 下列分子中属于sp 3不等性杂化成键的是 ( )A. BF 3B. NH 4+C. CH 4D. H 2S7. 下列说法正确的是 ( ) A. 氢原子只有一个电子,故氢原子只有1s 轨道 B. 在N 2分子中存在三个σ 键C. s 电子在球形轨道上运动,p 电子在双球形轨道上运动D. ψ 3,1,0和ψ 2,1,0的角度分布图是相同的8. 下列各对溶液等体积混合后得到的是缓冲溶液的为 ( )A. 0.3 mol ·L -1 H 3PO 4与0.1 mol ·L -1 NaOHB. 0.1 mol ·L -1 H 3PO 4与0.3 mol ·L -1 NaOHC. 0.1 mol ·L -1 NaH 2PO 4与0.1 mol ·L -1 Na 3PO 4D. 10-4 mol ·L -1 NaH 2PO 4与10-4 mol ·L -1 Na 2HPO 49. 已知HA K a =1.0×10-5,欲使0.1 mol ·L -1 HA 溶液的α上升至原来的2倍,应将浓度稀释至 ( ) A. 0.025 mol ·L -1 B. 0.050 mol ·L -1 C. 0.075 mol ·L -1 D. 以上都不对10. 用NaOH 滴定HAc 最适用的指示剂是 ( ) A. 酚酞 B. 甲基橙 C. 甲基红 D. 三种指示剂均不行11. 能使红细胞产生溶血现象的水溶液是 ( ) A. 9g ·L -1NaCl 溶液(M r =58.5) B. 6 g ·L -1NaCl 溶液 C. 50g ·L -1葡萄糖溶液(M r =180) D. 100g ·L -1葡萄糖溶液12. A 的分解为二级反应,当A 浓度为0.1mol ·L -1时,反应掉30%所需时间为60s ,当A 浓度为0.2mol ·L -1时,反应掉30%所需时间为 ( ) A. 30s B. 60s C. 120s D. 15s13. 在H 2O 中通入H 2S 气体达饱和([ H 2S ] = 0.1 mol ·L -1 )时,溶液中S 2-的浓度为(已知K a1 =9.1×10-8, K a2 =1.1×10-12) ( ) A. 9.1×10-8 mol ·L -1 B. 1.1×10-12 mol ·L -1 C. 1.0×10-20 mol ·L -1 D. 0.1 mol ·L -114. 计算K 2HPO 4溶液[H +]的近似计算公式 ( ) A 、[H +]=C K ⨯w B 、[H +]=32a a K K ⨯ C 、[H +]=31a a K K ⨯ D 、[H +]=12a a K K ⨯15. 某一元弱酸HA(K a =4.0×10-10)与其共轭碱以后1: 4的体积比组成缓冲溶液,其pH= 9.7,则原来酸与共轭碱的物质的量浓度之比为()A. 1: 1 B. 1: 2 C. 2: 1 D. 3: 116. 决定多电子原子中电子能量的是()A. nB. n和lC. n, l和mD. n, l, m,和m17. 对HAc的离解平衡常数K a=[][][]HAcAcH-+⨯,下面说法正确的是()A. 加HCl,则K a变大B. 加NaAc,则K a变大C. 加HAc,则K a变小D. 分别加HCl,加NaAc,加HAc,则K a不变18. 电极Pt⎪MnO4-,Mn2+,H+中,若[H+]增加10倍,电极电势比原来()A.减少B.增加C.不变D.无法确定19. 用同一浓度NaOH来中和等体积的pH=3的HCl和pH=3的HAc,所消耗的NaOH的体积()A. 一样多 B.中和HCl时多 C. 中和HAc时多 D. 条件不足,无法确定20. 今有原电池(-) Pt | H2(p) | H+(c) || Cu2+ | Cu (+),要增加原电池电动势,可以采用()A. 增加H+浓度C. 增加Cu2+浓度B. 减少铜板的质量D. 降低Cu2+浓度,降低H2的分压21. 已知HF的K a=3.53×10-4, NH3·H2O的K b=1.76×10-5,由此可知F - 与NH3·H2O相比,其碱性()A. 比NH3·H2O的强 B. 比NH3·H2O的弱C. 与NH3·H2O的碱性相等D. 两者无法比较22. 有下列反应式甲:12Cu(s)+12Cl2(101.3kPa)→12Cu2+(1mol·L-1)+Cl-1(1mol·L-1)乙:Cu(s)+Cl 2(101.3kPa)→Cu 2+(1mol ·L -1)+2Cl -1(1mol ·L -1)则存在: ( ) A. E 甲 = E 乙 ,K 甲2 = K 乙 B. E 甲 = E 乙 ,K 甲 = K 乙C. E 甲 =12E 乙 ,K 甲2 = K 乙 D. E 甲 = 2E 乙 ,K 甲 = K 乙223. [25Mn(CN)6]4-,若μ =1.75μB ,则配合物类型及未成对电子数应分别 ( ) A. 外轨配合物,1 B. 外轨配合物,5 C. 内轨配合物,1 D. 内轨配合物,524. 升高温度可以加快反应速率的主要原因是 ( ) A. 分子平均动能增加 B. 碰撞频率加快 C. 活化分子百分率增加 D. 活化能增大25.下列分子中,含有π键的非极性分子是 ( ) A.CH 2Cl 2 B.HCN C.CO 2 D.BeCl 226. 若将碳原子的电子排布式写为1s 2 2s 2 2p x 2 ,则违背了 ( ) A.Hund 规则 B.能量守恒原理 C.能量最低原理 D.保里不相容原理27. 0.1mol ·L -1 NH 4H 2PO 4溶液的计算公式为(已知NH 3的离解常数为K b ,H 3PO 4的酸常数分别为K a1 K a2 K a3) ( ) A.[H +]=b a 1K K B. [H +]=2a wb w K K K KC. [H +]=b w a 1K K KD. [H +]=bw a 2K KK28. 已知Ag 2CrO 4的K sp 为4.0×10-12,在0.10mol ·L -1AgNO 3溶液中,Ag 2CrO 4的溶解度(mol ·L -1)约为 ( ) A.2.0×10-6 B.1.0×10-4 C.4.0×10-10 D.以上数值均不对29. 欲使某反应不论温度高低,均能自发进行,则应()A.∆r H m >0, ∆r S m >0B. ∆r H m <0, ∆r S m <0C. ∆r H m <0, ∆r S m >0D. ∆r H m >0, ∆r S m <030. 下列物质中存在氢键的是()A. CH3FB. CH3COCH3C. CH3COOHD. C2H5-O-C2H5三、填充题:(30分)1.2. 将等体积的0.008mol·L-1AgNO3和0.01 mol·L-1KI混合制成AgI溶胶,其胶团结构为,在电场作用下电泳方向为,若分别用K3[Fe(CN)6], MgSO4, AlCl3对其聚沉,其临界聚沉浓度为> >。
基础化学习题答案chap12

第一章绪论习题答案1.指出下列哪些单位属于SI单位,那些不是。
时间单位min、能量单位J、体积单位L、质量单位μg、长度单位nm、温度单位℃2.SI制的大体单位有哪几个?3.我国的法定计量单位和SI制单位有什么联系和不同?*******************************************************************************1.答:能量单位J、质量单位μg、长度单位nm、温度单位℃属于SI单位;其他不是。
2.答:SI大体单位:m、kg、s、A、K、mol、cd3.答:一切属于国际单位制的单位都是我国的法定计量单位。
按照我国的实际情况,在法定计量单位中还明确规定采用了若干可与国际单位制并用的非国际单位制单位。
第二章稀溶液的依数性习题答案1. 20C时,水的饱和蒸气压为2.34kpa。
若于100g水中溶入10.0g蔗糖(C12H22O11,相对分子质量为M r=342),求此溶液的蒸气压。
2.现有四种处于相同温度和压力下的理想稀溶液。
(1) 0.1 mol蔗糖溶于80 mol水中,水蒸气压为p1(2) 0.1 mol萘溶于80 mol苯中,苯蒸气压为p2(3) 0.1 mol葡萄糖溶于40 mol水中,水蒸气压为p3(4) 0.1 mol尿素溶于80 mol水中,水蒸气压为p4这四个溶液的蒸气压之间的关系为:( )(A) p1≠p2≠p3≠p4(B) p2≠p1=p4>p3(C) p1=p2=p4=(1/2)p3(D) p1=p4<2p3≠p23.医治脱水、电解质失调与中毒静脉滴注的林格氏(Ringer)液的处方是:在1.00L 注射用水中溶有8.50gNaCl,0.30gKCl,0.33gCaCl22H2O。
林格氏液的渗透浓度是多少?101.3kpa下凝固点为多少?它与人体血浆溶液等渗吗?4.将7.00g难挥发非电解质溶于250g水,该溶液在101.325kpa下,沸点为100.510C。
基础化学第二版习题答案chap

第五章 难容电解质溶液的沉淀溶解平衡 习题答案1.何谓沉淀溶解平衡?同物质的量的BaCl 2和H 2SO 4混合溶液中,含有哪些离子?这些离子浓度之间存在着哪些关系?答:难溶电解质溶解和沉淀速度相等,固体的量和溶液中分子或离子的量不再改变的状态,称为沉淀溶解平衡。
Ba 2+、Cl -、-24SO 、H +、OH -θsp 242]][S O [Ba K =-+,θw -]][OH [H K =+等2.活度积、溶度积、离子积之间有何区别与联系?答:活度积、溶度积指平衡状态下的活度积或浓度积,对给定的难溶电解质其活度积只与温度有关,溶度积不但与温度有关,还和溶液离子强度有关,对于MA 型难溶电解质:(MA))(A )(M (MA)θsp θap K K =⋅-+γγ。
离子积指任意状态下的浓度积,其值是任意的。
3.无副反应时,沉淀的溶度积与溶解度有何关系?溶度积小的物质,它的溶解度是否一定小?举例说明。
答:θθsp )A (M c n m K s n m n m n m +=不同类型难溶电解质的溶解度不能根据溶度积数值大小直接判断。
溶度积小的物质,它的溶解度是不一定小,如Ag 2CrO 4与AgCl 。
4.除了沉淀物质本性以外,影响沉淀溶解度的主要因素有哪些?答:除了沉淀物质本性以外,影响沉淀溶解度的主要因素还有:同离子效应、盐效应、酸碱效应、配位效应等。
5.判断下列操作中可能发生的反应和现象并予以解释。
(1)将少量CaCO 3固体放入稀HCl 中。
(2)将少量Mg(OH)2放入NH 4Cl 溶液中。
(3)向少量MnSO 4溶液中加入数滴饱和H 2S 水溶液,再逐滴加入2mol ·L -1的氨水。
(4)向盛少量PbS 固体的试管中,滴入H 2O 2溶液。
(5)向盛少量AgCl 沉淀的试管中,滴入KI 溶液。
(6)向盛少量Cu(OH)2沉淀的试管中,滴入2mol ·L -1NH 3·H 2O 溶液。
《基础化学》课后习题参考答案(有机部分)
均为 Na + , K + , Br , Cl 离子各 1mol 。
第十章开链烃1、扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答:2、NaCl 相同?如将 CH 4 及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同? 为什么?答: NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中 - -由于 CH 4 与 CCl 4 及 CHCl 3 与 CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合 物。
3、用系统命名法命名下列化合物:⑴2-甲基丙烷⑵2,4,4-三甲基-5-丁基壬烷⑶己烷⑷3-乙基戊烷⑸3-甲基-5-异丙基辛烷⑹2-甲基-5-乙基庚烷4、写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
H 3CCH 3 ⑴3,3-二甲基丁烷 H 3CH 2CH 3H 3C错,2,2-二甲基丁烷CH 2CH 3 ⑵2,3-二甲基-2-乙基丁烷 H 3C HC C3错,2,3,3-三甲基戊烷CH 3CH 3⑶2-叔丁基-4,5-二甲基己烷H 3CC CH 3CH 33错,2,2,3,5,6-五甲基庚烷H 3CC H 2CH 3CH 3H 3CCH⑷2,3-二甲基-4-丙基庚烷H 3H CH 2 CC H 2CH 3CH 2CH 2CH 3H 3CH 3CCH 2CH 3H 2⑸2,4,5,5-四甲基-4-乙基庚烷H 3CHC H 2 CH 3CC C 3 32 CH32CH2 3CH 2 3CH 3 3CH 3 2CH 3⑹2,2,3-三甲基戊烷H3CH3CCCH3CH2CH35、写出分子式为C6H14的烷烃的各种异构体,用系统命名法命名,丙标出伯、仲、叔、季碳原子。
1oCH 32oCH 2 2 o22 oCH2 oCH 21 o己烷1oCH 3oCH 21 o CH32 o CHo1 oCH32-甲基戊烷1 o CH31oCH 32ooCH2 oCH2 1 oCH3 3-甲基戊烷1oCHo3 oCH1 o3 2,3-二甲基丁烷1 o CH31 o1 o CH31oCH2o4 oCCH32,2-二甲基丁烷H3C 1 o 1 o CH36、⑶>⑵>⑸>⑴>⑷7、写出2,2,4-三甲基戊烷进行氯代反应可能得到的一氯代产物的结构式。
基础化学课后习题答案

基础化学 第一章 习题参考答案3. (1) 5位,(2) 3位,(3) 2位,(4)1位,(5)2位。
4. %1.0001.01024.00001.01024.01024.01023.0-=-=-=-=RE5. kPa}){}{}({m N 10}){}{}({dm m N }){}{}({ L J }){}{}({K mol K J L mol }){}{}({ ])[][]([}){}{}({][}{][}{][}{2331111-T R c T R c T R c T R c T R c T R c T R c T T R R c c cRT Π⨯⨯=⋅⨯⨯⨯=⋅⋅⨯⨯=⋅⨯⨯=⨯⋅⋅⨯⋅⨯⨯=⨯⨯⋅⨯⨯=⋅⨯⋅⨯⋅==-----式中,花括号代表量的值,方括号代表量的单位。
6. 1 mi 3 = 1.609 3443 km 3 = 4.168 182 km 3, 所以水资源的总体积V = (317 000 000 + 7 000 000 + 2 000 000 + 30 000) × 4.168 182 km 3 =1.3590 ×109 km 37.m ol 0.25 kg 1g1000 m ol g )00.10.160.23(kg 0.010(NaOH)1-=⨯⋅++=nmol1.89 kg 1g 1000 mol g )00.16301.1299.222(21kg 0.100 )CO Na 21(mol4.99 kg 1g1000 mol g 08.4021kg 0.100 )Ca 21(1-321-2=⨯⋅⨯++⨯⨯==⨯⋅⨯=+n n8. m ol 2.57 m ol g )35.45 239.65(g350)(ZnCl 1-2=⋅⨯+=n1-21-2k mol 3.95 kg 1g1000 650mol 2.57 )(ZnCl L mol 3.48 L1mL1000 mL 39.57mol 2.57)(ZnCl g g b c ⋅=⨯=⋅=⨯=9. 1-1--3L mmol 5.1 mol 1mmol1000 L 1L 100mL 1000 mol g 9.13g 10 20 )(K ⋅=⨯⨯⨯⋅⨯=+c1-1--3-L mmol 103 mol1mmol 1000 L 1L 100mL 1000 mol g 5.453g 10 366 )(Cl ⋅=⨯⨯⨯⋅⨯=c10. 设称取含结晶水的葡萄糖(C 6H 12O 6·H 2O)的质量为m ,052600. molg 16.0)1.01g/[(2 50)-(1000 mol 0.28mol0.278 )O H (C Lmol 0.278 mol g )0.16601.1120.126(L g 0.05 )O H (C g 27.5L g 50.0 L.50001g )0.1601.120.16601.1120.126(g)0.16601.1120.126( O)H O H (C 1-61261-1-1-61261-26126=⋅+⨯+=⋅=⋅⨯+⨯+⨯⋅==⋅=⨯+⨯+⨯+⨯+⨯⨯+⨯+⨯⨯=⋅x c m m ρ11. L .41 L g .091g 3.02g )5.350.23( g 5.0 (NaCl)1-=⋅⨯+⨯=V12. ∵ 10KI + 2KMnO 4 + 8H + = 12K + + 2MnO 2 + 5I 2 + 4H 2O∴ mol 0.004 mol g )9.1262(21g 0.508 )I 21( )KMnO 51 (KI 1-24=⋅⨯⨯==+n n基础化学 第二章 习题参考答案1. 根据 BA AA n n n x +=,mol 56.5mol 18.0g 100g O)(H 1-2=⋅=n mol 0292.0molg 342g 0.10)(1=⋅=-蔗糖n 995.0mol0292.0mol 56.5mol 56.5)(O)(H O)(H O)(H 222=+=+=蔗糖n n n xkPa 33.2995.0kPa 34.2O)(H 20=⨯==x p p2. (1) mol 004912.0molg 342g68.1)(1=⋅=-甲n mol 003551.0molg 690g45.2)(1=⋅=-乙n 1kg mol 2456.0kg0200.0mol004912.0-⋅==(甲)b1kg mol 1775.0kg0200.0mol003551.0-⋅==(乙)b溶液乙的蒸气压下降小,故蒸气压高。
《基础化学》习题答案第3版

《基础化学》习题答案(第3版)第一章 习题答案1.答:能量单位J 、质量单位μg 、长度单位nm 、温度单位℃、属于SI 单位;其他不是。
2.答:SI 基本单位:m 、kg 、s 、A 、K 、mol 、cd 。
3.答:一切属于国际单位制的单位都是我国的法定计量单位。
根据我国的实际情况,在法定计量单位中还明确规定采用了若干可与国际单位制并用的非国际单位制单位。
第二章习题答案1. 解: 根据)()O H ()O H ()O H (222蔗糖n n n x +=0292mol .0mol 342g g0.10)( mol 56.5mol 18.0g g 100)O H (1-1-2=⋅==⋅=蔗糖n n995.00.0292molmol 56.5mol56.5)O H (2=+=xkPa33.20.995kPa 34.2)O H ()O H (2*2=⨯==x p p2.解:)B ()O H ()()O H (999.00.1molmol 08mol08)O H ()O H ()O H ()O H (899.00.1molmol 04mol04)O H ()O H ()O H ()(999.00.1molmol 80mol80)()()()O H (999.00.1mol mol 80mol80)O H ()O H ()O H (*2**2*22*22*2*22*23***2*2*22*21答案为苯苯苯苯苯∴>=+⋅===+⋅===+⋅===+⋅==p p p p x p p p p x p p p p x p p p p x p p3.解:与人体血浆等渗。
11os f 11os f B f B f f 11-1-1-os L mmol 310L mol 31.0C58.0K58.0L mol 31.0mol kg K 86.1L mol 31.0L00.1mol 147g g33.03mol 74.6g g 30.02mol 58.5g g 50.82-----⋅=⋅=︒-==⋅⨯⋅⋅=≈≈=∆⋅=⋅⨯+⋅⨯+⋅⨯=c T c K c iK b iK T c4.解:K 85.1molkg K 512.00.510Kmol kg K 86.1mol g 1.28mol kg 0281.00.510K 250g g 00.7mol kg K 512.011b b f B f f 111b A B b B =⋅⋅⋅⋅⋅=∆⋅=⋅=∆⋅=⋅=⨯⨯⋅⋅=∆⋅⋅=-----K T K b K T T m m K MT f = -1.85℃ 5. 解:压略高于人体眼液的渗透kPa869K 310K mol L kPa 314.8L mol 337.0L mmol 337L mol 337.0mL10001.000LmL 1000mol 61.8g g 00.17mol 161.5g g 00.52111-os 1-1-1-1-os =⨯⋅⋅⋅⨯⋅==⋅=⋅=⨯⋅+⋅⨯=--RT c Πc6. 解:11A fB f B 11A b B b B mol kg 61.1100g0.220K g0.19mol kg K 86.1mol kg 62.1100g 0.0600K g 0.19mol kg .512K 0----⋅=⨯⨯⋅⋅=∆=⋅=⨯⨯⋅⋅=∆=m T m K M m T m K M用两种方法计算该物质的相对分子质量基本相同。
基础化学习题及答案精修订

基础化学习题及答案标准化管理部编码-[99968T-6889628-J68568-1689N]1.下列水溶液蒸气压最高的是(C )A. L NaClB. L H2SO4C. L 葡萄糖D. L?CaCl22. L 葡萄糖溶液的凝固点下降值接近于(B )A. L MgCl2 B. L NaCl C. L 蔗糖溶液 D. L CaCl24.按酸碱质子理论,下列物质中既是酸,又是碱的是(D ) A. CO32- B. HCl C. NH4+ D. HCO3-6.磷酸H3PO4的pKa1=、pKa2=、pKa3=,则HPO42-的pKb为:(A )7. 室温下L HB 溶液的pH值为3, 则其pOH值为( D )A. 7B. 1C. 13D. 118.在L HAc溶液中加入固体NaAc,溶液的pH值将会(B )A. 不变 B .增大 C. 减小 D. 与pOH相等9. 在BaSO4溶液中加入下列何种物质将不使BaSO4的溶解度下降(C )A. 1mol/L MgSO4B. 2mol/L BaCl2C. NaClD. 1mol/L Ba(NO3)210.将下列各对溶液等体积混合后,不是缓冲溶液的是( D )A. L Na2CO3 和 L NaHCO3B. L H3PO4 和 L NaOHC. L H3PO4 和 L NaOHD. L NH3 和 L HCl11. 已知H3PO4(Ka1=×10-3, Ka2=×10-8, Ka3=×10-13),取L NaH2PO4与L Na2HPO4等体积混合,则此溶液的pH值约为( )A. B. C. D.12.某缓冲溶液共轭酸的Ka=10-5,从理论推算该缓冲溶液的缓冲范围的pH是( D )A、6-8B、5-7C、7-9D、4-614. 由HCO3--CO32-(H2CO3的Ka1=×10-7,Ka2=×10-11)构成的缓冲溶液在总浓度相同的条件下,缓冲能力最强的溶液的pH值为(A )A .B. C. D.17. 正反应速率等于逆反应速率标志着( A )A.化学反应达到平衡 B.反应进行完全C.正、逆反应的焓变相等 D.反应物浓度等于生成物浓度18. 要改变可逆反应A+B=C+D的标准平衡常数,可以采取的措施是:( D )A. 改变系统的总压力B. 加入催化剂C. 改变A,B,C,D的浓度D. 升高或降低温度19. 元反应 A+2B→C + D,则其反应速率方程式是( A )A. V=kC(A)C2(B)B. V=kC2(B)C. V=kC(A)D.无法确定20. 某一级反应,反应物浓度由L降至L需用20min,由L降至L需用的时间是:( A )A. 20minB. 40minC. 10minD. 60min22. 反应级数等于( B )A. 反应方程式中各物质计量数之和B. 速率方程式中反应物浓度项的指数之和C. 反应分子数D. 元反应方程式中各生成物计量数之和23. 催化剂对反应速率的影响是( C )A. 能加快正向反应B. 能加快逆向反应C. 同等程度地加快正向反应和逆向反应D. 正向反应和逆向反应速率都无变化24. 关于速率常数k的叙述正确的是( B )A. k与反应物浓度成反比B.条件一定时,反应的k值恒定不变C.不同的反应,同一温度下,k值相同D. k值与反应速率无关25. 质量作用定律只适用于:( D )A. 一级反应B. 零级反应C. 二级反应D. 元反应26. 已知时,φθ(Fe3+/Fe2+)=+,φθ(Hg2+/Hg)=+,则在标准状态下反应Hg+2Fe3+=Hg2++2Fe2+( B )A. 正向自发进行B. 逆向自发进行C. 不能进行D. 不确定27. Fe3+氧化Br-; Br-在酸性溶液中能使K2Cr2O7溶液变为黄绿色。
《基础化学》课后习题参考答案(无机部分)
⑵
-2
⑶
-4
⑺ 1.1×10
1
⑻ 5.0×10-15
+
5.0×10
6.3×10
1.8×10
-5
1.1×10
-11
6.3×10
-8
1.0
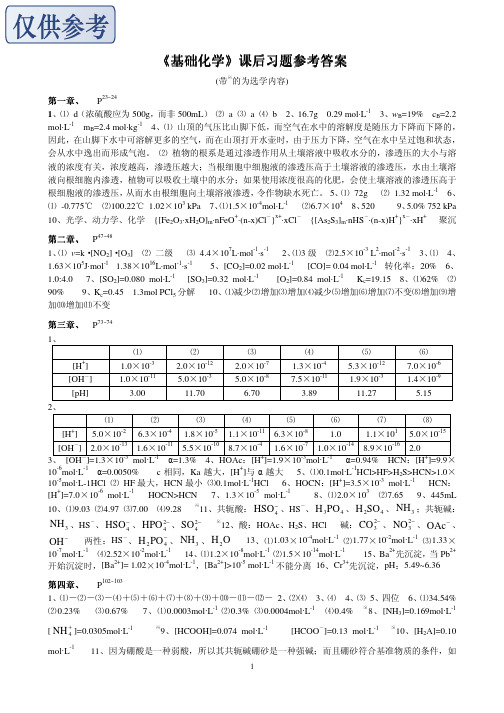
[OH ] 2.0×10-13 1.6×10-11 5.5×10-10 8.7×10-4 1.6×10-7 1.0×10-14 8.9×10-16 2.0 3、 [OH-]=1.3×10-3 mol·L-1 α=1.3% 4、HOAc:[H+]=1.9×10-3mol·L-1 α=0.94% HCN:[H+]=9.9× -6 -1 + 10 mol·L α=0.0050% c 相同,Ka 越大,[H ]与 α 越大 5、⑴0.1mol·L-1HCl>HF>H2S>HCN>1.0× 10-5mol·L-1HCl ⑵ HF 最大,HCN 最小 ⑶0.1mol·L-1HCl 6、HOCN:[H+]=3.5×10-3 mol·L-1 HCN: + -6 -1 -5 -1 3 [H ]=7.0×10 mol·L HOCN>HCN 7、1.3×10 mol·L 8、⑴2.0×10 ⑵7.65 9、445mL 10、⑴9.03 ⑵4.97 ⑶7.00 ⑷9.28
2
1 ⑷m = 0 2
5、 n ≥ 3 、 l = 0,1 、 l = 0 、 m = 0 、 m s = ±
2
1 2
2s
n 2 2
m 0 0
ms +1/2 -1/2
2p3
※
2 2 2
1 1 1
0 +1 -1
+1/2 +1/2 +1/2
基础化学李保山第二版12章主族元素答案

基础化学李保山第二版12章主族元素答案12 主族元素习题解答(p399-402)思考题1.解答:(1)将两种金属分别切割一小块儿,投入水中,反应比较剧烈的是钾,另一种金属则是钠。
(2)先将大苏打和小苏打分别配成溶液,向其中加入稀盐酸,有沉淀生成的是大苏打(3)将等量的三种物质溶于水,用PH试纸检验,PH最大的是烧碱,PH最小的是泡花碱,剩余的是纯碱。
2.解答:(1)铍(2)氧化钙(3)氢氧化铍和氢氧化钡(4)碳酸镁3.解答:(1)2Ca(OH)2+2Cl2==CaCl2+Ca(ClO)2+2H2O(2)Ca(OH)2+Na2CO3==2NaOH+CaCO3(3)2NH4Cl + Ca(OH)2 ==CaCl2 + 2NH3↑ + 2H2O(4)Ca(OH)2+MgCO3== CaCO3+Mg(OH)24. 解答:非极性固体I2易溶于非极性溶剂CCl4;I2+I-=I3-5.解答:加入稀HCl溶液鉴别S2-、SO32-、S2O32-;6.解答:因为硫化氢在水中的溶解度不高,而且长时间存放易被氧化成二氧化硫。
因为溶液中S2-被氧化为S单质,形成沉淀。
7.解答:具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。
氧的同位素:16O、17O、18O。
硫的同位素:32S、34S。
碳的同位素:12C、13C。
8.解答:(1)2Sb3++3Sn==2Sb+3Sn2+,而Bi3+不会发生这个反应。
(2)向两种溶液中加入氢氧化钙,有沉淀生成的是SO42-。
9.解答:H3PO2一元酸,H3PO3二元酸,H4P2O7三元酸。
10. 解答:稳定性不同、酸碱性等不同11.12.略13 解答:铝与盐酸:2Al+6HCl==2AlCl3+3H2铝与硫酸:2Al+3H2SO4==2Al2(SO4)3+3H2铝与硝酸反应,铝被钝化,不能进一步反应。
14. 解答:NO2-具有更强的氧化性,可在弱酸介质中将Fe2+氧化为Fe3+15. 解答:E(Sn2+/Sn)<="" cl-)<="" e(sn4+="" h2)="" p="" sn)16. 解答:Sb2S3酸性,Bi2S3碱性,Sb2S3的还原性较Bi2S3强17. 解答:(1)可以(2)不能:2Fe3++2I-===I2+2Fe2+(3)不能:5Br-+ BrO3-+6H+==3Br2+3H2O(4)不能:5I-+ IO3-+6H+==3I2+3H2O18.解答:(1)酸性:HClO<hclo2<hclo3<hclo4< p="">(2)酸性:H3PO4<h2so4<hclo4< p="">习题2. 答:(1)H 2CrO 4的K a2θ=3.3×10-7,c =0.05×0.5/(3.00+0.05)=8.2×10-3mol .dm -3HCrO 4- = H + + CrO 42-c -[CrO 42-] 10-6 [CrO 42-]]CrO []][H CrO [2424θa2-+--=c K 即 ]C r O [102.810]CrO [103.3243-6.00247-----??=?所以:[CrO 42-]=2.0×10-3 mol .dm -3(2) K sp θ=1.2×10-10=[Ba 2+][CrO 42-]=2.0×10-3 [Ba 2+][Ba 2+]min =1.2×10-10/2.0×10-3=6.0×10-8 mol .dm -33.解答:A —BaCO 3;B —BaO ;C —CaCO 3;D —BaCl 2;E —BaSO 4;反应式:BaCO 3== BaO+CO 2CO 2+Ca(OH)2= =CaCO 3↓+ H 2OBa(OH)2+ 2HCl== BaCl 2+2H 2OBa(OH)2+H 2SO 4== BaSO 4+2H 2O4.解答:KCl 、MgSO 45.解答:A —Na ;B —NaOH ;C —HCl ;D —NaCl ;E —AgCl ;F —Na 2O 2;G —Na 2O ;H —H 2O 2;I —O 2反应方程式:Na+2H 2O==2 NaOH+H 2NaOH+HX==NaX+H 2ONaX+AgNO 3==AgX+NaNO 3AgX+2NH 3·H 2O==[Ag(NH 3)2]++X -+2H 2ONa 2O 2+2Na==2 Na 2ONa 2O 2+2H 2O==2 NaOH+ H 2O 22 H 2O 2==2 H 2O+O 26.(1) Cl 2+I -==I 2+2 Cl -6 H 2O+5 Cl 2+ I 2==2HIO 3+10HClCl 2+2Br -==Br 2+2 Cl -(2) 不一定7.(1)3HClO==HClO 3+2HCl(2)8 HClO 3==4HClO 4+2 Cl 2 +3O 2+2H 2O(3)2K ClO 3==2KCl+3 O 2(4)NH 4Cl==NH 3+HCl(5) (NH 4)2CO 3==2 NH 3+CO 2+2H 2O(6) NH 4NO 2==N 2+2H 2O(7) NH 4NO 3== N 2O+2H 2O(8) (NH 4)2SO 4==2 NH 3+H 2SO 4(9) (NH 4)2Cr 2O 7== Cr 2O 3+ N 2+4H 2O8.CaC 2O 4能溶于醋酸,CaCO 3、CaC 2O 4能溶于稀强酸,BaSO 4不溶于强酸。
基础化学(人卫第8版)课后习题参考答案

8、 n( ZnCl 2 )
m( ZnCl 2 ) 350 g 2.57 mol M ( ZnCl 2 ) 136.3 g mol 1
此溶液的物质的量浓度为:
c( ZnCl 2 ) n( ZnCl 2 ) 2.57mol 3.48mol L1 V 739.5mL
此溶液的质量摩尔浓度为:
c Cl
m(Cl ) 366mg n(Cl ) M (Cl ) 35.5 g mol 1 103mmol L1 V V 100 mL
10、 m(C6 H12 O6 ) 50.0 g L1 500mL 25.0 g
m(C 6 H 12 O6 H 2 O) 25.0 g
Chapter 1 Introduction 习题 3、(1) 5 位; (2) 3 位; (3) 2 位; (4) 1 位; (5) 2 位. 4、 RE 5
X T 0.1023 0.1024 0.001 0.1% T 0.1024
、
mol L1 J K 1 mol 1 K J L1 kg m 2 s 2 L1 1000 kg m 1 s 2 1000 Pa kPa
溶液中水的质量为: 500mL 1.00kg L1 25.0 g 475 g ,则葡萄糖的摩尔分 数为:
m(C 6 H 12 O6 ) n(C 6 H 12 O6 ) M (C 6 H 12 O6 ) x(C 6 H 12 O6 ) n(C 6 H 12 O6 ) n( H 2 O) m(C 6 H 12 O6 ) m( H 2 O) M (C 6 H 12 O6 ) M ( H 2 O) 25.0 g 180 g mol 1 0.00525 25.0 g 475 g 180 g mol 1 18.0 g mol 1
基础化学课后习题答案

基础化学课后习题答案在基础化学课后习题中,通常会涉及到化学反应原理、化学计量学、化学键、物质的分类、化学平衡、溶液的浓度计算等方面的问题。
以下是一些基础化学课后习题的典型答案示例:1. 化学反应原理- 题目:解释为什么铁在氧气中燃烧会产生火花?- 答案:铁在氧气中燃烧是一个氧化反应。
当铁与氧气接触时,铁原子失去电子形成Fe²⁺或Fe³⁺离子,而氧气获得电子形成O²⁻离子。
这个过程中释放出大量的能量,表现为火花和热量。
2. 化学计量学- 题目:计算2摩尔的氢气(H₂)与1摩尔的氧气(O₂)反应生成水的摩尔数。
- 答案:根据化学方程式 \(2H_2 + O_2 \rightarrow 2H_2O\),2摩尔的氢气与1摩尔的氧气完全反应生成2摩尔的水。
3. 化学键- 题目:描述离子键和共价键的区别。
- 答案:离子键是由正负离子之间的静电吸引力形成的,通常存在于金属和非金属之间。
共价键则是由两个原子共享电子对形成的,通常存在于非金属元素之间。
4. 物质的分类- 题目:区分纯净物和混合物。
- 答案:纯净物是由单一物质组成的,具有固定的化学组成和性质。
混合物则是由两种或两种以上的物质混合而成,没有固定的化学组成。
5. 化学平衡- 题目:解释勒夏特列原理。
- 答案:勒夏特列原理指出,如果一个处于平衡状态的化学反应系统受到外部条件的改变(如温度、压力或浓度的变化),系统会自动调整以减少这种改变的影响,从而重新达到平衡状态。
6. 溶液的浓度计算- 题目:如果将50毫升的0.1摩尔/升的盐酸溶液稀释到200毫升,计算稀释后的浓度。
- 答案:稀释前后溶质的物质的量不变。
稀释前的盐酸物质的量为\(50 \text{ mL} \times 0.1 \text{ mol/L} = 5 \text{ mmol}\)。
稀释后的浓度为 \(5 \text{ mmol} / 200 \text{ mL} = 0.025\text{ mol/L}\)。
基础化学第八版课后习题答案

基础化学第八版课后习题答案基础化学第八版课后习题答案在学习化学的过程中,课后习题是巩固知识、检验理解的重要环节。
本文将为大家提供基础化学第八版课后习题的答案,希望能够帮助大家更好地学习和掌握化学知识。
第一章:化学世界1. 化学是一门研究物质的科学。
它研究物质的组成、性质、结构、转化过程以及与能量的关系。
2. 物质是构成宇宙万物的基本单位,可以分为纯物质和混合物。
纯物质由一种组分构成,混合物由两种或两种以上的组分构成。
3. 化学变化是物质发生变化的过程,包括化学反应和核反应。
4. 化学反应的特征有:起始物质(反应物)和生成物质的变化,化学键的形成和断裂,能量的吸收和释放。
5. 物质的性质可以通过观察和实验来确定,包括物理性质和化学性质。
物理性质是物质本身固有的性质,如颜色、密度、熔点等;化学性质是物质与其他物质发生反应时表现出的性质,如与酸反应产生气体等。
第二章:物质的量和化学反应1. 物质的量是描述物质数量的物理量,用单位摩尔(mol)表示。
1摩尔物质的质量称为摩尔质量,用单位克/摩尔(g/mol)表示。
2. 摩尔质量的计算公式为:摩尔质量 = 物质的质量 / 物质的量。
3. 化学方程式是用化学符号和化学式表示化学反应的过程。
化学方程式必须满足质量守恒定律和电荷守恒定律。
4. 反应的量比关系可以通过化学方程式的系数来确定。
系数表示反应物和生成物的摩尔比。
5. 化学计量是研究化学反应中物质的量关系的学科。
它可以通过计算反应物和生成物的摩尔比来确定反应的量比关系。
第三章:化学反应的能量变化1. 化学反应的能量变化可以通过热量变化来描述。
化学反应吸热时,称为吸热反应;放热时,称为放热反应。
2. 反应的焓变(ΔH)是描述化学反应能量变化的物理量。
焓变可以通过实验测量或计算得到。
3. 反应的焓变可以通过热量计(卡计)进行测量。
热量计是一种用于测量物质吸收或释放的热量的仪器。
4. 焓变的计算公式为:ΔH = 反应物的焓 - 生成物的焓。
基础化学第十二章 滴定分析习题答案

基础化学第十二章习题解答1. 下列数据各几位有效数字?(1)7.655 (2)6.023×1023 (3)4.8×10-10(4)p K a =7.20 (5)0.01023 (6) 51.14答:(1)4; (2)4; (3)2; (4)2; (5)4;(6)42. 应用有效数字规则计算下列各式。
(1)2.3-0.254+789.10= (2)=--341034.2354.21032.44.5⨯⨯⨯⨯(3)(1.276×4.17×10-4)+(1.7×10-4)-(2.176×10-3×1.30×10-2)= (4) (51.0×4.03×10-4)+(2.512×2.034×10-3)= 解:(1)2.3-0.254+789.10=2.3-0.3+789.1=791.1 (2)=--341034.2354.21032.44.5⨯⨯⨯⨯435.4 4.3102.4 2.310⨯⨯⨯⨯--=4.2×10-1(3)(1.276×4.17×10-4)+(1.7×10-4)-(2.176×10-3×1.30×10-2)= (1.28×4.17×10-4)+(1.7×10-4)-(2.18×10-3×1.30×10-2)=5.3×10-4+1.7×10-4-0.3×10-4=6.7×10-4(4) (51.0×4.03×10-4)+(2.512×2.034×10-3)= (51.0×4.03×10-4)+(2.512×2.034×10-3)=2.06×10-2+0.51×10-2)=2.57×10-23. 在用邻苯二甲酸氢钾标定NaOH 溶液的浓度时,若在实验过程中发生下列过失的情况,试说明每种情况下NaOH 溶液所测得的浓度是偏大还是偏小。
基础化学第二版习题答案chap12

第十二章 配位化合物 习题答案1. 解:(1)配合物的内界是配合物的特征部分,是由中心原子和配体组成;配合物中与配离子带相反电荷的离子称为配合物的外界。
(2)只含有一个配位原子的配体称为单齿配体,如NH 3、H 2O 、OH -、F -、Cl -、Br-等,含有2个或2个以上配位原子的配体称为多齿配体,如en 、EDTA 等。
(3)中心原子用2个次外层d 轨道、1个最外层s 轨道和3个最外层p 轨道进行杂化,这种杂化方式称为d 2sp 3杂化。
中心原子用1个最外层s 轨道、3个最外层p 轨道和2个最外层d 轨道进行杂化,这种杂化方式称为sp 3d 2杂化。
(4)中心原子全部用最外层空轨道进行杂化成键,所形成的配合物称为外轨配合物。
中心原子用次外层d 轨道和最外层的ns 、np 轨道进行杂化成键,所形成的配合物称为内轨配合物。
(5)同一中心原子形成的配位数相同的配合物中,单电子数较多的配合物称为高自旋配合物;单电子数较少的配合物称为低自旋配合物。
2. 解: 列表如下: 配合物 名 称中心原子 配体 配位原子配位数 1二(硫代硫酸根)合银(Ⅰ) 酸钠 Ag +S 2O 32-S22 硫酸三(乙二胺)合钴(Ⅲ) Co 3+ en N 63 四羟基合铝(Ⅲ)酸钠 Al 3+ OH -O 4 4 五氯·氨合铂(Ⅳ)离子 Pt 4+ Cl -、NH 3Cl -、N6 5 氯·硝基·四氨合铂(II ) Pt 2+ NO 2-,Cl -、NH 3 N 、Cl -、N 6 6氯化二氯·三氨·水合钴(Ⅲ)Co 3+Cl -、NH 3、H 2O Cl -、N 、O63. 解: Pd 2+的价层电子组态为4d 8。
由于[PdCl 4]2-为平面四方形结构,因此中心原子Pd 2+采用dsp 2杂化。
配离子[PdCl 4]2-中Pd 2+的价层电子排布为:配离子中没有未成对电子,μ= 0,为反磁性。
基础化学第12章练习题

基礎化學第1~2章練習題一、單選題( 題每題 分共 分)( ) 1. 目前已知碳的同素異形體中,何者最晚被發現?(A)石墨(B)金剛石(C)巴克球(D)鑽石。
C( ) 2. 下列物質中,何者僅含有一種分子?(A)雙氧水(B)鹽酸(C)葡萄糖(D)水銀。
C(A)H2O2水溶液(B)HCl水溶液(D)Hg原子。
( ) 3. 氫燃燒前後,下列有關敘述何者錯誤?(A)H原子的數目不變(B)產生新分子(C)產生新原子(D)H原子質量不變。
C化學變化,原子不變。
( ) 4. 有關元素及原子的概念哪一項敘述正確?(A)純物質甲受熱分解產生物質乙及氣體丙,則甲物質不可能是元素(B)具有物質特性之最小單元是原子(C)由兩種相同元素組成的多種化合物,性質必定相同(D)乾淨的空氣是純化合物。
A元素由同種原子構成,不可能產生兩種不同物質。
( ) 5. 就能量觀點而言,光合作用是哪兩種能量間的轉換?(A)輻射能→光能(B)光能→熱能(C)光能→化學能(D)化學能→光能。
C( ) 6. 下列敘述為一般科學上常見量的範圍哪些是正確的?(甲)一般化學變化的能量範圍在100~1000kJ/mol(乙)原子的直徑大小約在10-9~10-10m(丙)一般原子核直徑大小約10-45m(丁)一個電子所帶的電量約10-23庫倫(A)僅有甲、乙、丙(B)僅有甲、乙(C)甲、乙、丙、丁(D)僅有甲、乙、丁。
B丙:10-10m丁:1.6⨯10-19庫侖( ) 7. 下列何者不是混合物?(A)石墨棒(B)不鏽鋼(C)碘酒(D)汽油。
A( ) 8. 有關道耳吞的「原子論」,下列何項敘述錯誤?(A)是一種假設(B)是現代物質科學發展的基礎(C)原子以整數個相結合而成化合物(D)原子由電子、質子、中子所構成。
D(D)一切物質由原子組成。
( ) 9. 下列敘述何項正確(A)水泥凝固與水凝固都是物理變化(B)麵粉發酵是物理變化(C)水消毒、殺菌是物理變化(D)碘昇華是物理變化。
基础化学 人卫第 版 课后习题参考答案

(1)的说法正确。
9.
cB RT
mB M BV
RT
MB
mB RT V
2.00g 8.314J mol 1 K 1 298K 0.717kPa 0.100L
6.91104 g mol 1
10.
bB
T f Kf
0.52K
1.86K kg mol 1
0.28mol kg 1
cos 0.28 mol·L-1
或
mol L1 J K 1 mol 1 K J L1 N m L1 1000N m2 1000Pa kPa
7、 nNaOH
m(NaOH ) M (NaOH )
0.010kg 40.0g mol 1
0.25mol
n 1 Ca 2 2
m( 1 Ca 2 ) 2
M ( 1 Ca 2 )
25.0g
180g mol 1
0.00525
25.0g 475g
180g mol 1 18.0g mol 1
11、 mNa 5.0g
mNaCl 5.0g
M (NaCl ) M (Na )
5.0
g
58.5g 23.0g
mol mol
1 1
13g
V NaCl
m(NaCl ) (NaCl )
Chapter 1 Introduction
习题
3、(1) 5 位; (2) 3 位; (3) 2 位; (4) 1 位; (5) 2 位.
4、 RE X T 0.1023 0.1024 0.001 0.1%
T
0.1024
5
、
mol L1 J K 1 mol 1 K J L1 kg m2 s 2 L1 1000kg m1 s 2 1000Pa kPa
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章绪论习题答案
1.指出下列哪些单位属于SI单位,那些不是。
时间单位min、能量单位J、体积单位L、质量单位μg、长度单位nm、温度单位℃
2.SI制的基本单位有哪几个?
3.我国的法定计量单位和SI制单位有什么联系和不同?
******************************************************************************* 1.答:能量单位J、质量单位μg、长度单位nm、温度单位℃属于SI单位;其他不是。
2.答:SI基本单位:m、kg、s、A、K、mol、cd
3.答:一切属于国际单位制的单位都是我国的法定计量单位。
根据我国的实际情况,在法定计量单位中还明确规定采用了若干可与国际单位制并用的非国际单位制单位。
第二章稀溶液的依数性习题答案
1. 20︒C时,水的饱和蒸气压为。
若于100g水中溶入10.0g蔗糖(C12H22O11,相对分子质量为M r=342),求此溶液的蒸气压。
2.现有四种处于相同温度和压力下的理想稀溶液。
(1) mol蔗糖溶于80 mol水中,水蒸气压为p1
(2) mol萘溶于80 mol苯中,苯蒸气压为p2
(3) mol葡萄糖溶于40 mol水中,水蒸气压为p3
(4) mol尿素溶于80 mol水中,水蒸气压为p4
这四个溶液的蒸气压之间的关系为:( )
(A) p1≠p2≠p3≠p4(B) p2≠p1=p4>p3
(C) p1=p2=p4=(1/2)p3(D) p1=p4<2p3≠p2
3.治疗脱水、电解质失调与中毒静脉滴注的林格氏(Ringer)液的处方是:在1.00L注射用水中溶有,,⋅⋅2H2O。
林格氏液的渗透浓度是多少?下凝固点为多少?它与人体血浆溶液等渗吗?
4.将难挥发非电解质溶于250g水,该溶液在下,沸点为︒C。
求该溶质的相对分子质量及此溶液的凝固点。
5. 人体眼液的渗透压在37 ℃时约为770 kpa。
市售的某种眼药水是用下列4种物质配制而成的:5.00 g ZnSO4,17.00 g H3BO3(硼酸),0.20 g 盐酸黄连素和0.008 g 盐酸普鲁卡因,溶于水并稀释到1000 mL。
若设ZnSO4完全解离,硼酸是一元弱酸不解离,黄连素和普鲁卡因含量少忽略不计时,计算该眼药水在37 ℃时的渗透压是多少?并与人体眼液的渗透压比较。
6. 从植物中分离出一种未知结构的有抗白细胞增多症的生物碱,为了测定其相对分子质量,
将该物质溶入100g 水中,测得溶液沸点升高为、凝固点下降为。
用两种方法计算该物质的相对分子质量。
7. 把一小块冰放到0℃的水中,另一小块冰放到0℃的盐水中,冰是否会融化,为什么?
8. g Hg(NO 3)2和 g HgCl 2分别溶解于1000 g 水中。
溶液的凝固点分别为 ℃和 ℃。
问哪种物质在水中是以离子状态存在的?
9.下列各对溶液用半透膜隔开,请用箭头标明水分子的渗透方向:
(1)·L -1KCl | ·L -1蔗糖
(2)·L -1葡萄糖 | ·L -1蔗糖
(3)50g·L -1蔗糖 | 50g·L -1葡萄糖
10.农田施肥太浓时植物会被烧死,盐碱地的农作物长势不好甚至枯萎。
试解释原因。
11.测得人体血液的凝固点下降值△T f =,求体温37℃时人体血液的渗透压。
12.500mL10g ·L -1的葡萄糖溶液中,应加入多少g NaCl 才能与血浆渗透压相等?
13.晶体渗透压和胶体渗透压分别是何种物质产生的?它们对维持机体稳定状态各有什么作用?
******************************************************************************* 1.解: kPa 33.2mol 18g g 100mol g 34210g mol g 18g
100kPa 34.21
-11A *=⋅+⋅⋅⨯==--x p p 2.解: B 3.解:
11
11os L mol 305.0L 1/)mol 147.33g 03mol 5.74.30g 02mol 5.58g 5.82(----⋅=⋅⨯+⋅⨯+⋅⨯==g g g ic c C 567.0 K,567.0k mol 305.0mol k K 86.1k mol 305.0o f 11f f 1os -==⋅⨯⋅⋅==∆⋅≈≈---T g
g ib K T g c ib B B 与人体血浆溶液等渗 4.解:11A B b b mol 1.28kg
250.0g 00.7K 510.0mol kg 0.512K --⋅=⋅⋅⋅=⋅∆=g m m T K M 1B kg mol 996.0kg
250.0mol 1.28g
00.7-⋅=⋅=g b △T f =K f ·b B = K·kg·mol -1· mol·kg -1=1.85 ℃
T f =-1.85 ℃
5.解:
略高。
其渗透压比人眼渗透压kPa 868K 103mol K L 8.314kPa L mol 337.0L mol 337.0L 000.1/)mol
g 83.61g 0.17mol g 5.161.00g 52(11-1os 1
11os =⨯⋅⋅⋅⋅⋅==⋅=⋅+⋅⨯==-----RT c Πic c 6.解:
1
31A B b b mol 1062.1kg
100.00.19K 060.0mol k 0.512K --⋅⨯=⋅⋅⋅=⋅∆=g g g m m T K M 131A B f f mol 1061.1kg
100.00.19K 220.0mol k 1.86K --⋅⨯=⋅⋅⋅=⋅∆=g g g m m T K M 7.解:把一小块冰放到0℃的水中,冰不会融化。
因为水的凝固点为0℃,此时冰水处于平衡状态,所以冰水能够共处。
另一小块冰放到0℃的盐水中,冰会融化。
因为盐水的凝固点下降,小于0℃,0℃时冰和盐水没达到平衡状态,加入的冰会融化而使溶液温度降低。
8.解:
316.3kg 000.1mol g 6.324246.3mol k K 86.1K
0588.0)Hg(NO 11B f f 2
3≈=⋅⋅⨯⋅⋅=∆=--g g b K T i 对00.1kg 000.1mol 71.5g 284.10mol k K 86.1K 0744.0HgCl 11B f f 2=⋅⋅⨯⋅⋅=∆=--g g b K T i 对 所以Hg(NO 3)2在水中是以离子状态存在的。
9.解:(1) <----- (2)<======> (3)----->
10.施肥太浓即所配的化肥为高渗溶液,将其施入土中会使土地中的渗透压高于植物细胞中的渗透压。
植物因失水而会被烧死。
同样盐碱地的渗透压也高于农作物细胞的渗透压,使农作物失水而长势不好甚至枯萎。
11.解:kPa
776K 103mol K L 8.314kPa L mol 301.0L mol 301.0mol k 1.86K K 56.011-1os 1
1f f os =⨯⋅⋅⋅⋅⋅==⋅=⋅⋅=∆≈----RT c Πg K T c 12.解
g
m m c c c 63.3)NaCl (mol
g 180L g 10L mol 3037.0L 500.0mol g 5.58)
NaCl (2)
()()NaCl (1-111-os os os =⋅⋅-⋅=⋅⨯-=--葡萄糖血浆 13.解:晶体渗透压由小分子晶体物质组成,血浆晶体渗透压对维持细胞内外水分的正常交换和分布,保持红细胞的正常形态有重要作用。
胶体渗透压由蛋白质等胶体高分子组成,血浆中胶体渗透压比组织液中胶体渗透压大,故血浆胶体渗透压对调节毛细血管内外水分
的正常分布,促使组织中水分渗入毛细血管以维持血容量,具有重要作用。
