1992年第24届IChO试题与答案
2化学竞赛题库IChOLand10-10-答案

中国化学会第24届全国高中学生化学竞赛(省级赛区)模拟试题参考答案及评分细则题号1 2 3 4 5 6 7 总计满分 19 18 12 20 11 14 9 100评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
第1题 酸碱滴定法(19分)1-3H 2PO 4-(0.5分)HPO 42-(0.5分)其他答案不给分。
1-4cK a3<10-8(1分,表达出这个意思即可给分,但不能用中文说明)3Ca 2++2HPO 42-Ca 3(PO 4)2+2H +或Mg 2++NH 4++HPO 42-NH 4MgPO 4+H +答其他可以生成磷酸盐沉淀的离子,如锂离子,可得1分。
其他答案不给分。
(2分)第2题 “深度”有机反应(18分)e)ONCO(1分)其他答案不给分。
f)OHOHHO(2分)其他答案不给分。
第3题 Cram rule(12分)3-2PhOH结构:(1.5分,羟基碳的构型画错,扣一分。
其他答案不给分。
)命名:(2S,3S)-3-苯基-2-戊醇(1.5分,不加括号也可。
)命名未标注构型或标错,扣一分。
若结构中羟基的构型画反,但命名给出(2R,3S)这样的构型,命名得满分。
第4题 钴和镍的化学(20分)4-4Co 2++4SCN -Co(SCN)42-(1分,不用可逆箭头也可)溶液中出现蓝色。
(1分)若还写出Hg 2++Co(SCN)42-Hg[Co(SCN)4],不扣分。
4-6Ni2C14O2I4H8Ni2I4(CO)2(C6H4)2或各元素间可换位置写成或可得1分。
(2分)NiC7OI2H4NiI2(CO)(C6H4)NiCOOCNiIIII(4分,其他答案不给分。
)第5题 有关锑元素的结构化学(11分)第6题 (+)-laurallene的全合成(14分)第7题 McMurry反应(9分)7-1(1分)其他答案不给分。
化学奥赛试题例题

无机例题例1次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液中,加热到40℃-50℃,析出一种红棕色色的难溶物A。
经鉴定:反应后的溶液是磷酸和硫酸的混合物;X-射线证实A是一种六方晶体,结构类同于纤维锌矿(ZnS),组成稳定;A的主要化学性质如下:①温度超过60℃,分解成金属铜和一种气体;②在氯气中着火;③与盐酸反应放出气体。
试回答:(1)写出A的化学式;(2)写出A的生成反应的化学方程式;(3)写出A与氯气反应的化学方程式;(4)写出A与盐酸反应的化学方程式。
(1997年全国化学奥赛初赛试题)解析:(1)A—CuH,ZnS为AB(1-1)型,A可分解为Cu和一种气体,A是CuSO4被还原的产物(Cu2+→Cu+)。
(2)4CuSO4+3H3PO2+6H2O=4CuH+3H3PO4+4H2SO4(3)2CuH+3Cl2=2CuCl2+2HCl(Cl2是强氧化剂,而Cu+具有一定的还原性)(4)CuH+HCl=CuCl+H2或CuH+2HCl=H[CuCl2]+H2或CuH+3HCl=H2[CuCl3]+H2(氧化还原反应:H-+H+→H2,H-的还原性显然比Cu+强得多,而H+的氧化性显然比Cl2弱得多,故H+不可能将Cu+氧化成Cu2+。
)例2迄今已合成的最重元素是112号,它是用7030Zn高能原子轰击20882Pb的靶子,使锌核和铅核熔合而得。
科学家通过该放射性元素的一系列衰变的产物确定了它的存在,总共只检出一个原子。
该原子每次衰变都放出一个高能α粒子,最后得到比较稳定的第100号元素镄的含153个中子的同位素。
(1)112号元素是第几周期第几族元素?(2)它是金属还是非金属?(3)你认为它的最高氧化态至少可以达到多少?(4)写出合成112号元素的反应式(核素用AZX表示)。
(1998年全国化学竞赛初赛试题)解析:(1)112号元素是第七周期ⅡB 族元素;(2)金属;(3)+2;(4)112号可记为277112M , 70208277130821120Zn Pb M n +=+。
2化学竞赛题库IChOLand10-04-答案
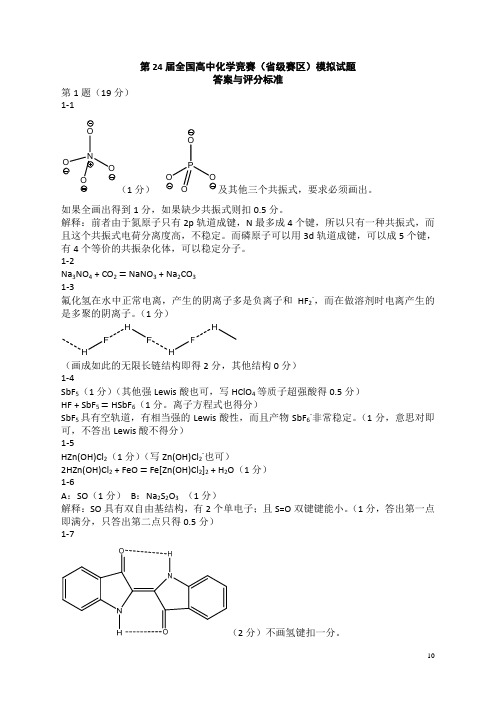
第24届全国高中化学竞赛(省级赛区)模拟试题答案与评分标准第1题(19分)1‐1NOO OO(1分)POOOO及其他三个共振式,要求必须画出。
如果全画出得到1分,如果缺少共振式则扣0.5分。
解释:前者由于氮原子只有2p轨道成键,N最多成4个键,所以只有一种共振式,而且这个共振式电荷分离度高,不稳定。
而磷原子可以用3d轨道成键,可以成5个键,有4个等价的共振杂化体,可以稳定分子。
1‐2Na3NO4 + CO2 NaNO3 + Na2CO31‐3氟化氢在水中正常电离,产生的阴离子多是负离子和HF2‐,而在做溶剂时电离产生的是多聚的阴离子。
(1分)(画成如此的无限长链结构即得2分,其他结构0分)1‐4SbF5(1分)(其他强Lewis酸也可,写HClO4等质子超强酸得0.5分)HF + SbF5 HSbF6(1分。
离子方程式也得分)SbF5具有空轨道,有相当强的Lewis酸性,而且产物SbF6‐非常稳定。
(1分,意思对即可,不答出Lewis酸不得分)1‐5HZn(OH)Cl2(1分)(写Zn(OH)Cl2‐也可)2HZn(OH)Cl2 + FeO Fe[Zn(OH)Cl2]2 + H2O(1分)1‐6A:SO(1分) B:Na2S2O3 (1分)解释:SO具有双自由基结构,有2个单电子;且S=O双键键能小。
(1分,答出第一点即满分,只答出第二点只得0.5分)1‐7(2分)不画氢键扣一分。
因为它具有大共轭体系,其吸收落在可见光区,所以可以用作染料(0.5分)因其氢键作用及分子对称性高,所以熔点高。
(0.5分)第2题(10分)2‐1A:NH4Cl(0.5分) B:NCl3(1分)(0.5分)因为氮有5个价电子,每个Cl提供1个价电子,共4对价电子,有3个配位原子,1对孤对电子,所以是三角锥。
(关键数据写出即可得到1分)2‐2NCl3 + 3H2O NH3 + 3HClO(0.5分)因为N电负性大于Cl,N显‐3价,Cl显+1价。
工业分析检验试题含答案

工业分析检验试题含答案一、单选题(共IOO题,每题1分,共100分)1、使用乙怏钢瓶气体时,管路接头可用()。
A、铜接头B、锌铜合金接头C、不锈钢接头D、银铜合金接头正确答案:C2、原子吸收光谱是()。
A、线性光谱B、分子光谱C、带状光谱D、宽带光谱正确答案:A3、采用福尔哈德法测定水中Ag+含量时,终点颜色为()。
A、红色B、纯蓝色C、黄绿色D、蓝紫色正确答案:A4、下面有关遵纪守法是从业人员的基本要求的论述错误的是()。
A、遵纪守法是从业人员的必备素质B、遵纪守法是从业人员的基本义务C、遵纪守法与从业人员无关D、遵纪守法是从业的必要保证正确答案:C5、产品质量是指()。
A、国家有关法定、质量标准以及合同规定对产品适用和其他特性的要求B、企业根据用户的要求进行协商的意项C、企业根据自身条件进行协商的要求D、企业领导制订的方针正确答案:A6、在列举出的实验室认可要求中,(不)属于质量体系保证的是()。
A、标准方法或非标准方法B、报验单(委托单)的登记C、按标准取样、制样D、填写抽、制作记录、样品传递记录正确答案:A7、当溶液的[H+]=10-4mo1/1时,下一反应进行的方向是()。
As042-+21-+2H+→A S O32→H^0+I2OΦθ(I√2I-)=0.54V,Φθ(As042-/AsO32-)=0.559VA、向左B、向右C、反应达到平衡D、无法判断正确答案:A8、对硅酸盐样品进行分析前,应该除去其中的()。
A、结晶水B、化合水C、结构水D、吸附水正确答案:D9、在滴定分析法测定中出现的下列情况,O属于系统误差。
A、滴定时有液滴溅出B、试样未经充分混匀C、滴定管的读数读错D、祛码未经校正正确答案:D10、在2Cι?++4I-=2CuII3中,Φθ(I√I-)=0.54V,Φθ(Cu2+/CuI)=0.86V,Φθ(Cu2+/CuI)>Φθ(Ijb)则反应方向向()。
A、右B、左C、不反应D、反应达到平衡时不移动正确答案:AIK下列分光光度计无斩波器的是()。
2化学竞赛题库IChOLand09-12-答案

冬令营模拟卷答案第一题(14分):1.3d54s1 (1’)2.其间除了正常的配位键外还有反馈π键的存在,(1’) 因此削弱了CO之间的化学键的强度,使之键级从3级下降到2级,键的能量下降。
(0.5’) 所以游离的CO比此处的CO键的能量大,向短波方向移动。
(0.5’)3.框里的为结构基元 (2’)未画出结构基元扣0.5’4.每个Cr与4个氧共用8个电子,与本单元外的Cr共用2个电子,剩下与单元内的Cr共用8个电子,满足EAN中的18电子规则。
(1’) 单元间存在Cr‐Cr单键,(0.5’) 单元内为Cr‐Cr四重键。
(0.5’)5.由4个d轨道构成。
(0.5’) d z2构成σ键(包括单元内的和单元外的),d yz和d xz构成π键,d xy或d x2‐y2构成δ键。
(每个0.5’,共2’)6.Cr与配体的C形成一个正常的共价键,(0.5’) Cr‐Cr之间是五重键。
(0.5’) 因为该化合物Cr缺电子的情况很严重,很容易和其他的配体或者其他的相同分子聚合。
选此配体是为了增大位阻,阻止其与别的分子配位或者分子间聚合成多核的金属簇合物。
(必须提到位阻 1’)(1’)7.下一个化合物应该有Cr‐Cr六重键,(0.5’) 同时会更严重的缺电子(0.5’)。
需要能提供一对电子的配体(0.5’),同时该配体的位阻应当更大(0.5’)。
第二题(10分):1.H的电负性为2.20,B是2.05,N是3.07。
因此B‐H键中,H带负电荷;N‐H中H带正电荷。
于是这里正H和负H会形成二氢键,是一种非常规氢键。
(1’)说明带电荷状况但未说明二氢键得0.5’2. (C 2)x(1’) 3. 两种结构分别是类似石墨和金刚石的结构: 类似石墨(1’)类似金刚石(1’)类石墨的可以作润滑剂(0.5’),类金刚石的可以用于切割(0.5’)未画出晶胞不得分 4.+4 (1’ 少“+”不得分) (1’)5.有配位键,共价键和二氢键 (1’) 少写二氢键得0.5’(2’)第三题(13分):1. △r H m = ∑△f H m O = ‐890.36 kJ/molQ=1000g/16gmol ‐1×(‐△r H m ) = 5.56×104 kJ (列式0.5’,结果0.5’,共1分) W=Q ×η=6.67×103 kJ (列式0.5’,结果0.5’,共1分) 总的可用功为反应的△G 的绝对值,△r G m =△r H m ‐T △r S m = ‐823.99 kJ/mol T=273.15 K 使用的功为△H ×η=106.84 kJ/mol ,所以浪费的占(823.99‐106.84)/823.99=87%(列式0.5’,结果0.5’,共1分)2. 负极CH 4 + 10 OH ‐ ‐ 8e ‐ =CO 32‐ + 7 H 2O (0.5’) 正极O 2 + 2 H 2O + 4e ‐ = 4 OH ‐ (0.5’)△G=‐nFE => E=1.068 V (0.5’)改变pH 理论上电压不变,实际上可能会有微小的变化 (0.5’) IrH H H H PPh 33效率η=△G/△H=92.5% (列式0.5’,结果0.5’,共1分)3.(1)△r G m = ∑△f G m =‐43.48 kJ/mol => K p O = 3.49×104C6H5CH3(g)+H2(g)=CH4(g)+C6H6(g)1‐x 1‐x x xK p O=x2/(1‐x)2 => x=0.995 即甲苯的转化率为99.5%(2)K p O=x/(1‐x)2 => x=0.995 即甲苯的转化率为99.5%(3)K p O=x2/(1‐x) => x=0.99997 即甲苯的转化率为99.997%(可以认为是100%) 以上三问每题列式0.5’,结果0.5’,共3分(4)反应的△G很负,反应相当完全,无需通过分离反应物等手段来提高反应产率。
2化学竞赛题库IChOLand10-05-答案

第二十四届全国高中学生化学竞赛(省级赛区)模拟试题参考答案第一题(5分)1‐12048Ca + 97249Bk 117293M + 401n 2048Ca + 97249Bk 117294M + 301n (每个核反应方程式各2分) 1‐2Uus (1分)第二题(11分)2‐1路易斯酸 路易斯碱 硬酸(碱)H +,Na +,Mg 2+,BF 3 OH ‐,Cl ‐,O 2‐,NH 3 软酸(碱)Cu +,Hg 2+,I 2 I ‐,S 2‐,CO 交界酸(碱)Fe 2+,Zn 2+,Pb 2+,SO 2 Br ‐,NO 2‐,SO 32‐判断路易斯酸的软硬度有一个三角形法则离软酸(三角区)远的金属为硬酸,在软酸(三角区)附近的金属为交界酸。
变价离子中高价离子比低价离子硬,如Fe 3+和Sn 4+为硬酸,Fe 2+和Sn 2+为交界酸;Cu 2+为交界酸,Cu +为软酸(3分)2‐2HF 硬‐硬结合,HI 硬‐软结合(1分)2‐3大 螯合效应 大 Pb 2+是交界酸而RSH 是软碱,结合比较牢固(4分) 2‐4 Ag(I)和Cu(I)均为软酸,Cu(II)为交界酸,S 2‐为软碱,结合牢固;Al(III)和Ca(II)为硬酸,O 2‐和CO 32‐为硬碱,结合牢固(3分) 第三题(15分) M :Sb N :As A :SbF 3 B :CCl 4 P :CCl 2F 2 C :SbCl 3 D :SbOCl E :K 2[Sb 2(d ‐C 4H 2O 6)2]∙3H 2O E 的结构式:2SbF3 + 3CCl4 2SbCl3 + 3CCl2F2SbCl3 + H2O SbOCl + 2HClSbOCl + C4H6O6 H[SbO(C4H4O6)] + HClSbOCl + 2HCl + 3Na2S2O3 3NaCl + H2O + Na3Sb(S2O3)3C20H29OH + SbCl3 C20H29OH∙SbCl3 (氯仿溶液)SbCl3 + 3t‐BuOH + 3NH3 Sb(Ot‐Bu)3 + 3NH4Cl(化学式共8分,E的结构式3分,反应方程式共4分)第四题(13分)4‐1Li: Fe3+ + IO4‐ + 2KOH K2FeIO6 + 2H+Li+ + K2FeIO6 KLi[FeIO6](黄色) + K+Na: Na+ + KSb(OH)6 NaSb(OH)6 + K+或Na+ + Zn(UO2)3Ac8 + HAc + 9H2O NaZn(UO2)3Ac9∙9H2O(金黄色) + H+K: 2K+ + Na3[Co(NO2)6] K2Na[Co(NO2)6](黄色) + 2Na+Rb: 2Rb+ + Na2Ag[Bi(NO2)6] Rb2 Ag[Bi(NO2)6](黄色) + 2Na+Cs: Cs+ + KBiI4 Cs3Bi2I9(亮红色) + K+(每一种离子的检验方法1分)4‐2(4分)溶解过程较为复杂,一般规律是:晶体的晶格能越大,水分子破坏晶格越难,因而溶解度越小;构成晶体的离子水合放热越多,盐的溶解度就越大。
氯化、酸化岗主操理论认证试题(A卷)

氯化、酸化岗主操理论认证试题(A卷)基本信息:[矩阵文本题] *Ⅰ岗位部分(共计70分)一、单选题(每题2分,总分40分)1.巡检过程中,检测氯化吸收塔pH()。
[单选题] *A ≥9B <9C ≥7(正确答案)D <92.新工艺一级酸化釜酸化温度控制在()℃。
[单选题] *A 57-62(正确答案)B 65-80C 70-80D 65-853.新工艺一级酸化釜酸化PH显示在()之间。
[单选题] *A 0.8-2.2B 1.0-2.2(正确答案)C 1.5-2.2D 6.0-7.04.生产中一级酸化釜雷达液位显示在()m。
[单选题] *A ≥2.1B ≥2.3C ≤2.3(正确答案)D ≤2.15.二级酸化釜酸化PH计显示()。
[单选题] *A ≤0.8(正确答案)B ≤1.0C ≤1.2D ≤1.56.二级酸化釜雷达液位计示数显示要()m 。
[单选题] *A ≤2.2(正确答案)B ≤2.5C ≥2.2D ≥2.57.生产中每至少多少时间巡检一次各设备仪表显示情况()。
[单选题] *A 1hB 0.5h(正确答案)C 1.5hD 2h8.冷却釜温度计显示温度()℃时,才能放料。
[单选题] *A ≥30B ≥40C ≤50(正确答案)D ≤609.冷却釜正常PH为()。
[单选题] *A ≤0.8(正确答案)B ≤1.0C ≤1.2D ≤1.510.氯化釜进料后,降温到()℃,滴加催化剂。
[单选题] *A 10-20B 20-30C 25-30(正确答案)D 30-4011.催化剂呈()性。
[单选题] *B 中C 碱(正确答案)D 无12.催化剂滴加过程中,PH数值会缓慢上升至()。
[单选题] *A 5.0-7.0B 5.5-7.5C 7.5-8.5D 9.5-10.5(正确答案)13.加完催化剂,确认氯化釜温度()℃,才进行氯化滴加操作。
[单选题] *A 15-30B 20-30C 25-30(正确答案)D 30-4014.得自控通知进行盐酸滴加,观察PH由10左右缓慢降低到(),再开始滴加次氯酸钠。
1992年第24届IChO试题与答案

1992年第24届IChO试题---理论题和实验题注意事项(1)当监考人员将“开始(start)”写在黑板上后才开始答题。
(2)请用黑色笔(黑墨水笔或黑圆珠笔)答题。
(3)请在每页答卷的右上角写上你的参赛编号。
(4)请将计算过程和答案写在每题后面的空白处,勿写在纸的反面。
若需另页,可向监考人员索取。
原子量H C N O Na Si P1.008 12.01 14.01 16.00 22.99 28.09 30.97S Cl K Ca Cr Fe Ag32.06 35.45 39.10 40.08 52.00 55.85 107.9物理常数R=8.314J·mol-1·K-1=8.314m3Pa mol-1K-1F=96486C·mol-11.硅藻(一种微生物)是海洋中丰富的食物来源,它们通过CO2和水的光合作用产生碳水化合物(即醣):6CO2+6H2O+太阳能→C6H12O6+6O2a)蓝鲸靠捕食一种称之为“Krill”的小鱼生长,在其头5年的生长期内体重每天增加75kg。
鲸每天吃掉的小鱼量是它自身体重增加量的10.0倍。
而小鱼(Krill)需吃掉10.0kg硅藻才增加1.0kg体重。
假定鲸在头5年内体重的增加完全是由于消耗硅藻碳水化合物,则为提供给该鲸在头5年内生长中所需要的硅藻碳水化合物,硅藻要消耗多少升CO2(0℃、1.0atm)?b)i)在24℃和1.0atm下,每升海水溶解0.23mlCO2,若硅藻能从水中把CO2全部除去,则必须处理多大体积的水才能产生蓝鲸在5年内所需要的碳水化合物?ii)假如海水的总体积是1.37×1018m3。
1000头蓝鲸在5年生长中所消耗的CO2(这些CO2是硅藻用来产生碳水化合物的)应该由这一总体积的百分之多少的水来溶解?c)成年鲸质量的3%是氮。
质量为9.1×104kg的鲸死亡后所产生的NH4+的最大质量是多少(这些NH4+可为水生物利用)?d)鲸的质量的18%是碳。
ICH试卷及答案

一、填空题1.ICH Q7适用于人用药品(医疗用品)所含原料药的生产。
2. “原料药的起始物料”是指一种原料、中间体或原料药,用来生产一种原料药,或者以主要结构单元的形式被结合进原料药结构中。
3. 参与原料药生产的每一个人都应当对质量负责。
4. 质量管理体系应当包括组织机构、规程、工艺和资源,以及确保原料药会符合其预期的质量与纯度要求所必需的活动。
5. 所有与质量有关的文件应当由质量部门审核批准。
6. 员工应当避免与中间体或原料药的直接接触。
7. 吸烟、吃、喝、咀嚼及存放食品仅限于与生产区隔开的指定区域。
8. 用于中间体和原料药生产的厂房和设施的选址、设计和建造应当便于清洁,维护和适应一定类型和阶段的生产操作。
设施的设计应尽量减少潜在的污染。
9.不合格物料应贮存在不合格区。
10. 永久性安装的管道应当有适宜的标识。
管道的安装处应当防止污染中间体或原料药。
中间体或原料药生产过程中使用的主要设备(如反应釜、贮存容器)和永久性安装的工艺管道,应当作适当的识别标志。
11. 生产设备应该只在其确认的操作范围内运行。
12. 所有生产、控制、销售记录都应保留至该批的有效期后至少一年。
对于有复验期的原料药,记录应当保留至该批全部发出后三年。
13.做记录时,应当在刚做操作活动后就在所提供的空白处以不易擦掉的方式填写,并标明填写者。
修改记录时应当注明日期、签名并保持原来的记录仍可识读。
14. 物料的搬运和贮存应当防止降解、污染和交叉污染。
15.生产用的原辅材料应当在适宜的条件下称重或测量,称重和测量装置应当有适合于其用途的精度。
16. 关键的称重、测量或分装操作应当一人操作一人复核。
使用前,生产人员应当确认该物料批记录中指定的。
17. 所有剩余的印有批号或与批有关内容的标签都应当销毁。
收回的标签应当以防止混淆并提供适当标识的方式加以保留和贮存。
18. 验证方案应当明确规定验证的关键工序和认可标准,所要进行的验证类型(回顾性验证、预验证、同步验证)和工序运转的次数。
工业分析检验试题库(附答案)

工业分析检验试题库(附答案)一、单选题(共42题,每题1分,共42分)1.酸度计是由一个指示电极和一个参比电极与试液组成的()。
A、电解池B、原电池C、电导池D、滴定池正确答案:B2.KMnO4滴定所需的介质是()A、硫酸B、盐酸C、硝酸D、磷酸正确答案:A3.《中华人民共和国产品质量法》在()适用A、中国大陆B、全中国范围内,包括港、澳、台C、澳门特别行政区D、香港特别行政区正确答案:A4.使用乙炔钢瓶气体时,管路接头可以用的是()。
A、银铜合金接头B、锌铜合金接头C、铜接头D、不锈钢接头正确答案:D5.若用EDTA测定Zn2+时,Cr3+干扰,为消除影响,应采用的方法A、控制酸度B、络合掩蔽C、氧化还原掩蔽D、沉淀掩蔽正确答案:C6.基元反应是指()。
A、反应物分子直接作用转化为产物分子B、按照化学反应计量方程式由反应物生成产物C、在一定温度下,反应物浓度越大,反应速率越大D、经过若干步骤由反应物生成产物正确答案:A7.原子吸收检测中消除物理干扰的主要方法是()。
A、加入保护剂。
B、使用高温火焰;C、加入释放剂;D、配制与被测试样相似组成的标准溶液;正确答案:D8.在1mol/LHAc的溶液中,欲使氢离子浓度增大,可采取下列何种方法()。
A、加水B、加NaAcC、加NaOHD、0.1mol/LHCl正确答案:D9.下列化合物最易发生亲电加成反应的是()。
A、异丁烯C、2-丁烯D、正丁烷正确答案:B10.在常压下,将蔗糖溶于纯水形成一定浓度的稀溶液,冷却时首先析出的是纯冰,相对于纯水而言将会出现沸点()。
A、升高B、无一定变化规律C、降低D、不变正确答案:A11.下列试剂中不属于易制毒化学品的是()。
A、浓硫酸B、高锰酸钾C、浓盐酸D、无水乙醇正确答案:D12.欲分析165~360nm的波谱区的原子吸收光谱,应选用的光源为()。
A、氘灯B、能斯特灯C、钨灯D、空心阴极灯正确答案:D13.下列四个数据中修改为四位有效数字后为0.7314的是()。
第22届IChO理论题答案

第22届IChO理论题答案
严宣申
【期刊名称】《化学教育》
【年(卷),期】1991(0)2
【摘要】无
【总页数】1页(P50)
【作者】严宣申
【作者单位】无
【正文语种】中文
【相关文献】
1.第23届全国高中学生化学竞赛理论题答案 [J],
2.论法律论证的论题学进路\r——以裁判文书说理为场域 [J], 金彦宇;纪旸
3.论事实与命题的同一——真理同一论的智识资源、核心论题及困境 [J], 李主斌
4.论裁判说理的论题学方法
——以指导案例99号为例 [J], 金彦宇
5.文理分科否:没有标准答案的讨论题 [J], 祝泉洲
因版权原因,仅展示原文概要,查看原文内容请购买。
生物化学练习题库(附参考答案)

生物化学练习题库(附参考答案)一、判断题(共100题,每题1分,共100分)1.故障切除时间等于继电保护装置动作时间和断路器动作时间之和。
A、正确B、错误正确答案:A2.在离子交换过程中可以发生类似于电解质水溶液中的中和、水解与复分解反应。
A、正确B、错误正确答案:A3.电解气浮法采用的是可溶性电极。
A、正确B、错误正确答案:B4.污泥消化是棚微生物賊谢泥中羅机物稳定化,减少驗体积,降低污泥中病原体数量。
当污泥中的挥发固体Vss含量降低至认到稳定化。
A、正确B、错误正确答案:B5.斜板管)沉淀池均采用_流形式,水流方向与颗粒沉降方向相反。
A、正确B、错误正确答案:B6.渗透装置的透水率或流通量是指单位时间内通过单位膜面积的通过量。
A、正确B、错误正确答案:A7.》依照法律规定征收环境保护税的,不再征收排污费。
B、错误正确答案:A8.按材料的性质和用途分类,可将髙聚物分为塑料、橡胶和纤维。
A、正确B、错误正确答案:A9.享利系数小的气体溶解度大,享利系数大的气体溶解度小。
A、正确B、错误正确答案:A10.以极性键结合的分子都是极性分子。
A、正确B、错误正确答案:B11.DCS的CRT操作台是人与被控制和管理系统进行对话的界面,由CRT和操作键盘构成。
A、正确B、错误正确答案:A12.平衡水分一定是结合水分,非结合_分一定是自由水分|A、正确B、错误正确答案:A13.活性炭吸附和臭氧消毒都属于废水的深度处理。
A、正确B、错误正确答案:A14.污泥处理一体化装置开车时要检査公用工程连接是否正常、完好,减速箱有无润滑油A、正确正确答案:A15.化工生产人员的爱尚敬业体现在忠于职守、遵章守纪,精心操作、按质按量按时完成生产任务.A、正确B、错误正确答案:A16.相对而言,污水的好氧生物处理适用于处理难以生物降解物质,而厌氧生物处理适于处理难以生物降解的物质。
A、正确B、错误正确答案:A17.普通活性污泥法的曝气池中污染物质纵向呈均匀分布。
2化学竞赛题库IChOLand10-07-答案
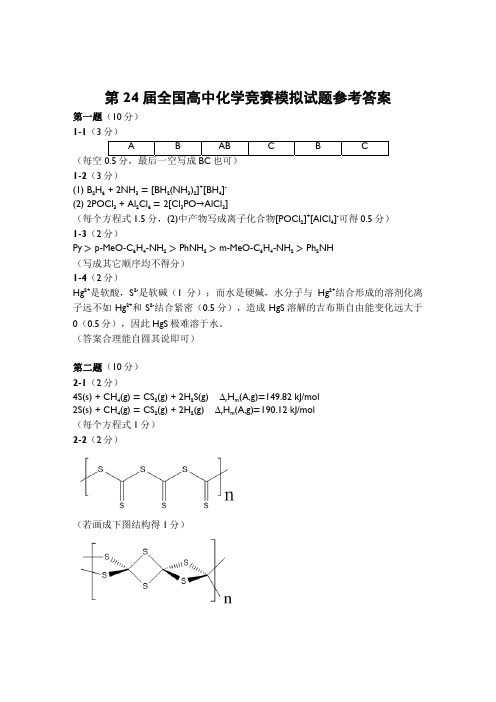
第24届全国高中化学竞赛模拟试题参考答案 第一题(10分)1-1(3分) A BAB C B C(每空0.5分,最后一空写成BC 也可)1-2(3分)(1) B 2H 6 + 2NH 3 [BH 2(NH 3)2]+[BH 4]-(2) 2POCl 3 + Al 2Cl 6 2[Cl 3PO →AlCl 3](每个方程式1.5分,(2)中产物写成离子化合物[POCl 2]+[AlCl 4]-可得0.5分) 1-3(2分)Py p-MeO-C 6H 4-NH 2 PhNH 2 m-MeO-C 6H 4-NH 2 Ph 2NH(写成其它顺序均不得分)1-4(2分)Hg 2+是软酸,S 2-是软碱(1分);而水是硬碱,水分子与Hg 2+结合形成的溶剂化离子远不如Hg 2+和S 2-结合紧密(0.5分),造成HgS 溶解的吉布斯自由能变化远大于0(0.5分),因此HgS 极难溶于水。
(答案合理能自圆其说即可)第二题(10分)2-1(2分)4S(s) + CH 4(g) CS 2(g) + 2H 2S(g) ∆r H m (A,g) 149.82 kJ/mol2S(s) + CH 4(g) CS 2(g) + 2H 2(g) ∆r H m (A,g) 190.12 kJ/mol(每个方程式1分)2-2(2分)(若画成下图结构得1分)2-3(2分)CH 3SH 和CH 2(SH)22-4(2分)CS 2 + 4NH 3 NH 4SCN + (NH 4)2S或CS 2 + 3NH 3 NH 4SCN + NH 4HS2-5(2分)M S C S M M C S S M M S C S M C S M S M(写出一个正确结构得1分,写出两个或以上得2分,若出现错误结构扣0.5分)第三题(14分)3-1(1分)4Ag + 2O 3 2Ag 2O 33-2(4分)以空隙为顶点的晶胞: 以Ag 为顶点的晶胞:(两种晶胞各2分)3-3(1分)变形八面体空隙(写成正八面体空隙不得分)3-4(4分)每份滴定中消耗的重铬酸钾质量:1.11494×25.00/250.0 0.11494 (g)每份滴定中消耗的重铬酸钾物质的量:0.11494/294.23.907×10-4 (mol)(0.5分)Cr 2O 72-~3I 2~6S 2O 32-(1分,写方程式亦可)故每份滴定消耗S 2O 32-:6×3.907×10-4 2.344×10-3 (mol)(0.5分)三次测定浓度分别为0.09456 mol/L ,0.09437 mol/L 和0.09464 mol/L (0.5分) 平均浓度为0.09452 mol/L (0.5分)相对平均偏差0.11%(1分,有效数字也可取一位,若多于两位则扣0.5分) 3-5(4分)Ag 2O 3 + 6KI + 6HCl 2AgI +2I 2 + 6KCl + 3H 2O (1.5分,离子方程式也可) 2Na 2S 2O 3 + I 2 Na 2S 4O 6 + 2NaI (0.5分,离子方程式也可)由方程式知Ag 2O 3~4Na 2S 2O 3故消耗的Ag 2O 3物质的量:27.70×10-3×0.09452/4 6.546×10-4 (mol)(1分) Ag 2O 3质量分数:6.546×10-4×263.8/0.1735 99.53%(1分)(若多步计算综合在一个算式中进行,算式正确而结果错误,扣1分)第四题(6分)4-1(1分)sp 2杂化4-2(5分)固态B 2Cl 4分子结构: 气态B 2Cl 4分子结构:(1.5分) (1.5分)原因:固态B 2Cl 4中,由于需要紧密堆积以增加晶格能,所以分子占的空间应该尽量小(1分);而气态B 2Cl 4中,需要让非键原子间的斥力尽量小(1分)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1992年第24届IChO试题---理论题和实验题注意事项(1)当监考人员将“开始(start)”写在黑板上后才开始答题。
(2)请用黑色笔(黑墨水笔或黑圆珠笔)答题。
(3)请在每页答卷的右上角写上你的参赛编号。
(4)请将计算过程和答案写在每题后面的空白处,勿写在纸的反面。
若需另页,可向监考人员索取。
原子量H C N O Na Si P1.008 12.01 14.01 16.00 22.99 28.09 30.97S Cl K Ca Cr Fe Ag32.06 35.45 39.10 40.08 52.00 55.85 107.9物理常数R=8.314J·mol-1·K-1=8.314m3Pa mol-1K-1F=96486C·mol-11.硅藻(一种微生物)是海洋中丰富的食物来源,它们通过CO2和水的光合作用产生碳水化合物(即醣):6CO2+6H2O+太阳能→C6H12O6+6O2a)蓝鲸靠捕食一种称之为“Krill”的小鱼生长,在其头5年的生长期内体重每天增加75kg。
鲸每天吃掉的小鱼量是它自身体重增加量的10.0倍。
而小鱼(Krill)需吃掉10.0kg硅藻才增加1.0kg体重。
假定鲸在头5年内体重的增加完全是由于消耗硅藻碳水化合物,则为提供给该鲸在头5年内生长中所需要的硅藻碳水化合物,硅藻要消耗多少升CO2(0℃、1.0atm)?b)i)在24℃和1.0atm下,每升海水溶解0.23mlCO2,若硅藻能从水中把CO2全部除去,则必须处理多大体积的水才能产生蓝鲸在5年内所需要的碳水化合物?ii)假如海水的总体积是1.37×1018m3。
1000头蓝鲸在5年生长中所消耗的CO2(这些CO2是硅藻用来产生碳水化合物的)应该由这一总体积的百分之多少的水来溶解?c)成年鲸质量的3%是氮。
质量为9.1×104kg的鲸死亡后所产生的NH4+的最大质量是多少(这些NH4+可为水生物利用)?d)鲸的质量的18%是碳。
碳被转化成CO2进入大气,然后又可通过含有硅酸钙的岩石的风化从大气中除去:CaSiO3(s)+2CO2(g)+3H2O(l)→Ca2+(aq)+2HCO3-(aq)+H4SiO4(aq)估计每年大约有1000头蓝鲸死亡,从这些死鲸的分解中所产生的CO2风化CaSiO3,问最多能风化多少克CaSiO3?2.许多小溪流经煤矿和金属矿。
由于含硫矿床暴露在空气中或暴露到含氧的水中,这些小溪变成酸性,溪水中含有溶解的铁和硫酸盐,它们的浓度都很高。
最常见的含硫矿是黄铁矿(FeS2),其中铁的氧化态是+2。
当富含铁的溪水和其他水混合时,溶于水的铁以针铁矿[FeO(OH)]的形式沉淀出来,复盖小溪的底部,而水仍保持酸性。
b)写出表明黄铁矿在小溪中被氧化而形成Fe(Ⅱ)和硫酸根离子的配平的方程式。
c)写出表明Fe(Ⅱ)离子被氧化而生成FeO(OH)沉淀的配平的化学反应方程式。
d)如果黄铁矿全部转化成FeO(OH)和氢离子,计算:需多少摩尔的FeS2使1.0升纯水的pH降到3.0?(不考虑HSO4-的形成)e)小溪中Fe(Ⅱ)离子的浓度是0.00835mol/L。
溪水从一个很小的孔流入一个很大的池塘,流速为20.0升/分钟。
溪水中有75%的 Fe(Ⅱ)被氧化为 Fe(Ⅲ)。
池塘中水的pH很高(pH>7)。
因而Fe(Ⅲ)马上沉淀为Fe(OH)3,经老化,变为Fe2O3。
计算两年内有多少克Fe2O3将在池塘底部沉淀出来。
3.从松树中分离得到的松柏醇,其分子式为C10H12O3。
a)松柏醇既不溶于水,也不溶于NaHCO3水溶液。
但当Br2的CCl4溶液加入松柏醇后,溴溶液的颜色消失而形成A(C10H12O3Br2);当松柏醇进行臭氧化及还原反应后,生成香荚醛(4-羟基-3-甲氧基苯甲醛)和B(C2H4O2)。
在碱存在下,松柏醇与苯甲酰氯(C6H5COCl)反应,形成化合物C(C24H20O5),此产物使KMnO4(aq)褪色,它不溶于稀NaOH溶液。
松柏醇与冷的HBr反应,生成化合物D(C10H11O2Br)。
热的HI可使ArOR转变为ArOH和RI,而松柏醇与过量的热HI反应,得到CH3I和化合物E(C9H9O2I)。
在碱水溶液中,松柏醇与CH3I反应,形成化合物F(C11H14O3),该产物不溶于强碱,但可使Br2/CCl4溶液褪色。
请写出化合物B、C、D、E、F及松柏醇的结构。
b)化合物A可有几种立体异构体,请画出化合物A的结构,用“*”号标出A中的手征中心。
对其全部立体异构体,画出它们的费歇尔(Fischer)投影(以下图为例),并用R或S来表示它们结构中手征中心的绝对构型。
4.某萜烯醇A(C10H18O)经选择性氧化得到的产物或是一个十碳原子的醛,或是一个十碳原子的羧酸;A与二摩尔的溴反应,生成一个四溴化合物,分子式为C10H18OBr4(B);A经臭氧解、氧化反应后,生成下述三个化合物:化合物A也能与氢溴酸(HBr)反应,生成几种化合物,包括分子式为C10H17Br的两个开链的溴化物。
a )画出化合物A 的结构;b )画出化合物B 的结构;c )画出分子式为C 10H 17Br 的两个开链溴化物的结构;d )用反应结构式表示出C 中两个溴化物形成的历程。
5.二氧化氮是大气中许多含氮氧化物之一,它可二聚成N 2O 4(g )。
a )NO 2(g )是顺磁性的,用共振方式,写出NO 2(g )的点电子结构式(用圆点表示电子)。
b )N 2O 4是反磁性的,写出其点电子结构式;c )在298K ,N 2O 4(g )的生成自由能是98.28kJ ·mol -1,NO 2(g )的生成自由能是51.84kJ ·mol -1。
在1.0atm 和298K 从1molN 2O 4(g )开始反应,若总压力恒定在1.0atm ,温度恒定在298K ,则有百分之多少的N 2O 4(g )分解?d )若反应N 2O 4(g )2NO2(g )的△H 是+58.03kJ ·mol -1,在什么温度下,N 2O 4(g )分解的百分数是c 中计算结果的两倍?(假定熵和焓不随温度变化)e )N 2O 4(g )解离成NO 2(g )的反应是一级反应,在298K ,比速率常数是5.3×104s -1。
N 2O 4(g )分解20%需多长时间?f )NO 2(g )二聚成N 2O 4(g )是二级反应,在298K ,比速率常数是9.8×106L ·mol -1·s -1,它的逆反应是一级反应,比速率常数是5.3×104S -1,请根据这些数据计算反应2NO 2(g )N 2O 4(g )在298K 时的浓度平衡常数Kc 。
6.本世纪大气中CO2的含量大大增加,预期今后将继续增加,有人预测,到2020年大气中CO2的分压可达到大约4.40×10-4atm。
有关热力学数据如下:25℃、总压1.00atm下,CO2(在水中)的享利常数是0.0343mol·L-1·atm-1;△f G(kJ·mol-1) △fH(kJ·mol-1)CO2(aq)-386.2 -412.9H2O(1) -237.2 -285.8HCO3-(aq)-587.1 -691.2 H+(aq) -0.0 0.0解答下列问题时,温度用25℃,总压力为1.0atm。
a)计算下列反应的平衡常数KCO2(aq)+H2O(1)H+(aq)+HCO3-(aq)b)计算2020年溶解在与大气平衡的蒸馏水中的CO2的浓度(以mol·L-1为单位);c)计算上述溶液(即b中溶液)的pH值;d)计算CO2(aq)和H2O反应的焓变;e)若CO2和H2O的反应已达平衡,溶液的温度升高,而溶解的CO2的浓度不变,则溶液的pH值改变。
判断pH升高还是降低。
圈出正确的答案。
升高降低7.当流向Chesapeake海湾的淡水河在春季大雨后洪水泛滥时,海湾中淡水的增加引起海蚝坜生长地带盐分的减少。
海坜正常生长所需最低的氯离子浓度是8ppm(亦可近似表示为8mg·L-1)a)一周大雨之后,对海湾的水进行分析。
向50.00ml海湾水样中加几滴K2CrO4指示剂,用16.16ml浓度为0.00164mol·L-1的AgNO3溶液滴定,终点时形成明显的砖红色沉淀。
Ksp (AgCl)=1.78×10-10 Ksp(Ag2CrO4)=1.00×10-12i)样品中氯离子的摩尔浓度是多少?ii)水中是否含有足够的氯离子以供海坜正常生长?圈出是或不是。
是不是。
写出计算过程。
iii)写出滴定剂和样品反应的配平的化学方程式;iv)写出滴定终点颜色变化的配平的离子反应式。
圈出反应式中砖红色化合物的分子式;v)在滴定终点,铬酸根离子的浓度是0.020mol·L-1。
计算当砖红色沉淀出现时溶液中Cl-的浓度。
vi)为使滴定更有效,被滴定溶液必须呈中性或弱碱性。
写出用来描述在酸性介质中所发生的竞争反应的配平的方程式(这个反应影响滴定终点的观察)。
b)如果开始滴定时样品溶液是酸性的,通常向被滴溶液加入缓冲溶液以控制pH。
假定海湾水的pH为5.10,则由于酸性太强而不能进行准确分析。
i)从列出的体系中选择一个缓冲剂,此缓冲剂能使你建立并维持pH=7.20的水溶液介质。
圈出你所选择的缓冲溶液的号码(假定缓冲剂不与样品和滴定剂发生反应)缓冲体系弱酸的Kα(25℃)(1)0.1mol·L-1乳酸/0.1mol·L-1乳酸钠 1.4×10-4(2)0.1mol·L-1醋酸/0.1mol·L-1醋酸钠 1.8×10-5(3)0.1mol·L-1NaH2PO4/0.1mol·L-1Na2HPO46.2×10-8(4)0.1mol·L-1NH4NO3/0.1mol·L-1氨水 5.6×10-10写出使你做出这种选择的计算过程。
ii)用从(i)中选出的缓冲体系,计算溶解在蒸馏水中以配制500mlpH =7.20的缓冲溶液所需的弱酸及其共轭碱的质量。
c)在另一个50.00ml海湾水样中的氯离子的浓度由佛尔哈德(Volhard)法测定。
将过量的AgNO3加到样品中,过量的Ag+用标准KSCN溶液滴定,生成AgSCN沉淀。
若加入50.00ml浓度为0.00129mol·L-1AgNO3溶液到水样后引起的过量Ag+需要27.46ml 1.41×10-3mol· L-1的KSCN溶液来滴定,计算海湾水中氯离子的浓度。
