第四章第二节 糖类2
选修五,第四章第二节第一课时 单糖 二糖

[答案] D
针对训练1
下列叙述正确的是(
)
A.糖类也叫碳水化合物 B.符合Cn(H2O)m通式的物质均可称为碳水化合物 C.由于糖的分子式可以用通式Cn(H2O)m来表示,所 以在它们的分子中H和O的原子数比一定等于2:1 D.橡胶、电木、葡萄糖都是高分子化合物
答案:A
葡萄糖的结构与性质
[典例2] 分别取1 mol葡萄糖进行下列实验: (1)银镜反应时,需银氨络离子________mol,反应后 葡萄糖变为________,其结构简式是________________。 (2)与乙酸反应生成酯,从理论上讲完全酯化需要 ________g乙酸。 (3)若使之完全转化为CO2和H2O,所需氧气的体积在 标准状况下为________L,反应的方程式是___________。
(1)其原因是(
)
A.蔗糖尚未水解 B.加热时间不够 C.煮沸后的溶液中没有加碱中和作催化剂的酸 D.蔗糖水解的产物中没有葡萄糖 (2)正确的操作是________。
答案:(1)C (2)待煮沸后的溶液冷却后加入适量的 NaOH 溶液至溶 液呈现碱性,再加入新配制的银氨溶液,水浴加热
互为同分异构体
规律技巧
一、葡萄糖和果糖的比较
二、葡萄糖 1.组成和结构
2.物理性质 葡萄糖为无色晶体,熔点为146℃,有甜味,但甜度 不如蔗糖,易溶于水,稍溶于乙醇,不溶于乙醚。 3.化学性质 (1)葡萄糖分子中的官能团及反应类型
(2)氧化反应 ①与银氨溶液反应: △ CH2OH(CHOH)4CHO+2Ag(NH3)2OH――→ CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O。 ②与新制的Cu(OH)2反应: △ CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH――→ CH2OH(CHOH)4COONa+Cu2O↓+3H2O。
化学选修5 4-2 糖类

△ 2Ag(NH3)2OH ――→ CH2OH(CHOH)4COONH4 + 2Ag↓ + 3NH3↑+H2O
②与新制 Cu(OH)2 悬浊液的反应: CH2OH(CHOH)4CHO + 2Cu(OH)2 CH2OH(CHOH)4COONa+Cu2O↓+3H2O ③生理氧化反应: C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(l) ΔH=-2804kJ/mol ④使溴水和酸性高锰酸钾溶液褪色 △ + NaOH ――→
二糖和多糖结构性质比较
• ●教材点拨 • 1.蔗糖和麦芽糖比较
蔗糖 麦芽糖 组成相同,化学式均为C12H22O11,互为同分异构体 都属于二糖,每摩尔水解后都生成两摩尔单糖 相 似 水解产物都能发生银镜反应,都能和新制Cu(OH) 悬 2 点 浊液反应 都具有甜味(蔗糖更甜)
蔗糖 官能团
麦芽糖
不含醛基(非还原性糖) 含醛基(还原性糖)
●典例透析 (2014· 江苏省南京市四校联考 )在某些酶的催化 下,人体内的葡萄糖的代谢有如下过程:
• 请填空: • (1)过程①是________反应,过程②是________反应, 过程③是________反应(填写反应类型的名称)。 • (2)过程④的另一种生成物是________(填写化学式)。 • (3)上述物质中________和________互为同分异构体 (填写字母代号)。
• ●变式训练 • 2.通过实验来验证淀粉水解可生成还原性糖,其 实验包括下列一些操作过程,这些操作过程的正确 排列顺序是( ) • ①取少量淀粉加水配成溶液 ②加热煮沸 • ③加入碱液至呈碱性 ④加入新制的Cu(OH)2悬浊液 • ⑤加入几滴稀H2SO4 ⑥再加热 • A.①②⑤⑥④③ B.①⑤②④⑥③ • C.①⑤②③④⑥ D.①⑥④⑤③②
高中化学第四章生命中的基础有机化学物质4.糖类第课时导学案无答案新人教版选修

第四章生命中的基础有机化学物质第二节糖类(第2课时)学习目标:蔗糖、淀粉、纤维素的组成和重要性质,以及它们之间的相互转变和跟烃的衍生物的关系。
教学重点:掌握糖类重要的代表物蔗糖、淀粉、纤维素的组成和重要性质,它们之间的相互转变以及与烃的衍生物的关系课前自主学习三、蔗糖与麦芽糖阅读P82问题二、蔗糖与麦芽糖部分,完成下表课堂学习交流【实验探究1】探究蔗糖和麦芽糖中有无醛基。
请设计实验来验证你的假设。
实验步骤:实验现象:实验结论:【实验探究2】探究蔗糖水解产物有无还原性,请根据所学知识设计实验进行探究?实验步骤:实验现象:实验结论:四、淀粉和纤维素I、淀粉(1)淀粉在人体内的水解过程淀粉(C6H10O5)n→糊精(C6H10O5)m_______C12H22O11_______C6H12O6(2)酸作用下水解反应:【思考】A.如何证明淀粉在酸性条件下没有水解?B、如何证明淀粉正在水解?C、如何证明淀粉已完全水解?II、纤维素物理性质:白色、气味、味道纤维状、溶于水.(1)纤维素的一个最大用途就是造纸(2)在人体消化道内________(能不能)消化,但同时又是必不可少的,因为它可以帮助肠子__________。
在反刍动物的消化道内,有分解纤维的__________,因此对植食性动物,它具有营养价值。
纤维素在催化剂的条件下,最终水解生成。
【巩固练习】1、如图所示:淀粉水解可产生某有机化合物A,A在不2、同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。
A、B、C都3、可以被强还原剂还原成为D(C6H14O6)。
B脱水可得4、到五元环的酯类化合物E或六元环的酯类化合物F。
5、已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,最难。
请在下列空格中填写A、B、C、D、E、F的结构简式。
A: B: C:D: E: F:2、化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等酵制得,A 的钙盐是人们喜爱的补钙剂之一。
第四章第二节糖类

科学视第野28 页
糖类
玉米及玉米核的综合利用 玉米粒的化学组成主要是淀粉、蛋白 质、油脂和纤维素。经过加工可以得 到淀粉、玉米油、玉米蛋白、玉米纤 维等产品。 玉米核主要成分为多缩戊糖,与稀硫 酸在加热加压下反应可得到糠醛,为 重要的化工原料,具有广泛的用途。
科学视第野29 页
糖类
当堂巩第固30 页
化学 性质
水解生成_葡__萄__糖__和__果__糖___
水解生成_葡__萄__糖__
非还原性糖、与银氨溶液或新制Cu(OH)2悬浊液 还原性糖,与银氨溶液或新制Cu(OH)2悬浊
不反应
液反应
鉴别方法
向其溶液中分别加入银氨溶液,水浴加热,能发生银镜反应的是麦芽糖,不能发生银镜反应的 是蔗糖(也可用新制的氢氧化铜悬浊液鉴别)
阿斯巴甜,化学合成 甜味剂,甜度一般约 为蔗糖的200倍。
生活经验第 4 页
糖精,化学合成甜味 剂,甜度为蔗糖的 300倍到500倍,无营 养。
木糖醇,天然植物 甜味剂 ,其甜度可 达到蔗糖的1.2倍。
糖类
1. 糖类的结构与分类 (1)糖类的组成
糖类被称为碳水化合物 糖类的分子组成大多数都符合:Cm(H2O)n 并不是所有糖类都符合此通式 符合Cm(H2O)n的不一定是糖类,如CH3COOH
植物光合作用的产物
构成细胞壁的基础物质
纺织、造纸、制纤维素硝酸酯、 用途 制葡萄糖和酒精,人体的能源之一
纤维素乙酸酯等
糖类
(2)淀粉水解及其程度的检验
多糖代表第物19 页
糖类
糖类还原性的检验以及淀粉水解程度的检验
总第结20 页
1.糖类还原性的检验
糖类的还原性是指糖类能发生银镜反应或与新制的Cu(OH)2悬浊液反应,若糖 不能发生银镜反应或不与新制的Cu(OH)2悬浊液反应,则该糖不具有还原性, 为非还原性糖。
高二化学选修5第四章第二节第四章第二节__糖类(1)

3、还原反应 CH2OH -(CHOH)4-CHO + H2
催化剂 加热
CH2OH –(CHOH)4 - CH2OH
己六醇
4.酯化反应(有多元醇的性质): CHO
(能与酸发生酯化反应)
浓H2SO4
(CHOH )4 + 5 CH3COOH
CH2OH
CHO
(CHOOCCH 3) 4 + 5 H2O CH2OOCCH3 五乙酸葡萄糖酯
(第1课时)
师宗县第一中学 赵福忠
【学习目标】1.知道糖类的概念及分类。
2.记住葡萄糖的结构,并能从官能团的角度把握 其化学性质。学会葡萄糖的检验方法。 【学习重点】
葡萄糖的概念、结构和主要化学性质。 【学习难点】 葡萄糖的结构和主要化学性质。
1.糖类的概念 多羟基醛 多羟基酮 结 具有______________ 结构、____________ 多羟基醛 、__________ 多羟基酮 的 构或能够水解生成___________ 物质称为糖类。 说明:(1)糖类不都是甜的。我们食用的 蔗糖是甜的,它只是糖类中的一种。淀粉、纤维 素均不甜,它们属于糖类。有些有甜味的物质, 如糖精,不属于糖类。 (2)糖类是由C、H、O三种元素组成的有 Cn(H2O)m 。所以糖类又 机化合物,通式为______________ 称碳水化合物。实际上这种叫法不科学,在学习 中对通式的理解应注意:
5、氧化反应(与氧气) 葡萄糖是人体内的重要能源物质: 糖是生命活动中的重要能源,机体所需 能量的70%是食物中的糖所提供的。人体每 日所摄入的淀粉类食物(占食物的大部分),最 终分解为葡萄糖,然后被吸收进入血液循环。 在胰岛素、胰高血糖素等激素的协调作用下, 血糖维持在 70~110mg/dl(3.9~6.1mmol/L)的 范围内,随血液循环至全身各组织,为细胞 的代谢提供能量,发生氧化分解,最终生成 二氧化碳和水:
人教版高中化学选修5 第四章第二节 糖类--葡萄糖果糖麦芽糖蔗糖的结构和转化
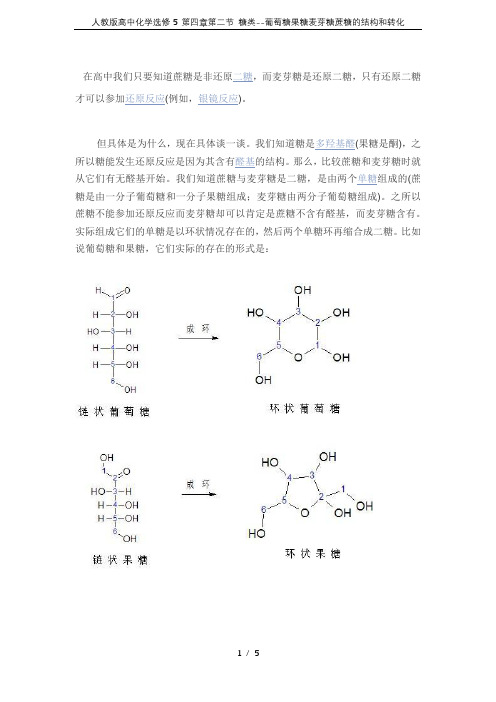
才可以参加还原反应(例如,银镜反应)。
但具体是为什么,现在具体谈一谈。
我们知道糖是多羟基醛(果糖是酮),之所以糖能发生还原反应是因为其含有醛基的结构。
那么,比较蔗糖和麦芽糖时就从它们有无醛基开始。
我们知道蔗糖与麦芽糖是二糖,是由两个单糖组成的(蔗糖是由一分子葡萄糖和一分子果糖组成;麦芽糖由两分子葡萄糖组成)。
之所以蔗糖不能参加还原反应而麦芽糖却可以肯定是蔗糖不含有醛基,而麦芽糖含有。
实际组成它们的单糖是以环状情况存在的,然后两个单糖环再缩合成二糖。
比如说葡萄糖和果糖,它们实际的存在的形式是:在环状的单糖的结构中,只要和环上的氧原子相邻最近碳上连有羟基,那么该糖就含有还原性,就像所举的例子中环状葡萄糖1号碳上有羟基,果糖2号碳上有羟基,所以它们都是还原糖,都可以发生还原反应。
现在,开始解释蔗糖和麦芽糖的还原性问题。
实际蔗糖和麦芽糖的结构如下:我们发现,麦芽糖的两个含氧环中有一个环的离环上氧最近的碳(即1号碳)上有羟基,所以它有还原性可以参加还原反应;而蔗糖的两个环中找不到这样的羟基,所以它没有还原性,不能参加还原反应。
补充:环状的糖中如果有上述像麦芽糖中1号碳这样的羟基,或者葡萄糖1号碳和果糖2号碳上的羟基的话,就会解离出醛基,那么就会有还原性了。
如果你是高中生,那么能理解到这里就可以了。
下面我解释的是高中以外的内容,可以试着理解一下。
链状的糖是怎么形成环状的?其实是它反生了半缩醛(酮)反应,反应式如下:上述反应中,如果R1和R2中至少有一个为H时,产物就为半缩醛,如果都为烃基那么就称为半缩酮~其实链状单糖就是反生了这个反应才成环的。
比如说链状葡萄糖中(如上述图),1号的醛基碳就与5号碳的羟基缩合成了半缩醛而成环的。
通过观察半缩醛(酮)反应,发现该反应是可逆反应,也就是说在反应过程中环状的糖是可以再变回链状的糖,从而会产生游离的醛基(或酮基)产生还原性从而可以参加还原反应。
观察半缩醛或半缩酮发现,它们的结构特点是两个氧原子夹着一个碳原子(两个氧原子必须直接连在所夹的碳原子上),其中一个氧原子必须得连着H原子,另一个必须连着非H原子(一般为烃基)。
高中化学第四章第2节 糖类知识点

第二节糖类一、糖的组成和分类1.定义:从分子结构上看,糖类可定义为多羟基醛、多羟基酮和它们的脱水缩合物。
根据能否水解以及水解后的产物,糖类可分为单糖、低聚糖和多糖。
2、糖的组成:糖类是由C、H、O三种元素组成的一类有机化合物。
糖类的组成通常用通式Cm(H2O)n表示,因而又称为碳水化合物。
3、糖的分类根据糖能否水解及水解产物的多少,可分为:单糖:不能再水解成更简单的糖,如葡萄糖、果糖二糖:每摩尔二糖可水解成两摩尔单糖,如蔗糖、麦芽糖多糖:每摩尔多糖可水解成多摩尔单糖,如淀粉、纤维素二、葡萄糖与果糖1、结构(1)葡萄糖葡萄糖是自然界中分布最广的单糖,因最初是从葡萄汁中分离得到而得名。
葡萄糖的分子式为C6H12O6,是白色晶体,熔点为146℃,有甜味,但甜度不如蔗糖,易溶于水,稍溶于乙醇,不溶于乙醚。
分子式:C6H12O6结构简式:CH2OH(CHOH)4CHO实验式:CH2O官能团:醛基(—CHO)、羟基(—OH)葡萄糖是一种多羟基醛,属醛糖。
(2)果糖果糖是最甜的糖,广泛分布于植物中,在水果和蜂蜜中含量较高。
纯净的果糖为无色晶体,熔点为103~105℃,它不易结晶,通常为黏稠性液体,易溶于水、乙醇和乙醚。
分子式:C6H12O6结构简式:CH2OH(CHOH)3COCH2OH官能团:酮基(CO)、羟基(—OH)果糖是一种多羟基酮,属酮糖。
总结:葡萄糖与果糖互为同分异构体。
2、化学性质(1)葡萄糖与氢气反应CH2OH(CHOH)4CHO+H2 → CH2OH(CHOH)4CH2OH(己六醇)。
(2)葡萄糖与银氨溶液反应CH2OH(CHOH)4CHO+2Ag(NH3)2OH →CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3。
(3)葡萄糖与氢氧化铜悬浊液反应CH2OH(CHOH)4CHO+2Cu(OH)2 → CH2OH(CHOH)4COOH+Cu2O↓+2H2O3、用途(1)葡萄糖是一种重要的营养物质,它在人体组织中,在酶的催化下可直接被人体吸收。
高中生物 第四章 糖类

苦杏仁即可引起儿童中毒。
问题:
α-D(+)-葡萄糖的苷羟基和另一α-D(+) -葡萄糖分子中的第四位羟基成苷产物是什 么,能写出结构式吗?
我们已经知道蔗糖是由一分子的葡萄糖和 一分子的果糖组成的,那么是通过成苷反 应形成的吗,能写出结构式吗?
根据碳原子数分类
丙糖(三碳糖) 丁糖(四碳糖) 戊糖(五碳糖)
己糖(六碳糖)
在自然界分布最广
醛糖
根据羰基分类
酮糖
2、低聚糖
(1)定义: 也叫寡糖,系由2~10个单糖分子脱水缩合
而成的糖。
完全水解后得到相应分子数的单糖。 (2)分类:
根据聚合度分类--二糖、三糖、四糖等 等。
二糖的分布最广,也最为重要。又称双糖。
63.6%
OH
H
H
OH
-D-吡喃葡萄糖
6
CH2OH HO H
5
O 4 OH
H3
OH
1 2
OH
-D-呋喃葡萄糖
1CHO
2 3
4 5
6 CH2OH
<0.01%
36.4%
CH2OH
H
H OH
OH H
OH
OH
H
OH
-D-吡喃葡萄糖
6
CH2OH
HO H 5
O
4 OH
1
H3
2 OH OH
-D-呋喃葡萄糖
H
OH
H
OH HO
H OH
半缩醛羟
H
OH
基为α位
O
H
C
H
糖类-PPT

CH2OH(CHOH)4COONH4 + 3NH3 + 2Ag↓+ H2O
③与新制Cu(OH)2悬浊液反应:
CH2OH (CHOH)4 CHO + Cu(OH)2 → CH2OH (CHOH)4COOH + Cu2O + H2O
CH2OH 2-脱氧核糖
糖类水解的产物
C12H22O11+H2O 麦芽糖
C12H22O11+H2O 蔗糖
H+ △
2C6H12O6
葡萄糖
H+
△
C6H12O6+C6H12O6
葡萄糖 果糖
(C6H10O5)n+nH2O 淀粉或纤维素
H+
△
nC6H12O6
葡萄糖
淀粉和纤维素
淀粉
(C6H10O5)n
纤维素
(C6H10O5)m
1、n不等于m,所以分子式不同 2、淀粉的糖单元和纤维素的糖单元
结构不同
结论:淀粉和纤维素不是同分异构体
三、葡萄糖与果糖
1、物理性质:
阅读教材P80
分子式
存 在 物 颜色状态 理溶 性解 质性 甜度
葡萄糖
果糖
C6H12O6(同分异构体)
自然界分布最广,
水果、蜂蜜
存在于葡萄及甜味水果中 广泛分布于植物中
CH2OH(CHOH)4COONH4 + 3NH3 + 2Ag↓+ H2O
葡萄糖的银镜反应:
葡萄糖溶液
注意事项:
(1)试管内壁必须洁净; (2)配制银氨溶液时滴加顺序不能颠倒,氨水不能过量.
(3)水浴加热,不能用酒精灯直接加热; (4)加热时不可振荡和摇动试管; (5)实验后,银镜用HNO3浸泡,再用水洗。
最新人教版高中化学选修五第四章生命中的基础 有机化学物质 第二节 糖类

第二节糖类学习目标核心素养1.了解糖类的概念、分类及结构特点。
2.掌握糖类重要代表物葡萄糖、蔗糖、淀粉和纤维素的组成和重要性质。
3.知道糖类在食品加工和生物质能源开发上的应用。
1.通过宏观实验认识糖类的性质,结合糖类的分子结构,从微观化学键的变化理解糖类性质的本质。
(宏观辨识与微观探析)2.从蔗糖、淀粉的性质出发,依据探究目的,改进实验装置,优化探究方案,运用化学实验对水解反应产物减产和水解程度进行探究。
(科学探究与创新意识)3.通过葡萄糖的氧化反应、淀粉的水解反应,认识糖类在生产生活中的重要应用,感受化学对社会发展的重大贡献。
(科学态度与社会责任)一、糖类的组成和分类1.概念:糖类是多羟基醛或多羟基酮和它们的脱水缩合物。
2.组成:由C、H、O三种元素组成。
3.通式:大多数糖可用通式C n(H2O)m表示。
4.分类类别单糖二糖多糖概念不能水解的糖1 mol糖水解后能产生2 mol单糖的糖1 mol糖水解后能产生n(n>10)摩尔单糖的糖代表物及分子葡萄糖、果糖蔗糖、麦芽糖淀粉、纤维素C6H12O6C12H22O11(C6H10O5)n式【教材二次开发】从教材资料卡片“糖的相对甜度”的表格数据思考,是不是所有的糖都有甜味,有甜味的物质是糖?提示:不是。
糖类不一定有甜味,如纤维素属于糖类但没有甜味。
有甜味的物质不一定是糖,如甜蜜素、糖精有甜味。
二、葡萄糖和果糖类别葡萄糖果糖分子式C6H12O6C6H12O6物理性质白色晶体,有甜味,易溶于水无色晶体,有甜味,易溶于水、乙醇和乙醚结构简式CH2OH(CHOH)4CHO化学性质①能和酸发生酯化反应②能和银氨溶液发生银镜反应③能与新制的氢氧化铜悬浊液反应产生红色沉淀④与H2加成生成醇①能和酸发生酯化反应②与H2加成生成醇相互关系互为同分异构体用途用于制镜、糖果、医药等行业主要用于食品工业【情境思考】糖是人体三大主要营养素之一,是人体热能的主要来源。
糖类物质及其产物广泛存在,在生产、生活中用途广泛,例如葡萄糖在糖果制造业、制镜业和医药领域有着广泛应用。
高中化学 第四章第二节 糖类教案 新人教版选修5

第二节 糖类[明确学习目标] 1.了解糖类的概念、分类及结构特点。
2.掌握糖类重要代表物葡萄糖、蔗糖、淀粉和纤维素的组成和重要性质。
一、葡萄糖与果糖 1.糖类的组成和分类 (1)概念糖类是□01多羟基醛、多羟基酮和它们的脱水缩合物。
(2)组成糖类是由□02C 、H 、O 三种元素组成的一类化合物。
大多数糖类化合物都可用通式C m (H 2O)n表示,故最早将其称为“碳水化合物”,实际上并不是所有的糖分子中的氢和氧原子的个数比都是2∶1。
(3)分类2.葡萄糖和果糖 (1)物理性质(2)分子组成和结构特点二、蔗糖与麦芽糖从结构和组成上看,蔗糖和麦芽糖互为□04同分异构体。
三、淀粉和纤维素1.淀粉2.纤维素1.(1)糖类的通式都是C m(H2O)n吗?(2)符合通式C m(H2O)n的有机物都属于糖类吗?提示:(1)不一定。
糖类是由C、H、O三种元素组成的,大多数都可用通式C m(H2O)n表示,m与n可以相同,也可以是不同的正整数。
但并非所有的糖都符合通式C m(H2O)n,如鼠李糖(C6H12O5)。
(2)不一定。
例如甲醛(CH2O)、乙酸(C2H4O2)的分子式可分别改写为C(H2O)、C2(H2O)2,但它们不是糖,而分别属于醛和羧酸。
2.糖类的还原性是指糖类含有醛基,能发生银镜反应或与新制的Cu(OH)2反应。
若糖不能发生银镜反应或不与新制的Cu(OH)2反应,则该糖不具有还原性,为非还原性糖。
蔗糖和麦芽糖分别属于哪一类?提示:蔗糖分子中不含有醛基,属于非还原性糖;麦芽糖分子中含有醛基,属于还原性糖。
3.淀粉和纤维素的分子通式都为(C6H10O5)n,二者是否互为同分异构体?提示:淀粉和纤维素分子通式中n值不同,不属于同分异构体。
一、葡萄糖的化学性质和工业制法(1)加成反应CH 2OH(CHOH)4CHO +H 2――→Ni△CH 2OH(CHOH)4CH 2OH(2)氧化反应①银镜反应:CH 2OH(CHOH)4CHO +2Ag(NH 3)2OH ――→△CH 2OH(CHOH)4COONH 4+2Ag↓+3NH 3+H 2O ②与新制Cu(OH)2悬浊液的反应:CH 2OH(CHOH)4CHO +2Cu(OH)2+NaOH ――→△CH 2OH(CHOH)4COONa +Cu 2O↓+3H 2O ③生理氧化反应:C 6H 12O 6(s)+6O 2(g)―→6CO 2(g)+6H 2O(l) ΔH =-2804 kJ·mol -1④使溴水和酸性高锰酸钾溶液褪色。
高二化学选修5第四章第二节糖类
发生酯化(提示:同一个C原子上连接2
个羟基不稳定)
⑶ 现代物理方法测定得知:葡萄糖分子
中的碳原子最多与两个碳原子相连 。 Company Logo
CH2 OH(CHOH)4 CHO
Company Logo
葡萄糖的结构 属 于 多 羟 基 醛
分子式: C6H12O
6
Company Logo
结构简式: CH2OH —(CHOH )4—CHO
水解反应(水解一分子) 生成葡萄糖和果糖各 生成两分子葡 一分子 萄糖 本身不发生银镜反应 本身可发生银 ,水解后可进行 镜反应 食物 食物
Company Logo
淀粉
分子式
纤维素
(C6H10O5)n (n值淀粉小于纤维素 ) 物理性 无甜味,白色粉末状物质 白色、无味丝 质 。不溶于冷水,热水中膨 状固体物质。 胀破裂,部分溶解,部分 不溶于水及一 悬浮,形成胶体 般有机溶剂 存 在 大米、小麦、马铃薯等谷 木材、棉花 类食物 组成与 直链淀粉(可溶),支链 仅为直链 Company Logo 结构 淀粉(不可溶)无还原性 无还原性
葡萄糖
分 子 式 结构特点 存在 物理性质
果糖
C6H12O6(同分异构体) 多羟基酮 多羟基醛
自然界分布最广, 葡萄及甜味水果 中
水果、蜂蜜
白色晶体, 溶于水
Company Logo
不易结晶,常为粘 稠状液体、纯净的 为白色晶体,溶于 水
葡萄糖
化学 性质
果糖
用途 制法
羟基性质:酯化反应 可发生银镜反应 醛基性质:还原性(新 及与新制 制Cu(OH)2悬浊 液、 Cu(OH)2悬 银镜反应、溴水)、氧 浊液的反应, 化性 (碱性条件下异 生物作用:氧化反应 构化) 不与溴水反应 食物 制药、制糖果、制镜 淀粉水解
糖类-2

选修5 第四章第二节糖类(第2课时)编写人:李忠梅审核:杜善英【目标要求】1.知道蔗糖、麦芽糖结构和组成的关系,能区分二者的化学性质。
2.了解淀粉、纤维素的组成和性质,掌握淀粉的水解反应实验。
一、蔗糖、麦芽糖1.蔗糖蔗糖是由1分子________和1分子______脱水形成的,分子式为______________,在酸性条件下水解的化学方程式为________________________________________________________________________。
2.麦芽糖分子式为______________,与蔗糖互为________,是由两分子________脱水形成的。
麦芽糖在硫酸等催化剂作用下发生水解反应的化学方程式为________________________________________________________________________。
3.麦芽糖和蔗糖的还原性麦芽糖分子中含醛基,能发生银镜反应,是一种__________二糖。
蔗糖分子中不含醛基,是一种________二糖,但其水解产物能发生银镜反应。
二、淀粉和纤维素1.淀粉(1)组成通式为____________,属于______________化合物。
(2)性质①______于冷水,在热水中形成胶状的淀粉糊。
②水解反应:________________________________________________________________________。
③特征反应淀粉__________,利用此反应可以鉴定淀粉的存在。
(3)用途淀粉是食物的重要成分,同时还是重要的食品工业原料,葡萄糖转化为酒精的化学方程式为________________________________________________________________________ ________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(第二课时)
二、蔗糖与麦芽糖
1、从结构上看,什么是蔗糖?什么是麦芽糖?
蔗糖是由一分子葡萄糖和一分子果糖脱水 形成的二糖,而麦芽糖是由两分子葡萄糖脱水 形成的二糖。 (二者分子式均为C12H22O11,两者互为同分异 构体) 2、蔗糖的存在和物理性质 存在于甘蔗(南方)和甜菜(北方)中。 无色晶体,易溶于水,有甜味,是重要的甜味 剂。 麦芽糖主要由淀粉水解得来。
小结
是否含醛基 不含醛基, 非还原性糖。 含醛基,还原性糖。
C6H12O6+ C6H12O6
重要用途 二者关系
葡萄糖 果糖
酸或酶
2C6H12O6
葡萄糖
可做甜味食物 可做甜味食物 互为同分异构体
三、淀粉与纤维素 属于多糖 (C6H10O5)n (C6H10O5)n= [C6H7O2 (OH )3] n
总结 糖的概念 具有多羟基醛或多羟基酮结构,以 及能够水解生成它们的一类有机化合物叫做糖 类;旧称碳水化合物,通式为Cm(H2O)n。 分类及相互转化
缩合
水解
低聚糖
(2~10) 缩聚
水解
缩合 水解 ( >10)
单糖
多糖
1、从食品店购买的蔗糖配成溶液,做银镜反 应实验,往往能得到银镜,产生这一现象的原 因是 ( D) A.蔗糖本身具有还原性 B.蔗糖被还原 C.实验过程中蔗糖发生水解 D.在生产和贮存过程中蔗糖有部分水解
3、蔗糖和麦芽糖的化学性质 演示对比实验:
20%蔗 糖溶液 20%麦 芽糖溶 液 新制的Cu(OH)2 加热 新制的Cu(OH)2 加热
无现象
产生 砖红色沉淀
蔗糖: 无还原性 有还原性 麦芽糖:
同分异构体
演示对比实验:
20%蔗 糖溶液 蔗糖 + 稀硫酸 新制的Cu(OH)2 加热 NaOH 中和酸
在水解冷却后的溶液中滴加NaOH以中和 H2SO4后,再加银氨溶液并水浴加热 。
4、棉子和甜菜中含有棉子糖,使棉子糖水解, 一分子棉子糖水解为一分子蔗糖和一分子半乳 糖(半乳糖和葡萄糖互为同分异构体)。棉子 C18H32O16 糖的分子式是 ,如果使1mol的棉子 半乳糖 葡萄糖 糖完全水解时,则成 和 、 果糖 各1mol。
2、蔗糖3.42g与麦芽糖3.42g混合后并完全水 解,若生成m个葡萄糖分子与n个果糖分子, 则m与n的比值是 ( B ) A.1︰3 B学生进行蔗糖水解的实验,并检验水解产物 中是否含有葡萄糖。它的操作如下: ①取少量蔗糖加适量水配成溶液 ②在蔗糖溶液中 加入3~5滴稀H2SO4 ③将混合液煮沸几分钟,冷却 ④在冷却后的溶液中加入银氨溶液,水浴加热,其 实验结果没有银镜产生。其原因是:_______。 C A.蔗糖尚未水解 B.加热时间不够 C.煮沸后的溶解中没有加碱中和其酸性 D.蔗糖水解的产物中没有葡萄糖 上述实验的正确操作是 。
但在淀粉和纤维素中,所包含的单糖 单元数目不相同,因而n值不同,所以二 者不是同分异构体。
1、淀粉
存在:存在于植物的种子和块根里。 结构:含有几百到几千个单糖单元(C6H10O5). 每个结构单元式量为162。相对分子质量从几 万到几十万;属于天然有机高分子化合物。 物理性质:白色、无气味、无味道的粉末状 质,不溶于冷水,在热水中产生糊化作用。 (即食物由生变熟的过程)
5、淀粉和纤维素不属于同分异构体的原因 是 ( C ) A. 组成元素不同 B. 物理性质、化学性质不同 C. 包含的单糖单元数目不相同 D. 分子结构不相同
6、向淀粉中加入少量稀硫酸,并加热使之 发生水解,为测定水解程度所需下列试剂是: ① 氢氧化钠溶液 ② 银氨溶液 ③ 新制氢 氧化铜 ④ 碘水 ⑤ 氯化钡溶液 C ( ) A.①⑤ B.②④ C.①③④ D.②③④
O—NO2 + 3nH2O (C6H7O2) O—NO2 O—NO2 n
纤维素硝酸酯
与乙酸发生酯化反应生成醋酸纤维。
纤维素的用途
① 棉麻纤维大量用于纺织工业。 ② 木材、稻草、麦秸、蔗渣等用于造纸。 ③ 制造纤维素硝酸酯(硝酸纤维)。根据含N
量分为火棉(含N量较高,用于制造无烟火药)、 胶棉(含N量较低,用于制赛璐璐和油漆)。 ④ 制造纤维素乙酸酯(醋酸纤维),不易着火, 用于制胶片。 ⑤ 制造粘胶纤维(NaOH、CS2处理后所得,其 中的长纤维称人造丝,短纤维称人造棉)。 ⑥ 食物中的纤维素有利于人的消化。
化学性质 ① 分子中无-CHO,本身不显还原性。 ② 可发生水解,但比淀粉水解困难,水解产 物(葡萄糖)具有还原性。
(C6H10O5)n+nH2O
纤维素
硫酸或酶 △
nC6H12O6
葡萄糖
③ 其单糖单元中含有-OH,所以能与乙酸、 硝酸等发生酯化反应。
OH (C6H7O2) OH OH
浓硫酸 △
+ 3n HNO3 n
实验现象及结论:
实 验 结 论 现象 A 现象 B 1 未出现银镜 溶液呈蓝色 淀粉尚未水解 2 出现银镜 溶液呈蓝色 淀粉部分水解 3 出现银镜 溶液不显蓝色 淀粉完全水解
淀粉的用途
① 淀粉是食物的重要成分,是人体的重要能
源; ② 可用于制葡萄糖和酒精等; ③ 淀粉在淀粉酶的作用下,先转化为麦芽糖, 再转化为葡萄糖,在酒化酶的作用下,转化为 乙醇: C6H12O6 催化剂 2C2H5OH +2 CO2
2、纤维素 存在:纤维素存在于一切植物中。(例如 棉花、木材、麻中),是构成植物细胞壁 的基础物质。 结构:分子中含有约几千个单糖单元 (C6H10O5)n ;n值为几千;属于天然高分子 化合物;纤维素是自然界中分布最广泛的一 种多糖。
物理性质 白色、无嗅、无味的具有纤维状结构的 物质。一般不溶于水和有机溶剂,但在一定 条件下,某些酸、碱和盐的水溶液可使纤维 素溶胀或溶解。
7、下列各组物质,两种物质无论以任何质量 比相混合并充分燃烧,生成H2O和CO2的物质 的量之比始终相等的是 ( D ) ①甲醇和乙醛 ②乙烯和乙烷 ③苯和乙炔 ④葡萄糖和乙酸 ⑤乙醇和甲醚 ⑥丙醛和丙烯酸 A.①②③④ B.③⑤⑥ C.①②⑤ D.③④⑤
淀粉的化学性质 ①通常淀粉不显还原性 ②遇碘变蓝色 ③淀粉在催化剂(如酸)存在和加热下可以 逐步水解,最终生成还原性单糖:葡萄糖。 (C6H10O5)n + n H2O 淀粉
酸或酶
n C6H12O6 葡萄糖
如何检验淀粉的水解程度?
实验步骤:
淀粉液 稀硫酸 水解液 NaOH 中和液
Δ 溶液
银氨溶液 现象A 微热 I2水 现象B
无现象 产生 砖红色 沉淀
加热
新制的 Cu(OH)2
热水浴
C12H22O11 + H2O
(蔗糖)
稀硫酸
C6H12O6 + C6H12O6
(葡萄糖) (果糖)
蔗糖 麦芽糖 C12H22O11 分子式 C12H22O11 物理性质 无色晶体,溶于水, 白色晶体,易溶 有甜味。 于水,有甜味。
水解方程式 C H O +H O 稀硫酸 C H O +H O 12 22 11 2 12 22 11 2
