2016届高考化学一轮复习 高效演练05 新人教版
(全国通用)2016届高考化学一轮复习 高效演练16 新人教版

高效演练161.(2015·哈尔滨模拟)下列过程中,共价键被破坏的是( )A.HCl气体溶于水B.酒精溶于水C.冰融化成水D.碘升华【解析】选A。
A项,HCl气体溶于水,发生电离,共价键被破坏,故A正确;B项,酒精溶于水后,酒精在水中以分子形式存在,所以没有化学键的破坏,故B错误;C项,冰融化克服的是分子间作用力以及氢键,共价键没有被破坏,故C错误;D项,碘升华克服的是分子间作用力,共价键没有被破坏,故D错误。
2.下列有关表述错误的是( )A.IBr的电子式B.HClO的结构式为H—O—ClC.HIO各原子都满足8电子结构D.MgO的形成过程可以表示为·Mg·+··Mg2+]2-【解析】选C。
I、Br最外层均有7个电子,通过共用一对电子即可达到8电子稳定结构,A 正确;B中H、Cl、O三原子之间通过共用电子对形成次氯酸,其电子式为,结构式为H—O—Cl,B正确;HIO的结构与HCl O类似,其中I、O两原子的最外层达到8电子稳定结构,氢原子最外层只有2个电子,C不正确;D中MgO是离子化合物,正确。
【方法规律】8电子稳定结构判断方法判断分子中各原子是否达到8电子的稳定结构,主要方法有2种:(1)经验规律法:凡符合最外层电子数+|化合价|=8的皆为8电子稳定结构。
(2)试写结构法:判断某化合物中的某元素最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如①H2O,氧原子最外层有6个电子,H2O中每个氧原子又与两个氢原子形成两个共价键,所以H2O中的氧原子最外层有6+2=8个电子;但H2O中的氢原子最外层有2个电子;②N2,氮原子最外层有5个电子,N与N之间形成三个共价键,所以N2中的氮原子最外层达到8电子稳定结构。
【加固训练】下列分子中所有原子都满足最外层为8电子结构的是( )A.BCl3B. H2OC.SiCl4D.PCl5【解析】选C。
2016届高考(人教版全国通用)化学一轮复习高效演练12Word版含答案

高效演练121.下列各组气体,在常温常压下不能共存的是( )A.SO2与O2B.NO与O2C.O2与N2D.NO2与O2【解析】选B。
NO和O2在常温常压下易发生化合反应生成NO2:2NO+O2====2NO2;而SO2和O2反应需催化剂、加热;N2和O2反应需放电或高温条件。
2.能正确表示下列反应的离子方程式的是( )A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++N====3Fe3++NO↑+2H2OB.铜片与浓硝酸:Cu+N+4H+====Cu2++NO↑+2H2OC.氯化铵浓溶液跟浓NaOH溶液混合后加热:N+OH-NH3·H2OD.碳酸氢铵溶液与足量的NaOH溶液混合后加热:N+OH-NH3↑+H2O【解析】选A。
B项应为Cu+4H++2N====Cu2++2NO2↑+2H2O;C项应为N+OH-NH3↑+H2O;D项中HC也参与反应,应为N+HC+2OH-NH3↑+C+2H2O。
【方法规律】铵盐与碱的反应条件及反应方程式(1)若是铵盐溶液与烧碱溶液共热,则可用离子方程式表示为N+OH-NH3↑+H2O。
(2)若反应物为稀溶液且不加热时,则无氨气逸出,用离子方程式表示为N+OH-====NH3·H2O。
(3)若反应物都是固体时,则只能用化学方程式表示。
3.红热的木炭与浓硝酸共热产生的气体等分为①和②两份,第①份先通过适量蒸馏水,再导入少量石灰水;第②份直接通入少量石灰水。
则石灰水的变化最可能为( )A.①不变浑浊,②变乳白色B.①变乳白色,②不变浑浊C.①变乳白色,②变乳白色D.①不变浑浊,②不变浑浊【解析】选B。
碳与浓硝酸反应产生CO2和NO2的混合气体,而NO2可与水反应生成硝酸为强酸,故混合气体直接通过石灰水,会产生Ca(NO3)2溶液,难以得到CaCO3沉淀;混合气体先通过水,NO2可与水反应生成硝酸和NO,则剩余NO和CO2的混合气体,再通过石灰水会产生CaCO3沉淀。
高考化学一轮复习规范练5氧化还原反应(含解析)新人教版

氧化还原反应(时间:45分钟满分:100分)一、选择题(本题共10小题,每小题5分,共50分。
每小题只有一个选项符合题目要求)1.(2020山东卷)下列叙述不涉及氧化还原反应的是( )。
2参与酸雨形成解析:本题考查的内容是“化学与生活”,题目较简单。
体现了化学学科核心素养中的“科学态度与社会责任”。
A项,谷物发酵酿造食醋的过程是:谷物葡萄糖乙醇乙酸;B项,小苏打做膨松剂是因为小苏打受热分解及能与酸反应放出CO2,发生的是非氧化还原反应;C项,含氯消毒剂给环境消毒是利用了消毒剂的强氧化性,使蛋白质变性;D项,NO2形成酸雨过程中,NO2发生的反应为3NO2+H2O2HNO3+NO,该反应属于氧化还原反应。
2.用脱硫弧菌生物法净化硫化氢废气,是减小硫化氢对空气污染的一种方法。
其反应原理为H2S+2HC O3-S O42-+CH3COOH,下列有关该反应的说法中正确的是( )。
3COOH分子中只含有极性键O3-发生氧化反应D.反应中生成1 mol CH3COOH转移电子为8 mol,A项错误;CH3COOH中的碳氢键、碳氧单键、氧氢键、碳氧双键均为极性键,而碳碳单键为非极性键,B项错误;HC O3-中的碳元素为+4价,而CH3COOH中碳元素的平均化合价为0价,故发生了还原反应,C项错误;反应中生成1molCH3COOH转移8mol电子,D项正确。
3.已知2Fe3++2I2Fe2++I2,Br2+2Fe2+2Br+2Fe3+。
向含有FeBr2、FeI2的混合液中通入一定量的氯气后,再滴加少量KSCN溶液,溶液变为红色,则下列说法不正确的是( )。
、Fe2+、Br的顺序还原性逐渐减弱2+一定被氧化一定被氧化2+解析:由2Fe3++2I2Fe2++I2、Br2+2Fe2+2Br+2Fe3+可知,还原性:I>Fe2+>Br,A正确;加少量的KSCN溶液,溶液变为红色,可知通入氯气后原溶液中Fe2+一定被氧化,B正确;若通入氯气后Fe2+部分被氧化,则Br没有被氧化,C错误;由上述实验不能确定通入氯气后的溶液中是否还存在Fe2+,D正确。
2016届高考(人教版全国通用)化学一轮复习高效演练18Word版含答案

高效演练181.向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生反应:N2+3H22NH3。
对达到化学平衡状态时的有关说法正确的是( )A.N2将完全转化为NH3B.N2、H2和NH3的物质的量浓度一定相等C.N2、H2和NH3的物质的量浓度不再变化D.正反应和逆反应的速率都为零【解析】选C。
可逆反应不可能进行到底,A错;此反应中的任何时刻N2、H2的浓度都不可能相等,B错;达到化学平衡时正、逆反应速率相等但不为零,D错。
2.(双选)(2014·海南高考)将BaO2放入密闭的真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )A.平衡常数减小B.BaO量不变C.氧气压强不变D.BaO2量增加【解析】选C、D。
因为温度不变,只缩小体积,则化学平衡常数不变,A错误;缩小体积,氧气浓度增大,化学平衡逆向移动,氧化钡物质的量减少,过氧化钡物质的量增加,B错误、D正确;因为平衡常数不变,所以氧气的浓度不变,则压强不变,C正确。
【方法规律】化学平衡移动问题分析的思维模式3.(2014·安徽高考)臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )【解析】选A。
根据A项图知,该反应的反应物的能量比生成物高,是放热反应,升温时,平衡逆向移动,平衡常数减小,A正确;v(NO2)=0.2 mol·L-1·s-1,单位错误,B错误;使用催化剂,不能使平衡移动,C错误;增大氧气浓度,平衡逆向移动,NO2的转化率减小,D错误。
【加固训练】下列反应中符合下图图象的是( )A.N2(g)+3H2(g)2NH3(g)ΔH=-Q1kJ·mol-1(Q1>0) B.2SO3(g)2SO2(g)+O2(g)ΔH=+Q2kJ·mol-1(Q2>0) C.4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH=-Q3kJ·mol-1(Q3>0) D.H2(g)+CO(g)C(s)+H2O(g)ΔH=+Q4kJ·mol-1(Q4>0) 【解析】选B。
2016届高考(人教版全国通用)化学一轮复习高效演练36含答案

高效操练 361.(2015 ·湛江模拟 ) 以下各项有机化合物的命名或分类正确的选项是()A.2 ,3- 二甲基 -2- 乙基己烷B.CH3CH2CH2Cl 氯丙烷C.属于芬芳化合物D.属于羧酸【分析】选 D。
A 项,该物质的名称为 3,3,4- 三甲基庚烷,故 A 错误;B 项,该物质的名称为1- 氯丙烷,故 B 错误; C项,芬芳族化合物一定含有苯环,故C错误; D项,— COOH为羧酸的官能团,故D正确。
2.以下说法错误的选项是 ()A. 三硝基甲苯的分子式为C7H3N3O6B. 等质量的甲烷、乙烯、1,3- 丁二烯分别充足焚烧,所耗用氧气的量挨次减少C.在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1D.2,3- 二甲基丁烷的核磁共振氢谱中会出现两个峰【分析】选。
A 项,三硝基甲苯的分子式为7 H5N3O6,错误;B项,A C等质量的 C x H y焚烧耗氧量多少是比较y/x 的值, y/x 的值越大,耗氧量越多,正确; C项,该物质的分子中有两种环境的氢原子,个数之比为 1∶3,正确; D项,2,3- 二甲基丁烷的核磁共振氢谱中会出现两个峰,且面积之比为6∶1,正确。
3.( 2015 ·宁波模拟 ) 以下说法不正确的选项是 ()A. 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3∶1B. 按系统命名法,化合物的名称是2,2,4,5- 四甲基 -3 ,3-二乙基己烷C.乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴识二者D.肌醇与葡萄糖的元素构成同样,化学式均为 C6 H12O6,知足 C m(H2O)n,所以,均属于糖类化合物【分析】选 D。
肌醇为环己六醇,属于环醇类,葡萄糖是多羟基醛,D错误。
【方法例律】键线式表示的有机物分子式的推导(1)图中的端点、折点、交错点上都表示碳原子,由此确立碳原子数。
(2)确立含有的官能团个数。
(3)由碳四价、氧二价、氮三价等来确立分子中的氢原子数。
(全国通用)2016届高考化学一轮复习 高效演练38 新人教版

高效演练381.下列说法正确的是( )A.聚乙烯塑料的老化是由于发生了加成反应B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等C.苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色D.“可燃冰”主要成分是甲烷和水【解析】选D。
聚乙烯分子中不存在碳碳双键,不能发生加成反应,聚乙烯塑料的老化是因为被氧化所致,A错误;苯甲酸的分子式为C7H6O2,可将分子式变形为C6H6·CO2,因此等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等,B错误;苯不能使酸性高锰酸钾溶液褪色,故可用酸性高锰酸钾溶液来鉴别苯和苯的同系物,C错误;可燃冰为甲烷的结晶水合物,主要成分是甲烷和水,D正确。
【加固训练】甲烷、乙烯和苯属于不同类型的有机化合物,但它们之间也有共性,下列关于它们之间共同特点的说法正确的有( )A.都是平面结构B.都能使酸性KMnO4溶液褪色C.都能发生加成反应和取代反应D.在氧气中完全燃烧后都生成CO2和H2O【解析】选D。
甲烷是空间正四面体结构,A错误;甲烷和苯不能使酸性高锰酸钾溶液褪色,故B 错误;甲烷是饱和烃,不能发生加成反应,故C错误;甲烷、乙烯和苯只含C和H两种元素,在氧气中完全燃烧后都生成CO2和H2O,故D正确。
2.只用一种试剂即可区别苯、甲苯、四氯化碳、氢氧化钠溶液,此试剂是( )A.酸性高锰酸钾溶液B.溴水C.浓硫酸D.液溴【解析】选A。
酸性高锰酸钾溶液与苯混合,溶液分层,上层无色,与甲苯混合溶液褪色,不分层,与四氯化碳混合,溶液分层,下层无色,与氢氧化钠溶液混合,溶液不褪色,不分层,A项可以;将溴水加入苯、甲苯中,都是上层的苯、甲苯萃取了溴水中的溴而无法区别苯与甲苯;浓硫酸无法区别苯、甲苯与四氯化碳;液溴与苯、甲苯的反应需要催化剂,且操作较麻烦,故液溴无法区分苯和甲苯。
【加固训练】下列各组有机物中,只需加入溴水就能一一鉴别的是( )A.己烯、苯、四氯化碳B.苯、己炔、己烯C.己烷、苯、环己烷D.甲苯、己烷、己烯【解析】选A。
2016届高考(人教版全国通用)化学一轮复习高效演练02Word版含答案

高效演练021.(2015·茂名模拟)设N A表示阿伏加德罗常数的值,下列关于0.2 mol·L-1Ba(NO3)2溶液的叙述不正确的是( )A.2 L溶液中阴阳离子总数为1.2N AB.500 mL溶液中N浓度为0.2 mol·L-1C.500 mL溶液中Ba2+浓度为0.2 mol·L-1D.500 mL溶液中N物质的量为0.2 mol【解析】选B。
2 L溶液中阴阳离子的物质的量为2 L×0.2 mol·L-1×3=1.2 mol,A正确;溶液具有均一性,根据Ba(NO3)2Ba2++ 2N,0.2 mol·L-1Ba(NO3)2溶液中Ba2+浓度为0.2 mol·L-1、N浓度为0.4 mol·L-1,B错误,C、D正确。
2.(2015·益阳模拟)下列溶液中的Cl-物质的量与100 mL 1 mol·L-1AlCl3溶液中Cl-物质的量相等的是( )A.150 mL 1 mol·L-1NaCl溶液B.100 mL 3 mol·L-1KClO3溶液C.75 mL 2 mol·L-1MgCl2溶液D.50 mL 1 mol·L-1FeCl3溶液【解析】选C。
100 mL 1 mol·L-1AlCl3溶液中Cl-物质的量浓度是 3 mol·L-1,Cl-物质的量为3 mol·L-1×0.1 L=0.3 mol。
A项,150 mL 1 mol·L-1NaCl溶液中c(Cl-)=1 mol·L-1×1=1 mol·L-1,Cl-物质的量为1 mol·L-1×0.15 L=0.15 mol;B项,100 mL 3 mol·L-1KClO3溶液中不含有Cl-,错误;C项,75 mL 2 mol·L-1MgCl2溶液中c(Cl-)=2 mol·L-1×2=4 mol·L-1,Cl-物质的量为4 mol·L-1×0.075 L=0.3 mol;D项,50 mL 1 mol·L-1FeCl3溶液中c(Cl-)=1 mol·L-1×3=3 mol·L-1,Cl-物质的量为3 mol·L-1×0.05 L=0.15 mol。
(全国通用)2016届高考化学一轮复习 高效演练33 新人教版

高效演练331.无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采利乌斯用金属钾还原SiF4获得单质硅,写出化学方程式:_________________________。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF63Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
A.Al是还原剂B.氧化产物只有KAlF4C.每转移6N A电子,得到42 g SiD.铝元素在KAlF4和K2AlF5中化合价不同②用白砂子与镁粉混合在高温条件下得到无定形硅,反应的化学方程式为______________________。
③无定形硅和晶体硅的结构有很大的差别,无定形硅为棕色粉末,而晶体硅是纯灰色、不透明而有光泽的等轴八面晶体,无定形硅的化学性质比晶体硅活泼得多。
通过上述描述你能得出的结论是______________________________。
(3)硅在炼钢时用作脱氧剂,还原在冶炼过程中所形成的FeO,化学方程式为___________________________________________。
(4)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO。
这种混合物叫做生氢剂。
请写出该反应的化学方程式:___________________________________________。
(5)硅橡胶是一种耐高温、低温,耐油,化学性质稳定的高分子合成材料,用于制造卫星部件、人体器官等,现以为原料合成硅橡胶(),需要发生反应的主要类型有________、________。
【解析】(1)K可与SiF4发生置换反应生成Si。
(全国通用)2016届高考化学一轮复习 高效演练11 新人教版

高效演练111.向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )①AgNO3溶液②NaOH溶液③水A.①②③B.②①③C.③②①D.①③②【解析】选B。
甲中气体和溶液都无色,说明不存在氯气,是加入NaOH溶液;乙中气体无色且溶液中出现白色浑浊,说明不存在氯气且溶液中生成了白色沉淀,是加入AgNO3溶液;丙中气体和溶液都呈浅黄绿色,说明存在氯气分子,是加入水。
【互动探究】(1)若集气瓶中加入淀粉KI溶液,振荡后现象是什么?提示:振荡时Cl2将KI中的I-氧化成I2,I2使淀粉变蓝色。
(2)若集气瓶中加入品红溶液,振荡后现象是什么?提示:氯气溶于水后,氯水中含有HClO,HClO的漂白性使品红溶液褪色。
2.(2015·南昌模拟)下面有关氯气的叙述正确的是( )A.氯气可使湿润的红布条褪色,所以氯气具有漂白性B.在通常情况下,氯气可以和任何金属直接化合C.氯气没有漂白性,但通入品红溶液中,品红会褪色D.氯气是黄绿色气体,闻其气味时要小心将集气瓶放在鼻孔下直接闻【解析】选C。
氯气没有漂白性,但通入水中与水反应生成次氯酸,次氯酸具有漂白性,A 错误,C正确;氯气与大多数金属反应需要点燃或加热,B错误;闻气体气味的正确方法是用手在瓶口轻轻扇动,让少量气体进入鼻孔,D错误。
3.(2015·三明模拟)某兴趣小组设计如图所示装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是( )A.钠在氯气中燃烧产生黄色的火焰B.反应产生的大量白烟是氯化钠固体C.棉球①的作用是吸收过量氯气防止产生污染D.棉球②变蓝色则证明氯气已被碱液完全吸收【解析】选D。
棉球②变蓝色则证明碱液已经反应完全,不能吸收过量氯气,D项错误。
4.(2015·邵阳模拟)下列变化过程不能直接实现的是( )①HCl ②Cl2③Ca(ClO)2④HClO ⑤CO2A.①→②B.②→③C.③→④D.④→⑤【解析】选D。
2016届高考人教版全国通用化学一轮温习高效演练26含答

高效演练261.下列有机物的化学用语正确的是( )(CH3)3:表示正丁烷的结构简式:表示乙醇的分子式Cl:表示四氯化碳的电子式D.:表示乙酸的球棍模型【解析】选D。
CH(CH3)3表示异丁烷的结构简式,A错误;乙醇的分子式为C2H6O,B错误;四氯化碳的电子式中,氯原子的周围应有8个电子,C错误。
2.甲烷和氯气以物质的量1∶1混合,在光照条件下,取得的有机产物是( )①CH3Cl ②CH2Cl2③CHCl3④CCl4A.只有①B.①和②的混合物C.只有②D.①②③④的混合物【解析】选D。
甲烷和氯气反映,无论二者的物质的量之比是多少,都会取得各类氯代物。
不能以为甲烷和氯气1∶1就生成CH3Cl,1∶2就生成CH2Cl2等。
【易错提示】本题由于对甲烷的取代反映理解不深刻常常错选A,以为甲烷和氯气物质的量之比1∶1(或同温同压劣等体积混合),只是发生第一步反映取得CH3Cl,而甲烷的取代反映是多步同时进行的,所以甲烷的氯代物并非是一种,而是几种物质的混合物。
3.(2015·长沙模拟)下列对有机物结构或性质的描述,错误的是( )A.将溴水加入苯中,溴水的颜色变浅,这是因为发生了加成反映B.苯分子中的6个碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键C.乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2OD.必然条件下,Cl2可在甲苯的苯环或侧链上发生取代反映【解析】选A。
苯使溴水褪色是因为溴在苯中的溶解度比在水中大,为萃取进程,A项错误;苯不能与溴发生加成反映,也不能与酸性高锰酸钾溶液发生氧化反映,可证明苯分子中碳碳键的特殊性,B项正确;乙烷的分子式为C2H6、丙烯的分子式为C3H6,故1 mol二者混合物完全燃烧,可生成3 mol H2O,C项正确;光照条件下,Cl2能够与苯环侧链的甲基发生取代反映,D项正确。
4.(2015·漳州模拟)下列叙述正确的是( )A.+属于取代反映B.能够用酸性高锰酸钾溶液辨别苯和己烷C.淀粉和纤维素水解的最终产物均为葡萄糖D.丙烯分子中可能有8个原子处于同一平面【解析】选C。
(全国通用)2016届高考化学一轮复习 高效演练03 新人教版

高效演练031.雾霾、PM2.5已经成为公众耳熟能详的热词。
“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物。
下列有关说法中,错误的是( )A.雾霾有可能产生丁达尔效应B.雾霾的形成与工业排放的烟气和汽车尾气有关系C.“PM2.5”分散在大气中形成气溶胶,性质稳定,没有必要纳入空气质量评价指标D.雾霾天气严重危害人体健康【解析】选C。
雾霾是成分复杂的分散系,有胶体成分,“PM2.5”是指直径小于或等于2.5微米的细小颗粒物,比胶体微粒大得多,不属于胶体,但PM2.5能吸附有毒、有害物质,危害人体健康。
2.下列实验装置或操作与粒子的大小无直接关系的是( )【解析】选C。
直径大于1 nm小于100 nm的胶体粒子能透过滤纸,但不能透过半透膜,溶液中的粒子直径小于1 nm,可透过半透膜和滤纸,而浊液的分散质粒子直径大于100 nm,不能透过滤纸和半透膜;丁达尔效应是胶体粒子对光线的散射作用形成的,而溶液中的粒子对光线的散射作用非常微弱,故无此现象;萃取是利用了物质在不同溶剂中溶解性的不同,与分散质粒子大小无关。
【方法规律】不同类别分散系的鉴别方法(1)浊液的物理特征是不稳定,分散剂与分散质易分离,而溶液很稳定,胶体比较稳定。
因此,当浊液与溶液、胶体的外观特征相同或相似时,可以通过静置观察的方法进行鉴别。
如果经过静置仍无变化则是溶液或胶体;如果经过静置出现浑浊或沉淀现象则是悬浊液;如果经过静置出现分层现象则是乳浊液。
(2)胶体的物理特征是具有丁达尔效应。
因此,当溶液与胶体的外观特征相似或相同时,可以通过在暗室里用一束光照射,观察有无光亮的“通路”来鉴别。
如果液体里产生光亮的“通路”,则该液体是胶体;如果液体里不产生光亮的“通路”,则该液体是溶液。
3.(2015·成都模拟)用下图表示的一些物质或概念间的从属关系中不正确的是( )【解析】选C。
甲烷是最简单的烃,烃是由碳、氢两种元素组成的一类有机化合物,A正确;胶体属于分散系,分散系属于混合物,B正确;置换反应属于氧化还原反应,但氧化还原反应不一定是离子反应,C错误;碱性氧化物一定是金属氧化物,D正确。
2016届高考(人教版全国通用)化学一轮复习高效演练30Word版含答案
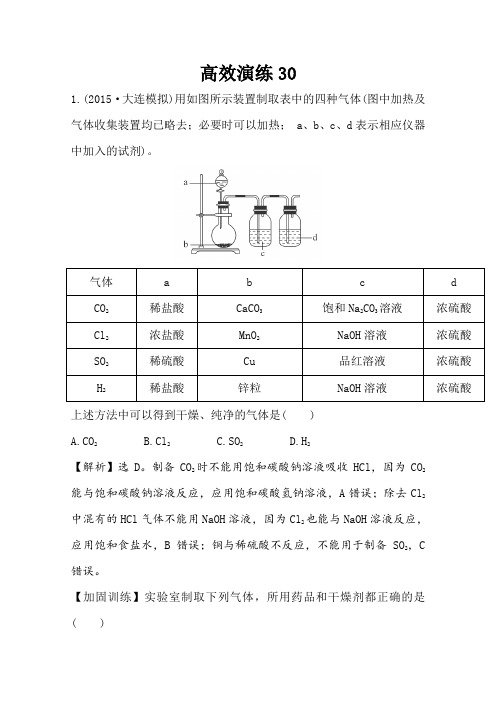
高效演练301.(2015·大连模拟)用如图所示装置制取表中的四种气体(图中加热及气体收集装置均已略去;必要时可以加热; a、b、c、d表示相应仪器中加入的试剂)。
上述方法中可以得到干燥、纯净的气体是( )A.CO2B.Cl2C.SO2D.H2【解析】选D。
制备CO2时不能用饱和碳酸钠溶液吸收HCl,因为CO2能与饱和碳酸钠溶液反应,应用饱和碳酸氢钠溶液,A错误;除去Cl2中混有的HCl气体不能用NaOH溶液,因为Cl2也能与NaOH溶液反应,应用饱和食盐水,B错误;铜与稀硫酸不反应,不能用于制备SO2,C 错误。
【加固训练】实验室制取下列气体,所用药品和干燥剂都正确的是( )【解析】选A。
A项中制取H2的药品及干燥剂的选择均正确;B项中干燥剂选择错误,因为Cl2能与碱石灰发生反应,应选浓硫酸为干燥剂;C项中药品与干燥剂选择均错误,应用浓硫酸作药品,P2O5或CaCl2为干燥剂;D项中的干燥剂选择错误,应用碱石灰作干燥剂。
2.(2015·赤峰模拟)实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是( )【解析】选A。
ab中的物质反应生成SO2,ed中的物质反应生成NH3,SO2和NH3在c中生成(NH4)2SO3,故A正确;ed中生成的H2S会溶解在稀盐酸中,故B错误;两装置中分别生成的氢气和氯气在常温下不反应,不能得到HCl,故C错误;浓硫酸和乙醇在常温下不反应,故D错误。
【加固训练】下列选项正确的是( )【解析】选B。
收集氧气时试管不能加橡皮塞,A项错误;反应装置无加热仪器,C项错误;收集乙酸乙酯的导管末端不应伸到液面以下,D 项错误。
3.下列关于实验的叙述正确的是( )A.向一定量的稀硫酸中加入除去油污的废铁屑,是制备硫酸亚铁溶液的可行方案B.向煮沸的1 mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体C.向铝屑与硫酸反应后的溶液中加入氢氧化钠溶液反应,是制备氢氧化铝的最佳方案D.向某溶液中,依次加入氯水和硫氰化钾溶液,溶液变红,说明溶液中含有Fe2+【解析】选A。
(全国通用)2016届高考化学一轮复习 高效演练22 新人教版

高效演练221.盐MN溶于水存在如下过程:下列有关说法中不正确的是( )A.MN是强电解质B.N-结合H+的能力一定比OH-强C.该过程使溶液中的c(OH-)>c(H+)D.溶液中存在c(HN)=c(OH-)-c(H+)【解析】选B。
由MN M++N-可看出MN是强电解质,A正确;从反应过程可以看出,N-与水电离出来的H+结合为弱电解质HN,因此溶液中c(OH-)>c(H+),C正确;根据质子守恒可知D 项正确;N-结合H+的能力不一定比OH-强,例如HC、F-等结合H+的能力都没有OH-强,故B错。
2.(2015·莆田模拟)已知某溶液中只存在OH-、Cl-、N、H+四种离子,下列说法不正确的是( )A.若溶液中c(N)=c(Cl-),则该溶液一定显中性B.若溶液中c(N)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2OC.若溶液中c(Cl-)>c(N)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HClD.若溶液中c(Cl-)>c(H+)>c(N)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl 【解析】选D。
A项,若溶液中c(N)=c(Cl-),由电荷守恒知c(OH-)=c(H+),则该溶液一定显中性;B项,溶液呈碱性,溶质只能是NH4Cl和NH3·H2O;C项,溶液呈酸性,溶质可能含有NH4Cl或可能含有NH4Cl和HCl,但若溶质是大量的NH4Cl和少量的HCl,则c(Cl-)>c(N)>c(H+)>c(OH-), D项错误。
【加固训练】关于浓度均为0.1 mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )A.c(N):③>①B.水电离出的c(H+):②>①C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)D.①和③等体积混合后的溶液:c(N)>c(Cl-)>c(OH-)>c(H+)【解析】选B。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高效演练05
1.下列试剂在空气中发生变质的反应中既是氧化剂又是还原剂的是( )
A.过氧化钠
B.硫化钠
C.硫酸亚铁
D.氢氧化钠
【解析】选A。
过氧化钠能够与水或二氧化碳发生自身氧化还原反应,过氧化钠既是氧化剂又是还原剂;硫化钠易被氧气氧化为硫单质,是还原剂;硫酸亚铁中的Fe2+易被氧气氧化成Fe3+,作还原剂;氢氧化钠在空气中变质主要是与二氧化碳反应,是非氧化还原反应。
2.(2015·莱芜模拟)下列反应中,氧化剂与还原剂物质的量之比为1∶2的是
( )
A.3S+6NaOH====2Na2S+Na2SO3+3H2O
B.2CH3COOH+Ca(ClO)2====2HClO+(CH3COO)2Ca
C.I2+2NaClO3====2NaIO3+Cl2
D.4HCl(浓)+MnO2高温
MnCl2+Cl2↑+2H2O
【解析】选D。
A项,氧化剂和还原剂均为S,物质的量之比为2∶1;B项,为非氧化还原反应;C项,NaClO3和I2分别为氧化剂和还原剂,物质的量之比为2∶1;D项,MnO2和HCl 分别为氧化剂和还原剂,4 mol HCl中有2 mol表现出还原性,另外2 mol表现出酸性,即氧化剂和还原剂的物质的量之比为1∶2。
3.一未配平的离子方程式为________+X+6H+——3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为( )
A.1∶1
B.3∶1
C.5∶1
D.7∶1
【解析】选C。
由质量守恒和电荷守恒可得出该离子方程式为5X-+X+6H+====3X2+3H2O,则氧化产物和还原产物的物质的量之比为5∶1。
4.(2015·许昌模拟)已知下列三个实验均能发生化学反应。
下列判断正确的是( )
A.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
B.实验①中铁钉只作还原剂
C.实验②中Fe2+既显氧化性又显还原性
D.实验③中发生的是置换反应
【解析】选B。
①中铁钉把硫酸铜中的铜置换出来,铁钉作还原剂,B项正确;②中硫酸亚铁被浓硝酸氧化,Fe2+被氧化成Fe3+,Fe2+只作还原剂,表现还原性,C项错误;③发生的反应为2Fe3++Cu====Cu2++2Fe2+,不属于置换反应,D项错误;从以上反应综合可知,离子的氧化性强弱为Fe3+>Cu2+>Fe2+,A项错误。
【互动探究】
(1)实验②中改为滴加稀硝酸,会有何现象?写出反应的离子方程式。
提示:溶液由浅绿色变为棕黄色,反应为3Fe2++4H++N====3Fe3++NO↑+2H2O。
(2)实验③中的铜丝换为足量铁丝有何现象?若有56 g的铁丝完全溶解时,溶液中Fe2+物质的量是多少?转移电子的物质的量是多少?
提示:发生反应2Fe3++Fe====3Fe2+,溶液由棕黄色变为浅绿色,Fe2+物质的量是3 mol,转移电子2 mol。
5.亚硝酸钠(NaNO2)因外观和食盐相似,又有咸味,容易使人误食中毒。
(1)NaNO2中毒的原理是NaNO2可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生________反应,说明亚硝酸钠具有________性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有________性。
(2)已知NaNO2能发生如下反应:2NaNO2+4HI====2NO↑+I2+2NaI+2H2O。
上述反应中氧化剂是________。
根据上述反应,鉴别NaNO2和NaCl。
可选用的物质有①水、②碘化钾-淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
【解析】(1)Fe2+化合价升高被氧化,发生氧化反应,NaNO2呈现氧化性;维生素C可以缓解NaNO2中毒,说明其有还原性。
(2)NaNO2中氮元素的化合价降低,作氧化剂。
根据上述反应,NaNO2在酸性溶液中,能将I-氧化成I2,淀粉遇I2变蓝色,故必须选用的物质有①②⑤。
答案:(1)氧化氧化还原
(2)NaNO2①②⑤
6.(2015·湛江模拟)氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应
过程的离子方程式为N+4H++3e-====NO↑+2H2O。
下列四种物质:KMnO4,Na2CO3,KI,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原的元素是________;还原剂是________。
(2)写出并配平该氧化还原反应方程式:______________________________。
(3)反应生成0.3 mol H2O,则转移电子的数目为________。
(4)若反应后,氧化产物的化合价升高,而其他物质保持不变,则反应中氧化剂与还原剂的物质的量之比将________(填“增大”“不变”“减小”或“不能确定”)。
【解析】(1)物质甲应该发生氧化反应,在题给四种物质中,能发生氧化反应的只有KI。
被还原的元素为N,还原剂是KI。
(3)反应6KI+8HNO3====6KNO3+2NO↑+3I2+4H2O中转移的电子数为6e-,即每生成
4 mol H2O,转移6 mol电子。
因此若生成0.3 mol H2O,转移0.4
5 mol电子。
(4)若反应后氧化产物的化合价升高,则需氧化剂的物质的量增大,故氧化剂与还原剂的物质的量之比增大。
答案:(1)N KI
(2)6KI+8HNO3====6KNO3+2NO↑+3I2+4H2O
(3)0.45N A(4)增大
【加固训练】(2015·长春模拟)以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体,其过程如下图所示。
回答下列问题:
(1)配平在滤液(Ⅲ)中发生反应的化学方程式:
______NO x+______H2O+______O2====______HNO3。
(2)写出制取硫酸铜的总反应方程式:_________________________________。
(3)在上述生产过程中,可循环使用的物质是____________。
【解析】NO x中氮元素的化合价可以看成+2x,利用化合价升降相等即可配平滤液(Ⅲ)中发生反应的化学方程式:4NO x+2H2O+(5-2x)O2====4HNO3;从流程图结合反应方程式可以看出,在反应中HNO3是循环利用的物质,因此总的反应实质上是Cu和O2、H2SO4反应生成CuSO4,写出方程式即可。
答案:(1)4 2 (5-2x) 4
(2)2Cu+O2+2H2SO4V
2CuSO4+2H2O
(3)HNO3。
