最新人教版必修二化学第一章第二节-化学键pptPPT课件
合集下载
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
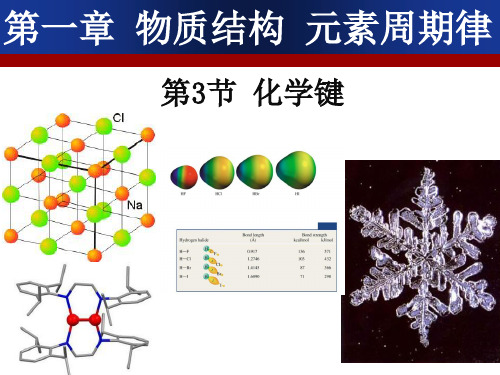
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
人教版高中化学必修2《化学键》PPT(28页)

高一化学必修《2》 第一章 物质结构元素周期律
第三节 化学键
教学目标
知识与技能 使学生认识离子键和共价键及其化合物的
概念,能用电子式表示其化合物的形成。
过程与方法 通过教学过程,培养学生的抽象思维,提
高对微观粒子运动的认识。
情感态度与价值观
加强对立统一规律的认识,渗透由感性认识 上升到理性认识,再运用理论指导实践的认识 规律。
人教版高中化学必修2《化学键》PPT( 28页)
人教版高中化学必修2《化学键》PPT( 28页)
4. 电子式
在元素符号周围用小黑点“•” (或×)来表示原子的最外层电子
的式子。
原 子H O
Cl Mg Na
离 子 Cl
2-
O
Mg2
Na
离 子 Na Cl 化合物 Cl Mg2 Cl
人教版高中化学必修2《化学键》PPT( 28页)
含有离子键的化合物,叫做离子化合物。
人教版高中化学必修2《化学键》PPT( 28页)
2.离子键的成键特点
成键的粒子: 阴、阳离子 成键的本质: 静电作用
3.离子键的成键规律
活泼金属与活泼非金属之间,例如:大部分 的IA、IIA族和VIA、VIIA族
大部分盐、金属氧化物、过氧化物等 (含NH4+的盐)
﹕﹕
练习1〉 下列说法中正确的是 ( C) (A)含有共价键的物质一定是共价分子
也可能是离子化合物,如 NaOH, Na2O2 。
(B)只含有共价键的物质一定是共价化合物
也可能是单质分子,如氯气,氮气。
(C)离子化合物中可能含有极性共价键或非极性共价 键 正确 (D)氦分子中含有共价键
氦气是单原子分子,不存在化学健。
第三节 化学键
教学目标
知识与技能 使学生认识离子键和共价键及其化合物的
概念,能用电子式表示其化合物的形成。
过程与方法 通过教学过程,培养学生的抽象思维,提
高对微观粒子运动的认识。
情感态度与价值观
加强对立统一规律的认识,渗透由感性认识 上升到理性认识,再运用理论指导实践的认识 规律。
人教版高中化学必修2《化学键》PPT( 28页)
人教版高中化学必修2《化学键》PPT( 28页)
4. 电子式
在元素符号周围用小黑点“•” (或×)来表示原子的最外层电子
的式子。
原 子H O
Cl Mg Na
离 子 Cl
2-
O
Mg2
Na
离 子 Na Cl 化合物 Cl Mg2 Cl
人教版高中化学必修2《化学键》PPT( 28页)
含有离子键的化合物,叫做离子化合物。
人教版高中化学必修2《化学键》PPT( 28页)
2.离子键的成键特点
成键的粒子: 阴、阳离子 成键的本质: 静电作用
3.离子键的成键规律
活泼金属与活泼非金属之间,例如:大部分 的IA、IIA族和VIA、VIIA族
大部分盐、金属氧化物、过氧化物等 (含NH4+的盐)
﹕﹕
练习1〉 下列说法中正确的是 ( C) (A)含有共价键的物质一定是共价分子
也可能是离子化合物,如 NaOH, Na2O2 。
(B)只含有共价键的物质一定是共价化合物
也可能是单质分子,如氯气,氮气。
(C)离子化合物中可能含有极性共价键或非极性共价 键 正确 (D)氦分子中含有共价键
氦气是单原子分子,不存在化学健。
最新高一化学必修2-化学键-ppt课件ppt

202120离子键和共价键的比较离子键共价键成键微粒阴阳离子原子成键本质静电作用共用电子对表示法以nacl为例以为hcl例成键元素典型的金属元素典型的非金属元素之间同种元素或同类非金属元素之间nacl
高一化学必修2-化学键-ppt
实验1—2:钠在氯气中燃烧
现象 化学方程式
Na在Cl2中剧烈燃烧,生成 的NaCl小颗粒悬浮在空气 中呈白烟状
Hale Waihona Puke 他们几乎所有的会议上都先强调工作中存在的 HSE问题。每到施工现场首先检查HSE管理。他们 遵循“一个目标”“一个团队”理念,把承包商 的HSE管理纳入到自己的系统之中,并把HSE目标 同其他经营管理指标一样重要,是对各级管理者 的重要考核依据。在对员工进行评估时,将HSE方 面的表现包括在内,并建立相应的奖励制度,以 提高全体员工的执行力。
2.真正的监管分离体制
壳牌各职能部门HSE管理责任划分十分清楚,实行 直线经理负责制。每个部门的领导都是该部门HSE的第 一责任人,全面负责本部门的HSE管理。每个员工也都 有相应的HSE职责。专业HSE部门只有服务、建议和参与 HSE审核权利,日常工作是负责制定公司HSE管理程序, 完善公司HSE管理体系,监督检查各部门对HSE执行情况, 并向管理部门提供有关安全资料及经验等。HSE部门对 HSE事故不负直接责任,而将HSE责任压力传递给了直接 领导和现场员工,实现了真正意义上的监管分离,促使 各部门领导主动关心HSE工作。他们具有高水平的HSE审
壳牌对现场检查非常仔细,不放过每一个细节,哪 怕是一个开关,一个接头,一个锐角,一个支点。在监 督过程中,壳牌注重人性化管理,注重理解和沟通,严 禁有粗暴野蛮辱骂言行。每个班组都要有HSE专职或兼 职监督员。每日坚持班前安全讲话,进行JHA和PTW要求 交底并做好记录。壳牌倡导“退后5×5(5步法)”, 即在你开始工作之前花5分钟来观察你的工作区域,在 脑中把工作步骤过一遍,考虑一下周围会有哪些别的活 动/工作,仔细考虑危害和风险,识别并控制危害与风 险。作业队和项目部每周分别进行HSE 例会,业主每周 每月进行HSE例会,并定期在现场召开HSE例会,总结和 解决HSE存在的问题。壳牌针对施工现场HSE管理制定了 HSE场地守则,对所有的壳牌员工和承包商的个人的HSE 责任提出了明确的最低要求。
高一化学必修2-化学键-ppt
实验1—2:钠在氯气中燃烧
现象 化学方程式
Na在Cl2中剧烈燃烧,生成 的NaCl小颗粒悬浮在空气 中呈白烟状
Hale Waihona Puke 他们几乎所有的会议上都先强调工作中存在的 HSE问题。每到施工现场首先检查HSE管理。他们 遵循“一个目标”“一个团队”理念,把承包商 的HSE管理纳入到自己的系统之中,并把HSE目标 同其他经营管理指标一样重要,是对各级管理者 的重要考核依据。在对员工进行评估时,将HSE方 面的表现包括在内,并建立相应的奖励制度,以 提高全体员工的执行力。
2.真正的监管分离体制
壳牌各职能部门HSE管理责任划分十分清楚,实行 直线经理负责制。每个部门的领导都是该部门HSE的第 一责任人,全面负责本部门的HSE管理。每个员工也都 有相应的HSE职责。专业HSE部门只有服务、建议和参与 HSE审核权利,日常工作是负责制定公司HSE管理程序, 完善公司HSE管理体系,监督检查各部门对HSE执行情况, 并向管理部门提供有关安全资料及经验等。HSE部门对 HSE事故不负直接责任,而将HSE责任压力传递给了直接 领导和现场员工,实现了真正意义上的监管分离,促使 各部门领导主动关心HSE工作。他们具有高水平的HSE审
壳牌对现场检查非常仔细,不放过每一个细节,哪 怕是一个开关,一个接头,一个锐角,一个支点。在监 督过程中,壳牌注重人性化管理,注重理解和沟通,严 禁有粗暴野蛮辱骂言行。每个班组都要有HSE专职或兼 职监督员。每日坚持班前安全讲话,进行JHA和PTW要求 交底并做好记录。壳牌倡导“退后5×5(5步法)”, 即在你开始工作之前花5分钟来观察你的工作区域,在 脑中把工作步骤过一遍,考虑一下周围会有哪些别的活 动/工作,仔细考虑危害和风险,识别并控制危害与风 险。作业队和项目部每周分别进行HSE 例会,业主每周 每月进行HSE例会,并定期在现场召开HSE例会,总结和 解决HSE存在的问题。壳牌针对施工现场HSE管理制定了 HSE场地守则,对所有的壳牌员工和承包商的个人的HSE 责任提出了明确的最低要求。
人教版高中化学必修二化学键ppt课件

·· C··l ·
→
[ :C··l :]- Ca2+ [ :C··l :]-
··
··
2. 下列各数值表示有关元素的原子序数,能形成AB2
型离子化合物的是( )D
A.6与8 B.11与13 C. 11与16 D.12与17
.
19
3.下列说法正确的是( D)
A.含有金属元素的化合物一定是离子化合物 B.第IA族和第VIIA族原子化合时,一定生成离子键 C.由非金属元素形成的化合物一定不是离子化合物 D.活泼金属与非金属化合时,能形成离子键
A2B型
.
16
(6)用电子式表示离子化合物的形成过程
NaCl: Na Cl
Na Cl
MgBr2:
Br Mg Br
Br Mg2 Br
.
17
注意:
1.离子要注明正负电荷及数目,且正负电荷总数
应相等
2.相同的原子可以合并写,相同的离子要单个写
即
箭头左方相同的微粒可以合并 箭头右方相同的微粒不可以合并
3.阴离子要用方括号 “[ ]” 括起
.
21
二、共价键
问题: 1.活泼的金属元素和活泼非金属元素化合时形成离子键,
氢氧键 氢氯键 氮氢键
【思考】是不是所有的物质中都有化学键?
稀有气体分子中不存在化学键
.
7
导学案
• 练一练
注:只有化学键的断裂或者只有新化学 键形成的过程不是化学反应。
例如:HCl溶于水 NaCl晶体析出
.
8
一、离子键
实验: 金属钠在氯气中燃烧 现象: 钠燃烧、黄色火焰、大量白烟
化学方程式:
点燃
2Na+Cl2 === 2NaCl
人教版高中化学必修二《化学键》ppt课件

二、离子化合物 1.定义:阴、阳离子间通过________构成的化合物 叫做离子化合物。 2.离子化合物包括以下几大类。 (1)大多数盐:如____________等。 (2)强碱:如__________等。 (3)大多数碱性氧化物:________等。
三、电子式 1.定义 在元素符号周围用“·”或“×”来表示原子的____ ____的式子。
O2-、OH-等;形成阴离子的情况很多,可以是非金属,
如Cl-、S2-等,也可以是原子团,如CO
2- 3
、NO
-
3
等,还可
以含有金属元素,如AlO
活活泼泼金非属金原属子原子MN―化―合→NM―+―-―m―n→ee→--NMmn-+―静作―电用→离子键 (2)离子键的存在 离子化合物中一定存在离子键。离子键存在于大多数
强碱、盐、金属氧化物等离子化合物中。例如:NaOH、 NaCl、NaHCO3、NH4NO3、Na2O2、CaO等均属于离子 化合物。但离子化合物中不一定只有离子键,还可能有其 他的化学键。
(2)用电子式表示离子的最外层电子 简单阳离子的电子式就是离子符号本身,如H、Na、 Mg、Al的离子的电子式分别为:
H+ Na+ Mg2+ Al3+
复杂阳离子和阴离子的电子式要加一个“[ ]”, 如H-、Cl-、S2-、OH-、NH+4 的电子式分别为:
离子化合物是阴离子和阳离子的组合,阴、阳离子的 电子式的组合就是离子化合物的电子式,如:
典例导析
知识点一 离子的结构和性质
【例1】 下列有关阴离子的说法正确的是:①阴离子一
定是酸根;②只有活泼的非金属元素才能形成阴离子;③阴
离子中不能含有金属原子;④C、Si等ⅣA族元素的原子很难
人教版化学《化学键》PPT课件

实验步骤
制备晶体样品,进行X射线 衍射实验,收集衍射数据 ,解析晶体结构,确定化 学键类型。
应用范围
适用于研究离子键、共价 键等多种类型的化学键, 特别适用于研究晶体结构 。
红外光谱法研究化学键
红外光谱原理
利用物质吸收红外光后产生的振 动和转动能级跃迁,分析物质的
结构和化学键类型。
实验步骤
制备样品,进行红外光谱实验,收 集光谱数据,解析光谱信息,确定 化学键类型。
利用金属键的性质可以合成具有特殊 功能的材料,如超导材料、储氢材料 等。
金属键的应用广泛,如制造导线、电 极、催化剂等。
05
化学键与物质性质的关系
化学键对物质物理性质的影响
01
02
03
熔点、沸点
离子键和共价键的强度影 响物质的熔点和沸点。离 子键越强,熔点越高;共 价键越强,沸点越高。
硬度
化学键的强度决定了物质 的硬度。离子键和共价键 越强,物质越硬。
化学性质多样性
不同类型的化学键导致物质具有 不同的化学性质。例如,离子键 形成的物质易溶于水,而共价键 形成的物质可能具有不同的溶解
性、酸碱性等。
化学键在材料科学中的应用
纳米材料
利用化学键的特性,可以合成出 具有特定形状和功能的纳米材料 。
生物医用材料
利用化学键的特性,可以设计出 与生物体相容性良好的医用材料 ,如生物降解材料、生物活性材 料等。
化学键的形成与性质
形成
原子或离子之间通过电子的转移或共 享形成化学键。
性质
不同类型的化学键具有不同的性质, 如离子键具有较强的极性和较高的熔 点,共价键具有方向性和饱和性,金 属键具有导电性和延展性等。
化学键在化学反应中的作用
第一章 第二节 第2课时 元素周期律-高二化学人教版(2019)选择性必修2课件

03
电负性
二、电负性的应用
3.判断化合物中元素化合价的正负
电负性数值大的元素原子吸引电子的能力强,元素的化合价 通常为负价;
电负性数值小的元素原子吸引电子的能力若,元素的化合价 通常为正价。
例3.电负性:H为2.1,C为2.5,Si为1.8, 则CH4中碳元素化合价为_-__4_价_,氢元素化合价为_+__1_价_; SiH4中硅元素化合价为_+__4_价_,氢元素化合价为-__1_价__
02
电离能
三、逐级电离能
1.逐渐电离能的变化趋势
同一元素原子的逐级电离能 越来越大。
首先失去的是能量最高的电 子,故第一电离能最小;失 去电子后形成阳离子,所带 正电荷对电子的吸引力更强, 从而逐级电离能越来越大。
02
电离能
三、逐级电离能
2.逐渐电离能与主族元素的价电子数及化合价的关系
主族元素的逐级电离能在逐 渐增大的过程中会发生一次 突变,因为电子是分层排布 的,相较于外层电子,内层 电子很难失去。
Y
原子核外s能级上的电子总数与p能级上的电子总数相等,但 第一电离能都高于同周期相邻元素
Z 其价电子中,在不同形状的原子轨道中运动的电子数相等
N 只有一个不成对电子
请完成下列空白(请填元素符号) : (1)写出各元素的元素符号:W:__H__ 、X:__O__、Y:_M__g_、Z:__S_i _、N:__C_l_。 (2)X、Y和Z三种元素的原子半径由大到小的顺序:_M__g_>_S_i_>_O__。
注意:不能将电负性1.8作为划分金属和非金属的绝对标准, 如锑、铅、铋等金属元素的电负性均为1.9。
03
电负性
二、电负性的应用
2.判断化学键的类型
人教版高中化学必修二《化学键》课件4PPT

1.概念:
原子间通过共用电子对所形成的相互作用
成键微粒: 原子
注 共价键的实质:原子间的静电作用。 意 成键元素:非金属元素之间
【体验】 2.共价键的形成条件: 一般是非金属原子之间
共价化合物:以共用电子对形成分子的化合物
如:H2 N2 HCl H2O HF 等 3.共价键的表示方法 (1)电子式:
7 、能认识到自己有种种的遗憾,敢于放弃不切实际的梦想而坦城无愧的人,可以说是完美的。 3 、人生需要耐心!在困难和挫折面前,更要耐心,沉着,冷静,耐心让你积极思维,发挥你的聪明才智,克服困难,度过挫折。 14 、人生,因为你的成就不够多,所以别人才会看不起你。因为你的成就不够高,别人才会忽视你,因为你的道德不高,别人才会欺负你。 因为你的情感不够完美,别人才会嘲笑你。人生,没有人是完美的。人生正是一个走向完美的过程。外界的评价与你所做的成就成正比。
Na+H2O=Na++OH-+H2↑
D.原子核内有l8个中子的氯原子:
4.(2011·江苏卷)下列有关化学用语表示
正确的是C(
)
A.N2的电子式:
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
D.H2O的电子式为
H
:
..
O
..
:H
5.(2012·大纲版)下列关于化学键的叙述 , 正 确的一项是( A ) A. 离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C.SiH4的沸点高于CH4,可推测pH3的 沸点高于 NH3 D.含有共价键的化合物一定是共价化合物
(3)氢键的形成使物质的熔沸点升高,对物质的溶解度硬度 等也影响。
【生成】
化学键
原子间通过共用电子对所形成的相互作用
成键微粒: 原子
注 共价键的实质:原子间的静电作用。 意 成键元素:非金属元素之间
【体验】 2.共价键的形成条件: 一般是非金属原子之间
共价化合物:以共用电子对形成分子的化合物
如:H2 N2 HCl H2O HF 等 3.共价键的表示方法 (1)电子式:
7 、能认识到自己有种种的遗憾,敢于放弃不切实际的梦想而坦城无愧的人,可以说是完美的。 3 、人生需要耐心!在困难和挫折面前,更要耐心,沉着,冷静,耐心让你积极思维,发挥你的聪明才智,克服困难,度过挫折。 14 、人生,因为你的成就不够多,所以别人才会看不起你。因为你的成就不够高,别人才会忽视你,因为你的道德不高,别人才会欺负你。 因为你的情感不够完美,别人才会嘲笑你。人生,没有人是完美的。人生正是一个走向完美的过程。外界的评价与你所做的成就成正比。
Na+H2O=Na++OH-+H2↑
D.原子核内有l8个中子的氯原子:
4.(2011·江苏卷)下列有关化学用语表示
正确的是C(
)
A.N2的电子式:
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
D.H2O的电子式为
H
:
..
O
..
:H
5.(2012·大纲版)下列关于化学键的叙述 , 正 确的一项是( A ) A. 离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C.SiH4的沸点高于CH4,可推测pH3的 沸点高于 NH3 D.含有共价键的化合物一定是共价化合物
(3)氢键的形成使物质的熔沸点升高,对物质的溶解度硬度 等也影响。
【生成】
化学键
人教版化学必修二《化学键》ppt课件

实例
H-H
H-Cl
4.化学键 使离子相结合或原子相结合的强烈作用力 通 称 为 化学键
离子键 (1)分类:共价键非极极性性键键
(2)化学反应的实质: 一个化学反应过程:本质上就是 旧化学键的断裂和 新化学键的形成 过程。 化学反应:H2+Cl2=点==燃==2HCl 实质:旧键断裂 H-H→H+H Cl-Cl→Cl+Cl 新键形成 :H+Cl→H-Cl
答案:(1)O2 (2) (3)离子 (4)共价
··
·O·· · H×+·O·····+H×―→H×·O····×·H
10.推断出下列原子、分子或离子的名称,写出它们 的电子式。
(1)离子化合物AB2,所有离子电子层数相同,电子总 数为30________。
(2)由4个原子核和10个电子组成分子______________。 (3)第三周期内A、B两元素原子序数差为4,它们组成 化合物的化学式为AB________。
解析:构成离子键的粒子是阴、阳离子,但阴、阳 离子不一定只是活泼金属与活泼非金属,也可以是带电 荷的原子团,如 NH+ 4 、SO24-等,故 A 错。共价化合物是 由共价键结合而成的,但具有共价键的化合物不一定是 共价化合物,某些离子化合物中也具有共价键;离子化 合物中必须有离子键,也允许有共价键。故全部以共价 键结合的化合物才是共价化合物,有离子键的化合物为 离子化合物,故 B 不正确,C 正确。分子内相邻原子之
活泼金属或NH+ 4 活Ⅰ泼A非族金、属ⅡA族―化―合→ ⅥA族、ⅦA族
M X
―-―ne→- ―+―m→e-
MXmn-+―吸达―引到―、―平排―衡斥→离子键
⑤存在范围:离子键存在于大多数强碱、盐及金属氧 化物中。
2.共价键 (1)概念 : 原子之间通过共用电子对所形成的相互作 用,叫做共价键。 (2)成键粒子:原子。 (3)成键性质:共用电子对 对两原子的电性作用。
人教版化学必修二化学键PPT

二、共价键
(1)定义: 原子之间通过共用电子对所形成的相互作用
(2)成键微粒: 原子 (3)相互作用: 共用电子对
(4)成键条件:
a.同种或不同种非金属元素原子之间相结合 b.部分金属元素与非金属元素之间的结合
(如AlCl3等)
多数非金属单质,气态氢化物,酸分子,大多 数有机物里都有共价键。
由离子键构成的化合物叫做离子化合物
用电子式表示下列化合物的形成过程:H2O、NH3、
水
氨
··
共用电子对
HH
用一根短线代表一对 共用电子对
H﹣H(结构式)
::
H : Cl :
H﹣Cl(结构式)
练习:写出表1-3中分子的结构式
1.写出下列物质的电子式
C F Mg F D 2K S
[ Mg 2 F ]2 K2 [ S ]
问题: 1、什么是离子键?哪些元素原子化合易形成离子键?
使阴、阳离子结合成化合物的静电作用,叫做离子键。 成键条件:一般为活泼金属元素和活泼非金属元素
2.非金属元素之间化合时,核外电子排布是通过什么方式 达到稳定结构的?
探讨: 以H2、HCl分子的形成为例
• 3、下列关于离子化合物的说法正确的是( ) • A、离子化合物中不一定都含离子键 • B、离子化合物中的阳离子只能是金属离子 • C、在离子化合物氯化钠中,除钠离子和氯离子的静电吸引作用 • 外,还存在电子与电子、原子核与原子核之间的排斥作用 • D、离子化合物若能溶于水,则其所得溶液一定不能导电 • 4、据成键元素判断下列化合物含有离子键的是( ) • A、HF B、H2O C、H2SO4 D、MgO
含离子键的化合物一定是离子化合物
1、下列说法正确的是( )
人教版高中化学必修二第一章第三节《化学键》课件(共26张PPT)

3、离子化合物:由阳离子的电子式和阴离子的电子 式组合而成.
Na Cl
2-
Na O Na
Cl Mg 2 Cl
注意:相同的离子不能写在一起,一般对称
排列。
练习:下列电子式是否正确
×
:O:
[:Na:]+×
[:S:]-2 ×
::
::
:: ::
::
×
Ca2+[:Cl:]2-
Na2+[:O:]2- ×
4、用电子式表示离子化合物的形成过程
从元素周期表我们可以看出,到 目前为止,已经发现的元素只有一百 多种。然而,这一百多种元素的原子 组成的物质却数以千万计。那么,元 素的原子通过什么作用形成如此丰富 多彩的物质呢?
高一化学必修2
第一章 物质结构 元素周期表
第三节 化学键 离子键
1、能说出离子键的定义,成键粒子, 成键的实质,成键元素,成键的过程, 离子键的存在
2.能熟练地用电子式表示离子化合物 的形成过程。
钠和氯气的反应【flash课件 钠和氯气的反应视频.AVI
实验1—2:钠在氯气中燃烧
现象
Na在Cl2中剧烈燃烧,生成 的NaCl小颗粒悬浮在空气 中呈白烟状
化学方程式
点燃
2Na + Cl2 ==== 2NaCl
• 从宏观上我们看到钠在氯气中燃烧, 生成新的物质氯化钠,若从微观角度 考虑,又该如何解释呢?这就是我们 今天要学习的离子键
吸引、排斥 达到平衡
离 子 键
离子化合物: 含有离子键的化合物
范例:
大多数盐、强碱和活泼金属氧化物
练习
请问下列物质哪些是离子化合物?
1. CaBr2
是
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
作用称为共价键
三、共价键
1、定义:原子间通过共用电子对形成的相互作
×× ××
2用、表示式
××
①电子式
HCl的电子式
H Cl ××
×× ×× ××
Cl2的电子式
×× ××
Cl Cl
×× ××
②、结构式:
用一根短线表示一对共用电子。其他电子一律省去
如:H-Cl
Cl-Cl
转化原子成序自数由越小移,动半径的越离大子。 , 离子键如即:O被2->破F-坏> N。a+> Mg2+
4.由下列离子化合物熔点变化
规律 ,分析离子键的强弱与离
子半径、离子电荷有什么关系?
(1)NaF NaCl NaBr NaI
---988℃ 801℃ 740℃ 660℃
(2)NaF
CaF2
CaO
----988℃ 1360℃ 2614℃
活泼金属如与:活Na+泼<Na非金属
2、阴离子半径>相应的原子半径;
2.离子键是一种什么性质的 相互作用? 如:Cl->Cl
阴3、阳同离一子主族间元的素,静从电上作到下用, (静离电子吸半径引逐=渐静增大电;排如:斥)
3.离L子i+<化Na合+<K物+ 溶于F水-<C或l-<熔Br化-<I时4离、具子有键相是同否电发子层生结变构化的?离子,
4.镁原子
2、离子的电子式:
简单阴离子: 一般用
①阴离子的电子式
Cl
2-
O
R
注意
n-
表示
H
复杂的阴离子 使每一个原子铺开,并都达
- 到稳定结构 OH
简单的阳离子: 即离子符号
②阳离子的电子式
如Mg2
Na
复杂的阳离子: 要注明最外层电子数
H
及电荷数 +
如NH4+: H N .H
H
3、离子化合物: 由阳离子的电子式和阴离子的电
子式组合而成.
Na Cl
2-
Na O Na
Cl Mg2 Cl
注意:相同的离子不能写在一起,一般对称
排列.
4、用电子式表示离子化合物的形成过程
左侧写原子的电子式
右侧写离子化合物的电子式
中间用
连接.
例:K S
2-
K KSK
Br Mg Br
Br Mg2 Br
注意:用弧形荐头表示电子转移的方向.
C 例1、下列说法正确的是(
(提示:Ca2+半径略大于Na+半径)
离子半径越小、离子所带 电荷越多,离子键就越强。
5、离子键的强弱及其意义
①影响离子键强弱的因素有: 离子半径和离子所带电荷
离子半径越小,所带电荷越多, 阴阳离子间的作用就越强
②强弱与性质的关系: 影响该离子的熔沸点高低,硬度大小等
例如:ⓐNaCl 与此 KCl中,前者离子键强于后者, 所以熔点NaCl> KCl
练习1:写出下列物质的电子式和结构式: CH4、NH3、CO2、H2O、O2、N2、HClO
练习2根据下列物质的结构式写出相应的电子式:
离子化合物,请用电子式表示该离子化合物。
[ :Y····:]- X2+[ :Y····:]-
3、 钠与氧气在常温下反应生成氧化钠。请
用电子式表示氧化钠的形成过程。
2Na·
+
·· ·O··· →
Na+[:O····:]2- Na+
请思考:
活泼的金属元素和活泼非金属元素化合时形 成离子键。 非金属元素之间化合时,能形成离子键吗? 为什么?
不能. 因非金属元素的原子均有获得电子的倾向。
氢分子的形成:
··
H ·+ ·H → H H 氯化氢分子的形成:
H ·+
·C····l: → H
··
C··l ··
··
注意:
用电子式 表示靠共 用电子对 形成的分 子时,不 标 [ ]和 电荷。
所以:非金属元素的原子间可通过共用电子
对的方法使双方最外电子层均达到稳定结构。
2、化学键:使离子相结合或使原子相结合的作用力
一、离子键
1、定义: 带相反电荷(阴阳)离子之间的相
互作用
2、形成过程
二、电子式
电子式:在元素符号周围用小黑点.(或×)来
表示原子的最外层电子的式子。
1、原子的电子式:
H O Cl Mg Na
练习:用电子式表示:
1.氢原子
2.钙原子
3.氧原子
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键 静电引力应改为静电作用,它包括引力和斥力。
(C)只有金属元素和非金属元素化合时才能形成离子键 铵离子和非金属元素,酸根离子和金属元素等也可
形成离子键。 (D)大多数的盐、碱和低价金属氧化物中含有离子键
正确
2、某ⅡA族元素 X 和ⅦA族元素 Y 可形成
人教版必修二化学第一章第 二节-化学键ppt
微粒间的作用——三键一力
化学键
离子键 共价键
1、三键一力
金属键
分子间作用力(氢键)
“三键一力”是微观粒子(原子、分子、离子)结合 在一起构成客观物质的四种基本作用力,它的强弱不仅 决定着物质的存在形态(气、固、液),熔沸点高低, 硬度大小,而且与物质的化学性质也有密切的关系
C F Mg D H Cl
F
Mg 2 [ F ]2
H [ Cl ]
练习2. 用电子式表示下列离子化合物的形成过程:
(1)CaO
(2)Na2O
(3)CaCl2
4.溴化钾的形成过程 5.氧化镁的形成过程 6.溴化钙的形成过程
[思考与讨论]
1.离通子常情半况径下大,小哪比些较元素规之律
间1、最阳易离形子成半离径<子相化应的合原物子?半径;
)
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系能量降低
D、在离子化合物氯化钙中,两个氯原子间也存在
离子键
例2、下列各数值表示有关元素的原子序数,能以离
C 子键相互结合成稳定化合物的是( )
A、10和19 B、6和16 C、11和17 D、14和8
ⓑAl2O3与MgO均为高熔点物质,常用耐火材料,原 因是它们均由半径小、高电荷的离子构成, 离子键很强
小结:
失去电子
活泼金属原子
得到电子
活泼非金属原子
阳离子 阴离子
静电作用 离子键
电子式 离子化合物
离子晶体
复习 1、下列说法中正确的是 ( ) D
(A)两个原子或多个原子之间的相互作用叫做化学键 应指相邻的两个或多个原子,强烈的相互作用
讨论:下列电子式是否正确
× × × :O:
[:Na:]+
::
[:S:]-2
::
:: ::
::
× × Ca2+[:Cl:]2-
Na2+[:O:]2-
课堂练习
练习 1.下列用电子式表示化合物的形成过程正确的是:( A )
A K O K K [ O ]2 K B Cl Ba Cl [ Cl ] [ Ba ]2 [ Cl ]
三、共价键
1、定义:原子间通过共用电子对形成的相互作
×× ××
2用、表示式
××
①电子式
HCl的电子式
H Cl ××
×× ×× ××
Cl2的电子式
×× ××
Cl Cl
×× ××
②、结构式:
用一根短线表示一对共用电子。其他电子一律省去
如:H-Cl
Cl-Cl
转化原子成序自数由越小移,动半径的越离大子。 , 离子键如即:O被2->破F-坏> N。a+> Mg2+
4.由下列离子化合物熔点变化
规律 ,分析离子键的强弱与离
子半径、离子电荷有什么关系?
(1)NaF NaCl NaBr NaI
---988℃ 801℃ 740℃ 660℃
(2)NaF
CaF2
CaO
----988℃ 1360℃ 2614℃
活泼金属如与:活Na+泼<Na非金属
2、阴离子半径>相应的原子半径;
2.离子键是一种什么性质的 相互作用? 如:Cl->Cl
阴3、阳同离一子主族间元的素,静从电上作到下用, (静离电子吸半径引逐=渐静增大电;排如:斥)
3.离L子i+<化Na合+<K物+ 溶于F水-<C或l-<熔Br化-<I时4离、具子有键相是同否电发子层生结变构化的?离子,
4.镁原子
2、离子的电子式:
简单阴离子: 一般用
①阴离子的电子式
Cl
2-
O
R
注意
n-
表示
H
复杂的阴离子 使每一个原子铺开,并都达
- 到稳定结构 OH
简单的阳离子: 即离子符号
②阳离子的电子式
如Mg2
Na
复杂的阳离子: 要注明最外层电子数
H
及电荷数 +
如NH4+: H N .H
H
3、离子化合物: 由阳离子的电子式和阴离子的电
子式组合而成.
Na Cl
2-
Na O Na
Cl Mg2 Cl
注意:相同的离子不能写在一起,一般对称
排列.
4、用电子式表示离子化合物的形成过程
左侧写原子的电子式
右侧写离子化合物的电子式
中间用
连接.
例:K S
2-
K KSK
Br Mg Br
Br Mg2 Br
注意:用弧形荐头表示电子转移的方向.
C 例1、下列说法正确的是(
(提示:Ca2+半径略大于Na+半径)
离子半径越小、离子所带 电荷越多,离子键就越强。
5、离子键的强弱及其意义
①影响离子键强弱的因素有: 离子半径和离子所带电荷
离子半径越小,所带电荷越多, 阴阳离子间的作用就越强
②强弱与性质的关系: 影响该离子的熔沸点高低,硬度大小等
例如:ⓐNaCl 与此 KCl中,前者离子键强于后者, 所以熔点NaCl> KCl
练习1:写出下列物质的电子式和结构式: CH4、NH3、CO2、H2O、O2、N2、HClO
练习2根据下列物质的结构式写出相应的电子式:
离子化合物,请用电子式表示该离子化合物。
[ :Y····:]- X2+[ :Y····:]-
3、 钠与氧气在常温下反应生成氧化钠。请
用电子式表示氧化钠的形成过程。
2Na·
+
·· ·O··· →
Na+[:O····:]2- Na+
请思考:
活泼的金属元素和活泼非金属元素化合时形 成离子键。 非金属元素之间化合时,能形成离子键吗? 为什么?
不能. 因非金属元素的原子均有获得电子的倾向。
氢分子的形成:
··
H ·+ ·H → H H 氯化氢分子的形成:
H ·+
·C····l: → H
··
C··l ··
··
注意:
用电子式 表示靠共 用电子对 形成的分 子时,不 标 [ ]和 电荷。
所以:非金属元素的原子间可通过共用电子
对的方法使双方最外电子层均达到稳定结构。
2、化学键:使离子相结合或使原子相结合的作用力
一、离子键
1、定义: 带相反电荷(阴阳)离子之间的相
互作用
2、形成过程
二、电子式
电子式:在元素符号周围用小黑点.(或×)来
表示原子的最外层电子的式子。
1、原子的电子式:
H O Cl Mg Na
练习:用电子式表示:
1.氢原子
2.钙原子
3.氧原子
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键 静电引力应改为静电作用,它包括引力和斥力。
(C)只有金属元素和非金属元素化合时才能形成离子键 铵离子和非金属元素,酸根离子和金属元素等也可
形成离子键。 (D)大多数的盐、碱和低价金属氧化物中含有离子键
正确
2、某ⅡA族元素 X 和ⅦA族元素 Y 可形成
人教版必修二化学第一章第 二节-化学键ppt
微粒间的作用——三键一力
化学键
离子键 共价键
1、三键一力
金属键
分子间作用力(氢键)
“三键一力”是微观粒子(原子、分子、离子)结合 在一起构成客观物质的四种基本作用力,它的强弱不仅 决定着物质的存在形态(气、固、液),熔沸点高低, 硬度大小,而且与物质的化学性质也有密切的关系
C F Mg D H Cl
F
Mg 2 [ F ]2
H [ Cl ]
练习2. 用电子式表示下列离子化合物的形成过程:
(1)CaO
(2)Na2O
(3)CaCl2
4.溴化钾的形成过程 5.氧化镁的形成过程 6.溴化钙的形成过程
[思考与讨论]
1.离通子常情半况径下大,小哪比些较元素规之律
间1、最阳易离形子成半离径<子相化应的合原物子?半径;
)
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系能量降低
D、在离子化合物氯化钙中,两个氯原子间也存在
离子键
例2、下列各数值表示有关元素的原子序数,能以离
C 子键相互结合成稳定化合物的是( )
A、10和19 B、6和16 C、11和17 D、14和8
ⓑAl2O3与MgO均为高熔点物质,常用耐火材料,原 因是它们均由半径小、高电荷的离子构成, 离子键很强
小结:
失去电子
活泼金属原子
得到电子
活泼非金属原子
阳离子 阴离子
静电作用 离子键
电子式 离子化合物
离子晶体
复习 1、下列说法中正确的是 ( ) D
(A)两个原子或多个原子之间的相互作用叫做化学键 应指相邻的两个或多个原子,强烈的相互作用
讨论:下列电子式是否正确
× × × :O:
[:Na:]+
::
[:S:]-2
::
:: ::
::
× × Ca2+[:Cl:]2-
Na2+[:O:]2-
课堂练习
练习 1.下列用电子式表示化合物的形成过程正确的是:( A )
A K O K K [ O ]2 K B Cl Ba Cl [ Cl ] [ Ba ]2 [ Cl ]
