江苏专用2019届高考化学二轮复习压轴题热点练6晶胞的有关计算含答案
高中化学晶胞的相关计算专项训练知识点及练习题及答案

高中化学晶胞的相关计算专项训练知识点及练习题及答案一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.国庆70周年阅兵式展示了我国研制的各种导弹。
导弹之所以有神奇的命中率,与材料息息相关,镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物(如砷化镓、磷化镓等)都是常用的半导体材料。
回答下列问题:(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]__。
(2)根据元素周期律,原子半径Ga__As,第一电离能Ga__As。
(填“大于”或“小于”)(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是__。
高考化学二轮复习化学晶胞的相关计算专项训练试题及答案

高考化学二轮复习化学晶胞的相关计算专项训练试题及答案一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。
回答下列问题:(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__。
基态K+的电子排布式为__。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__,中心原子的杂化方式为__。
NaBH4中存在__(填标号)。
a.离子键b.氢键c.σ键d.π键(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为__,其中Be的配位数为__。
2019江苏省高考压轴卷化学试题化学答案

参考答案1.BA项.羊毛主要成分是蛋白质,灼烧会产生特殊的气味,假的羊毫是化学纤维,所以用灼烧法可鉴别毛笔羊毫的真伪,故A正确;B项.造纸的原料是木材,主要成分是纤维素,不是低聚糖,故B错误;C项.化石燃料的燃烧是形成雾霾的重要因素之一,减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施,故C正确;D项.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料可以在自然界中自行分解为小分子化合物,用以替代聚乙烯等塑料,实现“碳循环”,可减少“白色污染”,故D正确。
故选B。
2.CA项.根据原子构成,左上角为质量数,左下角为质子数,即该核素为5626Fe,故A错误;B项.原子失去电子,只是失去最外层电子数,质子数不变,Cl-结构示意图正确的是,故B错误;C项.C2H6的结构简式为CH3CH3,其结构式为,故C正确;D项.没有表示C和Cl最外层所有的电子,故D错误;故选C。
3.BA. 晶体硅能导电,是制造太阳能电池和计算机芯片的主要材料,与其熔点高、硬度大没有关系,A错误;B. 氧化铝熔点高,常用于耐高温材料,B正确;C. 明矾溶于水能形成氢氧化铝胶体,可用于净水,不能用于自来水的杀菌消毒,C错误;D. 苏打溶液呈碱性,但碳酸钠具有腐蚀性,不能用作胃酸中和剂,D错误,答案选B。
4.AFe3+、Ba2+、NO3-、Cl-四种离子互相之间都不反应,所以可以大量共存,选项A正确。
酚酞变红色的溶液应该显碱性,不能存在大量的铵根离子,选项B错误。
铝离子和偏铝酸根离子会发生双水解反应得到氢氧化铝沉淀,所以不能大量共存,选项C错误。
由水电离产生的c(H+)=10-13mol/L,说明水的电离被抑制了,而CH3COO-对于水的电离应该起到促进作用,所以选项D错误。
5.C氨气不能用氯化钙干燥,因为会得到CaCl2·8NH3,选项A错误。
二氧化锰和浓盐酸需要在加热条件下反应才能得到氯气,选项B错误。
二氧化硫溶于水生成亚硫酸,亚硫酸是二元中强酸,酸性强于碳酸,所以二氧化硫会与碳酸氢钠溶液反应生成二氧化碳,达到除去二氧化硫杂质的目的,选项C正确。
2019届高考化学二轮复习压轴题热点练6晶胞的有关计算(含答案)

热点6 晶胞的有关计算1.某晶体的晶胞结构如图所示。
X(•)位于立方体顶点,Y位于立方体中心。
试分析:(1)晶体中每一个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式是____________。
(2)晶体中在每个X周围与它最近且距离相等的X共有________个。
(3)晶体中距离最近的2个X分别与1个Y形成的两条线的夹角为_______。
答案(1)4 8 XY2(或Y2X) (2)12 (3)109°28′解析(1)同时吸引的微粒个数即指在某微粒周围距离最近的其他种类的微粒个数,观察图可知,Y位于立方体的体心,X位于立方体的顶点,每个Y同时吸引着4个X,而每个X 同时被8个立方体共用,每个立方体的体心都有1个Y,所以每个X同时吸引着8个Y,X、Y的个数比为1∶2,所以化学式为XY2或Y2X。
(2)晶体中每个X周围与它最接近的X之间的距离应为如图所示立方体的面对角线。
位置关系分别在此X的上层、下层和同一层,每层均有4个,共有12个。
(3)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知该夹角为109°28′。
2.(1)单质O有两种同素异形体,其中沸点高的是________(填分子式),原因是________________________;O和Na的氢化物所属的晶体类型分别为________和________。
(2)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。
列式表示Al单质的密度____________g·cm-3(不必计算出结果)。
答案(1)O3O3相对分子质量较大,范德华力大分子晶体离子晶体(2)124×276.02×1023×(0.405×10-7)3解析(1)O元素形成O2和O3两种同素异形体,固态时均形成分子晶体,而分子晶体中,相对分子质量越大,分子间作用力越大,物质的沸点越高,故O3的沸点高于O2。
高中化学晶胞的相关计算专项训练知识点及练习题含答案

高中化学晶胞的相关计算专项训练知识点及练习题含答案一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。
(2)配合物K4Fe(CN)6的中心离子的价电子排布图为______,该中心离子的配位数是_______。
(3)1mol HCN分子中含有σ键的数目为_______,HCN分子中碳原子轨道杂化类型是_______,与CN-互为等电子体的阴离子是_______。
2019年高考化学二轮复习同步精选对点训练:晶胞的计算(含解析)
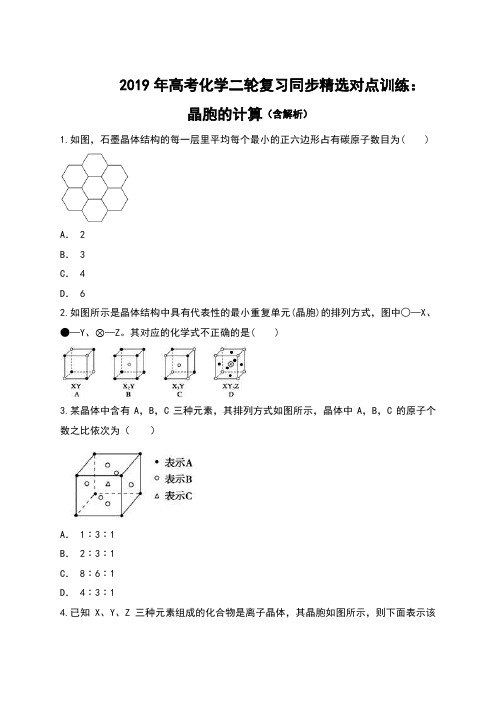
2019年高考化学二轮复习同步精选对点训练:晶胞的计算(含解析)1.如图,石墨晶体结构的每一层里平均每个最小的正六边形占有碳原子数目为( )A. 2B. 3C. 4D. 62.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中○—X、●—Y、⊗—Z。
其对应的化学式不正确的是( )3.某晶体中含有A,B,C三种元素,其排列方式如图所示,晶体中A,B,C的原子个数之比依次为()A. 1∶3∶1B. 2∶3∶1C. 8∶6∶1D. 4∶3∶14.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是( )A. ZXY3B. ZX2Y 6C. ZX4Y 8D. ZX8Y 125.氢是重要而洁净的能源。
要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。
化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为()A. LaNi5B. LaNiC. La14Ni24D. La7Ni126.已知某晶体由X、Y、Z三种元素组成的,其晶胞如图所示,则X、Y、Z三种元素的原子个数之比正确的是( )A. 1:3:1B. 2:6:1C. 4:8:1D. 8:1:17.某离子化合物的晶胞如图所示。
阳离子位于晶胞的中心,阴离子位于晶胞的8个顶点上,则该离子化合物阴、阳离子的个数比为 (A. 1∶8B. 1∶C. 1∶2D. 1∶18.最近发现了一种由金属原子M和非金属原子N构成的气态团簇分子,如图所示,顶角和面的原子是M原子,棱中心和体心的原子是N原子,它的分子式为( )A. M4N 4B. MNC. M14N 13D.条件不够,无法写出9.科学家发现钇钡铜氧化合物在90 K时具有超导性,若该化合物的结构如图所示,则该化合物的化学式可能是 ( )A. YBa2Cu3O8。
高中化学晶胞的相关计算专项训练专题复习附答案
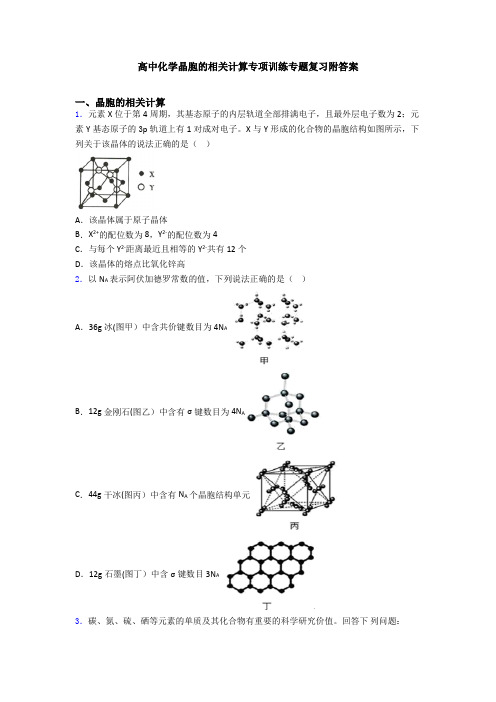
高中化学晶胞的相关计算专项训练专题复习附答案一、晶胞的相关计算1.元素X位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有1对成对电子。
X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是()A.该晶体属于原子晶体B.X2+的配位数为8,Y2-的配位数为4C.与每个Y2-距离最近且相等的Y2-共有12个D.该晶体的熔点比氧化锌高2.以N A表示阿伏加德罗常数的值,下列说法正确的是()A.36g冰(图甲)中含共价键数目为4N AB.12g金刚石(图乙)中含有σ键数目为4N AC.44g干冰(图丙)中含有N A个晶胞结构单元D.12g石墨(图丁)中含σ键数目3N A3.碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。
回答下列问题:(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。
(CN)2 中π键和σ键的数目之比为__________。
沸点:(CN)2__________ (SCN)2(填“大于”、“等于”或“小于”),理由是__________。
(2)无机含氧酸的通式可写成(HO)m RO n ,如果成酸元素 R 相同,则 n 值越大,R 的正电性越高,在水中越容易电离出 H +。
酸性强弱:HNO 2____________HNO 3(填“大于”、“等于”或“小于”);NO 2-中氮原子的杂化方式为___________。
(3)一种硒单质晶体的晶胞为六方晶胞,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶 体结构图和晶体结构俯视图如下所示。
已知正六棱柱的边长为 a cm ,高为 b cm ,N A 表示阿伏加德罗常数,则该晶体的密度为__________g·cm -3(用含 N A 、a 、b 的式子表示)。
4.浙江师范大学的研究团队研究获得了一类具有高活性和选择性的钙钛矿光催化剂(3CsPbBr Ni(tpy) ),这一成果发表在2020年1月Chem . Mater .上。
高考化学晶胞的相关计算专项训练(讲义及答案)及解析

高考化学晶胞的相关计算专项训练(讲义及答案)及解析一、晶胞的相关计算1.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
该合金储氢后,H2与 Ni 的物质的量之比为___________。
②Mg2NiH4 是一种储氢的金属氢化物。
在 Mg2NiH4晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。
Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。
晶体的密度为ρg·cm-3,N A表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 N A的代数式表示)。
2.国庆70周年阅兵式展示了我国研制的各种导弹。
导弹之所以有神奇的命中率,与材料息息相关,镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物(如砷化镓、磷化镓等)都是常用的半导体材料。
回答下列问题:(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]__。
(2)根据元素周期律,原子半径Ga__As,第一电离能Ga__As。
(填“大于”或“小于”)(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是__。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因:__。
晶胞的相关计算专项训练知识归纳总结及答案

晶胞的相关计算专项训练知识归纳总结及答案一、晶胞的相关计算1.氮及其化合物有许多用途。
回答下列问题:(1)基态Mn 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)3NCl 的沸点(71℃)比HCN 的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,3NCl 、2NH -、2NO -三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
(4)4Mn N (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm 。
该氮化锰的密度为-3g cm ⋅(列出计算式)。
________________________________________________________2.物质的组成与结构决定了物质的性质与变化。
回答下列问题:(1)基态铁原子简化的电子排布式为[Ar]___。
(2)硫酸镍溶于氨水形成[Ni(NH 3)6]SO 4蓝色溶液。
①[Ni(NH 3)6]SO 4中阴离子的立体构型是___。
②在[Ni(NH 3)6]2+中Ni 2+与NH 3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点高于膦(PH 3)的原因是___;PH 3分子中P 原子的杂化轨道类型为___。
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为___。
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是[SiO 4]四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链结构的多硅酸根,该多硅酸根的化学式为___(用n 代表聚合度)。
(5)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___,其晶体密度的计算表达式为___g·cm -3(阿伏加德罗常数的值用N A 表示)。
晶胞的相关计算专项训练(讲义及答案)附解析

晶胞的相关计算专项训练(讲义及答案)附解析一、晶胞的相关计算1.以N A表示阿伏加德罗常数的值,下列说法正确的是()A.36g冰(图甲)中含共价键数目为4N AB.12g金刚石(图乙)中含有σ键数目为4N AC.44g干冰(图丙)中含有N A个晶胞结构单元D.12g石墨(图丁)中含σ键数目3N A2.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
3.碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。
回答下列问题:(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。
(CN)2中π键和σ键的数目之比为__________。
06常考题空6有关晶胞参数的计算(附答案解析)-2023年高考化学大题逐空突破

10.(2021·广东卷)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成
(1)图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是______________
(2)图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为________;该晶胞中粒子个数比Hg∶Ge∶Sb=________
(3)设X的最简式的式量为Mr,则X晶体的密度为________________g·cm-3(列出算式)
3.(2022·湖南卷)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
(1)该超导材料的最简化学式为_______
(2)Fe原子的配位数为_______
(3)该晶胞参数a=b=0.4 nm、c=1.4 nm。阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3(列出计算式)
(2)若晶胞参数a=384.1 pm,Z晶体的密度为________(计算结果保留两位有效数字,已知3.8413≈56.67,阿伏加德罗常数的值为6.02×1023)
3.XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有________个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 。已知Xe—F键长为rpm,则B点原子的分数坐标为_______;晶胞中A、B间距离d=_______pm
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热点6 晶胞的有关计算1.某晶体的晶胞结构如图所示。
X (•)位于立方体顶点,Y位于立方体中心。
试分析:(1)晶体中每一个Y 同时吸引着________个X ,每个X 同时吸引着________个Y ,该晶体的化学式是____________。
(2)晶体中在每个X 周围与它最近且距离相等的X 共有________个。
(3)晶体中距离最近的2个X 分别与1个Y 形成的两条线的夹角为_______。
答案 (1)4 8 XY 2(或Y 2X) (2)12 (3)109°28′解析 (1)同时吸引的微粒个数即指在某微粒周围距离最近的其他种类的微粒个数,观察图可知,Y 位于立方体的体心,X 位于立方体的顶点,每个Y 同时吸引着4个X ,而每个X 同时被8个立方体共用,每个立方体的体心都有1个Y ,所以每个X 同时吸引着8个Y ,X 、Y 的个数比为1∶2,所以化学式为XY 2或Y 2X 。
(2)晶体中每个X 周围与它最接近的X 之间的距离应为如图所示立方体的面对角线。
位置关系分别在此X 的上层、下层和同一层,每层均有4个,共有12个。
(3)若将4个X 连接,构成1个正四面体,Y 位于正四面体的中心,可联系CH 4的键角,知该夹角为109°28′。
2.(1)单质O 有两种同素异形体,其中沸点高的是________(填分子式),原因是________________________;O 和Na 的氢化物所属的晶体类型分别为________和________。
(2)Al 单质为面心立方晶体,其晶胞参数a =0.405 nm ,晶胞中铝原子的配位数为________。
列式表示Al 单质的密度____________g·cm -3(不必计算出结果)。
答案 (1)O 3 O 3相对分子质量较大,范德华力大 分子晶体 离子晶体 (2)124×276.02×1023×(0.405×10-7)3解析 (1)O 元素形成O 2和O 3两种同素异形体,固态时均形成分子晶体,而分子晶体中,相对分子质量越大,分子间作用力越大,物质的沸点越高,故O 3的沸点高于O 2。
O 元素形成的氢化物有H 2O 和H 2O 2,二者均能形成分子晶体。
Na 元素形成的氢化物为NaH ,属于离子晶体。
(2)面心立方晶胞中粒子的配位数是12。
一个铝晶胞中含有的铝原子数为8×18+6×12=4(个),一个晶胞的质量为46.02×1023×27g ,再利用密度与质量、晶胞参数a 的关系即可求出密度,计算中要注意1 nm =10-7cm 。
3.氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
(1)ZnO 是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。
不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为____________,某种ZnO 晶体的晶胞如图1所示,O 2-的配位数为________。
(2)图2是氮化镓的晶胞模型。
其中镓原子的杂化方式为________杂化,N 、Ga 原子之间存在配位键,该配位键中提供电子对的原子是____________。
氮化镓为立方晶胞,晶胞边长为a pm ,若氮化镓的密度为ρ g ·cm-3,则氮化镓晶胞边长的表达式a =________pm(设N A 表示阿伏加德罗常数的值)。
答案 (1)8(2)sp 3N3168N A ·ρ×1010解析 (1)锌提供空轨道,OH -中的O 提供孤电子对,形成配位键,结构示意图是:或,离子晶体配位数,是周围最近的异性离子的个数,即O 2-最近的Zn 2+有8个。
(2)根据晶胞,镓有4个共价键,因此镓的杂化类型为sp 3,形成配位键,金属提供空轨道,非金属提供孤电子对,因此提供电子对的原子是N ;根据晶胞的结构,Ga 的个数为8×18+1=2,N 原子的个数为1+4×14=2,晶胞的质量为2×84N Ag ,设晶胞的边长为a pm ,晶胞的体积为(a ×10-10)3cm 3,根据密度的定义,即a =3168N A ·ρ×1010pm 。
4.根据晶胞结构示意图,计算晶胞的边长或密度。
(1)N 和Cu 元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为________。
该化合物的相对分子质量为M ,N A 为阿伏加德罗常数的值。
若该晶胞的边长为a pm ,则该晶体的密度是________g ·pm -3。
(2)S 与Cu 形成化合物晶体的晶胞如图所示。
已知该晶体的密度为a g ·cm -3,则该晶胞的体积为________cm 3(N A 表示阿伏加德罗常数的值)。
答案 (1)Cu 3NM N A a 3 (2)384aN A解析 (1)该晶胞中N 原子个数=8×18=1,Cu 原子个数=12×14=3,所以其化学式为Cu 3N ,晶胞的边长为a pm ,其体积为a 3 pm 3,密度=MN A V =M N A a3 g ·pm -3。
(2)该晶胞含Cu :8×18+6×12=4,S 原子个数为4,因此化学式为CuS ,晶胞体积V =m ρ=4×(64+32)N A ×ρ=384aN Acm 3。
5.O 和Na 能够形成化合物F ,其晶胞结构如图所示,晶胞参数a =0.566 nm ,F 的化学式为__________;晶胞中O 原子的配位数为________;列式计算晶体F 的密度__________________________________(单位为g·cm -3)。
答案 Na 2O 84×62 g ·mol -1(0.566×10-7 cm )3×6.02×1023 mol-1≈2.27 g ·cm -3解析 由示意图可知:小黑球8个全部在晶胞内部,大灰球数有8×18+6×12=4个。
根据钠和氧的化合价,可知大灰球代表氧原子,小黑球代表钠原子。
则该物质的化学式为Na 2O ,且一个晶胞中有4个Na 2O 。
根据密度公式ρ=m V =4×62 g ·mol -1(0.566×10-7 cm )3×6.02×1023 mol-1≈2.27 g ·cm -3。
6.硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为________;若该晶胞密度为ρ g ·cm -3,硒化锌的摩尔质量为M g ·mol -1。
N A 代表阿伏加德罗常数,则晶胞参数a 为________pm 。
答案 434M N A ρ×1010解析 根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为8×18+6×12=4,含有锌原子数为4,根据ρ=m V =4MN AV ,所以V =4M ρN A ,则晶胞的参数a =34M N A ρ cm =34M N A ρ×1010pm 。
7.某镍白铜合金的立方晶胞结构如图所示。
(1)晶胞中铜原子与镍原子的数量比为________________。
(2)若合金的密度为d g ·cm -3,晶胞参数a =______________nm 。
答案 (1)3∶1 (2)32516.02×1023×d×107解析 (1)晶胞中含Cu 原子数为12×6=3,含Ni 原子数为18×8=1,两者数量比为3∶1。
(2)由题意可得:d =3×64+59(a ×10-7)3×6.02×1023,解得a =32516.02×1023×d×107nm 。
8.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
回答下列问题: (1)GaF 3的熔点高于1000 ℃,GaCl 3的熔点为77.9 ℃,其原因是___________ ______________________________________________。
(2)GaAs 的熔点为1238 ℃,密度为ρ g ·cm -3,其晶胞结构如图所示。
该晶体的类型为____________,Ga 与As 以________键键合。
Ga 和As 的摩尔质量分别为M Ga g ·mol -1和M As g ·mol -1,原子半径分别为r Ga pm 和r As pm ,阿伏加德罗常数值为N A ,则GaAs 晶胞中原子的体积占晶胞体积的百分率为___________。
答案 (1)GaF 3为离子晶体,GaCl 3为分子晶体(2)原子晶体 共价 4π×10-30N A ρ(r 3Ga +r 3As )3(M Ga +M As )×100%解析 (1)GaF 3、GaCl 3的熔点相差较大,是因为晶体类型不同,GaF 3熔点高,为离子晶体,而GaCl 3的熔点低,为分子晶体。
(2)GaAs 为原子晶体,Ga 和As 之间以共价键键合。
该晶胞中原子个数:Ga 为4个,As 为8×18+6×12=4个,晶胞中原子所占体积为43π(r 3Ga +r 3As )×4 pm 3;则GaAs 晶胞中原子的体积占晶胞体积的百分率为43π(r 3Ga +r 3As )×4×10-304(M Ga +M As )ρ×N A×100%=4π×10-30N A ρ(r 3Ga +r 3As )3(M Ga +M As )×100%。
