2016 材料化学复习题
《材料化学》复习题

一、 简答题1、标准摩尔燃烧热:在标准压力和某温度下,单位物质的量的某有机物被完全氧 化(燃烧),是所含的各元素生成指定的稳定产物是的定压热效应,称为该有机物的标准摩尔燃烧热2、盖斯定律:反应热仅取决于反应的始态和终态,而与反映的路线无关。
3、反应热效应:在热化学中,当体系的始态和终态温度相同,而且在反应过程中只做体积功时,发生化学反应所吸收或放出的热。
4、标准摩尔熵:在标准状态下,单位物质的量的物质B 在T 时的熵值。
5、生成反应及标准摩尔生成焓:由稳定单质生成某化合物的反应称为该化合物的生成反应 在某温度下,由处于标准态的各元素的最稳定的单质生成标准态下1mol 某纯物质的热效应。
6、化学势)(,,)(B j n P T BB j n G ≠∂∂=μ的含义:当熵、体积及除B 组分外其他各物质的量(n j )均不变时,增加dn B 的B 种物质则相应的增加内能dU. 7、偏摩尔量≠∂=∂j B ,m T ,P ,n (j B )B G G ()n 的含义:组分B 的各偏摩尔量,实际就是定温定压下加入1molB 于大量的均匀体系中该量的增加。
8、相律:表达相平衡体系中相数(ϕ)、独立组分数(c )和自由度数(f )及影响平衡的外界因素的定量关系式。
9、一级相变:当处于平衡状态的两相,其吉布斯自由能对p 或t 的一级导数不相等的相变。
10、二级相变及其特点:若两相的吉布斯自由能对温度或压力的一级导数相等,但二级导数发生不连续变化的相变。
特点:没有体积变化、没有相变潜热、αv 、k T 和c p 发生变化。
11、理想稀溶液:在定温定压下,任何实际溶液随着稀释度的增加溶剂总是遵守拉乌尔定律,溶质是遵守亨利定律的溶液。
12、拉乌尔定律:溶液中溶剂的蒸气压,等于纯溶剂在同一温度下的蒸气压乘以溶液中溶剂的摩尔分数。
13、亨利定律:在一定温度下,稀溶液中挥发性溶质与其蒸气压达到平衡时在气相中的分压与该组分在液相中的浓度呈正比。
材料化学第1章练习题

10. 晶面间距 对于正交晶系: 1
dhkl
h2 k2 l2 a2 b2 c2
立方晶系
dhkl
a0 h2 k2 l2
Chapter5 Preparation of Materials
3
晶体和非晶体 .
6.晶体:
是一种内部粒子(原子、分子或离子)或粒子集团 在空间Байду номын сангаас照一定规律周期性重复排列而形成的固体 物质。 特点:长程有序
非晶体:原子、分子或离子无规则地堆积在一起所形成。 特点:短程有序、长程无序。
7. 晶胞(unit cell): 构成晶格的最基本的几何单元 晶胞二要素:
(1) 晶胞的大小和形状——用晶胞参数来表示。
a、b、c : 确定晶胞大小;、、 : 确定晶胞形状. (2) 晶胞所含内容——晶胞内原子的种类、数量、位置.
晶胞中原子的位置,用原子的分数坐标来表示 .
Chapter5 Preparation of Materials
2
8.晶向指数的确定:[uvw] 9.晶面指数的确定:(hkl) 数字hkl是晶面在三个坐标轴(晶轴)上截距(r, s, t)的 倒数的互质整数比。
1.材料化学是关于材料 结构、性能、制备和应用 的化学. 2.材料化学的特点是: 跨学科性 和实践性 . 3.材料按照按组成、结构特点分为 金属材料、无机非金属材料、高分子材料 、复合材料。
4. 金属键的特点是: ①电子共有化 , ②既无方向性又无饱和性
离子键的特点: 无饱和性和无定向性 共价键的特点:饱和性和定向性 5. 根据固态物质原子或分子聚集态的不同,可以分为
材料化学考试题库

材料化学复习题一、概念1.键能与点阵能键能:在标准条件下将1mol 的气态AB 分子中的化学键断开,使每个AB 分子离解成2个中性气态原子A+B 所需的能量。
点阵能:1mol 气态的M Z+和X Z-离子生成1mol MX 晶体时所释放出的总能量称为离子晶体的点阵能,又称为晶格能。
2 删除不考 34.PVD 与CVDPVD :用物理过程制备薄膜的方法称为物理气相沉积法CVD :形成的薄膜材料除了原材料的组成元素外,还在基片上产生与其它组分的化学反应,获得与原成分不同的薄膜材料,这种有化学反应的气相沉积称为化学气相沉积5.热平衡等离子体与非平衡等离子体热平衡等离子体:Te =Ti 时称为热平衡等离子体,简称为热等离子体。
特点:电子温度高,重粒子温度也高。
实际上,所谓完全热平衡状态是不能达到的。
实际上比较容易形成的是各种粒子的温度几乎近似相等(Tg Ti Te ≈≈),组成也接近平衡组成的等离子体,这叫做局域热力学平衡态(LTE 态等离子体),实际使用的LTE 态等离子体在温度约为k 43102~105⨯⨯,且压力>Pa 410条件下产生的。
非平衡等离子体:Te >>Ti特点:电子温度高达k 410以上,离子和原子之类重粒子温度都可低到k 500~300、一般压力<Pa 210下形成。
按其重粒子温度也叫做低温等离子体(cold plasima )。
6.弛豫界面与重构界面弛豫界面:固体表面层之间以及表面和体内原子层之间的垂直距离偏离固体内部的晶格常数,而其晶胞结构基本不变,这种情况称为弛豫重构界面:是指表面原子层在水平方向上的周期性不同于体内,但重直方向的层间间距与体内相同。
7.等离子体与等离子体鞘等离子体:气体分子电离产生的带电粒子密度达到一定数值时,这种电离气体是有别于普通气体的一种新的物质聚集态,列为物质的第四态。
无论气体是部分电离还是完全电离,其中的正负电荷总数在数值上总是相等的,故称为等离子体。
材料化学试题库..

一填空题(1)材料是具有使其能够用于机械、结构、设备和产品性质的物质。
这种物质具有一定的性能或功能。
(2)材料按照化学组成、结构一般可分为金属材料、无机非金属材料、聚合物材料和复合材料。
(3)材料按照使用性能可分为结构材料和功能材料。
结构材料更关注于材料的力学性能;而另一种则考虑其光、电、磁等性能。
(4)材料化学是关于材料的结构、性能、制备和应用的化学。
(5)一般材料的结构可分为三个层次,分别是微观结构、介观结构和宏观结构。
(6)对于离子来说,通常正离子半径小于相应的中性原子,负离子的半径则变大。
(7)晶体可以看成有无数个晶胞有规则的堆砌而成。
其大小和形状由晶轴(a,b,c)三条边和轴间夹角(α,β,γ)来确定,这6个量合称晶格参数。
(8)硅酸盐基本结构单元为硅氧四面体,四面体连接方式为共顶连接。
(9)晶体的缺陷按照维度划分可以分为点缺陷、线缺陷、面缺陷和体缺陷,其延伸范围为零维、一维、二维和三维。
(10)位错分为韧型位错、螺型位错以及由前两者组成的混合位错三种类型.(11)固溶体分为置换型固溶体和填隙型固溶体,前者溶质质点替代溶剂质点进入晶体结点位置;后者溶质质点进入晶体间隙位置。
(12)材料热性能主要包括热容、热膨胀和热传导。
(13)材料的电性能是指材料被施加电场时的响应行为,包括有导电性、介电性、铁电性和压电性等。
(14)衡量材料介电性能的指标为介电常数、介电强度和介电损耗。
(15)磁性的种类包括:反磁性、顺磁性、铁磁性、反铁磁性和铁氧体磁性等。
(16)铁磁材料可分为软磁材料、硬磁材料和矩磁材料。
(17)材料的制备一般包括两个方面即合成与控制材料的物理形态.(18)晶体生长技术主要有熔体生长法和溶液生长法,前者主要包括有提拉法、坩埚下降法、区融法和焰融法等。
(19)溶液达到过饱和途径为:一,利用晶体的溶解度随改变温度的特性,升高或降低温度而达到过饱和;二,采用蒸发等办法移去溶剂,使溶液浓度增高.(20)气相沉积法包括物理气相沉积法PVD和化学气相沉积法CVD。
材料化学复习题

材料化学第二章化学基础知识一、填空题1.热力学第三定律的具体表述为纯物质完美晶体在0K时的熵值为零,数学表达式为S*(T)=0 J·K-1。
2.理想稀溶液存在依数性质,即溶剂的蒸气压下降、凝固点降低、沸点升高、渗透压的量值均与溶液中溶质的数量有关,而与溶质的种类无关。
3.人们将存在于两相间厚度为几个分子大小的薄层称为界面层,简称界面,有液-气、固-气、固-液、液-液、固-固界面,通常把固-气界面及液-气界面称为表面。
4.表面张力一般随温度和压力的增加而降低。
5.按照氧化态、还原态物质的状态不同,一般将电极分成第一类电极(金属电极、气体电极)、第二类电极(金属-难溶盐电极、金属-难溶氧化物电极)、氧化还原电极三类。
6.相律是描述相平衡系统中自由度、组分数、相数之间关系的法则。
其有多种形式,其中最基本的是吉布斯相律,其通式为f=c-p+2。
二、名词解释1.拉乌尔定律气液平衡时,稀溶液中溶剂A在气相中的蒸气压pA等于同一温度下该纯溶剂的饱和蒸气压与溶液中溶剂的摩尔分数xA的乘积2.基元反应反应物生成生成物的中间步骤反应称为基元反应3.稳态近似处理假设中间物浓度不随时间变化而改变的处理方法4.相图相图(phase diagram)又称平衡状态图,是用几何(图解)的方式来描述处于平衡状态下,物质的成分、相和外界条件相互关系的示意图三、简答题1.简述物理吸附与化学吸附的区别。
第三章材料的制备一、填空题1.熔体生长法主要有提拉法、坩埚下降法、区熔法、焰熔法等。
2.物理气体沉积法是利用高温热源将原料加热,使之汽化或形成等离子体,在基体上冷却凝聚成各种形态的材料(如晶须、薄膜、晶粒等)的方法。
其中以阴极溅射法、真空蒸镀较为常用。
3.PECVD所采用的等离子种类有辉光放电等离子体、射频等离子体、电弧等离子体。
4.固相反应按反应物状态不同为纯固相反应、气固相反应、液固相反应及气液固相反应,按反应机理不同分为扩散控制过程、化学反应速度控制过程、晶核成核速率控制过程和升华控制过程等,按反应性质分为为氧化反应、还原反应、加成反应、置换反应和分解反应。
《材料化学》考试试题

1、什么是材料化学?其主要特点是什么?答:材料化学是与材料相关的化学学科的一个分支,是与材料的结构、性质、制备及应用相关的化学。
材料化学的主要特点是跨学科性和实践性2、一些物理量在元素周期表中规律,答:电离势同一周期的主族元素从左到右增大,稀有气体最大;同一周期的副族元素从左到右略有增加。
同一主族,从上到下减小;同一副族从上到下呈无规则变化。
电子亲和势同周期从左到右大体上增加,同族元素变化不大。
电负性同周期从左到右变大,同主族从上到下减小。
材料中的结合键有哪几种?各自的特点如何?对材料的特性有何影响?3、原子间结合键有哪些,怎么分类?答:依据键的强弱可分为主价键和次价键。
主价键是指两个或多个原子之间通过电子转移或电子共享而形成的键合,即化学键;主要包括离子键、共价键和金属键。
次价键如范德华键是一种弱的键合力,是物理键,氢键也是次价键。
4、谈谈化学锈蚀和电化学锈蚀的各自特点和机理。
答:化学锈蚀是指金属与非电解质接触时,介质中的分子被金属表面所吸附并分解成原子,然后与金属原子化合,生成锈蚀产物。
可以利用致密氧化膜的保护特性。
电化学锈蚀原理与金属原电池的原理相同。
即当两种金属在电解质溶液中构成原电池时,作为原电池负极的金属就会被锈蚀。
在金属材料上外加较活泼的金属作为阳极,而金属材料作为阴极,电化学腐蚀时阳极被腐蚀金属材料主体得以保护。
5、如何防止或减轻高分子材料的老化?答:在制造成品时通常都要加入适当的抗氧化剂和光稳定剂(光屏蔽剂、紫外线吸收剂、猝灭剂)可提高其抗氧化能力。
6、试解释为何铝材不易生锈,而铁则较易生锈?答:铝在空气中可以生成致密得氧化物膜,阻止与空气得进一步接触,所以不易生锈;铁在空气中生成疏松得氧化物膜,不能隔绝空气,特别是铁在潮湿得空气中能够发生电化学反应,因此加大了锈蚀,所以铁较易生锈。
7、谈谈热膨胀系数相关知识。
答:热膨胀系数分线膨胀系数和体膨胀系数。
不同材料的膨胀系数不同。
金属和无机非金属的膨胀系数较小,聚合物材料的膨胀系数较大。
材料化学考试试题重点

材料化学考试试题重点 The latest revision on November 22, 20201、什么是材料化学其主要特点是什么答:材料化学是与材料相关的化学学科的一个分支,是与材料的结构、性质、制备及应用相关的化学。
材料化学的主要特点是跨学科性和实践性2、一些物理量在元素周期表中规律,答:电离势同一周期的主族元素从左到右增大,稀有气体最大;同一周期的副族元素从左到右略有增加。
同一主族,从上到下减小;同一副族从上到下呈无规则变化。
电子亲和势同周期从左到右大体上增加,同族元素变化不大。
电负性同周期从左到右变大,同主族从上到下减小。
材料中的结合键有哪几种各自的特点如何对材料的特性有何影响3、原子间结合键有哪些,怎么分类答:依据键的强弱可分为主价键和次价键。
主价键是指两个或多个原子之间通过电子转移或电子共享而形成的键合,即化学键;主要包括离子键、共价键和金属键。
次价键如范德华键是一种弱的键合力,是物理键,氢键也是次价键。
4、谈谈化学锈蚀和电化学锈蚀的各自特点和机理。
答:化学锈蚀是指金属与非电解质接触时,介质中的分子被金属表面所吸附并分解成原子,然后与金属原子化合,生成锈蚀产物。
可以利用致密氧化膜的保护特性。
电化学锈蚀原理与金属原电池的原理相同。
即当两种金属在电解质溶液中构成原电池时,作为原电池负极的金属就会被锈蚀。
在金属材料上外加较活泼的金属作为阳极,而金属材料作为阴极,电化学腐蚀时阳极被腐蚀金属材料主体得以保护。
5、如何防止或减轻高分子材料的老化答:在制造成品时通常都要加入适当的抗氧化剂和光稳定剂(光屏蔽剂、紫外线吸收剂、猝灭剂)可提高其抗氧化能力。
6、试解释为何铝材不易生锈,而铁则较易生锈答:铝在空气中可以生成致密得氧化物膜,阻止与空气得进一步接触,所以不易生锈;铁在空气中生成疏松得氧化物膜,不能隔绝空气,特别是铁在潮湿得空气中能够发生电化学反应,因此加大了锈蚀,所以铁较易生锈。
7、谈谈热膨胀系数相关知识。
材料化学练习题

材料化学练习题材料化学是研究材料结构、性质和制备方法的一门学科。
在实践中,我们经常会遇到一些与材料化学相关的问题。
本文将为您提供一些材料化学的练习题,以帮助您巩固知识和提升解题能力。
题目一:金属材料1. 金属最显著的特点是什么?请解释其原因。
2. 金属材料的导电性较好,请解释为什么金属具有良好的导电性。
3. 铝是一种常见的金属材料。
请列举铝的几个重要特点。
题目二:聚合物材料1. 什么是聚合物?请简要解释聚合物的结构和性质。
2. 聚合物材料有许多重要应用,请列举几个聚合物材料的应用领域。
3. 聚合物材料的强度和韧性之间存在着一种权衡关系,请简要解释这种关系。
题目三:无机非金属材料1. 请列举几种常见的无机非金属材料,并简要说明每种材料的特点。
2. 陶瓷是一种重要的无机非金属材料,请解释陶瓷具有的一些独特特性。
3. 玻璃是一种特殊的无机非金属材料,请列举几种制备玻璃的方法。
题目四:材料分析方法1. 介绍一种常见的材料表征方法,并解释其原理。
2. X射线衍射(XRD)是一种常用的材料分析方法,请解释XRD 在材料研究中的应用。
3. 扫描电子显微镜(SEM)是一种常用的材料表征方法,请解释SEM的工作原理和应用。
题目五:材料制备方法1. 熔融法是一种常见的材料制备方法,请解释熔融法的基本原理和应用领域。
2. 沉积法是一种常用的材料制备方法,请解释沉积法的工作原理和几种常见的沉积法。
3. 气相沉积法是一种用于制备薄膜材料的方法,请解释气相沉积法的原理和应用。
题目六:材料性能测试1. 介绍一种常见的材料性能测试方法,并解释其原理。
2. 冲击试验是一种常用的材料性能测试方法,请解释冲击试验的原理和应用。
3. 硬度测试是一种常见的材料性能测试方法,请列举几种常用的硬度测试方法。
这些练习题涵盖了金属材料、聚合物材料、无机非金属材料、材料分析方法、材料制备方法以及材料性能测试等方面的知识点。
通过解答这些问题,您将能够更好地理解和应用材料化学的知识,提升自己的学习水平。
材料化学试卷含答案

一、填空题(本大题共8小题,每空1分,共25分)1. 材料的种类繁多,性能千差万别,应用领域也十分广泛。
若按照材料的使用性能可将其分为结构材料和功能材料两大类,前者主要利用材料的力学性能,后者则主要利用材料的物理和化学性能。
2. 杂质使半导体的电学性质发生显著变化。
单晶硅中掺杂质Ga和As元素后,能得到不同类型的半导体,由空穴迁移导电的称p型半导体,由电子移动导电的则成为n型半导体。
n型半导体和p型半导体的结合处称为p-n结,它使电流单向导通。
3.组织工程三要素是指:种子细胞、支架、信号因子。
4. 现在研究表明,1912年泰坦尼克号豪华轮船船体钢材因S、P 含量过高不耐低温,故在北海与冰山相撞发生脆性断裂以致迅速沉没。
如果钢材中添加13%的Ni ,或者直接采用面心立方结构的铝合金或奥氏体不锈钢,该惨剧可能不会发生。
5. 形状记忆效应实质上是在温度和应力作用下合金内部热弹性马氏体形成、变化、消失的相变过程的宏观表现。
6.各向异性材料的硬度取决于物质中存在的化学键中最弱的键,而熔点和化学反应性则取决于化学键中最强的键。
7合材料中,通常有一相为连续相,称为基体;另一相为分散相相,称为增强材料(或增强体);两相之间存在着相界面。
8. 非晶态金属材料同时具有高强度、高韧性的力学性能。
二、单选题(本大题共8小题,每题2分,共16分)1. 具有立方面心立方结构、晶格间隙较大,碳容量较多的是:( B )A、α-FeB、γ-FeC、δ-FeD、FeC2. 下列光纤材料中抗弯曲和冲击性能最好的是:( D )A、石英光纤B、多元氧化物光纤C、晶体光纤D、聚合物光纤3. 有机化学实验室电动搅拌的搅拌头所用的材料是:( D )A、PPB、ABSC、PPOD、PTFE4. 享有“第三金属”和“未来的金属”的称号的是:( C )A、铝合金B、铁锰铝合金钢C、钛合金D、奥氏体不锈钢5. 下列陶瓷中,硬度最大是:( A )A、BNB、Al2O3C、ZrO2D、ZnO26. 下列哪种检测仪器的发明首先为人类直接观察和操纵原子和分子提供了有力工具:( D )A、TEMB、SEMC、STMD、AFM7. 我国在东汉制造出了( B ),她是中国文化的象征,极大地促进了世界文明。
材料化学期末复习参考题

材料化学期末复习参考题试卷总结材料化学一、多项选择题(每题2分)1.晶体的特性是(b)(a)有一个明确的熔点,没有各向异性;(b)具有一定的熔点和各向异性;(c)没有明确的熔点和各向异性;(d)没有明确的熔点,没有各向异性;2.一般来说,如果金属的粒度很细,那么(a)。
(a)金属的强度高,塑性好,韧性好。
(b)金属的强度高,塑性好,韧性差。
(c)金属的强度高,塑性差,韧性好。
(d)金属的强度低,塑性好,韧性好。
3.高温下从熔融的盐溶剂中生长晶体的方法称为(c)。
a、溶液法B、水热法C、溶剂法D、熔融法4根据晶体对称性,可将晶体分为(D)大晶体体系。
a、 32b、14c、11d、75。
单元格必须是a:(c)。
a、八面体b、六方柱体c、平行六面体d、正方体6.某晶体外型为正三棱柱,问该晶体属于(d)晶系a.立方b.三方c.四方d.六方7.中国河南商代遗址出土的四木屋鼎重8750牛顿,是世界上最古老的大型(c)鼎。
(a)石头(b)瓷器(c)青铜(d)铁8。
晶体中的位错是(b)的一种。
(a)点缺陷(b)线缺陷(c)面缺陷(d)间隙原子9.工程材料一般可分为(d)等四大类。
(a)金属、陶瓷、塑料、复合材料(b)金属、陶瓷、塑料、非金属材料(c)钢、陶瓷、塑料、复合材料(d)金属、陶瓷、聚合物材料、复合材料10通过特殊方法将固体材料加工成纳米(1-100nm)超细粉末颗粒,然后制备纳米材料。
以下分散体系中分散体的粒径与该颗粒的数量级相同(c)a.溶液b.悬浊液c.胶体d.乳浊液11.美国《科学》杂志评选出2001年十大科技成就。
纳米电子排名第一。
其中,美国的IBM科学家制造了第一批碳纳米管晶体管,并发明了利用电子的波特性传输信息的“导线”。
众所周知,纳米材料是指粒径为1nm~100nm的材料。
以下陈述是正确的(b)a.纳米碳管是一种新型的高分子化合物b.纳米碳管的化学性质稳定c.纳米碳管导电属于化学变化d.纳米碳管的结构和性质与金刚石相同12.晶行沉淀陈化的目的是(c)完全的降水b去除混晶C小颗粒长大,这意味着沉淀更纯净,D形成更细的晶体13.晶族、晶系、点群、布拉菲格子、空间群的数目分别是(a)a3,7,32,14,230b3,720,15,200c3,5,32,14,230d3,7,32,14,20014.晶体与非晶体的根本区别是:(a)a、晶体具有长程有序,而不是长程无序和短程有序。
材料化学复习题填空版

第一章材料高温化学一、选择题1、纯物质的自由能G决定于以下因素:()A、物质的化学性质,B、物质数量,C、物质的聚集状态,D、温度和压力。
2、二元系溶体的自由能和()有关。
A、相,B、温度,C、压力,D、构成溶体的两种物质的相对量。
3、自蔓燃合成按原料组成可以分为()A、铝热剂型,B、元素粉末型,C、固体-固体型,D、混合型4、自蔓燃合成按反应形态可以分为()A、固体一气体反应,B、固体一液体反应,C、固体一固体反应,D、混合型二、填空题1、金属冶炼方法分为两种:一种是利用水溶液的________,另一种是利用高温化学反应的______。
冶炼时,通常用________的两相之间的________来完成分离过程。
2、纯物质的自由能G决定于以下因素:________________,___________,____________,_____________。
3、摩尔自由能是_________一定时,所研究的某相中物质的固有量,有时又叫_____。
4、自由能由___和___两部分组成。
5、液体的蒸气压随温度升高而________;压力降低时,气体化学势曲线的_______。
6、T b温度下单位压力的气体和液体处于平衡,该温度称为________。
7、对于气体,物质的标准化学势仅是温度的函数,纯物质的化学势是____和____的函数。
8、两种或两种以上成分构成的相叫做____,包括____和_____。
9、二元系溶体的自由能不但和相、温度及压力有关,而且取决于_______________________。
10、区域精炼工艺通常把金属棒_____,在容器中完成精炼过程。
11、在某一给定温度下,决定两个互不相溶的液体的物质分配平衡位置的因素是物质在两种溶液中的___________。
12、在氧、氢以及其他混合气体气氛中,根据________、_________、____及______等影响因素的不同,有些金属被氧化,有些金属不被氧化。
材料化学-第一章习题及答案

第一章习题1、什么是材料化学?其主要特点是什么?(15分)答:材料化学是研究材料的制备、组成、结构、性质及其应用的一门科学。
又称为固体化学。
既是材料科学的一个重要分支,也是材料科学的核心内容。
同时又是化学学科的一个组成部分。
材料化学是最近几十年发展并形成的化学科学的重要分支。
是无机化学、有机化学、物理化学、材料物理、晶体结构和材料科学等多学科的交叉领域,因此材料化学具有明显的交叉学科、边缘学科的性质。
已成为当前材料科学与工程学科中一个十分活跃的新兴分支学科。
2、新石器时代的标志是什么?(10分)答:新石器时代的标志:磨制石器的出现、陶器的出现、原始农业、畜牧业和手工业的出现。
3、材料与试剂的主要区别是什么?(15分)材料是人类用于制造物品、器件、构件、机器或其他产品的那些物质。
材料是物质,但不是所有物质都称为材料。
燃料和化学原料、工业化学品、食物和药物,一般都不算作材料,往往称为原料。
但这个定义并不严格,如炸药、固体火箭推进剂,一般称之为“含能材料”,因为它属于火炮或火箭的组成部分。
材料总是和一定的使用场合相联系,可由一种或若干种物质构成。
同一种物质,由于制备方法或加工方法不同,可成为用途迥异的不同类型和性质的材料。
试剂,又称生物化学试剂或试药。
主要是实现化学反应、分析化验、研究试验、教学实验、化学配方使用的纯净化学品。
一般按用途分为通用试剂、高纯试剂、分析试剂、仪器分析试剂、临床诊断试剂、生化试剂、无机离子显色剂试剂等。
4、人类照明可以简单地说,经历了太阳光、篝火、油灯、蜡烛、电气照明、白炽灯、荧光灯、三基色节能灯直到今天LED照明的发展过程,尤其是发白光LED灯的发明,大幅提高了人类的照明效率。
试着查阅文献,简述白色LED灯的发光原理和所需要的材料组成,并列出引用的文献。
(25分)它是半导体二极管的一种,可以把电能转化成光能。
发光二极管与普通二极管一样是由一个PN结组成,也具有单向导电性。
当给发光二极管加上正向电压后,从P区注入到N区的空穴和由N区注入到P区的电子,在PN结附近数微米内分别与N区的电子和P区的空穴复合,产生自发辐射的荧光。
材料化学复习习题

第一章材料高温化学一、选择题1、纯物质的自由能G决定于以下因素:(ABCD)A、物质的化学性质,B、物质数量,C、物质的聚集状态,D、温度和压力。
2、二元系溶体的自由能和(ABCD)有关。
A、相,B、温度,C、压力,D、构成溶体的两种物质的相对量。
3、自蔓燃合成按原料组成可以分为(ABD)A、铝热剂型,B、元素粉末型,C、固体-固体型,D、混合型4、自蔓燃合成按反应形态可以分为(ABC)A、固体一气体反应,B、固体一液体反应,C、固体一固体反应,D、混合型二、填空题1、金属冶炼方法分为两种:一种是利用水溶液的湿法冶炼,另一种是利用高温化学反应的干法冶炼。
冶炼时,通常用互不相混的两相之间的分配差来完成分离过程。
2、纯物质的自由能G决定于以下因素:物质的化学性质,物质数量,物质的聚集状态,温度和压力。
3、摩尔自由能是温度、压力一定时,所研究的某相中物质的固有量,有时又叫化学势。
4、自由能由焓和熵两部分组成。
5、液体的蒸气压随温度升高而增大;压力降低时,气体化学势曲线的斜度变大。
6、T b温度下单位压力的气体和液体处于平衡,该温度称为标准沸点。
7、对于气体,物质的标准化学势仅是温度的函数,纯物质的化学势是温度和压力的函数。
8、两种或两种以上成分构成的相叫做溶体,包括溶液和固溶体。
9、二元系溶体的自由能不但和相、温度及压力有关,而且取决于构成溶体的两种物质的相对量。
10、区域精炼工艺通常把金属棒横放,在容器中完成精炼过程。
11、在某一给定温度下,决定两个互不相溶的液体的物质分配平衡位置的因素是物质在两种溶液中的最终浓度比。
12、在氧、氢以及其他混合气体气氛中,根据气体成分、组成比、温度及压力等影响因素的不同,有些金属被氧化,有些金属不被氧化。
13、内氧化发生与否,在很大程度上取决于合金中成分元素的种类以及氧的扩散速度,不能单凭热力学分析来确定。
14、自蔓燃合成按原料组成可以分为元素粉末型、铝热剂型、混合型。
材料化学复习题和答案

一名词解释1 晶体:是内部质点在三维空间呈周期性重复排列的固体。
2 点缺陷:它是在结点上或邻近的微观区域内偏离晶体结构的正常排列的一种缺陷。
3线缺陷:指二维尺度很小而第三维尺度很大的缺陷,其特征是两个个方向尺寸上很小另外两个方向延伸较长,也称一维缺陷,集中表现形式是位错,由晶体中原子平面的错动引起4 面缺陷:指二维尺度很大而第三维尺度很小的缺陷。
5 本征缺陷:没有杂质的晶体中的缺陷,称为本征缺陷。
6 位错:是晶体中的线缺陷,(即原子排列的一种错排)。
7固溶体:指的是矿物一定结晶构造位置上离子的互相置换,而不改变整个晶体的结构及对称性等。
8 化学气相沉积法:指把含有构成薄膜元素的气态反应剂或液态反应剂的蒸气及反应所需其它气体引入反应室,在衬底表面发生化学反应生成薄膜的过程。
9 水解反应法:水与另一化合物反应,该化合物分解为两部分,水中氢原子加到其中的一部分,而羟基加到另一部分,因而得到两种或两种以上新的化合物的反应过程。
10 超耐热合金:指在700~1200℃高温下能满足工作的金属材料。
11 贮氢合金:在一定温度和氢气压力下,能多次吸收,贮存和释放氢气的材料。
12特种陶瓷:又称精细陶瓷,按其应用功能分类,大体可分为高强度、耐高温和复合结构陶瓷及电工电子功能陶瓷两大类。
在陶瓷坯料中加入特别配方的无机材料,经过1360度左右高温烧结成型,从而获得稳定可靠的防静电性能,成为一种新型特种陶瓷,通常具有一种或多种功能,如:电、磁、光、热、声、化学、生物等功能;以及耦合功能,如压电、热电、电光、声光、磁光等功能。
13 结构陶瓷:由单一或复合的氧化物或非氧化物组成,如单由Al2O3、ZrO2、SiC、Si3N4,或相互复合,或与碳纤维结合而成。
14 氧化铝陶瓷:是一种以氧化铝(AL2O3)为主体的材料,用于厚膜集成电路。
15 非氧化物陶瓷:由碳化物,硅化物和硼化物等制造的陶瓷的总称。
16 功能陶瓷:是一类颇具灵性的材料,它们或能感知光线,或能区分气味,或能储存信息17 超导材料:具有在一定的低温条件下呈现出电阻等于零以及排斥磁力线的性质的材料。
材料化学复习题(含答案)【打印】
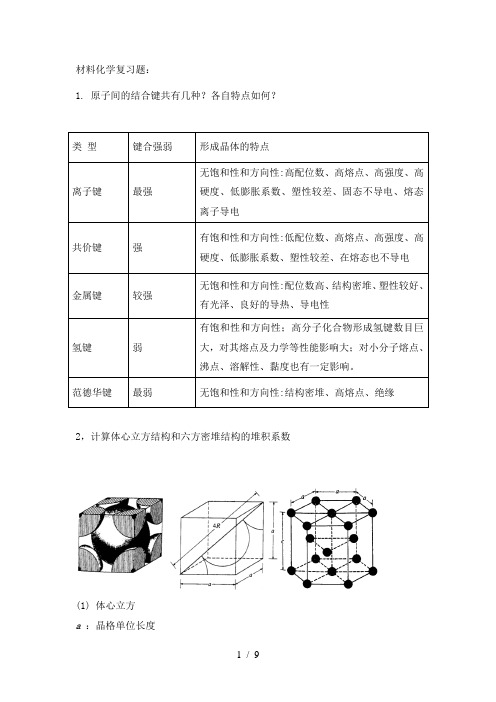
材料化学复习题:1.原子间的结合键共有几种?各自特点如何?类型键合强弱形成晶体的特点离子键最强无饱和性和方向性:高配位数、高熔点、高强度、高硬度、低膨胀系数、塑性较差、固态不导电、熔态离子导电共价键强有饱和性和方向性:低配位数、高熔点、高强度、高硬度、低膨胀系数、塑性较差、在熔态也不导电金属键较强无饱和性和方向性:配位数高、结构密堆、塑性较好、有光泽、良好的导热、导电性氢键弱有饱和性和方向性;高分子化合物形成氢键数目巨大,对其熔点及力学等性能影响大;对小分子熔点、沸点、溶解性、黏度也有一定影响。
范德华键最弱无饱和性和方向性:结构密堆、高熔点、绝缘2,计算体心立方结构和六方密堆结构的堆积系数(1) 体心立方a :晶格单位长度R :原子半径 a 34R = 34R a =,n=2, ∴68.0)3/4()3/4(2)3/4(23333===R R a R bccππζ (2)六方密堆 n=63,已知金属镍为A1型结构,原子间接触距离为249.2pm ,请计算:1)Ni 立方晶胞的参数;2)金属镍的密度;3)分别计算(100)、(110)、(111)晶面的间距。
解:对于面心立方A1型: 原子间接触距离249.2pm=0.2492nm=2R,(1)nm R a 3525.022492.0224=⨯==,(2)金属镍的密度:AA N a nMabcN nM 3==ρ 3823-34458.693.51610 6.02108.972g cm A M a N ρ-⨯⨯==⨯⨯⨯⨯=⋅(3)对于立方晶系,面间距公式为:222hkl d h k l =++因此有:(100) 晶面间距: 2221000013525.0++=d =0.3525nm74.0)3(3812)3/4(6)2321(6)3/4(633hcp =⋅=⋅R R R R a a c R ππξ=R a a c 238==(110) 晶面间距: nm d 2493.00113525.0222110=++=(111) 晶面间距: 2035.033525.01113525.0222111==++=d nm4,试计算体心立方铁受热而变为面心立方铁时出现的体积变化。
材料化学复习题

名词解释1. 电极极化:当腐蚀的原电池短接,电极上有电流通过时,会引起电极电位的变化,这种变化称为电极极化。
2. 电池循环寿命:指电池的容量下降至某一水平前,可以循环充电和放电的次数。
3. 激发态猝灭:加速电子由激发态衰减到基态或低激发态的过程。
4. 固相反应的特点:固相反应是固体参与直接化学反应并起化学反应,同时至少在固体内部或外部的一个过程中起控制作用的反应。
其特点是固体质点间具有很大的作用键力,故固态物质的反应活性通常较低,速度较慢;其次,在低温时固体在化学上一般是不活泼的,因而固相反应通常在高温下进行。
5.挥发精炼:液相与气相间的分配比随成分不同而不同。
考虑两种成分构成的二元系,如果杂质成分B和有用成分A的蒸气压不同,则χB g<χB l 或χB g>χB l。
当χB g>χB l,则液体中杂质成分B的浓度降低,而液体A的纯度增高,这种除杂方法称为挥发精炼。
6.扩散相变:一种在晶格发生变化的同时伴有原子扩散的相变。
7.金属的表面偏析:金属加热后,金属中所含的杂质在金属表面发生富集的现象。
8.储氢合金定义:一些在与压力较高的氢接触时可以吸入大量的氢气的金属(或合金)。
9.引发效率:引发单体的初级游离基占引发剂分解的初级游离基的百分数。
10.多分散性:聚合物中所有分子的相对分子量大小并不相等的现象。
简答题:1. 什么是电极的极化现象,简述极化产生的原因。
答:由于电流通过电极而引起的电极电位变化称为电极的极化。
极化现象的产生是当有反应电流存在时,由于电极反应的迟缓或电子传递过程中的阻碍所引起的,主要有浓度极化、电化学极化、阻力极化。
2.什么是腐蚀电池?比较其与原电池的异同点。
(1)由阳极、阴极、电解质溶液和电子回路组成的只能导致金属材料破坏而不能对外界作有用功的短路原电池。
(2)相同点:①均有氧化还原反应发生;②均为自发反应不同点:①原电池的氧化还原反应是分开进行的,即阳极氧化,阴极还原;而腐蚀电池则是在发生腐蚀的位置同时同地进行反应;②原电池是特殊的异相催化反应,受电极界面双电层影响较大;③原电池中物质进行转变过程中有电子通过外电路。
材料化学基础知识单选题100道及答案解析

材料化学基础知识单选题100道及答案解析1. 材料的物理性质主要取决于()A. 原子结构B. 分子结构C. 晶体结构D. 化学键类型答案:C解析:材料的物理性质如密度、硬度、导电性等主要取决于晶体结构。
2. 金属材料的延展性主要源于()A. 金属键B. 离子键C. 共价键D. 氢键答案:A解析:金属键没有方向性和饱和性,使得金属原子可以相对滑动,表现出良好的延展性。
3. 下列材料中,属于无机非金属材料的是()A. 塑料B. 陶瓷C. 橡胶D. 纤维答案:B解析:陶瓷是典型的无机非金属材料,塑料、橡胶、纤维通常属于有机高分子材料。
4. 晶体中原子的排列具有()A. 周期性B. 无序性C. 随机性D. 独立性答案:A解析:晶体的特点之一是原子排列具有周期性。
5. 高分子材料的分子量通常在()以上A. 1000B. 5000C. 10000D. 50000答案:A解析:高分子材料的分子量一般在1000 以上。
6. 材料的热膨胀系数主要与()有关A. 原子间结合力B. 晶体结构C. 化学成分D. 以上都是答案:D解析:原子间结合力、晶体结构和化学成分都会影响材料的热膨胀系数。
7. 半导体材料的导电性能介于()之间A. 导体和绝缘体B. 金属和非金属C. 离子晶体和分子晶体D. 以上都不对答案:A解析:半导体的导电性能介于导体和绝缘体之间。
8. 下列哪种材料具有压电效应()A. 石英B. 玻璃C. 陶瓷D. 金属答案:A解析:石英具有压电效应。
9. 复合材料的性能主要取决于()A. 增强相B. 基体相C. 界面D. 以上都是答案:D解析:复合材料的性能受增强相、基体相以及它们之间的界面共同影响。
10. 铁碳合金中,含碳量为0.77%的是()A. 亚共析钢B. 共析钢C. 过共析钢D. 铸铁答案:B解析:含碳量为0.77%的铁碳合金是共析钢。
11. 材料的疲劳强度是指()A. 材料在交变载荷作用下不发生断裂的最大应力B. 材料在静载荷作用下不发生断裂的最大应力C. 材料在拉伸载荷作用下不发生断裂的最大应力D. 材料在压缩载荷作用下不发生断裂的最大应力答案:A解析:材料的疲劳强度是在交变载荷作用下不发生断裂的最大应力。
材料化学期末试题及参考答案

材料化学试题一、选择题1. 某晶体外型为正三棱柱,问该晶体属于(D )晶系。
A. 立方B. 三方C. 四方D.六方2. 晶胞一定是一个(C )。
A、八面体B、六方柱体C、平行六面体D、正方体二、填空题1.材料按化学组成,可分为(金属材料)、(无机非金属材料)、(有机高分子材料)、(复合材料);根据材料的性能,可分为(结构材料)和(功能材料)。
2.物质的三态:气态、液态和固态,从宏观上来看,气体和液体表现为(流动性),固体表现出(固体性),液体在缓慢降温过程中形成(晶体),在急冷过程中形成(非晶体)。
三、判断题1. SF4分子中含有两种不同的键长。
(对)2. 凡是中心原子采用sp3d2杂化轨道成键的分子,其空间构型一定是八面体。
(错)四、名词解释1.材料:人类社会所能接受的经济地制造有用器件的物质。
(可以用来制造有用的构件、器件或物品的物质。
)2.空间点阵:表示晶体结构中各类等同点排列规律的几何图形。
五、简答题1.按材料的发展水平,简述材料发展的五个过程,这五个过程的关系如何?答:天然材料,烧炼材料,合成材料,可设计材料,只能材料。
五代材料并不是新旧交替的,而是长期并存,它们共同在各个领域发挥着不同的作用。
2.简述晶体与非晶体间的转化特点。
答:非晶态是一种亚稳态,所以非晶态固体有向晶态自发转化的趋势,但温度不够高时,非晶态中的原子(离子)的运动幅度较小,同时晶核的形成和生长都比较困难,因此非晶态向晶态的转化就不易发生。
另外,非晶态向晶态的转化要经过一些中间步骤,且转变带有突变的特征,一般伴随有幅度不大的体积变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.名词解释
π键;大Π键;高分子(聚合物);自由基;杂化材料;线型聚合物;缩合聚合;聚合度;均聚物;单体、重复单元、单体单元、结构单元、聚合度、数均分子量、重均分子量、粘均分子量。
活性种、均裂、异裂、自由基聚合、离子聚合、诱导效应、共轭效应、笼蔽效应
2.为什么自由基聚合会出现自动加速现象?离子聚合反应中能否出现自动加速现象?为什么?
3.杂化材料与传统复合材料相比优点何在?
4.丁二烯分子式为H2CCHCHCH2,请分析该分子中有几种形式的共价键?这些键是怎么形成的,请画电子云图形来说明。
5.何谓本体聚合、溶液聚合、悬浮聚合和乳液聚合?列表比较四种聚合方法的异同点。
6.聚合物的多分散性定义
7.简要说明杂化材料的制备方法。
8.下列烯类单体适于何种机理聚合?自由基聚合、阳离子聚合还是阴离子聚合?并说明原因。
CH2=CHCl、CH2=CHCN、CH2=C(CH3)2、CH2=CHC6H5、CH2=CH-CH=CH2、CF2=CF2、CH2=C(CN)COOR
9.已知一个PS试样的组成如下表所列,计算它的数均相对分子质量、重均相对分子质量。
10.生产尼龙-66,想获得M n=13500的产品,采用己二酸过量的办法, 若使反应程度P=0.994,试求己二胺和己二酸的配料比和己二酸过量分率,已知己二酸结构单元的分子量为112,己二胺结构单元的分子量为为114。
11.求下列混合物的数均分子量、重均分子量和分子量分布指数。
组分A:质量 = 10g,分子量 = 30000;b、组分B:质量 = 5g,分子量 = 70000;c、组分C:质量 = 1g,分子量 = 100000
12.请详细比较自由基聚合与阴离子聚合和阳离子聚会的异同点。
13.什么是自由基?以乙烯或苯乙烯为例自由基聚合的三个基元反应
是什么?分别写出链引发、链增长、链终止和链转移的速率(动力学)表达式。
14.请阐述自由基聚合的基元反应,链引发反应的引发方式,并列举
一种链引发方式。
15.请详细比较自由基聚合与阴离子聚合和阳离子聚会的异同点。
16.什么是自由基?以乙烯或苯乙烯为例自由基聚合的三个基元反应
是什么?分别写出链引发、链增长、链终止和链转移的速率(动
力学)表达式。
17.请阐述自由基聚合的基元反应,链引发反应的引发方式,并列举
一种链引发方式。
18.写出聚氯乙烯、聚苯乙烯、涤纶、尼龙-66、聚丁二烯和天然橡胶
的结构式(重复单元)。
19.求下列混合物的数均分子量、重均分子量和分子量分布指数。
组分A:质量 = 10g,分子量 = 30000;b、组分B:质量 = 5g,分子量 = 70000;c、组分C:质量 = 1g,分子量 = 100000
20.聚合物化学反应有那三种基本类型?与低分子化学反应有什么区
别?
21.连锁聚合与逐步聚合有哪些区别?
22.逐步聚合有几种实施方法?
23.聚合物化学反应有哪些特征?
24.聚合物老化的原因有哪些?
25.简要解释下列名次,并指出它们之间的异同点
(1) 本体聚合、气相聚合、固相聚合、熔融聚合
(2) 悬浮聚合、乳液聚合、界面聚合
(3) 溶液聚合、均相聚合、沉淀聚合。
